大豆分离蛋白(soybean protein isolate,SPI)是蛋白质量分数90%以上的全价蛋白质,由于其具有两亲性质,可以吸附在油-水界面以稳定乳液,常被用作乳化剂[1-2]。但是蛋白质乳液易受到外界因素的干扰,影响乳液稳定性。如乳液在经过冻融循环后,形成的冰晶会刺破界面膜,打破油-水的平衡,出现乳析、出油等失稳现象[3]。
接枝反应是一种常用的蛋白质改性方法,加入糖链可增加油-水界面的厚度,增加空间位阻,有效地改善蛋白乳液的冻融稳定性[4-5]。改性蛋白的疏水侧链还能提高溶解性、乳化性等功能特性[6]。辐照作为一种新型的冷加工技术,具有高效率、低耗能、低成本、环保等特点,因此具有广泛的应用前景[7]。1980年联合国粮食及农业组织、国际原子能机构、世界卫生组织宣布,辐照剂量在10 kGy以下认定为没有毒理学危险;1997年世界卫生组织废除10 kGy的上限剂量;2003年国际食品法典委员会宣布在保证食品的感官特性、功能特性、结构完整性和安全性的情况下,食品辐照剂量可高于10 kGy[7]。这从法规上保证了辐照技术在食品工业中的应用。辐照除了应用于食品的杀菌和保鲜领域外,也能在蛋白质制取和贮藏过程中改变蛋白质分子的空间构象进而影响蛋白质的乳化性、持油性、持水性等理化性质[8-9]。研究表明,SPI和大豆浓缩蛋白经10 kGy的γ射线辐照后,乳化特性均有所改善[10]。花生蛋白经辐照后,蛋白质的结构改变,蛋白分子结构展开,疏水基团暴露,导致各种功能性质均有所改善,但辐照剂量进一步增加时,致敏蛋白抗原性降低[11]。血浆蛋白经过1、5、7、10 kGy的γ辐射后有序结构减少,多肽链出现初始断裂和随后的聚集,辐射改变了血浆蛋白粉末和溶液的物理化学性质[12]。可见,辐照通过改变蛋白分子结构来改善蛋白质的功能特性。
辐照技术由于作用时间短、耗能低、效率高,逐渐发展为一种改性修饰方法。同时糖基化修饰等也可实现蛋白质改性,将辐照与糖基化相结合的研究鲜见报道。本实验利用辐照辅助接枝反应来提高SPI乳液的冻融特性,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、出油率测定和光学显微结构观察对改性产物进行性质和结构分析,以期拓宽蛋白质改性领域,为综合改性技术提供理论参考。
1 材料与方法
1.1 材料与试剂
脱脂豆粉 武汉远成共创科技有限公司;麦芽糖(maltose,M) 北京化学试剂厂;大豆油 九三粮油工业集团有限公司;其他试剂均为分析纯。
1.2 仪器与设备
FJ300S-数显高速分散均质机 上海隆拓仪器设备有限公司;高压均质机 北京同和友德科技有限公司;高速冷冻离心机 长沙湘锐离心机有限公司;紫外-可见分光光度计 上海元析仪器有限公司;恒温磁力搅拌器 常州市凯航仪器有限公司;MS104TS分析天平上海花潮实业有限公司;冷冻干燥机 江苏天翎仪器有限公司;DYY-12电脑三恒多用电泳仪 北京君意仪器厂;ST5凝胶成像仪 上海银泽仪器设备有限公司;数显型恒温水浴锅 江苏金怡仪器科技有限公司;YS-100YS-100生物显微镜 上海蔡康光学仪器有限公司。
1.3 方法
1.3.1 SPI的制备
将100 g脱脂豆粉溶于1 000 mL去离子水中,搅拌均匀后用NaOH溶液调节pH值至8.5,离心后收集上清液,用HCl溶液调节pH值至4.5,4 ℃静置过夜。弃去上清液后离心得沉淀。用去离子水洗涤3 次,将洗涤得到的沉淀用去离子水复溶后,再用NaOH溶液调节pH值至7.0,然后进行冷冻干燥得SPI[13],凯氏定氮法测定蛋白质量分数为90.23%。
1.3.2 辐照糖基化SPI的制备
将SPI与麦芽糖按照质量比1∶1、2∶1、3∶1、4∶1、5∶1溶解于0.01 mol/L pH 7.0磷酸盐缓冲液,25 ℃下搅拌4 h,配成一定蛋白质量分数(2%、3%、4%、5%、6%)的溶液(SPI+M)。加入少量的叠氮钠(终质量分数0.02%)以防滋生微生物,置于4 ℃冰箱中水化过夜。第2天取出后室温下搅拌直至液体温度至25 ℃,取样品溶液100 mL置于辐照装置(辐射源60Co γ)下进行辐照反应(辐照剂量为2.5、5、7.5、10、12.5 kGy)。辐照后样品,冷冻干燥制成干粉即为辐照糖基化SPI(SPI-M)。
1.3.3 接枝度测定
取2 0 0 μ L样品加入4 m L邻苯二甲醛(o-phthalaldehyde,OPA)试剂中混合均匀后于35 ℃水浴锅中反应2 min,于340 nm波长处测吸光度A340 nm,另取200 μL去离子水加入OPA试剂中作为空白对照。OPA试剂现用现配(取80 mg OPA、2 mL甲醇溶液、5 mL质量分数20%的SDS溶液、50 mL硼砂溶液、100 μL β-巯基乙醇混合均匀,定容至50 mL)。接枝度按式(1)计算。
式中:A0为空白对照溶液吸光度;A1为接枝反应后溶液吸光度。
1.3.4 褐变程度测定
配制质量浓度为2 mg/mL样品溶液,以去离子水为空白对照,于420 nm波长处测吸光度,以吸光度表征褐变程度。
1.3.5 SDS-PAGE分析
分别使用质量分数5%的浓缩胶和13%的分离胶进行SDS-PAGE。取20 μL样品溶液与5 μL上样缓冲液混合,沸水浴5 min。冷却至室温,取9 μL样品溶液注入点样孔。浓缩胶电压设置为90 V,进入分离胶后改为120 V,直至溴酚蓝距离凝胶底部0.5 cm左右结束电泳,关闭电源,起胶。分别用考马斯亮蓝染色液和Schiff试剂进行蛋白质和糖蛋白染色[14]。
1.3.6 乳液制备及冻融循环
配制质量浓度为20 mg/mL样品溶液,将样品溶液与大豆油按体积比9∶1混合,11 000 r/min均质3 min形成粗乳液,再通过60 MPa高压均质形成微乳液。将乳液加入10 mL塑料管内,于-18 ℃冰箱中冷冻24 h后在水浴锅中解冻2 h,如此连续进行3 次冻融循环[15-16]。
1.3.7 乳析指数测定
乳析指数按式(2)计算。
式中:HS表示乳清层高度/cm;HT表示乳液总高度/cm。
1.3.8 出油率测定
参考Palanuwech等[17]的方法,略作改动。取8 g样品乳液与2 g苏丹III油溶液混匀,10 000×g离心20 min,取上层液于508 nm波长处测定吸光度,大豆油为空白,调零吸光度。出油率按式(3)计算。
式中:m0为苏丹III油溶液质量/g;me为乳液质量/g;a为苏丹III油溶液吸光度与离心后苏丹III油溶液吸光度的比值;ωd为乳液中油相的质量分数/%。
1.3.9 光学显微镜观察
将待测样品乳液摇匀后取10 μL置于载玻片,盖上盖玻片后置于显微镜观察区,将目镜调为400 倍进行观察。
1.4 数据处理与分析
所有实验均重复3 次,用平均值±标准偏差表示结果,运用SPSS Statistics 20软件进行Pearson相关性分析,采用Origin 8软件作图。
2 结果与分析
2.1 SPI与麦芽糖质量比对接枝物冻融特性的影响
固定SPI质量分数为4%,辐照剂量5 kGy,研究m(SPI)∶m(M)对接枝物冻融特性的影响。乳析指数是反映乳液冻融特性的重要指标之一,乳液乳析指数越低,冻融特性越稳定[18]。由图1可知,糖的引入明显降低了乳析指数,并且经历了3 次冻融循环后,m(SPI)∶m(M)为4∶1的乳液乳析指数最低,这是因为当反应体系中糖的含量适量时,糖分子移动空间变大,适量的糖与蛋白分子充分接触发生接枝反应,乳析指数降低。这与图2的褐变程度和接枝度变化成反比,接枝度越高,乳析指数越低,冻融稳定性增加。随着麦芽糖含量的降低,褐变程度和接枝度均呈现先升高后降低的趋势,说明美拉德反应程度逐渐增加,但随着麦芽糖含量的减少,较少的糖不足以与蛋白分子发生反应,糖基化反应程度降低[19]。考虑到冻融稳定性,选取m(SPI)∶m(M)为4∶1进行实验,与同类研究[20-21]相比,糖的添加量减少了71%和77.8%,节约成本。

图1 m (SPI)∶m(M)对辐照SPI-M乳析指数的影响
Fig. 1 Effect of m(SPI)/m(M) ratio on creaming index of irradiated SPI-M

图2 m (SPI)∶m(M)对辐照SPI-M接枝度和褐变程度的影响
Fig. 2 Effect of m(SPI)/m(M) ratio on grafting reaction and browning degree of irradiated SPI-M
2.2 SPI质量分数对接枝物冻融特性的影响
固定m(SPI)∶m(M)4∶1,辐照剂量5 kGy,研究SPI质量分数对接枝物冻融特性的影响。由图3可知,随SPI质量分数的增加,乳析指数与对照组相比均明显降低,在质量分数为4%时乳析指数最低,表现出最佳的冻融特性,这与王喜波等[22]的研究结果类似。由图4可知,接枝度在质量分数4%时最大,为29.7%,褐变程度也适中。可能是因为随着SPI质量分数增加,自由氨基浓度增大,提高了自由氨基与糖分子的碰撞几率,更易发生接枝反应,但浓度过高时蛋白质聚集,使得自由氨基含量降低[23]。适量的浓度促进了接枝反应,增加了界面膜的厚度,有效抵御了外界因素的干扰,乳液最稳定[24]。考虑到冻融稳定性,选取SPI质量分数为4%进行实验。
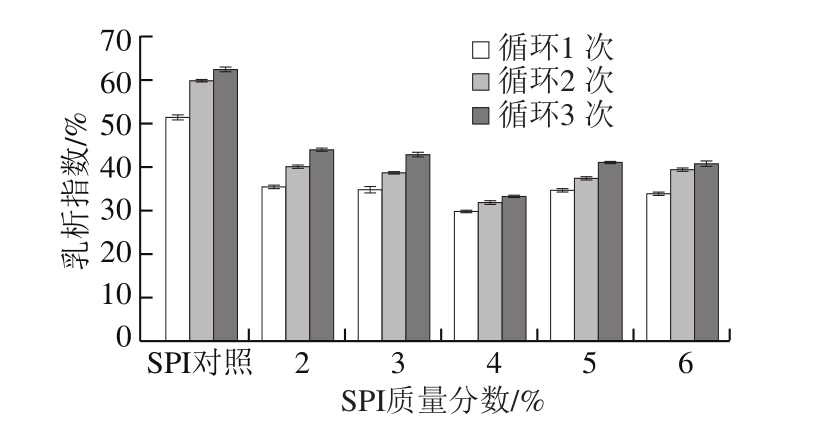
图3 SPI质量分数对辐照SPI-M乳析指数的影响
Fig. 3 Effect of SPI concentration on creaming index of irradiated SPI-M
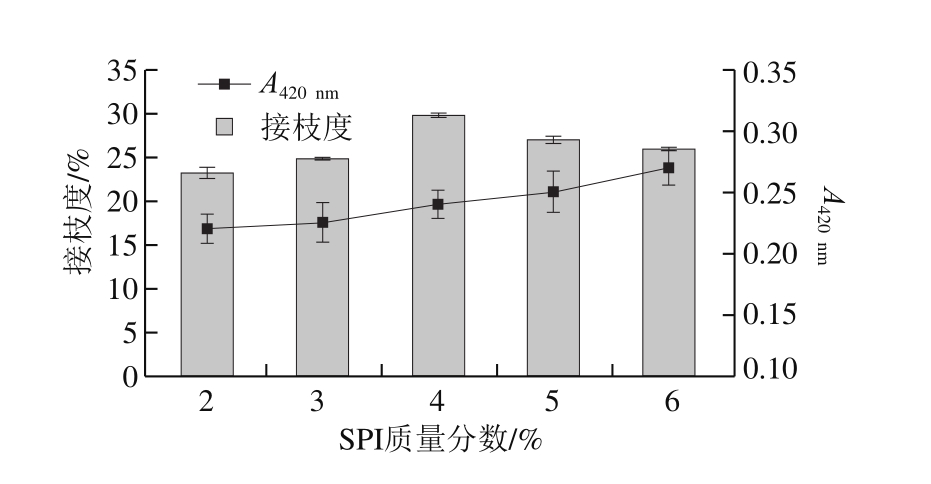
图4 SPI质量分数对辐照SPI-M接枝度和褐变程度的影响
Fig. 4 Effect of SPI concentration on grafting degree and brown degree of irradiated SPI-M
2.3 辐照剂量对接枝物冻融特性的影响

图5 辐照剂量对辐照SPI-M乳析指数的影响
Fig. 5 Effect of irradiation dose on creaming index of irradiated SPI-M

图6 辐照剂量对辐照SPI-M接枝度和褐变程度的影响
Fig. 6 Effect of irradiation dose on grafting degree and browning degree of irradiated SPI-M
固定SPI质量分数4%,m(SPI)∶m(M)为4∶1,研究辐照剂量对接枝物冻融特性的影响。辐照提供的能量促使蛋白分子中的氢键、二硫键等配位键发生断裂或重建,使蛋白分子发生脱氨、脱羧等一系列反应,进而改变蛋白分子的高级结构及聚集程度,使蛋白分子的功能特性发生变化[25-26]。由图5可知,辐照处理后样品的乳析指数明显降低,7.5 kGy处理组的乳液表现出最佳的冻融特性。由图6可知,随辐照剂量增加,接枝度先增加后降低,在7.5 kGy处理组接枝度最大,为34.56%。可能是因为辐照处理后,蛋白分子展开程度增加,柔性变大,释放出更多的疏水基团,从而增强油-水界面的吸附作用,使得蛋白分子展开,形成较厚的保护膜,阻止了尖锐的冰晶破坏油-水界面的平衡,进而提高了乳液的冻融稳定性[27]。由图6可知,褐变程度随辐照剂量的增加而变大,样品的颜色变深,积累过多类黑精会影响产物感官品质和营养价值。综合考虑,选取辐照剂量为7.5 kGy进行实验。
2.4 相关性分析结果
在单因素试验的基础上,运用SPSS Statistics 20软件对接枝度和乳析指数进行Pearson相关性分析,由表1可知,接枝度与冻融后的乳析指数具有显著相关性。表明样品乳析指数降低与发生接枝反应有关。
表1 接枝度和乳析指数间相关系数
Table 1 Correlation coefficient between grafting degree and creaming index

注:**.极显著相关(P<0.01)。
指标 乳析指数循环1 次 循环2 次 循环3 次接枝度 -0.915** -0.909** -0.760**
2.5 接枝物性质分析结果
根据单因素试验结果,优化的SPI-M的最佳制备条件为m(SPI)∶m(M)为4∶1、SPI质量分数4%和辐照剂量7.5 kGy,在此条件下进行验证实验并设对照组。
2.5.1 SDS-PAGE分析结果

图7 SPI及SPI+M、辐照SPI、辐照SPI-M的SDS-PAGE图谱
Fig. 7 SDS-PAGE of SPI and SPI + M, radiated SPI, and radiated SPI-M
SPI与糖发生接枝反应形成共价复合物可以通过分析考马斯亮蓝和Schiff试剂染色形成的电泳图谱得到证实[28]。由图7可知,泳道2和泳道1条带类似,说明SPI单纯地与麦芽糖混合不会发生接枝反应。泳道3与泳道1条带类似,说明辐照基本不会改变蛋白分子质量。泳道4亚基组分条带颜色变浅,这是因为考马斯亮蓝与自由氨基形成非共价键而呈现显色反应,当SPI与麦芽糖发生美拉德反应后,自由氨基含量减少,剩余较少的氨基不足以与考马斯亮蓝发生显色反应,从而证实SPI与麦芽糖发生接枝反应。Schiff试剂染色对糖蛋白比较敏感,能够表征美拉德反应[29],糖染色原理为高碘酸氧化糖基化蛋白糖链上相邻两个碳上的羟基为醛基,醛基与Schiff试剂生成颜色络合物。泳道5与泳道6相比,泳道5糖染色各亚基条带几乎消失,而泳道6出现糖染色条带,表明发生接枝反应。这是因为辐照促使蛋白结构打开,暴露出更多的氨基与糖发生反应形成接枝物[30]。
2.5.2 出油率分析结果
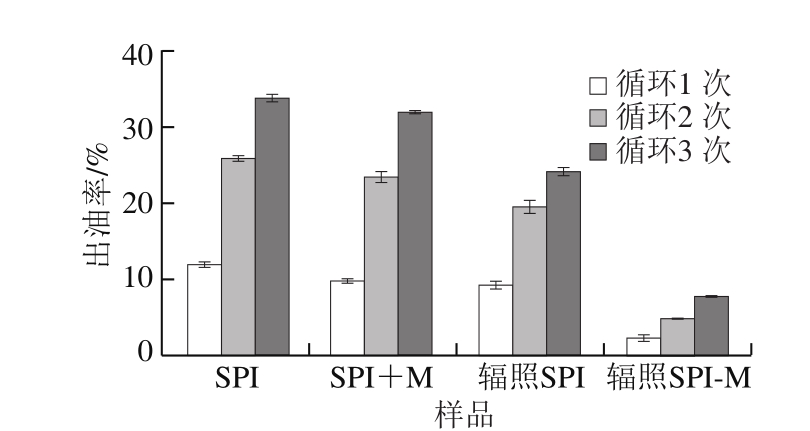
图8 SPI及SPI+M、辐照SPI、辐照SPI-M冻融循环3 次的出油率
Fig. 8 Oil release rates of SPI, SPI + M, radiated SPI and radiated SPI-M after 1, 2 and 3 freeze-thaw cycles
乳液经冻融处理后,脂肪的不稳定作用会使乳液油相与水相分离,通过出油率来表征乳液的稳定性[31]。由图8可知,经过冻融循环后,SPI和SPI+M样品乳液的出油率明显增加,可见单纯地混入糖并不能明显改善样品乳液的冻融特性。在历经冻融循环后,只经过辐照处理的SPI出油率比对照虽有所改善,但效果并不理想。而辐照处理得到的SPI-M接枝物样品乳液经过1、2、3 次冻融循环后出油率与SPI乳液相比分别降低了9.7%、21.2%和26.4%。可能是因为接入的糖改善了蛋白样品乳化性,促使油-水表面形成具有弹性的界面膜,同时增加了黏度,减缓油滴的运动速度,避免了油滴之间的聚集,降低了出油率。Zhang Zeyu等[32]利用超声协同接枝反应处理乳液得到了类似结果,说明辐照辅助接枝反应能改善乳液的冻融特性。
2.5.3 光学显微结构分析结果
由图9可知,在经历冻融循环后,由SPI和SPI+M制备的乳液微观结构发生了较为明显的改变,出现大而圆的油滴和不规则的团块。经过辐照的SPI乳液较SPI和SPI+M乳液出现了较小的油滴,而辐照处理得到的SPI-M接枝物的乳液更稳定,在经过冻融循环后蛋白形状完整,表面光滑圆润,边界明显,只出现较少的小油滴。可能是因为辐照促进糖的接入,形成了致密的保护膜,减少了外界因素对乳液的损坏,分子柔性也随之增加,乳化性提高,进而降低了油滴之间的碰撞几率,减少了絮凝和聚结[33]。因而SPI-M制备的乳液结构变化稳定,说明辐照辅助接枝反应处理蛋白样品乳液能表现出良好的冻融特性。

图9 SPI及SPI+M、辐照SPI、辐照SPI-M冻融循环3 次的微观结构
Fig. 9 Microstructure of SPI, SPI + M, radiated SPI and radiated SPI-M after 1, 2 and 3 freeze-thaw cycles
3 结 论
本实验对辐照辅助接枝反应制备的SPI乳液进行冻融特性研究,探究SPI质量分数、m(SPI)∶m(M)、辐照剂量对改性产物的接枝度、褐变程度和乳析指数的影响。通过SDS-PAGE、出油率测定和光学显微结构观察对改性产物进行性质和结构分析。结果表明,SPI-M最佳反应参数为m(SPI)∶m(M)为4∶1、SPI质量分数4%和辐照剂量7.5 kGy,辐照辅助接枝反应不仅降低了糖的比例,还改善了冻融特性。SDS-PAGE结果表明SPI与麦芽糖发生接枝反应。优化的SPI-M样品乳液经过1、2、3 次冻融循环后出油率与SPI乳液相比分别降低了9.7%、21.2%和26.4%。微观结构观察结果也证实了SPI-M样品乳液比较稳定。说明辐照作为一种冷加工技术协同接枝反应改善蛋白乳液冻融特性是可行的。
[1] WANG X B, CHI Y J. Microwave-assisted phosphorylation of soybean protein isolates and their physicochemical properties[J]. Czech Journal of Food Sciences, 2012, 36: 99-107. DOI:10.17221/91/2011-CJFS.
[2] CHEN L, CHEN J S, REN J Y, et al. Modifications of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J].Food Hydrocolloids, 2011, 25(5): 887-897. DOI:10.1016/j.foodhyd.2010.08.013.
[3] SHEPHERD R, ROBERTSON A, OFMAN D. Dairy glycoconjugate emulsifiers: casein-maltodextrins[J]. Food Hydrocolloids, 2000, 14(4):281-286. DOI:10.1016/S0268-005X(99)00067-3.
[4] MARTINEZ K D, FARIAS M E, PILOSOF A M R. Effects of soy protein hydrolysis and polysaccharides addition on foaming properties studied by cluster analysis[J]. Food Hydrocolloids, 2011, 25(7):1667-1676. DOI:10.1016/j.foodhyd.2011.03.005.
[5] DIFTIS N G, BILIADERIS C G, KIOSSEOGLOU V D. Rheological properties and stability of model salad dressing emulsions prepared with a dry-heated soybean protein isolate-dextran mixture[J].Food Hydrocolloids, 2005, 19(6): 1025-1031. DOI:10.1016/j.foodhyd.2005.01.003.
[6] MU M F, PAN X Y, YAO P, et al. Acidic solution properties of β-casein-graft-dextran copolymer prepared through Maillard reaction[J]. Journal of Colloid and Interface Science, 2006, 301(1): 98-106. DOI:10.1016/j.jcis.2006.04.048.
[7] FARKAS J, MOHACSI-FARKAS C. History and future of food irradiation[J]. Trends in Food Science & Technology, 2011, 22(2/3):121-126. DOI:10.1016/j.tifs.2010.04.002.
[8] SOLIMAN E A, FURUTA M. Influence of γ-irradiation on mechanical and water barrier properties of corn protein-based fi lms[J].Radiation Physics & Chemistry, 2009, 78(7): 651-654. DOI:10.1016/j.radphyschem.2009.03.053.
[9] WU Y, WANG Y, REN G, et al. Improvement of fish meal replacements by soybean meal and soy protein concentrate in golden pompano diet through γ-ray irradiation[J]. Aquaculture Nutrition,2016, 22(4): 873-880. DOI:10.1111/anu.12303.
[10] PEDNEKAR M, DAS A K, RAJALAKSHMI V, et al. Radiation processing and functional properties of soybean (glycine max)[J].Radiation Physics and Chemistry, 2010, 79(4): 490-494. DOI:10.1016/j.radphyschem.2009.10.009.
[11] LUO C P, HU C Q, GAO J Y, et al. A potential practical approach to reduce Ara h 6 allergenicity by gamma irradiation[J]. Food Chemistry,2013, 136(3/4): 1141-1147. DOI:10.1016/j.foodchem.2012.09.091.
[12] LEE S, LEE S, SONG K B. Effect of gamma-irradiation on the physicochemical properties of porcine and bovine blood plasma proteins[J]. Food Chemistry, 2003, 82(4): 521-526. DOI:10.1016/S0308-8146(02)00592-7.
[13] YU J, WANG G Y, WANG X B, et al. Improving the freeze-thaw stability of soy protein emulsions via combing limited hydrolysis and maillard-induced glycation[J]. LWT-Food Science and Technology,2018, 91: 63-69. DOI:10.1016/j.lwt.2018.01.031.
[14] ZANG X D, YUE C H, WANG Y X, et al. Effect of limited enzymatic hydrolysis on the structure and emulsifying properties of rice bran protein[J]. Journal of Cereal Science, 2019, 85: 168-174. DOI:10.1016/j.jcs.2018.09.001.
[15] PALAZOLO G G, SOBRAL P A, WAGNER J R. Freeze-thaw stability of oil-in-water emulsions prepared with native and thermallydenatured soybean isolates[J]. Food Hydrocolloids, 2011, 25(3): 398-409. DOI:10.1016/j.foodhyd.2010.07.008.
[16] SURH J, DECKER E A, MCCLEMENTS D J. Influence of pH and pectin type on properties and stability of sodium-caseinate stabilized oil-in-water emulsions[J]. Food Hydrocolloids, 2006, 20(5): 607-618.DOI:10.1016/j.foodhyd.2005.07.004.
[17] PALANUWECH J, POTINENI R, ROBERTS R F, et al. A method to determine free fat in emulsions[J]. Food Hydrocolloids, 2003, 17(1):55-62. DOI:10.1016/s0268-005x(02)00035-8.
[18] ZANG X D, YUE C H, LIU M J, et al. Improvement of freeze-thaw stability of oil-in-water emulsions prepared with modified soy protein isolates[J]. LWT-Food Science and Technology, 2019, 102: 122-130.DOI:10.1016/j.lwt.2018.09.004.
[19] 张泽宇, 于洁, 徐晔晔, 等. 超声协同接枝反应改性大豆蛋白及其冻融稳定性[J]. 中国食品学报, 2018, 18(5): 122-129. DOI:10.16429/j.1009-7848.2018.05.015.
[20] 张泽宇, 张诗雨, 于洁, 等. 超声辅助美拉德反应提高大豆蛋白冻融性质[J]. 中国粮油学报, 2017, 32(6): 63-68. DOI:10.3969/j.issn.1003-0174.2017.06.011.
[21] 窦超然, 于国萍, 宋岩, 等. 冻融稳定型糖基化大豆分离蛋白的制备[J].食品工业, 2013, 34(4): 3-5.
[22] 王喜波, 张泽宇, 葛洪如, 等. 超声辅助制备抗冻融大豆分离蛋白工艺优化[J]. 农业工程学报, 2016, 32(14): 272-278. DOI:10.11975/j.issn.1002-6819.2016.14.036.
[23] GHARIBZAHEDI S M T, ROSTAMI H, YOUSEFI S. Impact of whey protein-beet pectin conjugation on the physicochemical stability of β-carotene emulsions[J]. Food Hydrocolloids, 2012, 28(2): 258-266.DOI:10.1016/j.foodhyd.2012.01.002.
[24] GHOSH S, CRAMP G L, COUPLAND J N. Effect of aqueous composition on the freeze-thaw stability of emulsions[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 272(1):82-88. DOI:10.1016/j.colsurfa.2005.07.013.
[25] KUAN Y H, BHAT R, PATRAS A, et al. Radiation processing of food proteins: a review on the recent developments[J]. Trends in Food Science and Technology, 2013 30(2): 105-120. DOI:10.1016/j.tifs.2012.12.002.
[26] 祝祥威, 黄行健, 赵琪, 等. 亚基水平上大豆蛋白改性修饰的研究进展[J]. 食品科学, 2012, 33(23): 388-392.
[27] KUAN Y H, BHAT R, KARIM A A. Emulsifying and foaming properties of ultraviolet-irradiated egg white protein and sodium caseinate[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8):4111-4118. DOI:10.1021/jf104050k.
[28] 王允华, 郭兴凤. 大豆蛋白-阴离子多糖共价复合物性能研究[J]. 粮食与油脂, 2014, 27(8): 49-52. DOI:10.3969/j.issn.1008-9578.2014.08.013.
[29] 齐军茹, 杨晓泉, 廖劲松. 液相体系制备大豆酸沉蛋白-葡聚糖共价复合物及其反应机制(I)共价复合物的制备[J]. 食品科学, 2008,29(1): 111-114. DOI:10.3321/j.issn:1002-6630.2008.01.019.
[30] 曹静, 翁静宜, 程萌, 等. 大豆分离蛋白-葡聚糖糖基化产物作为乳化剂和活性物质载体的性能分析[J]. 食品科学, 2018, 39(8): 6-12.DOI:10.7506/spkx1002-6630-201808002.
[31] OLIVER C M, KHER A, MCNAUGHTON D, et al. Use of FTIR and mass spectrometry for characterization of glycated caseins[J].Journal of Dairy Research, 2009, 76(1): 105-110. DOI:10.1017/S002202990800383X.
[32] ZHANG Zeyu, WANG Xibo, YU Jie, et al. Freeze-thaw stability of oil-in-water emulsions stabilized by soy protein isolate-dextran conjugates[J]. LWT-Food Science and Technology, 2017, 78: 241-249.DOI:10.1016/j.lwt.2016.12.051.
[33] WANG Z J, HAN F F, SUI X N, et al. Effect of ultrasound treatment on the wet heating Maillard reaction between mung bean (Vigna radiate L.) protein isolates and glucose and on structural and physicochemical properties of conjugates[J]. Journal of the Science of Food and Agriculture, 2016, 96(5): 1532-1540. DOI:10.1002/jsfa.7255.