甜樱桃果实酸甜鲜香、色泽艳丽、营养丰富,深受消费者喜爱。然而甜樱桃成熟期集中,贮藏期短,极易软化腐烂,采后损失严重,这限制了樱桃产业的健康发展。据报道,引发甜樱桃采后霉变的病原菌包括青霉、链核盘菌属、链格孢属、根霉、灰霉等[1]。采后预冷处理可快速降低樱桃果实生理活性,延长冷藏期。然而不同的冷藏方式可能改变微生物菌群结构,最终呈现出不同程度或类型的霉烂。风冷处理是目前应用较为广泛的预冷方式,成本低,较易实现,但其降温速率慢,果实保质期短。冰水预冷的冷却速率快,可以延长果蔬保藏期[2-3]。臭氧具有杀菌作用,在碱性溶液中有高的氧化还原电位(2.07 V),是一种有效的抗菌物质[4]。臭氧在溶液中不稳定,会持续缓慢地分解为O2和水,不产生其他残留物质,安全性高。因此臭氧水广泛用于果蔬的防腐保鲜[5]。高通量测序可以分析一个生物样本中所有真菌组成。因此学术界广泛应用该技术鉴定果蔬种植及贮藏过程中的腐败菌,并分析菌群演替规律[6-7]。
本实验拟通过高通量测序法解析经过风冷、冰水预冷以及臭氧化冰水预冷的红玛瑙樱桃,在冷藏前期、中期和后期果实表面的真菌组成,包括真菌的丰富度、多样性以及优势菌的动态变化。以揭示3 种冷却方式在控制真菌方面的优劣势,为实际生产中樱桃预冷方式的选择提供参考,也为进一步引入其他抗菌技术、综合延长樱桃采后贮藏期提供思路。
1 材料与方法
1.1 材料与试剂
红玛瑙樱桃(山西省农科院果树研究所研发的新品种)采自山西省太谷县。采收时果实成熟度为8~9成,为一级果,选择单果质量(5.0±0.5)g、果个均匀、色泽一致、无病虫害及物理损伤的果实进行实验。
高保真DNA聚合酶 北京全式金生物技术有限公司;xyPrepDNA凝胶回收试剂盒 美国AXYGEN公司。
1.2 仪器与设备
QuantiFluorTM-ST蓝色荧光定量系统 美国Promega公司;便携式臭氧发生器 青岛艺博净化设备有限公司。
1.3 方法
1.3.1 红玛瑙樱桃预冷处理
樱桃采用4 种预处理方式,处理方法分别如下。
风冷:樱桃果实于0 ℃冷库中进行通风冷却,至果品温度下降到(1.0±0.5)℃时停止冷却,包装后置于(0.0±0.5)℃冷库贮藏。
冰水预冷:将樱桃果实放入(1.0±0.5)℃冰水中。冰水的制备采用山西省太谷县自来水(pH 7.28),部分存入冷库(0.0±0.5)℃降温为冷水,部分冻为边缘光滑的冰块,二者混合制得(1.0±0.5)℃的冰水。冷却樱桃过程中,当冰水温度上升超过5 ℃时,将樱桃转入新的冰水中,直至果实内部温度下降到(1.0±0.5)℃时停止冷却。
臭氧化冰水预冷:依照冰水预冷方法制得冰水(1.0±0.5)℃,以便携式臭氧发生器通入冰水,使得臭氧质量浓度达到2.1 mg/L,预冷策略与冰水预冷相同。
冰水预冷以及臭氧化冰水预冷处理后的樱桃均以无菌吸水纸吸去表面水分,包装后与风冷组樱桃置于相同冷库(温度(0.0±0.5)℃、相对湿度(93±2)%)贮藏。每种预冷处理分别设置3 个生物学重复。
1.3.2 真菌基因组提取及ITS序列测定
分别在贮藏的第0(即为预冷处理后,送入冷库达到平衡温度后的样品)、15天和第30天收集风冷、冰水预冷和臭氧化冰水预冷处理组的红玛瑙樱桃果实,每组从3 个生物学重复样品中分别取30 颗果实,立即置于无菌容器中,液氮速冻后置于-80 ℃冷冻保存,于1 个月内送样测试。
对于0、15、30 d的样品编号,风冷组分别为:A0、A15、A30;冰水预冷组分别为:I0、I15、I30;臭氧化冰水预冷组分别为:OI0、OI15、OI30。
样品处理过程:1)以氯化钠-三羟甲基氨基甲烷-乙二胺四乙酸缓冲液洗涤果实表面,DNA提取试剂盒提取表面真菌总DNA,以质量分数1%琼脂糖凝胶电泳检测基因组DNA长度。2)聚合酶链式反应(polymerase chain reaction,PCR)扩增真菌内部转录间隔子(the internal transcribed spacer,ITS)序列。3)使用xyPrepDNA凝胶回收试剂盒切胶回收PCR产物,用QuantiFluorTM-ST蓝色荧光定量系统进行定量检测。4)MiSeq文库构建。5)MiSeq上机测序。
1.4 数据处理与分析
测序原始数据下机后,首先进行数据质控,通过序列拼接、过滤和去嵌合体后得到优化序列,然后进行可操作分类单元(operational taxonomic unit,OTU)聚类及注释。基于聚类结果,进行Alpha多样性分析;基于注释结果,得到各水平的分类信息,进行样本组成及样本间群落结构差异相关分析。
2 结果与分析
2.1 真菌组数据质控及OTU基础分析
27 个样品的下机数据(raw data、PE file)在去除barcode和primer并拼接后得到raw_tags共计664 077 个,raw_tags经进一步去除嵌合体、短序列后得到优质序列clean_tags共计661 881 个。所获得的优质序列长度主要分布在200~260 bp之间,还有少部分分布在260~480 bp之间。真菌ITS组测序共产生334 个OTU,从3 个处理组的整体水平而言(不考虑贮藏时间),3 种预冷处理组样品OTU分类有明显的区别(图1a)。3 个处理组共有的OTU数量为124,风冷处理组独有的OTU数量为63 个,冰水处理组独有的OTU数量为26 个,臭氧化冰水处理组独有的OTU数量为35 个。除三组共有序列外,对于两组共有的OTU数量,冰水处理组与风冷处理组共有29 个,臭氧化冰水与风冷处理组共有46 个,冰水处理和臭氧化冰水处理组共有11 个。考虑贮藏时间对群落结构多样性的影响(图1b),各处理各取样时间样品共有的OTU 25 个,特有的OTU数量分别为A0 178 个、A15 133 个、A30 138 个、I0 92 个、I15 111 个、I30 109 个、OI0 166 个、OI15 103 个、OI30 103 个。
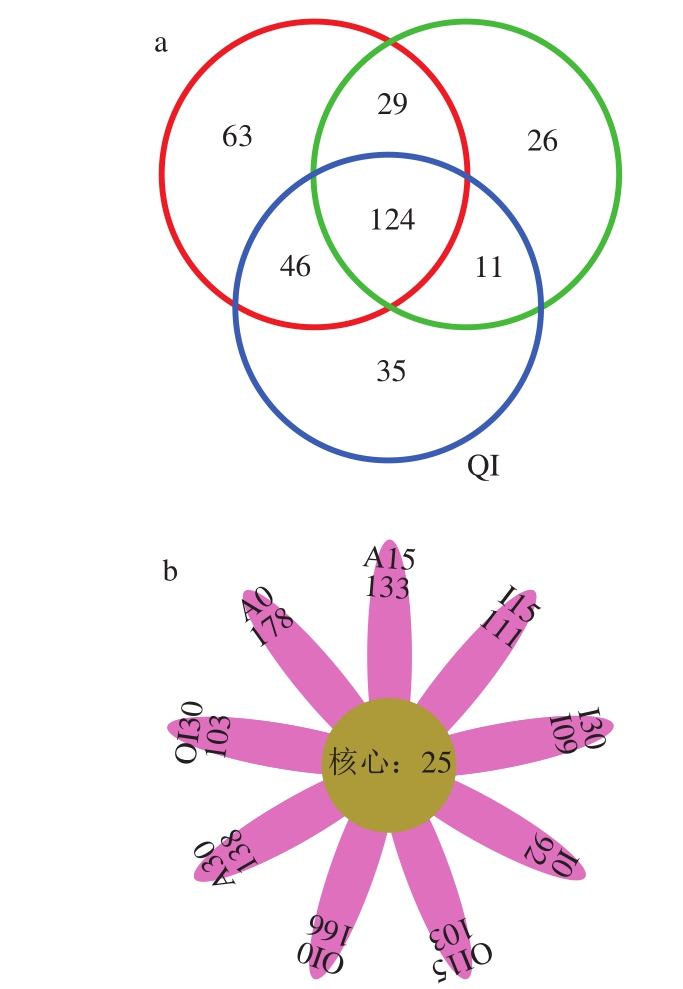
图1 不同预冷处理的红玛瑙樱桃表皮真菌组群落结构(a)及贮藏过程中OTU分布(b)
Fig. 1 Venn map (a) of fungal community structure on Red Agate cherry fruit treated with different pre-cooling methods and Petal map of OTU distribution (b) during storage
2.2 不同预冷处理对红玛瑙樱桃表面真菌组Alpha多样性的影响
表1 不同预冷处理的红玛瑙樱桃贮藏期间表皮真菌组Alpha多样性指数
Table 1 Alpha diversity indices of fungal communities on Red Agate cherry fruit treated with different pre-cooling methods during storage

Chao1指数样品编号观测A0 174.94 0.999 4 157 2.85 A15 141.48 0.999 6 131.7 3.01 A30 170.64 0.999 1 125.5 2.34 I0 97.58 0.999 6 82.5 2.67 I15 129.58 0.999 3 105.1 2.47 I30 129.25 0.999 5 102.6 2.59 OI0 165.48 0.999 3 141.8 2.74 OI15 125.11 0.999 4 93.9 2.38 OI30 112.53 0.999 5 93.3 2.49深度OTU数量Shannon指数
表1显示了各处理组在不同取样时间的Alpha多样性指数。各组样品的观测深度(goods_coverage)均在0.999以上,说明本次测序结果能代表样本中微生物的真实情况。Chao1指数可用于评估菌群丰度,其数值越高代表丰富度越高,风冷处理组在贮藏过程中物种丰富度(Chao1指数)先下降,之后到30 d(170.64)又恢复到与初始(174.94)相近的水平。相对于风冷处理组,冰水处理组初始时物种丰富度较低(Chao1指数为97.58),随着贮藏时间延长而升高,但仍低于风冷处理组。臭氧化冰水处理组初始物种丰富度(Chao1指数为165.48)略低于风冷处理组,在贮藏过程中Chao1指数一直下降。Shannon指数可用来评估菌群多样性,Shannon指数越大,说明群落多样性越高。贮藏初始的各组Shannon指数由大到小依次为风冷处理组(2.85)>臭氧化冰水处理组(2.74)>冰水处理组(2.67)。贮藏过程中,风冷处理组中多样性先增加后降低,到30 d时Shannon指数为2.34。冰水处理组Shannon指数变化幅度较小,臭氧化冰水处理组先小幅下降,后略有上升,但30 d时仍低于最初水平。
2.3 不同预冷处理对红玛瑙樱桃表面真菌组成的影响
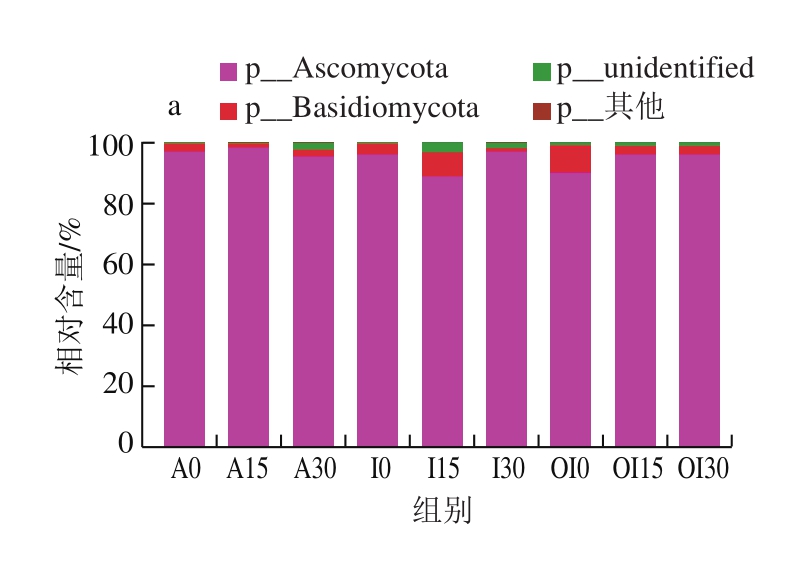
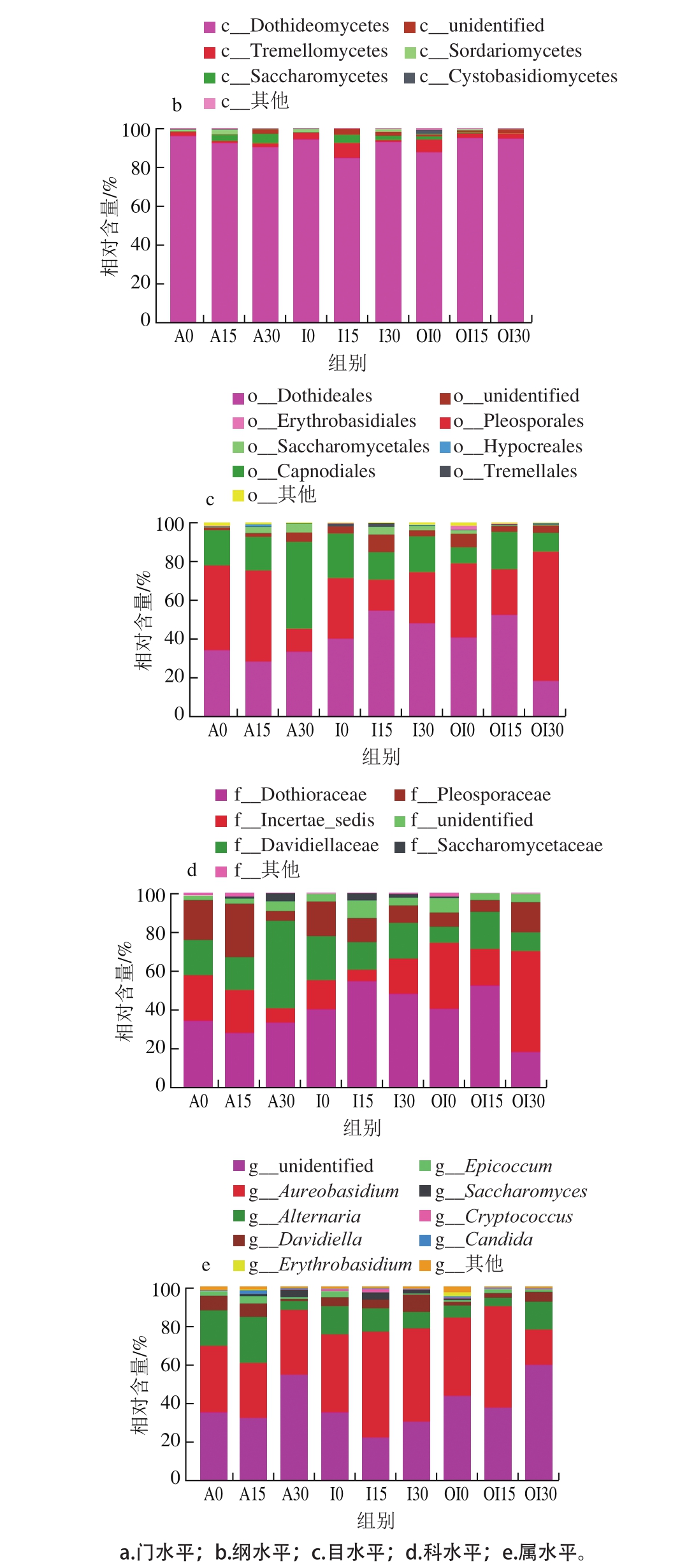
图2 不同预冷处理的红玛瑙樱桃贮藏期间表皮真菌群落结构组分比例
Fig. 2 Fungal community structure on Red Agate cherry fruit treated with different pre-cooling methods during storage
不同预冷处理组红玛瑙樱桃表面的真菌组成发生了显著变化,在初始和贮藏过程中真菌菌群组成存在差异。如图2a所示,在门水平上,冰水处理组在贮藏的第15天(I15),优势的子囊菌门(Ascomycota)比例明显下降,贮藏到第30天(I30)又上升。而臭氧化冰水处理组在贮藏的初期(OI0)子囊菌门(Ascomycota)比例低于其他两种处理(A0、I0),但贮藏的第15天和第30天时,子囊菌门(Ascomycota)比例相对0 d时上升。
如图2b所示,在纲水平上,风冷处理组随着贮藏时间的延长,比例占优势的座囊菌纲(Dothideomycetes)所占比例持续下降,酵母纲(Saccharomycetes)和粪壳菌纲(Sordariomycetes)在0~15 d比例增加,酵母纲的比例在第30天时最高。对于冰水处理组,初始菌落构成与风冷组类似,贮藏到15 d时座囊菌纲所占比例降低,而银耳纲(Tremellomycetes)和酵母纲(Saccharomycetes)的比例增加,但在贮藏30 d时,座囊菌纲比例又回升至初始状态。臭氧化冰水处理组贮藏初期座囊菌纲依然为优势菌纲,但比例低于风冷组和冰水处理组低,银耳纲所占比例较高,随着贮藏的进行,座囊菌纲占据绝对优势。
如图2c所示,在目水平上,各处理组初始优势菌为座囊菌目(Dothideales)、格孢腔菌目(Pleosporales)和煤炱目(Capnodiales)3 类。风冷组这3 类菌初始相对含量由大到小为:格孢腔菌目(Pleosporales)>座囊菌目(Dothideales)>煤炱目(Capnodiales);冰水预冷组初始真菌组成中座囊菌目(Dothideales)>格孢腔菌目(Pleosporales)>煤炱目(Capnodiales);臭氧化冰水预冷组初始真菌组成比例与风冷和冰水处理组有较大差别,座囊菌目和格孢腔菌目比例较高,煤炱目比例相对较低,这3 种目总体比例显著低于它们在其他两种处理中的初始比例。随着贮藏时间的延长,风冷处理组格孢腔菌目比例先上升后大幅度降低,座囊菌目比例先下降后上升至与初始比例相近,煤炱目比例在前15 d变化不大,之后大幅增加,到第30天成为优势菌,酵母菌目比例持续增加;同时,其他菌所占的比例在30 d内也有所增加。对于冰水预冷处理组,座囊菌目比例先上升后下降,格孢腔菌目和煤炱目比例先下降后增加,但这两个目的比例都低于对应组的初始水平;酵母菌目在15 d时比例最高,另有一类未鉴定出的菌比例较高。对于臭氧化冰水处理组,贮藏第15天,座囊菌目比例上升成为比例最高的优势菌,格孢腔菌目比例下降,煤炱目比例上升到与格孢腔菌目比例相当,其他菌比例降低。贮藏到第30天,格孢腔菌目比例大幅度上升,成为最主要的优势菌,座囊菌目和煤炱目比例均降低,但三者仍然是合计占比95%以上的优势菌。
如图2d所示,在科水平上,各处理组初始优势菌科一致,均含小穴壳菌科(Dothioraceae)、分类位置未定菌(Incertae-sedis)、小戴卫霉科(Davidiellaceae)、孢腔菌科(Pleosporaceae),以及一类未知的菌。风冷处理组初始这4 类菌比例相当。冰水处理组初始小穴壳菌科(Dothioraceae)比例最高,臭氧化冰水处理组初始小穴壳菌科(Dothioraceae)和分类位置未定菌(Incertae-sedis)比例相当,占据了75%以上。与贮藏开始相比,风冷处理组第15天时小穴壳菌科比例降低,孢腔菌科比例增加,到第30天时小戴卫霉科比例明显增加,成为优势菌,酵母科比例也明显增加。冰水处理组贮藏第15天,小穴壳菌科、未知菌以及酵母科比例增加,孢腔菌科比例降低,贮藏30 d,孢腔菌科比例增加,小穴壳菌科比例降低。臭氧化冰水处理组贮藏15 d后小穴壳菌科和小戴卫霉科比例上升,分类位置未定菌比例下降,贮藏30 d时,分类位置未定菌比例大幅度上升,成为比例最高的菌。
如图2e所示,就属水平而言,各处理组的初始优势菌均包括未知菌(unidentified)和短梗霉属(Aureobasidium)。风冷处理组和冰水处理组的初始优势菌还有链格孢属(Alternaria)、Davidiella和附球(真)菌属(Epicoccum);而臭氧化冰水处理组初始真菌组中这3 类菌的比例显著低于其他两种处理组。随着贮藏过程的进行,风冷处理组在15 d时,链格孢属比例小幅增加,未知菌和短梗霉属比例略降低,其他非优势菌比例略有增加,贮藏第30天,未知菌比例大幅上升,短梗霉属比例也有一定程度的上升,链格孢属比例明显降低。冰水处理组贮藏15 d后,短梗霉属比例增加,未知菌和链格孢属比例降低,贮藏30 d后,未知菌和Davidiella比例增加。臭氧化冰水处理组在贮藏15 d时,链格孢属比例下降,贮藏第30天,短梗霉属比例降低,未知菌和链格孢属比例增加。


图3 不同预冷处理的红玛瑙樱桃贮藏期间表皮优势真菌(OTU)饼形图
Fig. 3 Global percentage of dominant fungi on Red Agate cherry fruit treated with different pre-cooling methods during storage
图3 和图4分别展现了不同预冷处理后红玛瑙樱桃表面优势真菌OTU的分布和比例变化趋势。3 种预冷处理樱桃表面初始共有的优势菌均包括出芽短梗霉菌(Aureobasidium pullulans)、格孢腔菌目(OTU 1)、链格孢属(OTU 4)和小戴卫霉科(OTU 3)。与风冷相比,冰水预冷显著降低了初始菌中OTU 1和OTU 4的比例,使得出芽短梗霉菌成为最主要的优势菌,占据总菌的40.23%。与其他两个预冷处理相比,臭氧化冰水预冷则显著降低了初始菌中OTU 4和OTU 3的比例,使得出芽短梗霉菌成为最主要的优势菌,占据总菌的40.49%。随着贮藏的进行,风冷组出芽短梗霉菌比例先下降,到30 d又上升至33.56%,格孢腔菌目(OTU 1)比例一直下降至5.29%,链格孢属(OTU 4)先小幅度上升,后期大幅下降到4.6%,小戴卫霉科(OTU 3)前期略有下降,后期大幅度上升至42.83%,成为比例最高的菌。冰水预冷组在贮藏的整个过程中,出芽短梗霉菌都占据数量上的绝对优势,15 d时比例达到54.64%,30 d时达到48.29%,链格孢属(OTU 4)和小戴卫霉科(OTU 3)的比例在贮藏过程中持续缓慢下降到10%以下,而格孢腔菌目(OTU 1)在第15 天时快速降低至3.29%,在第30天又恢复至15.28%。臭氧化冰水预冷组的出芽短梗霉菌在0 d和15 d占据绝对优势,15 d时比例超过50%,但30 d时却大幅下降到18.45%,而初始占比29.86%的格孢腔菌目(OTU 1),虽然在15 d时下降到了15.04%,却在30 d时上升到48.27%,成为优势菌,致腐菌链格孢属(OTU 4)虽然在第0天和15天占比不高于6%,却在30 d时达到了14.26%,也可能参与臭氧化冰水预冷红玛瑙樱桃的腐败,小戴卫霉科(OTU 3)比例在第15 天大幅度上升,但30 d时下降到了低于4%的水平,可能不是主要的腐败菌。
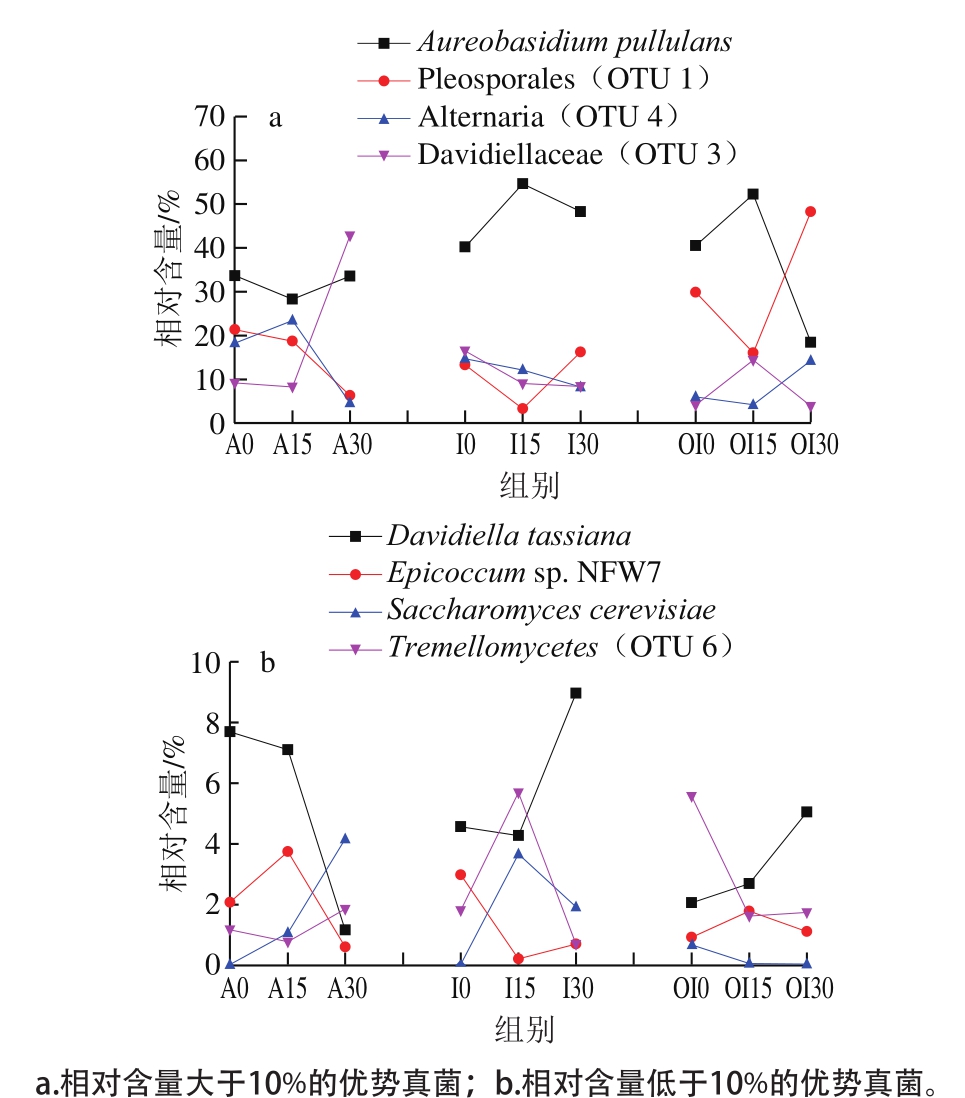
图4 不同预冷处理的红玛瑙樱桃贮藏期间表皮优势真菌(OTU)变化趋势
Fig. 4 Development of dominant fungal components (OTU) on Red Agate cherry fruit treated with different pre-cooling methods during storage
3 讨 论
新鲜果蔬在贮藏过程中非常容易腐败,从而产生严重的经济损失,其中由微生物所带来的损伤可能达到30%[8]。预冷能快速降低果实温度,降低果实自身代谢,同时对果蔬表面真菌组也有一定影响,从而影响后续贮藏过程中的霉变。本研究通过高通量测序技术分析证明,与风冷相比,冰水预冷以及臭氧冰水预冷对于红玛瑙樱桃表面初始真菌组具有明显的影响,两种处理均提高了出芽短梗霉菌在初始菌群中所占的比例,降低了格孢腔菌目、链格孢属和小戴卫霉科的比例。据报道,出芽短梗霉菌可以作为生防菌,拮抗引起桃子褐腐病的核果链核盘菌[9]以及导致番茄晚疫病的致病疫霉[10],可用于防治苹果采后由灰葡萄孢和扩展青霉引起的霉变[11]。格孢腔菌目包含许多属种[12],包含一些可引起果蔬疾病的病原菌,如黑星菌属中的苹果黑星菌(引起苹果黑星病)[13]、梨黑星菌(引起梨黑星病)[14]、格孢腔菌属中的枯叶格孢腔菌(危害葱、蒜、辣椒等,引起黑斑病、叶枯病)等[15]。链格孢属,属半知菌亚门,是樱桃树的重要内生菌[16],也能够引起樱桃果实的腐败[17]。小戴卫霉科含7 个属,其中包含一种重要的病原真菌腊叶芽枝霉(Cladosporium herbarum s. str.(Davidiella tassiana))[18]。可见,本研究中冰水预冷和臭氧冰水预冷可提高红玛瑙樱桃表面初始真菌群中的益生菌比例,而降低病原菌比例,有利于樱桃的贮藏。
据报道甜樱桃果实采后的常见病原真菌有扩展青霉(Penicillium expansum)、葡枝根霉(Rhizopus stolonifer)、链核盘菌(Monilinia sp.)[19]、灰葡萄孢菌(Botrytis cinerea)[20]、炭疽菌(Colletotrichum acutatum)[21]、链格孢菌(Alternaria alternata)等[22]。本研究中的红玛瑙樱桃无论以哪种方式预冷,在贮藏30 d时均出现少量的霉腐果实。风冷预冷樱桃表面的小戴卫霉科是最主要的腐败菌。冰水预冷樱桃表面,生防菌出芽短梗霉菌占据绝对优势,格孢腔菌目(OTU 1)、链格孢属(OTU 4)、小戴卫霉科(OTU 3)和腊叶芽枝霉在第30天比例分别上升到16.28%、8.23%、8.40%和8.96%,它们可能是主要病原菌。贮藏的第30天,臭氧化冰水预冷樱桃表面格孢腔菌目占据绝对优势,是最主要的腐败菌。
除以上绝对优势菌外,一些比例不高于10%的真菌也可能影响红玛瑙樱桃的贮藏。如附球菌属中Epicoccum sp. NFW7在风冷樱桃表面的比例先升后降,在冰水预冷组初始比例略高于风冷组,在贮藏中先降低后轻微上升,但仍然较低。而臭氧化冰水预冷组该菌比例一直较低。附球菌属是樱桃树的重要内生菌[16],但其与红玛瑙樱桃的采后腐败关系不明。研究发现附球菌属(Epicoccum)中的黑附球菌可用作生防菌,防治桃子采后褐腐病[23];但也会引起中国西南琵琶叶斑病[24]。Epicoccum sorghinum能造成芋头叶斑病[25]。酿酒酵母(Saccharomyces cerevisiae)可以作为生物防治菌,防治采前炭疽病菌[26]及苹果的青霉病[27]等。本研究中风冷处理组酿酒酵母的比例在贮藏过程中持续上升,冰水处理组先升后降,而臭氧化冰水处理组中比例一直较低。臭氧及其氧化物可以攻击细菌的许多成分,包括与细胞膜脂肪酸反应生成酸类或者过氧化物[28],从而增强细菌细胞膜的通透性[29-31]。臭氧还可以攻击细胞的膜结合酶类的巯基、细胞内酶类[32-34]、电子传递链物质[35],以及细胞内的DNA[36]。臭氧也能攻击细菌芽孢及真菌孢子的外壳、病毒衣壳中的蛋白质和糖蛋白,因此对芽孢、孢子和病毒有抑杀作用[37-39]。
可见3 种预冷方式对红玛瑙樱桃表面的初始真菌组有明显的影响,而贮藏过程中真菌组的变化除了与初始真菌组成以及贮藏条件相关外,也受到樱桃本身生理状态的影响。风冷组樱桃果实在预冷过程中呼吸消耗较大,而冰水和臭氧冰水预冷虽然以较快速度降低了樱桃的代谢,但难以避免的对樱桃表皮造成了一定损伤。研究3 种预冷处理后樱桃的代谢水平,将有利于揭示各种预冷方式的优缺点。
4 结 论
相比于风冷处理,冰水处理和臭氧化冰水处理明显改变了红玛瑙樱桃初始表面真菌组的群落组成,并且改变了冷藏期间真菌组的发展变化。冰水处理最有利于提高樱桃表面出芽短梗霉菌等生防菌的比例,臭氧化冰水处理样品在冷藏前期芽短梗霉菌等生防菌比例较高。然而,冷藏过程中,3 种预冷方式处理的樱桃,病原微生物依然占据一定比例,并最终导致霉变。建议将预冷与其他抑菌方式相结合,利用栅栏技术控制樱桃冷藏过程中的真菌腐败。
[1] LARRABEE M M A. Environmental effects on the presence and quantity of postharvest fungal pathogens on sweet cherry in the Okanagan Valley[D]. Vancouver: University of British Columbia,2019: 36-54. DOI:10.14288/1.0378449.
[2] SHILPA, MAHAJAN B V C, SINGH N P, et al. Hydrocooling delays pericarp browning, enzymatic activities and maintains quality of litchi fruits under cold chain conditions[J]. Indian Journal of Horticulture,2019, 76(1): 162-167. DOI:10.5958/0974-0112.2019.00023.9.
[3] DE OLIVEIRA ALVES SENA E, DA SILVA P S O, DE ARAUJO H G S, et al. Postharvest quality of cashew apple after hydrocooling and coold room[J]. Postharvest Biology and Technology, 2019, 155:65-71. DOI:10.1016/j.postharvbio.2019.05.002.
[4] FISHER C W, LEE D, DODGE B A, et al. Influence of catalase and superoxide dismutase on ozone inactivation of Listeria monocytogenes[J]. Applied & Environmental Microbiology, 2000,66(4): 1405-1409. DOI:10.1128/AEM.66.4.1405-1409.2000.
[5] SUVETHA K, KAVITHA C, SOORIANATHASUNDARAM K, et al.Ozonated water for shelf-life improvement in grapes[J]. International Journal of Chemical Studies, 2019, 7(3): 4715-4718.
[6] NILSSON R H, ANSLAN S, BAHRAM M, et al. Mycobiome diversity: high-throughput sequencing and identification of fungi[J].Nature Reviews Microbiology, 2019, 17: 95-109. DOI:10.1038/s41579-018-0116-y.
[7] TEDERSOO L, DRENKHAN R, ANSLAN S, et al. High-throughput identification and diagnostics of pathogens and pests: overview and practical recommendations[J]. Molecular Ecology Resources, 2019,19(1): 47-76. DOI:10.1111/1755-0998.12959.
[8] JIANG Y M, ZHU X R, LI Y B. Postharvest control of litchi fruit rot by Bacillus subtilis[J]. LWT-Food Science and Technology, 2001,34(7): 430-436. DOI:10.1006/fstl.2001.0758.
[9] FRANCESCO A D, UGOLINI L, D’AQUINO S, et al. Biocontrol of Monilinia laxa by Aureobasidium pullulans strains: insights on competition for nutrients and space[J]. International Journal of Food Microbiology, 2017, 248: 32-38. DOI:10.1016/j.ijfoodmicro.2017.02.007.
[10] FRANCESCO A D, MILELLA F, MARI M, et al. A preliminary investigation into Aureobasidium pullulans as a potential biocontrol agent against Phytophthora infestans of tomato[J]. Biological Control,2017, 114: 144-149. DOI:10.1016/j.biocontrol.2017.08.010.
[11] IPPOLITO A, GHAOUTH A E, WILSON C L, et al. Control of postharvest decay of apple fruit by Aureobasidium pullulans and induction of defense responses[J]. Postharvest Biology & Technology,2000, 19(3): 265-272. DOI:10.1016/S0925-5214(00)00104-6.
[12] ZHANG Y, CROUS P W, SCHOCH C L, et al. Pleosporales[J]. Fungal Diversity, 2012, 53(1): 1-221. DOI:10.1007/s13225-011-0117-x.
[13] LE CAM B, PARISI L, ARENE L. Evidence of two formae speciales in Venturia inaequalis, responsible for apple and pyracantha scab[J]. Phytopathology, 2002, 92(3): 314-320. DOI:10.1094/PHYTO.2002.92.3.314.
[14] GONZ Á LEZ-DOM Í NGUEZ E, ARMENGOL J, ROSSI V. Biology and epidemiology of Venturia species affecting fruit crops: a review[J]. Frontiers in Plant Science, 2017, 8: 1496. DOI:10.3389/fpls.2017.01496.
[15] LEACH C M, TRIONE E J. Action spectra for light-induced sporulation of the fungi Pleospora herbarum and Alternaria dauci[J].Photochemistry & Photobiology, 1966, 5(8): 621-630. DOI:10.1111/j.1751-1097.1966.tb05808.x.
[16] HADDADDERAFSHI N, P ÓSA T B, P ÉTER G, et al.Characterization of community structure of culturable endophytic fungi in sweet cherry composite trees and their growth-retarding effect against pathogens[J]. Acta Biologica Hungarica, 2016, 67(3): 269-285.DOI:10.1556/018.67.2016.3.5.
[17] ZHAO Y Z, LIU Z H. First report of black spot disease caused by Alternaria alternata on cherry fruits in China[J]. Plant Disease, 2012,96(10): 1580. DOI:10.1094/PDIS-04-12-0416-PDN.
[18] SCHUBERT K, GROENEWALD J Z, BRAUN U, et al. Biodiversity in the Cladosporium herbarum complex (Davidiellaceae,Capnodiales), with standardisation of methods for Cladosporium taxonomy and diagnostics[J]. Studies in Mycology, 2007, 58: 105-156.DOI:10.3114/sim.2007.58.05.
[19] 张涛, 李婷, 郭鹏飞, 等. 西安市樱桃褐腐病发生特点及综合防治措施[J]. 中国植保导刊, 2011, 31(1): 20-21; 47.
[20] FELIZIANI E, SANTINI M, LANDI L, et al. Pre- and postharvest treatment with alternatives to synthetic fungicides to control postharvest decay of sweet cherry[J]. Postharvest Biology & Technology, 2013,78(4): 133-138. DOI:10.1016/j.postharvbio.2012.12.004.
[21] B Ø RVE J, STENSVAND A. Timing of fungicide applications against anthracnose in sweet and sour cherry production in Norway[J]. Crop Protection, 2006, 25(8): 781-787. DOI:10.1016/j.cropro.2005.10.012.
[22] 赵远征, 刘志恒, 李俞涛, 等. 大樱桃黑斑病病原鉴定及其致病性研究[J]. 园艺学报, 2013, 40(8): 1560-1566.
[23] LARENA I, TORRES R, CAL A D, et al. Biological control of postharvest brown rot (Monilinia spp.) of peaches by field applications of Epicoccum nigrum[J]. Biological Control, 2005, 32(2): 305-310.DOI:10.1016/j.biocontrol.2004.10.010.
[24] WU D, ZHANG D H, TIMKO M P, et al. First report of Epicoccum nigrum causing brown leaf spot of loquat in southwestern China[J]. Plant Disease, 2017, 101(8): 1553. DOI:10.1094/PDIS-12-16-1840-PDN.
[25] LIU P Q, WEI M Y, ZHU L, et al. First report of leaf spot on taro caused by Epicoccum sorghinum in China[J]. Plant Disease, 2010,102(3): 682-682. DOI:10.1094/PDIS-11-16-1621-PDN.
[26] LOPES M R, KLEIN M N, FERRAZ L P, et al. Saccharomyces cerevisiae: a novel and efficient biological control agent for Colletotrichum acutatum during pre-harvest[J]. Microbiological Research, 2015, 175: 93-99. DOI:10.1016/j.micres.2015.04.003.
[27] GHOLAMNEJAD J, ETEBARIAN H, ROUSTAEE A, et al.Biological control of apples blue mold by isolates of Saccharomyces cerevisiae[J]. Journal of Plant Protection Research, 2009, 49(3):270-275. DOI:10.2478/v10045-009-0042-0.
[28] SARRON E, COCHET N, GADONNA-WIDEHEM P. Effects of aqueous ozone on Pseudomonas syringae viability and ice nucleating activity[J]. Process Biochemistry, 2013, 48(7): 1004-1009.DOI:10.1016/j.procbio.2013.05.018.
[29] KOMANAPALLI I R, LAU B H S. Ozone-induced damage of Escherichia coli K-12[J]. Applied Microbiology & Biotechnology,1996, 46(5/6): 610-614. DOI:10.1007/s0025300508.
[30] KHADRE M A, YOUSEF A E, KIM J G. Microbiological aspects of ozone applications in food: a review[J]. Journal of Food Science, 2001,66(9): 1242-1252. DOI:10.1111/j.1365-2621.2001.tb15196.x.
[31] ALWI N A, ALI A. In vitro and microscopic analysis of ozone fumigation effects on Salmonella typhimurium and Listeria monocytogenes[J]. Acta Horticulturae, 2013, 1012: 1247-1254.DOI:10.17660/ActaHortic.2013.1012.168.
[32] WHITESIDE C, HASSAN H M. Induction and inactivation of catalase and superoxide dismutase of Escherichia coli by ozone[J].Archives of Biochemistry & Biophysics, 1987, 257(2): 464-471.DOI:10.1016/0003-9861(87)90591-1.
[33] AOYAMA K, NAKAKI T. Glutathione in cellular redox homeostasis: association with the excitatory amino acid carrier 1(EAAC1)[J]. Molecules, 2015, 20(5): 8742-8758. DOI:10.3390/molecules20058742.
[34] DAŞ E, G Ü RAKAN G C, BAYINDIRLI A. Effect of controlled atmosphere storage, modified atmosphere packaging and gaseous ozone treatment on the survival of Salmonella Enteritidis on cherry tomatoes[J]. Food Microbiology, 2006, 23(5): 430-438. DOI:10.1016/j.fm.2005.08.002.
[35] MUDD J B, DAWSON P J, TSENG S, et al. Reaction of ozone with protein tryptophans: band III, serum albumin, and cytochrome C[J].Archives of Biochemistry & Biophysics, 1997, 338(2): 143-149.DOI:10.1006/abbi.1996.9848.
[36] HAMELIN C. Production of single- and double-strand breaks in plasmid DNA by ozone[J]. International Journal of Radiation Oncology Biology Physics, 1985, 11(2): 253-257. DOI:10.1016/0360-3016(85)90146-4.
[37] C ÉSAR J, SUMITA T C, JUNQUEIRA J C, et al. Antimicrobial effects of ozonated water on the sanitization of dental instruments contaminated with E. coli, S. aureus, C. albicans, or the spores of B. atrophaeus[J]. Journal of Infection and Public Health, 2012, 5(4):269-274. DOI:10.1016/j.jiph.2011.12.007.
[38] NAITO S, TAKAHARA H. Ozone contribution in food industry in Japan[J]. Ozone Science & Engineering, 2006, 28(6): 425-429.DOI:10.1080/01919510600987347.
[39] WU J N, DOAN H, CUENCA M A. Investigation of gaseous ozone as an anti-fungal fumigant for stored wheat[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(7): 1288-1293.DOI:10.1002/jctb.1550.