肌原纤维蛋白是由肌球蛋白、肌动蛋白、肌动球蛋白、肌钙蛋白、原肌球蛋白等组成的复合体,它是肌肉中一类重要的结构蛋白质群[1],对肉制品品质以及凝胶、乳化等特性有非常重要的影响[2-3]。肌原纤维蛋白在一定温度下会形成三维网状结构,即凝胶化,从而赋予肉制品特殊的口感;而肌原纤维蛋白优良的乳化特性使得蛋白质能够将油脂和水分保留在其附近,并且对于分散和稳定脂肪颗粒或油滴起着重要作用,从而维持肉制品较好的质地。但是肌原纤维蛋白在加工过程中的氧化可能会对其功能特性以及营养和安全造成不良影响,不同的氧化程度对肌原纤维蛋白的交联、聚集等产生的影响程度有一定的差异[4],轻度氧化对肌原纤维蛋白的功能特性有促进作用,而重度氧化则会对肌原纤维蛋白的结构和性质造成不良影响,破坏肉制品的口感和营养价值,并可能形成有毒化合物,从而降低食物的品质[5],同时氧化产物如硫化合物、犬尿氨酸等会引发癌症、糖尿病等疾病[6-7]。因此需要加入抗氧化剂进行控制,但合成抗氧化剂具有潜在的毒性[8],天然抗氧化剂尤其是多酚类物质在食品中的应用研究日益深化[9-10],添加多酚对于肉类蛋白氧化抑制具有重要作用,且肉制品加工过程中香辛料的加入也会引入多酚物质,在调色调味的同时起到抗氧化作用。多酚与肌原纤维蛋白相互作用会影响蛋白特性,从而影响肉制品品质,本文总结了多酚与肌原纤维蛋白的相互作用机制及影响相互作用的因素研究,并在此基础上凝练多酚对肌原纤维蛋白品质影响机制和调控手段,旨在为多酚影响肉制品品质机制的明确乃至相关理论体系的构建提供参考。
1 多酚与肌原纤维蛋白的相互作用机制
多酚与蛋白质由于其特殊的结构和特性能够发生可逆或不可逆的相互作用。可逆的相互作用通常为非共价相互作用,而不可逆的化学反应则通常为共价相互作用,两种相互作用可同时发生[11-12]。
1.1 多酚与肌原纤维蛋白的非共价相互作用
多酚与蛋白质之间的非共价作用,通常包括疏水相互作用、氢键、范德华力和静电相互作用力等[13-14]。Haslam等率先提出多酚与蛋白质非共价相互作用是“手和手套”模式,其依赖于蛋白质的类型和pH值,在蛋白质的等电点或接近等电点处相互作用达到最大[15]。对于肌原纤维蛋白,疏水相互作用主要是由多酚的芳香环和肌原纤维蛋白的疏水位点,如肌球蛋白中的脯氨酸残基等作用引起;氢键主要是由多酚的羟基基团与肌原纤维蛋白的氢原子受体位点,如主链的肽基,侧链上的氨基、羧基等反应生成,一定程度上能够加强其他非共价作用;范德华力主要是肌原纤维蛋白与多酚中的极性基团相互靠近,固有偶极发生相对移动,从而产生的分子间作用力;静电相互作用主要是由于肌原纤维蛋白与多酚物质中离子间相互吸引或者相互排斥所产生的作用力。黄渊等[16]通过测定荧光光谱发现,表没食子儿茶素没食子酸酯与白藜芦醇两种多酚物质与鲢鱼肌球蛋白的非共价相互作用主要是范德华力及氢键,且多酚与肌球蛋白为自发结合过程。Jia Na等[17]通过利用溴酚蓝测定猪肉肌原纤维蛋白的表面疏水性,推断儿茶素与肌原纤维蛋白会进行非共价结合,发生疏水相互作用。李玲等[18]在氧化条件下测定猪肌原纤维蛋白的表面疏水性,其推论茶多酚与猪肉肌原纤维蛋白发生疏水相互作用,从而降低了溴酚蓝与蛋白表面疏水基团的结合。Cao Yungang等[19]通过测定荧光光谱发现随着没食子儿茶素-3-没食子酸酯的添加量从0逐渐增加至1 000 mg/L,猪肉肌原纤维蛋白荧光逐渐猝灭,表明没食子儿茶素-3-没食子酸酯和色氨酸残基之间具有非共价相互作用。多酚与蛋白质的非共价相互作用见图1。
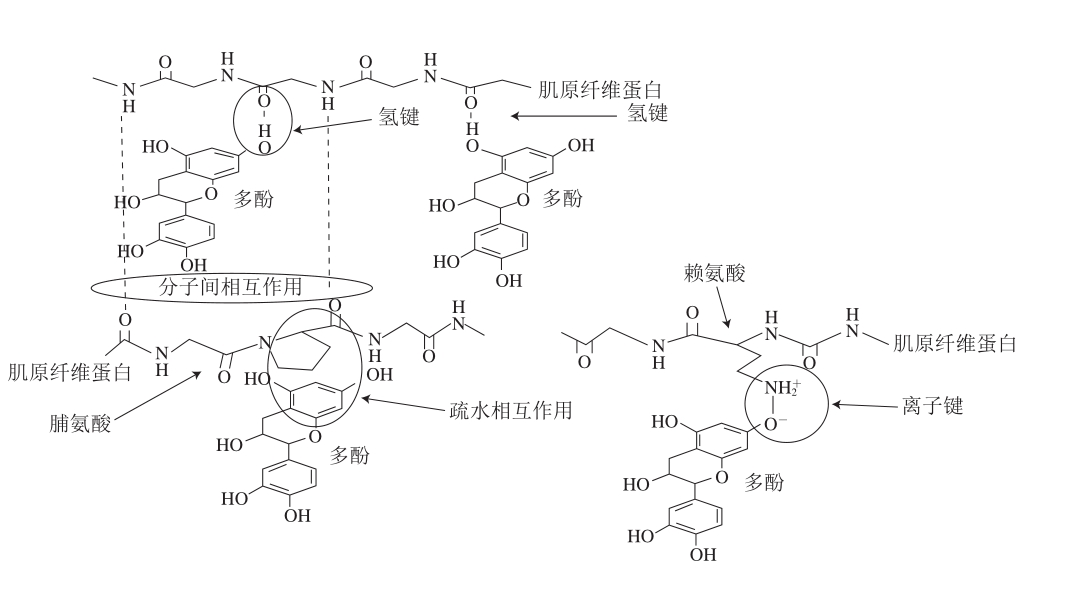
图1 多酚与肌原纤维蛋白非共价相互作用[20]
Fig. 1 Non-covalent interaction between polyphenols and myofibrillar proteins[20]
1.2 多酚与肌原纤维蛋白的共价相互作用
多酚与蛋白质的共价相互作用通常是一种加成反应,作用较强且不可逆。多酚清除自由基后会转变为高活性的半醌自由基结构或醌类物质[21],进而与蛋白质的巯基和氨基发生加成反应,形成“巯基-醌”和“氨基-醌”加成产物[22],故而该种加成反应常称为“巯基-醌”和“氨基-醌”加成反应。肌原纤维蛋白富含巯基,与多酚共价互作位点主要为巯基和氨基。“巯基-醌”和“氨基-醌”加成反应会引起肌原纤维蛋白巯基、游离氨基水平显著降低,使肌原纤维蛋白的α-螺旋、β-折叠等二级结构和三级结构改变[23-24]。Jongberg等[25]研究发现,添加了多酚类物质的牛肉肌原纤维蛋白巯基含量减少,通过液相色谱-质谱联用技术分析显示有“巯基-醌”加成产物的形成。Tang Changbo等[26]通过基质辅助激光解吸电离飞行时间质谱(matrix assisted laser desorption ionization-time of flight/mass spectrometry,MALDI-TOF/MS)研究发现多酚可以与猪肉肌原纤维蛋白上的巯基形成“巯基-醌”加成产物,且这种加成产物会随着多酚与肌原纤维蛋白混合搅拌时间的延长而增加。Prodpran等[27]研究了多酚对鱼肌原纤维蛋白交联的影响,发现多酚的酚羟基被氧化为醌类物质,并与肌原纤维蛋白的巯基发生共价作用形成更加稳定的构象,导致肌原纤维蛋白总巯基含量降低。Fujimoto等[28]通过核磁共振和液相色谱-质谱联用技术,发现在自由基氧化条件下,多酚与巯基能够发生加成反应,从而生成“巯基-醌”加成产物。曹云刚[11]研究发现,添加了多酚物质后,绿原酸氧化生成醌类物质或半醌类物质,与猪肉肌原纤维蛋白中的游离氨基共价结合,生成“氨基-醌”共价产物,导致肌原纤维蛋白中的游离氨基含量进一步降低。Tang Changbo等[29]采用三重TOF MS/MS技术,发现多酚被氧化成醌类物质后会与猪肉肌原纤维蛋白发生加成反应,并在氧化应激凝胶模型中鉴定迷迭香酸衍生醌类化合物与肌原纤维蛋白的加合物,发现加入迷迭香酸后,迷迭香酸与肌原纤维蛋白中不同氨基酸结合,形成“氨基-醌”加成产物。多酚与蛋白质共价相互作用见图2。
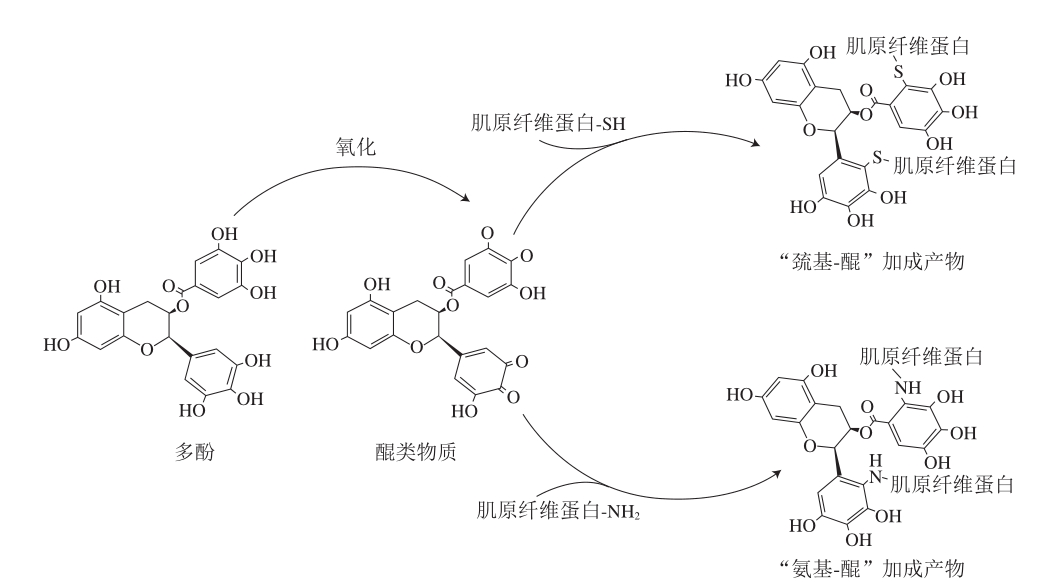
图2 多酚与肌原纤维蛋白共价相互作用[30]
Fig. 2 Covalent interaction between polyphenols and myofibrillar proteins[30]
1.3 多酚与肌原纤维蛋白的相互作用对蛋白结构的影响
多酚与肌原纤维蛋白的相互作用对蛋白质的二级及三级结构具有显著影响。Sun Jiaojiao等[31]以草鱼为原料研究发现,添加苹果多酚后,肌原纤维蛋白巯基含量减少且肌原纤维蛋白的降解减缓,同时苹果多酚不会对草鱼的口感产生不良影响。张慧芸等[32]研究发现,添加表没食子儿茶素没食子酸酯会显著抑制鱼肉肌原纤维蛋白羰基形成,并且由于表没食子儿茶素没食子酸酯氧化生成的醌类物质与巯基、氨基发生共价结合,导致巯基和游离氨基的损失。梅甜恬等[33]通过对鸭肉肌原纤维蛋白的研究发现多酚能够较好地保护α-螺旋结构,减少β-折叠结构的产生。黄渊等[16]通过圆二色谱法研究发现随着表没食子儿茶素没食子酸酯浓度上升,鲢鱼肌球蛋白α-螺旋含量整体呈上升趋势,β-折叠、β-转角、无规卷曲含量都呈现下降趋势,说明表没食子儿茶素没食子酸酯与肌球蛋白作用使肌球蛋白二级结构发生变化,而随着白藜芦醇浓度上升,肌球蛋白α-螺旋、无规卷曲含量基本不变,仅β-转角、β-折叠含量发生少许变化,说明不同种类多酚对肌球蛋白二级结构影响有明显差异,这也从侧面说明不同结构的多酚物质与肌原纤维蛋白的相互作用方式有所差异,从而造成肌原纤维蛋白的结构差异。Czubinski等[34]发现多酚可通过与蛋白质结合来影响某些氨基酸的有效性,并改变蛋白质结构,导致蛋白折叠,从而影响蛋白质的功能和消化率,但如果多酚与蛋白疏水位点结合,且疏水位点较弱时,蛋白结构基本不发生变化。
2 多酚与肌原纤维蛋白相互作用的影响因素
多酚与肌原纤维蛋白的非共价相互作用和共价相互作用均会受到自身特性和外界条件的影响。多酚的种类、分子质量与结构等自身特性以及温度、pH值、离子强度等外界条件均会影响多酚与肌原纤维蛋白的相互作用。
2.1 影响非共价相互作用的因素
2.1.1 多酚种类
不同多酚物质由于分子质量及结构不同,导致其与肌原纤维蛋白之间的非共价相互作用的强度有所区别。多酚物质中的疏水基团越多,其与肌原纤维蛋白之间的疏水相互作用越强;多酚物质中的羟基等氢供体越多,其与肌原纤维蛋白的氢键作用越强;多酚物质中的极性基团越多,则范德华力越强;多酚物质与肌原纤维蛋白的异性电荷越多,则静电相互作用越强。黄渊等[16]研究了表没食子儿茶素没食子酸酯与白藜芦醇两种多酚物质与鲢鱼肌球蛋白的相互作用,发现非共价作用主要是氢键和范德华力,且在相同温度条件下,两种多酚类物质与肌球蛋白相互作用的结合常数、结合位点数均不相同,其非共价作用的强度不同。Jia Na等[17]研究发现儿茶素与猪肌原纤维蛋白之间的非共价相互作用主要是疏水相互作用。李玲等[18]研究推测茶多酚与猪肉肌原纤维蛋白之间也发生了疏水相互作用,从而降低了溴酚蓝与蛋白表面疏水基团的结合,由此可以看出不同种类的多酚物质与肌原纤维蛋白的非共价相互作用强度及种类均有所不同。
2.1.2 温度
温度的改变会引起多酚和肌原纤维蛋白自身的结构变化,从而导致多酚与肌原纤维蛋白的非共价相互作用强度和类型发生变化。较大幅度的升温或者降温会使肌原纤维蛋白表层的微环境改变,导致其二级结构变化,使其结构更加疏松,暴露更多的分子内疏水基团,使表面疏水作用增强,形成疏水键,并且温度会影响氢键的强弱。通常情况下,氢键会随温度升高而减弱,但是疏水相互作用会随温度升高而增强[35]。黄渊等[16]研究发现表没食子儿茶素没食子酸酯和白藜芦醇与鲢鱼肌球蛋白的结合位点数均接近1,表明多酚与肌球蛋白的之间结合力较强,在25~37 ℃时,两种多酚物质与肌球蛋白相互作用的结合常数、结合位点数都随着温度上升而降低。Nunez-Flores等[36]研究发现,加热使鱼肌球蛋白的结构展开,暴露更多的疏水基团,使多酚和肌原纤维蛋白的疏水相互作用增强;但是温度过高会破坏多酚的结构,从而降低多酚与肌原纤维蛋白的非共价相互作用强度。Zeng Zicong等[37]从糙米中鉴定出6 种酚酸、4 种酚酸苷、8 种黄酮类苷类化合物等27 种多酚物质,其后分别在60、80、100 ℃下对糙米酚提取物进行120 min的水热稳定性研究;研究发现,经水热处理后,糙米酚类物质含量降低,总抗氧化活性降低,而游离葡萄糖含量升高,说明加热使部分多酚糖苷脱糖,导致多酚物质结构改变,羟基数量减少,氢键作用被减弱。
2.1.3 pH值
pH值对多酚与肌原纤维蛋白相互作用的影响较为复杂,它不仅能够影响多酚与肌原纤维蛋白的结合程度,还能通过影响多酚和肌原纤维蛋白的化学结构进而影响相互作用的类型和强度。Sun Hongnan等[38]研究发现,在pH值范围为5.0~7.0时,多酚物质中氢供体数量相对较多,因此多酚与肌原纤维蛋白氢键作用较强;Anna等[39]研究发现,在酸性较强时,槲皮素和没食子儿茶素没食子酸酯的氢供体数量较低,随着氢离子浓度的降低,多酚物质的氢供体数量增加,多酚与肌原纤维蛋白的氢键作用随之加强。因此,在弱酸环境中,多酚与肌原纤维蛋白中的氢原子受体位点能更好地结合,相互作用中的氢键作用被强化。在肌原纤维蛋白的等电点附近时,多酚与肌原纤维蛋白的静电互斥作用最弱,故而此时静电引力作用最强。当pH值远离肌原纤维蛋白的等电点时,其分子负电荷数量增加,从而导致肌原纤维蛋白间静电斥力增大,使其结构充分展开,色氨酸等疏水性氨基酸被暴露,最终使肌原纤维蛋白与多酚的疏水相互作用增强;同时,随着肌原纤维蛋白结构的展开,其氢原子受体位点数量增多,与多酚物质的氢键作用增强[40]。
2.1.4 离子强度
金属离子对多酚与肌原纤维蛋白的非共价相互作用有一定的影响,在一定程度上,金属离子能够使肌原纤维蛋白解折叠,其内部的疏水性基团暴露,从而增大多酚与肌原纤维蛋白的疏水相互作用,而且金属离子在一定程度上会对多酚物质的氢供体数量产生影响,从而影响氢键强度。Nunez-Flores等[36]研究发现,质量分数3%的NaCl会增加鱼肌球蛋白的溶解度,降低肌球蛋白的变性温度和焓,同时引导肌球蛋白展开,使疏水基团暴露出来,加强多酚与肌原纤维蛋白的疏水相互作用。Jia Dan等[41]研究发现,60 mmol/L CaCl2溶液可以诱导鱼肌球蛋白的构象发生改变,暴露更多的疏水氨基酸残基,疏水氨基酸残基可与多酚的苯环发生疏水相互作用。贾娜等[42]通过研究NaCl与迷迭香提取物的协同作用对猪肉肌原纤维蛋白的影响时发现,当NaCl浓度为0.45 mol/L时,加入迷迭香提取物后的肌原纤维蛋白中部分色氨酸暴露于极性环境中,由此造成三级结构发生改变,其特定空间结构部分解折叠,从而使多酚与肌原纤维蛋白的疏水相互作用增强。Anna等[39]通过研究铜离子、锌离子、铝离子对多酚物质的影响发现,有铝离子存在的多酚物质氧化活性较其他含两种金属离子的多酚物质低,表明其结合肌原纤维蛋白的能力较低。
2.2 影响共价相互作用的因素
2.2.1 多酚种类
多酚种类众多,不同种类多酚的抗氧化活性不同,其氧化为半醌类物质或醌类物质的能力有所区别,从而导致多酚与肌原纤维蛋白的“巯基-醌”和“氨基-醌”加成反应强度不同。Prodpran等[27]通过研究咖啡酸、儿茶素、阿魏酸和单宁酸4 种多酚物质对鱼肌原纤维蛋白的影响发现,由于单宁酸中存在的羟基数量较多,单宁酸表现出比咖啡酸、儿茶素和阿魏酸更高的蛋白质交联能力,加入单宁酸的肌原纤维蛋白游离氨基含量最低,“氨基-醌”加成反应较强;而咖啡酸和单宁酸导致巯基含量的更大程度降低,“巯基-醌”共价反应较强。刘丹等[43]通过研究丁香、桂皮、迷迭香3 种香辛料提取物对猪肌原纤维蛋白的性能影响发现,加入香辛料提取物后的肌原纤维蛋白中总巯基含量均下降,但是不同香辛料使总巯基含量下降速率不同,且最终的总巯基含量也不同,其中添加丁香提取物的肌原纤维蛋白的总巯基含量下降得最快,其含量均显著低于添加桂皮提取物和迷迭香提取物的肌原纤维蛋白,由此表明不同多酚物质与肌原纤维蛋白的“巯基-醌”加成反应强度不同。
2.2.2 温度
温度改变会使多酚与肌原纤维蛋白的结构发生变化,从而影响“巯基-醌”、“氨基-醌”加成反应。吴利芬等[44]研究发现,猪肌原纤维蛋白巯基含量在40~70 ℃时下降程度较大,40 ℃以下及70 ℃以上时的变化不明显,当巯基含量降低时,其与多酚发生“巯基-醌”共价反应的可能性降低。Zeng Zicong等[37]研究发现,多酚物质经过60、80、100 ℃处理后,酚类物质含量降低,总抗氧化活性降低,其将自由基转化为半醌类或醌类物质的能力降低,从而影响共价相互作用。
2.2.3 pH值对共价相互作用的影响
pH值对多酚与肌原纤维蛋白共价相互作用的影响主要是在碱性环境中。在极碱环境中,肌原纤维蛋白的结构发生变化,暴露更多的多酚结合位点,使得共价相互作用加强。Anna等[39]研究发现,随着pH值从2.9增大至5.8,多酚氧化分解程度加剧,其稳定性变差,而且碱性环境破坏多酚结构,氧化生成醌类物质,在此种情况下,多酚与肌原纤维蛋白更易发生共价结合,形成“巯基-醌”和“氨基-醌”加成产物。
2.2.4 离子强度
由于肌原纤维蛋白是盐溶性蛋白,离子强度对肌原纤维蛋白的溶解度具有显著影响,而溶解度在一定程度上与肌原纤维蛋白的亲水基团数量有关,氨基等亲水基团易与醌类物质发生共价反应,同时,盐离子可改变肌原纤维蛋白的构象,从而影响共价相互作用[45]。Zhou Feibai等[46]研究发现,NaCl浓度(0~0.6 mmol/L)的升高促进了肌原纤维蛋白与多酚的“氨基-醌”的共价反应,肌原纤维蛋白中的氨基数量减少,且0.6 mol/L的NaCl溶液可提高肌原纤维蛋白的溶解度,进一步加强相互作用的强度。Jia Na等[17]研究发现,60 mmol/L的CaCl2溶液可以诱导肌球蛋白暴露更多巯基基团,发生“巯基-醌”共价结合,从而促进多酚与肌原纤维蛋白的相互作用。
3 多酚与肌原纤维蛋白相互作用对蛋白性质的影响
多酚与肌原纤维蛋白的非共价结合和共价结合均会对肌原纤维蛋白的溶解度、表面疏水性、凝胶能力及强度、乳化特性等性质产生影响,且这种影响强度随着多酚浓度的变化而变化,多酚浓度过高会对肌原纤维蛋白功能性质起破坏作用。
3.1 对蛋白溶解及表面疏水性的影响
通常来说,肌原纤维蛋白的溶解度与表面疏水性呈负相关,溶解度的变化可以从侧面反映表面疏水性的变化。肌原纤维蛋白中的亲水性基团与水发生相互作用从而使其具有一定的溶解度,而疏水性基团会减弱肌原纤维蛋白与水的作用力,因此肌原纤维蛋白的溶解度与其亲、疏水性基团的比例有关。当添加适量的多酚物质时,多酚与肌原纤维蛋白的相互作用能够减少肌原纤维蛋白在氧化过程中的疏水性基团暴露,同时引入了多酚物质中的亲水性基团,从而使其亲水性基团与疏水性基团的比例增大,使得肌原纤维蛋白的溶解度增大,表面疏水性降低。当添加过量的多酚物质时,过剩的多酚物质会屏蔽肌原纤维蛋白中的氨基等亲水性基团,从而使肌原纤维蛋白的溶解性降低。
Wang Xu[47]、窦川林[48]等研究发现3 g/L的茶多酚能够抑制泥鳅肌原纤维蛋白的表面疏水性上升,同时缓解其溶解度下降;多酚能清除自由基,抑制肌原纤维蛋白的氧化变性,从而能减少其疏水性氨基酸残基暴露;在这个过程中,虽然多酚清除自由基后转变为的醌类物质与肌原纤维蛋白的氨基等亲水性基团发生共价结合,但是同时又引入了多酚中的羟基等亲水性基团,且多酚能在一定程度上抑制微生物生长和繁殖,致使微生物对肌原纤维蛋白的破坏能力减弱,因此能减缓蛋白质溶解度下降趋势。但是Cao Yungang等[49]发现6、30 μmol/g(以蛋白质量计,下同)的绿原酸处理猪肌原纤维蛋白,其表面疏水性基本无差异;然而在添加量为150 μmol/g时,绿原酸会使肌原纤维蛋白表面疏水性和不溶性大幅度增加,表明高浓度的绿原酸促进了肌原纤维蛋白进一步展开,使其疏水基团暴露。贾娜等[50]研究发现,在添加10 μmol/g没食子酸时,肌原纤维蛋白表面疏水性下降,但在添加量为50、100、150 μmol/g时,表面疏水性会上升,并且没食子酸的添加量越大,肌原纤维蛋白表面疏水性越大。
3.2 对肌原纤维蛋白凝胶性能的影响
肌原纤维蛋白由于富含肌球蛋白而具有较好的凝胶特性,随着温度的升高,肌原纤维蛋白展开并交联,形成具有一定黏弹性的稳定的三维网状结构,从而实现凝胶化。凝胶的结构和特性取决于变性速率和聚集速率,变性速率较大有利于肌原纤维蛋白展开和发生相互作用,从而形成高度有序的凝胶[51]。在肌原纤维蛋白形成凝胶过程中,疏水相互作用、静电相互作用、氢键等非共价相互作用及共价相互作用均会对凝胶性能造成影响。当多酚含量过高时,多酚与肌原纤维蛋白共价结合过度,导致游离氨基和巯基数量显著下降,破坏了肌原纤维蛋白的二级和三级结构,引起肌原纤维蛋白的不良聚集[23,25],而且过剩的多酚物质还会屏蔽肌原纤维蛋白中的巯基、氨基等反应性官能团,阻碍形成有序的蛋白质凝胶网络,从而导致肌原纤维蛋白凝胶性能的下降;当多酚含量适当时,多酚被氧化形成的醌类物质会促使肌原纤维蛋白中的巯基向二硫键转化,而且可以作为交联剂,同时与不同的亲核基团共价结合从而使肌原纤维蛋白交联[49,52]。
相关研究发现,多酚类物质可以有效提高肌原纤维蛋白的交联[53-54],张慧芸等[55]研究发现添加0.05%(以蛋白质量计,下同)鞣酸或0.25%没食子酸能够抑制猪肉肌原纤维蛋白的氧化,改善其凝胶保水性和凝胶强度;Balange等[56]研究表明,向鲭鱼鱼糜中分别添加0.40%阿魏酸、0.50%单宁酸、0.50%咖啡酸、0.10%儿茶素等多酚物质均可提高其肌原纤维蛋白凝胶特性,但当加入0.60%酚类化合物时会降低鱼糜凝胶白度;Buamard等[57]分别利用体积分数60%、80%乙醇溶液制备椰壳提取物,并记为E60、E80,研究发现0.125% E60或0.075% E80椰壳提取物到加入沙丁鱼鱼糜中,均能使肌球蛋白具有更高的链密度和联结度,提高鱼糜凝胶强度,降低鱼糜凝胶自溶能力,但凝胶白度略有下降。多酚氧化生成的醌类物质可以促进蛋白质中赖氨酸、蛋氨酸、丝氨酸等氨基酸的氧化交联,从而形成更为稳定的网络结构[58-59]。但是Cao Yungang等[49]研究发现,添加6、30 μmol/g绿原酸会提高肌原纤维蛋白的胶凝能力,并增强氧化在构建弹性凝胶网络中的积极作用,但当绿原酸添加量达到150 μmol/g时,绿原酸会发生自我交联,从而阻碍肌原纤维蛋白的相互交联能力,导致其凝胶强度下降。贾娜等[50]以猪肉肌原纤维蛋白为研究对象,发现添加50 μmol/g的没食子酸会破坏肌原纤维蛋白的凝胶结构,并且随着没食子酸的添加量继续增加,破坏作用更大。
3.3 对肌原纤维蛋白乳化性能的影响
肌原纤维蛋白的乳化性能主要包括乳化活性和乳化稳定性,具有使肉糜制品形成乳化体系并且稳定其体系的能力。肌原纤维蛋白能在脂肪颗粒表面吸附伸展形成界面膜,界面膜与黏弹性蛋白基质相连,共同稳定脂肪颗粒。而肌原纤维蛋白的氧化会导致其结构的改变,不再能形成稳定的界面膜,使其乳化性能降低。而多酚与肌原纤维蛋白的相互作用会减缓肌原纤维蛋白的氧化,从而减缓肌原纤维蛋白乳化性能的降低。但是添加的多酚物质过量会导致肌原纤维蛋白的不良聚集,因而在乳化过程中难以伸展并包裹于油滴表面,难以形成界面膜。
雷娜[30]研究发现添加0.01%(以蛋白质量计,下同)表没食子儿茶素没食子酸酯能够稳定肌原纤维蛋白的乳化性能,而添加0.1%表没食子儿茶素没食子酸酯会使其乳化性能处于不稳定状态,由于高浓度的表没食子儿茶素没食子酸酯会与肌原纤维蛋白发生共价结合,产生较多的“氨基-醌”、“巯基-醌”加成产物,过度阻碍了肌原纤维蛋白之间的共价键的形成和交互作用,进而导致形成更大的乳化液滴,破坏乳化稳定性。同时Jongberg等[23]研究发现0.15%的绿茶提取物也会破坏肌原纤维蛋白的乳化性能。Li Yuanyuan等[60]研究发现,随着鼠尾草提取物浓度的增加,猪肌原纤维蛋白乳化稳定性先升高后降低,在鼠尾草提取物质量浓度为100 μg/mL时,乳化稳定性最高,鼠尾草提取物中的多酚物质与肌原纤维蛋白发生相互作用,提高了界面膜的稳定性,从而提高了肌原纤维蛋白的乳化稳定性。
4 结 语
多酚与肌原纤维蛋白的相互作用类型包括疏水相互作用、氢键、范德华力和静电相互作用力等非共价相互作用以及“巯基-醌”和“氨基-醌”加成反应等共价相互作用。而多酚与肌原纤维蛋白的相互作用受自身性质和外界条件的影响,并能对肌原纤维蛋白的结构和功能性质造成一定的影响。但是目前对多酚与肌原纤维蛋白相互作用研究的深度和广度有所不足,在以下方面具有较大挖掘和研究空间。
4.1 多酚与及原纤维蛋白共价互作机制及其影响尚需深入研究
由于共价相互作用的不可逆性,且其比非共价相互作用强度更大,可能会对肌原纤维蛋白的性质造成更明显的影响。目前明确的多酚与肌原纤维蛋白的共价作用主要包括“氨基-醌”、“巯基-醌”的生成,但何种情况下生成何种产物?是否可通过外界条件对其进行调控?这些问题尚需进一步明确。此外,“氨基-醌”、“巯基-醌”的生成和积累对肌原纤维蛋白性质的影响也值得进一步探究,可以扩大加成产物在食品领域中的应用。
4.2 基于多酚与肌原纤维蛋白相互作用的蛋白调控机制及理论体系构建亟待深入
通过综述多酚与肌原纤维蛋白相互作用机制和影响条件及其对肌原纤维蛋白的影响发现,多酚物质的结构以及外界条件对肌原纤维蛋白的功能特性有较大的影响,且具有一定的规律性。
如在众多多酚物质中,对于表没食子儿茶素没食子酸酯、儿茶素、绿原酸、单宁酸、姜黄素、咖啡酸等的研究较为深入[61]。同时,也有很多关于各类富含多酚的植物提取物的研究,但是植物提取物中,多酚物质非单一,可能不同多酚物质存在拮抗或协同作用。而由于不同多酚物质的分子质量不同,针对不同的多酚物质,其添加量的最佳范围有所差异,通常选取的研究范围为0.05%~0.50%,多酚添加量过高会对肌原纤维蛋白的功能性质造成不良影响。
外界条件对多酚与肌原纤维蛋白的相互作用影响较大,通常来说,当温度在20~40 ℃左右,相互作用较强,温度过高会使蛋白变性,而低温会抑制蛋白活性;pH值在5.0~8.0左右相互作用较强,极酸和极碱环境都会破坏蛋白结构;此外,通常向溶液中添加NaCl、CaCl2等盐溶液,加强相互作用。同时可通过添加其他物质如β-环糊精等多糖物质来控制相互作用的程度[62]。
但总地来说,基于多酚与肌原纤维蛋白互作机制对蛋白性质进行调控的研究尚需进一步深入,而相应的理论体系也亟待构建。
除以上问题外,根据多酚和肌原纤维蛋白的相互作用,以肌原纤维蛋白为载体,将多酚或多酚复合物与肌原纤维蛋白结合,应用于食品免疫学等方面;基于多酚与肌原纤维蛋白的相互作用及肌原纤维蛋白的凝胶特性,改善可食用可降解薄膜的品质等也是未来的研究方向。
[1] LIU R, LONERGAN S, STEDHAM E, et al. Effect of nitric oxide on myofibrillar proteins and the susceptibility to calpain-1 proteolysis[J]. Food Chemistry, 2019, 276: 63-70. DOI:10.1016/j.foodchem.2018.10.005.
[2] FENG X, ZHU Y Y, LIU Q, et al. Effects of bromelain tenderisation on myofibrillar proteins, texture and flavour of fish balls prepared from golden pomfret[J]. Food and Bioprocess Technology, 2017, 10:1918-1930. DOI:10.1007/s11947-017-1963-7.
[3] JIANG W X, HE Y F, XIONG S B, et al. Effect of mild ozone oxidation on structural changes of silver carp (Hypophthalmichthys molitrix) myosin[J]. Food and Bioprocess Technology, 2017, 10(2):370-378. DOI:10.1007/s11947-016-1828-5.
[4] 李玲, 郭燕云, 周怡. 氧化程度对肌原纤维蛋白理化特性和凝胶水分分布的影响[J]. 食品与发酵工业, 2019, 45(6): 97-103.DOI:10.13995/j.cnki.11-1802/ts.018135.
[5] UTRERA M, MORCUENDE D, ESTEVEZ M. Temperature of frozen storage affects the nature and consequences of protein oxidation in beef patties[J]. Meat Science, 2014, 96: 1250-1257. DOI:10.1016/j.meatsci.2013.10.032.
[6] SOLADOYE O P, JUÁREZ M L, AALHUS J L, et al. Protein oxidation in processed meat: mechanisms and potential implications on human health[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2): 106-122.DOI:10.1111/1541-4337.12127.
[7] PAPUC C, GORAN G V, PREDESCU C N, et al. Mechanisms of oxidative processes in meat and toxicity induced by postprandial degradation products: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2017, 16(1): 96-123. DOI:10.1111/1541-4337.12241.
[8] JIANG J, XIONG Y L L.. Natural antioxidants as food and feed additives to promote health benefits and quality of meat products:a review[J]. Meat Science, 2016, 120: 107-117. DOI:10.1016/j.meatsci.2016.04.005.
[9] HYGREEVA D, PANDEY M C, RADHAKRISHNA K. Potential applications of plant based derivatives as fat replacers, antioxidants and antimicrobials in fresh and processed meat products[J]. Meat Science, 2014, 98(1): 47-57. DOI:10.1016/j.meatsci.2014.04.006.
[10] GRANATO D, NUNES D S, BARBA F J. An integrated strategy between food chemistry, biology, nutrition, pharmacology, and statistics in the development of functional foods: a proposal[J]. Trends in Food Science & Technology, 2017, 62: 13-22. DOI:10.1016/j.tifs.2016.12.010.
[11] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D]. 无锡: 江南大学, 2016: 10-80.
[12] LE B C, RENARD C M G C. Interactions between polyphenols and macromolecules: quantification methods and mechanisms[J].Critical Reviews in Food Science and Nutrition, 2012, 52(3): 213-248.DOI:10.1080/10408398.2010.499808.
[13] JAKOBEK L. Interactions of polyphenols with carbohydrates, lipids and proteins[J]. Food Chemistry, 2015, 175: 556-567. DOI:10.1016/j.foodchem.2014.12.013.
[14] PRIGENT S. Interactions of phenolic compounds with globular proteins and their effects on food-related functional properties[D].Wageningen: Wageningen University, 2005: 1-10.
[15] HASLAM E, LILLEY T H, CAI Y, et al. Traditional herbal medicines-the role of polyphenols[J]. Planta Medica, 1989, 55(1): 1-8.DOI:10.1055/s-2006-961764.
[16] 黄渊, 岳世阳, 熊善柏, 等. 2 种天然抗氧化剂与鲢鱼肌球蛋白的相互作用[J]. 食品科学, 2019, 40(4): 14-20. DOI:10.7506/spkx1002-6630-20171221-263.
[17] JIA Na, WANG Letian, SHAO Junhua, et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J]. Meat Science, 2017, 127: 45-50. DOI:10.1016/j.meatsci.2017.01.004.
[18] 李玲, 季慧, 康大成, 等. 氧化条件下茶多酚对猪肉肌原纤维蛋白理化和凝胶特性的影响[J]. 食品科学, 2019, 40(2): 12-17.DOI:10.7506/spkx1002-6630-20180606-064.
[19] CAO Yungang, AI Nasi, TRUE A D, et al. Effects of (-)-epigallocatechin-3-gallate incorporation on the physicochemical and oxidative stability of myofibrillar protein-soybean oil emulsions[J]. Food Chemistry, 2018, 245:439-445. DOI:10.1016/j.foodchem.2017.10.111.
[20] ASANO K, SHINAGAWA K, HASHIMOTO N. Characterization of haze-forming proteins of beer and their roles in chill haze formation[J].Journal of the American Society of Brewing Chemists, 1982, 40(4):147-154. DOI:10.1094/ASBCJ-40-0147.
[21] RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chemistry, 2002, 78(40): 443-455.DOI:10.1016/S0308-8146(02)00155-3.
[22] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International,2013, 51(2): 954-970. DOI:10.1016/j.foodres.2013.02.009.
[23] JONGBERG S, TERKELSEN L D S, MIKLOS R, et al. Green tea extract impairs meat emulsion properties by disturbing protein disulfide cross-linking[J]. Meat Science, 2015, 100: 2-9. DOI:10.1016/j.meatsci.2014.09.003.
[24] TANG C B, ZHANG W G, ZHOU Y F, et al. Influence of RosA-protein adducts formation on myofibrillar protein gelation properties under oxidative stress[J]. Food Hydrocolloids, 2017, 67: 197-205.DOI:10.1016/j.foodhyd.2017.01.006.
[25] JONGBERG S, LUND M N, WATERHOUSE A L, et al.4-Methylcatechol inhibits protein oxidation in meat but not disulfide formation[J]. Journal of Agricultural and Food Chemistry, 2011,59(18): 10329-10335. DOI:10.1021/jf202268q.
[26] TANG Changbo, ZHANG Wangang, DAI Chen, et al. Identification and quantification of adducts between oxidized rosnnarinic acid and thiol compounds by UHPLC-LTQ-Orbitrap and MALDI-TOF/TOF tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2015, 63(3): 902-911. DOI:10.1021/jf5044713.
[27] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/j.ijbiomac.2012.07.010.
[28] FUJIMOTO A, MASUDA T. Chemical interaction between polyphenols and a cysteinyl thiol under radical oxidation conditions[J].Journal of Agricultural and Food Chemistry, 2012, 60(20): 5142-5151.DOI:10.1021/jf3008822.
[29] TANG Changbo, ZHANG Wangang, WANG Yaosong, et al.Identification of rosmarinic acid-adducted sites in meat proteins in a gel model under oxidative stress by triple TOF MS/MS[J]. Journal of Agricultural and Food Chemistry, 2016, 64(33): 6466-6476.DOI:10.1021/acs.jafc.6b02438.
[30] 雷娜. EGCG修饰巯基对肌原纤维蛋白乳化凝胶特性的影响及机制研究[D]. 杨凌: 西北农林科技大学, 2017: 1-50.
[31] SUN Jiaojiao, SUN Lijun, MENG Yonghong, et al. Antioxidant activities of young apple polyphenols and its preservative effects on lipids and proteins in grass carp (Ctenopharyngodon idellus) fillets[J]. Cyta-Journal of Food, 2017, 15(2): 291-300. DO I:10.1080/19476337.2016.1250110.
[32] 张慧芸, 吴静娟, 段续. 添加多酚对鲤鱼肌原纤维蛋白结构及膜性能的影响[J]. 食品科学, 2016, 37(5): 35-40. DOI:10.7506/spkx1002-6630-201605007.
[33] 梅甜恬, 唐洁, 夏杨毅, 等. 卤料提取物对氧化诱导鸭肉肌原纤维蛋白功能特性和结构的影响[J]. 食品与发酵工业, 2019, 45(7): 116-122.DOI:10.13995/j.cnki.11-1802/ts.018139.
[34] CZUBINSKI J, DWIECKI K. A review of methods used for investigation of protein-phenolic compound interactions[J].International Journal of Food Science and Technology, 2017, 52(3):573-585. DOI:10.1111/ijfs.13339.
[35] VILJANEN K. Protein oxidation and protein-lipid interactions in different food models in the presence of berry phenolics[D]. Helsinki:University of Helsinki, 2005: 1-10.
[36] NUNEZ-FLORES R, CANDO D, BORDERIAS A J, et al. Importance of salt and temperature in myosin polymerization during surimi gelation[J]. Food Chemistry, 2018, 239: 1226-1234. DOI:10.1016/j.foodchem.2017.07.028.
[37] ZENG Zicong, HU Xiuting, MCCLEMENTS D J, et al. Hydrothermal stability of phenolic extracts of brown rice[J]. Food Chemistry, 2019,271: 114-121. DOI:10.1016/j.foodchem.2018.07.180.
[38] SUN Hongnan, MU Taihua, XI Lisha. Effect of pH, heat, and light treatments on the antioxidant activity of sweet potato leaf polyphenols[J]. International Journal of Food Properties, 2017, 20(2):318-332. DOI:10.1080/10942912.2016.1160410.
[39] ANNA P, KRYSTYNA P. Effect of pH and metal ions on DPPH radical scavenging activity of tea[J]. International Journal of Food Sciences and Nutrition, 2015, 66(1): 58-62. DOI:10.3109/0 9637486.2014.959899.
[40] 张兴, 杨玉玲, 马云, 等. pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J]. 中国农业科学, 2017, 50(3): 564-573.DOI:10.3864/j.issn.0578-1752.2017.03.015.
[41] JIA Dan, YOU Juan, HU Yang, et al. Effect of CaCl2 on denaturation and aggregation of silver carp myosin during setting[J]. Food Chemistry, 2015, 185: 212-218. DOI:10.1016/j.foodchem.2015.03.130.
[42] 贾娜, 谢振峰, 李儒仁, 等. 迷迭香提取物与NaCl协同改善肌原纤维蛋白凝胶特性[J]. 食品科学, 2018, 39(3): 28-33. DOI:10.7506/spkx1002-6630-201803005.
[43] 刘丹, 贾娜, 杨磊, 等. 3 种不同香辛料提取物对猪肉肌原纤维蛋白功能特性的影响[J]. 食品科学, 2017, 38(15): 14-19. DOI:10.7506/spkx1002-6630-201715003.
[44] 吴利芬, 张立彦, 汪媛, 等. 加热温度和含水量对猪肉及其蛋白质特性的影响[J]. 肉类研究, 2018, 32(10): 12-18. DOI:10.7506/rlyj1001-8123-201810003.
[45] WU C L, LI L Y, ZHONG Q X, et al. Myofibrillar protein-curcumin nanocomplexes prepared at different ionic strengths to improve oxidative stability of marinated chicken meat products[J]. LWTFood Science and Technology, 2019, 99: 69-76. DOI:10.1016/j.lwt.2018.09.024.
[46] ZHOU Feibai, SUN Weizheng, ZHAO Mouming. Controlled formation of emulsion gels stabilized by salted myofibrillar protein under malondialdehyde (MDA)-induced oxidative stress[J]. Journal of Agricultural and Food Chemistry, 2015, 63(14): 3766-3777.DOI:10.1021/jf505916f.
[47] WANG Xu, XIONG Youling L., SATO H, et al. Controlled cross-linking with glucose oxidase for the enhancement of gelling potential of pork myofibrillar protein[J]. Joumal of Agriculture and Food Chemistry,2016, 64(50): 9523-9531. DOI:10.1021/acs.jafc.6b03934.
[48] 窦川林, 林静, 董唯, 等. 茶多酚处理对泥鳅微冻贮藏过程中肌原纤维蛋白功能性质的影响[J]. 食品科学, 2018, 39(23): 250-256.DOI:10.7506/spkx1002-6630-201823037.
[49] CAO Yungang, XIONG Youling L.. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243. DOI:10.1016/j.foodchem.2015.02.036.
[50] 贾娜, 刘丹, 张晓星, 等. 氧化条件下没食子酸对猪肉肌原纤维蛋白结构及凝胶特性的影响[J]. 食品工业科技, 2016, 37(23): 61-66.DOI:10.13386/j.issn1002-0306.2016.23.003.
[51] LEFEVRE F, FAUCONNEAU B, OUALI A, et al. Thermal gelation of brown trout myofibrils from white and red muscles: effect of pH and ionic strength[J]. Journal of the Science of Food and Agriculture,2002, 82(4): 452-463. DOI:10.1002/jsfa.1057.
[52] ANVARI M, CHUNG D. Dynamic rheological and structural characterization of fish gelatin-gum arabic coacervate gels crosslinked by tannic acid[J]. Food Hydrocolloids, 2016, 60: 516-524.DOI:10.1016/j.foodhyd.2016.04.028.
[53] TEMDEE W, BENJAKUL S. Effect of oxidized kiam wood and cashew bark extracts on gel properties of gelatin from cuttlefish skins[J]. Food Bioscience, 2014, 7: 95-104. DOI:10.1016/j.fbio.2014.07.001.
[54] BUAMARD N, BENJAKUL S. Cross-linking activity of ethanolic coconut husk extract toward sardine (Sardinella albella) muscle proteins[J]. Journal of Food Biochemistry, 2017, 41(2): 1-9.DOI:10.1111/jfbc.12283.
[55] 张慧芸, 吴静娟, 郭新宇. 多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响[J]. 食品科学, 2016, 37(21): 43-47. DOI:10.7506/spkx1002-6630-201621008.
[56] BALANGE A K, BENJAKUL S. Effect of oxidised phenolic compounds on the gel property of mackerel (Rastrelliger kanagurta)surimi[J]. LWT-Food Science and Technology, 2009, 42(6): 1059-1064. DOI:10.1016/j.lwt.2009.01.013.
[57] BUAMARD N, BENJAKUL S. Improvement of gel properties of sardine (Sardinella albella) surimi using coconut husk extracts[J]. Food Hydrocolloids, 2015, 51: 146-155. DOI:10.1016/j.foodhyd.2015.05.011.
[58] MAQSOOD S, BENJAKUL S, SHAHIDI F. Emerging role of phenolic compounds as natural food additives in fish and fish products[J]. Critical Reviews in Food Science and Nutrition, 2013,53(2): 162-179. DOI:10.1080/10408398.2010.518775.
[59] STRAUSS G, GIBSON S M. Plant phenolics as crosslinkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids, 2004, 18(1): 81-89. DOI:10.1016/S0268-005X(03)00045-6.
[60] LI Yuanyuan, LIU Haotian, LIU Qian, et al. Effects of zein hydrolysates coupled with sage (Salvia officinalis) extract on the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions[J]. Food Hydrocolloids, 2019, 87: 149-157.DOI:10.1016/j.foodhyd.2018.07.052.
[61] GALANAKIS C M. Polyphenols: properties, recover, and applications[M]. Duxford: Woodhead Publishing, 2018: 1-12.DOI:10.1016/C2016-0-05057-X.
[62] 王双喜. β-环糊精抑制EGCG-蛋白互作对肌原纤维蛋白凝胶特性的影响[D]. 杨凌: 西北农林科技大学, 2018: 1-40.