疲劳是一种普遍存在的生理现象,是一个复杂的生理生化过程。一般情况下,疲劳是指生理过程不能持续其功能在特定水平和(或)不能维持预定的运动强度,即运动性疲劳[1]。持续性或重度疲劳不仅会影响人们的正常生活,还会导致内分泌紊乱、免疫力下降,甚至出现器质性疾病,威胁身体健康。运动疲劳的产生往往伴随着能量物质、代谢产物、激素水平、细胞代谢调节酶和抗氧化系统酶类等的变化,实质上就是内环境平衡失去稳态引起了机体不适感[2]。目前,运动疲劳产生的机制主要包括能量耗竭、代谢产物蓄积和氧自由基-脂质过氧化物学说[3-5]。这三大机制之间存在着共同的信号调控途径,如能量代谢改变可以激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),氧化应激同样也能激活AMPK,参与机体抗氧化还原反应的调节[6]。因此,以抗氧化与能量代谢的共同调控靶点作为筛选安全有效的抗疲劳活性成分并设计与开发抗疲劳产品是非常可行的策略。
近年来,国内外学者开展了大量的食源性抗疲劳活性成分的相关研究,这些工作的开展为抗疲劳功能产品的研发与抗疲劳机制的阐释奠定了基础。本文重点从运动疲劳产生机制、具有潜在抗疲劳作用的食源性活性成分及其应用等方面进行综述,并提出亟待加强的研究方向,这对今后筛选安全高效的抗疲劳活性成分具有重要意义,同时为新型抗疲劳保健产品的研究与开发提供参考。
1 运动疲劳产生机制
运动疲劳是发生于多器官、多细胞和多分子水平上的一连串事件,其产生的内在机制非常复杂。根据各种生理诱发因素的作用途径、位点和方式可以将运动疲劳分为外周疲劳和中枢疲劳[7]。外周疲劳通常被定义为肌肉功能的受损,而中枢疲劳是指大脑无法维持产生所需动力或输出所需能量的驱动力,指的是运动神经元和中枢神经系统内部的过程[8]。能量耗竭、代谢产物蓄积和氧化应激是目前疲劳产生机制的主流学说,它们对肌肉和中枢神经系统的影响可能直接导致了疲劳的产生。
1.1 能量耗竭对肌肉和中枢神经系统的影响
机体中为生命活动供应能量的主要能源物质有三磷酸腺苷(adenosine triphosphate,ATP)、磷酸肌酸、糖原、血糖以及脂肪,能量供应不足是导致运动能力下降和疲劳产生的因素之一,而运动强度和运动时间可以影响能源物质的消耗速率。短时间、大强度的运动,体内ATP和磷酸肌酸等高能磷酸化合物水平的下降是引起疲劳的主要因素[9]。长时间、大强度的运动,肌糖原是决定疲劳产生的主要能源物质,肌糖原含量的降低引起肌质网Ca2+释放的减少,肌肉收缩功能下降[10]。中等强度、长时间的运动,血糖浓度显著下降使大脑能量供应不足引起中枢疲劳。中低等强度、长时间的运动,脂肪动员加强产生大量的游离脂肪酸,而血浆游离脂肪酸的累积则促进游离色氨酸的增加,过多的色氨酸进入脑内引起5-羟色胺水平上升,从而抑制大脑工作能力,加强中枢疲劳[11]。运动强度通常以个人最大耗氧量(VO2max)的百分比来表示,低、中、高等运动强度分别对应于小于45%、45%~75%和大于75%的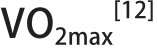 。总而言之,不同运动强度和运动时间对能量代谢底物的利用具有选择性,根据运动项目的特点选择合适的能源物质的补充有利于延缓疲劳的产生。
。总而言之,不同运动强度和运动时间对能量代谢底物的利用具有选择性,根据运动项目的特点选择合适的能源物质的补充有利于延缓疲劳的产生。
1.2 代谢产物蓄积对肌肉和中枢神经系统的影响
运动加快了能源物质的消耗,同时也伴随着更多代谢产物的生成,进而破坏体内环境的稳态[13]。乳酸、无机磷酸、H+、酮体、NH3等是引起运动疲劳产生的主要代谢产物。酸性代谢产物如乳酸、无机磷酸、酮体等会使H+浓度上升,H+的累积导致肌肉pH值下降,抑制磷酸化酶和磷酸果糖激酶活性,从而限制糖原分解及糖酵解反应,导致能量供应的不足[14]。但是有研究报道酮体可以作为运动营养补充剂,前提是机体需具备生酮适应性,酮体可持续快速地供应能量,增强运动耐力,促进疲劳恢复,防止力竭运动引起的肌肉和器官损伤[15]。Tsuda等[16]研究发现健康志愿者在补充精氨酸、缬氨酸和丝氨酸的混合补剂后,运动前血液中酮体的含量明显增加,同时也促进了运动时机体对酮体的利用,延缓了运动过程中疲劳的产生。由此可见,代谢产物的堆积对机体的利与害主要取决于它在体内蓄积的程度,增强机体利用代谢产物的能力可以减少损伤及改善运动能力。
研究表明,运动能促进神经元5-羟色胺的合成和释放,中枢神经系统抑制过程占优势,即表现为中枢疲劳[17-18]。此外,当运动导致能量耗尽后,肌肉蛋白分解代谢产生NH3,NH3具有神经毒性作用,从而也能引起疲劳[17]。有研究发现运动强度在50% VO2max时,几乎观察不到NH3的累积;运动强度在70%~110% VO2max时,NH3的生成显著增加[19]。所以,运动强度对疲劳生化指标的变化具有重要的影响。因此,在不同的运动疲劳模型中,可以根据运动强度选择合适的评价指标,确保实验数据的有效性。
1.3 氧化应激对肌肉和中枢神经系统的影响
氧化应激是指体内氧化剂与抗氧化剂之间平衡稳态被打破,且氧化剂占据优势,从而导致氧化还原信号通路被阻断,体内大分子物质如DNA、脂质和蛋白质等受到损伤[20]。运动过程中自由基的生成与肌肉收缩强度有关。短暂或低强度的肌肉收缩诱导生成的活性氧(reactive oxygen species,ROS)/NO水平具有增强骨骼肌收缩相关蛋白如Ca2+释放通道蛋白(ryanodine receptor 1,RyR1)和肌钙蛋白I(troponin I)的S-亚硝基化和S-谷胱甘肽酰化作用,从而提高肌原纤维的钙敏感性及增强骨骼肌收缩力量;而运动产生过量ROS/NO时可引起RyR1超S-亚硝基化致使其与亚基calstabin1分裂,肌原纤维的钙敏感性受到抑制,导致骨骼肌收缩功能及力量输出受损[21]。此外,自由基与物质输送有关。在安静状态下,机体内的氧化应激处于较低水平,适量的自由基具有促进血管舒张的作用,增强O2和营养物质的流通;然而过高的自由基水平却会抑制血管扩张并且减少血液流量,引起身体各组织器官如骨骼肌、心脏、皮肤和大脑所需的O2和营养物质的供应不足,加速疲劳的产生[22]。
当前很多抗氧化剂应用于缓解运动疲劳中表现出良好的效果,如N-乙酰半胱氨酸、VC、VE等[23],但也有研究表明这类抗氧化剂的使用不但没有增强运动能力,反而有损肌肉功能[21]。这很有可能是因为在不同的运动模型中没有准确评价机体的氧化应激水平,抗氧化剂的过量使用造成的。因此,当调控氧化应激水平至机体可适应的生理水平时,抗氧化剂的抗疲劳效果才有可能最大程度显现出来,且不易产生毒副作用。
1.4 抗运动疲劳的潜在分子机制
延缓运动疲劳的发生可以体现为运动耐力的增强,同时表现出对能量代谢应激和氧化应激具有更好的适应性。调控能量代谢和氧化应激的两个重要分子靶点分别是AMPK和核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)。
AMPK是参与各种能量底物代谢通路的关键因子,主要包括葡萄糖的利用、促进脂肪酸氧化、线粒体的生物合成以及肌纤维类型的转变,同时也参与了细胞氧化应激通路的调控,在运动性疲劳的调节中发挥了关键作用。AMPK通过磷酸化GTP酶激活蛋白TBC1D1(Tre-2/BUB2/cdc1 domain family 1)促进葡萄糖转运蛋白(glucose transporter type 4,GLUT4)囊泡与细胞膜融合,实现细胞外葡萄糖分子向细胞内转运并进一步在细胞内氧化代谢产能或进行糖原合成[24]。Lee-Young等[25]研究发现过表达显性失活突变型AMPK小鼠与野生型小鼠相比,其氧利用能力和运动能力均明显减弱。AMPKα2敲除小鼠与野生型小鼠相比,其能承受的最大跑步速度减少了27%,且脂肪酸氧化能力降低。AMPKα2活化后增强了丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase 4,PDK4)蛋白的表达,抑制了丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)的活性,因此葡萄糖氧化速率受到限制,而线粒体对脂肪酸的摄取增加,脂肪酸进行氧化代谢产能,则有利于糖原的合成,加快疲劳的消除[26]。
研究表明增强骨骼肌过氧化物增殖子激活-受体因子γ辅激活因子(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)的表达水平可以增加肌肉的重量并促进乳酸代谢,从而提高运动能力,其涉及到的分子机制有CaMKK-AMPK-PGC-1α和NO-CREB-PGC-1α信号途径[27-28]。在相同运动强度下,间歇性运动引起的反复代谢波动相比于持续性运动更有利于增强AMPK、CaMKII和p38丝裂原活化的蛋白激酶(p38 mitogen-activated protein kinases,p38-MAPK)的磷酸化,从而增强骨骼肌PGC-1α的表达,促进线粒体的生物合成,调节细胞对氧化应激的适应性反应[29]。此外,肌肉中肌纤维的比例对运动耐力具有很大的影响。I型和IIa型肌纤维主要进行的是有氧代谢反应,IId/x型和IIb型肌纤维主要利用糖酵解供能,增加I型和IIa型肌纤维的比例有利于提高运动耐力,AMPK在激活状态下调控PGC-1α的活性,可促使肌纤维向I型和IIa型转化[30]。
Zimmermann等[31]利用一种AMPK和Nrf2的激活因子——黄腐酚证实了AMPK激活对小鼠胚胎成纤维细胞中Nrf2/血红素加氧酶(heme oxygenase 1,HO-1)信号通路具有增强作用,表明细胞氧化还原信号通路与能量代谢信号通路之间存在紧密的合作关系。而且,AMPK可直接磷酸化Nrf2,并通过抑制糖原合成酶激酶-3β的活性间接促进Nrf2的核内蓄积,Nrf2与抗氧化反应元件(antioxidant response element,ARE)结合后驱动抗氧化酶基因的表达,进而调控细胞氧化应激平衡[32]。总而言之,可将AMPK作为靶点中心,从调控代谢底物的利用、细胞氧化应激的适应性、线粒体的生物合成以及肌纤维类型的变化相关的信号通路来阐释抗运动疲劳潜在的分子机制(图1)。
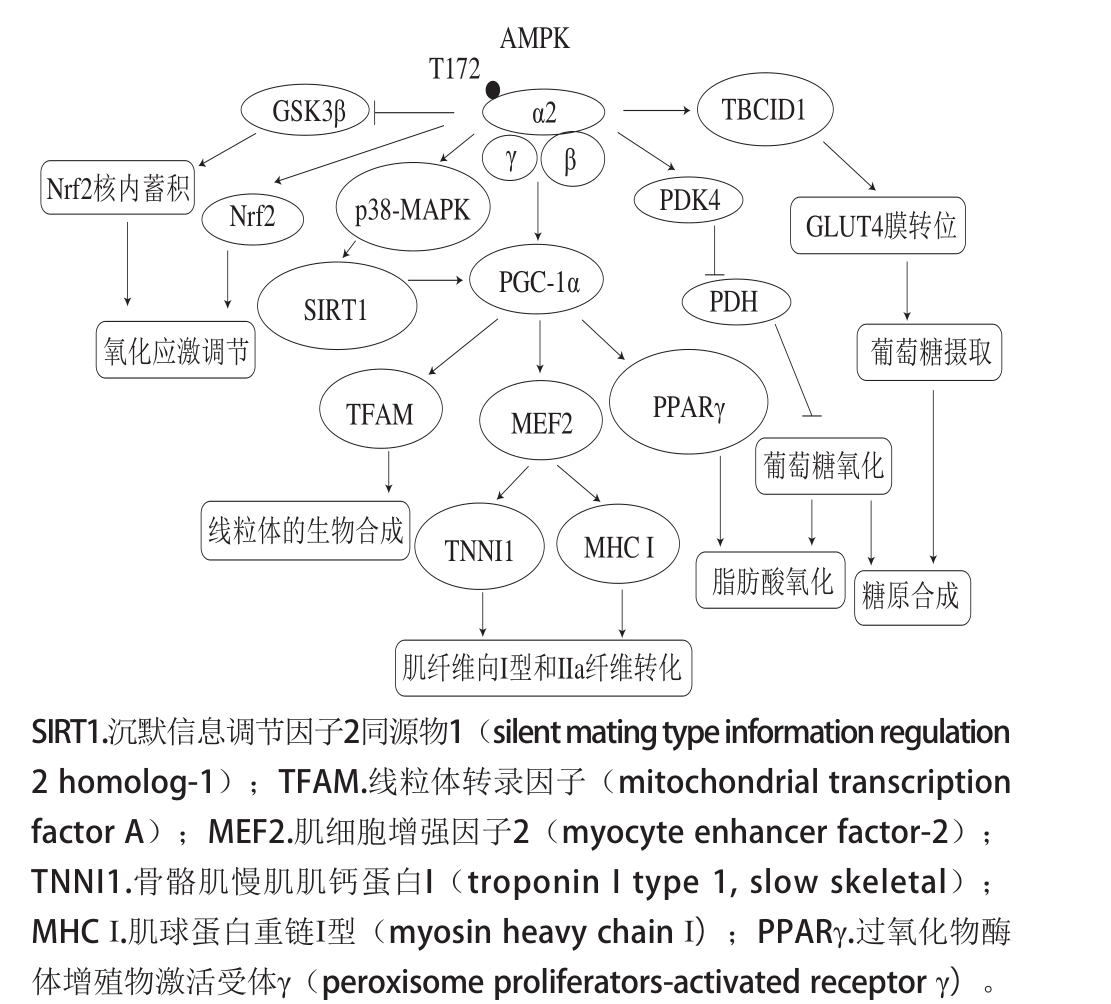
图1 基于AMPK信号通路的抗运动疲劳潜在分子机制
Fig. 1 Potential molecular mechanism of exercise-induced fatigue resistance based on AMP-activated protein kinase signaling pathway
Nrf2是机体应对氧化损伤的一种重要转录因子,大部分组织中均有表达。正常情况下,Nrf2与Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)和泛素连接酶Cullin 3在细胞质中结合并不断被降解;氧化应激发生时,Nrf2脱离Keap1,向细胞核内迁移,然后与核内相关抗氧化基因的启动子如ARE结合后促进其转录及翻译过程,从而产生抗氧化酶或蛋白,清除过量自由基,维持机体氧化还原稳态[33-34]。Nrf2调控抗氧化酶基因包括HO-1、醌氧化还原酶1(quinine oxidoreductase l,NQO1)、谷氨酸-半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)、硫氧还蛋白还原酶1(thioredoxin reductase 1,TXNRD1)等的表达,同时也可通过调控苹果酸酶1(malic enzyme 1,ME-1),异柠檬酸盐脱氢酶1(isocitrate dehydrogenase,IDH-1)、葡萄糖-6-磷酸脱氢酶(glucose 6-phosphatedehydrogenase,G6PD)、6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,6-PGD)参与还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)的生成,NADPH是氧化型谷胱甘肽(glutathione,GSH)和硫氧还蛋白(thioredoxin,Thx)重要的还原剂[34-35]。急性运动中Nrf2被激活,以此对抗运动过程中产生的过量的ROS;当Nrf2被阻断时,心肌对氧化应激的敏感性增强,加快内源性抗氧化剂GSH的耗尽,造成细胞、组织和器官产生更严重的氧化损伤[36]。Oh等[37]研究表明通过激活Nrf2介导的骨骼肌氧化还原信号通路可以缓解小鼠力竭性运动引起的肌肉疲劳,而Nrf2敲除的小鼠在力竭性运动导致的氧化应激和肌肉损伤程度更加严重,小鼠运动能力显著降低。
Nrf2影响线粒体脂肪酸氧化速率。在含有相同浓度棕榈酸的无葡萄糖培养基离体培养WT、Keap1-KO和Nrf2-KO小鼠胚胎成纤维细胞MEFs,各组MEFs细胞的耗氧率、ATP生成量、线粒体呼吸速率均有显著差异,其中Keap1-KO MEFs细胞中Nrf2表达量最高,线粒体脂肪酸氧化速率最快[38],然而Nrf2是如何调节线粒体氧化脂肪酸的机理尚不清楚,可能与其调控参与脂肪酸氧化相关基因(图2)的表达有关[39]。通过激活Nrf2信号通路,一方面有助于缓解运动过程中产生的过度氧化应激造成的细胞、组织及器官的损伤;另一方面可以增强线粒体脂肪酸氧化功能,有助于减少葡萄糖氧化,从而促进糖原合成。因此,Nrf2可以作为抗运动疲劳的分子靶点,其可能的调控机制如图2所示。
不管是在短期还是长期的体力活动中,运动表现都会受到线粒体氧化磷酸化速率达到稳定状态的滞后程度的影响,运动开始的前几分钟以及运动负荷的逐步增加过程中,氧化磷酸化速率需要一定的时间达到稳定状态[40]。这一过程受到肌肉能量水平、可利用O2的多少以及代谢相关酶的激活的影响。其中,运动引起乙酰基的不足是造成氧化代谢缓慢,运动耐力受限的因素之一。肉毒碱乙酰转移酶(carnitine acyl-transferase,CrAT)是一种线粒体酶,调控乙酰辅酶A和乙酰肉碱的相互转化以及肌肉能量的经济化利用,CrAT介导的缓冲线粒体内乙酰基作用是优化运动性能的关键因子[41]。小鼠骨骼肌CrAT基因特异性敲除后,不管在中低强度和高强度运动中小鼠运动能力相比于野生型小鼠显著减弱、糖原消耗明显增加、氧利用效率显著降低[41]。L-肉碱具有增强CrAT mRNA表达的作用,运动前正常小鼠补充L-肉碱有效延长了跑台力竭时间,而CrAT基因敲除的小鼠补充L-肉碱后,运动耐力不受影响[41-42]。所以,提高线粒体CrAT的含量与活性可作为改善运动耐力的一个策略。
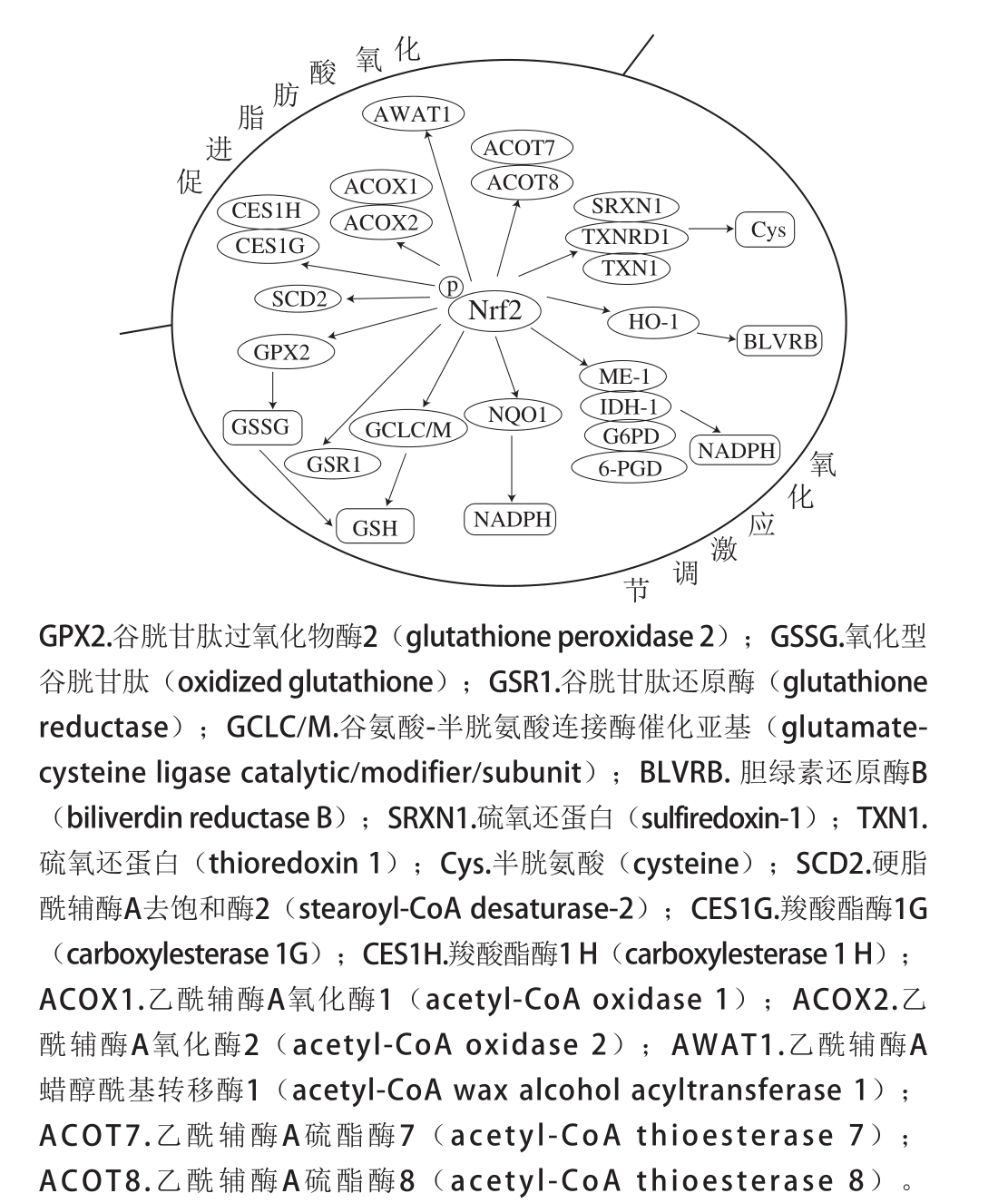
图2 基于Nrf2信号通路的抗运动疲劳潜在分子机制
Fig. 2 Potential molecular mechanism of exercise-induced fatigue resistance based on nuclear factor E2-related factor 2 signaling pathway
过氧化物酶体增殖物激活受体δ(peroxisome proliferators-activated receptor δ,PPARδ)也可以作为抗运动疲劳的一个分子靶点。PPARδ及其共激活子PGC-1α是调节线粒体的生物合成和肌纤维氧化能力,脂肪酸氧化的关键因子,也是机体运动耐力的调节因素[43-44]。研究表明,靶向PPARδ在骨骼肌中的过表达小鼠的跑步耐力是野生型小鼠的两倍,腓肠肌中红肌比例明显增加,即主要以有氧代谢产能方式的I型肌纤维含量显著高于野生型小鼠[45]。Narkar等[46]发现PPARδ激动剂GW1516联合运动训练能协同增加成年小鼠氧化型肌纤维比例以及在跑台运动测试中的运动耐力,两者联合作用对小鼠的运动耐力相比只进行运动训练的小鼠提高了70%,然而单独补充PPARδ激动剂或运动训练相同时间并不能改善小鼠的运动耐力。运动训练与PPARδ激活对部分基因的调控作用相似,说明运动训练联合GW1516增强PPARδ转录活性至一定程度时才能使运动耐力增强至可观测的范围,如骨骼肌VP16-PPARδ基因型小鼠拥有持续较高PPARδ活性,运动耐力是野生型的2 倍[45-46]。因此,药物激活PPARδ只有在结合运动训练诱导的相关信号分子的活化才能有效增强运动耐力,如AMPK。
基于抗运动疲劳的潜在分子靶点,更有利于筛选抗疲劳效果明显、特异性强的活性成分。目前已有很多相关的研究报道了丰富多样的抗运动疲劳活性物质,然而大部分都没有明确阐释抗疲劳的分子机制,只是初步评价了抗疲劳效果及生化指标如血乳酸、尿素氮、肌酸激酶、脂质过氧化物、抗氧化酶等的变化。将现有的抗运动疲劳活性成分经过抗运动疲劳分子靶点的再次筛选有利于寻找更加安全高效、机制明确的抗疲劳活性成分以及开发具备多种功效、更加有利于健康的抗疲劳产品。
2 具有抗运动疲劳作用的食源性有效成分
食物是机体所需要的各种生物活性成分的丰富来源,对于维持机体正常的生命活动具有重要的意义。食物中含有多种多样的生理活性成分,如茶叶中的茶多酚具有抗脂质过氧化,预防衰老的作用;西兰花、青花椰菜等蔬菜中的萝卜硫素具有降糖、抗癌功能;葡萄、桑葚等浆果中的白藜芦醇具有抗衰老、抗肿瘤、预防心血管疾病等生理活性。而具有抗运动疲劳活性成分的食物也非常多,从食物当中寻找抗运动疲劳活性物质也是当前抗疲劳产品研究的热点之一。众多研究表明(表1),食源性抗运动疲劳活性成分主要包括活性肽类、氨基酸类、糖类、维生素、多酚、生物碱、类胡萝卜素以及皂苷类等天然活性产物,评价模型以动物的负重游泳及跑台模型为主,而且它们的抗疲劳作用普遍与调节能量代谢和氧化应激的作用明显相关。
2.1 生物活性肽及氨基酸类
食源性的生物活性肽主要是蛋白质经酶、酸或碱的水解产物,以及直接从高含量活性肽的天然动植物组织中直接提取得到。现代营养学研究发现,活性肽具有比蛋白质和氨基酸更易消化、吸收和利用的优点,它以完整的形式直接进入小肠后被吸收进入循环系统,为全身提供营养和能量[92]。动物是抗疲劳生物活性肽的重要来源,包括海洋动物、哺乳动物、昆虫等;植物性生物抗疲劳活性肽的主要来源是大豆、玉米和花生等。草鱼蛋白活性多肽可增强小鼠游泳运动耐力,与其自由基清除作用有一定的相关性,而碱性多肽、疏水性多肽抗氧化活性较高[47,93]。大豆多肽和玉米多肽在清除自由基方面也表现出了一定的作用,并且还可以促进组织损伤恢复、减少乳酸堆积及增加糖原储备[53,56,58]。从枯草芽孢杆菌发酵的脱脂豆粕当中分离提取纯化而来的一种大豆多肽,连续给小鼠灌胃20 d后进行游泳耐力实验,大豆多肽可显著延长小鼠游泳耐力时间且呈剂量依赖性,最大延长时间比例达到了70%,血乳酸水平和糖原水平均有显著性改善[58]。
牛磺酸是一种非蛋白质氨基酸,它主要分布于视网膜、中性粒细胞、神经元以及心脏和骨骼肌中,对于细胞内氧化还原稳态和肌肉功能具有重要的调节作用[62]。支链氨基酸包括亮氨酸、异亮氨酸和缬氨酸,尤其是亮氨酸,通过增加蛋白质合成的速度和降低蛋白质在静息状态下的降解速度,有助于加速运动后肌肉的恢复[94]。Tsuda等[64]比较了大鼠运动前30 min急性补充三种支链氨基酸对其游泳1 h后的代谢相关指标的影响,发现只有补充缬氨酸可以有效地维持肝糖原和血糖,增加大鼠运动后的自发活动,表明缬氨酸有助于减轻运动过程中的疲劳程度。肽类、氨基酸类化合物在抗疲劳作用方面不仅表现在抗氧化活性上,同时为机体的重要组成成分蛋白质提供了合成原料,氨基酸在糖类代谢途径中也是重要成员之一,因此氨基酸或肽类的补充可能对疲劳时机体糖代谢起到了调节作用。
2.2 多糖和寡糖
多糖是一类天然活性生物大分子,其最重要的生理功效就是免疫调节作用,目前也有不少研究发现多糖在抗疲劳方面也卓有成效。黑果枸杞(Lycium barbarum)多糖能显著延长负重力竭游泳小鼠的游泳时间,这与其提高小鼠抗氧化能力、促进糖原储备及减少代谢物蓄积的作用关系密切[69]。黑木耳(Auricularia auricula)多糖增强了小鼠在力竭游泳运动中的抗氧化能力,表现在过氧化物质丙二醛(malondialdehyde,MDA)和8-羟基脱氧鸟苷水平降低,抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和过氧化氢酶活性增强,同时小鼠游泳耐力增强了36%以上[70]。李晶等[71]对姬松茸(Agaricus blazei)多糖的免疫功能和抗疲劳作用研究发现,姬松茸多糖不仅能提高小鼠血清中IL-6和TNF-α的含量及提高CD4+、CD8+细胞数量,并能延长小鼠常压耐缺氧时间和负重游泳时间,提高小鼠血清中SOD活性,降低MDA含量,有效改善了小鼠的免疫调节能力并缓解疲劳。在多糖的抗疲劳作用研究中,实验对象多为大鼠或小鼠,给药时间6~28 d不等,运动疲劳评价模型多采用游泳力竭模型,大部分具有延长运动耐力时间作用的多糖都具有共同的特点,即增强了运动机体的抗氧化水平,说明多糖的抗氧化作用对于延缓疲劳的产生意义重大[69-71,95-96]。
表1 食源性抗运动疲劳活性成分
Table 1 Mechanisms of action and functional evaluation of anti-exercise-induced fatigue components from food sources
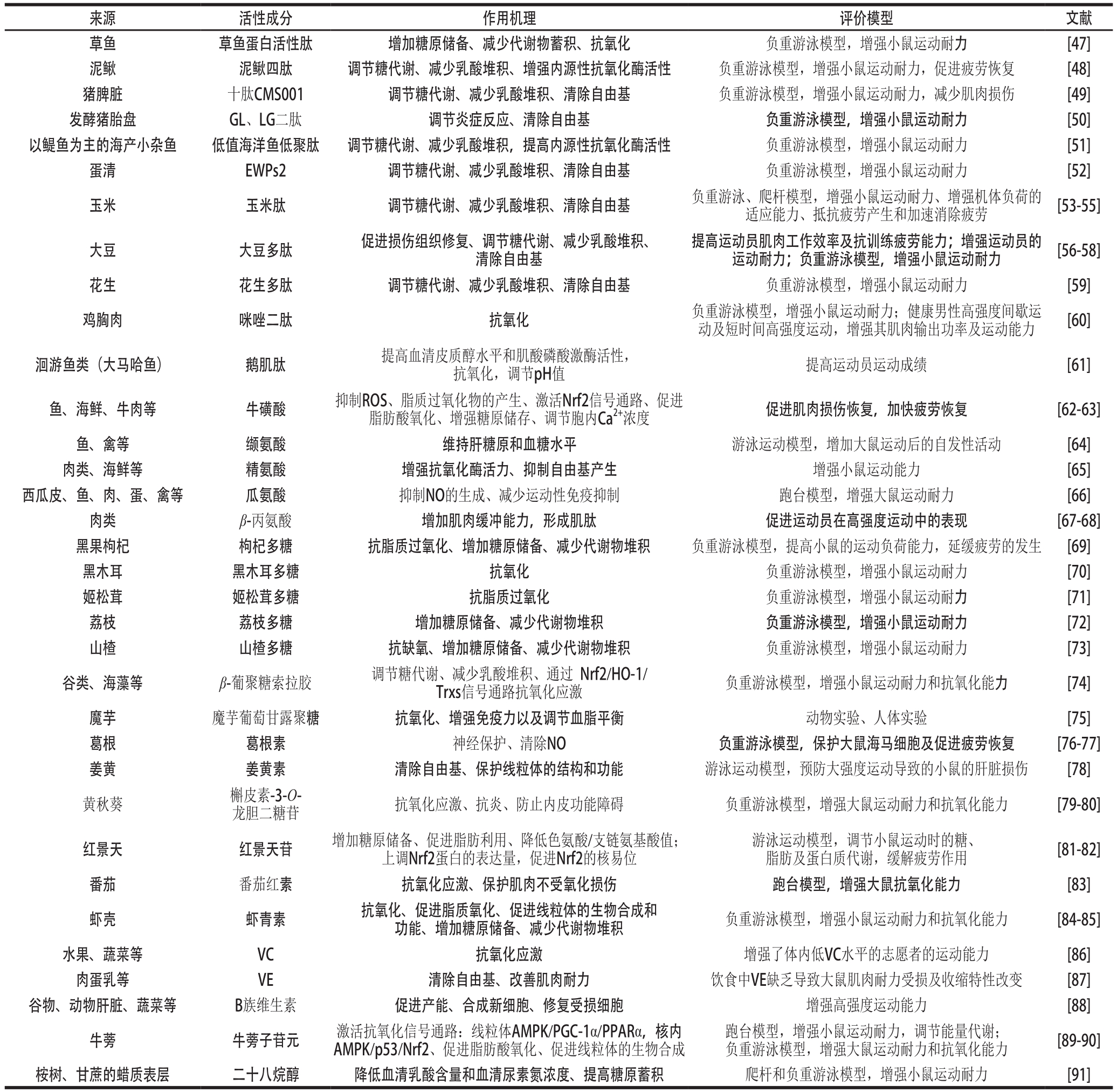
评价模型 文献草鱼 草鱼蛋白活性肽 增加糖原储备、减少代谢物蓄积、抗氧化 负重游泳模型,增强小鼠运动耐力 [47]泥鳅 泥鳅四肽 调节糖代谢、减少乳酸堆积、增强内源性抗氧化酶活性 负重游泳模型,增强小鼠运动耐力,促进疲劳恢复 [48]猪脾脏 十肽CMS001 调节糖代谢、减少乳酸堆积、清除自由基 负重游泳模型,增强小鼠运动耐力,减少肌肉损伤 [49]发酵猪胎盘 GL、LG二肽 调节炎症反应、清除自由基 负重游泳模型,增强小鼠运动耐力 [50]以鳀鱼为主的海产小杂鱼 低值海洋鱼低聚肽 调节糖代谢、减少乳酸堆积,提高内源性抗氧化酶活性 负重游泳模型,增强小鼠运动耐力 [51]蛋清 EWPs2 调节糖代谢、减少乳酸堆积、清除自由基 负重游泳模型,增强小鼠运动耐力 [52]玉米 玉米肽 调节糖代谢、减少乳酸堆积、清除自由基 负重游泳、爬杆模型,增强小鼠运动耐力、增强机体负荷的适应能力、抵抗疲劳产生和加速消除疲劳 [53-55]来源 活性成分 作用机理大豆 大豆多肽 促进损伤组织修复、调节糖代谢、减少乳酸堆积、清除自由基提高运动员肌肉工作效率及抗训练疲劳能力;增强运动员的运动耐力;负重游泳模型,增强小鼠运动耐力 [56-58]花生 花生多肽 调节糖代谢、减少乳酸堆积、清除自由基 负重游泳模型,增强小鼠运动耐力 [59]鸡胸肉 咪唑二肽 抗氧化 负重游泳模型,增强小鼠运动耐力;健康男性高强度间歇运动及短时间高强度运动,增强其肌肉输出功率及运动能力 [60]洄游鱼类(大马哈鱼) 鹅肌肽 提高血清皮质醇水平和肌酸磷酸激酶活性,抗氧化,调节pH值 提高运动员运动成绩 [61]鱼、海鲜、牛肉等 牛磺酸 抑制ROS、脂质过氧化物的产生、激活Nrf2信号通路、促进脂肪酸氧化、增强糖原储存、调节胞内Ca2+浓度 促进肌肉损伤恢复,加快疲劳恢复 [62-63]鱼、禽等 缬氨酸 维持肝糖原和血糖水平 游泳运动模型,增加大鼠运动后的自发性活动 [64]肉类、海鲜等 精氨酸 增强抗氧化酶活力、抑制自由基产生 增强小鼠运动能力 [65]西瓜皮、鱼、肉、蛋、禽等 瓜氨酸 抑制NO的生成、减少运动性免疫抑制 跑台模型,增强大鼠运动耐力 [66]肉类 β-丙氨酸 增加肌肉缓冲能力,形成肌肽 促进运动员在高强度运动中的表现 [67-68]黑果枸杞 枸杞多糖 抗脂质过氧化、增加糖原储备、减少代谢物堆积 负重游泳模型,提高小鼠的运动负荷能力,延缓疲劳的发生 [69]黑木耳 黑木耳多糖 抗氧化 负重游泳模型,增强小鼠运动耐力 [70]姬松茸 姬松茸多糖 抗脂质过氧化 负重游泳模型,增强小鼠运动耐力 [71]荔枝 荔枝多糖 增加糖原储备、减少代谢物堆积 负重游泳模型,增强小鼠运动耐力 [72]山楂 山楂多糖 抗缺氧、增加糖原储备、减少代谢物堆积 负重游泳模型,增强小鼠运动耐力 [73]谷类、海藻等 β-葡聚糖索拉胶 调节糖代谢、减少乳酸堆积、通过 Nrf2/HO-1/Trxs信号通路抗氧化应激 负重游泳模型,增强小鼠运动耐力和抗氧化能力 [74]魔芋 魔芋葡萄甘露聚糖 抗氧化、增强免疫力以及调节血脂平衡 动物实验、人体实验 [75]葛根 葛根素 神经保护、清除NO 负重游泳模型,保护大鼠海马细胞及促进疲劳恢复 [76-77]姜黄 姜黄素 清除自由基、保护线粒体的结构和功能 游泳运动模型,预防大强度运动导致的小鼠的肝脏损伤 [78]黄秋葵 槲皮素-3-O-龙胆二糖苷 抗氧化应激、抗炎、防止内皮功能障碍 负重游泳模型,增强大鼠运动耐力和抗氧化能力 [79-80]红景天 红景天苷 增加糖原储备、促进脂肪利用、降低色氨酸/支链氨基酸值;上调Nrf2蛋白的表达量,促进Nrf2的核易位游泳运动模型,调节小鼠运动时的糖、脂肪及蛋白质代谢,缓解疲劳作用 [81-82]番茄 番茄红素 抗氧化应激、保护肌肉不受氧化损伤 跑台模型,增强大鼠抗氧化能力 [83]虾壳 虾青素 抗氧化、促进脂质氧化、促进线粒体的生物合成和功能、增加糖原储备、减少代谢物堆积 负重游泳模型,增强小鼠运动耐力和抗氧化能力 [84-85]水果、蔬菜等 VC 抗氧化应激 增强了体内低VC水平的志愿者的运动能力 [86]肉蛋乳等 VE 清除自由基、改善肌肉耐力 饮食中VE缺乏导致大鼠肌肉耐力受损及收缩特性改变 [87]谷物、动物肝脏、蔬菜等 B族维生素 促进产能、合成新细胞、修复受损细胞 增强高强度运动能力 [88]牛蒡 牛蒡子苷元 激活抗氧化信号通路:线粒体AMPK/PGC-1α/PPARα,核内AMPK/p53/Nrf2、促进脂肪酸氧化、促进线粒体的生物合成跑台模型,增强小鼠运动耐力,调节能量代谢;负重游泳模型,增强大鼠运动耐力和抗氧化能力 [89-90]桉树、甘蔗的蜡质表层 二十八烷醇 降低血清乳酸含量和血清尿素氮浓度、提高糖原蓄积 爬杆和负重游泳模型,增强小鼠运动耐力 [91]
除了部分多糖具有抗疲劳作用之外,人们发现寡糖也具有抗疲劳活性,如β-葡聚糖索拉胶。Xu Xi等[74]连续4 周给予ICR小鼠灌胃不同剂量的β-葡聚糖索拉胶,剂量为每天50、100 mg/kg β-葡聚糖索拉胶有效延长了小鼠的力竭游泳时间,与对照组相比,分别增加了63.4%和89.2%,并且显著改善了疲劳相关生化指标乳酸、血尿素氮、肌酸激酶等水平。此外,β-葡聚糖索拉胶增强了小鼠肌肉和肝脏中Nrf2的表达水平以及Nrf2下游信号分子HO-1及Trx的转录表达水平,表明β-葡聚糖索拉胶可通过调控Nrf2/HO-1/Trx信号通路缓解由运动产生的氧化应激对机体造成的疲劳感和损伤。魔芋葡萄甘露聚糖是魔芋中主要的成分,它可以抑制机体氧化物质的生物合成或活化,提高机体抗氧化能力,减轻细胞的胁迫损伤,增强运动过度引起的免疫力下降[75]。不管是多糖还是寡糖,都具有一定的免疫调节功能,增强机体免疫力对其缓解疲劳作用是否有贡献值得进一步研究。
2.3 多酚类
多酚是天然抗氧化剂的主要来源,是含有多个酚羟基的芳香族化合物。多项研究表明多酚具有抗疲劳的功能,主要机制就是减少自由基的过度累积。单宁酸、花青素、儿茶酸、葛根素、茶多酚、芦丁、姜黄素、槲皮素、大豆异黄酮等天然多酚类化合物都具有明显的抗疲劳作用。桑葚果实中含有丰富的多酚类化合物,Jiang Dongqing等[97]对不同来源的桑葚果汁和果渣提取物进行了体外抗氧化作用和负重力竭游泳时间的评价,发现力竭游泳时间与提取物抗氧化性具有一定的正相关性,表明桑葚多酚类化合物抗疲劳作用与其自由基清除功能有关。葛根素属于异黄酮类化合物,具有抗中枢运动疲劳作用。有研究采用10 d递增负荷游泳运动方式建立大鼠运动疲劳模型,通过Morris水迷宫测试法发现葛根素能显著增强大鼠的认知能力,主要机制是通过抑制诱导型一氧化氮合酶的表达,减少了运动疲劳大鼠海马组织中NO的生成,有利于海马组织中环磷酸鸟苷的含量趋于稳定,从而实现对运动疲劳大鼠神经的保护作用,并且有助于疲劳恢复[76-77]。大强度运动会导致小鼠肝脏尤其是线粒体的结构和功能损伤,而在姜黄素提前4 周干预下,线粒体的结构和功能损伤得到了有效的缓解,这可能与姜黄素直接清除自由基及调控Nrf2信号通路有关[98-99]。大部分多酚类化合物因其多羟基的结构特性,具有良好的自由基清除功能,在抗运动疲劳方面表现出良好的效果。
2.4 生物碱类
胡椒碱是从黑胡椒中分离得到的一种生物碱类化合物,具有多种生物学功能,如抗炎、抗氧化、减肥、调节糖脂代谢等作用,也有研究显示胡椒碱在抗运动疲劳方面也有积极的作用。穆丽华等[100]每天给小鼠灌胃胡椒碱及其衍生物的水溶液20 mg/kg,连续7 d,末次灌胃1 h后进行小鼠负重力竭游泳实验,得到结果表明胡椒碱及其衍生物处理组的小鼠游泳力竭时间均延长了70%以上,小鼠血清中尿素氮、肌酸激酶,乳酸水平相比于模型组也有明显降低,该研究证明了胡椒碱可以提高机体运动机能。在ICR小鼠急性跑台运动模型中,运动前30 min给予胡椒碱抑制了小鼠比目鱼肌NADPH氧化酶1以及抗氧化酶DNA修复酶和Mn-SOD的表达,是胡椒碱直接清除超氧化物的结果;胡椒碱显著增强了急性运动后小鼠骨骼肌中碳水化合物/脂肪代谢相关转运体如GLUT4、单羧酸转运体1、脂肪酸转运酶、肉毒碱棕榈酰转移酶(carnitine palmitoyltransferase 1,CPT1)以及柠檬酸合酶的表达,反映了胡椒碱具有促进骨骼肌利用葡萄糖、乳酸和脂肪酸等产能的作用,因此有助于提高运动能力[101]。另外,红辣椒中的辣椒素也能通过增加肝糖原含量来增强耐力表现[102]。咖啡碱又称咖啡因,常见于可乐、茶饮料、部分抗疲劳功能饮料中,它可以在不影响心脏的自主活动和能量代谢的前提下通过调控中枢神经系统延缓疲劳的产生从而提高运动耐力[103]。然而,长期摄入低剂量的咖啡因会使机体产生耐受性,因此,应该避免长期补充咖啡因,以便从急性摄入咖啡因中最大限度地提高运动能力[104]。茶碱具有增加肌肉组织的耐受性,可明显延迟细胞内代谢性酸中毒的发生,缓解运动负荷引起的疲劳。生物碱类化合物的抗疲劳机制多样,且目前在抗疲劳产品的应用中比较广泛,它们在抗疲劳活性物质筛选中是一类具有研究前景的天然产物。
2.5 类胡萝卜素类
类胡萝卜素是广泛存在于新鲜瓜果蔬菜、动物、微生物中的一类脂溶性天然色素,主要包括虾青素、β-胡萝卜素、番茄红素、叶黄素、玉米黄质等。虾青素存在于许多海产品中,包括三文鱼、鳟鱼、虾等,它具有很好的抗氧化性能,在预防和治疗各种疾病,如癌症、慢性炎症、糖尿病、运动性疲劳等具有潜在的健康效应,其胶囊产品在保健品中越来越受到消费者的青睐[105]。Ikeuchi等[106]探究了虾青素对小鼠游泳运动耐力的影响,连续给小鼠补充虾青素5 周,最大剂量是每天30 mg/kg,每周都进行力竭游泳实验,结果第一周测试时虾青素补充组相对于模型组的游泳力竭时间显著增加,随着补充时间的延长效果越明显,且呈剂量依赖性。另外,作者通过改变小鼠尾部负重质量观察到虾青素对不同运度强度下小鼠的运动耐力仍然有改善的作用,并得出虾青素是通过增强脂肪酸氧化和糖原储备延缓小鼠运动疲劳的发生。另有研究表明虾青素促进脂肪酸氧化的分子机制是增强骨骼肌脂肪酸转位酶与CPT1的共定位,并抑制运动过程中CPT1的赖氨酸乙酰化修饰,从而增强CPT1活性[107]。番茄红素可通过降低肌肉组织的黄嘌呤氧化酶、髓过氧化物酶活性和MDA水平,改善力竭运动引起的氧化损伤,但是对大鼠跑台运动表现并没有显著的影响,而在小鼠经过游泳训练或不训练的条件下补充番茄红素均能有效延长小鼠的游泳力竭时间[83,108]。导致番茄红素对运动耐力影响的实验结果不一致的主要原因可能包括运动疲劳模型的选择、给药剂量、给药周期、给药方式的不同。类胡萝卜素类化合物都具有显著的抗氧化活性,从降低氧化应激的角度来看,它们是极具潜力的抗疲劳候选活性物质之一。
2.6 皂苷类
皂苷是苷元为三萜或螺旋甾烷类的糖苷类化合物,糖基部分常见的有葡萄糖、半乳糖、鼠李糖、阿拉伯糖、木糖、葡萄糖醛酸和半乳糖醛酸等,它是红景天、人参、大豆、甘草中的主要有效成分。有研究报道红景天苷具有上调Nrf2的表达水平并促进其向细胞核转位的作用,能够增强机体自身抗氧化系统活力以减轻力竭运动产生过量ROS对心肌的损伤,而且,它对运动状态下小鼠糖、脂肪及蛋白质代谢的调控有利于延缓疲劳的发生,如增加运动后糖原储备、促进脂肪利用、降低色氨酸/支链氨基酸的比值,对延缓外周和中枢疲劳的产生均有积极的作用[81-82]。Rosavin也是红景天中提取得到的具有抗疲劳活性的皂苷类物质。张慧云等[109]研究结果显示Rosavin可增加小鼠糖原和血红蛋白含量,降低肌肉乳酸和血清尿素氮水平,延长小鼠负重游泳时间,表明其在减轻机体疲劳方面具有一定的作用,且相同剂量下红景天苷的抗疲劳效果较Rosavin更佳。人参皂苷的抗疲劳效果在众多抗疲劳产品中已有体现,主要作用在于调节中枢神经系统、改善机体功能和消除疲劳等方面[110]。大鼠补充人参皂苷Rg3连续7 d后,体质量无明显变化,其力竭游泳时间延长了30%左右,表明人参皂苷Rg3具有一定的抗疲劳效果。其抗疲劳机制包括增强酪氨酸羟化酶活性、海马体和中脑α-突触核蛋白的表达,降低了由力竭游泳运动诱导的蛋白激酶A、细胞外信号调节激酶和蛋白激酶B磷酸化水平以及二羟苯乙酸/多巴胺的比值,即人参皂苷Rg3通过调控中枢疲劳增强大鼠运动耐力[111]。皂苷类化合物对中枢系统的影响占据了主导地位,因此在抗疲劳应用中剂量应该严格控制,以免产生兴奋剂样副作用。
2.7 维生素类
维生素是人和动物生长发育过程中所必需的营养素,生物体不能自身合成,必须从食物中获得,分为脂溶性(VA、VD、VE和VK)和水溶性(B族维生素、VC)两类。维生素在维持体力与提高机体疲劳耐受力具有重要的作用。研究表明体内VC含量较低的人较VC含量高的人具有更小的最大耗氧量VO2max,且F2异前列素和蛋白羰基化合物水平在运动后明显更高,而补充了VC之后可以缩小两者之间的差异,并且同时也提高了运动能力[86]。VE是一种主要的阻断自由基链式反应的抗氧化剂,它可以减少肌肉收缩介导的氧化损伤。大鼠在VE缺乏的饮食中表现为肌肉耐力受损且肌肉在长期收缩后的收缩性能也发生改变[87]。VB(硫胺素、核黄素、VB6)是人体产能途径中所必需的物质,而叶酸和VB12是合成新细胞(如红细胞)和修复受损细胞所必需的维生素[88]。运动可能会增加人体对核黄素和VB6的需求,而对叶酸和VB12的需求有待进一步研究。对于那些限制能量摄入或食物种类的运动员,应该考虑补充多种维生素及矿物质补充剂[88]。维生素的抗疲劳活性离不开其抗氧化应激、调节能量代谢及修复受损细胞的多重机制。
2.8 其他
其他化合物如牛蒡子苷元、二十八烷醇、萝卜硫素等都有研究报道它们能显著增强动物运动如跑步、游泳耐力。牛蒡子苷元可以激活心肌细胞H9C2和成肌细胞C2C12中的AMPK,而AMPK激活剂AICAR具有增强未受运动训练小鼠的跑步运动耐力的作用。在动物跑台和游泳运动疲劳模型中,牛蒡子苷元均提高了运动力竭时间,可能是因为牛蒡子苷元激活AMPK信号途径增强了骨骼肌脂肪酸氧化、线粒体的生物合成以及抗氧化酶表达,从而提高了机体有氧代谢能力及抗氧化水平[89-90]。萝卜硫素是Nrf2激动剂,它诱导的Nrf2上调及其抗氧化作用可以降低过度运动引起的氧化应激水平,可在减轻肌肉疲劳方面发挥重要作用[37]。此外,目前已有的一些抗疲劳饮料和食品中往往含有矿物元素,如钙、镁、锌、钠、钾等,其并没有直接的抗疲劳作用,但是缺少这些矿物质却有可能引起疲劳,所以应针对不同人群考虑矿物质的合理补充。
食源性抗疲劳活性物质大部分都可以通过抗氧化作用、增加糖原储存以及减少代谢物的蓄积来缓解疲劳,增强运动能力,其中只有少部分活性物质进行了更深入的分子机制的研究,它们对潜在的抗运动疲劳的分子靶点具有调控作用,图3是部分既有抗运动疲劳作用又对抗运动疲劳分子靶点有激活作用的食源性功能成分,根据这些功能成分的作用靶点,可以进行2、3 种甚至多种成分的组合,从而更好地发挥其抗疲劳效果。
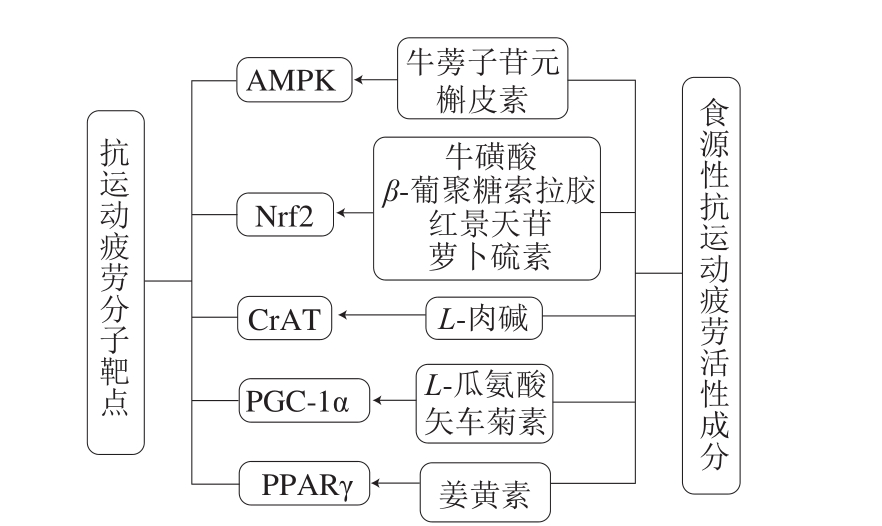
图3 食源性抗运动疲劳活性成分及其作用分子靶点
Fig. 3 Dietary bioactive components against exercise-induced fatigue and their molecular targets
3 食源性抗运动疲劳活性成分在抗疲劳功能食品中的应用
虽然目前已经发现的具有抗疲劳活性的天然活性产物数不胜数,但是大部分相关的研究都还处于非常基础的阶段,在抗疲劳产品中的应用方面还比较落后。市场上的抗疲劳功能产品丰富多样,主要分为三大类,一类是以西洋参、红景天、冬虫夏草等名贵中药材为原料的抗疲劳保健品,成本高、价格贵;一类是以生物活性肽为主要原料,再配伍其他中药材和营养物质的抗疲劳保健品;另一类是运动饮料,主要包含一些能量物质、维生素及氨基酸等,此类产品价格亲民,然而其抗疲劳作用仍有待进一步研究。此外,部分食源性抗疲劳活性成分也有出现在抗疲劳功能食品的配方中。
甘蔚乐是一种专门针对饮酒人群和工作强度大的人群的定向营养剂,主要由黄精多糖、玉米低聚肽、黑茶茶多酚、氨基酸、不饱和脂肪酸等原料组成。相关研究表明,甘蔚乐能显著延长负重小鼠力竭游泳时间,减少代谢产物蓄积,增加糖原储存,具有良好的抗疲劳效果[112]。又如一种新型抗疲劳保健品——Fitnox,主要功能成分包括黑姜黄烷酮类、石榴皮多酚和辣木叶皂苷[113],其可以增加血清NO、促红细胞生成素的水平,预防脱水,补充电解质,提供抗氧化剂,增加多巴胺水平。临床实验结果表明不论是运动前还是运动后补充Fitnox都能有效改善机体的生理状态。一种保健口服液(主要成分及质量浓度为VBl 230 μg/mL、VB2 15 μg/mL、VB6 15 μg/mL、烟酸胺20 μg/mL、葛根素150 μg/mL、牛磺酸4 500 μg/mL)经动物实验表明能延长小鼠的游泳时间、增加小鼠肝糖原、血清乳酸脱氢酶水平,降低小鼠血乳酸含量,对血清尿素氮、血糖作用不明显,表明该保健口服液具有抗疲劳作用[114]。
众多的抗疲劳功能食品配方中基本上都含有3 种以上的活性物质,这种复配的合理性、必要性与有效性,以及抗疲劳作用机制仍然需要进一步的研究。目前的抗疲劳产品更多的是针对运动员、军事人员或是特殊人群设计的配方,对于普通人群并不适用,或者效果并不是很显著。今后,可以利用已有的食源性活性成分设计新型的抗疲劳配方,让更多的人群受益。
4 结 语
综上所述,鉴于运动疲劳是一种复杂的生理生化过程,涉及机体全身,包括外周组织和中枢系统,目前人们对其产生的机制还未解析透彻,但是主流的疲劳产生学说:能量耗竭、代谢物蓄积、自由基学说对抗疲劳研究仍然具有重要的指导作用。而食源性功能成分是一个巨大的抗疲劳活性成分筛选库,可提供糖类、蛋白质、肽类等能源物质,也可以提供自由基清除剂如多酚、VC等,还可以提供调节机体能量代谢的多糖,多酚类等物质。结合运动疲劳发生机制,以食源性功能成分为抗疲劳功能配方的物质基础,可为研发新型、高效、安全、价廉的抗疲劳产品提供理论基础和技术支撑。
目前,国内外在抗疲劳活性成分的发现与应用上也取得了丰硕的成果,但还存在一定的不足。1)大部分研究只是初步评价了活性成分的抗疲劳效果,其明确的抗疲劳机制还有待进一步研究。2)现有抗疲劳保健食品的评价都是以动物实验为基础展开的,实验周期长,成本高,细胞培养技术具有操作简便、周期短、成本低等优点,却缺乏有效的细胞抗疲劳评价方法。3)成果转化率较低,大部分只停留在动物实验层面,人体方面的研究数据相对匮乏。另外,以分子靶点为基础,更有利于筛选机制明确的抗疲劳活性成分,可为今后新型抗疲劳保健产品开发提供研究思路。
[1] 王亚雯, 辛中豪, 高蔚娜, 等. 植物来源化合物抗疲劳作用研究进展[J]. 军事医学, 2016(12): 1009-1012. DOI:10.7644/j.issn.1674-9960.2016.12.015.
[2] 刘源源, 刘军, 邹宇晓, 等. 抗疲劳功能食品检测评价研究进展及新思路[J]. 食品研究与开发, 2016, 37(2): 209-213. DOI:10.3969/j.issn.1005-6521.2016.02.052.
[3] LAMBERT E V, NOAKES T D, HAMPSON D B, et al. Exercise and fatigue-control mechanisms[J]. International SportMed Journal, 2001,2(3): 1-14.
[4] GREEN H J. Mechanisms of muscle fatigue in intense exercise[J]. Journal of Sports Sciences, 1997, 15(3): 247-256.DOI:10.1080/026404197367254.
[5] FINAUD J, LAC G, FILAIRE E. Oxidative stress relationship with exercise and training review[J]. Sports Medicine, 2006, 36(4):327-358. DOI:10.2165/00007256-200636040-00004.
[6] 罗琳, 张缨. AMPK与氧化应激及其与运动关系的研究进展[J]. 中国体育科技, 2017, 53(4): 125-130. DOI:10.16470/j.csst.201704018.
[7] MCKENNA M J, HARGREAVES M. Resolving fatigue mechanisms determining exercise performance: integrative physiology at its finest[J]. Journal of Applied Physiology, 2008, 104(1): 286-287.DOI:10.1152/japplphysiol.01139.2007.
[8] CARROLL T J, TAYLOR J L, GANDEVIA S C. Recovery of central and peripheral neuromuscular fatigue after exercise[J]. Journal of Applied Physiology, 2017, 122(5): 1068-1076. DOI:10.1152/japplphysiol.00775.2016.
[9] 颜卫东. 运动性疲劳产生的机制及其恢复[J]. 南京体育学院学报(自然科学版), 2007, 6(2): 57-60. DOI:10.3969/j.issn.1671-5950.2007.03.016.
[10] ØRTENBLAD N, WESTERBLAD H, NIELSEN J. Muscle glycogen stores and fatigue[J]. The Journal of Physiology, 2013, 591(18):4405-4413. DOI:10.1113/jphysiol.2013.251629.
[11] HUFFMAN D, ALTENA T, MAWHINNEY T, et al. Effect of n-3 fatty acids on free tryptophan and exercise fatigue[J]. European Journal of Applied Physiology, 2004, 92: 584-591. DOI:10.1007/s00421-004-1069-6.
[12] HAWLEY J A, HARGREAVES M, JOYNER M J, et al. Integrative biology of exercise[J]. Cell, 2014, 159(4): 738-749. DOI:10.1016/j.cell.2014.10.029.
[13] AMENT W, VERKERKE G J. Exercise and fatigue[J]. Sports Medicine, 2009, 39(5): 389-422. DOI:10.2165/00007256-200939050-00005.
[14] BOSCÃ L, ARAG Ã N J J, SOLS A. Modulation of muscle phosphofructokinase at physiological concentration of enzyme[J]. Journal of Biological Chemistry, 1985, 260(4): 2100-2107. DOI:10.1016/0165-022X(85)90070-3.
[15] MA S, SUZUKI K. Keto-adaptation and endurance exercise capacity, fatigue recovery, and exercise-induced muscle and organ damage prevention: a narrative review[J]. Sports, 2019, 7(2): 40-49.DOI:10.3390/sports7020040.
[16] TSUDA Y, YAMAGUCHI M, NOMA T, et al. Combined effect of arginine, valine, and serine on exercise-induced fatigue in healthy volunteers: a randomized, double-blinded, placebo-controlled crossover study[J]. Nutrients, 2019, 11(4): 862-873. DOI:10.3390/nu11040862.
[17] FERNSTROM J D, FERNSTROM M H. Exercise, serum free tryptophan, and central fatigue[J]. The Journal of Nutrition, 2006,136(2): 553S-559S. DOI:10.1093/jn/136.2.553S.
[18] 刘蓓蓓, 张蕴琨. 力竭运动对大鼠脑纹状体5-HT含量及其代谢的影响[J]. 南京体育学院学报(自然科学版), 2008, 7(1): 94-99.DOI:10.15877/j.cnki.nsin.2008.01.034.
[19] WILKINSON D J, SMEETON N J, WATT P W. Ammonia metabolism, the brain and fatigue; revisiting the link[J].Progress in Neurobiology, 2010, 91(3): 200-219. DOI:10.1016/j.pneurobio.2010.01.012.
[20] SIES H, BERNDT C, JONES D P. Oxidative stress[J]. The Annual Review of Biochemistry, 2017, 86: 715-748. DOI:10.1146/annurevbiochem-061516-045037.
[21] MASON S A, MORRISON D, MCCONELL G K, et al. Muscle redox signalling pathways in exercise. Role of antioxidants[J]. Free Radical Biology and Medicine, 2016, 98: 29-45. DOI:10.1016/j.freeradbiomed.2016.02.022.
[22] TRINITY J D, BROXTERMAN R M, RICHARDSON R S.Regulation of exercise blood flow: role of free radicals[J]. Free Radical Biology and Medicine, 2016, 98: 90-102. DOI:10.1016/j.freeradbiomed.2016.01.017.
[23] KANTER M. Free radicals, exercise and antioxidant supplementation[J]. Proceedings of the Nutrition Society, 1998, 57(1):9-13. DOI:10.1079/PNS19980004.
[24] HARDIE D G, ROSS F A, HAWLEY S A. AMPK: a nutrient and energy sensor that maintains energy homeostasis[J]. Nature Reviews Molecular Cell Biology, 2012, 13(4): 251-262. DOI:10.1038/nrm3311.
[25] LEE-YOUNG R S, AYALA J E, BIRNBAUM M J, et al. Coupling of oxidative metabolism to muscular work in healthy and insulin resistant conscious mice: role of AMPK signaling[J]. Diabetes, 2007,56(Suppl 1): A63.
[26] FRITZEN A M, LUNDSGAARD A M, JEPPESEN J, et al. 5’-AMP activated protein kinase alpha2 controls substrate metabolism during post-exercise recovery via regulation of pyruvate dehydrogenase kinase 4[J]. The Journal of Physiology, 2015, 593(21): 4765-4780.DOI:10.1113/JP270821.
[27] MATSUKAWA T, MOTOJIMA H, SATO Y, et al. Upregulation of skeletal muscle PGC-1α through the elevation of cyclic AMP levels by cyanidin-3-glucoside enhances exercise performance[J]. Scientific Reports, 2017, 7(1): 44799-44800. DOI:10.1038/srep44799.
[28] VILLAREAL M O, MATSUKAWA T, ISODA H. L-Citrulline supplementation-increased skeletal muscle PGC-1α expression is associated with exercise performance and increased skeletal muscle weight[J]. Molecular Nutrition & Food Research, 2018, 62(14):1701043-1701050. DOI:10.1038/srep44799.
[29] COMBES A, DEKERLE J, WEBBORN N, et al. Exercise-induced metabolic fluctuations influence AMPK, p38-MAPK and CaMKII phosphorylation in human skeletal muscle[J]. Physiological Reports,2015, 3(9): e12462-e12469. DOI:10.14814/phy2.12462.
[30] 于亮, 陈晓萍, 王瑞元. 骨骼肌纤维类型转化的分子调控机制研究进展[J]. 中国运动医学杂志, 2014, 33(5): 470-475. DOI:10.16038/j.1000-6710.2014.05.007.
[31] ZIMMERMANN K, BALDINGER J, MAYERHOFER B, et al.Activated AMPK boosts the Nrf2/HO-1 signaling axis: a role for the unfolded protein response[J]. Free Radical Biology and Medicine,2015, 88: 417-426. DOI:10.1016/j.freeradbiomed.2015.03.030.
[32] JOO M S, KIM W D, LEE K Y, et al. AMPK facilitates nuclear accumulation of Nrf2 by phosphorylating at serine 550[J]. Molecular and Cellular Biology, 2016, 36(14): 1931-1942. DOI:10.1128/MCB.00118-16.
[33] EGGLER A L, GAY K A, MESECAR A D. Molecular mechanisms of natural products in chemoprevention: induction of cytoprotective enzymes by Nrf2[J]. Molecular Nutrition & Food Research, 2008,52(Suppl 1): S84-S94. DOI:10.1002/mnfr.200700249.
[34] HAYES J D, DINKOVA-KOSTOVA A T. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism[J]. Trends in Biochemical Sciences, 2014, 39(4): 199-218.DOI:10.1016/j.tibs.2014.02.002.
[35] WU K C, CUI J Y, KLAASSEN C D. Beneficial role of Nrf2 in regulating NADPH generation and consumption[J]. Toxicological Sciences, 2011, 123(2): 590-600. DOI:10.1093/toxsci/kfr183.
[36] MUTHUSAMY V R, KANNAN S, SADHAASIVAM K, et al.Acute exercise stress activates Nrf2/ARE signaling and promotes antioxidant mechanisms in the myocardium[J]. Free Radical Biology and Medicine, 2012, 52(2): 366-376. DOI:10.1016/j.freeradbiomed.2011.10.440.
[37] OH S, KOMINE S, WARABI E, et al. Nuclear factor (erythroid derived 2)-like 2 activation increases exercise endurance capacity via redox modulation in skeletal muscles[J]. Scientific Reports, 2017,7(1): 12902-12912. DOI:10.1038/s41598-017-12926-y.
[38] LUDTMANN M H, ANGELOVA P R, ZHANG Y, et al. Nrf2 affects the efficiency of mitochondrial fatty acid oxidation[J]. Biochemical Journal, 2014, 457(3): 415-424. DOI:10.1038/s41598-017-12926-y.
[39] PAEK J, LO J Y, NARASIMHAN S D, et al. Mitochondrial SKN-1/Nrf mediates a conserved starvation response[J]. Cell Metabolism, 2012, 16(4): 526-537. DOI:10.1016/j.cmet.2012.09.007.
[40] POOLE D C, JONES A M. Oxygen uptake kinetics[J]. Comprehensive Physiology, 2012, 2(2): 933-996. DOI:10.1002/cphy.c100072.
[41] SEILER S E, KOVES T R, GOODING J R, et al. Carnitine acetyltransferase mitigates metabolic inertia and muscle fatigue during exercise[J]. Cell Metabolism, 2015, 22(1): 65-76. DOI:10.1016/j.cmet.2015.06.003.
[42] KIENESBERGER K, PORDES A G, VOLK T G, et al. L-Carnitine and PPARα-agonist fenofibrate are involved in the regulation of carnitine acetyltransferase (CrAT) mRNA levels in murine liver cells[J].BMC Genomics, 2014, 15: 514. DOI:10.1186/1471-2164-15-514.
[43] VITOŠEVIĆ B, RANKOVIĆ G, POPOVIĆ-ILIĆ T. Role of PPARδ in determintion of muscle fiber type in response to exercise[J]. Acta Medica Medianae, 2011, 50(2): 57-62. DOI:10.5633/amm.2011.0211.
[44] FAN Weiwei, WAIZENEGGER W, LIN Chunshi, et al.PPARδ promotes running endurance by preserving glucose[J].Cell Metabolism, 2017, 25(5): 1186-1193. DOI:10.1016/j.cmet.2017.04.006.
[45] WANG Yongxu, ZHANG Chunli, YU R T, et al. Regulation of muscle fiber type and running endurance by PPARdelta[J]. PLoS Biology,2004, 2(10): e294. DOI:10.1371/journal.pbio.0020294.
[46] NARKAR V A, DOWNES M, YU R T, et al. AMPK and PPARδ agonists are exercise mimetics[J]. Cell, 2008, 134(3): 405-415.DOI:10.1016/j.cell.2008.06.051.
[47] REN Jiaoyan, ZHAO Mouming, WANG Haiyan, et al. Effects of supplementation with grass carp protein versus peptide on swimming endurance in mice[J]. Nutrition, 2011, 27(7): 789-795. DOI:10.1016/j.nut.2010.08.020.
[48] YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al. In vitro antioxidant activity and in vivo anti-fatigue effect of loach (Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chemistry, 2011, 124(1): 188-194. DOI:10.1016/j.foodchem.2010.06.007.
[49] WANG Li, ZHANG Huali, LU Rong, et al. The decapeptide CMS001 enhances swimming endurance in mice[J]. Peptides, 2008, 29(7):1176-1182. DOI:10.1016/j.peptides.2008.03.004.
[50] NAM S, KIM H, JEONG H. Anti-fatigue effect by active dipeptides of fermented porcine placenta through inhibiting the inflammatory and oxidative reactions[J]. Biomedicine & Pharmacotherapy, 2016, 84: 51-59.DOI:10.1016/j.biopha.2016.09.012.
[51] 丁树慧, 齐曼婷, 齐斌, 等. 低值海洋鱼低聚肽抗氧化和抗疲劳活性[J]. 食品科学, 2019, 40(1): 155-161. DOI:10.7506/spkxl002-6630-20170922-328.
[52] SUN Suguo, NIU Huihui, YANG Tao, et al. Antioxidant and antifatigue activities of egg white peptides prepared by pepsin digestion[J].Journal of the Science of Food and Agriculture, 2014, 94(15): 3195-3200. DOI:10.1002/jsfa.6671.
[53] 昌友权. 玉米肽抗疲劳作用的实验研究[J]. 食品科学, 2004, 25(9):173-178. DOI:10.3321/j.issn:1002-6630.2004.09.040.
[54] 陈红漫, 杜国丰, 田秀艳, 等. 脱色素玉米活性肽对小鼠抗运动性疲劳的影响[J]. 江苏农业学报, 2009, 25(3): 592-595. DOI:10.3969/j.issn.1000-4440.2009.03.031.
[55] 郑鸿雁. 玉米肽抗疲劳作用的实验研究[J]. 中国粮油学报, 2005,20(1): 33-35. DOI:10.3321/j.issn:1003-0174.2005.01.009.
[56] 周丽丽, 李素反, 高红, 等. 大豆多肽对大强度训练举重运动员肌肉代谢的影响[J]. 中国食品学报, 2006, 6(1): 40-43. DOI:10.16429/j.1009-7848.2006.01.009.
[57] JIANG Chuan. Research of the recovery effect from soybean polypeptide solid beverage on athletes in endurance events[J].Carpathian Journal of Food Science and Technology, 2015, 7(1): 5-12.
[58] YU Bo, LU Zhaoxin, BIE Xiaomei, et al. Scavenging and anti-fatigue activity of fermented defatted soybean peptides[J]. European Food Research and Technology, 2008, 226(3): 415-421. DOI:10.1007/s00217-006-0552-1.
[59] LIU J, CHEN L W, JI K M, et al. An endurance-enhancing effect of peanut meal protein hydrolysate in mice: possible involvement of a specific peanut peptide[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(5): 830-837. DOI:10.1111/jpn.12140.
[60] NISHITANI M, MUNEKIYO Y, SUGINO T, et al. Novel antifatigue compound: imidazole dipeptide[J]. Japanese Journal of Complementary and Alternative Medicine, 2009, 6(3): 123-129.DOI:10.1625/jcam.6.123.
[61] TAKAHASHI Y. Chapter 16: anserine as a suppressor of fatigue[M]//PREEDY V R. Imidazole dipeptides: chemistry, analysis, function and effects. Cambridge: Royal Society of Chemistry, 2015: 312-324.
[62] SEIDEL U, HUEBBE P, RIMBACH G. Taurine: a regulator of cellular redox-homeostasis and skeletal muscle function[J]. Molecular Nutrition & Food Research, 2018, 63(16): e1800569-e1800582.DOI:10.1002/mnfr.201800569.
[63] CAI Jianhuang, YIN Dazhong, TANG Hui. The biochemical mechanisms of taurine in anti sports fatigue[J]. Advanced Materials Research, 2012, 550/551/552/553: 1043-1047. DOI:10.4028/www.scientific.net/AMR.550-553.1043.
[64] TSUDA Y, IWASAWA K, YAMAGUCHI M. Acute supplementation of valine reduces fatigue during swimming exercise in rats[J].Bioscience, Biotechnology, and Biochemistry, 2018, 82(5): 856-861.DOI:10.1080/09168451.2018.1438168.
[65] SILVA J E P, BORGES L S, MENDES-DA-SILVA C, et al.L-Arginine supplementation improves rats’ antioxidant system and exercise performance[J]. Free Radical Research, 2017, 51(3): 281-293.DOI:10.1080/10715762.2017.1301664.
[66] STEAR S J, CASTELL L M, BURKE L M, et al. A-Z of nutritional supplements: dietary supplements, sports nutrition foods and ergogenic aids for health and performance: part 10[J]. British Journal of Sports Medicine, 2010, 44(9): 688-690. DOI:10.1136/bjsm.2010.075218.
[67] HARRIS R, STELLINGWERFF T, VANLOON L, et al. Effect of beta-alanine supplementation on high-intensity exercise performance[J]. Limits of Human Endurance, 2013, 76: 61-71.DOI:10.1159/000350258.
[68] SAUNDERS B, ARTIOLI G G, SALE C, et al. Imidazole dipeptides:chemistry, analysis, function and effects[M]. London: Royal Society of Chemistry, 2015: 277-294. DOI:10.1039/9781782622611-00277.
[69] 汪建红, 陈晓琴, 张蔚佼. 黑果枸杞果实多糖抗疲劳生物功效及其机制研究[J]. 食品科技, 2009, 34(2): 203-207. DOI:10.13684/j.cnki.spkj.2009.02.061.
[70] HAO Haitao. Effect effects of Auricularia auricula polysaccharides on exhaustive swimming exercise-induced oxidative stress in mice[J]. Tropical Journal of Pharmaceutical Research, 2014, 13(11):1845-1851. DOI:10.4314/tjpr.v13i11.11.
[71] 李晶, 魏健. 姬松茸多糖增强免疫功能及抗疲劳作用的研究[J].食品研究与开发, 2017, 38(5): 201-204. DOI:10.3969/j.issn.1005-6521.2017.05.043.
[72] 宋伟峰, 苏俊芳, 罗淑媛. 荔枝多糖抗疲劳作用的实验研究[J]. 中药材, 2012, 35(9): 1485-1487. DOI:10.13863/j.issn1001-4454.2012.09.034.
[73] 唐礼可. 山楂多糖抗疲劳作用实验研究[J]. 云南中医中药杂志,2008, 29(2): 32-33. DOI:10.16254/j.cnki.53-1120/r.2008.02.026.
[74] XU Xi, DING Yijian, YANG Yunxia, et al. β-glucan Salecan improves exercise performance and displays anti-fatigue effects through regulating energy metabolism and oxidative stress in mice[J].Nutrients, 2018, 10(7): 858-870. DOI:10.3390/nu10070858.
[75] 刘丹松, 屈萍, 段广明, 等. 魔芋葡萄甘露聚糖与运动员生理机能恢复[J]. 武汉体育学院学报, 2015, 49(12): 96-100. DOI:10.15930/j.cnki.wtxb.2015.12.015.
[76] 程丽彩, 何玉秀. 补充葛根素对力竭游泳训练大鼠海马细胞凋亡及Bcl-2、P53蛋白表达的影响[J]. 中国运动医学杂志, 2010, 29(3):332-334. DOI:10.16038/j.1000-6710.2010.03.002.
[77] 郭雅, 习雪峰. 葛根素对运动疲劳大鼠海马NO-cGMP信号系统的影响[J]. 食品科学, 2012, 33(13): 276-279.
[78] 高超, 刘阳, 王宇飞, 等. 大强度运动导致肝脏线粒功能紊乱及姜黄素的拮抗效应[J]. 中国食物与营养, 2017, 23(5): 59-63.DOI:10.3969/j.issn.1006-9577.2017.05.014.
[79] LIN Yin, LIU Hualiang, FANG Jie, et al. Anti-fatigue and vasoprotective effects of quercetin-3-O-gentiobiose on oxidative stress and vascular endothelial dysfunction induced by endurance swimming in rats[J]. Food and Chemical Toxicology, 2014, 68:290-296. DOI:10.1016/j.fct.2014.03.026.
[80] XIA Fangbo, ZHONG Yu, LI Mengqiu, et al. Antioxidant and antifatigue constituents of Okra[J]. Nutrients, 2015, 7(10): 8846-8858.DOI:10.3390/nu7105435.
[81] 豆瑞, 马莉, 郭晓冬, 等. 红景天苷对不同运动状态下小鼠糖、脂肪及蛋白质代谢的影响[J]. 同济大学学报(医学版), 2018, 39(1):59-63. DOI:10.16118/j. 1008-0392.2018.01.012.
[82] XU Peng, SUN Weiwei, LIU Haiyan, et al. The effect of salidroside on improving cardiac function by reducing oxidative stress upregulating through Nrf2 in exhausted exercise rats[J]. Journal of the American College of Cardiology, 2016, 68(16): C59. DOI:10.1016/j.jacc.2016.07.217.
[83] LIU Chiehchung, HUANG Chichang, LIN Wanteng, et al. Lycopene supplementation attenuated xanthine oxidase and myeloperoxidase activities in skeletal muscle tissues of rats after exhaustive exercise[J].British Journal of Nutrition, 2005, 94(4): 595-601. DOI:10.1079/BJN20051541.
[84] YAMASHITA E. Let astaxanthin be thy medicine[J]. PharmaNutrition,2015, 3(4): 115-122. DOI:10.1016/j.phanu.2015.09.001.
[85] 王茵, 刘淑集, 苏永昌, 等. 天然虾青素的抗疲劳及抗氧化作用研究[J].西南大学学报(自然科学版), 2015, 37(9): 42-48. DOI:10.13718/j.cnki.Dak.2015.09.007.
[86] PASCHALIS V, THEODOROU A A, KYPAROS A, et al. Low vitamin C values are linked with decreased physical performance and increased oxidative stress: reversal by vitamin C supplementation[J].European Journal of Nutrition, 2016, 55(1): 45-53. DOI:10.1007/s00394-014-0821-x.
[87] COOMBES J S, ROWELL B, DODD S L, et al. Effects of vitamin E deficiency on fatigue and muscle contractile properties[J]. European Journal of Applied Physiology, 2002, 87(3): 272-277. DOI:10.1007/s00421-002-0631-3.
[88] WOOLF K, MANORE M M. B-vitamins and exercise: does exercise alter requirements?[J]. International Journal of Sport Nutrition and Exercise Metabolism, 2006, 16(5): 453-484. DOI:10.1123/ijsnem.16.5.453.
[89] TANG Xuan, ZHUANG Jingjing, CHEN Jing, et al. Arctigenin efficiently enhanced sedentary mice treadmill endurance[J]. PLoS ONE, 2011, 6(8): 1-13. DOI:10.1371/journal.pone.0024224.
[90] WU Ruoming, SUN Yanyan, ZHOU Tingting, et al. Arctigenin enhances swimming endurance of sedentary rats partially by regulation of antioxidant pathways[J]. Acta Pharmacologica Sinica, 2014, 35(10):1274-1284. DOI:10.1038/aps.2014.70.
[91] 陈芳, 赵广华, 田泽, 等. 二十八烷醇提取物的抗疲劳作用研究[J]. 营养学报, 2006, 28(3): 269-270. DOI:10.3321/j.issn:0512-7955.2006.03.022.
[92] 杨少玲, 李来好. 抗疲劳肽的研究现状[J]. 湛江海洋大学学报(自然科学), 2006, 26(6): 77-82. DOI:10.3969/j.issn.1673-9159.2006.06.020.
[93] REN Jiaoyan, ZHAO Mouming, SHI John, et al. Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry, 2008, 108(2): 727-736. DOI:10.1016/j.foodchem.2007.11.010.
[94] BLOMSTRAND E, ELIASSON J, KARLSSON H K R, et al.Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise[J]. Nutrition, 2006, 136(1): 269-273.DOI:10.1093/jn/136.1.269S.
[95] YEN Chiahung, TSAO Tehung, HUANG Chenguan, et al. Effects of sweet cassava polysaccharide extracts on endurance exercise in rats[J].Journal of the International Society of Sports Nutrition, 2013, 10(1):18-24. DOI:10.1186/1550-2783-10-18.
[96] GUO Rui, QI Bo. Protective effect of polysaccharides from Cortex Eucommiae on exhaustive exercise-induced oxidative stress in mice[J]. Biomedical Research, 2015, 26(2): 375-379. DOI:10.1007/s004040050070.
[97] JIANG Dongqing, GUO Ying, XU Dianhong, et al. Antioxidant and anti-fatigue effects of anthocyanins of mulberry juice purification(MJP) and mulberry marc purification (MMP) from different varieties mulberry fruit in China[J]. Food and Chemical Toxicology, 2013, 59:1-7. DOI:10.1016/j.fct.2013.05.023.
[98] KAWANISHI N, KATO K, TAKAHASHI M, et al. Curcumin attenuates oxidative stress following downhill running-induced muscle damage[J]. Biochemical and Biophysical Research Communications,2013, 441(3): 573-578. DOI:10.1016/j.bbrc.2013.10.119.
[99] WAFI A M, HONG J, RUDEBUSH T L, et al. Curcumin improves exercise performance of mice with Coronary artery ligation-induced HFrEF: Nrf2 and antioxidant mechanisms in skeletal muscle[J].Journal of Applied Physiology, 2019, 126(2): 477-486. DOI:10.1152/japplphysiol.00654.2018.
[100] 穆丽华, 刘屏, 胡园, 等. 胡椒碱及其衍生物抗疲劳和心肌细胞保护作用研究[J]. 解放军药学学报, 2009, 25(2): 113-117.
[101] KIM J, LEE K P, LEE D W, et al. Piperine enhances carbohydrate/fat metabolism in skeletal muscle during acute exercise in mice[J].Nutrition & Metabolism, 2017, 14(43): 1-8. DOI:10.1186/s12986-017-0194-2.
[102] HSU Y, HUANG W, CHIU C, et al. Capsaicin supplementation reduces physical fatigue and improves exercise performance in mice[J]. Nutrients, 2016, 8(10): 648-662. DOI:10.3390/nu8100648.
[103] PEREIRA P E, MOTOYAMA Y, ESTEVES G J, et al. Caffeine supplementation delays the fatigue through central nervous system modulation[J]. Sport Sciences for Health, 2016, 12(2): 239-245.DOI:10.1007/s11332-016-0281-1.
[104] BEAUMONT R, CORDERY P, FUNNELL M, et al. Chronic ingestion of a low dose of caffeine induces tolerance to the performance benefits of caffeine[J]. Journal of Sports Sciences, 2017, 35(19): 1920-1927.DOI:10.1080/02640414.2016.1241421.
[105] DHANKHAR J, KADIAN S S, SHARMA A. Astaxanthin: a potential carotenoid[J]. International Journal of Pharmaceutical Sciences and Research, 2012, 3(5): 1246-1259. DOI:10.13040/IJPSR.0975-8232.3(5).1246-59.
[106] IKEUCHI M, KOYAMA T, TAKAHASHI J, et al. Effects of astaxanthin supplementation on exercise-induced fatigue in mice[J].Biological & Pharmaceutical Bulletin, 2006, 29(10): 2106-2110.DOI:10.1248/bpb.29.2106.
[107] AOI W, NAITO Y, TAKANAMI Y, et al. Astaxanthin improves muscle lipid metabolism in exercise via inhibitory effect of oxidative CPTI modification[J]. Biochemical and Biophysical Research Communications, 2008, 366(4): 892-897. DOI:10.1016/j.bbrc.2007.12.019.
[108] 毕立茹, 周冬, 王凤阳, 等. 番茄红素对训练小鼠力竭运动能力的影响[J]. 中国康复医学杂志, 2008, 23(6): 537-539.
[109] 张慧云, 马朝阳, 王洪新. 玫瑰红景天提取物rosavin抗疲劳作用的实验研究[J]. 食品工业科技, 2013, 34(6): 357-359. DOI:10.13386/j.issn1002-0306.2013.06.013.
[110] 张祥, 张晶莹, 宋昕恬, 等. 人参皂苷的抗疲劳作用研究[J]. 安徽农业科学, 2018, 46(5): 12-14. DOI:10.13989/j.cnki.0517-6611.2018.05.005.
[111] XU Yuxia, ZHANG Peng, WANG Chu, et al. Effect of ginsenoside Rg3 on tyrosine hydroxylase and related mechanisms in the forced swimming-induced fatigue rats[J]. Journal of Ethnopharmacology,2013, 150(1): 138-147. DOI:10.1016/j.jep.2013.08.016.
[112] 童敏, 龚莉, 张逸. 甘蔚乐对小鼠抗疲劳作用的研究[J]. 中南药学,2017, 15(4): 440-442. DOI:10.7539/j.issn.1672-2981.2017.04.013.
[113] JACOB J, GOPI S, DIVYA C. A randomized single dose parallel study on enhancement of nitric oxide in serum and saliva with the use of natural sports supplement in healthy adults[J]. Journal of Dietary Supplements, 2018, 15(2): 161-172. DOI:10.1080/19390211.2017.1331944.
[114] 周双桥, 薛慧, 郭伟杰, 等. 维生素B族在保健食品中的作用[J]. 中国自然医学杂志, 2002, 4(2): 113-114.