茯苓(Poria cocos (Schw.) Wolf)是一种寄生在松树根部的真菌,在中国有2000多年的食用历史,是我国重要的药食两用药材之一[1]。茯苓在食品工业以及医药行业用途广泛,具有利尿、安神、健脾等功效,常用于治疗水肿、失眠、心神不安等症[2-3]。
茯苓多糖为茯苓的主要有效成分,其中90%以上为碱溶性多糖,不溶于水,且基本没有生理活性,生物利用率极低,使之在临床应用上受到限制[4]。但是将不溶于水的碱溶性茯苓多糖经过适当的化学修饰后,可提高其水溶性和生物活性[5]。因此,目前有关茯苓多糖的水溶性修饰(如羧甲基化和硫酸酯化及水溶性低聚体等)以及多糖的活性与结构的关系,已成为国内外研究的热点和核心问题[6]。研究表明,羧甲基化修饰的茯苓多糖具有多种生物活性,如抗肿瘤、抗氧化、抗凝血等[7]。根据Wang Yongjiang等[8]报道,茯苓多糖羧甲基化后能提高对胆汁酸的结合能力。Wang Yufen等[9]通过气相色谱-质谱联用、核磁共振等技术对羧甲基化与硫酸酯化Lachnum多糖进行了结构表征与活性研究,证实羧甲基化与硫酸酯化修饰都能显著提高多糖抗氧化和降血糖活性。本实验室研究发现,茯苓多糖经羧甲基化修饰后,水溶性增强,对肠道健康也具有一定的促进作用,其抑制肠毒素大肠杆菌的能力显著提高,并且与莲房原花青素(lotus seedpod procyanidins,LSPC)协同使用时能有效解决多酚低浓度促进大肠杆菌生长的负效应[10]。然而,关于茯苓多糖羧甲基化程度与理化性质、结构及生物活性关系的研究较少,尤其是有关羧甲基化程度与其体外抑菌活性之间的研究并不完善[11]。本研究采用二次碱化法制备羧甲基茯苓多糖(carboxymethylated pachymaran,CMP),通过单因素试验和正交试验得到最佳改性工艺,并对不同取代度(0.350~0.728)的CMP进行理化性质分析、结构表征与体外抑菌活性研究,以期为进一步研究CMP作为天然抗菌剂提供科学基础,进而促进碱溶性茯苓多糖的合理深加工,提高其利用价值。
1 材料与方法
1.1 材料与试剂
白茯苓购自湖南省怀化县茯苓基地;LSPC由实验室自提,莲房采自洪湖蓝田种植区,品种名称为“武植2号”。
无水乙醇、氢氧化钠、一氯乙酸、冰醋酸、PAN指示剂(均为分析纯) 国药集团化学试剂有限公司;金黄色葡萄球菌C M C C(B)2 6 0 0 3、大肠杆菌NCTC12900、肠炎沙门菌BNCC103134、Luria-Bertani(LB)肉汤、LB琼脂、Mueller-Hinton(MH)肉汤中国青岛霍普生物科技有限公司。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器 上海东玺制冷仪器设备有限公司;SHZ-D(III)型循环水真空泵 武汉科尔仪器设备有限公司;UV-2100型紫外-可见分光光度计上海尤尼柯仪器有限公司;Nexus 470 FT-IR傅里叶变换红外光谱仪 日本岛津公司;Zetasizer Nano ZS纳米粒度电位分析仪 英国马尔文仪器有限公司;DSC204F型差示扫描量热仪 耐驰仪器上海有限公司;DAWN HELEOSII型多角度激光散射仪(配备Optilab T-rEX型示差检测器)美国A g i l e n t公司;AV 6 0 0核磁共振仪 德国Bruker公司;JSM-6930LV扫描电镜 日本NTC公司;Multskan Go全波长读数仪 美国Thermo公司。
1.3 方法
1.3.1 CMP的合成
采用二次碱化法[12],称取一定量脱脂后的茯苓多糖于锥形瓶中,倒入一定量的不同体积分数的乙醇,在不同温度下,搅拌溶胀0.5 h,再加入固体氢氧化钠,继续搅拌碱化反应2 h,再向锥形瓶中加入同样质量的氢氧化钠和一定质量的固体醚化试剂一氯乙酸,继续进行搅拌。结束反应后,混合物用冰醋酸调节pH值到6.0±0.2,随后进行抽滤,用80%乙醇溶液洗涤至滤液中无Cl-,固体用50 ℃烘箱烘干至质量恒定,得到CMP。
1.3.2 单因素试验
固定反应时间5 h、乙醇体积分数80%、反应物(茯苓多糖、氢氧化钠与一氯乙酸)物质的量比1∶3∶1.5,考察反应温度分别为50、55、60、65、70 ℃对CMP取代度的影响。固定反应温度60 ℃、乙醇体积分数80%、反应物物质的量比1∶3∶1.5,考察反应时间分别为3、4、5、6、7 h对CMP取代度的影响。固定反应温度60 ℃、反应时间5 h、反应物物质的量比1∶3∶1.5,考察乙醇体积分数分别为70%、75%、80%、85%、90%对CMP取代度的影响。固定反应温度60 ℃、反应时间5 h、乙醇体积分数80%,考察反应物物质的量比分别为1∶2∶1、1∶2.5∶1.25、1∶3∶1.5、1∶3.5∶1.75、1∶4∶2对CMP取代度的影响。
1.3.3 正交试验
根据单因素试验结果,每个因素选取3 个水平,以CMP取代度为考察指标,设计正交试验,见表1,并利用SPSS分析正交试验结果,确定最佳合成工艺,并进行验证。
表1 CMP改性正交试验因素与水平
Table 1 Factors and levels used in orthogonal array experiments on modification of carboxymethyl pachyman

images/BZ_78_224_762_1203_856.png1 1∶2.5∶1.25 75 4 55 2 1∶3∶1.5 80 5 60 3 1∶3.5∶1.75 85 6 65
1.3.4 CMP取代度的测定
采用铜盐络合滴定法[13]测定。其原理是基于CMP上的羧基官能团可以定量和铜离子发生沉淀反应,该法简便快速,准确可靠。
1.3.5 不同取代度CMP的结构表征
1.3.5.1 紫外-可见光谱分析
配制1.0 mg/mL的不同取代度的CMP溶液,用超纯水作参比,用UV-2100型紫外-可见分光光度计在200~800 nm波长条件下进行扫描[14]。
1.3.5.2 红外光谱分析
准确称取不同取代度的CMP 10 mg,与已干燥的500 mg KBr混合,在玛瑙研钵中研磨均匀,取50 mg研磨后的粉末进行压片,利用Nexus 470 FT-IR傅里叶变换红外光谱仪于4 000~400 cm-1波数范围内进行扫描,分析CMP的特征基团[15]。
1.3.5.3 Zeta电位与粒径分析
Zeta电位是指剪切面的电位,是表征分散体系稳定性的重要指标。用去离子水将不同取代度的CMP配制成质量浓度为0.5 mg/mL的溶液,于Zetasizer Nano ZS纳米粒度电位分析仪上测定CMP的Zeta电位,测量温度25 ℃,每组数值重复3 次取平均值。将不同取代度的CMP配制成0.5 mg/mL的多糖溶液,于Zetasizer Nano ZS纳米粒度电位分析仪上测定CMP的粒径分布,测量温度25 ℃,每组数值重复3 次取平均值[16]。
1.3.5.4 总糖含量测定
采用苯酚-硫酸法测定总糖含量[17],准确称取0.100 0 g葡萄糖(105 ℃烘干恒质量),配成10 mg/mL的葡萄糖溶液,再吸取上述溶液1.0 mL用蒸馏水定容至100 mL,得到0.100 0 mg/mL葡萄糖标准溶液。精密量取上述标准溶液0、0.5、1、1.5、2、2.5、3、3.5 mL于25 mL比色管中,补加蒸馏水至5 mL,摇匀。分别吸取1 mL供试液于具塞试管中,用苯酚-硫酸法在波长490 nm处测紫外吸光度,记录数据,制作标准曲线。将不同取代度CMP样品溶于水,配成适当质量浓度的供试样品溶液,吸取1 mL样品溶液,依照上述显色条件,于波长490 nm处测定吸光度,根据葡萄糖标准曲线换算CMP中的葡萄糖质量浓度,根据式(1)计算CMP中总糖质量分数:
式中:c为供试液中葡萄糖质量浓度/(mg/mL),由标准曲线换算所得;b为稀释倍数;V为样品总体积/mL;m为样品质量/mg。
1.3.5.5 蛋白含量测定
采用考马斯亮蓝法[18]测蛋白。准确称取10.00 mg牛血清白蛋白标准品,用蒸馏水定容至10 mL,配制成1 mg/mL的蛋白质储备液,吸取上述溶液1 mL,定容至10 mL,配制成0.1 mg/mL的蛋白质标准溶液,备用。分别吸取蛋白质标准溶液0、0.03、0.06、0.12、0.24、0.48、0.72、0.84、0.96 mL于10 mL比色管,补充蒸馏水至1 mL,加入5 mL考马斯亮蓝贮备液,摇匀,静置5 min,于595 nm波长处测紫外吸光度,记录数据,绘制标准曲线。配制适当质量浓度的CMP溶液,吸取1 mL测定吸光度,代入标准曲线计算蛋白含量。
1.3.5.6 热稳定性分析
差式扫描量热分析:称取样品6~10 mg,于铝坩埚中压紧,以空铝盒为参比,升温速率10 ℃/min,温度范围20~350 ℃。在N2中进行测定[19]。
1.3.5.7 分子质量测定
采用凝胶色谱与多角度激光光散射联用仪检测不同取代度CMP的分子质量[20]。将CMP样品用0.1 mol/L NaNO3配制成质量浓度为2.0 mg/mL的溶液,经0.45 μm微孔滤膜过滤,进样量200 μL。色谱条件:PL aquagel-OH MIXED色谱柱(7.5 mm×300 mm,8.0 μm),检测温度25 ℃,流速0.8 mL/min。
1.3.5.8 单糖组成分析
采用气相色谱法分析不同取代度CMP样品的中性单糖组成[21]。
CMP样品水解及衍生化:称取10 mg干燥样品于具塞试管中,加入3 mol/L三氟乙酸溶液4 mL,使多糖完全溶解后密封,于110 ℃烘箱水解6 h,向多糖水解液中少量多次加入甲醇并减压蒸干,至三氟乙酸被完全蒸出。再分别准确称取6 种单糖标准品各10 mg,向样品水解物和单糖标准品中再分别加入10 mg盐酸羟胺、1.5 mg肌醇和1.0 mL吡啶并混合均匀,封口后于90 ℃条件下水浴30 min,冷却至室温后加入乙酸酐0.50 mL,90 ℃条件下继续反应30 min。冷却后经0.45 μm微孔滤膜过滤并进样。
气相色谱条件:H P-5石英毛细管柱(30 m×0.53 mm,0.32 μm);氢火焰离子检测器;气化室温度250 ℃;检测器温度270 ℃;升温程序:初始温度190 ℃,保持3 min,以5 ℃/min升温至240 ℃,保持20 min;载气N2;氮气流量50 mL/min;氢气流量30 mL/min;空气流量50 mL/min;分流比30∶1;进样量1 μL。
1.3.5.9 核磁共振波谱分析
上样质量浓度20 mg/mL,茯苓多糖以氘代二甲基亚砜为溶剂,CMP以D2O为溶剂,在600 MHz核磁共振谱仪上测定,参数如下:探针温度60 ℃;扫描次数16;空扫次数0 次;脉冲角度30°;弛豫延迟时间1.0 s。
1.3.5.10 扫描电镜的超微结构分析
取少量干燥的茯苓多糖及CMP粉末,用双面导电胶将样品黏到样品台,用溅射镀膜法进行镀金处理,厚度15 nm,在电压15 kV,高真空条件下使用扫描电镜对样品进行微观形貌分析[22]。
1.3.6 不同取代度CMP的抑菌活性
抑菌实验用96 孔板微量二倍稀释法[23],挑取单菌落置于LB液体培养基,37 ℃摇床培养至对数期。活化好之后,根据麦氏比浊法0.5号管,用MH培养基将菌液浓度调节至108 CFU/mL,再稀释10 倍。将不同取代度的CMP配制为20 mg/mL样液,LSPC配制为10 mg/mL样液,将LSPC和CMP按1∶1比例(m/m)混合,在96 孔板中加入200 µL样液,采用二倍稀释法将每种样品稀释为8 个梯度,之后再加入100 µL MH培养基,10 µL菌液,使每个孔最终菌浓度为5×105 CFU/mL,每种样品质量浓度为10~0.078 125 mg/mL。茯苓多糖以无菌二甲基亚砜为溶剂,以同等质量浓度的二甲基亚砜为对照。样品对照组以培养基代替菌液,阴性对照用培养基代替样品溶液,阳性对照用苄氨青霉素代替样品溶液。每个质量浓度设置3 个平行,于37 ℃培养箱中培养12 h,于全波长读数仪上测定其吸光度。按式(2)计算抑制率:
式中:A0为空白培养基吸光度;AS为样品对照组吸光度。
2 结果与分析
2.1 CMP制备的单因素试验结果
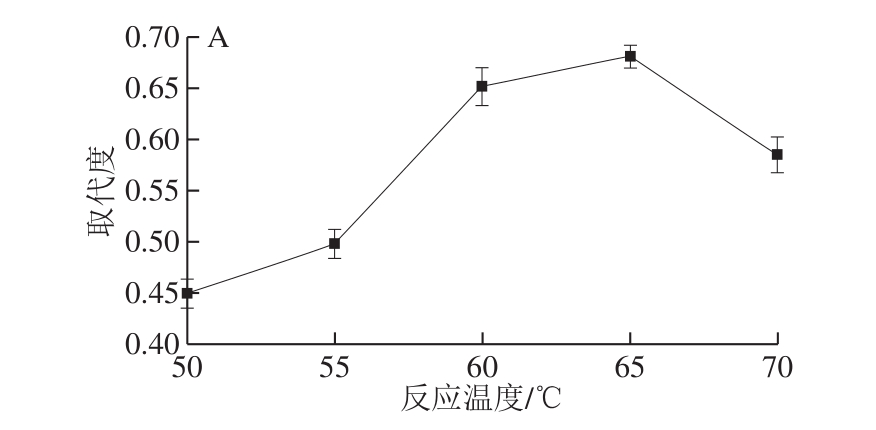
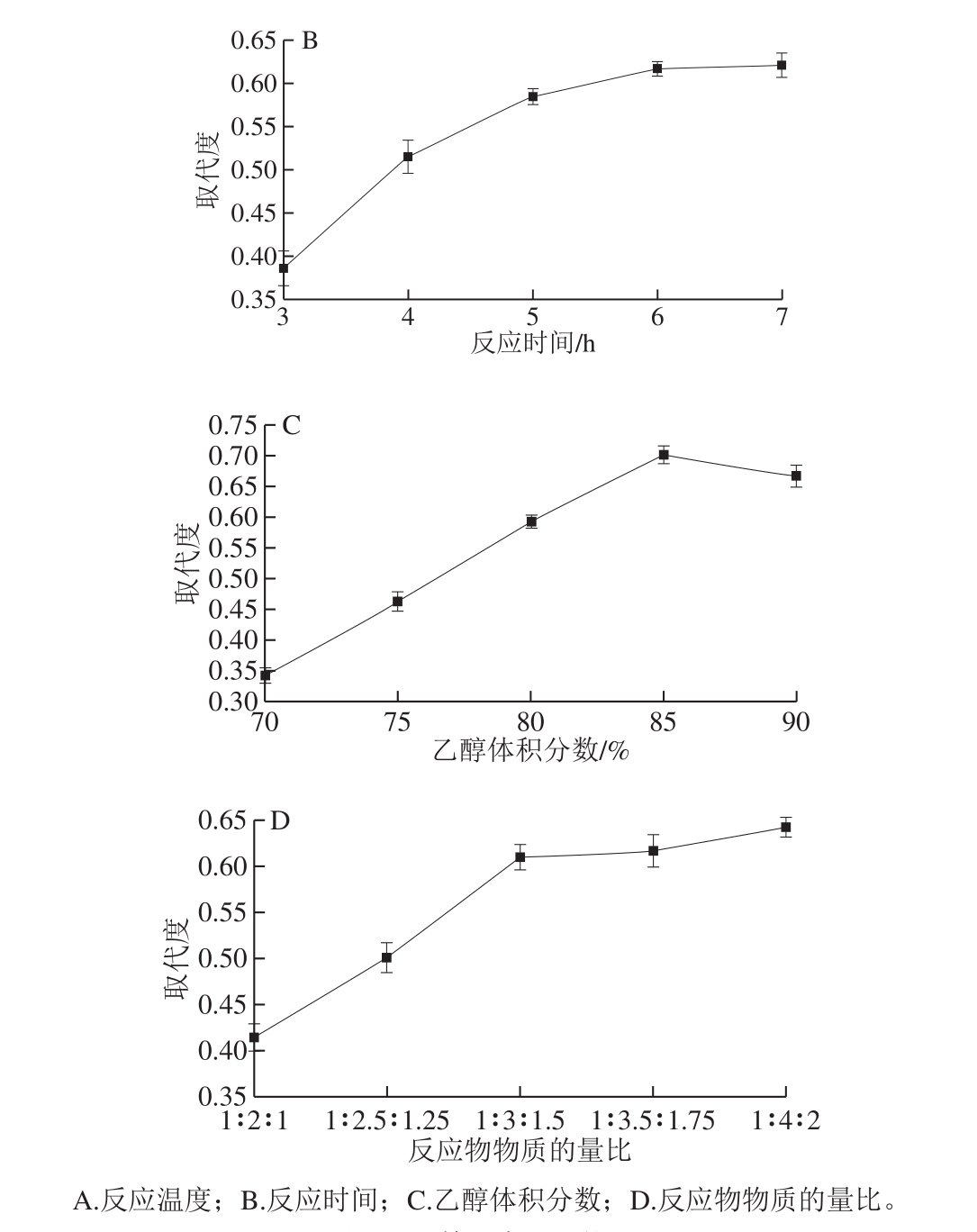
图1 单因素试验结果
Fig. 1 Results of one-factor-at-a-time experiments
如图1A所示,在一定的温度范围内,羧甲基的取代度先上升后下降,当反应温度到65 ℃时,羧甲基的取代度最高。结果表明,提高反应温度可以促进羧甲基化反应,但温度过高会破坏多糖的结构[24],导致羧甲基化程度降低,因此,CMP达到最高取代度时合成的最佳反应温度为65 ℃。如图1B所示,随着反应时间的延长,羧甲基取代度也随之增高,在5 h后增加速度减缓,6 h后趋于平稳。反应时间的延长有助于多糖充分溶胀,但从节能环保的角度出发,选择6 h作为CMP的最佳反应时间。如图1C所示,在一定的乙醇体积分数范围内,羧甲基取代度随着乙醇体积分数的增加而增大,在乙醇体积分数为85%时,羧甲基取代度达到最大值,但继续增加乙醇体积分数,羧甲基取代度反而降低。这是因为羧甲基取代反应的实质是氢氧化钠和一氯乙酸反应生成的氯乙酸钠进攻茯苓多糖的活性中心,当乙醇体积分数较高时,氢氧化钠的浓度增大,进攻活性中心的反应更剧烈,反应产物取代度也较高而当乙醇体积分数过高时,少量水分使得醚化试剂向茯苓多糖活性中心迁移的速率下降,取代度也随之下降,因此,CMP合成的最佳乙醇体积分数为85%。如图1D所示,羧甲基的取代度在一定范围内稳步上升,当反应物物质的量比从1∶2∶1变为1∶3∶1.5时,羧甲基取代度快速增大,随后继续增加反应物物质的量比水平时,羧甲基取代度变化平缓。这是因为氢氧化钠和一氯乙酸达到一定浓度时会发生副反应[25],反应效率随之下降,因此,CMP合成的最佳反应物茯苓多糖、氢氧化钠、一氯乙酸的物质的量比为1∶3∶1.5。
2.2 正交试验结果
2.2.1 正交试验设计与结果
在单因素试验结果基础上,考察反应物物质的量比(A)、乙醇体积分数(B)、反应时间(C)、反应温度(D)对茯苓多糖羧甲基化取代度的影响,结果见表2。各因素对取代度的影响由大到小依次为A>D>B>C,反应的最优组合为A3B2C1D3,因此,反应的最佳条件为反应物物质的量比1∶3.5∶1.75、乙醇体积分数80%、反应时间4 h、反应温度65 ℃。
表2 CMP改性工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for optimization of modification of carboxymethyl pachyman
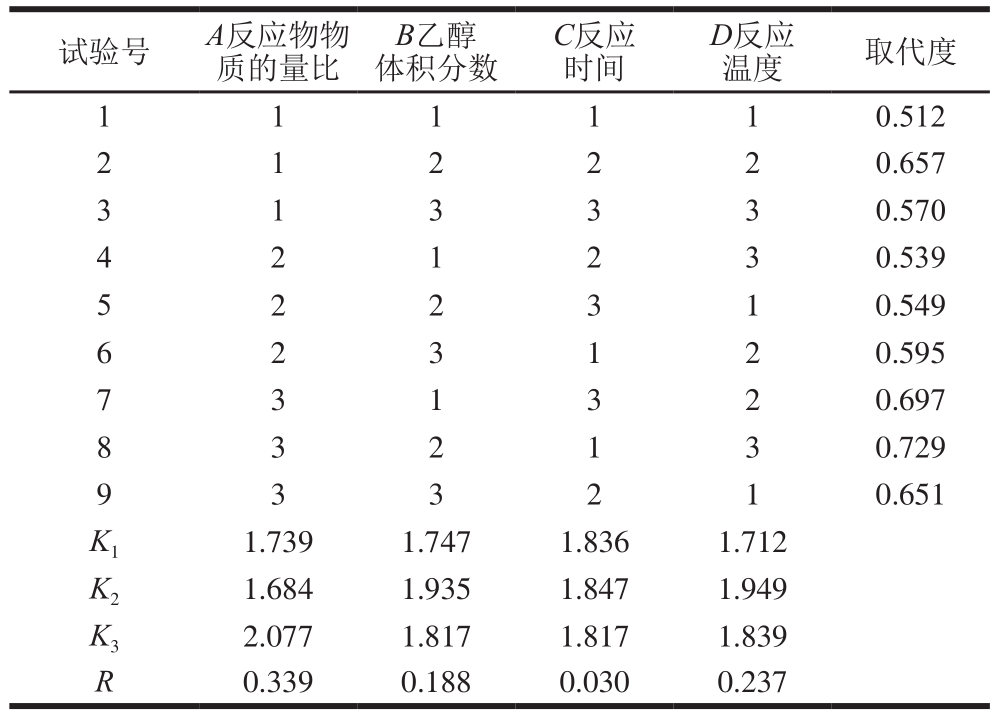
试验号 A反应物物质的量比B乙醇体积分数C反应时间D反应温度 取代度1 1 0.512 2 1 2 2 2 0.657 1 1 1 3 3 0.570 4 2 1 2 3 0.539 1 3 3 5 2 2 3 1 0.549 6 2 3 1 2 0.595 7 2 0.697 8 3 2 1 3 0.729 3 1 3 3 3 2 1 0.651 K1 1.739 1.747 1.836 1.712 K2 1.684 1.935 1.847 1.949 K3 2.077 1.817 1.817 1.839 R 0.339 0.188 0.030 0.237 9
2.2.2 验证实验
在理论最优条件A3B2C2D2下进行3 次平行实验,取代度分别为0.639、0.617、0.651,平均取代度为0.636,在正交试验中最优反应条件A3B2C1D3下进行了3 次平行实验,取代度分别为0.724、0.729、0.718,平均取代度为0.724,要高于理论最优条件A3B2C2D2下的0.636,因此,选择实验A3B2C1D3为最优取代工艺。
2.3 不同取代度CMP的制备
正交试验优化条件下得到的CMP的取代度普遍较高(>0.5),为增大对CMP取代度的研究范围,选用单因素与正交试验中制备CMP的反应条件,通过控制反应条件,制备6 个不同取代度的CMP。CMP-1:反应温度50 ℃、反应物物质的量比1∶3∶1.5、反应时间5 h、乙醇体积分数70%,取代度为0.350;CMP-2:反应温度60 ℃、反应物物质的量比1∶3∶1.5、反应时间5 h、乙醇体积分数70%,取代度为0.448;CMP-3:反应温度60 ℃、反应物物质的量比1∶3∶1.5、反应时间4 h、乙醇体积分数80%,取代度为0.501;CMP-4:反应温度60 ℃、反应物物质的量比1∶3∶1.5、反应时间5 h、乙醇体积分数80%,取代度为0.591;CMP-5:反应温度60 ℃、反应物物质的量比1∶3∶1.5、反应时间5 h、乙醇体积分数90%,取代度为0.666;CMP-6:反应温度65 ℃、反应物物质的量比1∶3.5∶1.75、反应时间4 h、乙醇体积分数80%,取代度为0.728。
2.4 不同取代度CMP理化性质的分析
2.4.1 紫外-可见光谱分析
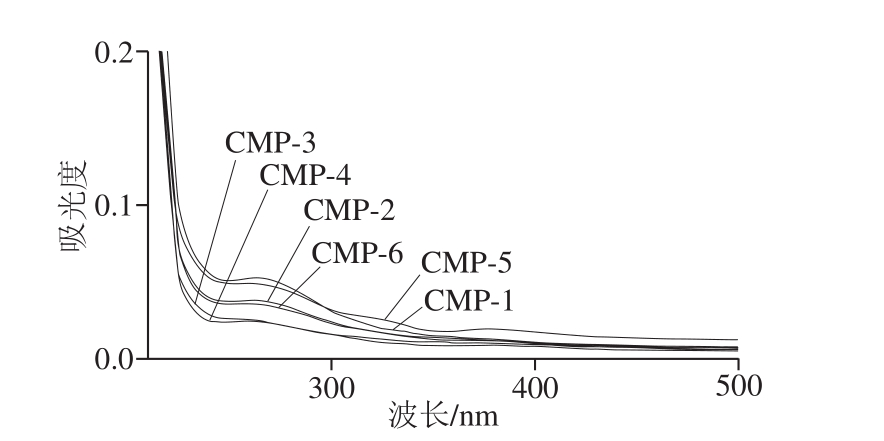
图2 不同取代度CMP紫外-可见光谱图
Fig. 2 UV-visible absorption spectra of CMP with different substitution degrees
如图2所示,CMP在波长200 nm处有多糖的特征吸收峰,而在波长280 nm附近处有弱吸收峰,说明CMP含有少量蛋白质,为避免除蛋白造成对多糖的损失,本实验暂未进行除蛋白研究,蛋白含量由考马斯亮蓝法测定。
2.4.2 红外光谱分析
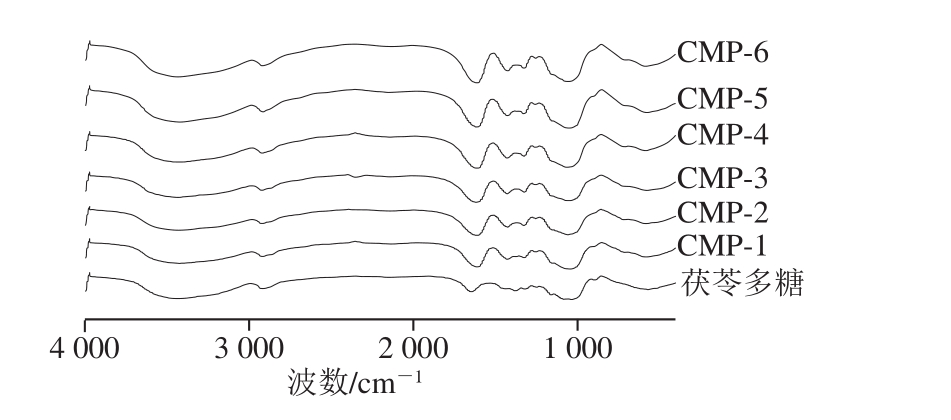
图3 茯苓多糖、CMP的红外光谱
Fig. 3 IR spectra of pachyman and CMP
如图3所示,茯苓多糖和CMP在2 900 cm-1附近处均有典型的多糖特征吸收峰(C—H),在3 700~3 000 cm-1处,较宽的吸收峰是羟基(—OH)的缔合峰,1 640 cm-1(C=O的非对称伸缩振动)和1 420 cm-1(次甲基的伸缩振动)附近处是羧甲基的特征吸收峰,说明发生了羧甲基化反应。890 cm-1附近为β-吡喃糖特征峰,从图3可看出,890 cm-1处,茯苓多糖的特征峰最为明显,CMP-1稍弱,CMP-2~CMP-6几乎没有β-吡喃糖特征峰。结果表明取代度越高,峰强度越大,表明羧甲基化程度越高,β-吡喃糖特征峰逐渐减弱直至消失。
2.4.3 Zeta电位与粒径分析
如图4A所示,不同取代度的CMP始终带负电荷,说明CMP属于阴离子多糖,同样表明羧甲基化成功。随着取代度的上升,CMP电位的绝对值也不断增大,证明CMP所带的电荷随着取代度的增加而增大。从电位层面分析,CMP是阴离子多糖,并且其溶液的稳定性随着取代度的增大而增大。有研究证实抗菌剂的抗菌活性与其Zeta电位有关[26],抗菌剂电荷分布可能会进一步影响细菌细胞壁的电位分布。
如图4B所示,随着取代度的增加,CMP的粒径先增大后减小。羧甲基基团的引入,一方面使得CMP的结构变得舒展,另一方面,较高的取代度有助于发生聚合。Chen Lingyun等[27]的研究证明羧甲基壳聚糖在水溶液中有很强的聚集性,其聚集行为取决于其取代度。取代度在0.501之前,粒径随着取代度的增加而急剧增大。然而,在水溶液中,CMP带有负电荷,且取代度越高,电位绝对值越高,因此,颗粒间静电斥力增强,使CMP在水溶液中的聚集行为减弱,多糖链压紧收缩,所以在取代度大于0.501之后,粒径又开始大幅减小。
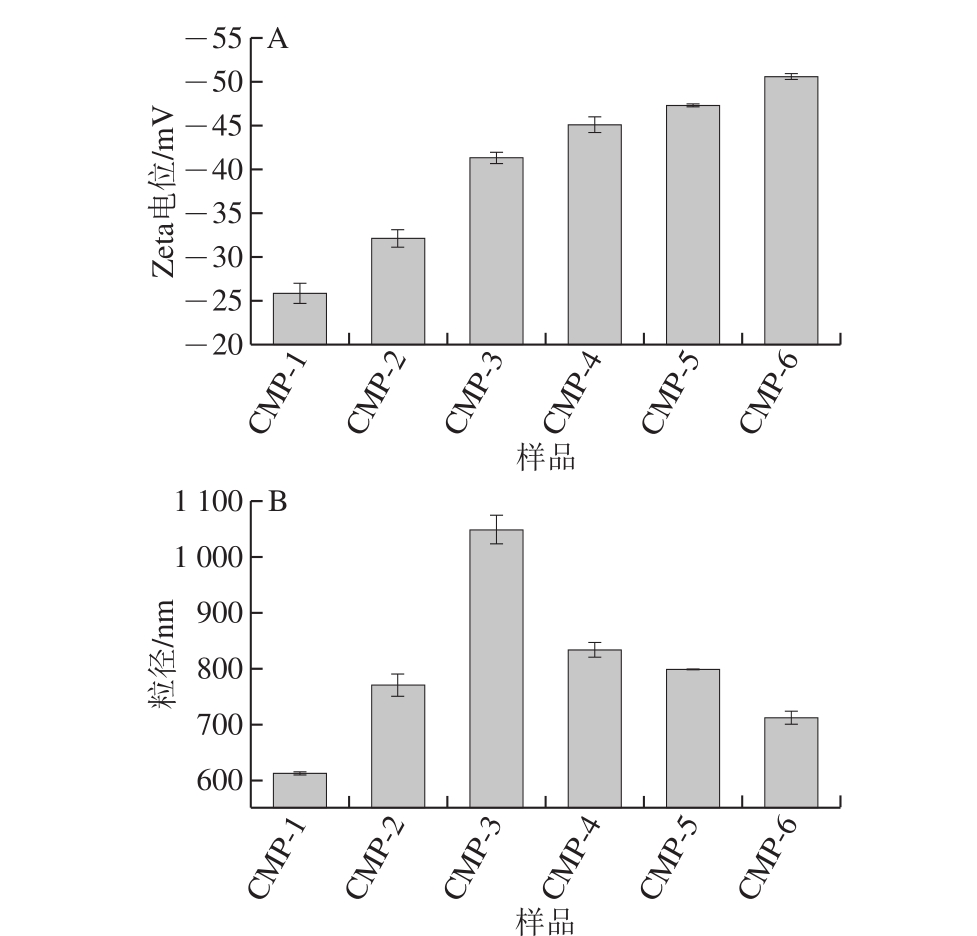
图4 不同取代度CMP溶液的Zeta电位(A)与粒径(B)分析
Fig. 4 Zeta potential (A) and particle size (B) analysis of CMP solutions with different substitution degrees
2.4.4 不同取代度CMP中的中性糖组成和蛋白含量分析
表3 不同取代度CMP的总糖含量与蛋白含量
Table 3 Total sugar and protein contents of CMP with different substitution degrees
images/BZ_81_201_2670_1178_2710.png总糖质量分数/% 81.95 76.76 74.56 71.57 65.46 56.72 89.39蛋白质量分数/% 2.49 1.36 0.93 0.87 1.58 1.01 2.53
由标准曲线得总糖回归方程y=9.38x+0.088(R2=0.997 8)。如表3所示,随着取代度的增高,CMP中总糖含量下降。有研究证实茯苓多糖羧甲基化后,β-吡喃糖特征峰变弱,β-糖苷键C3质子峰消失[28]。本实验也由红外光谱与核磁波谱分析结果得到了证实。
由标准曲线得蛋白回归方程y=6.110 5x+0.009 4(R2=0.998 3)。如表3所示,蛋白含量变化与CMP的取代度无明显关系,且所含蛋白很少。
2.4.5 不同取代度CMP的热稳定性分析
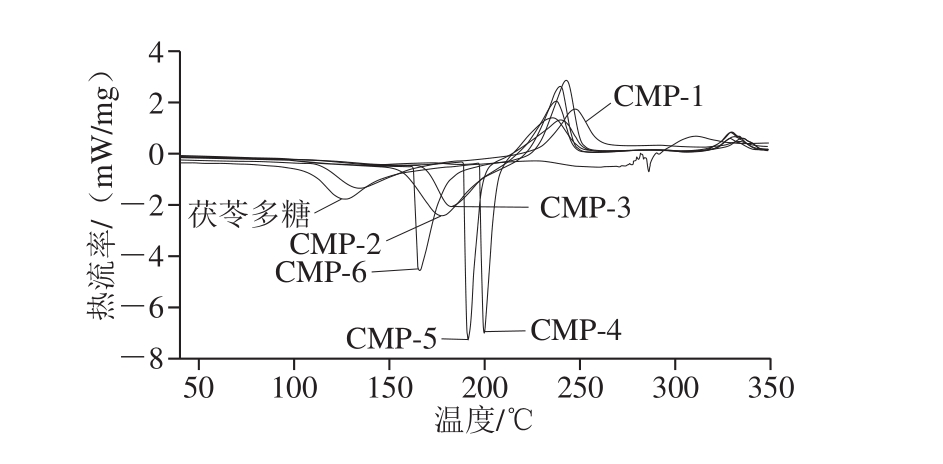
图5 不同取代度CMP的热稳定性分析
Fig. 5 DSC analysis of CMP with different substitution degrees
由图5可知,未经羧甲基化的茯苓多糖在127 ℃左右出现一个吸热峰,对应样品的晶区熔融;在311 ℃左右出现一个放热峰,对应于样品的受热碳化。相应的,所有经过修饰后的CMP的吸热峰和放热峰对应茯苓多糖,均向右移动,可见,羧甲基改性提高了茯苓多糖的热稳定性。其中,230~260 ℃是羧甲基的分解峰,该温度范围内,羧甲基发生断裂,脱去羧基和羰基[29]。茯苓粉在此温度范围内无峰,也说明了羧甲基反应的成功。值得注意的是不同取代度的CMP热稳定性也有较大差别,在一定范围内,取代度增高,CMP的热稳定性也增高,当取代度超过0.591时,CMP的热稳定性反而随着取代度的增高而降低。这可能是因为取代度的升高使得CMP颗粒破碎,发生裂解。
2.4.6 分子质量分布
表4 不同取代度CMP的分子质量
Table 4 Molecular mass distribution of CMP with different substitution degrees
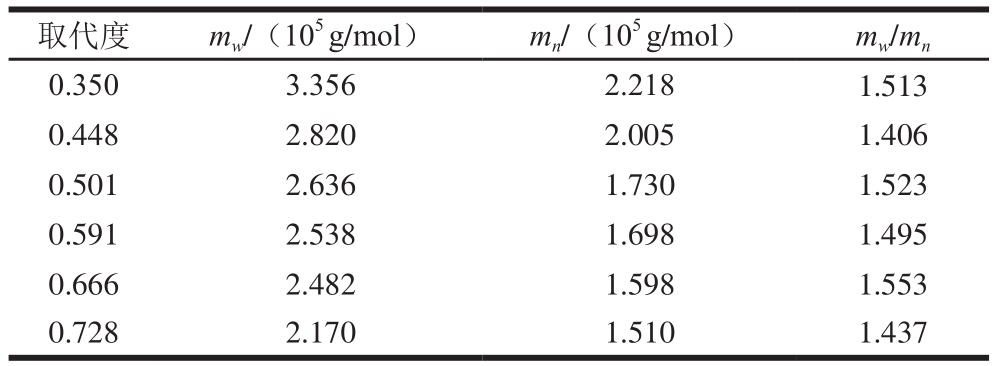
images/BZ_81_1276_2288_2256_2338.png0.350 3.356 2.218 1.513 0.448 2.820 2.005 1.406 0.501 2.636 1.730 1.523 0.591 2.538 1.698 1.495 0.666 2.482 1.598 1.553 0.728 2.170 1.510 1.437
由表4可知,样品的mw、mn随取代度的增加而降低。这可能与衍生化反应条件的剧烈程度有关,反应条件越剧烈,茯苓多糖的分子结构被破坏的越严重,最终导致分子链的断裂从而导致分子质量的减少[30]。
2.4.7 气相色谱分析
如图6所示,该多糖为均一多糖,仅由D-葡萄糖这一种单糖组成。
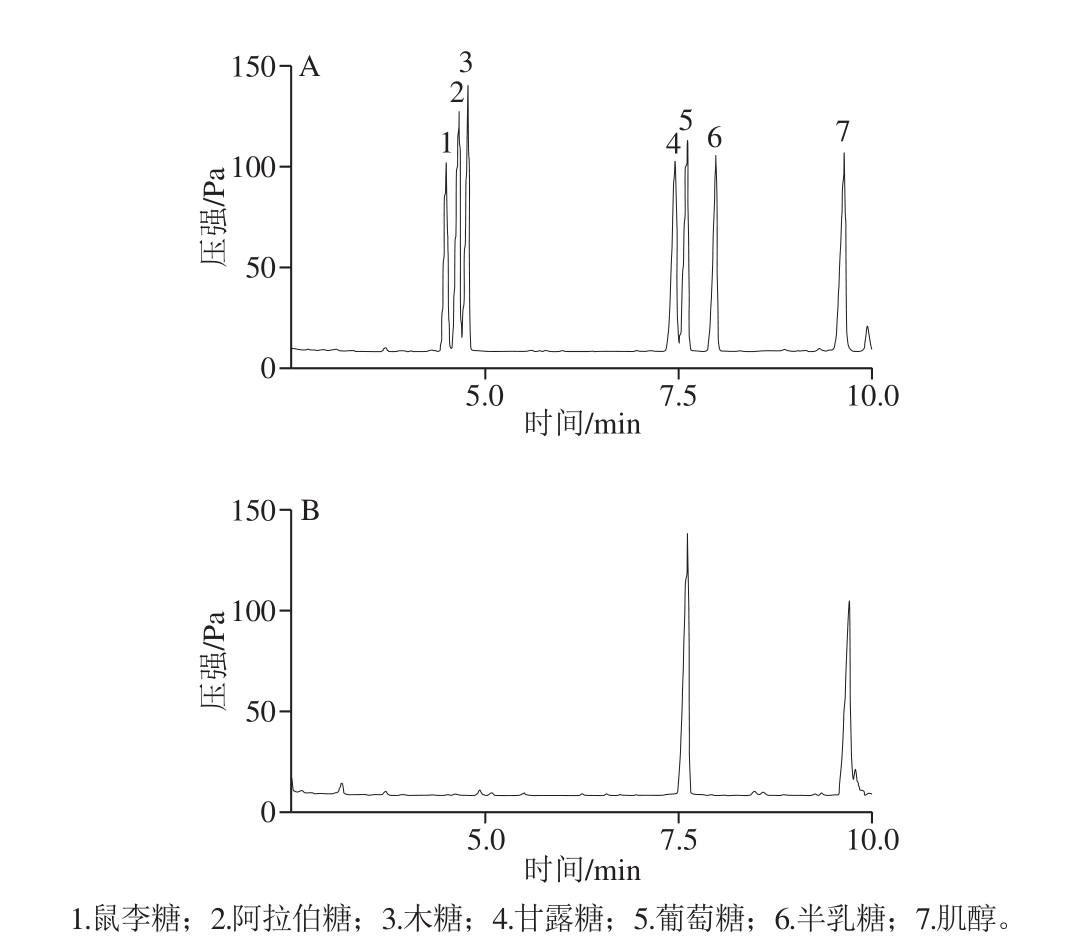
图6 标准单糖(A)与CMP-6(B)的气相色谱图
Fig. 6 GC chromatograms of mixed standards of monosaccharides (A) and CMP-6 (B)
2.4.8 核磁共振分析
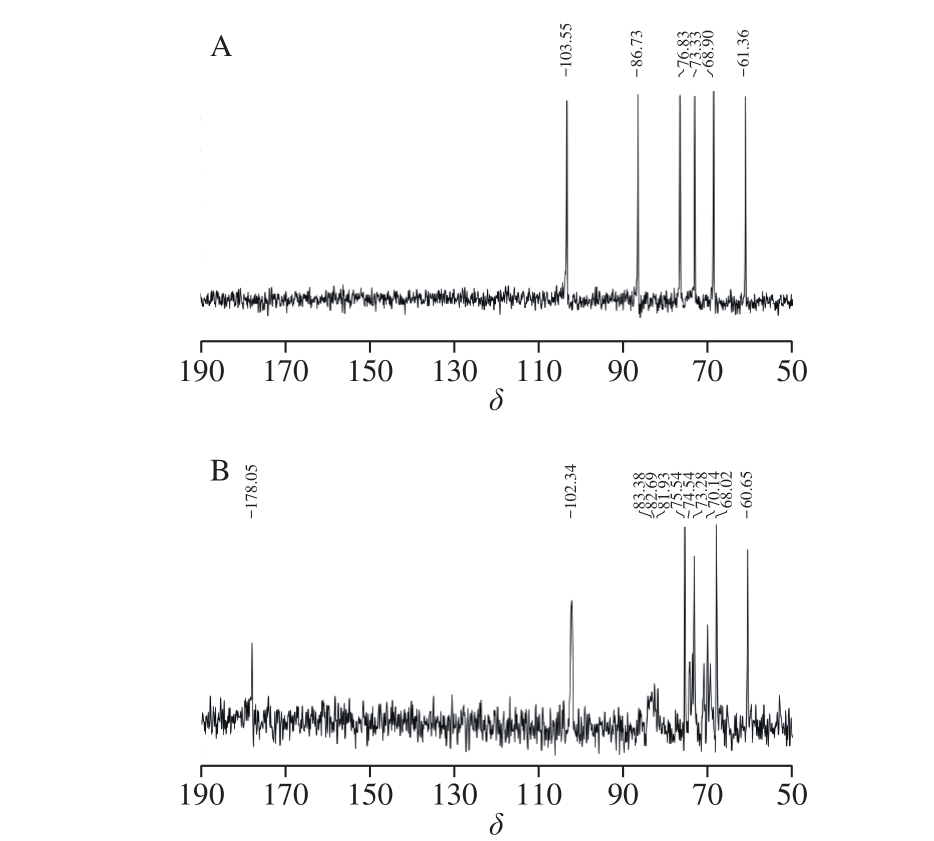
图7 茯苓多糖(A)与CMP-6(B)13C NMR谱图
Fig. 7 13C NMR spectra of pachymaran (A) and CMP-6 (B)
表5 样品与葡聚糖残基的13C NMR的化学位移
Table 5 Chemical shifts of pachymaran, CMP and dextran residues in 13C NMR spectra
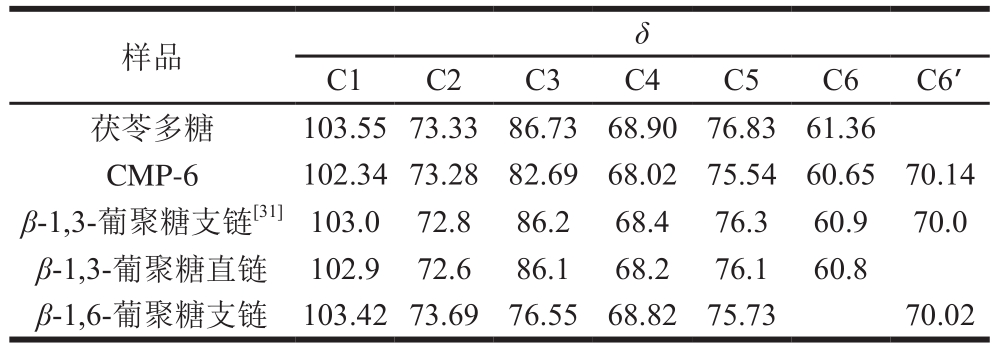
images/BZ_82_224_2636_1201_2730.png茯苓多糖 103.55 73.33 86.73 68.90 76.83 61.36 CMP-6 102.34 73.28 82.69 68.02 75.54 60.65 70.14 β-1,3-葡聚糖支链[31]103.0 72.8 86.2 68.4 76.3 60.9 70.0 β-1,3-葡聚糖直链 102.9 72.6 86.1 68.2 76.1 60.8 β-1,6-葡聚糖支链 103.42 73.69 76.55 68.82 75.73 70.02
如图7A所示,6 个显著的葡萄糖残基上C的化学位移峰。在δ 100~115之间,仅有1 个异头碳的峰,茯苓多糖C1的δ为103.55,说明只有一种单糖,根据出峰的位置和相关文献报道[31]值,确定为葡萄糖。而羧甲基化后的茯苓多糖(CMP-6)C1的δ相对于改性前的茯苓多糖,从δ 103.55移动到了δ 102.34,也只显示了1 个异头碳的信号峰(图7B)。表明茯苓多糖与CMP-6都只存在唯一一种糖残基[32]。CMP-6其余的13C-NMR谱图中的δ与文献[31]报道的β-1,3-葡聚糖支链十分一致。图7B中,原未改性的多糖中C3(δ 86.73)峰消失,而在δ 82~85出现的一系列信号峰为C2、C4、C6取代对C3的影响[33]。说明取代反应在C2、C4、C6位上都有发生。图7B中,C5信号峰从δ 76.83位移至δ 75.54,说明羧甲基衍生化反应主要发生在C6位羟基,并使C5的峰略向高场移动[34]。图7B中部分原茯苓多糖的信号峰由于羧甲基化而向低场移动,从C6(δ 61.36)位移至δ 70.14(C6’),这是由于在C6上—CH2COOH基团取代了羟基,C6从δ 61.36向低场(左区域)转移[33]。改性后茯苓多糖的C4部分信号峰从δ 68.90移至δ 68.02,C2部分信号峰从δ 73.33移至δ 73.28,进一步说明衍生化反应也发生在C4和C2羟基位。δ 178.05的新信号峰为羧甲基上C=O的碳信号。综上分析可认为,茯苓多糖与CMP-6主要由β-1,3-葡聚糖组成,从这些峰的面积来看,对应取代量,羧甲基的引入程度为C6>C4>C2。
2.4.9 超微结构分析


图8 茯苓多糖及不同取代度CMP的扫描电镜图
Fig. 8 SEM pictures of CMP with different substitution degrees and pachymaran
由图8可知,未经处理的茯苓多糖颗粒间隙大,表面光滑;羧甲基衍生化后,颗粒间较为紧实,且随着取代度增加,颗粒间聚集程度增大,结构越紧密。这可能与多糖结构中的羧甲基根有关,由于羧甲基根的极性与离子强度较大,所以分子间相对作用力较大,导致颗粒形成聚集体[35]。并且随着取代度越大,颗粒表面越粗糙,并伴随着裂痕的出现,当取代度在0.591时,颗粒破碎,出现一定程度的裂解,在取代度为0.728时,裂解情况更加严重,这说明羧甲基化影响茯苓多糖的结构排列,合成过程中剧烈的反应条件造成的形态破坏是合理的,从扫描电镜分析可知,CMP-6的裂解情况最为严重,影响了茯苓多糖的结构排列,所以,当取代度超过0.591时,CMP的热稳定性反而降低。
2.5 不同取代度CMP对金黄色葡萄球菌、大肠杆菌、沙门菌的抑菌作用
如图9所示,同一取代度时,抑菌活性与多糖呈浓度依赖性,多糖质量浓度越高,抑菌效果越好,且同一质量浓度下,不同取代度CMP的抑菌率不同,羧甲基化程度越高,抑菌活性越大。结果表明,在CMP质量浓度为10 mg/mL时,取代度为0.728的CMP对金黄色葡萄球菌的抑制率能达到60.91%,取代度为0.350的CMP在10 mg/mL时对金黄色葡萄球菌的抑制率也能达到35.88%,这说明CMP对金黄色葡萄球菌有较好的抑菌效果,并且CMP的取代度是影响其抑菌性的重要指标之一。对大肠杆菌的抑制强度随着CMP取代度的增高而增强,最大抑菌率可以达到35.55%,在1.25 mg/mL之后趋于平缓,同时远低于同质量浓度的苄氨青霉素对大肠杆菌的抑制率,因此反映出CMP对大肠杆菌的抑制效果较差。而CMP对肠炎沙门菌最高的抑制率仅能达到7.80%,低质量浓度的CMP反而促进肠炎沙门菌的生长,阳性对照在低浓度时也无抑菌效果。而且取代度越低,促进肠炎沙门菌生长的情况越明显。这可能是由于肠炎沙门菌将多糖当作碳源。结果说明,CMP对肠炎沙门菌无抑菌效果。并且茯苓多糖对3 种菌无明显抑制效果,也不促进菌的增殖,说明茯苓多糖无体外抗菌作用。结果表明,CMP与LSPC混合物的抑菌效果要强于单独的LSPC,且能明显改善LSPC在低质量浓度下促进肠道菌增殖的负效应。如LSPC在0.04 mg/mL时,对金黄色葡萄球菌的增殖率为40%,而与CMP复配后,同样的浓度下,不同取代度CMP与LSPC混合物均不会使其增殖,相反,有明显的抑制效果,与CMP-6复配时其抑制率达到30%。高取代度的CMP与LSPC的复配物在低质量浓度下对肠炎沙门菌也无负效应,证实了取代度越高的CMP与LSPC的复配效果越好。综上表明,CMP的抑菌作用具有选择性,对革兰氏阴性菌的抑菌效果较弱,且抑菌所需要的质量浓度较大,实验室已证实多糖与多酚协同使用比单独的多糖或多酚抑菌效果更好[36],且能大大减少多糖用量,因此可以与多酚联合使用。
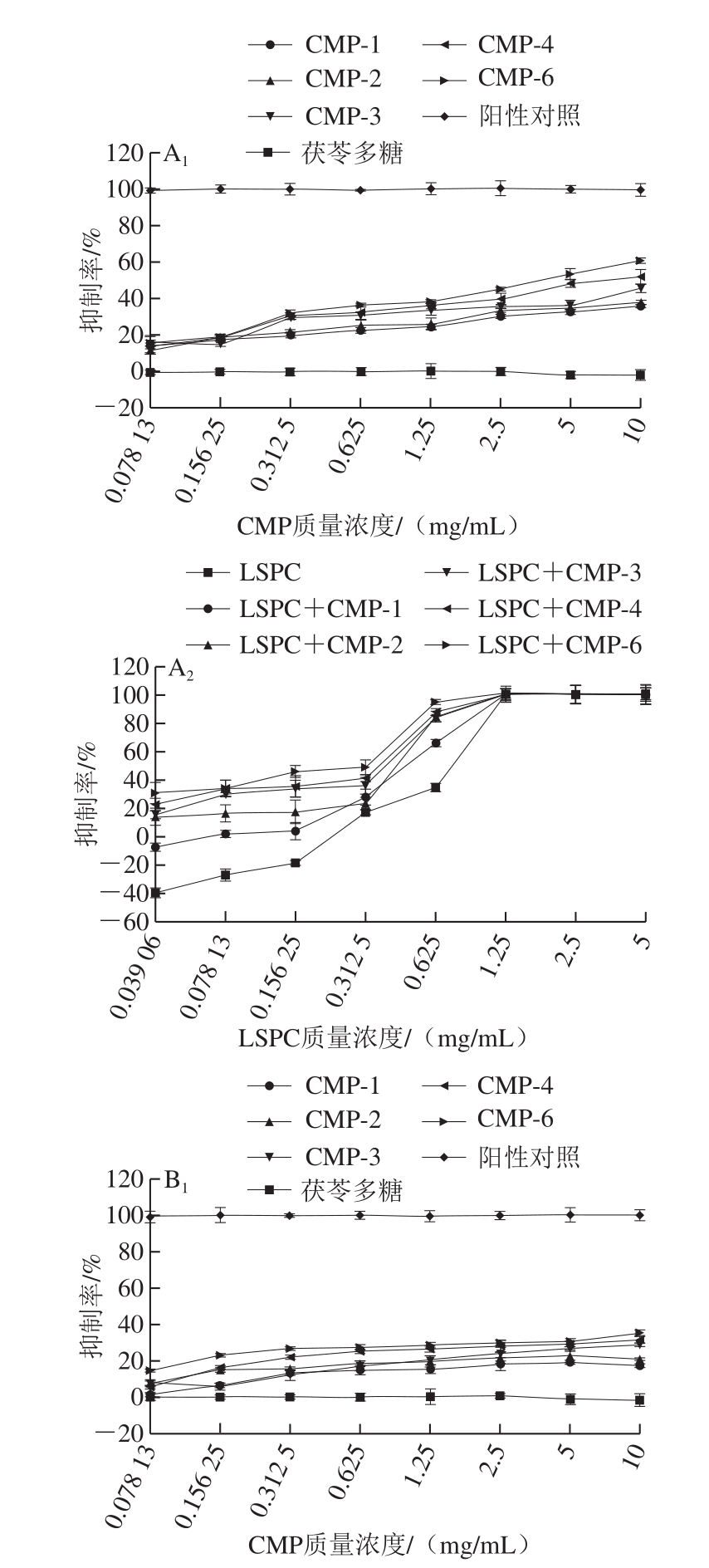
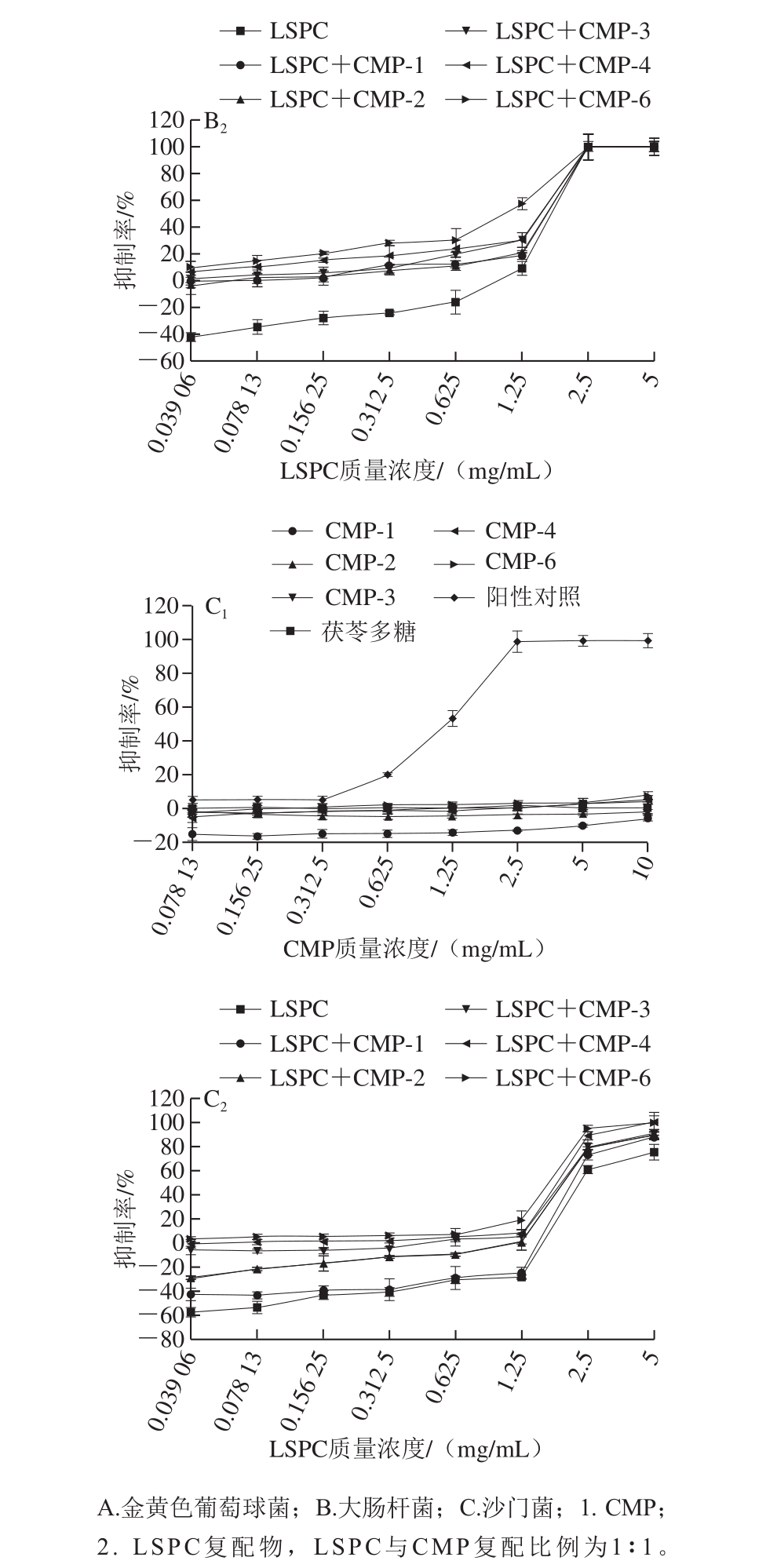
图9 CMP及LSPC复配物对金黄色葡萄球菌CMCC(B)26003、大肠杆菌NCTC12900、沙门菌BNCC103134的抑制率
Fig. 9 Inhibition rates of CMP and LSPC and their mixture against S. aureus CMCC(B)26003, E. coli NCTC12900 and Salmonella enteritis BNCC103134
3 结 论
通过单因素试验与正交试验设计探究CMP的最佳合成工艺为反应时间4 h、反应温度65 ℃、乙醇体积分数80%、反应物茯苓多糖-氢氧化钠-一氯乙酸物质的量比1∶3.5∶1.75;进行验证实验,得到CMP的平均取代度为0.724,优化工艺准确可靠。随后,通过控制反应条件制备出不同取代度的CMP,并对CMP-1~CMP-6进行理化性质鉴定和结构表征。
紫外扫描结果表明CMP含有少量蛋白,而蛋白含量与CMP的取代度无关。红外光谱分析表明,CMP具备多糖的特征吸收峰,Zeta电位分析与粒径分析结果表明CMP为阴离子多糖,且取代度越高,电位绝对值越高,粒径先增大后减小,溶液越稳定。中性糖分析结果表明,随着CMP取代度的增高,其中性糖含量下降。差示扫描量热分析结果表明其热稳定性在一定取代度范围内先增加后降低,扫描电镜分析与凝胶色谱分析表明CMP的取代度越大,空间结构越紧密,裂解情况越严重,从而导致其分子质量随取代度的增大而减小。结构分析显示茯苓多糖与CMP为以β构型的吡喃糖环,主要由β-1,3-葡聚糖组成,且衍生化反应主要发生在C6位羟基。
采用茯苓多糖及不同取代度的CMP、LSPC及其复配物对3 种食源性致病菌进行抑菌实验,结果表明,茯苓多糖没有抑菌作用,而CMP有抑菌作用,其取代度越高,其抑菌效果越好。与LSPC复配使用时能有效解决LSPC在低浓度促进肠道致病菌增殖的难题,且取代度越高,复配的效果越好。CMP对革兰氏阳性菌的抑菌能力高于革兰氏阴性菌。这可能是因为阳性菌的细胞膜比阴性菌敏感,取代度高的CMP水溶性及电位绝对值均较高,能破坏细菌的细胞膜,但抑菌作用需要浓度较高,因此需要对多糖与多酚协同抑菌作用及其可能的机制进行进一步的研究。
[1] 侯玮婷, 罗佳波. 复方茯苓多糖口服液抗肿瘤作用和免疫调节功能的初步研究[J]. 中药药理与临床, 2017(2): 80-83.
[2] SUN Y C. Biological activities and potential health benefits of polysaccharides from Poria cocos and their derivatives[J].International Journal of Biological Macromolecules, 2014, 68: 131-134. DOI:10.1016/j.ijbiomac.2014.04.010.
[3] 莫清. 茯苓多糖的化学修饰和生理性质的研究[D]. 杭州: 浙江理工大学, 2013.
[4] 程水明, 刘莹, 梅光明, 等. 羧甲基茯苓多糖的抗氧化活性研究[J].食品研究与开发, 2013, 34(3): 1-5.
[5] LIU X F, WANG X Q, XU X F, et al. Purification, antitumor and anti-inflammation activities of an alkali-soluble and carboxymethyl polysaccharide CMP33 from Poria cocos[J]. International Journal of Biological Macromolecules January, 2019, 127: 39-47. DOI:10.1016/j.ijbiomac.2019.01.029.
[6] HE P, DONG Z, WANG Q, et al. Structural characterization and immunomodulatory activity of a polysaccharide from Eurycoma longifolia[J]. Journal of Natural Products, 2019, 82(2): 169-176.DOI:10.1021/acs.jnatprod.8b00238.
[7] KAGIMURA F Y, DA CUNHA M A A, THEIS T V, et al.Carboxymethylation of (1→6)-β-glucan (lasiodiplodan): preparation,characterization and antioxidant evaluation[J]. Carbohydrate Polymers,2015, 127: 390-399. DOI:10.1016/j.carbpol.2015.03.045.
[8] WANG Y J, MO Q, LI Z N, et al. Effects of degree of carboxymethylation on physicochemical and biological properties of pachyman[J]. International Journal of Biological Macromolecules,2012, 51(5): 1052-1056. DOI:10.1016/j.ijbiomac.2012.08.022.
[9] WANG Y F, HOU G H, LI J L, et al. Structure characterization, modification through carboxymethylation and sulfation, and in vitro antioxidant and hypoglycemic activities of a polysaccharide from Lachnum sp.[J].Process Biochemistry, 2018, 72: 177-187. DOI:10.1016/j.procbio.2018.06.002.
[10] WANG J Y, ZHANG W J, TANG C E, et al. Synergistic effect of B-type oligomeric procyanidins from lotus seedpod in combination with water-soluble Poria cocos polysaccharides against E. coli and mechanism[J]. Journal of Functional Foods, 2018, 48: 134-143.DOI:10.1016/j.jff.2018.07.015.
[11] 杨焕治, 刘欣, 杨岚, 等. 不同构型羧甲基茯苓多糖(CMP)抗氧化活性研究[J]. 湖南师范大学自然科学学报, 2018, 41(5): 29-33.
[12] JIA F, LIU H J, ZHANG G G. Preparation of carboxymethyl cellulose from corncob[J]. Procedia Environmental Sciences, 2016, 31: 98-102.DOI:10.1016/j.proenv.2016.02.013.
[13] 黄静, 潘丽军, 郑志, 等. 一种快速准确测定羧甲基淀粉取代度的方法[J]. 食品工业科技, 2003, 24(3): 82-84. DOI:10.3969/j.issn.1002-0306.2003.03.035.
[14] 宋林珍, 朱丽云, 高永生, 等. 茶多糖的结构特征与降血糖活性[J].食品科学, 2018, 39(19): 169-175. DOI:10.7506/spkx1002-6630-201819025.
[15] 何婷婷, 柴军红, 钟读波, 等. 蒲公英活性成分提取工艺的优化、多糖红外表征及其抗氧化性[J]. 江苏农业科学, 2018, 46(11): 163-166.DOI:10.15889/j.issn.1002-1302.2018.11.043.
[16] 程萌, 齐军茹, 曹静. 水溶性豌豆多糖的提取及性能研究[J]. 中国粮油学报, 2017(10): 62-67; 97. DOI:10.3969/j.issn.1003-0174.2017.10.010.
[17] 张媛媛, 张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学, 2016, 37(4): 158-163. DOI:10.7506/spkx1002-6630-201604028.
[18] 王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工,2009, 23(3): 40-42. DOI:10.3969/j.issn.1008-1267.2009.03.016.
[19] GURIAN E, BELLICH B, CESARO A. Polysaccharide solutions and gels: isothermal dehydration study by dynamic calorimetric experiments with DSC[J]. Food Hydrocolloids, 2016, 61: 163-171.DOI:10.1016/j.foodhyd.2016.05.011.
[20] MCFADZEAN B, GROENMEYER G. Selective molecular weight adsorption from polydisperse polysaccharide depressants[J]. Minerals Engineering, 2015, 77: 172-178. DOI:10.1016/j.mineng.2015.03.009.
[21] 闫光玲, 张锋, 金娟, 等. 金银花多糖分子量及单糖组成研究[J].中国中医药信息杂志, 2019, 26(2): 102-106.
[22] ROMDHANE M B, HADDAR A, GHAZALA I, et al. Optimization of polysaccharides extraction from watermelon rinds: structure,functional and biological activities[J]. Food Chemistry, 2017, 216:355-364. DOI:10.1016/j.foodchem.2016.08.056.
[23] KHEMAKHEM I, ABDELHEDI O, TRIGUI I, et al. Structural,antioxidant and antibacterial activities of polysaccharides extracted from olive leaves[J]. International Journal of Biological Macromolecules, 2018,106: 425. DOI:10.1016/j.ijbiomac.2017.08.037.
[24] 白晨, 宋文荣, 杨剑飞, 等. 绣球菌子实体干燥条件与多糖保留率相关性研究[J]. 食品科学, 2012, 33(20): 119-122.
[25] 张金萍, 王敬文. 一步法制备羧甲基茯苓多糖的工艺研究[J].天然产物研究与开发, 2006(2): 291-294. DOI:10.3969/j.issn.1001-6880.2006.02.029.
[26] CHEN L C, KUNG S K, CHEN H H, et al. Evaluation of zeta potential difference as an indicator for antibacterial strength of low molecular weight chitosan[J]. Carbohydrate Polymers, 2010, 82(3): 913-919.DOI:10.1016/j.carbpol.2010.06.017.
[27] CHEN L Y, DU Y M, TIAN Z, et al. Effect of the degree of deacetylation and the substitution of carboxymethyl chitosan on its aggregation behavior[J]. Journal of Polymer Science, Part B (Polymer Physics), 2005, 43(3): 296-305. DOI:10.1002/polb.20212.
[28] 蒋先明, 石清东. 茯苓多糖与羧甲基茯苓多糖的结构表征[J]. 广西师范大学学报(自然科学版), 1996(3): 40-46.
[29] 马小涵, 刘雄, 郭婷, 等. 羧甲基化改性纳米甘薯渣纤维素的表征[J]. 食品与机械, 2017, 33(3): 37-41. DOI:10.13652/j.issn.1003-5788.2017.03.008.
[30] 刘彦涛, 张威伟. 微水固相法皂荚多糖胶羧甲基化改性[J]. 林产化学与工业, 2017, 37(4): 45-50. DOI:10.3969/j.issn.0253-2417.2017.04.007.
[31] 王艺峰. 茯苓菌核多糖及其衍生物的结构及生物活性[D]. 武汉: 武汉大学, 2004.
[32] WANG J G, ZHANG L N. Structure and chain conformation of five water-soluble derivatives of a β-D-glucan isolated from Ganoderma lucidum[J]. Carbohydrate Research, 2009, 344(1): 105-112.DOI:10.1016/j.carres.2008.09.024.
[33] JIN Y, ZHANG H B, YIN Y M, et al. Comparison of curdlan and its carboxymethylated derivative by means of rheology, DSC, and AFM[J]. Carbohydrate Research, 2006, 341(1): 90-99. DOI:10.1016/j.carres.2005.11.003.
[34] CHAKRAVORTY A, BARMAN G, MUKHERJEE S, et al. Effect of carboxymethylation on rheological and drug release characteristics of locust bean gum matrix tablets[J]. Carbohydrate Polymers, 2016, 144:50-58. DOI:10.1016/j.carbpol.2016.02.010.
[35] 原静. 古尼虫草多糖的化学修饰与活性研究[D]. 天津: 天津科技大学, 2011.
[36] WANG J Y, BIE M, ZHOU W J, et al. Interaction between carboxymethyl pachyman and lotus seedpod oligomeric procyanidins with superior synergistic antibacterial activity[J]. Carbohydrate Polymers, 2019, 212: 11-20. DOI:10.1016/j.carbpol.2019.02.030.