由于特殊的自然环境及自由的放牧方式,牦牛肉质鲜美、营养物质丰富,越来越引起国内外学术界和商业界人士的广泛关注。但是,由于肉及其制品在加工贮藏等过程中会不可避免受到温度、氧气和催化剂等外界因素的干扰,从而导致肉品质量下降,品质劣变严重[1]。在宰后肉品的成熟过程当中,肌肉蛋白的氧化会导致侧链氨基酸的氧化修饰,其中主要包括巯基氧化、芳香族羟基化和羰基的形成等化学变化[2]。肌原纤维蛋白的存在对肉品质构的形成具有至关重要的作用,并且蛋白质的羰基化和羧基化与肌原纤维蛋白功能受损具有密不可分的联系[3]。张丽等[4]通过研究肌肉蛋白氧化对肉品质的影响发现,肌红蛋白是肌肉中的天然组成成分,并被证实可以引发肌肉蛋白的氧化。早有研究证实,高铁肌红蛋白(metmyoglobin,MetMb)是牛肉肌纤维中肌红蛋白在低氧的情况下Fe2+转变为Fe3+所形成的一种物质,与此同时,MetMb含量的增加或减少也可以表征牛肉氧化程度的高低[5]。
研究表明,MetMb能够与H2O2作用产生氧络合铁色素和蛋白自由基。Xiong[6]和Ooizumi[7]等通过这种反应建立了模拟MetMb氧化的体系,在此体系中研究了MetMb对肌原纤维蛋白氧化的影响,并发现MetMb氧化体系对肌原纤维蛋白结构的影响很大,尤其是肌球蛋白。并且在与羟自由基氧化体系实验结果进行分析对比后发现,MetMb氧化体系能诱发更为剧烈的蛋白氧化。研究表明,过氧化氢能够与MetMb发生反应生成某些肌红蛋白前体物质,这种前体物质的性质相当不稳定,它能够以最快速度转变形成超铁肌红蛋白,而这种前体物质与超铁肌红蛋白都具有能够促进肉品中脂质氧化的强大能力[8]。Promeyrat等[9]通过研究发现,肌红蛋白含量的高低是预测肉品中羰基生成的一个重要的标志,这在一定程度上表明了肌红蛋白是肌原纤维蛋白羰基化的有效促进剂。Estévez等[10]研究发现,过氧化氢存在条件下,肌红蛋白比铜离子和铁离子等金属离子与过氧化氢的作用更能促进肌原纤维蛋白生成氧化产物,并且研究指出,肌红蛋白含量的高低可以影响脂肪氧化,与这种影响机理类似的是,在肌红蛋白氧化过程中会生成H2O2和羟自由基等活性氧物质,而这些物质可以进一步促进蛋白质发生氧化;与此同时,蛋白质的氧化产物MetMb同样具有促进蛋白质发生氧化的能力。Decker等[11]研究发现,三价铁与抗坏血酸作用能够积极地诱导肌原纤维蛋白氧化生成羰基化合物。陈骋[12]对牦牛肉肌红蛋白稳定性的研究发现,为适应低氧高寒环境,牦牛肉中肌红蛋白的含量高于平原地区的牛,而由这种特性引起MetMb氧化进而使肌原纤维蛋白发生氧化的研究鲜有报道,有必要对其进行深入探讨。
因此,本实验通过建立MetMb氧化体系,选取甘南牦牛背最长肌,将提取的肌原纤维蛋白于4 ℃氧化孵育24 h,并系统探究氧化系统中蛋白结构的变化,对其生化特性进行研究。根据蛋白结构各指标的变化规律及相互关系比较不同处理组牦牛肉宰后肌原纤维蛋白生化特性的变化,探究MetMb氧化对牦牛肉肌原纤维蛋白生化特性的影响规律,以期为牦牛肉生产加工过程中蛋白氧化控制提供理论参考。
1 材料与方法
1.1 材料与试剂
随机选取甘肃甘南藏族自治州同一牧场健康无病的(36±6)月龄牦牛6 头,平均体质量(250±50)kg。宰后在其左半胴体现场采集背最长肌,在0~4 ℃条件下现场分割成2 cm×2 cm×3 cm长条状肉样,锡箔纸包装,置于液氮罐运输至实验室,于超低温冰箱-80 ℃冻藏待测。
H2O2、三氯乙酸、盐酸胍、FeCl3、抗坏血酸、溴酚蓝、甘氨酸、肌红蛋白(马心肌)、牛血清白蛋白、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、哌嗪-N,N′-双(2-乙磺酸)(1,4-piperazinebis(ethanesulfonic acid),PIPES)) 天津市光复科技发展有限公司;5,5’-二硫代双(2-硝基苯甲酸) 美国Sigma公司。以上试剂均为分析纯。
1.2 仪器与设备
XH-B型涡旋混合器 江苏康健医疗用品有限公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司;756P紫外分光光度计 上海光谱仪器有限公司;TGL-16M高速台式冷冻离心机 长沙湘仪有限公司;XHF-D型高速分散器 宁波新芝生物科技股份有限公司;HX202T电子天平 慈溪市天东衡器厂。
1.3 方法
1.3.1 MetMb氧化模型构建
参考Park等[13]的方法。MetMb溶液浓度分别为0、0.3、0.4、0.5 mmol/L。肌原纤维蛋白分散于上述氧化体系中(最终质量浓度为20 mg/mL,4 ℃氧化24 h后用1 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)终止反应。上述氧化反应均在15 mmol/L PIPES缓冲溶液(pH 6.0,0.6 mol/L NaCl)中进行。空白对照为未处理的肌原纤维蛋白。然后通过用pH 7.0的5 倍体积15 mmol/L PIPES缓冲液(无NaCl)洗涤肌原纤维蛋白样品,1 000×g离心15 min除去氧化剂。将蛋白质沉淀重新悬浮在3 倍体积的含有0.1 mol/L NaCl(pH 7.0)的15 mmol/L PIPES缓冲液中,1 000×g离心15 min,得到肌原纤维蛋白沉淀。蛋白浓度用双缩脲法测定。
1.3.2 肌原纤维蛋白的提取
参照Park等[13]的方法略作修改。称取5 g肉样,加入10 倍体积标准盐溶液(20 mmol/L磷酸钾缓冲液,pH 6.8),13 000 r/min匀浆10 s,4 ℃、1 000×g离心10 min,并弃去上清液。沉淀用8 倍体积标准盐溶液溶解后,4 ℃、1 000×g离心10 min,弃去上清液,重复操作2 次。沉淀用8 倍体积的100 mmol/L KCl溶液溶解,然后4 ℃、1 000×g离心10 min,并弃去上清液,重复2 次。最终所得沉淀中加入4 mL 20 mmol/L磷酸钠缓冲溶液(pH 6.25),用双缩脲法测定其蛋白质含量。
1.3.3 羰基浓度的测定
参考Levine等[14]的方法,并略作修改。在10 mL的离心管中加入终止氧化后的蛋白质溶液0.5 mL与2 mL 2,4-二硝基苯肼的HCl溶液,置于25 ℃反应40 min,空白样品中不加2,4-二硝基苯肼。然后加入20%三氯乙酸溶液2 mL,振荡后11 000×g离心5 min,倒掉上清液。蛋白质沉淀用乙醇-乙酸乙酯溶液(1∶1,V/V)洗涤3 次,挥发完溶剂后将蛋白质悬浮于3 mL 6 mol/L盐酸胍溶液中,于37 ℃水浴保温30 min,370 nm波长处测定吸光度。以空白为对照,采用分子吸光系数22 000 mol/(L·cm)计算羰基浓度。
1.3.4 巯基浓度的测定
参考Korchak等[15]的方法测定。
1.3.5 二硫键浓度测定
参考Thannhauser等[16]的方法,并略作修改。调整蛋白质质量浓度为5 mg/mL。取100 μL稀释后的蛋白液与3 mL新鲜配制的NTSB溶液混合,在室温避光反应25 min,然后在412 nm波长处测定吸光度(A)。以0.1 mL 20 mmol/L磷酸钾缓冲液(pH 6.25)作空白对照。采用分子吸光系数13 600 mol/(L·cm)进行计算。
1.3.6 Ca/K-ATPase活性测定
参考Wells等[17]的方法,并略作修改。反应液A:0.18 mol/L Tris-HCl缓冲液(0.15 mmol/L KCl、15 mmol/L CaCl2、7.6 mmol/L ATP,pH 7.4),测定Ca-ATPase活性。反应液B:0.18 mol/L Tris-HCl缓冲液(7.6 mmol/L ATP、0.3 mol/L KCl、5.0 mmol/L EDTA,pH 7.4),测定K-ATPase活性。用15 mmol/L PIPES(0.6 mol/L NaCl,pH 6.25)将蛋白液稀释为2 mg/mL,取0.2 mL稀释液分别与2 mL反应液A或B在25 ℃培养10 min后,加入1 mL 10%三氯乙酸溶液,然后4 ℃、2 500×g离心5 min,取1 mL上清液,加入3.0 mL 0.66%钼酸铵(溶解在0.375 mol/L硫酸溶液)和0.5 mL新鲜配制的10% FeSO4溶液(溶解在0.075 mol/L硫酸溶液),反应2 min后于700 nm波长处读数。活性结果表示为μmol/(mg·10 min),0~1.0 mmol/L NaH2PO4溶液制作标准曲线用于磷酸盐计算。
1.3.7 二聚酪氨酸测定
参考Davies等[18]的方法并略加修改。将含有20 mg肌原纤维蛋白的悬浮液溶于10 mL高离子强度缓冲液(0.6 mol/L,pH 6.0、20 mol/L磷酸缓冲液)中,滤纸过滤除去残留脂肪和不溶性物质。滤液用双缩脲法测蛋白含量,用牛血清白蛋白做标准曲线,y = 0.061 3x-0.000 6,x为蛋白质量浓度/(mg/mL),y为吸光度。荧光光度法测定滤液中二酪氨酸含量,测定条件为:发射波长420 nm(狭缝5 nm),激发波长325 nm(狭缝5 nm)。测定结果用荧光强度除以蛋白浓度,表示为相对荧光值。
1.3.8 表面疏水性测定
参考Chelh等[19]的方法测定。
1.3.9 肌原纤维小片化指数(myofibrillar fragmentation index,MFI)的测定
参考Culler等[20]的方法测定。
1.4 数据分析
实验每个处理重复3 次。采用Microsoft Excel 2010进行数据统计分析,用SPSS 19.0 Duncan法进行数据分析,P<0.05,显著差异。
2 结果与分析
2.1 羰基浓度的变化
由图1可知,经MetMb体系氧化24 h的肌原纤维蛋白羰基浓度呈上升趋势,当MetMb浓度升高至0.5 mmol/L时,羰基浓度增加至最大值10.11 nmol/mL,较空白对照组升高了近4 倍,与空白对照组(0 mmol/L)2.26 nmol/mL差异显著(P<0.05)。可能是因为随着MetMb浓度的增加,牦牛肉肌原纤维蛋白氧化程度加剧导致的。

图1 牦牛肉肌原纤维蛋白羰基浓度的变化
Fig. 1 Changes in carbonyl content of myofibrillar protein in yak meat
2.2 巯基浓度的变化

图2 牦牛肉肌原纤维蛋白巯基浓度的变化
Fig. 2 Changes in sulfhydryl content in myofibrillar protein of yak meat
由图2可知,随着MetMb浓度的增加,经MetMb体系氧化的肌原纤维蛋白巯基浓度呈下降趋势,当MetMb浓度为0.5 mmol/L时,巯基浓度降至41.18 nmol/mL,较空白对照组显著降低(P<0.05),下降31.5%。
2.3 二硫键浓度的变化

图3 牦牛肉肌原纤维蛋白二硫键浓度的变化
Fig. 3 Changes in disulfide bond content in myofibrillar protein of yak meat
由图3可知,随着MetMb浓度的增加,经MetMb体系氧化的肌原纤维蛋白二硫键浓度呈上升趋势,当MetMb浓度为0.5 mmol/L时,二硫键浓度与空白对照组相比显著增加了约3.5 倍(P<0.05)。肌原纤维蛋白含有大量自由巯基,这些巯基很容易被氧化而转化成分子内或分子间的二硫键,这也是氧化过程中肌原纤维蛋白聚合的主要途径,综上,随着MetMb浓度的增加,肌原纤维蛋白中大量巯基转换成二硫键,蛋白氧化程度加深。
2.4 Ca/K-ATPase活性的变化

图4 牦牛肉肌原纤维蛋白Ca-ATPase活性的变化
Fig. 4 Changes in Ca-ATPase activity of myo fibrillar protein in yak meat
由图4可知,随着MetMb浓度的增加,经MetMb体系氧化的肌原纤维蛋白Ca-ATPase活性总体呈上升趋势,MetMb浓度为0.5 mmol/L时,Ca-ATPase活性显著增加至1.343 μmol/(mg·10 min)(P<0.05)。ATPase活性是反映肌球蛋白完整性的指标,肌球蛋白头部催化中心有两个活性巯基(—SH1和—SH2)。—SH1影响Ca-ATPase活性,而—SH1和—SH2同时影响K-ATPase活性。综上,在氧化过程中—SH1发生了较大程度的变性。
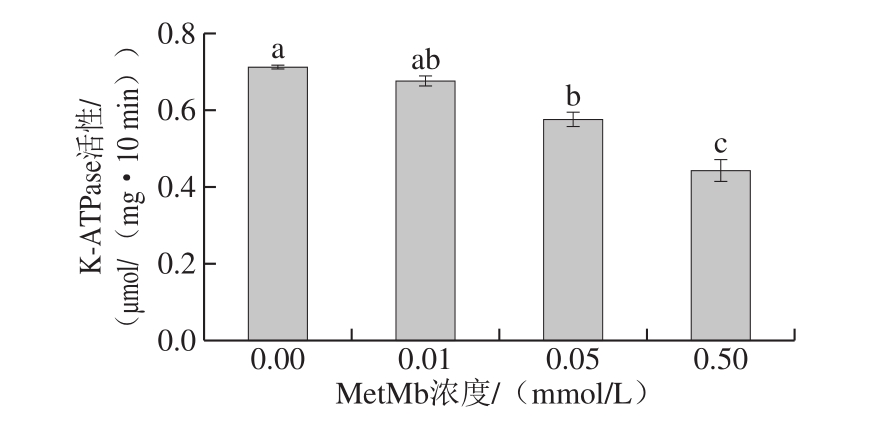
图5 牦牛肉肌原纤维蛋白K-ATPase活性的变化
Fig. 5 Changes in K-ATPase activity of myo fibrillar protein in yak meat
由图5可知,随着MetMb浓度的增加,经MetMb体系氧化的肌原纤维蛋白K-ATPase活性总体呈下降趋势。当MetMb浓度为0.5 mmol/L时,K-ATPase活性降低至最低,与空白对照组相比显著降低36.62%(P<0.05)。肌球蛋白头部催化中心的两个活性巯基(—SH1和—SH2)同时影响K-ATPase活性。综上,在氧化过程中,—SH1和—SH2均严重变性。
2.5 二聚酪氨酸的变化

图6 牦牛肉肌原纤维蛋白二聚酪氨酸的变化
Fig. 6 Changes in dimer tyrosine content of myofibrillar protein in yak meat
由图6可知,随着MetMb浓度的增加,相对荧光值呈上升趋势,在MetMb浓度低于0.01 mmol/L时,其相对荧光值上升缓慢,当浓度增加至0.5 mmol/L时,相对空白对照,相对荧光值增加了近1 倍(P<0.05)。
2.6 表面疏水性的变化

图7 牦牛肉肌原纤维蛋白表面疏水性的变化
Fig. 7 Changes in surface hydrophobicity of myofibrillar protein in yak meat
由图7可知,随着MetMb浓度的增加,经MetMb体系氧化的肌原纤维蛋白表面疏水性呈上升趋势。当MetMb浓度为0.5 mmol/L时,溴酚蓝结合量较空白对照组增加1 倍左右(P<0.05)。随MetMb浓度的增加,蛋白聚集解折叠程度大于其再折叠程度,表面疏水性逐渐增加。
2.7 MFI的变化

图8 牦牛肉肌原纤维蛋白MFI的变化
Fig. 8 Changes in myofibrillar fragmentation index of myofibrillar protein in yak meat
由图8可知,牦牛肉肌原纤维蛋白在MetMb浓度为0 mmol/L时MFI为23.86,0.5 mmol/L时达最大值55.27。从浓度为0.01 mmol/L开始,MFI呈增加趋势,显著小于0.05 mmol/L和0.5 mmol/L时的MFI(P<0.05)。
2.8 各指标间的相关性分析
通过对MetMb氧化牦牛肉肌原纤维蛋白过程中各指标进行相关性分析,其Pearson相关系数如表1所示。由表1可知,牦牛肉肌原纤维蛋白在MetMb氧化过程中,除羰基浓度与巯基浓度(r=-0.978,P<0.01)、K-ATPase活性(r=-0.972,P<0.01)呈极显著负相关外,与其他指标均呈极显著正相关。羰基浓度的变化是最能够表征蛋白氧化程度的指标,结果分析表明各指标均与羰基浓度呈极显著相关,由此可知MetMb氧化对牦牛肉肌原纤维蛋白的氧化产生了显著影响。
表1 各指标间的Pearson相关系数
Table 1 Pearson correlation coefficients among various indexes
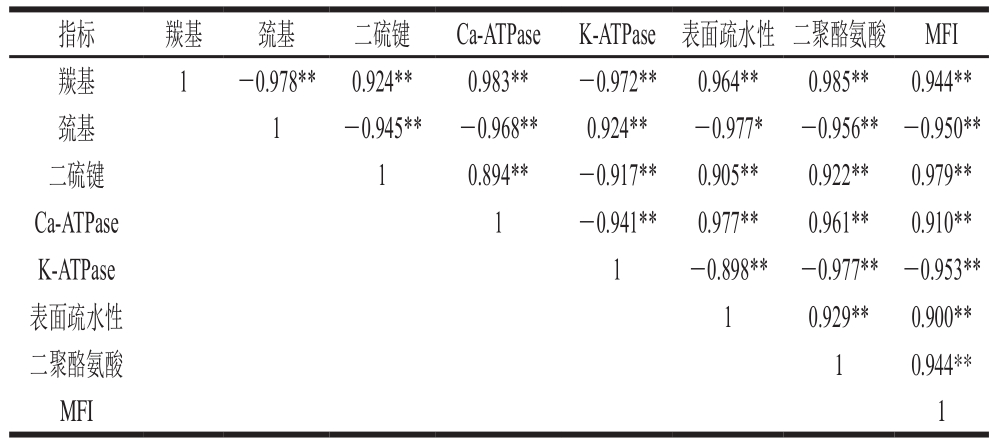
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
images/BZ_90_1299_604_2276_652.png羰基 1 -0.978** 0.924** 0.983** -0.972** 0.964** 0.985** 0.944**巯基 1 -0.945** -0.968** 0.924** -0.977* -0.956** -0.950**二硫键 1 0.894** -0.917** 0.905** 0.922** 0.979**Ca-ATPase 1 -0.941** 0.977** 0.961** 0.910**K-ATPase 1 -0.898** -0.977** -0.953**表面疏水性 1 0.929** 0.900**二聚酪氨酸 1 0.944**MFI 1
3 讨 论
研究发现,肌红蛋白含量的高低是对肉色深浅最直观的表征,肌红蛋白含量越高则肉色越深,而为了适应低氧高寒环境,牦牛肉中肌红蛋白的含量高于平原地区的牛[12],因此,有必要对由这种特性引起的MetMb氧化进而对其肌原纤维蛋白氧化产生的影响进行深入探讨。Promeyrat等[9]通过对宰后猪肉蛋白氧化研究发现,肌红蛋白含量增加能够导致肉中羰基浓度的上升。这与本研究中通过调整MetMb浓度,构建MetMb氧化体系并分析表征蛋白氧化结构和生化特性变化的各指标中,羰基浓度显著升高这一结果相一致。同时,Savd等[21]通过对宰后猪肉早期肌浆蛋白氧化研究表明,肌红蛋白是肌原纤维蛋白氧化的有效促进剂。在本研究中,通过各氧化指标间相关性分析的结果发现,牦牛肉肌原纤维蛋白在MetMb氧化过程中其羰基浓度除与巯基浓度、K-ATPase活性呈极显著负相关外,与其他指标均呈极显著正相关。这表明在MetMb氧化体系中,牦牛肉肌原纤维蛋白结构发生改变,表征氧化程度的指标对此氧化体系敏感,这可能是由于肌红蛋白氧化过程中生成的H2O2和羟自由基等活性氧物质进一步促进了蛋白质氧化[22]。李春强[23]研究发现,蛋白氧化过程中,MetMb会在肌肉中积累,并与H2O2反应生成超价态(Fe4+)的肌红蛋白种类,这类物质可以促进蛋白发生氧化,这与本研究中MetMb促进肌原纤维蛋白发生氧化结果一致。此外,自由基从超价态肌红蛋白转移到其他肌肉蛋白上则会生成蛋白自由基并引发蛋白氧化[24-25],这从深层次确证了本实验构建MetMb氧化体系导致肌原纤维蛋白发生氧化的理论依据。
本研究中,随着MetMb浓度升高,巯基浓度逐渐减少,且二硫键浓度逐渐增加,当MetMb浓度为0.5 mmol/L时,巯基浓度与空白对照组呈显著差异(P<0.05),二硫键浓度与空白对照组差异显著(P<0.05)。Souza等[8]通过对大鼠额叶皮质中的蛋白氧化研究发现,H2O2还能与MetMb发生反应生成活性中间产物MetMb-H2O2和超铁(+4价)肌红蛋白前体物质,这种前体物质极不稳定,可以迅速转变成超铁肌红蛋白,MetMb-H2O2和超铁肌红蛋白均具有促进肉中脂质氧化的强大能力,脂质氧化进而促进蛋白氧化,致使巯基浓度减少、二硫键浓度增加,这与本实验结果一致。张丽等[26]研究发现,牦牛肉氧化21 d相比于氧化7 d,其MFI值显著升高,这与本研究中高浓度(MetMb浓度为0.5 mmol/L)氧化期间MFI值显著高于对照处理组MFI值结果一致。Irwin等[27]研究表明,与肌红蛋白介导脂肪氧化类似,肌红蛋白氧化过程中生成的H2O2和羟自由基等活性氧物质能促进蛋白质氧化;此外,氧化产物MetMb也具有促进蛋白氧化的能力;肌红蛋白发生解离后,释放的血红素和铁离子同样具有促进肌原纤维蛋白氧化的能力[28]。本研究中,随着MetMb浓度升高,溴酚蓝结合量呈上升后下趋势(P<0.05),蛋白质表面疏水性增加,说明MetMb氧化产生的超铁肌红蛋白可以促进蛋白质氧化作用的进行。
4 结 论
经不同浓度MetMb氧化处理的牦牛肉肌原纤维蛋白,随着MetMb浓度的增加,羰基浓度呈显著增加趋势,二硫键、表面疏水性和Ca-ATPase活性、二聚酪氨酸、MFI也发生不同程度的增加,巯基浓度和K-ATPase活性均呈现不同程度的降低,巯基在氧化浓度为0.5 mmol/L时下降显著;K-ATPase活性在高氧化浓度时下降程度更为明显。MetMb浓度越高,牦牛肉肌原纤维蛋白氧化程度加剧,肌球蛋白头部活性巯基—SH1和—SH2均严重变性。
[1] RYU Y C, KIM B C. The relationship between muscle fiber characteristics, postmortem metabolic rate, and meat quality of pig longissimus dorsi muscle[J]. Meat Science, 2005, 71(2): 351-357.DOI:10.1016/j.meatsci.2005.04.015.
[2] XIONG Y L, DECKER E A. Alterations of muscle protein functionality by oxidative and antioxidative processes[J]. Journal of Muscle Foods, 1995, 6(2): 139-160. DOI:10.1111/j.1745-4573.1995.tb00563.x.
[3] PARK D, XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2): 607-616. DOI:10.1016/j.foodchem.2006.09.004.
[4] 张丽, 余群力, 孙宝忠. 肌肉蛋白氧化对肉类品质的影响[J].食品与发酵工业, 2017(5): 273-281. DOI:10.13995/j.cnki.11-1802/ts.201705043.
[5] 吴成帆, 韩玲, 陈骋, 等. 中国荷斯坦育肥公犊肉储藏过程中脂肪氧化对肌红蛋白稳定性的影响[J]. 食品工业科技, 2015, 36(7): 323-327. DOI:10.13386/j.issn1002-0306.2015.07.059.
[6] XIONG Y L, PARK D, OOIZUMI T. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J]. Journal of Agricultural and Food Chemistry, 2009,57(1): 153-159. DOI:10.1021/jf8024453.
[7] OOIZUMI T, XIONG Y L. Identification of cross-linking site(s) of myosin heavy chains in oxidatively stressed chicken myofibrils[J].Journal of Food Science, 2006, 71(3): 169-199. DOI:10.1111/j.1365-2621.2006.tb15617.x.
[8] SOUZA C G, MOREIRA J D, SIQUEIRAI I R, et al. Highly palatable diet consumption increases protein oxidation in rat frontal cortex and anxiety-like behavior[J]. Life Sciences, 2007, 81(3): 198-203.DOI:10.1016/j.lfs.2007.05.001.
[9] PROMEYRAT A, SAYD T, LAVILLE E, et al. Early postmortem sarcoplasmic proteome of porcine muscle related to protein oxidation[J]. Food Chemistry, 2011, 127(3): 1097-1104. DOI:10.1016/j.foodchem.2011.01.108.
[10] ESTÉVEZ M, HEINONEN M. Effect of phenolic compounds on the formation of α-aminoadipic and γ-glutamic semialdehydes from myofibrillar proteins oxidized by copper, iron, and myoglobin[J].Journal of Agricultural and Food Chemistry, 2010, 58(7): 4448-4455.DOI:10.1021/jf903757h.
[11] DECKER E A, XIONG Y L, CALVERT J T, et al. Chemical, physical,and functional properties of oxidized turkey white muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1993, 41(2):186-189. DOI:10.1021/jf00026a007.
[12] 陈骋. 脂质氧化和抗氧化因子对牦牛肉肌红蛋白稳定性及高铁肌红蛋白还原能力的影响[D]. 兰州: 甘肃农业大学, 2016.
[13] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3):1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[14] LEVINE R L,WILLIAMS J A, STADTMAN E R, et al. Carbonyl assays for determination of oxidatively modified proteins[J].Methods in Enzymology, 1994, 233: 346-352. DOI:10.1016/S0076-6879(94)33040-9.
[15] KORCHAK L I, SPERANSKAYA T A. Effect of some protective substances on change in reactivity of tissue sulfhydryl groups in irradiated animals[J]. Steel Research International, 2009, 80(11): 796-799. DOI:10.2374/SRI09SP071.
[16] THANNHAUSER T W, KONISHI Y, SCHERAGA H A. Analysis for disulfide bonds in peptides and proteins[J]. Methods in Enzymology,1987, 143(1): 115-119. DOI:10.1016/0076-6879(87)43020-6.
[17] WELLS J A, WERBER M M, YOUNT R G. Inactivation of myosin subfragment one by cobalt (II)/cobalt (III) phenanthroline complexes. 2.Cobalt chelation of two critical thiolgroups[J]. Biochemistry, 1979,18(22): 4800-4805. DOI:10.1021/bi00589a005.
[18] DAVIES K J, LIN S W, PACIFICI R E. Protein damage and degradation by oxygen radicals. IV. Degradation of denatured protein[J].Journal of Biological Chemistry, 1987, 262(20): 9895-9901.DOI:10.1016/j.theochem.2007.09.005.
[19] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[20] CULLER R D, PARRISH Jr. F C P , SMITH G C, et al. Relationship of myofibril fragmentation index to certain chemical, physical and sensory characteristics of bovine longissimus muscle[J]. Journal of Food Science, 1978, 43(4): 1177-1180. DOI:10.1111/j.1365-2621.1978.tb15263.x.
[21] SAYD T, CHAMBON C, LAVILLE E, et al. Early post-mortem sarcoplasmic proteome of porcine muscle related to lipid oxidation in aged and cooked meat[J]. Food Chemistry, 2012, 135(4): 2238-2244.DOI:10.1016/j.foodchem.2012.07.079.
[22] SUN W, ZHOU F, SUN D W, et al. Effect of oxidation on the emulsifying properties of myofibrillar proteins[J]. Food & Bioprocess Technology, 2013, 6(7): 1703-1712. DOI:10.1007/s11947-012-0823-8.
[23] 李春强. 肌原纤维蛋白的氧化程度对谷氨酰胺转移酶催化交联作用的影响及其机理研究[D]. 无锡: 江南大学, 2013.
[24] LUND M, LUXFORD C, SKIBSTED L, et al. Oxidation of myosin by haem proteins generates myosin radicals and protein crosslinks[J]. Biochemical Journal, 2008, 410(3): 565-574. DOI:10.1042/bj20071107.
[25] HENRIK Ø, SKIBSTED L H, ANDERSEN H J. Formation of long-lived protein radicals in the reaction between H2O2-activated metmyoglobin and other proteins[J]. Free Radical Biology &Medicine, 1997, 23(5): 754-761. DOI:10.1021/ja962764d.
[26] 张丽, 王莉, 周玉春, 等. 适宜宰后成熟时间提高牦牛肉品质[J].农业工程学报, 2014, 30(15): 325-331. DOI:10.3969/j.issn.1002-6819.2014.15.041.
[27] IRWIN J A, OSTDAL H, DAVIES M J. Myoglobin-induced oxidative damage: evidence for radical transfer from oxidized myoglobin to other proteins and antioxidants[J]. Archives of Biochemistry &Biophysics, 1999, 362(1): 94-104. DOI:10.1006/abbi.1998.0987.
[28] ESTÉVEZ M, HEINONEN M. Effect of phenolic compounds on the formation of α-aminoadipic and γ-glutamic semialdehydes from myofibrillar proteins oxidized by copper, iron, and myoglobin[J].Journal of Agricultural and Food Chemistry, 2010, 58(7): 4448-4455.DOI:10.1021/jf903757h.