葡萄酒酿造主要是酵母菌将糖转化为乙醇的复杂过程。发酵过程中,酵母菌种类呈规律变化,非酿酒酵母和酿酒酵母(Saccharomyces cerevisiae)之间的相互作用不仅影响发酵进程,而且对葡萄酒的色泽、香气、感官质量及产品风格的形成都起到至关重要的作用[1]。葡萄酒工业发酵倾向于使用S. cerevisiae以保证葡萄酒发酵顺利进行,但在一定程度上也降低了葡萄酒的风味多样性。近年来随着对非酿酒酵母微生物特征和酿造特性的深入研究,其对葡萄酒风味的积极影响广受关注[2-4]。毕赤酵母属酵母具有高产乙酸乙酯、乙酸异丁酯和乙酸异戊酯等酯类物质的特性,在提高葡萄酒花香及果香特征方面具有极大的应用潜力[2]。毕赤克鲁维酵母(Pichia kluyveri)作为其中最受关注的菌种之一,已有国外公司推出了商业化的纯种发酵剂[5],其在各类发酵产品中的应用不断被报道。比如,Amaya-Delgado等[6]将P. kluyveri用于龙舌兰酿造发现其具有优良的乙醇耐受性和产乙醇能力,且可促进乳酸乙酯的生成;Batista等[7]研究发现P. kluyveri有利于可可发酵过程中咖啡风味的形成;Wei Jianping等[8]将P. kluyveri用于苹果酒发酵,发现其能赋予苹果酒热带水果风味。
与S. cerevisiae相比,由于非酿酒酵母在葡萄醪生境中生长缓慢、乙醇转化力较弱,利用非酿酒酵母纯种发酵可能会导致葡萄酒发酵延滞,因此通常采用混合接种策略,既确保了发酵的顺利进行,又保留了非酿酒酵母的发酵特征,对葡萄酒香气质量的提升有重要意义[3]。Prior等[9]研究发现利用P. kluyveri和S. cerevisiae混合接种发酵可显著提高葡萄酒中高级醇和乙基酯的含量;Lu Yuyun等[10]研究发现P. kluyveri和美极梅奇酵母(Metschnikowia pulcherrima)混合接种发酵可显著提高榴莲酒中乙酸乙酯和乙酸异戊酯等物质含量;此外,在混合接种策略中,接种比例对葡萄酒质量及香气有显著影响。杨诗妮等[11]利用戴尔有孢圆酵母(Torulaspora delbrueckii)和S. cerevisiae顺序接种混合发酵,发现接种比例为20∶1时,葡萄酒中挥发酸含量显著降低;王倩倩等[12]发现在同时接种混合发酵中,高比例接种发酵毕赤酵母(Pichia fermentans)会显著降低S. cerevisiae最大生长数量,且给葡萄酒带来较强的生青味。Anfang等[13]研究发现P. kluyveri与S. cerevisiae以1∶9接种比例混合发酵可显著增加葡萄酒中果香硫醇的含量。因此,对接种比例进行优化是混合酿造工艺中的关键点。
利用具有优良酿酒特性的本土酵母有助于塑造葡萄酒的产区或地域典型性,非酿酒酵母与S. cerevisiae混合发酵作为当下的研究热点,是避免产品同质化、获得高品质葡萄酒的有效酿造方法[14]。我国葡萄酒产区气候变化多样,酵母资源极其丰富,而相关的研究尚处于起步阶段。P. kluyveri广泛存在于葡萄酒自然发酵前期,能够促进葡萄酒中酯类物质的生成,具有广阔的应用前景[2]。但目前关于P. kluyveri对葡萄酒香气影响的研究还不够充分,尚鲜见有关中国本土P. kluyveri与S. cerevisiae混合接种增香酿造的报道。本研究以课题组前期优选的本土P. kluyveri HS-2-1[15]和S. cerevisiae NX11424[16]为材料,按照小容器酿造工艺法[17]探究不同接种比例的P. kluyveri对葡萄酒香气的影响。进一步研究优选P. kluyveri的酿造学特性,获得P. kluyveri与S. cerevisiae混合发酵酿造赤霞珠干红葡萄酒的最佳接种比例,旨在为改善国内葡萄酒单一风味、提高香气质量提供参考。
1 材料与方法
1.1 材料与试剂
葡萄原料:赤霞珠,2016年购自陕西咸阳瑞那酒庄,初始糖度280 g/L,pH 3.85,总酸4.8 g/L。
P. kluyveri HS-2-1分离自贺兰山东麓产区自然发酵葡萄醪;S. cerevisiae NX11424分离自宁夏产区自然发酵葡萄醪,保藏于西北农林科技大学葡萄酒学院。
酵母浸出粉胨葡萄糖(yeast extract protein dextrose,YEPD)培养基、WLN(Wallerstein laboratory nutrient)培养基配制参考文献[18],所用试剂均为国产分析纯。
乙酸乙酯、癸酸乙酯、异丁醇、苯乙醇和辛酸等标准品(均为色谱纯) 美国Sigma-Aldrich公司。
1.2 仪器与设备
ZHWY-2102C恒温培养振荡器 上海智城分析仪器制造有限公司;BK1301生物显微镜 重庆光电仪器有限公司;50/30 μm DVB/CAR/PDMS萃取纤维头、固相微萃取装置 美国Supelco公司;6890-5975气相色谱-质谱联用仪、HP-Innowax色谱柱(60 m×0.25 mm,0.25 μm) 美国Agilent公司。
1.3 方法
1.3.1 小容器发酵
在2 L发酵罐中加入约1.5 L葡萄醪,随后添加60 mg/L SO2和600 mg/L二甲基二碳酸盐[19]过夜灭菌处理。处理好的葡萄醪先接入HS-2-1,发酵48 h后以1∶1、10∶1和20∶1的接种比例接种NX11424,其中HS-2-1接种量约为1×106 CFU/mL(血球板计数法),NX11424的接种量按比例计算;以S1、S10、S20表示HS-2-1和NX11424混合接种比例依次为1∶1、10∶1、20∶1。以HS-2-1纯种发酵(PK组)和NX11424纯种发酵(SC组)为对照,发酵温度为25 ℃,每个处理设置3 组重复。
1.3.2 菌落数检测
采用稀释平板计数法。WLN培养基中添加20 μg/mL氯霉素,排除杂菌生长对酵母菌总菌数检测的干扰。在葡萄酒发酵4 个关键点取样涂布(发酵启动ST1:糖开始下降;旺盛期ST2:二次接种;发酵后期ST3:糖消耗约3/4;发酵结束ST4:糖质量浓度低于4.0 g/L)。根据S. cerevisiae和非酿酒酵母在WLN平板上菌落形态进行分类统计,其中S. cerevisiae菌落有光泽、乳白色球状凸起、边缘规则;P. kluyveri菌落呈奶油色至灰绿色,表面干燥,中间平坦,边缘呈放射状[20]。
1.3.3 理化指标检测
发酵过程中每24 h取样测定还原糖含量,待还原糖质量浓度不大于4 g/L且不再降低时加入50 mg/L SO2终止发酵[17]。发酵结束后参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定葡萄酒基本理化指标。
1.3.4 香气成分测定
采用固相微萃取-气相色谱-质谱联用技术,具体方法参考蔡建等[21]。取5.0 mL葡萄酒加入到15 mL样品瓶中,同时加入1.0 g NaCl和10 μL的4-甲基-2-戊醇(内标,2.004 g/L)后密封样品瓶,在40 ℃、180 r/min条件平衡30 min,然后插入萃取头萃取30 min后进样,解析8 min。升温程序为:50 ℃保持1 min,然后以3 ℃/min的速率升到220 ℃,保持5 min。载气为氦气,平均线速率为25 cm/s。采用不分流进样模式,所有质谱在电子能量70 eV条件下冲击,质量扫描范围m/z 29~350。
质谱结果利用计算机谱库(NIST14)并结合文献进行各挥发性物质的定性。对于已有标准品的物质,采用外标法定量;没有标准品的物质利用化学结构相似、碳原子数相近的标准品物质的标准曲线进行相对定量[21]。
1.3.5 香气活性值计算及气味特征分类
香气活性值(odour activity value,OAV)由物质含量除以其嗅觉阈值得到,本研究中香气物质的嗅觉阈值及香气描述均引自文献[21-24]。
根据文献[21,25],将葡萄酒中香气物质按照其气味特征可分为9组:1=果香,2=花香,3=植物味,4=坚果香,5=焦糖味,6=土腥味,7=化学味,8=脂肪味,9=烘烤味,对所有OAV大于0.1的香气物质进行分组,各组物质OAV的总和表示葡萄酒该类香气轮廓特征。
1.4 数据处理
采用Excel 2010软件进行数据统计;SPSS 16.0进行数据分析,多组间比较采用One-Way ANOVA法,不同处理供试酒样中香气成分分布规律采用主成分分析(principal component analysis,PCA);使用Origin 8.5软件作图。
2 结果与分析
2.1 发酵曲线
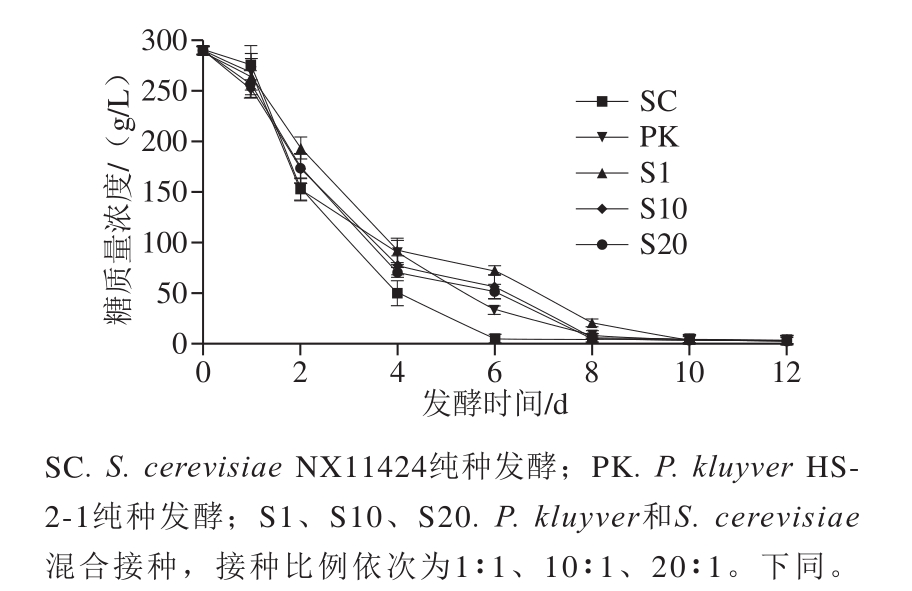
图1 不同发酵处理发酵曲线
Fig. 1 Fermentation curves with different starter cultures
如图1所示,所有发酵组均能完成发酵。SC组最快,历时7 d,PK组耗时最长,约11 d完成,不同接种比例混合发酵组(S1、S10、S20)均10 d左右完成发酵。发酵前2 d各处理发酵速率与SC组保持一致。但随着发酵进行,发酵速率呈现明显差异,SC>PK>混合接种发酵处理(S1、S10、S20)。与SC组相比,P. kluyveri的接入在一定程度上延缓了发酵进程,这是非酿酒酵母发酵能力相对较弱的体现[2]。
2.2 发酵过程中活菌数变化
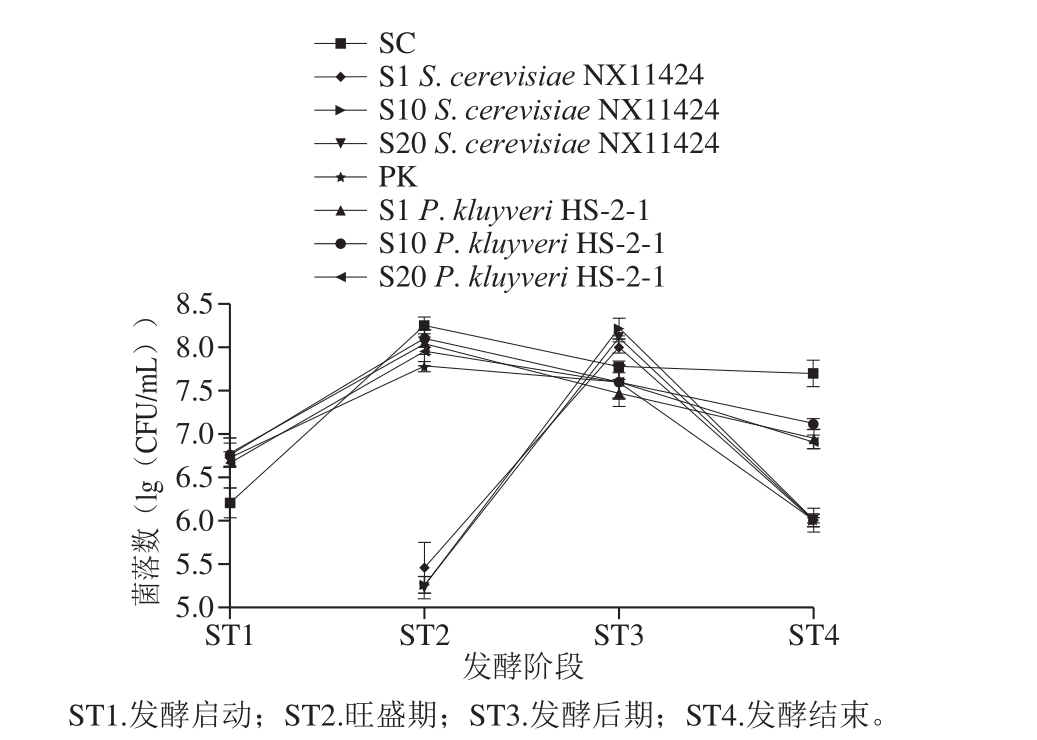
图2 不同接种处理发酵中P. kluyver与S. cerevisiae菌株在不同阶段的数量变化
Fig. 2 Populations of P. kluyver and S. cerevisiae at different stages of fermentation
图2 为在不同发酵处理中4 个关键时期S. cerevisiae和P. kluyveri的菌落数变化。整体看,S. cerevisiae和P. kluyveri的菌落数在发酵过程中均呈现先上升后下降的趋势。由于接种比例的不同,混合发酵处理酒样中NX11424的生长受到不同程度的抑制。与SC组相比,混合发酵处理酒样中NX11424的最大增殖量和发酵结束后菌落数均降低,不同接种比例处理之间发酵结束后S. cerevisiae的菌落数无明显差别,这与Fleet等[1]的研究结果一致。发酵过程中酵母菌之间存在竞争作用,随着发酵的进行,生长能力及耐受性更强的S. cerevisiae迅速占据主导地位,处于弱势地位的P. kluyveri菌落数下降较快。本实验中HS-2-1菌落数在ST2开始剧烈下降。此外,混合发酵处理中HS-2-1的最大增殖量和发酵结束后菌落数均显著高于PK组,且S10组的最大增殖量最高(1.30×108 CFU/mL),这可能与不同种属酵母之间存在生长协同作用有关[26],二者的互作关系有待进一步研究。实验结果表明,HS-2-1在葡萄酒酿造过程中具有良好的定植能力,在整个发酵过程中均能保持一定的生物量水平。混合接种不会影响乙醇发酵的正常进行,且在一定程度上能减缓HS-2-1的衰亡。
2.3 理化指标分析
表1 发酵结束后酒样的基本理化指标
Table 1 Chemical composition of wines at the end of fermentation
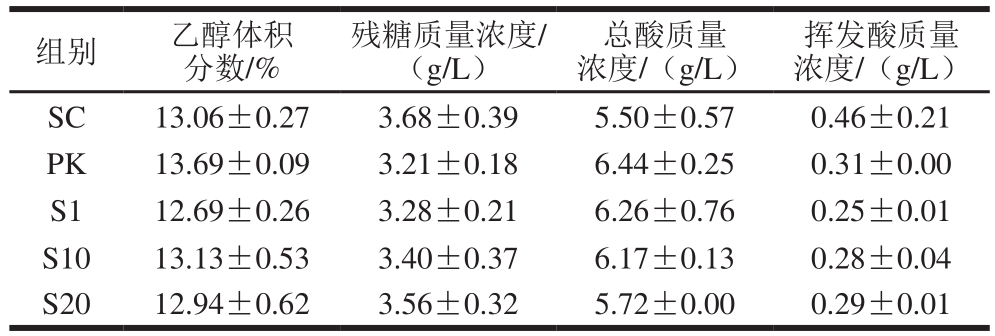
组别 乙醇体积分数/%挥发酸质量浓度/(g/L)SC 13.06±0.27 3.68±0.39 5.50±0.57 0.46±0.21 PK 13.69±0.09 3.21±0.18 6.44±0.25 0.31±0.00 S1 12.69±0.26 3.28±0.21 6.26±0.76 0.25±0.01 S10 13.13±0.53 3.40±0.37 6.17±0.13 0.28±0.04 S20 12.94±0.62 3.56±0.32 5.72±0.00 0.29±0.01残糖质量浓度/(g/L)总酸质量浓度/(g/L)
如表1所示,所有处理都完成了乙醇发酵,残糖质量浓度均低于4 g/L,乙醇体积分数约为13%。相较于SC组,其他处理酒样中总酸含量升高,挥发酸含量降低,其中PK组酒样总酸质量浓度最高(6.44 g/L),S1组酒样挥发酸质量浓度最低(0.25 g/L)。这可能由于菌株HS-2-1具有嗜杀特性[15],研究表明嗜杀酵母能够有效抑制发酵过程中腐败微生物的生长,净化发酵体系,从而降低挥发酸含量[27]。
2.4 香气成分分析
对发酵后葡萄酒样进行香气分析,共检测到46 种物质,包括16 种高级醇类物质、19 种酯类物质、6 种脂肪酸类物质以及5 种其他物质(表2)。各处理间香气物质组成种类没有显著差异,但物质含量存在显著差异。
高级醇是葡萄酒中重要的香气物质,总质量浓度超过400 mg/L时,会带来强烈的刺鼻味,而低于300 mg/L时,可以增加香气复杂性[28]。各处理酒样中高级醇质量浓度均低于300 mg/L。与SC组相比,混合发酵处理(S10、S20)酒样中高级醇总量显著升高,其中S20组酒样中高级醇总量最高(176.92 mg/L),提高了24.19%。这与王倩倩等[12]在P. fermentans中的研究结果相似,混合发酵处理中高比例接种P. fermentans提高了葡萄酒中高级醇类物质含量,而这与非酿酒酵母的存活数量及存活时间密切相关[29]。2-苯乙醇可为葡萄酒带来玫瑰香等愉悦香气[30],本研究发现高比例接种P. kluyvei的酒样中2-苯乙醇含量显著提高,其中PK组酒样中2-苯乙醇质量浓度最高(8.27 mg/L)。一般认为非酿酒酵母具有更高的苯乙醇产生能力[3],如Andorrà等[30]研究发现与S. cerevisiae纯种发酵相比,假丝酵母(Candida zemplinina)纯种发酵能显著提高葡萄酒中2-苯乙醇含量,从而使得其高级醇含量显著增高。在检测到的醇类物质中,只有异戊醇含量超过感官阈值,是葡萄酒主要香气贡献物质[21]。与SC组相比,PK组酒样中异戊醇含量显著升高,提高21.26%。混合发酵处理酒样中只有高比例接种处理(S10、S20)酒样中异戊醇含量显著提高,其中S20组物质含量最高,提高38.31%。此外余欢等[31]发现巴斯德毕赤酵母(Pichia pastoris)纯种发酵能够提高葡萄酒中癸醇含量,给葡萄酒带来橙子花香。本实验也发现了类似结果,PK组酒样中癸醇含量较其他处理显著提高,3 组混合发酵处理葡萄酒中癸醇含量也较SC组显著提高,且其含量随着P. kluyveri接种比例的升高而降低。
酯类物质是葡萄酒果香和花香的主要贡献者[28]。前人研究表明毕赤酵母属酵母具有高产酯类物质的特性[3]。本实验中,与SC组相比,3 组混合发酵处理酒样中酯类物质总量均显著提高,且随着P. kluyvei所占比例的增加,酯类物质增幅越大。其中S20组酒样酯类物质总量为74.08 mg/L,较SC组中酯类物质总量高出21.34%。这与Escribano等[32]报道毕赤酵母属酵母具有高酯酶活性的结果一致。在检出的19 种酯类物质中,丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯和9-癸烯酸乙酯5 种物质的OAV均大于1,对所得酒样香气的贡献更为显著[21]。检出19 种酯类物质,其中有5 种物质OAV大于1,分别为丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯和9-癸烯酸乙酯。与SC组酒样相比,不同比例混合发酵处理均可促进以上5 种酯类物质的合成,有利于葡萄酒果香和复杂性的增强[31]。其中,己酸乙酯具有最高的OAV(15.08~17.19),可以给葡萄酒带来浓郁的草莓、菠萝香气[21]。S20组酒样己酸乙酯质量浓度最高(429.73 μg/L),为SC组的1.06 倍,但S1、S10组与SC组间差异不显著。Chua等[33]发现P. kluyvei在豆腐乳清发酵中能显著提高发酵产物中乙酸异戊酯含量,赋予其香蕉香气,这与本研究结果一致。此外乳酸乙酯能赋予葡萄酒特殊的乳香风味[32],与SC组相比,PK组酒样中乳酸乙酯含量较低,但混合发酵过程中乳酸乙酯含量显著增加,其中S20组酒样中乳酸乙酯含量最高(26.38 mg/L),为SC组(13.12 mg/L)的2.01 倍,这可能是因为混合发酵过程中酵母之间的互作促进了乳酸乙酯的生成。相关
研究表明,葡萄酒中香气物质的生成在非酿酒酵母与S. cerevisiae共发酵体系中存在协同作用[34]。
表2 不同发酵处理葡萄酒的香气成分
Table 2 Volatile compounds identified from wines fermented with different starter cultures
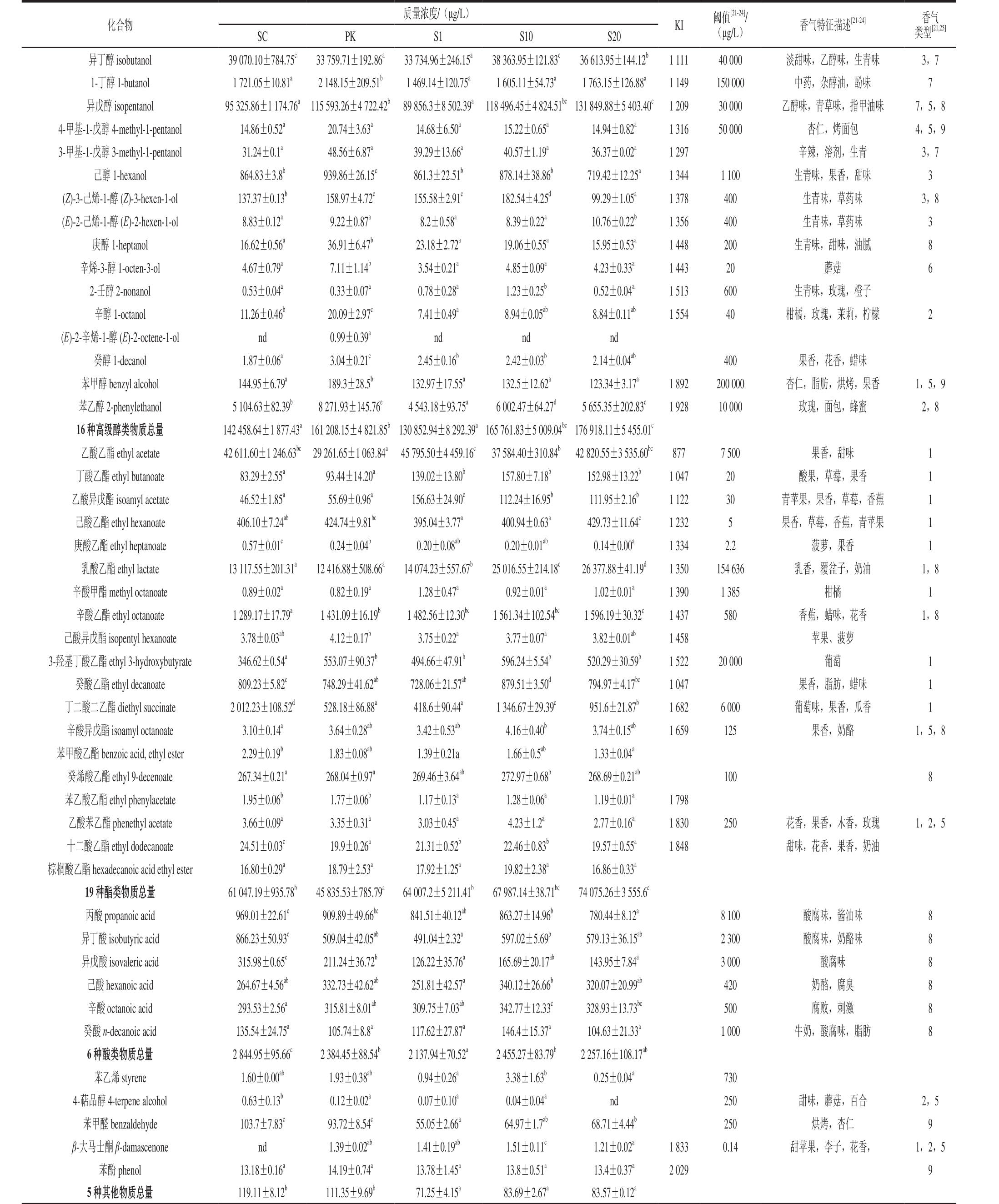
注:同行不同小写字母表示差异显著(P<0.05);KI值(Kovats index,保留指数)根据HP-Innowax毛细管柱计算所得;nd.未检出。
质量浓度/(μg/L)化合物SC PK S1 S10 S20KI 阈值[21-24]/(μg/L) 香气特征描述[21-24] 香气类型[21,25]异丁醇 isobutanol 39 070.10±784.75c 33 759.71±192.86a 33 734.96±246.15a 38 363.95±121.83c 36 613.95±144.12b 1 111 40 000 淡甜味,乙醇味,生青味 3,7 1-丁醇 1-butanol 1 721.05±10.81a 2 148.15±209.51b 1 469.14±120.75a 1 605.11±54.73a 1 763.15±126.88a 1 149 150 000 中药,杂醇油,酚味 7异戊醇 isopentanol 95 325.86±1 174.76a115 593.26±4 722.42b 89 856.3±8 502.39a 118 496.45±4 824.51bc131 849.88±5 403.40c 1 209 30 000 乙醇味,青草味,指甲油味 7,5,8 4-甲基-1-戊醇 4-methyl-1-pentanol 14.86±0.52a 20.74±3.63a 14.68±6.50a 15.22±0.65a 14.94±0.82a 1 316 50 000 杏仁,烤面包 4,5,9 3-甲基-1-戊醇 3-methyl-1-pentanol 31.24±0.1a 48.56±6.87a 39.29±13.66a 40.57±1.19a 36.37±0.02a 1 297 辛辣,溶剂,生青 3,7己醇 1-hexanol 864.83±3.8b 939.86±26.15c 861.3±22.51b 878.14±38.86b 719.42±12.25a 1 344 1 100 生青味,果香,甜味 3(Z)-3-己烯-1-醇 (Z)-3-hexen-1-ol 137.37±0.13b 158.97±4.72c 155.58±2.91c 182.54±4.25d 99.29±1.05a 1 378 400 生青味,草药味 3,8(E)-2-己烯-1-醇 (E)-2-hexen-1-ol 8.83±0.12a 9.22±0.87a 8.2±0.58a 8.39±0.22a 10.76±0.22b 1 356 400 生青味,草药味 3庚醇 1-heptanol 16.62±0.56a 36.91±6.47b 23.18±2.72a 19.06±0.55a 15.95±0.53a 1 448 200 生青味,甜味,油腻 8辛烯-3-醇 1-octen-3-ol 4.67±0.79a 7.11±1.14b 3.54±0.21a 4.85±0.09a 4.23±0.33a 1 443 20 蘑菇 6 2-壬醇 2-nonanol 0.53±0.04a 0.33±0.07a 0.78±0.28a 1.23±0.25b 0.52±0.04a 1 513 600 生青味,玫瑰,橙子辛醇 1-octanol 11.26±0.46b 20.09±2.97c 7.41±0.49a 8.94±0.05ab 8.84±0.11ab 1 554 40 柑橘,玫瑰,茉莉,柠檬 2(E)-2-辛烯-1-醇 (E)-2-octene-1-ol nd 0.99±0.39a nd nd nd癸醇 1-decanol 1.87±0.06a 3.04±0.21c 2.45±0.16b 2.42±0.03b 2.14±0.04ab 400 果香,花香,蜡味苯甲醇 benzyl alcohol 144.95±6.79a 189.3±28.5b 132.97±17.55a 132.5±12.62a 123.34±3.17a 1 892 200 000 杏仁,脂肪,烘烤,果香 1,5,9苯乙醇 2-phenylethanol 5 104.63±82.39b 8 271.93±145.76e 4 543.18±93.75a 6 002.47±64.27d 5 655.35±202.83c 1 928 10 000 玫瑰,面包,蜂蜜 2,8 16 种高级醇类物质总量 142 458.64±1 877.43a161 208.15±4 821.85b130 852.94±8 292.39a165 761.83±5 009.04bc176 918.11±5 455.01c乙酸乙酯 ethyl acetate 42 611.60±1 246.63bc 29 261.65±1 063.84a 45 795.50±4 459.16c 37 584.40±310.84b 42 820.55±3 535.60bc 877 7 500 果香,甜味 1丁酸乙酯 ethyl butanoate 83.29±2.55a 93.44±14.20a 139.02±13.80b 157.80±7.18b 152.98±13.22b 1 047 20 酸果,草莓,果香 1乙酸异戊酯 isoamyl acetate 46.52±1.85a 55.69±0.96a 156.63±24.90c 112.24±16.95b 111.95±2.16b 1 122 30 青苹果,果香,草莓,香蕉 1己酸乙酯 ethyl hexanoate 406.10±7.24ab 424.74±9.81bc 395.04±3.77a 400.94±0.63a 429.73±11.64c 1 232 5 果香,草莓,香蕉,青苹果 1庚酸乙酯 ethyl heptanoate 0.57±0.01c 0.24±0.04b 0.20±0.08ab 0.20±0.01ab 0.14±0.00a 1 334 2.2 菠萝,果香 1乳酸乙酯 ethyl lactate 13 117.55±201.31a 12 416.88±508.66a 14 074.23±557.67b 25 016.55±214.18c 26 377.88±41.19d 1 350 154 636 乳香,覆盆子,奶油 1,8辛酸甲酯 methyl octanoate 0.89±0.02a 0.82±0.19a 1.28±0.47a 0.92±0.01a 1.02±0.01a 1 390 1 385 柑橘 1辛酸乙酯 ethyl octanoate 1 289.17±17.79a 1 431.09±16.19b 1 482.56±12.30bc 1 561.34±102.54bc 1 596.19±30.32c 1 437 580 香蕉,蜡味,花香 1,8己酸异戊酯 isopentyl hexanoate 3.78±0.03ab 4.12±0.17b 3.75±0.22a 3.77±0.07a 3.82±0.01ab 1 458 苹果、菠萝3-羟基丁酸乙酯 ethyl 3-hydroxybutyrate 346.62±0.54a 553.07±90.37b 494.66±47.91b 596.24±5.54b 520.29±30.59b 1 522 20 000 葡萄 1癸酸乙酯 ethyl decanoate 809.23±5.82c 748.29±41.62ab 728.06±21.57ab 879.51±3.50d 794.97±4.17bc 1 047 果香,脂肪,蜡味 1丁二酸二乙酯 diethyl succinate 2 012.23±108.52d 528.18±86.88a 418.6±90.44a 1 346.67±29.39c 951.6±21.87b 1 682 6 000 葡萄味,果香,瓜香 1辛酸异戊酯 isoamyl octanoate 3.10±0.14a 3.64±0.28ab 3.42±0.53ab 4.16±0.40b 3.74±0.15ab 1 659 125 果香,奶酪 1,5,8苯甲酸乙酯 benzoic acid, ethyl ester 2.29±0.19b 1.83±0.08ab 1.39±0.21a 1.66±0.5ab 1.33±0.04a癸烯酸乙酯 ethyl 9-decenoate 267.34±0.21a 268.04±0.97a 269.46±3.64ab 272.97±0.68b 268.69±0.21ab 100 8苯乙酸乙酯 ethyl phenylacetate 1.95±0.06b 1.77±0.06b 1.17±0.13a 1.28±0.06a 1.19±0.01a 1 798乙酸苯乙酯 phenethyl acetate 3.66±0.09a 3.35±0.31a 3.03±0.45a 4.23±1.2a 2.77±0.16a 1 830 250 花香,果香,木香,玫瑰 1,2,5十二酸乙酯 ethyl dodecanoate 24.51±0.03c 19.9±0.26a 21.31±0.52b 22.46±0.83b 19.57±0.55a 1 848 甜味,花香,果香,奶油棕榈酸乙酯 hexadecanoic acid ethyl ester 16.80±0.29a 18.79±2.53a 17.92±1.25a 19.82±2.38a 16.86±0.33a 19 种酯类物质总量 61 047.19±935.78b 45 835.53±785.79a 64 007.2±5 211.41b 67 987.14±38.71bc 74 075.26±3 555.6c丙酸 propanoic acid 969.01±22.61c 909.89±49.66bc 841.51±40.12ab 863.27±14.96b 780.44±8.12a 8 100 酸腐味,酱油味 8异丁酸 isobutyric acid 866.23±50.93c 509.04±42.05ab 491.04±2.32a 597.02±5.69b 579.13±36.15ab 2 300 酸腐味,奶酪味 8异戊酸 isovaleric acid 315.98±0.65c 211.24±36.72b 126.22±35.76a 165.69±20.17ab 143.95±7.84a 3 000 酸腐味 8己酸 hexanoic acid 264.67±4.56ab 332.73±42.62ab 251.81±42.57a 340.12±26.66b 320.07±20.99ab 420 奶酪,腐臭 8辛酸 octanoic acid 293.53±2.56a 315.81±8.01ab 309.75±7.03ab 342.77±12.33c 328.93±13.73bc 500 腐败,刺激 8癸酸 n-decanoic acid 135.54±24.75a 105.74±8.8a 117.62±27.87a 146.4±15.37a 104.63±21.33a 1 000 牛奶,酸腐味,脂肪 8 6 种酸类物质总量 2 844.95±95.66c 2 384.45±88.54b 2 137.94±70.52a 2 455.27±83.79b 2 257.16±108.17ab苯乙烯 styrene 1.60±0.00ab 1.93±0.38ab 0.94±0.26a 3.38±1.63b 0.25±0.04a 730 4-萜品醇 4-terpene alcohol 0.63±0.13b 0.12±0.02a 0.07±0.10a 0.04±0.04a nd 250 甜味,蘑菇,百合 2,5苯甲醛 benzaldehyde 103.7±7.83c 93.72±8.54c 55.05±2.66a 64.97±1.7ab 68.71±4.44b 250 烘烤,杏仁 9 β-大马士酮 β-damascenone nd 1.39±0.02ab 1.41±0.19ab 1.51±0.11c 1.21±0.02a 1 833 0.14 甜苹果,李子,花香, 1,2,5苯酚 phenol 13.18±0.16a 14.19±0.74a 13.78±1.45a 13.8±0.51a 13.4±0.37a 2 029 9 5 种其他物质总量 119.11±8.12b 111.35±9.69b 71.25±4.15a 83.69±2.67a 83.57±0.12a
葡萄酒中的脂肪酸能够抑制对应芳香酯的水解,有利于葡萄酒香气的平衡。其中低浓度脂肪酸能赋予葡萄酒奶酪、奶油风味,但含量过高时会给葡萄酒带来刺激、腐败等不良风味[28]。本实验检出的6 种脂肪酸含量均低于感官阈值,有利于提高葡萄酒的复杂性[28]。与SC组相比,各处理脂肪酸总量均降低,特别是各混合发酵处理中丙酸、异丁酸、异戊酸的含量均显著降低,这与Lu Yuyun等[35]利用P. kluyvei和T. delbrueckii混合发酵榴莲酒的结果一致。
在检出的其他物质中,β-大马士酮能够贡献葡萄酒中的甜香、花香和蜂蜜香[32]。本实验中该物质在3 组混合发酵处理中含量较高,均超出感官阈值,但在SC组酒样中并未检测到,这可能与非酿酒酵母可产生较多的利于水解香气前体物质的糖苷酶相关[2]。

图3 干红葡萄酒发酵香气成分在前2 个主成分上的载荷及酒样分布图
Fig. 3 Loading plot of wine aroma components on the first two PCs
为进一步判别不同处理之间香气成分的差异,对所有发酵香气成分进行PCA,结果如图3所示。在PCA模型中,PC1(40.66%)和PC2(39.69%)的累计方差贡献率为80.35%,能够反映样本的大部分信息。3 组混合发酵处理均位于PC1方向正端,其酒样中辛酸乙酯、乳酸乙酯、丁酸乙酯和乙酸异戊酯等香气物质含量丰富,而SC组位于PC1方向负向端,酒样中香气物质含量相对较少。PC2可将混合发酵处理(S1、S10、S20)酒样与PK处理酒样显著区分,主要贡献物质为己酸异戊酯、1-辛醇和3-甲基-1-戊醇等。由此可知P. kluyvei和S. cerevisiae混合发酵改变了纯种发酵时的呈香特征。
对酒样中OAV大于0.1的物质进行香气分组,选取∑OAV大于0.5的6 种香气类型绘制得到葡萄酒的香气轮廓图(图4)。所有实验酒样香气均以果香为主,其次为花香、焦糖味、脂肪味、化学味、植物味。相较于SC组酒样,接种P. kluyvei的葡萄酒样中果香、花香及焦糖味均有显著提高。这与混合发酵显著提高了样品中酯类、醇类及β-大马士酮等物质含量有关。植物味、脂肪味及化学味在低浓度条件有利于提升香气复杂度[21],所有处理中植物味和化学味强度无显著差别,但混合接种处理中脂肪味强度略有上升,这是由于混合发酵处理提高了葡萄酒中异戊醇、乳酸乙酯等物质的含量。
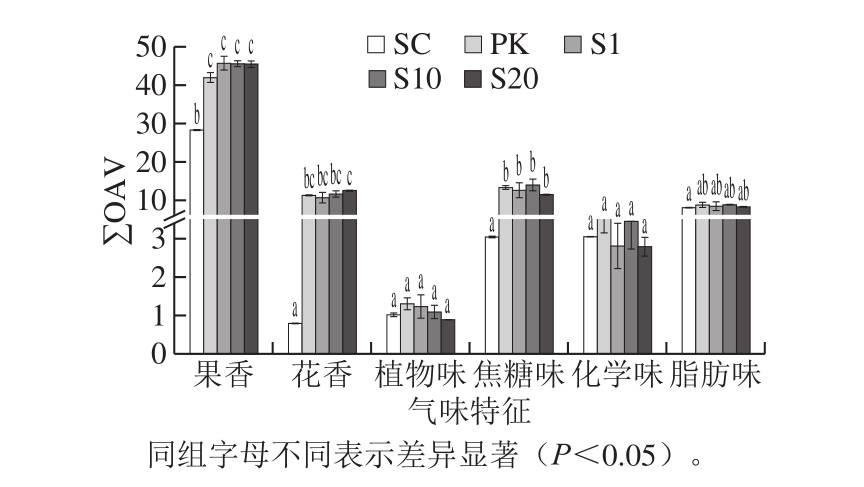
图4 不同发酵处理干红葡萄酒发酵香气轮廓
Fig. 4 Aroma profile of red wines produced with different tarter cultures
3 结 论
随着对非酿酒酵母酿造特性研究的深入开展,其在改善葡萄酒风味中的积极贡献被不断挖掘,与S. cerevisiae混合发酵作为有潜力的工艺措施也得到了广泛的关注。本研究选择本土P. kluyveri HS-2-1与S. cerevisiae NX11424以不同比例顺序接种酿造赤霞珠干红葡萄酒,发现HS-2-1和NX11424以20∶1比例接种,在确保乙醇发酵顺利完成的同时,能够最大限度地发挥P. kluyveri的产香特性,显著提高发酵酒样中己酸乙酯、丁酸乙酯等乙基酯类物质含量,使葡萄酒的果香和花香显著增强。因此,本研究认为本土P. kluyveri HS-2-1具有增香酿造葡萄酒的应用潜力。在后续研究中,将进一步细化其与S. cerevisiae的互作关系及对葡萄酒品质指标的全面影响,以期为葡萄酒增香酿造工艺技术的研发提供重要理论依据。
[1] FLEET G H. Yeast interactions and wine flavour[J]. International Journal of Food Microbiology, 2003, 86(1/2): 11-22. DOI:10.1016/s0168-1605(03)00245-9.
[2] DOMIZIO P, ROMANI C, LENCIONI L, et al. Outlining a future for non-Saccharomyces yeasts: selection of putative spoilage wine strains to be used in association with Saccharomyces cerevisiae for grape juice fermentation[J]. International Journal of Food Microbiology,2011, 147(3): 170-180. DOI:10.1016/j.ijfoodmicro.2011.03.020.
[3] PADILLA B, GIL J V, MANZANARES P. Past and future of non-Saccharomyces yeasts: from spoilage microorganisms to biotechnological tools for improving wine aroma complexity[J].Frontiers in Microbiology, 2016, 7: 1-20. DOI:10.3389/fmicb.2016.00411.
[4] WHITENER M E B, CARLIN S, JACOBSON D, et al. Early fermentation volatile metabolite profile of non-Saccharomyces yeasts in red and white grape must: a targeted approach[J]. LWTFood Science and Technology, 2015, 64(1): 412-422. DOI:10.1016/j.lwt.2015.05.018.
[5] LUDOVIC R, PASQUALE R, CARMEN B, et al. Non-Saccharomyces commercial starter cultures: scientific trends, recent patents and innovation in the wine sector[J]. Recent Patents on Food, Nutrition &Agriculture, 2019, 10: 27-39. DOI:10.2174/22127984106627-6190131103713.
[6] AMAYA-DELGADO L, HERRERA-LOPEZ E J, ARRIZON J, et al.Performance evaluation of Pichia kluyveri, Kluyveromyces marxianus and Saccharomyces cerevisiae in industrial tequila fermentation[J]. World Journal of Microbiology and Biotechnology, 2013, 29(5): 875-881.DOI:10.1007/s11274-012-1242-8.
[7] BATISTA N N, RAMOS C L, RIBEIRO D D, et al. Dynamic behavior of Saccharomyces cerevisiae, Pichia kluyveri and Hanseniaspora uvarum during spontaneous and inoculated cocoa fermentations and their effect on sensory characteristics of chocolate[J]. LWTFood Science and Technology, 2015, 63(1): 221-227. DOI:10.1016/j.lwt.2015.03.051.
[8] WEI J P, ZHANG Y X, YUAN Y H, et al. Characteristic fruit wine production via reciprocal selection of juice and non-Saccharomyces species[J]. Food Microbiology, 2018, 79: 66-74. DOI:10.1016/j.fm.2018.11.008.
[9] PRIOR K J, BAUER F F, DIVOL B. The utilisation of nitrogenous compounds by commercial non-Saccharomyces yeasts associated with wine[J]. Food Microbiology, 2019, 79: 75-84. DOI:10.1016/j.fm.2018.12.002.
[10] LU Y Y, HUANG D, LEE P R, et al. Assessment of volatile and nonvolatile compounds in durian wines fermented with four commercial non-Saccharomyces yeasts[J]. Journal of the Science of Food and Agriculture, 2016, 96(5): 1511-1521. DOI:10.1002/jsfa.7253.
[11] 杨诗妮, 叶冬青, 贾红帅, 等. 本土戴尔有孢圆酵母在葡萄酒酿造中的应用潜力研究[J]. 食品科学, 2019, 40(18): 108-115. DOI:10.7506/spkx1002-6630-20180914-142.
[12] 王倩倩, 覃杰, 马得草, 等. 优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒[J]. 中国农业科学, 2018, 51(11): 2178-2192. DOI:10.3864/j.issn.0578-1752.2018.11.015.
[13] ANFANG N, BRAJKOVICH M, GODDARD M R. Co-fermentation with Pichia kluyveri increases varietal thiol concentrations in Sauvignon Blanc[J]. Australian Journal of Grape & Wine Research,2010, 15(1): 1-8. DOI:10.1111/j.1755-0238.2008.00031.x.
[14] BELDA I, ZARRAONAINDIA I, PERISIN M, et al. From vineyard soil to wine fermentation: microbiome approximations to explain the “terroir” concept[J]. Frontiers in Microbiology, 2017, 8: 821.DOI:10.3389/fmicb.2017.00821.
[15] 冯莉, 陈雪, 李丽, 等. 5 株克鲁维毕赤酵母的酿造学特性[J]. 中国食品学报, 2018, 18(12): 66-73. DOI:10.16429/j.1009-7848.2018.12.009.
[16] LIU N, SONG Y Y, QIN Y, et al. Chromatic characteristics and anthocyanin compositions of cabernet sauvignon wines: influence of indigenous Saccharomyces cerevisiae strains in Ningxia,China[J]. Food Science and Biotechnology, 2015, 24(6): 1973-1978.DOI:0.1007/s10068-015-0260-3.
[17] 李华. 小容器酿造葡萄酒[J]. 酿酒科技, 2002(4): 70-71.DOI:10.13746/j.njkj.2002.04.028.
[18] 曹培鑫, 马涛, 杨凯迪, 等. 我国葡萄酒中布鲁塞尔酒香酵母的检测和鉴定[J]. 食品科学, 2015, 36(23): 172-177. DOI:10.7506/spkx1002-6630-201523032.
[19] LISANTI M T, BLAIOTTA G, NIOI C, et al. Alternative methods to SO2 for microbiological stabilization of wine[J]. Comprehensive Reviews in Food Science and Food Safety, 2019, 18(2): 455-479.DOI:10.1111/1541-4337.12422.
[20] 杨莹, 徐艳文, 薛军侠, 等. WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J]. 微生物学杂志, 2007, 27(5): 75-78. DOI:10.3969/j.issn.1005-7021.2007.05.017.
[21] 蔡建. 发酵前处理工艺对天山北麓‘赤霞珠’葡萄酒香气改良研究[D].北京: 中国农业大学, 2014.
[22] CAI J, ZHU B Q, WANG Y H, et al. Influence of prefermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J]. Food Chemistry, 2014, 154(2): 217-229. DOI:10.1016/j.foodchem.2014.01.003.
[23] CULLERE L, ESCUDERO A, CACHO J, et al. Gas chromatographyolfactometry and chemical quantitative study of the aroma of six premium quality Spanish aged red wines[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6): 1653-1660. DOI:10.1021/jf0350820.
[24] GUTH H. Quantitation and sensory studies of character impact odorants of different white wine varieties[J]. Journal of Agricultural &Food Chemistry, 1997, 45(8): 3027-3032. DOI:10.1021/jf970280a.
[25] GARCIA-CARPINTERO G, GAMEZ G M, SANCHEZ P E, et al.Impact of alternative technique to ageing using oak chips in alcoholic or in malolactic fermentation on volatile and sensory composition of red wines[J]. Food Chemistry, 2012, 134(2): 851-863. DOI:10.1016/j.foodchem.2012.02.194.
[26] GOBBI M, COMITINI F, DOMIZIO P, et al. Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation: a strategy to enhance acidity and improve the overall quality of wine[J]. Food Microbiology, 2013, 33(2): 271-281. DOI:10.1016/j.fm.2012.10.004.
[27] 王麟, 谭春明, 于刚, 等. 嗜杀酵母的生物学特性及其应用[J].天津农学院学报, 2017, 24(1): 83-87; 92. DOI:10.3969/j.issn.1008-5394.2017.01.021.
[28] LIU P T, LU L, DUAN C Q, et al. The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J]. LWT-Food Science and Technology, 2016, 71: 356-363. DOI:10.1016/j.lwt.2016.04.031.
[29] LEE P R, KHO S H C, YU B, et al. Yeast ratio is a critical factor for sequential fermentation of papaya wine by Williopsis saturnus and Saccharomyces cerevisiae[J]. Microbial Biotechnology, 2013, 6(4):385-393. DOI:10.1111/1751-7915.12008.
[30] ANDORRÀ I, BERRADRE M, ROZÈS N, et al. Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J]. European Food Research and Technology, 2010,231(2): 215-224. DOI:10.1007/s00217-010-1272-0.
[31] 余欢, 管敬喜, 杨莹, 等. 7 株野生葡萄酒酵母对‘桂葡3号’干白葡萄酒香气成分的影响[J]. 食品科学, 2019, 40(4): 251-258.DOI:10.7506/spkx1002-6630-20180207-097.
[32] ESCRIBANO R, GONZÁLEZ-ARENZANA L, GARIJO P, et al.Screening of enzymatic activities within different enological non-Saccharomyces yeasts[J]. Journal of Food Science and Technology,2017, 54(6): 1555-1564. DOI:10.1007/s13197-017-2587-7.
[33] CHUA J Y, LU Y Y, LIU S Q. Evaluation of five commercial non-Saccharomyces yeasts in fermentation of soy (tofu) whey into an alcoholic beverage[J]. Food Microbiology, 2018, 76: 533-542.DOI:10.1016/j.fm.2018.07.016.
[34] SADOUDI M, TOURDOT-MARÉCHAL R, ROUSSEAUX S, et al.Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J]. Food Microbiology,2012, 32(2): 243-253. DOI:10.1016/j.fm.2012.06.006.
[35] LU Y Y, VOON M K W, CHUA J Y, et al. The effects of co- and sequential inoculation of Torulaspora delbrueckii and Pichia kluyveri on chemical compositions of durian wine[J]. Applied Microbiology and Biotechnology, 2017, 101(21): 7853-7863. DOI:10.1007/s00253-017-8527-7.