ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由25~35个L-赖氨酸通过ε-氨基和α-羧基之间的酰胺键连接而成的同型氨基酸聚合物,具有热稳定性好、水溶性强、安全性高及抑菌谱广等优点,在日本、韩国及美国被广泛用于食品防腐[1-3]。目前,ε-PL的产生菌主要为链霉菌,其最适的生长pH值偏中性[4]。然而,在ε-PL的生物合成过程中产生菌则面临着自发酸胁迫(微生物在发酵过程中自发形成的酸性物质对菌体造成的酸胁迫):随着发酵的进行,环境pH值最终自发下降到3.0左右;而且,ε-PL合成的最适pH值(pH 4.0)对产生菌而言也是一种酸胁迫环境[3-5]。酸胁迫会引起胞内pH值(pHi)的下降,导致一些对酸敏感的酶失活,造成细胞膜和胞内大分子的结构损伤,最终引起细胞死亡[6]。因此,ε-PL产生菌对自发酸胁迫具有一定的耐受性。
目前,关于革兰氏阳性菌对酸胁迫耐受机制的研究主要集中于乳酸菌和蜡样芽胞杆菌等,研究表明,胞外碱性物质的合成、胞内质子(H+)的去除、细胞膜组分的改变、休克蛋白和分子伴侣的合成、转录调控因子的表达以及代谢途径的改变等都能够提高菌株的酸耐受能力[6]。然而,在同为革兰氏阳性菌的链霉菌中相关研究报道较少。前期分别对Streptomyces albulus M-Z18在pH 5.0、4.0和pH 3.0分批发酵过程中细胞壁、细胞膜、胞内微环境以及全局基因转录水平的研究发现,细胞通过协同方式维持酸性pH值条件下细胞壁和细胞膜的正常功能、pHi值的动态平衡以及DNA和RNA的稳定;更为重要的是,随着pH值的下降,ε-PL合成酶的转录水平逐渐升高,pH 3.0时ε-PL合成酶的转录水平相比pH 5.0时上调35.75 倍[7]。此外,在ε-PL的发酵过程中人为引入酸性pH值冲击(短时pH 3.0胁迫),补料-分批发酵中ε-PL产量达到54.70 g/L,较对照提高了52.50%[3]。考虑到ε-PL是一种碱性的氨基酸聚合物(等电点为9.0左右),其侧链的多NH2结构能够在酸性条件下结合胞外游离的H+。由此推测,合成ε-PL也是产生菌应对自发酸胁迫的一种方式[7]。因此,提高ε-PL产生菌的耐酸能力并解析其如何在自发酸胁迫条件下生存,对于丰富链霉菌的酸胁迫耐受机制以及提高ε-PL的产量至关重要。
适应性进化,是一种研究微生物在特定环境条件下进化过程的有效方法,通过将微生物置于一定的环境压力下,经过长期的驯化,获得具有特定生理功能的突变菌株[8],广泛应用于筛选具有抗胁迫[9]、抗药性[10]的微生物以及提高代谢产物的产量[11]等。本研究以1 株ε-PL产生菌淀粉酶产色链霉菌(Streptomyces diastatochromogenes)T17为原始菌株,利用酸性适应性进化的方法筛选得到3 株进化菌株,从耐酸能力、细胞膜以及胞内微环境等水平比较原始菌株和进化菌株之间的差异,分析适应性进化提高S. diastatochromogenes T17应对自发酸胁迫能力的生理机制。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
利用双层琼脂显色法[12]从土壤中筛选得到1 株野生ε-PL产生菌株S. diastatochromogenes T17,通过酸性适应性进化的方法,筛选得到3 株进化菌株S. diastatochromogenes AE44、S. diastatochromogenes AE51和S. diastatochromogenes AE56。均保藏于齐鲁工业大学生物工程学院生物制药工程研究所。
1.1.2 试剂
2’,7’-双-(2-羧乙基)-5-(-6)-羧基荧光素-乙酰氧基甲酯(2’,7’-bis-(2-carboxyethyl)-5-(and-6)-carboxyfluorescein,acetoxymethyl ester,BCECF AM) 碧云天生物技术研究所;H+-ATPase试剂盒(细菌) 上海杰美基因医药科技有限公司;Super-Bradford蛋白定量试剂盒 北京康为世纪生物科技有限公司。
1.1.3 培养基
种子和发酵培养基(M3G):葡萄糖50 g/L,酵母粉5.0 g/L,(NH4)2SO4 10 g/L,KH2PO4·2H2O 1.4 g/L,MgSO4·7H2O 0.5 g/L,K2HPO4·2H2O 0.8 g/L,FeSO4·7H2O 0.03 g/L,ZnSO4·7H2O 0.03 g/L,用1 mol/L NaOH或H2SO4溶液调节pH值至设定值,115 ℃灭菌15 min。如果配制M3G固体培养基,则添加20 g/L的琼脂。
1.2 仪器与设备
L-20AT高效液相色谱仪 日本Shimadzu公司;L-8900全自动氨基酸分析仪 日本Hitachi公司;Trace1310 ISQ气相色谱-质谱联用仪 美国Thermo Fisher公司;JEM-1200EX透射电子显微镜 日本电子株式会社;VCX800超声波破碎仪 美国Sonics公司;Synergy NEO2多功能酶标仪 美国BioTek公司。
1.3 方法
1.3.1 种子培养
取两环生长成熟的孢子接种到装有50 mL M3G培养基(初始pH 6.8)的300 mL锥形瓶中(孢子浓度约为2×105 个/mL),在30 ℃、200 r/min振荡培养24 h作为种子液。
1.3.2 酸性适应性进化
以2%的接种量将培养24 h的S. diastatochromogenes T17种子液接种至初始pH 4.0的M3G培养基中,30 ℃、200 r/min振荡培养4 d(发酵2 d后pH值即降到3.1左右,随后保持不变),再以2%的接种量转接至新鲜的相同培养基中。如此不断重复,连续转接70 d。在进化的不同时期,挑选在pH 4.0的M3G固体平板上生长快速、产孢子能力强的菌株,即为耐酸能力提高的进化菌株。
1.3.3 酸胁迫生长性能测定
取培养24 h的原始菌株和进化菌株种子液,经梯度稀释(100、10-1、10-2、10-3)后,点种于不同pH值(5.0、4.5、4.0)的M3G平板上,30 ℃静置培养4 d,观测菌落生长情况;取2 mL培养24 h的种子液接种到装有50 mL M3G培养基(初始pH 4.0)的300 mL锥形瓶中,置于摇床中30 ℃、200 r/min培养96 h,测定菌体干质量。
1.3.4 自发酸胁迫实验
取2 mL培养24 h的原始菌株和进化菌株种子液接种到装有50 mL M3G培养基(初始pH 6.8)的300 mL锥形瓶中,置于摇床中30 ℃、200 r/min培养48 h,分别在第0、48小时取样测定相关生理参数。
1.3.5 pHi值测定
取不同自发酸胁迫时间(0 h和48 h)的原始菌株和进化菌株,用50 mmol/L的磷酸盐缓冲液(pH 7.4)离心洗涤菌体3 次后(4 500×g,10 min),冰水浴超声破碎菌丝体(功率480 W,破碎2 s、停2 s,5 min),离心收集破碎菌丝的悬浮液(600×g,4 min),按照Breeuwer等[14]报道的方法,加入BCECF AM反应,分别测定菌丝悬浮液的荧光强度Itotal和离心上清液(10 000×g,10 min)的荧光强度If i ltrate。激发波长为490 nm和440 nm,发射波长为525 nm,测定体系为200 µL,缝隙宽度为9 nm。按照下式计算总的荧光强度I。再根据lgI的值由标准曲线计算pHi值。
式中:I490 nm total、I440 nm total分别为菌丝悬浮液在490、440 nm激发波长下的荧光强度;I490 nm fi ltrate、I440 nm fi ltrate分别为离心上清液在490、440 nm激发波长下的荧光强度。
1.3.6 胞内ATP测定
胞内ATP测定的方法参照Cichna等[13],并稍作改动。发酵液4 500×g离心5 min弃去上清液,重悬于0.5 mol/L HClO4溶液(0 ℃)中以阻止菌体代谢。冰水浴超声破碎菌体(功率480 W,破2 s停2 s,10 min),经12 000×g离心20 min,上清液过0.22 μm的滤膜后于高效液相色谱测定。
色谱条件:Agilent Zorbax SB-AQLAChrom C18-AQ色谱柱(250 mm×4.6 mm);检测波长254 nm;柱温25 ℃;流动相5%乙腈、95% Na2HPO4-NaH2PO4缓冲液(pH 7.0,0.2 mol/L)以及四丁基溴化铵(10 mmol/L);流速1.0 mL/min;进样体积10 μL。
1.3.7 H+-ATPase活性测定
根据H+-ATPase试剂盒提供的方法测定。酶活性单位定义:能够在1 min内将1 μmol的NADH氧化所用的酶量为1 U。
1.3.8 胞内氨基酸含量测定
取750 μL发酵液于1.5 mL离心管中,用超纯水离心洗涤3 次(8 000×g,60 s),加入750 μL的10 g/100 mL三氯乙酸溶液,37 ℃水浴10 min,然后放入沸水中煮沸30 min,12 000×g离心10 min后上清液于氨基酸分析仪测定。
1.3.9 细胞膜脂肪酸含量测定
参照Sasser[15]的方法,发酵液离心弃去上清液(4 500×g,5 min),下层菌体用生理盐水(0.9%NaCl)洗涤2 次,顺序经过皂化、甲基化、提取及碱洗后,取上层有机相利用气质联用色谱分析脂肪酸成分。
气相色谱条件:TG-5MS色谱柱(30 m×0.25 mm,0.25 μm);升温程序:80 ℃保持1 min,以10 ℃/min的速率升温至200 ℃,继续以5 ℃/min的速率升温至250 ℃,最后以2 ℃/min的速率升到270 ℃,保持3 min;进样口温度290 ℃;载气流速1.2 mL/min;不分流进样,开阀时间1 min。
质谱条件:电子电离源:电子能量70 eV;传输线温度280 ℃;离子源温度280 ℃;溶剂延迟时间5 min;质量扫描范围m/z 30~400。
1.3.10 蛋白含量测定
采用Super-Bradford蛋白定量试剂盒测定。样品采用生理盐水(0.9% NaCl)适当稀释,在595 nm波长处测定吸光度。
1.3.11 菌体干质量测定
取10 mL发酵液,4 500×g离心10 min弃去上清液,经预先称质量的滤纸过滤,105 ℃烘干至质量恒定后用于测量。
1.4 统计学分析
数据分析采用费舍尔最小显著差异法,P<0.05,差异显著。
2 结果与分析
2.1 适应性进化对酸胁迫下菌体生长性能的影响

图1 酸胁迫条件下不同菌株的生长情况
Fig. 1 Growth performance of strains under acidic stress
如图1a所示,4 株菌在pH 5.0、4.5和4.0的M3G固体平板上的菌落生长和孢子成熟情况各不相同。虽然4 株菌在pH 5.0平板上的菌落大小相似,但是3 株进化菌株的菌落颜色呈褐色,而原始菌株的菌落颜色较浅,这说明进化菌株即使在pH 5.0条件下也能正常产孢子,而原始菌株则由于受到酸胁迫影响孢子的生成;进化菌株在pH 4.5平板上的生长情况比原始菌株更好,在稀释倍数为10-3时可以明显观察到;在pH 4.0的环境中生长时,由于受到的酸胁迫更加强烈,4 株菌的生长受到明显的限制,菌体生长缓慢且没有孢子产生,但仍然可以看出进化菌株的菌落较原始菌株大。如图1b所示,在pH 4.0的M3G液体培养基中生长96 h后,进化菌株AE44、AE51和AE56的菌体干质量分别为(0.33±0.02)、(0.35±0.02)g/L和(0.40±0.01)g/L,较原始菌株T17分别提高了32%、40%和60%。综上所述,与原始菌株相比,进化菌株在酸胁迫环境中菌体生长和产孢子速度更快,证明了进化菌株对酸胁迫的耐受能力更强。
2.2 自发酸胁迫对原始菌株和进化菌株pHi值的影响
如图2所示,在第0小时(环境pH(pHex)值为6.5),4 株菌的pHi值之间没有明显差别,均维持在7.7以上。随着发酵过程的进行,环境pH值自发下降,第48小时(pHex 3.2),4 株菌的pHi值均呈现不同程度的下降:原始菌株下降到5.19±0.15,进化菌株则保持在6.27~6.53之间。由此可见,与原始菌株相比,进化菌株在自发酸胁迫条件下的pHi值明显高于原始菌株。pHi值能够影响细胞中营养物质的吸收、蛋白质的合成、糖酵解作用以及核酸的合成。在正常的生长代谢中,微生物的pHi值必须维持动态平衡,否则当pHi值下降到一定范围后,会引起蛋白质以及DNA的损伤,可能导致细胞死亡[16]。因此,保持pHi值的相对稳定对微生物的生长代谢至关重要。前期研究发现,S. albulus M-Z18在pH 5.0、4.0、3.0分批发酵27 h,其pHi值都在7.7左右,由于菌株在酸胁迫环境中所处时间短,pHi值还未开始下降[7]。Wu Chongde等[17]比较了Lactobacillus casei Zhang及其耐酸进化菌株在pH 5.0、3.3的酸胁迫环境中处理1 h后的pHi值,发现进化菌株的pHi值比原始菌株高,而且这种差距会随着胁迫pH值的降低而增大。此外,据Yamanaka等[18]报道,ε-PL合成酶的最适pH值为8.5,酸性pH值能够显著抑制其酶活性;因此,较高的pHi值也有利于胞内ε-PL的合成。综上所述,在自发酸胁迫条件下,进化菌株能够维持更高的pHi值,为菌体的正常生长和代谢以ε-PL的合成提供有利的pHi值环境。

图2 不同酸胁迫时间下原始菌株和进化菌株的pHi值
Fig. 2 Comparison of pHi values at different acid stress times between the original and evolutionary strains
2.3 自发酸胁迫对菌株胞内ATP含量和H+-ATPase活性的影响
胞内ATP含量和H+-ATPase活性在维持pHi值稳定方面发挥最重要的作用,H+-ATPase主要通过消耗ATP将胞内H+排出胞外[6]。如表1所示,在第0小时,原始菌株和进化菌株的胞内ATP含量和H+-ATPase活性没有明显区别;第48小时,与原始菌株相比,进化菌株始终保持较高的胞内ATP含量和H+-ATPase活性:其中,进化菌株AE44、AE51、AE56的胞内ATP含量是原始菌株T17的1.7 倍以上,H+-ATPase活性分别比原始菌株提高79.87%、85.53%和100.63%。因此,在自发酸胁迫条件下,进化菌株始终比原始菌株保持较高的胞内ATP含量和H+-ATPase活性,从而能有效地将胞内H+泵出胞外,维持pHi值的稳定,提高菌株在酸胁迫环境下的存活率。此外,Yamanaka等[19]的研究表明,ε-PL合成酶作用的发挥需要消耗大量的ATP;自发酸胁迫条件下,进化菌株胞内ATP含量更高,这也为ε-PL合成酶提供更多的能量,有利于ε-PL的合成。
表1 不同酸胁迫时间下原始菌株和进化菌株的胞内ATP含量和H+-ATPase活性
Table 1 Comparison of ATP concentration and H+-ATPase activity at different acid stress times between the original and the evolutionary strains
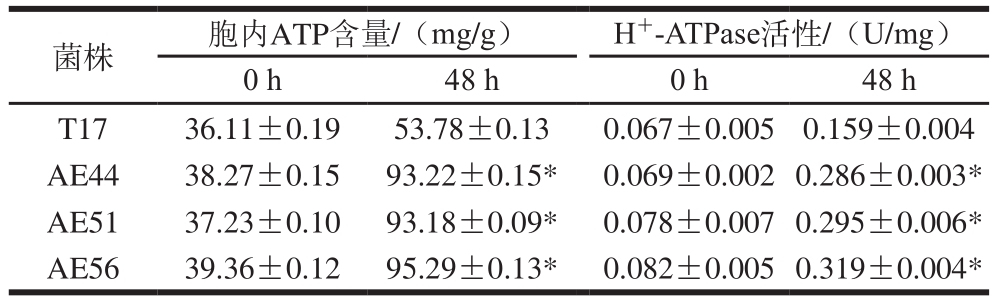
images/BZ_119_201_757_1177_851.pngT17 36.11±0.19 53.78±0.13 0.067±0.005 0.159±0.004 AE44 38.27±0.15 93.22±0.15* 0.069±0.002 0.286±0.003*AE51 37.23±0.10 93.18±0.09* 0.078±0.007 0.295±0.006*AE56 39.36±0.12 95.29±0.13* 0.082±0.005 0.319±0.004*
2.4 自发酸胁迫中原始菌株与进化菌株胞内氨基酸含量的差异
氨基酸代谢在调控pHi值、代谢产能或还原力以及增强细胞对环境胁迫的抵抗力等方面发挥重要的作用[20]。因此,考察自发酸胁迫条件下(48 h,pHex 3.2),原始菌株和进化菌株胞内所有氨基酸含量的变化。如图3所示,在自发酸胁迫条件下,与原始菌株相比,进化菌株胞内天冬氨酸、丙氨酸、谷氨酸、赖氨酸、甘氨酸以及脯氨酸含量明显增加,这说明它们可能在S. diastatochromogenes AE44等3 株进化菌株抵抗酸胁迫中发挥作用。
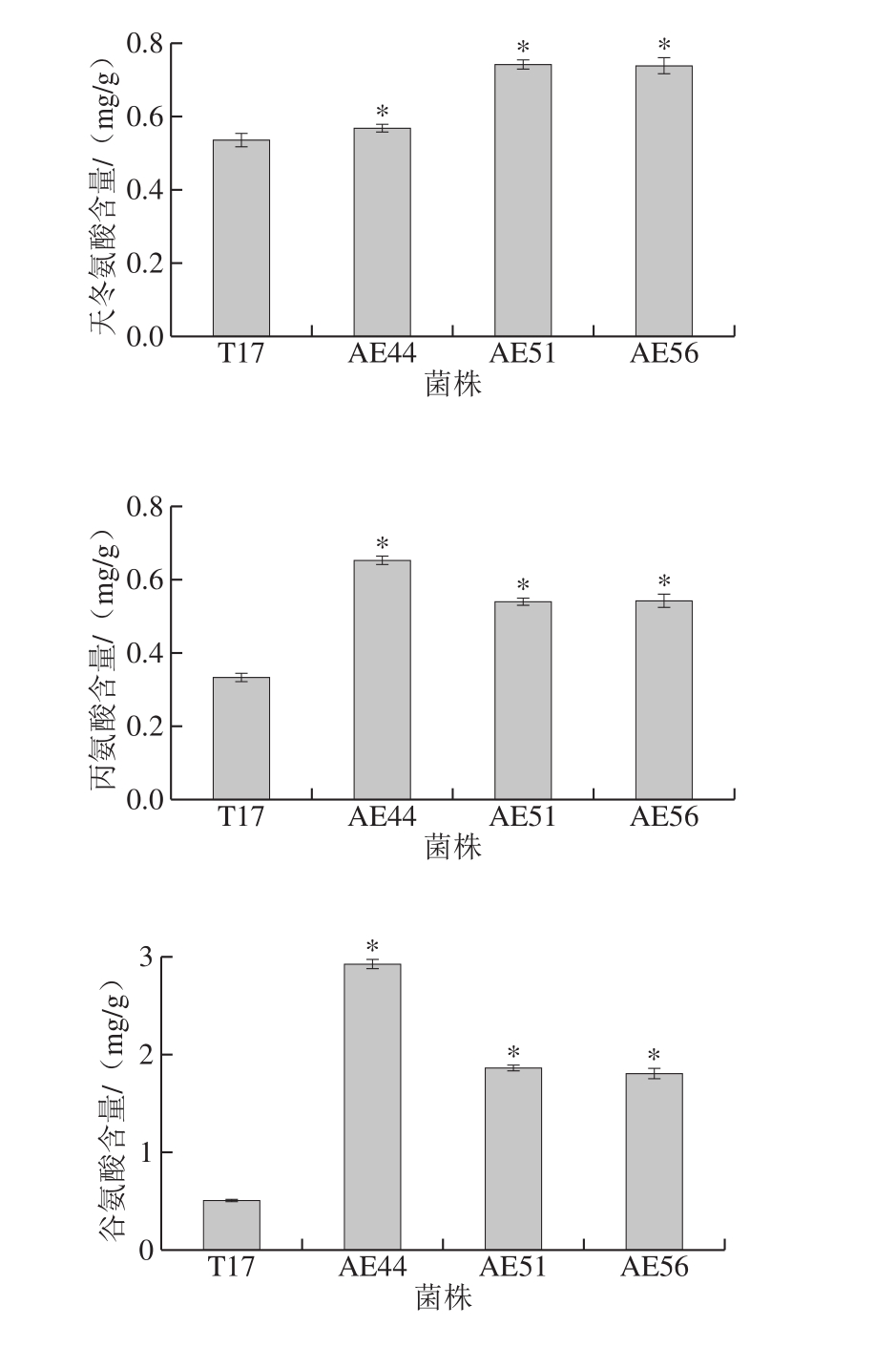
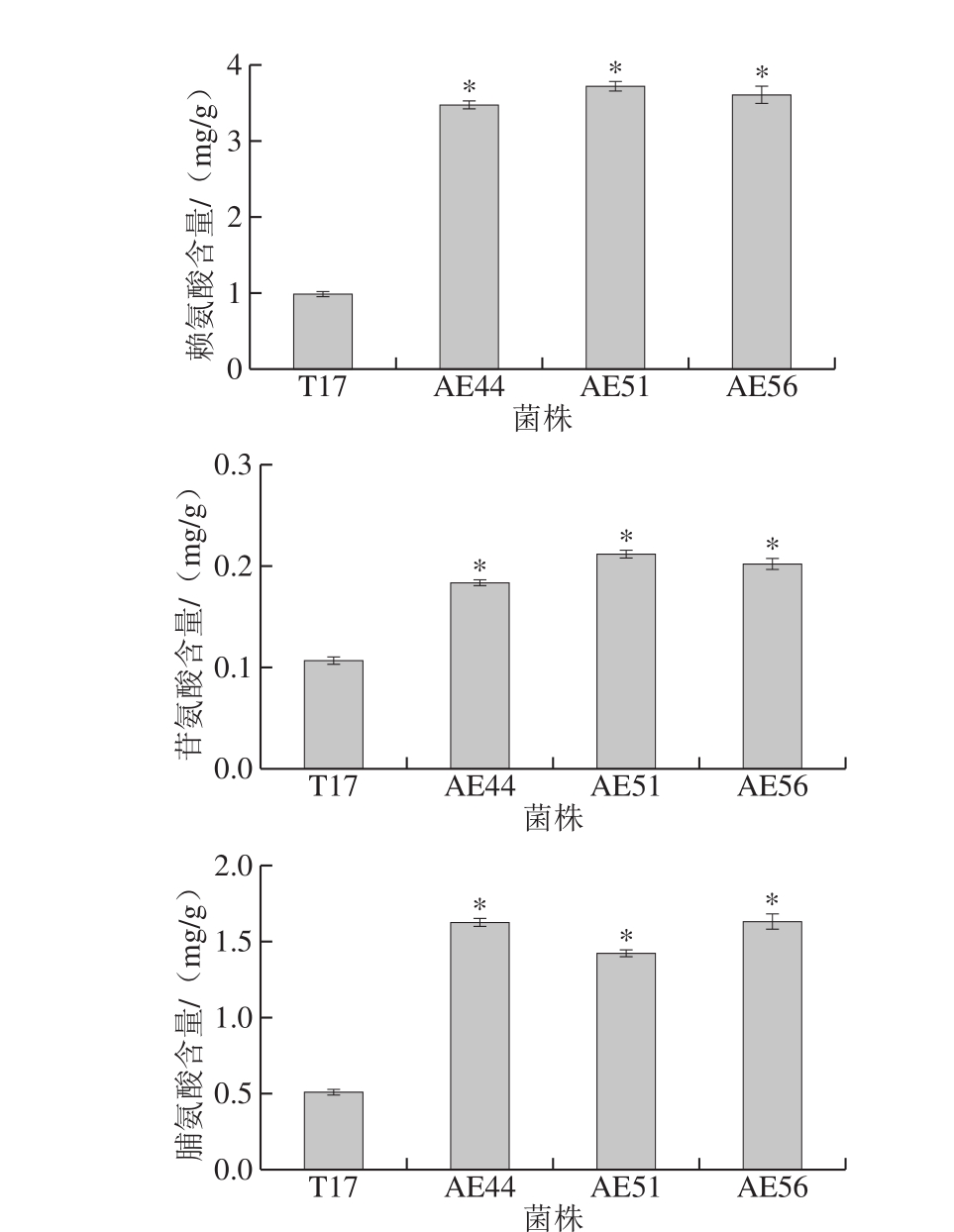
图3 自发酸胁迫条件下原始菌株与进化菌株胞内氨基酸含量的变化
Fig. 3 Comparison of intracellular contents of amino acids between the original and evolutionary strains under spontaneous acidic stress conditions
天冬氨酸能够消耗胞内H+转化为丙氨酸,同时,天冬氨酸还可以生成精氨酸,进入精氨酸脱亚胺酶系统产生ATP和NH3[21]。此外,氨基酸脱羧酶系统在微生物抵御外界酸胁迫中发挥重要作用[22]。在酸胁迫中,胞外的谷氨酸被转运到胞内,在谷氨酸脱羧酶的作用下被转化成γ-氨基丁酸(γ-aminobutyric acid,GABA)和CO2,同时消耗胞内H+;随后,合成的GABA被释放到胞外。由于GABA比谷氨酸的酸性弱,因此,这一过程不仅减少了胞内H+的浓度,也导致外界环境的碱化[23]。许多研究表明,赖氨酸也能够通过赖氨酸脱羧酶的作用消耗胞内H+,维持pHi值稳定并增强细胞对酸胁迫抗性[24-26]。甘氨酸和脯氨酸也可能通过脱羧酶的作用维持pHi值的稳定,作者前期研究也表明胞内甘氨酸的积累可能与ε-PL产生菌的耐酸机制有关[7];脯氨酸则被发现能够在胁迫条件下降低植物细胞酸性和维持生物大分子结构稳定等[27]。此外,赖氨酸为ε-PL合成的前体,天冬氨酸则是赖氨酸合成的前体,而谷氨酸则为赖氨酸的合成提供氨基[28],所以胞内赖氨酸、谷氨酸和天冬氨酸含量的增加也有利于ε-PL的合成。
2.5 自发酸胁迫条件下菌株细胞膜脂肪酸含量的差异
细胞膜可以依靠脂肪酸组分的变化应对外界的酸胁迫环境[29]。细胞膜脂肪酸包括饱和脂肪酸和不饱和脂肪酸,改变其比例和链长能够直接影响细胞膜的流动性与稳定性[30]。考察在自发酸胁迫条件下(48 h,pHex 3.2),原始菌株和进化菌株细胞膜脂肪酸成分的变化,结果见图4。S. diastatochromogenes T17的细胞膜脂肪酸主要由饱和脂肪酸肉豆蔻酸(C14:0)、十五烷酸(C15:0)、棕榈酸(C16:0)和硬脂酸(C18:0)以及不饱和脂肪酸棕榈油酸(C16:1)和油酸(C18:1)组成。在自发酸胁迫条件下,与原始菌株相比,进化菌株的细胞膜中饱和脂肪酸(C14:0、C15:0、C16:0和C18:0)相对含量下降;而不饱和脂肪酸(C16:1和C18:1)相对含量增加,其中增加最明显的为C16:1,进化菌株AE56的C16:1相对含量是原始菌株T17的6.04 倍。因此,进化菌株细胞膜脂肪酸具有更高的不饱和度(图5),从而增加细胞膜的流动性,更加有利于细胞膜的物质运输以及能量代谢等功能的发挥,以保证细胞在酸胁迫条件下的生存与功能行使。由图4可知,C16:0和C16:1在原始菌株和进化菌株的脂肪酸组成中所占比例较大,在自发酸胁迫条件下,虽然进化菌株中C16:0相对含量明显减少,C16:1相对含量明显增加,但是进化菌株的细胞膜脂肪酸的链长与原始菌株相比没有显著变化(图5)。

图4 自发酸胁迫条件下原始菌株与进化菌株细胞膜脂肪酸成分的变化
Fig. 4 Comparison of contents of membrane fatty acids between the original and evolutionary strains under spontaneous acidic stress conditions
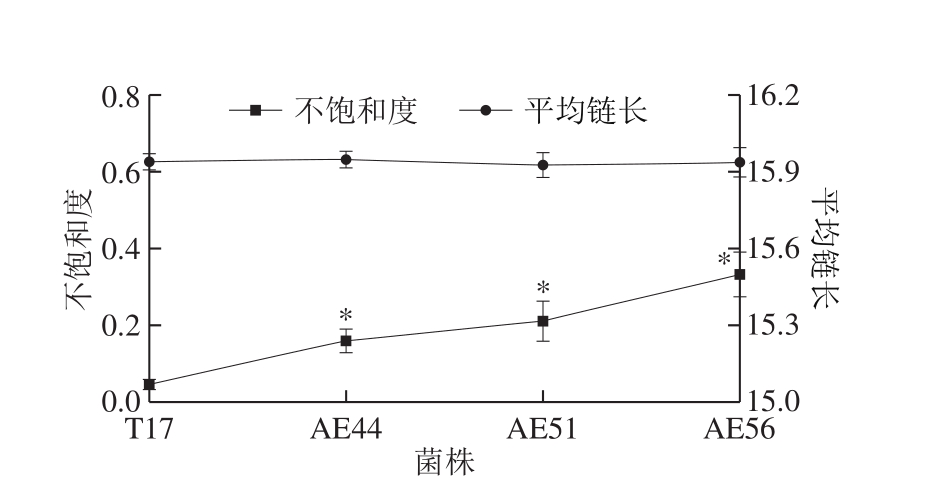
图5 自发酸胁迫条件下原始菌株与进化菌株细胞膜脂肪酸不饱和度和平均链长的变化
Fig. 5 Comparison of ratio of unsaturated/saturated fatty acids and mean chain length between the original and evolutionary strains under spontaneous acidic stress conditions
3 结 论
与原始菌株相比,酸性适应性进化得到的进化菌株在自发酸胁迫条件下能够在胞内保持更高的ATP含量和
H+-ATPase活性,积累更多的天冬氨酸、丙氨酸、谷氨酸、赖氨酸、甘氨酸以及脯氨酸,从而使pHi值维持在较高水平;同时,进化菌株中细胞膜脂肪酸的不饱和度升高,从而增强了细胞膜的流动性。这些变化减轻了自发酸胁迫对菌体的损伤。此外,进化菌株中较高的pHi值、胞内ATP、天冬氨酸、谷氨酸以及赖氨酸浓度也有利于ε-PL的合成。目前,其他研究者只注意到ε-PL的合成需要依赖酸性pH值环境[4],而忽略了这种酸性环境对产生菌而言是一种胁迫环境,本研究有利于充实革兰氏阳性菌对酸胁迫的响应机制,同时也为揭示ε-PL在酸性环境中合成的生理意义提供参考。
[1] SHIMA S, SAKAI H. Polylysine produced by Streptomyces[J].Agricultural and Biological Chemistry, 1977, 41(9): 1807-1809.DOI:10.1271/bbb1961.41.1807.
[2] SHIMA S, MATSUOKA H, IWAMOTO T, et al. Antimicrobial action of ε-poly-L-lysine[J]. The Journal of Antibiotics, 1984, 37(11):1449-1455. DOI:10.7164/antibiotics.37.1449.
[3] REN X D, CHEN X S, ZENG X, et al. Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation by Streptomyces sp. M-Z18 from agro-industrial by-products[J].Bioprocess and Biosystems Engineering, 2015, 38(6): 1113-1125.DOI:10.1007/s00449-015-1354-2.
[4] XU Z, XU Z, FENG X, et al. Recent advances in the biotechnological production of microbial poly(ɛ-L-lysine) and understanding of its biosynthetic mechanism[J]. Applied Microbiology and Biotechnology,2016, 100(15): 6619-6613. DOI:10.1007/s00253-016-7677-3.
[5] KAHAR P, IWATA T, HIRAKI J, et al. Enhancement of ε-polylysine production by Streptomyces albulus strain 410 using pH control[J].Journal of Bioscience and Bioengineering, 2001, 91(2): 190-194.DOI:10.1016/S1389-1723(01)80064-5.
[6] COTTER P D, HILL C. Surviving the acid test: responses of grampositive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3): 429-453. DOI:10.1128/MMBR.67.3.429-453.2003.
[7] 任喜东. 小白链霉菌响应酸性pH高产ε-聚赖氨酸的生理解析[D].无锡: 江南大学, 2015.
[8] 吴重德. 干酪乳杆菌抵御酸胁迫的生理机制解析[D]. 无锡: 江南大学, 2012.
[9] ÇAKAR Z P, SEKER U O S, TAMERLER C, et al. Evolutionary engineering of multiple-stress resistant Saccharomyces cerevisiae[J].FEMS Yeast Research, 2005, 5(6/7): 569-578. DOI:10.1016/j.femsyr.2004.10.010.
[10] COWEN L E, SANGLARD D, CALABRESE D, et al. Evolution of drug resistance in experimental populations of Candida albicans[J].Journal of Bacteriology, 2000, 182(6): 1515-1522. DOI:10.1128/JB.182.6.1515-1522.2000.
[11] FONG S S, BURGARD A P, HERRING C D, et al. In silico design and adaptive evolution of Escherichia coli for production of lactic acid[J]. Biotechnology and Bioengineering, 2005, 91(5): 643-648.DOI:10.1002/bit.20542.
[12] LI S, TANG L, CHEN X, et al. Isolation and characterization of a novel ε-poly-L-lysine producing strain: Streptomyces griseofuscus[J].Journal of Industrial Microbiology and Biotechnology, 2011, 38(4):557-563. DOI:10.1007/s10295-010-0803-9.
[13] CICHNA M, RAAB M, DAXECKER H, et al. Determination of fifteen nucleotides in cultured human mononuclear blood and umbilical vein endothelial cells by solvent generated ion-pair chromatography[J].Journal of Chromatography B, 2003, 787(2): 381-391. DOI:10.1016/S1570-0232(02)01007-3.
[14] BREEUWER P, DROCOURT J L, FRANK M R, et al. A novel method for continuous determination of the intracellular pH in bacteria with the internally conjugated fluorescent probe 5(and 6-)-carboxyfluorescein succinimidyl ester[J]. Applied and Environmental Microbiology, 1996, 62(1): 178-183. DOI:10.1128/AEM.62.1.178-183.1996.
[15] SASSER M. Identification of bacteria by gas chromatography of cellular fatty acids[J]. USFCC Newsl, 1990, 20: 1-6.
[16] BUDIN-VERNEUIL A, PICHEREAU V, AUFFRAY Y, et al.Proteomic characterization of the acid tolerance response in Lactococcus lactis MG1363[J]. Proteomics, 2005, 5(18): 4794-4807.DOI:10.1002/pmic.200401327.
[17] WU C D, ZHANG J, CHEN W, et al. A combined physiological and proteomic approach to reveal lactic-acid-induced alterations in Lactobacillus casei Zhang and its mutant with enhanced lactic acid tolerance[J]. Applied Microbiology and Biotechnology, 2012, 93(2):707-722. DOI:10.1007/s00253-011-3757-6.
[18] YAMANAKA K, MARUYAMA C, TAKAGI H, et al. ε-Poly-L-lysine dispersity is controlled by a highly unusual nonribosomal peptide synthetase[J]. Nature Chemical Biology, 2008, 4(12): 766-772.DOI:10.1038/nchembio.125.
[19] YAMANAKA K, KITO N, IMOKAWA Y, et al. Mechanism of ε-poly-L-lysine production and accumulation revealed by identification and analysis of an ε-poly-L-lysine-degrading enzyme[J]. Applied and Environmental Microbiology, 2010, 76(17): 5669-5675. DOI:10.1128/AEM.00853-10.
[20] FERNÁNDEZ M, ZÚÑIGA M. Amino acid catabolic pathways of lactic acid bacteria[J]. Critical Reviews in Microbiology, 2006, 32(3):155-183. DOI:10.1080/10408410600880643.
[21] ZHANG J, WU C, DU G, et al. Enhanced acid tolerance in Lactobacillus casei by adaptive evolution and compared stress response during acid stress[J]. Biotechnology and Bioprocess Engineering, 2012, 17(2): 283-289. DOI:10.1007/s12257-011-0346-6.
[22] COTTER P D, GAHAN C G, HILL C. A glutamate decarboxylase system protects Listeria monocytogenes in gastric fluid[J]. Molecular Microbiolology, 2001, 40(2): 465-475. DOI:10.1046/j.1365-2958.2001.02398.x.
[23] WATERMAN S R, SMALL P. Acid-sensitive enteric pathogens are protected from killing under extremely acidic conditions of pH 2.5 when they are inoculated onto certain solid food sources[J].Applied and Environmental Microbiology, 1998, 64(10): 3882-3886.DOI:10.1128/AEM.64.10.3882-3886.
[24] SENOUCI-REZKALLAH K, SCHMITT P, JOBIN M P. Amino acids improve acid tolerance and internal pH maintenance in Bacillus cereus ATCC14579 strain[J]. Food Microbiology, 2011, 28(3): 364-372.DOI:10.1016/j.fm.2010.09.003.
[25] RHEE J, RHEE J, RYU P, et al. Identification of the cadBA operon from Vibrio vulnificus and its inf l uence on survival to acid stress[J].FEMS Microbiology Letters, 2002, 208(2): 245-251. DOI:10.1111/j.1574-6968.2002.tb11089.x.
[26] IYER R, WILLIAMS C, MILLER C. Arginine-agmatine antiporter in extreme acid resistance in Escherichia coli[J]. Journal of Bacteriology,2003, 185(22): 6556-6561. DOI:10.1128/JB.185.22.6556-6561.2003.
[27] SCHAUF B, REPAS L M, KAUFMANN R. Localization of ultraweak photon emission in plants[J]. Photochemistry and Photobiology, 1992,55(2): 287-291. DOI:10.1111/j.1751-1097.1992.tb04238.x.
[28] TAKEHARA M, HIBINO A, SAIMURA M, et al. High-yield production of short chain length poly(ε-L-lysine) consisting of 5-20 residues by Streptomyces aureofaciens, and its antimicrobial activity[J].Biotechnology Letters, 2010, 32(9): 1299-1303. DOI:10.1007/s10529-010-0294-9.
[29] DENICH T J, BEAUDETTE L A, LEE H, et al. Effect of selected environmental and physico-chemical factors on bacterial cytoplasmic membranes[J]. Journal of Microbiological Methods, 2003, 52(2): 149-182. DOI:10.1016/S0167-7012(02)00155-0.
[30] RUSSELL N J. Mechanisms of thermal adaptation in bacteria:blueprints for survival[J]. Trends in Biochemical Sciences, 1984, 9(3):108-112. DOI:10.1016/0968-0004(84)90106-3.