目前,驴乳以其营养价值和潜在的健康效益逐渐引起人们的关注。与其他原料乳相比,驴乳最重要的特征是其化学成分与母乳类似[1]。因此,在牛乳蛋白过敏的情况下,与其他反刍动物乳相比,驴乳是良好的婴儿营养替代品[1]。此外,驴乳的生理保健和疾病预防也引发了医学界的关注,流行病学和机制研究已初步证明了驴乳具有一定的减轻氧化应激、抗菌、抗病毒、抗炎、抗肿瘤、改善免疫功能等作用[2-6]。
国内外研究主要集中在探究驴乳的组成、物化和营养性质以及功效,其中2011年在分子水平研究驴乳蛋白质组成取得了重要的进展[7]。此后,关于驴乳蛋白质组学的报道大量增加。研究表明,不同品种、同一品种中的个体动物之间的乳蛋白质含量和相对蛋白质组成不同[8-9]。虽然,目前关于驴乳的研究较多,但是德州驴作为我国主要品种之一,蛋白质组成的研究较少。因此,本实验以德州驴乳粉为研究对象,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、二维电泳、圆二色谱和基质辅助激光解析电离-飞行时间质谱(matrix assisted laser desorption ionization-time of fight-mass spectrometry,MALDITOF/TOF-MS)等技术手段揭示德州驴乳粉蛋白质的性质、结构和组成,以期为德州驴乳的深层次开发提供依据。
1 材料与方法
1.1 材料与试剂
冻干驴乳粉 东阿阿胶股份有限公司。
乙腈、甲醇、甲酸(均为质谱纯) 百灵威科技有限公司;牛血清白蛋白、尿素、二硫苏糖醇(dithiothreitol,DTT)、CHAPS 北京索莱宝科技有限公司;BCA蛋白浓度测定试剂盒 天根生化科技(北京)有限公司;Tris-base 美国阿拉丁公司;苯甲基磺酰氟 上海碧云天生物技术有限公司;Bio-Lyte 3-10 buffer、Ready Strip IPG Strips、Modified Trypsin(Sequencing Grade,Promega)SDS-PAGE Marker、毛细管凝胶电泳(capillary gel electrophoresis,CGE)Marker美国Bio-Rad公司;HiLoad 16/60 Superdex 200 pg制备级分子筛分离柱 美国通用电气公司。
1.2 仪器与设备
Orbitrap Fusion Lumos Tribrid MALDI-TOF/TOFMS、Multiskan GO多功能酶标仪 美国Thermo公司;Mini Protean 3 Cell SDS-PAGE仪、Protean IEF cell双向凝胶电泳(2-dimensional gel electrophoresis,2-DE)仪美国Bio-Rad公司;P/ACETM MDQ CGE仪 美国贝克曼库尔特有限公司;AKTA蛋白纯化系统 美国通用电气公司;MOS 450圆二色谱仪 法国Bio Logic公司。
1.3 方法
1.3.1 蛋白质特性的测定
1.3.1.1 BCA法测定蛋白质含量
按照BCA蛋白浓度测定试剂盒的方法检测驴乳粉的蛋白质含量。
1.3.1.2 SDS-PAGE测定蛋白质分子质量范围
根据刘晓等[10]的方法稍作修改。10%驴乳粉溶液稀释10 倍后,加入等量含DTT的2×Loading Buffer缓冲液,充分混匀,沸水浴5 min。浓缩胶5%,分离胶12%。上样量10 μL,将凝胶扫描电子图谱保存,电泳所用的Marker分子质量范围为10~250 kDa。
1.3.1.3 CGE分析蛋白质相对丰度
参考文献[11]的方法,略有改动。毛细管规格为内径100 μm,总长31 cm,有效长度20 cm,柱体温度40 ℃,电动进样,进样电压-10 kV,进样时间1 s,分离电压-12.4 kV,紫外检测波长280 nm,样品贮存温度30 ℃。
1.3.1.4 2-DE分析蛋白质等电点范围
根据陈静廷等[12]的方法,稍作修改。200 μL 10%驴乳粉溶液与800 μL的水化液混匀。取200 μL加载到电泳池,等电聚焦程序见表1。
表1 7 cm胶条的等电聚焦程序
Table 1 IEF program for 7 cm latex
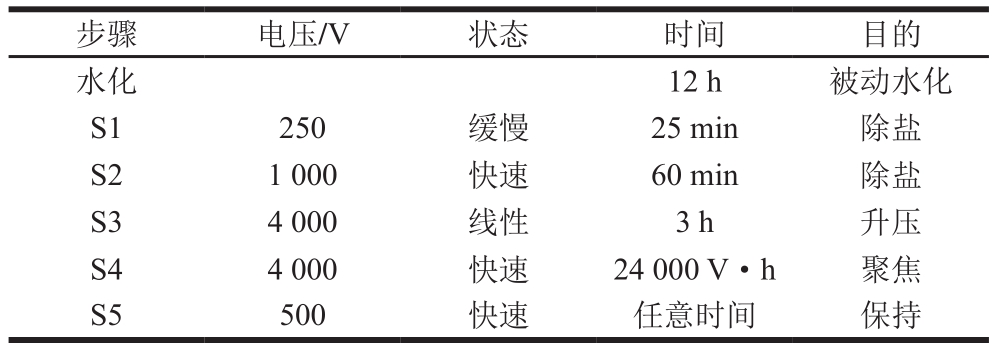
images/BZ_231_1276_1372_2256_1420.png水化 12 h 被动水化S1 250 缓慢 25 min 除盐S2 1 000 快速 60 min 除盐S3 4 000 线性 3 h 升压S4 4 000 快速 24 000 V·h 聚焦S5 500 快速 任意时间 保持
等电聚焦后立即进行胶条平衡。平衡分两步,每次15 min,分别使用5 mL含1% DTT平衡液和5 mL含2.5%碘乙酰胺平衡液。将平衡好的胶条置于12%聚丙烯酰胺凝胶上,并用1%的琼脂糖固定胶条,进行第二向电泳。凝胶用考马斯亮蓝染色后,以脱色液脱去背景颜色,使用凝胶成像设备扫描成电子图片保存。
1.3.2 蛋白质二级结构的表征
1.3.2.1 蛋白质的分离纯化
酪蛋白的纯化:称取一定量的驴乳粉,加入2.5 倍质量的50~55 ℃水充分溶解乳粉,将配制好的醋酸-醋酸钠溶液缓慢加入驴乳溶液中,直至淡黄色块状胶体完全沉淀为止。在加入缓冲液过程中,使用pH计控制缓冲液的pH值范围在4.6~4.8之间。3 000 r/min离心15 min,上清液为乳清蛋白粗品,沉淀为粗品酪蛋白。将粗品酪蛋白用无水乙醇沉淀3 次,每次洗涤后3 000 r/min离心15 min,最终得到白色洁净的酪蛋白,将酪蛋白移至表面皿中进行减压真空干燥。
乳清蛋白纯化:乳粉乳清蛋白质粗品经0.22 μm滤膜过滤,备用。利用分子筛纯化驴乳粉乳清蛋白。具体条件如下:层析柱条件:HiLoad 16/60 Superdex 200 pg制备级分子筛纯化层析柱,内径16 mm,柱床高度600 mm,柱床体积120 mL,分离范围10~600 kDa;AKTA纯化系统运行参数:流速恒定2 mL/min,室温环境纯化(20~25 ℃),最大压力0.3 MPa,缓冲体系pH 8.0(含100 mmol/L氯化钠的50 mmol/L Tris-HCl缓冲液),上样量3 mL,检测器包含紫外检测器(280、254、215 nm)、pH检测器、电导率检测器和温度检测器。
1.3.2.2 圆二色谱法检测蛋白质二级结构
参考文献[13]的方法,略有改动。0.5 mg/mL左右的蛋白质样品经过0.45 μm微孔滤膜处理后进行远紫外圆二色谱扫描,超纯水作为空白。测定条件:0.1 cm石英比色杯,温度25 ℃,光径0.1 cm,带宽1 nm,扫描范围250~190 nm,扫描速率0.5 nm/s,用平均残基摩尔椭圆率[θ]表示圆二色谱光谱数据,单位为(deg·cm2)/dmol,通过在线引擎采用SELCON3程序估算蛋白质的二级结构(http://dichroweb.cryst.bbk.ac.uk/html/home.shtml),匹配方式为Closest matching solution with all proteins。
1.3.3 蛋白质组成分析
驴奶粉经SDS-PAGE分离后,将3 个明显的蛋白区域分成3 份切开,转移至EP管中。蛋白质的脱色酶切方法参考文献[14]。浓缩液与基质混合后,采用MALDI-TOF/TOF-MS分析。利用Mascot软件的SwissPort数据库进行搜索。检索分类(Taxonomy)为Equus caballus,Mascot检索P值小于0.05和Mascot得分大于41 分的结果被认为鉴定成功。
1.4 数据处理
以3 次重复实验每次同时做平行实验所得的数据为结果,用平均值表示。
2 结果与分析
2.1 蛋白质的基本性质
2.1.1 蛋白质含量的分析
利用BCA法测定驴乳粉蛋白质质量分数为16.10%,折合驴乳蛋白质质量分数约为1.61%,这与相关研究[15-16]结果一致。
2.1.2 蛋白质分子质量的分布

图1 驴乳粉SDS-PAGE图
Fig. 1 SDS-PAGE profile of donkey milk powder
如图1所示,分子质量主要分布在3 个区域,10~20 kDa小分子质量的乳清蛋白区域,28~36 kDa的酪蛋白区域,53~78 kDa的大分子乳清蛋白区域。通过分子标记物条带和相关报道[15,17-20]的驴乳蛋白质迁移模式,识别出以下蛋白:乳铁蛋白(分子质量约为75 kDa)、血清白蛋白(分子质量约为67 kDa)、免疫球蛋白(分子质量约为60 kDa)、酪蛋白(分子质量约为28~36 kDa)、β-乳球蛋白(分子质量约为18 kDa)、溶菌酶(分子质量约为15 kDa)、α-乳清蛋白(分子质量约为14 kDa)。
2.1.3 蛋白质丰度

图2 驴乳粉GCE结果
Fig. 2 GCE spectra of donkey milk powder
由图2可以看出,驴乳粉蛋白质主要集中在酪蛋白区域和小分子质量乳清蛋白区域,且酪蛋白丰度低于小分子质量乳清蛋白丰度,这与Salimei[17]、张岩春[21]、Malacarne[22]等的报道一致。人乳乳清蛋白约占总蛋白50%,而牛乳的乳清蛋白不足20%[23],由此可见,与牛乳相比,驴乳更接近于人乳,更易被消化吸收。酪蛋白与乳清蛋白的比值是牛乳致敏能力的重要影响因素[24],Cunsolo等[8]通过综合分析驴乳的相关临床研究发现,低酪蛋白与乳清蛋白比率是驴乳低致敏性的主要因素之一。
2.1.4 蛋白质等电点
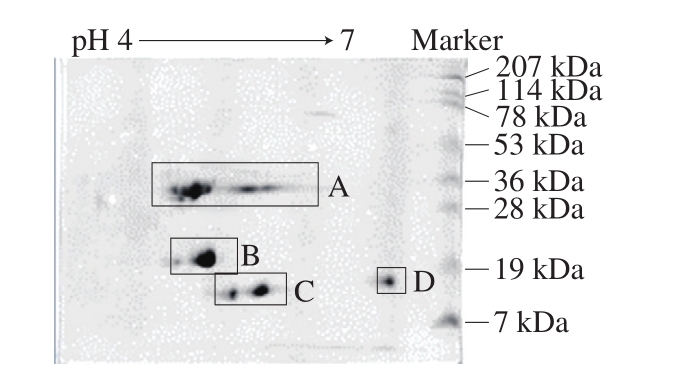
图3 驴乳粉2-DE图
Fig. 3 2-DE profile of donkey milk powder
如图3所示,水平方向为第一固相pH值梯度等电聚焦,垂直向为第二向垂直板SDS-PAGE。驴乳粉蛋白的等电点均匀分布在4.5~6.5之间,与人体pH值酸碱环境相近。驴乳蛋白质条带清晰单一,结构完整,与Vincenzetti等[25]的报道驴乳蛋白质二维电泳结果一致。A区域分子质量为28~36 kDa,pI在4.5~6之间;B区域分子质量约为19 kDa,pI在5~5.5之间;C区域分子质量为7~19 kDa,pI在5~6之间;D区域分子质量约为19 kDa,pI在6.5左右。根据驴乳常见蛋白分子质量的大小和pI可推断[8,25],A区域蛋白为酪蛋白,B区域蛋白为β-乳球蛋白,C区域蛋白为α-乳清蛋白。
2.2 蛋白质结构的表征
2.2.1 蛋白质的分离纯化
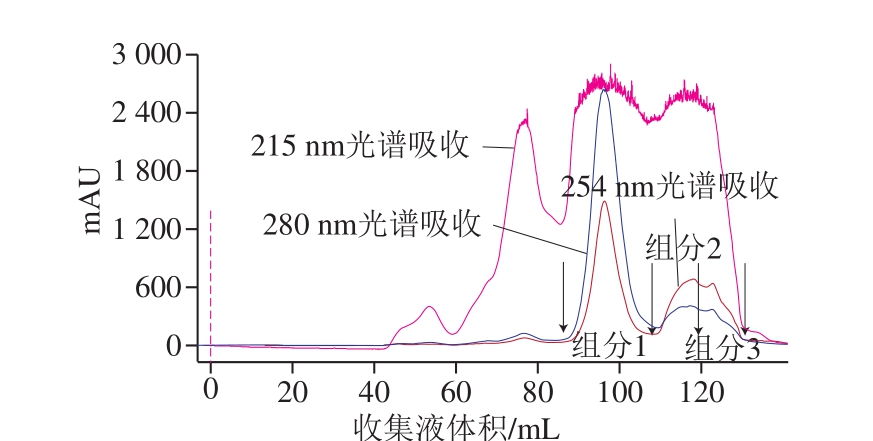
图4 驴乳粉分子筛纯化洗脱图
Fig. 4 Molecular sieve gel chromatographic patterns of donkey milk powder
从图4可以看出,组分1和组分2之间并无明显280 nm吸收峰,且电泳图谱中也并未发现明显酪蛋白条带,由此可见,经第1步粗分离后,酪蛋白和乳清蛋白已基本分离。第2步经分子筛纯化,由图4可以找到3 个典型性蛋白峰,非常明显3 个典型性蛋白质峰对应3 个不同分子质量的区域的蛋白质,分别为大分子质量乳清蛋白和2 个不同分子质量的小分子质量乳清蛋白。由图4可知,在驴乳粉纯化蛋白质峰前,有一个215 nm吸收峰,该处峰可能为糖类分子及其他大分子杂质。经冻干称质量计算驴乳粉蛋白质综合回收率在90%以上。

图5 纯化驴乳粉SDS-PAGE图
Fig. 5 SDS-PAGE patterns of puri fied donkey milk powder
由图5可以看出,经等电点沉淀分离酪蛋白,再经分子筛纯化乳清蛋白,电泳条带非常清晰,可得到较为单一的蛋白质组分。由此可见醋酸-醋酸钠等电点沉淀配合Superdex分子筛纯化乳粉中的蛋白质方法较为理想,为后期靶向研究蛋白功能,开发功能性蛋白分子提供理论依据。
2.2.2 蛋白质二级结构分析
表2 各纯化蛋白质组分的二级结构分析
Table 2 Secondary structures of purified protein components from donkey mild powder

images/BZ_233_1276_581_2254_675.png乳粉粗酪蛋白 7.2 37 22.7 33.1乳粉大分子质量乳清蛋白 22.8 24.7 22.2 30.3乳粉小分子质量乳清蛋白1 7.8 36.3 23.1 32.7乳粉小分子质量乳清蛋白2 6.5 37.9 22.9 32.7
如表2所示,驴乳粉中的酪蛋白二级结构主要以β-折叠、无规卷曲和β-转角为主;大分子质量乳清蛋白α-螺旋、β-折叠、β-转角和无规卷曲比例较为均衡;小分子质量乳清蛋白仍主要以β-折叠、无规卷曲和β-转角为主。这与预期结果一致,Aspre等[26]报道驴乳主要富含脯氨酸、亮氨酸、异亮氨酸和缬氨酸。而脯氨酸具有环状结构有利于β-转角的形成,缬氨酸和异亮氨酸易形成β-折叠。刘微等[27]也报道人乳β-酪蛋白单体二级结构以β-折叠、无规卷曲和β-转角为主,推测驴乳酪蛋白二级结构与母乳类似,可能是驴乳低致敏性的原因之一。
2.2.3 蛋白质组成的分析
表3 驴乳粉常见蛋白质分析结果
Table 3 Analysis of common protein components in donkey milk
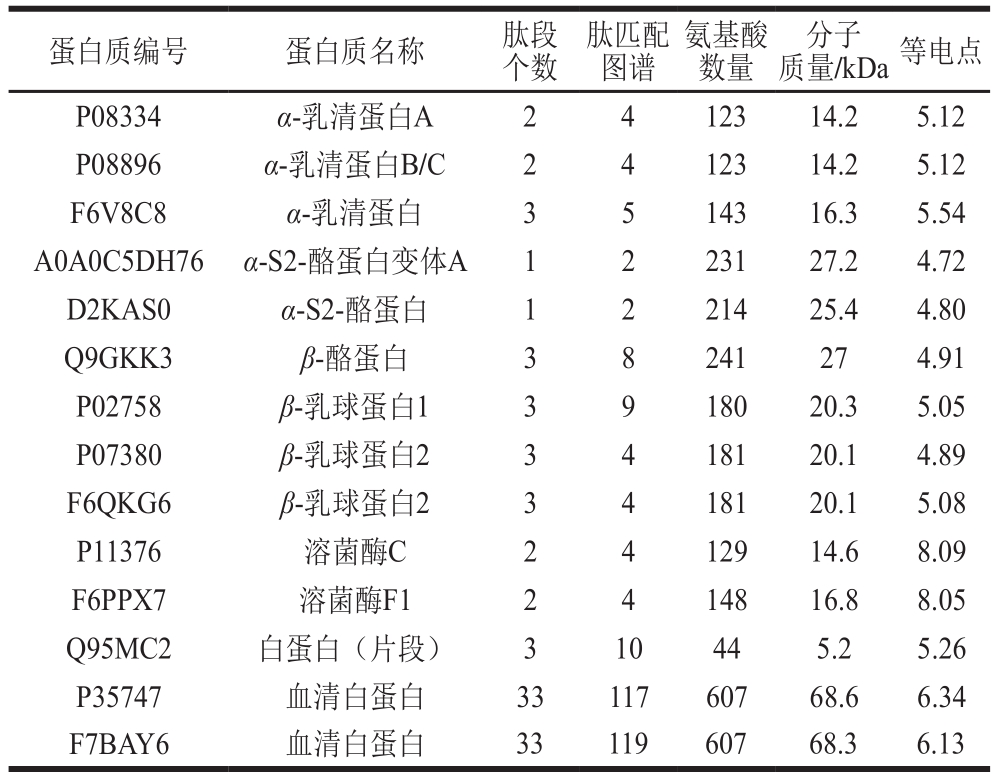
蛋白质编号 蛋白质名称 肽段个数肽匹配图谱氨基酸数量分子质量/kDa等电点P08334 α-乳清蛋白A 2 4 123 14.2 5.12 P08896 α-乳清蛋白B/C 2 4 123 14.2 5.12 F6V8C8 α-乳清蛋白 3 5 143 16.3 5.54 A0A0C5DH76 α-S2-酪蛋白变体A 1 2 231 27.2 4.72 D2KAS0 α-S2-酪蛋白 1 2 214 25.4 4.80 Q9GKK3 β-酪蛋白 3 8 241 27 4.91 P02758 β-乳球蛋白1 3 9 180 20.3 5.05 P07380 β-乳球蛋白2 3 4 181 20.1 4.89 F6QKG6 β-乳球蛋白2 3 4 181 20.1 5.08 P11376 溶菌酶C 2 4 129 14.6 8.09 F6PPX7 溶菌酶F1 2 4 148 16.8 8.05 Q95MC2 白蛋白(片段) 3 10 44 5.2 5.26 P35747 血清白蛋白 33 117 607 68.6 6.34 F7BAY6 血清白蛋白 33 119 607 68.3 6.13
利用SDS-PAGE结合MALDI-TOF/TOF-MS的方法,共鉴定出386 种蛋白质,显著高于Cunsolo等[7]报道的106 种蛋白、古丽巴哈尔·卡吾力等[14]报道的283 种蛋白、张新浩等[28]报道的216 个乳清蛋白。鉴定出的386 种蛋白质,其中有72 种蛋白为未命名蛋白,剩余314 种已命名蛋白。在314 种已命名蛋白质中,101 种成分是常见的驴乳蛋白,包括87 种免疫λ轻链可变区片段,剩余的14 种蛋白主要是酪蛋白、α-乳清蛋白、β-乳球蛋白、溶菌酶、血清白蛋白,见表3。除常见驴乳蛋白外,有139 种(约占总识别蛋白的36.01%)蛋白首次在驴乳中鉴定出的蛋白,见表4。
根据驴乳蛋白2-DE图谱,酪蛋白部分存在一些蛋白斑点,经MALDI-TOF/TOF-MS鉴定后,发现驴乳蛋白存在3 种酪蛋白:一种是β-酪蛋白(27 kDa,pI 4.91)和2 种α-S2-酪蛋白(27.2 kDa,pI 4.72;25.4 kDa,pI 4.8)。α-S2-酪蛋白的异质性主要取决于磷酸化程度和RNA错误剪接事件产生的内部缺失异构体[8]。研究表明,分子质量25.4 kDa的蛋白与α-S2-酪蛋白的区别在于Asn176~Gln180五肽的缺失[29]。驴乳α-乳清蛋白A和α-乳清蛋白B/C(14.2 kDa)的发现与Bertino等[30]报道一致,α-乳清蛋白(16.3 kDa),是乳清蛋白(Met 90)的氧化甲硫氨酸形式,这是由于体内氧化应激导致的α-乳清蛋白同种型[31]。驴乳β-乳球蛋白存在2 种不同的形式,β-乳球蛋白I和β-乳球蛋白II(同分异构体II B、C、D)[25],但是在本次鉴别中只发现了3 种同分异构体,可能与所使用的鉴别方法的低敏感性有关。在驴乳中,已鉴定出2 个溶菌酶的变体,分子质量分别为14.6 kDa和16.8 kDa,分子质量的差异主要与49、52、61位氨基酸残基不同有关[32]。值得注意的是,此次鉴别出的驴乳血清白蛋白含有607个氨基酸,分子质量为68.3~68.6 kDa,与Cunsolo等[8]报道的驴乳血清白蛋白含有583 个氨基酸,分子质量为65.584 kDa略有不同,但是与鲜马奶血清白蛋白含有的氨基酸及分子质量(607 个氨基酸,68.3 kDa)一致[13]。
表4 驴乳粉首次鉴定蛋白组分分析
Table 4 Analysis of donkey milk powder protein components first identified in this study
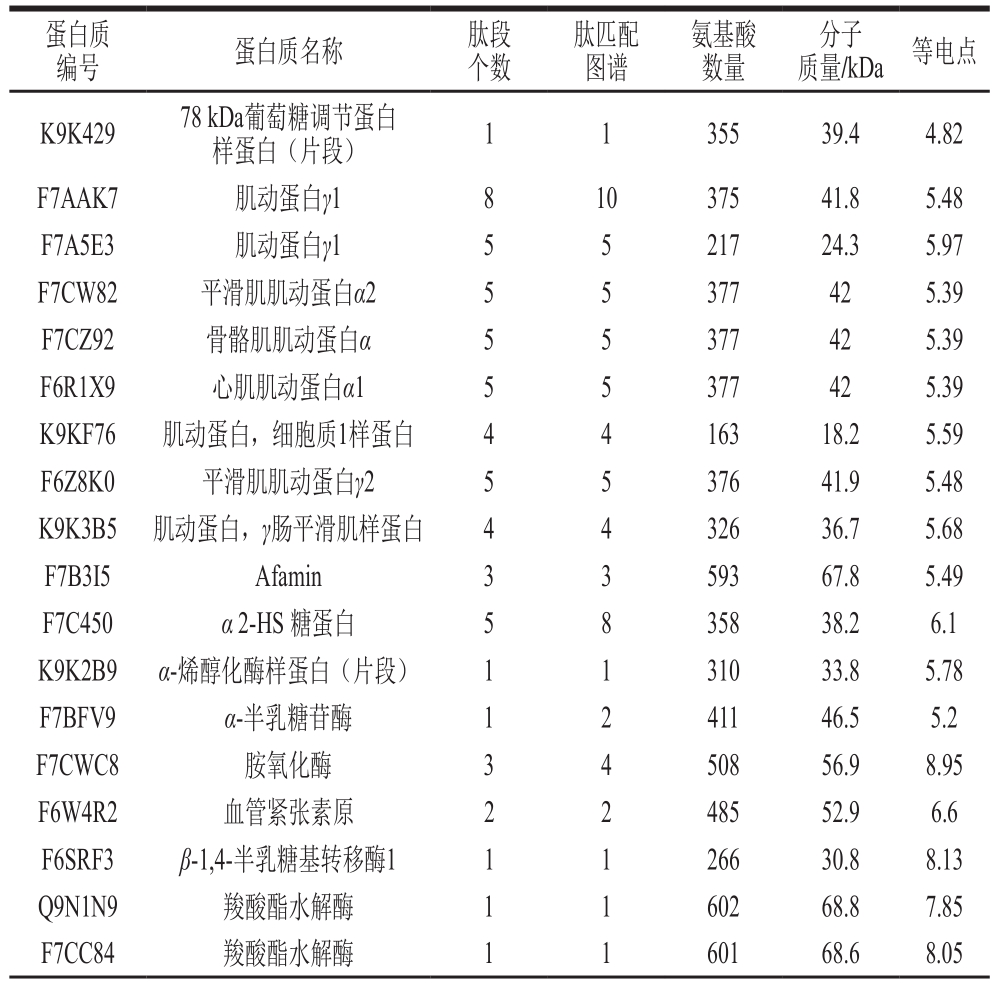
蛋白质编号 蛋白质名称 肽段个数肽匹配图谱氨基酸数量分子质量/kDa 等电点K9K429 78 kDa葡萄糖调节蛋白样蛋白(片段) 1 1 355 39.4 4.82 F7AAK7 肌动蛋白γ1 8 10 375 41.8 5.48 F7A5E3 肌动蛋白γ1 5 5 217 24.3 5.97 F7CW82 平滑肌肌动蛋白α2 5 5 377 42 5.39 F7CZ92 骨骼肌肌动蛋白α 5 5 377 42 5.39 F6R1X9 心肌肌动蛋白α1 5 5 377 42 5.39 K9KF76 肌动蛋白,细胞质1样蛋白 4 4 163 18.2 5.59 F6Z8K0 平滑肌肌动蛋白γ2 5 5 376 41.9 5.48 K9K3B5 肌动蛋白,γ肠平滑肌样蛋白 4 4 326 36.7 5.68 F7B3I5 Afamin 3 3 593 67.8 5.49 F7C450 α 2-HS 糖蛋白 5 8 358 38.2 6.1 K9K2B9 α-烯醇化酶样蛋白(片段) 1 1 310 33.8 5.78 F7BFV9 α-半乳糖苷酶 1 2 411 46.5 5.2 F7CWC8 胺氧化酶 3 4 508 56.9 8.95 F6W4R2 血管紧张素原 2 2 485 52.9 6.6 F6SRF3 β-1,4-半乳糖基转移酶1 1 1 266 30.8 8.13 Q9N1N9 羧酸酯水解酶 1 1 602 68.8 7.85 F7CC84 羧酸酯水解酶 1 1 601 68.6 8.05
续表4

蛋白质编号 蛋白质名称 肽段个数肽匹配图谱氨基酸数量分子质量/kDa 等电点Q95MC4 心脏α肌动蛋白(片段) 1 1 75 8.2 4.78 F6U904 CD36 1 1 472 52.8 8.88 Q9TQV4 Clone 7转铁蛋白(片段) 1 2 10 1.2 7.18 F7A3F7 I型胶原蛋白α1链 3 8 1 455 140.6 5.66 F6VUP8 I型胶原蛋白α1链 3 8 1 449 140.1 6.09 F6RVX8 I型胶原蛋白α1链 3 8 1 432 138 8.27 F7D9C7 I型胶原蛋白α1链 3 8 1 448 140 6.18 F7D939 I型胶原蛋白α1链 3 8 1 448 139.9 7.27 F6SSG3 I型胶原蛋白α1链 3 8 1 424 137.3 8.25 F6RTH9 I型胶原蛋白α2链 6 9 1 357 128 9.03 F6RUA6 I型胶原蛋白α2链 6 9 1 364 128.6 9.03 F6RTL6 I型胶原蛋白α2链 6 9 1 364 128.8 9.19 F6RTN7 I型胶原蛋白α2链 6 9 1 364 128.7 8.98 F6RTP3 I型胶原蛋白α2链 6 9 1 364 128.7 9.04 F6RTJ6 I型胶原蛋白α2链 6 9 1 359 128.3 9.09 F6RTI8 I型胶原蛋白α2链 6 9 1 357 128 8.97 F7A1L2 补体C1r亚成分样 1 1 483 53.2 7.05 K9KBR1 补体因子B样蛋白(片段) 1 1 227 25.6 8.62 F6XRJ3 DnaJ热休克蛋白家族(Hsp40)成员C3 2 2 477 54.8 5.95 K9KFG5 DnaJ样蛋白亚家族C成员3样蛋白(片段) 2 2 358 41.7 5.47 A2Q0Z0 延长因子1α1 1 1 462 50.1 9.01 F6V7C1 烯醇酶1 1 1 434 47.1 6.8 F6QYS3 细胞外基质蛋白1 1 1 544 60.8 6.51 F6RGN2 脂肪酸结合蛋白5 1 1 135 15.1 6.15 F7C7J0 IgA和IgM的Fc片段受体 1 1 530 56.4 9.8 F6SX98 果糖二磷酸醛缩酶 1 1 381 41.1 8.09 F6T0P6 GC,VD结合蛋白 4 5 474 52.8 5.39 F6RDD3 珠蛋白A1 3 4 147 16.1 7.02 F6RF57 珠蛋白B1 1 1 147 16.1 8.65 F6Z4B4 热休克蛋白家族A(Hsp70)成员13 2 2 471 51.9 5.31 F6Z587 热休克蛋白家族D(Hsp60)成员1 3 3 575 61.1 6.04 F6X1I8 血液结合素 3 11 462 51.3 7.65 F6WFI8 组蛋白H2B 1 1 127 14.1 10.17 F7AHT9 组蛋白H2B 2 7 126 13.9 10.32 F7E1X9 组蛋白H2B 3 8 126 13.9 10.32 F6UGW9 组蛋白H2B 2 7 126 13.9 10.32 F6PWV1 组蛋白H2B 3 8 126 13.9 10.32 F6VYH8 组蛋白H2B 3 8 126 13.9 10.32 F7A4V1 组蛋白H2B 2 7 126 13.9 10.32 F6TWM4 组蛋白H2B 3 8 126 13.9 10.32 F7ASE9 组蛋白H2B 3 8 126 13.9 10.32 F7DIN7 组蛋白H2B 2 7 126 13.9 10.32 F7AZR5 组蛋白H2B 2 7 126 13.9 10.32 F7CJ51 组蛋白H2B 3 8 126 13.9 10.32 F6PRL4 组蛋白H2B 2 7 126 14.0 10.37 F6SK17 组蛋白H2B 2 7 126 13.9 10.32 F6VUX0 组蛋白H2B 3 8 126 13.9 10.32 F7DLL0 组蛋白H2B 3 8 126 13.9 10.32 F7BUY8 多磷酸肌醇-5-磷酸酶D 1 1 1 184 132.7 7.88 F7BUL4 多磷酸肌醇-5-磷酸酶D 1 1 1 172 131.6 7.88 F6QX36 交联-α-胰蛋白酶抑制物重链1 1 1 909 101.1 7.02 F6SIE2 细胞间黏附分子3 1 1 510 55.4 6.6 F7B7X0 角蛋白1 5 15 639 66.1 8.07
续表4
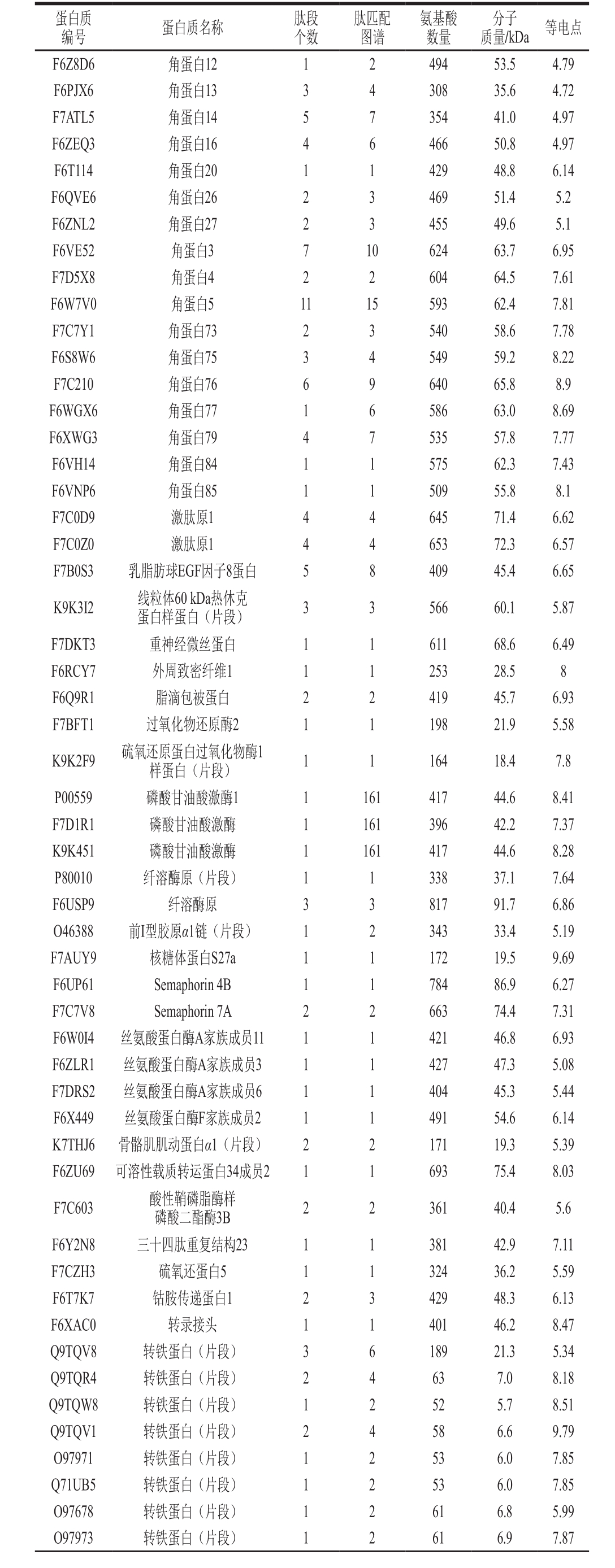
蛋白质编号 蛋白质名称 肽段个数肽匹配图谱氨基酸数量分子质量/kDa 等电点F6Z8D6 角蛋白12 1 2 494 53.5 4.79 F6PJX6 角蛋白13 3 4 308 35.6 4.72 F7ATL5 角蛋白14 5 7 354 41.0 4.97 F6ZEQ3 角蛋白16 4 6 466 50.8 4.97 F6T114 角蛋白20 1 1 429 48.8 6.14 F6QVE6 角蛋白26 2 3 469 51.4 5.2 F6ZNL2 角蛋白27 2 3 455 49.6 5.1 F6VE52 角蛋白3 7 10 624 63.7 6.95 F7D5X8 角蛋白4 2 2 604 64.5 7.61 F6W7V0 角蛋白5 11 15 593 62.4 7.81 F7C7Y1 角蛋白73 2 3 540 58.6 7.78 F6S8W6 角蛋白75 3 4 549 59.2 8.22 F7C210 角蛋白76 6 9 640 65.8 8.9 F6WGX6 角蛋白77 1 6 586 63.0 8.69 F6XWG3 角蛋白79 4 7 535 57.8 7.77 F6VH14 角蛋白84 1 1 575 62.3 7.43 F6VNP6 角蛋白85 1 1 509 55.8 8.1 F7C0D9 激肽原1 4 4 645 71.4 6.62 F7C0Z0 激肽原1 4 4 653 72.3 6.57 F7B0S3 乳脂肪球EGF因子8蛋白 5 8 409 45.4 6.65 K9K3I2 线粒体60 kDa热休克蛋白样蛋白(片段) 3 3 566 60.1 5.87 F7DKT3 重神经微丝蛋白 1 1 611 68.6 6.49 F6RCY7 外周致密纤维1 1 1 253 28.5 8 F6Q9R1 脂滴包被蛋白 2 2 419 45.7 6.93 F7BFT1 过氧化物还原酶2 1 1 198 21.9 5.58 K9K2F9 硫氧还原蛋白过氧化物酶1样蛋白(片段) 1 1 164 18.4 7.8 P00559 磷酸甘油酸激酶1 1 161 417 44.6 8.41 F7D1R1 磷酸甘油酸激酶 1 161 396 42.2 7.37 K9K451 磷酸甘油酸激酶 1 161 417 44.6 8.28 P80010 纤溶酶原(片段) 1 1 338 37.1 7.64 F6USP9 纤溶酶原 3 3 817 91.7 6.86 O46388 前I型胶原α1链(片段) 1 2 343 33.4 5.19 F7AUY9 核糖体蛋白S27a 1 1 172 19.5 9.69 F6UP61 Semaphorin 4B 1 1 784 86.9 6.27 F7C7V8 Semaphorin 7A 2 2 663 74.4 7.31 F6W0I4 丝氨酸蛋白酶A家族成员11 1 1 421 46.8 6.93 F6ZLR1 丝氨酸蛋白酶A家族成员3 1 1 427 47.3 5.08 F7DRS2 丝氨酸蛋白酶A家族成员6 1 1 404 45.3 5.44 F6X449 丝氨酸蛋白酶F家族成员2 1 1 491 54.6 6.14 K7THJ6 骨骼肌肌动蛋白α1(片段) 2 2 171 19.3 5.39 F6ZU69 可溶性载质转运蛋白34成员2 1 1 693 75.4 8.03 F7C603 酸性鞘磷脂酶样磷酸二酯酶3B 2 2 361 40.4 5.6 F6Y2N8 三十四肽重复结构23 1 1 381 42.9 7.11 F7CZH3 硫氧还蛋白5 1 1 324 36.2 5.59 F6T7K7 钴胺传递蛋白1 2 3 429 48.3 6.13 F6XAC0 转录接头 1 1 401 46.2 8.47 Q9TQV8 转铁蛋白(片段) 3 6 189 21.3 5.34 Q9TQR4 转铁蛋白(片段) 2 4 63 7.0 8.18 Q9TQW8 转铁蛋白(片段) 1 2 52 5.7 8.51 Q9TQV1 转铁蛋白(片段) 2 4 58 6.6 9.79 O97971 转铁蛋白(片段) 1 2 53 6.0 7.85 Q71UB5 转铁蛋白(片段) 1 2 53 6.0 7.85 O97678 转铁蛋白(片段) 1 2 61 6.8 5.99 O97973 转铁蛋白(片段) 1 2 61 6.9 7.87
续表4

蛋白质编号 蛋白质名称 肽段个数肽匹配图谱氨基酸数量分子质量/kDa 等电点O97966 转铁蛋白(片段) 1 2 61 6.9 8.32 Q9TQV7 转铁蛋白(片段) 2 3 54 6.0 8.38 F6UMQ4 转化生长因子β诱导 5 9 552 59.8 5.47 F6VB94 转化生长因子β诱导 6 10 666 72.5 6.83 K9K4R7 微管蛋白α链(片段) 1 2 393 43.8 5.58 F6ZSB4 微管蛋白α链 1 2 451 50.1 5.06 F7ANC9 微管蛋白α链 1 2 454 50.4 5.06 F6YRE0 微管蛋白α链 1 2 449 49.9 5.1 F6SAV5 微管蛋白α链 1 2 455 50.5 5.03 F6YM88 泛素B 1 1 229 25.7 7.43 F6Y4I1 α-D-葡萄糖-1-磷酸脲苷酰转移酶 1 2 502 56.2 7.61 K9KFU8 α-D-葡萄糖-1-磷酸脲苷酰转移酶样蛋白(片段) 1 2 216 23.8 8.32 F6Z129 Vanin 1 3 4 516 57.5 5.27 K9KER8 黄嘌呤脱氢酶/氧化酶样蛋白(片段) 1 1 110 12.1 9.44
3 结 论
本实验主要研究德州驴乳粉蛋白质的性质、结构和组成。研究表明,驴乳粉蛋白质质量分数为16.10%,等电点均匀分布在4.5~6.5之间,分子质量主要集中在10~20 kDa小分子质量的乳清蛋白区域、28~36 kDa的酪蛋白区域和53~78 kDa的大分子乳清蛋白区域。驴乳粉酪蛋白和小分子质量乳清蛋白二级结构主要以β-折叠、无规卷曲和β-转角为主,大分子质量乳清蛋白二级结构较为均衡。通过与马科蛋白图库进行对比,检索出386 种可识别的蛋白,其中有139 种蛋白首次在驴乳中发现,为揭示驴乳的生理功效提供理论基础。
[1] CLAEYS W L, VERRAES C, CARDOEN S, et al. Consumption of raw or heated milk from different species: an evaluation of the nutritional and potential health benefits[J]. Food Control, 2014, 42(3):188-201. DOI:10.1016/j.foodcont.2014.01.045.
[2] ZHANG W W, ZHAO H Q, XU T F, et al. Chemical and nutritional compositions of donkey milk and its bioactive properties[J]. Journal of Food Safety and Quality, 2017, 8(12): 4574-4581. DOI:10.3969/j.issn.2095-0381.2017.12.013.
[3] ŠARIĆ L, PEZO L, ŠARIĆ B, et al. Calcium-dependent antibacterial activity of donkey’s milk against Salmonella[J]. Annals of Microbiology,2017, 67(2): 185-194. DOI:10.1007/s13213-016-1250-2.
[4] JIANG L, LV J Y, LIU J W, et al. Donkey milk lysozyme ameliorates dextran sulfate sodium-induced colitis by improving intestinal barrier function and gut microbiota composition[J]. Journal of Functional Foods, 2018, 48: 144-152. DOI:10.1016/j.jff.2018.07.005.
[5] GIOVANNA T, GINA C, CHIARA D F, et al. Human milk and donkey milk, compared to cow milk, reduce inflammatory mediators and modulate glucose and lipid metabolism, acting on mitochondrial function and oleylethanolamide levels in rat skeletal muscle[J]. Frontiers in Physiology, 2018, 9: 1-15. DOI:10.3389/fphys.2018.00032.
[6] TRINCHESE G, CAVALIERE G, CANANI R B, et al. Human,donkey and cow milk differently affects energy efficiency and inflammatory state by modulating mitochondrial function and gut microbiota[J]. Journal of Nutritional Biochemistry, 2015, 26(11):1136-1146. DOI:10.1016/j.jnutbio.2015.05.003.
[7] CUNSOLO V, MUCCILLI V, FASOLI E, et al. Poppea’s bath liquor:the secret proteome of she-donkey’s milk[J]. Journal of Proteomics,2011, 74(10): 2083-2099. DOI:10.1016/j.jprot.2011.05.036.
[8] CUNSOLO V, SALETTI R, MUCCILLI V, et al. Proteins and bioactive peptides from donkey milk: the molecular basis for its reduced allergenic properties[J]. Food Research International, 2017,99: 41-57. DOI:10.1016/j.foodres.2017.07.002.
[9] CRISCIONE A, CUNSOLO V, BORDONARO S, et al. Donkeys’milk protein fraction investigated by electrophoretic methods and mass spectrometric analysis[J]. International Dairy Journal, 2009, 19(4):190-197. DOI:10.1016/j.idairyj.2008.10.015.
[10] 刘晓, 姜竹茂, 芦晶, 等. 热处理对牛乳蛋白质消化率的影响[J].中国乳品工业, 2017, 45(11): 14-18. DOI:10.3969/j.issn.1001-2230.2017.11.003.
[11] 田兰, 马晓丽, 陈春丽, 等. 毛细管电泳法对乳及乳制品中乳源蛋白的研究[J]. 食品工业科技, 2012, 33(8): 108-111. DOI:10.3969/j.issn.1005-6521.2013.04.024.
[12] 陈静廷, 卜登攀, 马露, 等. 不同等电点沉淀法和超速离心法提取牛奶乳清蛋白的双向电泳分析[J]. 食品科学, 2014, 35(20): 180-184.DOI:10.7506/spkx1002-6630-201420036.
[13] 张岩春, 尤娟, 郑喆, 等. 驴乳的营养成分与功能特性[J]. 农产品加工(学刊), 2009(2): 71-72. DOI:10.3969/j.issn.1671-9646-B.2009.02.023.[14] 古丽巴哈尔·卡吾力, 李玲, 常占瑛, 等. 鲜马奶乳清蛋白质组学研究[J]. 中国乳品工业, 2018, 46(9): 15-20. DOI:10.3969/j.issn.1001-2230.2018.09.003.
[15] GUO H Y, PANG K, ZHANG X H, et al. Composition, physiochemical properties, nitrogen fraction distribution, and amino acid profile of donkey milk[J]. Journal of Dairy Science, 2007, 90(4): 1635-1643.DOI:10.3168/jds.2006-600.
[16] MASSOURAS T, TRIANTAPHYLLOPOULOS K A,THEODOSSIOU I. Chemical composition, protein fraction and fatty acid profile of donkey milk during lactation[J]. International Dairy Journal, 2017, 75: 83-90. DOI:10.1016/j.idairyj.2017.06.007.
[17] SALIMEI E, FANTUZ F, COPPOLA R, et al. Composition and characteristics of ass’s milk[J]. Animal Research, 2004, 53: 67-78.DOI:10.1051/animres:2003049.
[18] ASPRI M, LENI G, GALAVERNA G, et al. Bioactive properties of fermented donkey milk, before and after in vitro simulated gastrointestinal digestion[J]. Food Chemistry, 2018, 268: 476-484.DOI:10.1016/j.foodchem.2018.06.119.
[19] BIDASOLO I B, RAMOS M, GOMEZ-RUIZ J A. In vitro simulated gastrointestinal digestion of donkeys’ milk. Peptide characterization by high performance liquid chromatography-tandem mass spectrometry[J]. International Dairy Journal, 2012, 24: 146-152.DOI:10.1016/j.idairyj.2011.04.014.
[20] FANTUZ F, VINCENZETTI S, POLIDORI P, et al. Study on the protein fractions of donkey milk[C]//Recent Progress in Animal Production Science, 2001.
[21] 张岩春, 尤娟, 罗永康. 驴乳蛋白质组成及其与人乳和牛乳的比较[J].中国乳业, 2008(9): 50-51. DOI:10.3969/j.issn.1671-4393.2008.09.011.
[22] MALACARNE M, MARTUZZI F, SUMMER A, et al. Protein and fat composition of mare’s milk: some nutritional remarks with reference to human and cow’s milk[J]. International Dairy Journal, 2002, 12(11):869-877. DOI:10.1016/S0958-6946(02)00120-6.
[23] ZHANG L, VAN DIJK A D J, HETTINGA K. An interactomics overview of the human and bovine milk proteome over lactation[J].Proteome Science, 2017, 15(1). DOI:10.1186/s12953-016-0110-0.
[24] LARA-VILLOSLADA F, OLIVARES M, XAUS J. The balance between caseins and whey proteins in cow’s milk determines its allergenicity[J]. Journal of Dairy Science, 2005, 88(5): 1654-1660.DOI:10.3168/jds.S0022-0302(05)72837-X.
[25] VINCENZETTI S, AMICI A, PUCCIARELLI S, et al. A proteomic study on donkey milk[J]. Biochemistry & Analytical Biochemistry,2012, 1(2): 109. DOI:10.4172/2161-1009.1000109.
[26] ASPRI M, ECONOMOU N, PAPADEMAS P. Donkey milk: an overview on functionality, technology, and future prospects[J]. Food Reviews International, 2017, 33(3): 316-333. DOI:10.1080/87559129.2016.1175014.
[27] 刘微, 王辰元, 张婉舒, 等. 人乳β-酪蛋白单体二级结构及胶束微观结构的研究[J]. 中国乳品工业, 2014, 42(10): 4-6. DOI:10.3969/j.issn.1001-2230.2014.10.001.
[28] 张新浩, 李海静, 刘景辉, 等. 德州驴乳清蛋白差异蛋白质组学研究[J]. 中国草食动物科学, 2019, 39(2): 1-4; 8. DOI:10.3969/j.issn.2095-3887.2019.02.001.
[29] SALETTI R, MUCCILLI V, CUNSOLO V, et al. MS-based characterization of α(s2)-casein isoforms in donkey’s milk[J]. Journal of Mass Spectrometry, 2012, 47(9): 1150-1159. DOI:10.1002/jms.3031.
[30] BERTINO E, GASTALDI D, MONTI G, et al. Detailed proteomic analysis on DM insight into its hypoallergenicity[J]. Frontiers in Bioscience, 2010, E2(2): 526-536. DOI:10.2741/e111.
[31] CUNSOLO V, SALETTI R, MUCCILLI V, et al. Characterization of the protein profile of donkey’s milk whey fraction[J]. Journal of Mass Spectrometry, 2007, 42(9): 1162-1174. DOI:10.1002/jms.1247.
[32] HERROUIN M, MOLLÉ D, FAUQUANT J, et al. New genetic variants identified in donkey’s milk whey proteins[J]. Journal of Protein Chemistry,2000, 19(2): 105-115. DOI:10.1023/a:1007078415595.