石榴(Punica granatum L.)为石榴科(Punicaceae)石榴属(Punica L.)植物,其果实营养丰富,并具有较高的食用、药用价值[1],是一种集社会、经济、生态效益和观赏价值与保健功能于一身的特色经济作物。工业生产中,石榴主要用于果汁、果酒的酿造,期间产生了大量以石榴皮渣为主的加工副产物。据报道,每吨新鲜石榴水果能产生669 kg副产物,其中含78%果皮和22%石榴籽[2]。随着石榴产业的飞速发展,石榴皮渣的浪费情况日趋严重,对环境的压力也越来越大,现仅有少量文献对石榴皮渣进行研究[3],其中果胶作为石榴皮渣中大量存在的天然成分,具备安全,无毒等特点,乳化性[4]、凝胶性[5]等性质优良,因此被广泛应用于食品、药品、化妆品等领域。
近年来,国内外众多学者对果胶的提取工艺技术进行了大量研究,主要有酸提法[6]、酶提取法[7-8]、高压脉冲电场技术[9]、微波法[10]、亚临界水提取法[11]、离子交换法[12]等。提取方法通常需要使用大量强酸调节提取环境的pH值,因此对环境造成极大的破坏,且提取得率受到限制。超声辅助提取是通过利用超声波在液体介质中传播时会形成大量的空化泡,空化泡骤裂时释放出的巨大能量可对细胞结构产生破坏,使材料与溶剂的接触面积大大增加,有效提高了目标物向溶剂的转移[13-14]。电解水是指在特殊装置中通过采用无隔膜电解方式电解稀溶液所得到的功能性水[15]。酸性电解水(pH<2.5)具有较强的氧化性和杀菌效果,且价格低廉、绿色环保、安全无毒,在食品、医药、农业等领域广泛研究与应用[16]。目前,利用超声与酸性电解水相结合提取果胶的方法鲜见报道。
基于以上分析,本实验拟采用石榴皮渣作为研究对象,在超声辅助下,以弱酸性电解水为提取溶剂,对果胶的提取工艺进行研究。考察pH值、料液比、提取温度、提取时间以及超声功率密度等因素对石榴皮渣果胶提取得率的影响,通过响应面法优选果胶的提取工艺,并利用傅里叶变换红外光谱等手段对提取物的结构进行测定分析,以期为石榴皮渣果胶的高效绿色提取及制备提供理论依据,促进其果胶的深加工和高值化利用。
1 材料与方法
1.1 材料与试剂
新鲜甜石榴样品来源于中国新疆维吾尔自治区和田市。石榴样品去除果肉后,果皮和果渣烘干磨粉后冷冻备用。
电解水(pH 5.0) 深圳市润正电解技术有限公司;果胶酶(200 U/mL) 丹麦Novozymes公司;咔唑美国阿拉丁试剂公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TU-1900型双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;Multifuge高速冷冻离心机、Nicoletis-5傅里叶变换红外光谱仪 赛默飞世尔科技(中国)有限公司;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;ICS-500高效阴离子交换色谱美国Dionex公司;凝胶渗透色谱与多角度激光光散射联用仪(分析系统由Shodex OHpak SB-G型保护柱、ShodexOHpak SB-805型分离柱、515 HPLC型泵和检测器组成;检测器由DAWNHELEOS型多角度激光光散射仪(砷化镓光源,激光波长658 nm)、SPD-10Av型紫外检测器(检测波长280 nm)和Optilabr EX型示差折光检测器(激光波长658 nm)组成) 美国Wyatt技术公司。
1.3 方法
1.3.1 果胶的提取及含量测定
准确称取10 g石榴皮渣,与一定比例的酸性电解水充分混合,使用1 mol/L HCl溶液调节pH值,在超声波条件下提取(超声频率40 kHz)。首先趁热将提取液纱布过滤,5 000 r/min离心10 min后收集上层提取液。使用2 倍体积的乙醇在4 ℃条件下沉淀果胶4 h。再将沉淀的果胶凝胶在4 ℃条件下以8 000 r/min离心10 min。冻干、磨粉得到果胶粉末。
采用NY/T 2016—2011《水果及其制品中果胶含量的测定 分光光度法》咔唑-硫酸法测定D-半乳糖醛酸含量,以表示果胶含量。分别取1 mL D-半乳糖醛酸标准溶液(0、20、40、60、80、100 µg/mL)加入到25 mL具塞试管中,继续添加0.25 mL咔唑-乙醇溶液,连续摇动试管,并迅速加入5 mL浓硫酸。将试管在85 ℃水浴锅中保持20 min,取出后置于冷水中冷却。在525 nm波长处测定吸光度,以半乳糖醛酸质量浓度为横坐标、吸光度为纵坐标,绘制标准曲线方程为Y=0.011 9X+0.003 8,R2=0.997 5。将果胶提取液稀释到一定质量浓度,按照标准曲线步骤操作,根据式(1)计算果胶提取得率:
式中:C为半乳糖醛酸质量浓度/(μg/mL);V为果胶提取液总体积/mL;N为提取液稀释倍数;W为样品质量/g。
1.3.2 石榴皮渣果胶的提取工艺优化
1.3.2.1 单因素试验
研究提取时间(20、30、40、50、60 min)、提取温度(30、40、50、60 、70 ℃)、超声功率密度(0.8、1.0、1.2、1.4、1.6 W/mL)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30(g/mL))和pH值(1.0、1.5、2.0、2.5、3.0)5 个因素对石榴皮渣果胶提取得率的影响,其中各因素固定水平为提取时间30 min、提取温度60 ℃、超声功率密度1.0 W/mL、料液比1∶20 (g/mL)、pH 2.0。
1.3.2.2 响应面试验
以果胶提取得率为评价指标,根据单因素试验结果,固定超声功率密度为1 W/mL,以pH值、提取时间、提取温度、料液比为考察因素,确定因素和水平(表1),采用Design-Expert软件,应用Box-Behnken原理进行4因素3水平试验(共29 组),从而确定提取的最优条件。
表1 Box-Behnken试验设计因素与水平
Table 1 Code and level of independent variables used in Box-Behnken design

images/BZ_254_224_823_1204_908.pngA pH 2.5 2.0 1.5 B提取时间/min 40 30 20 C提取温度/℃ 70 60 50 D料液比(g/mL) 1∶25 1∶20 1∶15
1.3.3 果胶分子质量的测定
凝胶渗透色谱与多角度激光光散射联用表征果胶分子质量,参考Liao Hua等[17]的方法。用去离子水配制0.2 mol/L的NaCl溶液,添加0.02% NaN3以防止微生物的生长。用0.22 μm尼龙微孔滤膜抽滤3 次,超声除去气泡后作为流动相备用。准确称取一定量的样品溶于流动相中,使果胶样品终质量浓度为0.2 mg/mL。置于滚轴混合器上摇匀备用。进样前样品用0.22 μm的尼龙微孔滤膜过滤,进样量200 μL,流速0.45 mL/min,实验温度25 ℃,dn/dc值为0.131 mL/g。数据分析软件为ASTRA5.3.4.14,分析方法为Berry。
1.3.4 酯化度测定
参考Pinheiro等[18]的方法对果胶酯化度进行测定。准确称取0.1 g果胶,用1 mL乙醇湿润,加入1 g NaCl,用超纯水溶解定容至100 mL。酚酞作为指示剂,用0.1 mol/L NaOH溶液滴定至颜色变成粉红色(pH 7.5),且30 s不变色。记录所用NaOH的体积为V1。然后向溶液中加入15 mL 0.25 mol/L NaOH溶液,室温搅拌30 min后加入15 mL 0.25 mol/L盐酸溶液,然后用0.1 mol/L NaOH溶液滴定至粉红色,30 s不变色。记录所用NaOH体积为V2。酯化度按式(2)计算:
1.3.5 果胶的单糖组成测定
果胶的水解:用去离子水溶解2 mg/mL的果胶样品,在40 ℃水浴锅内保温,滴加1 mL果胶酶保温24 h,再加入1 mL 6 mol/L H2SO4溶液沸水浴2 h。冷却后用NaOH调节pH值为中性,稀释一定程度后样品过0.22 μm滤膜后备用。
采用高效阴离子交换色谱层析法-脉动电流探测法探究石榴皮渣果胶的单糖组成。测试条件:Carbo PacPA-1分离柱(内径4 mm,柱长250 mm);流动相A为250 mmol/L NaOH,B为1 mol/L NaAc,C为去离子水;流速1 mL/min;柱温30 ℃;进样体积25 μL。在积分脉冲安培检测器中,Au为工作电极,Ag/ACl为参比电极。
中性单糖和糖醛酸的淋洗梯度程序如下:5 mmol/L NaOH(0~20 min),5~100 mmol/L NaOH(20~30 min),100 mmol/L NaOH、0~100 mmol/L CH3COONa(30~50 min),200 mmol/L NaOH(50~60 min)。
1.3.6 果胶红外光谱扫描
将干燥的果胶粉末(约2 mg)与溴化钾以质量比1∶250混匀研磨后压片通过傅里叶变换红外光谱。从溴化钾样品盘中以4 000~400 cm-1的范围进行64 次扫描以4 cm-1的分辨率获得光谱。
根据果胶酯化度与式(3)中酯基峰面积百分比建立标准曲线,根据标准曲线测定果胶的酯化度[19]。
式中:I为酯基峰面积百分比/%;A1 742为甲酯基吸收峰面积;A1 630~1 600为羧酸盐吸收峰面积。
1.4 数据处理
采用Design-Expert 8.0.6软件进行响应面优化试验的作图及分析,采用Origin 2017软件作图及分析数据。
2 结果与分析
2.1 提取工艺的单因素试验结果
如图1a所示,随着提取时间的延长,石榴皮渣果胶提取得率呈现出先升高后降低的趋势,在提取时间为30 min时达到最大值,可能由于提取时间过短,果胶不能充分溶出;提取时间过长,在热效应与超声条件下,可能会造成部分果胶发生双重降解[20]。因此选用提取时间20、30 min和40 min 3 个水平进行响应面试验优化。
如图1b所示,随着提取温度的升高,石榴皮渣果胶提取得率增大,在提取温度为60 ℃时达到最大,继续升高温度提取得率没有明显的变化。在一定提取温度范围内,温度升高果胶的提取得率增加,这是由于温度较高时,细胞壁和表皮组织比较松弛,使得原果胶可以更快的转化为水溶性果胶,提高果胶提取得率,而温度过高会使果胶发生降解[21],提取得率和果胶品质均会受到影响。因此选择提取温度50、60 ℃和70 ℃ 3 个水平用于响应面试验优化。
如图1c所示,果胶提取得率随着超声功率密度的增加,呈先上升后减小的趋势,在超声功率密度1.0 W/mL时提取得率最大,这是因为在超声功率密度过低时,石榴皮果胶提取不完全,而当超声功率密度过高时,果胶会发生降解,影响果胶提取得率[22-23]。超声功率密度在0.8~1.6 W/mL时对果胶提取得率影响较小,故在响应面试验优化中不考虑此因素,并选择超声功率密度为1.0 W/mL。
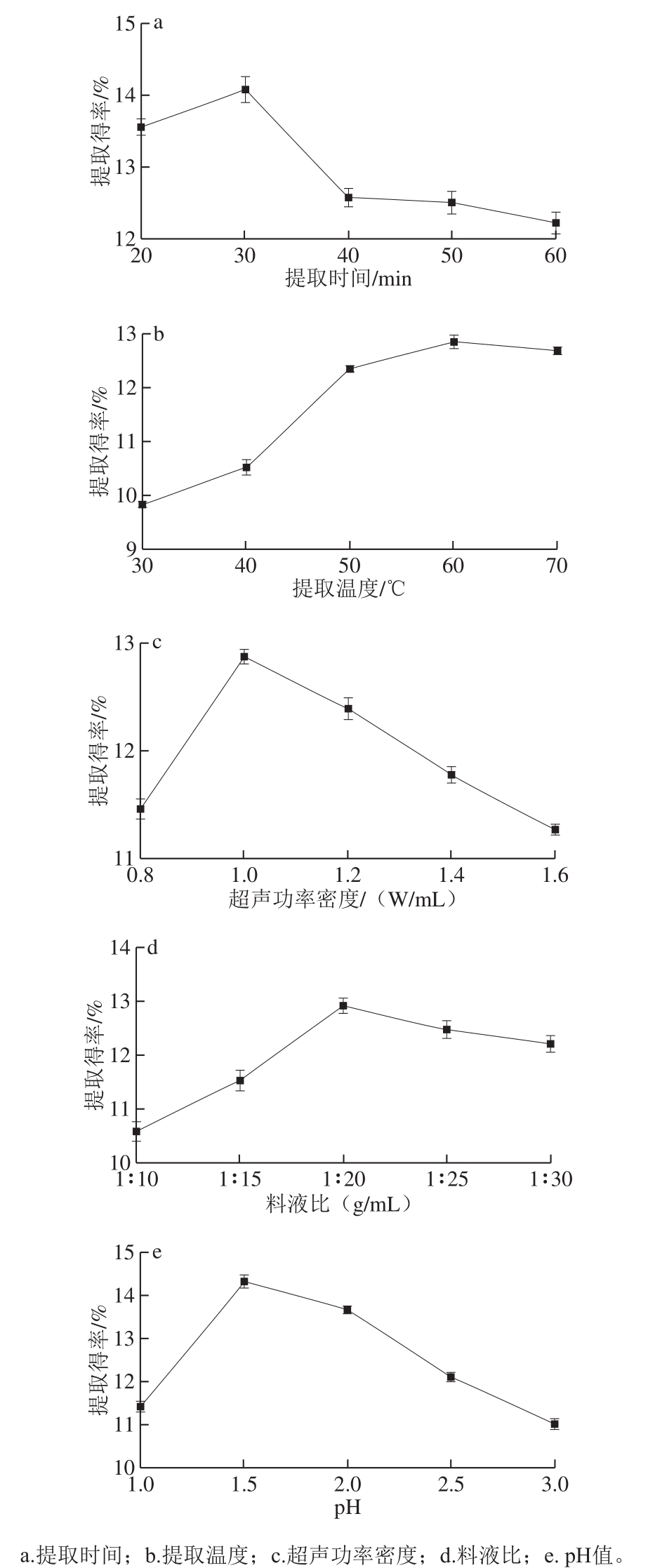
图1 提取因素对果胶提取得率的影响
Fig. 1 Effect of extraction parameters on pectin yield
如图1d所示,果胶提取得率随溶剂用量的增加呈先增加后减少的趋势,在料液比为1∶20(g/mL)时达到最大值。在溶剂用量增大的过程中,石榴皮渣果胶提取得率逐渐增大是因为在较小的溶剂用量条件下,原材料中的果胶难以完全转移到提取液中,溶液黏度大,果胶残余多,提取不完全,而在溶剂用量过大时,提取液中果胶可能被部分水解,且提取液的体积增加,果胶浓度减小,增加了后续工艺的难度[24]。因此选用料液比1∶15、1∶20、1∶25(g/mL)3 个水平用于响应面试验优化。
如图1e所示,石榴皮渣果胶提取得率随pH值的升高呈先增大后减小的变化趋势,这是由于果胶是一种酸性多糖,一定程度上的酸度增强有助于原果胶的水解,使更多的原果胶转化为水溶性果胶,从而提升果胶提取得率,但当pH<1.5时,果胶的提取得率会缓慢下降,溶于水溶液中的果胶在强酸性条件下发生脱酯裂解,从而使果胶提取得率下降[25]。pH值的变化对石榴皮渣果胶的提取得率有很大的影响,选择pH 1.5、2.0、2.5用于响应面试验优化。
2.2 提取工艺的响应面试验优化分析
2.2.1 响应面试验结果及方差分析
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken design with experimental results
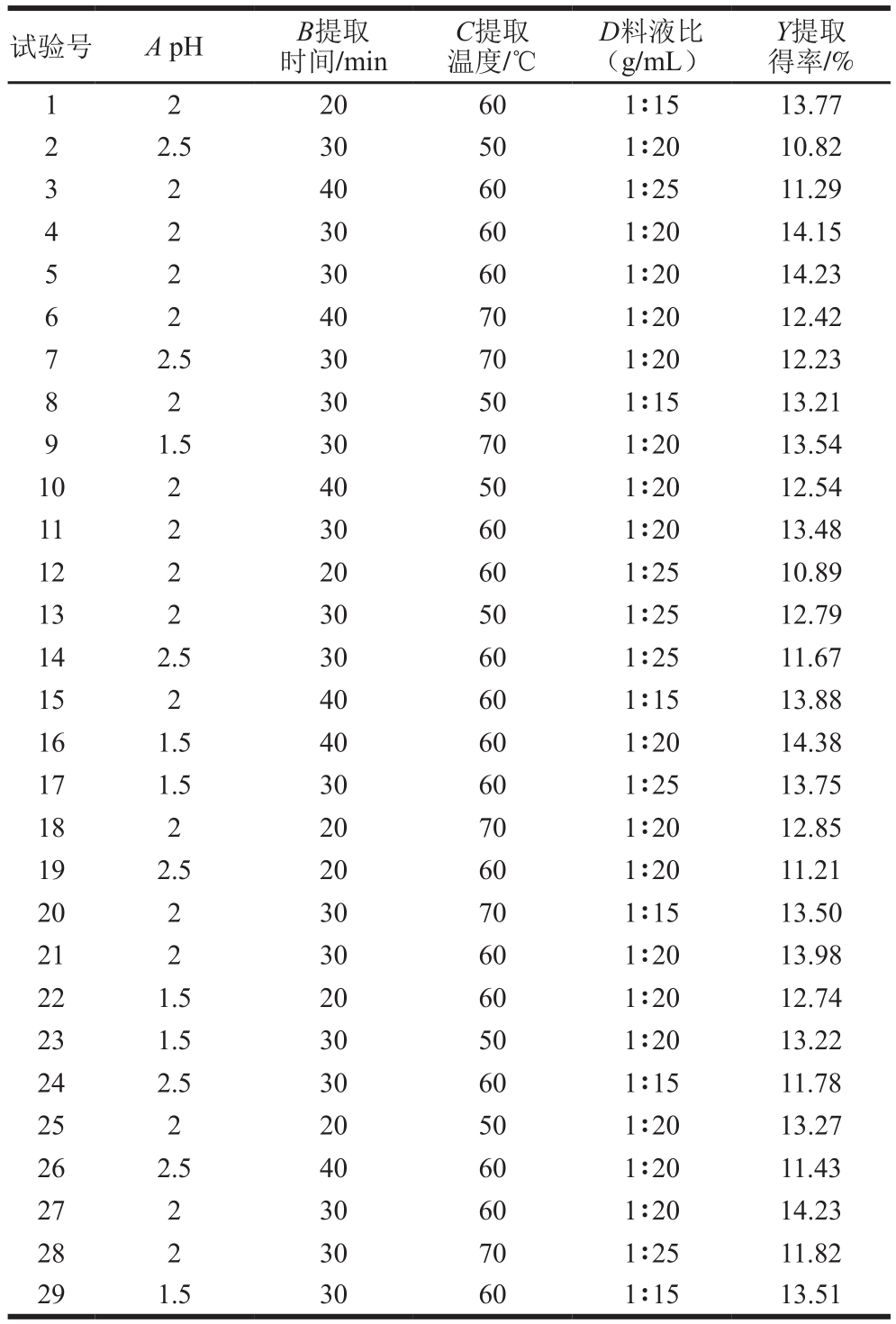
试验号 A pH B提取时间/min Y提取得率/%1 2 20 60 1∶15 13.77 2 2.5 30 50 1∶20 10.82 3 2 40 60 1∶25 11.29 4 2 30 60 1∶20 14.15 5 2 30 60 1∶20 14.23 6 2 40 70 1∶20 12.42 7 2.5 30 70 1∶20 12.23 8 2 30 50 1∶15 13.21 9 1.5 30 70 1∶20 13.54 10 2 40 50 1∶20 12.54 11 2 30 60 1∶20 13.48 12 2 20 60 1∶25 10.89 13 2 30 50 1∶25 12.79 14 2.5 30 60 1∶25 11.67 15 2 40 60 1∶15 13.88 16 1.5 40 60 1∶20 14.38 17 1.5 30 60 1∶25 13.75 18 2 20 70 1∶20 12.85 19 2.5 20 60 1∶20 11.21 20 2 30 70 1∶15 13.50 21 2 30 60 1∶20 13.98 22 1.5 20 60 1∶20 12.74 23 1.5 30 50 1∶20 13.22 24 2.5 30 60 1∶15 11.78 25 2 20 50 1∶20 13.27 26 2.5 40 60 1∶20 11.43 27 2 30 60 1∶20 14.23 28 2 30 70 1∶25 11.82 29 1.5 30 60 1∶15 13.51 C提取温度/℃D料液比(g/mL)
综合单因素试验,选取对石榴皮渣果胶提取得率影响较大的pH值(A)、提取时间(B)、提取温度(C)、料液比(D)4 个因素,建立4因素3水平Box-Behnken试验设计(表1),共包括29 个试验方案,24 个分析试验点,5 个中心试验点,用以计算试验误差。石榴皮渣果胶提取的响应面分析结果见表2。对响应值和各个因素进行二次多元回归拟合,该模型对应的回归方程为石榴皮渣果胶提取得率:

2.2.2 回归模型的方差分析
为了确定响应面试验设计中4 个因素对果胶提取得率的影响,以及各个因素的交互作用和显著性,通过F统计量、响应面二次多项式模型的方差分析(ANOVA)检验回归模型的显著性,见表3。失拟项通常用以描述回归模型的合适程度,考察没有在回归范围内被包含的数据点。本研究中,模型失拟项的F值为5.960,P值为0.050 1(>0.05),表明失拟项不显著,说明该模型拟合度较好。一次项A、D对模型的影响显著(P<0.05),二次项A2、B2、C2和D2为显著(P<0.05),交互项均不显著。从F值可看出各因素对响应值的影响程度,得到提取因素的主效应关系为A>D>C>B,即pH值>料液比>提取温度>提取时间。
表3 回归模型方差分析
Table 3 Analysis of variance of regression model

注:**.差异极显著(P<0.01);*.差异显著(P<0.05)。
images/BZ_256_224_1581_1203_1629.png模型 26.618 14 1.901 4.205 0.006**A pH值 12.04 1 12.04 26.628 0.000 1**B提取时间 0.007 1 0.007 0.015 0.903 C提取温度 0.022 1 0.022 0.048 0.83 D料液比 4.613 1 4.613 10.202 0.007**AB 0.941 1 0.941 2.081 0.171 AC 0.297 1 0.297 0.657 0.431 AD 0.031 1 0.031 0.068 0.799 BC 0.023 1 0.023 0.05 0.827 BD 0.021 1 0.021 0.046 0.083 CD 0.397 1 0.397 0.878 0.365 A2 4.099 1 4.099 9.065 0.009**B2 3.611 1 3.611 7.897 0.014*C2 2.344 1 2.344 5.184 0.039*D2 2.698 1 2.698 5.967 0.028*残差 6.33 14 0.452失拟 5.932 10 0.593 5.960 0.050 1净误差 0.398 4 0.995总离差 32.948 28
2.2.3 响应面试验分析
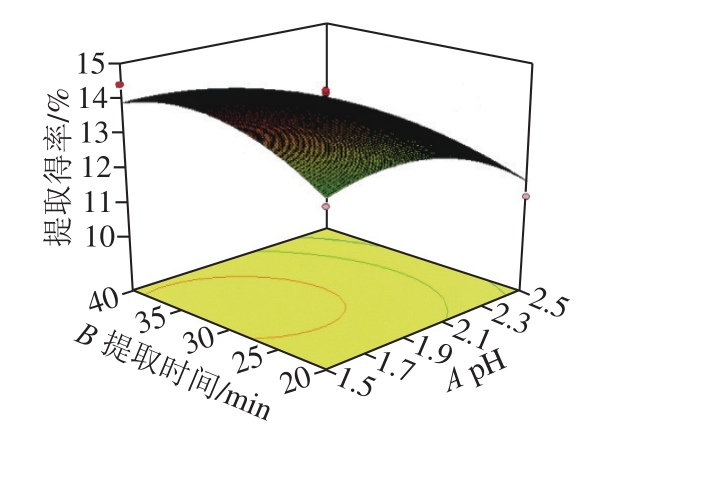
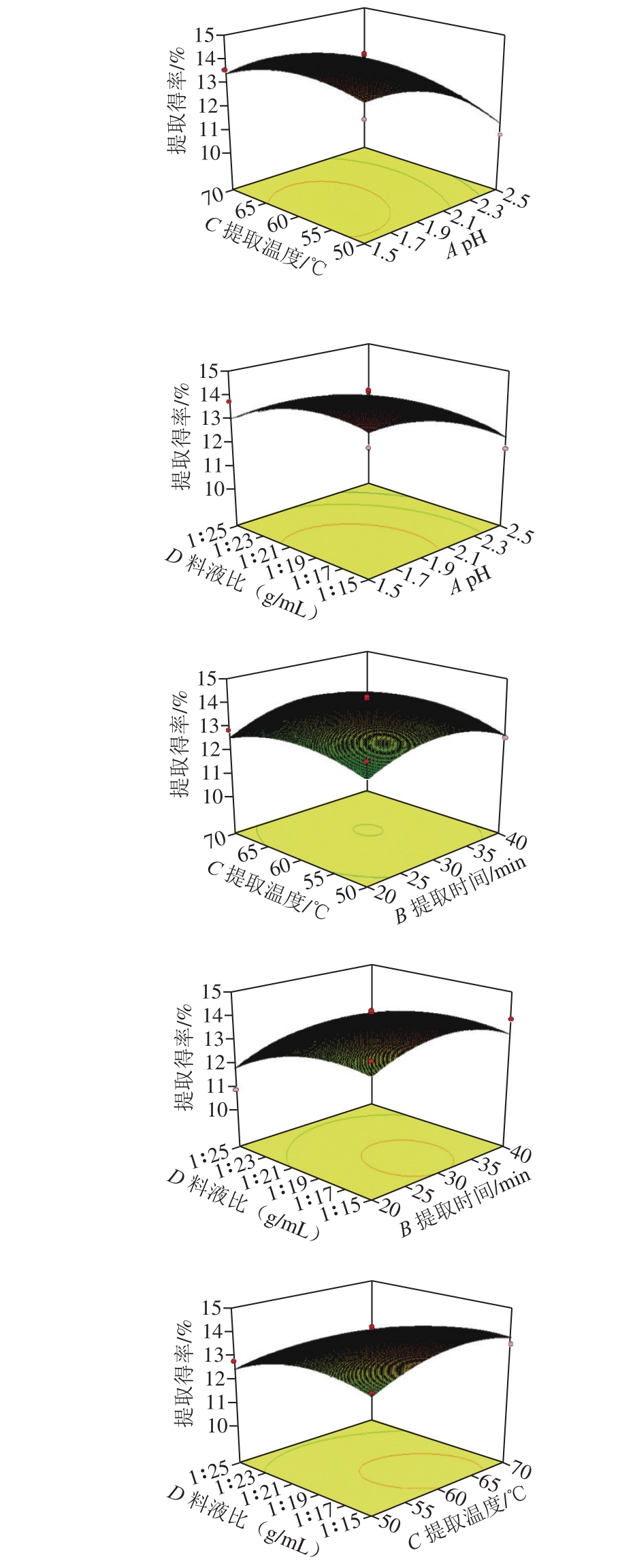
图2 石榴皮渣果胶提取得率与各因素的响应面图
Fig. 2 Response surface plots showing the interactive effect of various extraction parameters on pectin yield
如图2所示,pH值、提取时间、提取温度及料液比中任意2 个变量取0水平时,其余变量对果胶得率的影响,三维响应面的形状都与抛物线图形相似,说明果胶提取得率的最大值出现在中间点处,此模型存在最大值的稳定点。二维等高线的形状可反映因素间交互效应的强弱,中心圆越趋于椭圆形则表示2 个因素交互效果显著,而越趋于圆形则相反[20,26]。由图2可知,A(pH值)与B(提取时间)和D(料液比)与B(提取时间)的等高线图形呈较为扁的椭圆形,而其他的椭圆偏圆形,与方差分析相吻合。即BD与AB的交互作用对果胶提取得率影响更大。降低pH值可以使果胶和半纤维素之间的连接断裂,释放果胶分子,从而增加提取溶剂中果胶的含量[25],而料液比影响提取液的黏度和果胶的扩散速度,使原料中的果胶完全转移到提取液中,减少胶质残留[24],在适当的提取时间下,更多的果胶分子溶解在提取液中,进而增加果胶的提取率[20]。
2.2.4 模拟验证实验
表4 电解水与超纯水提取果胶实验对比
Table 4 Comparison between electrolyzed water and UP water used for solvent extraction of pectin

提取得率/%1(电解水) 1.7 33 60 1∶18 1.0 14.95 1(超纯水) 1.7 33 60 1∶18 1.0 13.61 2(电解水) 2.0 33 60 1∶18 1.0 13.67实验组 pH 提取时间/min提取温度/℃料液比(g/mL)超声功率密度/(W/mL)
通过对石榴皮渣果胶提取得率的二次多项数学模型进行解析,得出提取石榴皮渣果胶的最佳工艺条件为超声功率密度1.0 W/mL、pH 1.67、料液比1∶17.87(g/mL)、提取温度60.09 ℃、超声时间32.14 min,此时,石榴皮渣果胶的提取得率理论上可达到14.48%。考虑到实际操作性,调整工艺参数为超声功率密度1.00 W/mL、pH 1.7、提取温度60 ℃、提取时间33 min、料液比1∶18(g/mL)。在此条件下进行3 组验证实验,石榴皮渣果胶的提取得率分别为14.71%、15.09%、15.06%,平均值为14.95%,与理论值接近,表明数学模型对优化石榴皮渣果胶的提取工艺可行。并在此基础上对比研究同等条件下超纯水提取石榴皮渣果胶的提取得率结果如表4所示,根据对比实验可以看出同等条件下电解水提取果胶的得率高于超纯水提取,在2 种提取方法均得到相同果胶提取得率结果时,只需调节电解水pH值至2.0。相比超纯水提取法,盐酸的使用量降低了15%,这在降低成本、绿色环保方面也有突出贡献。
2.3 果胶的理化性质和结构分析
2.3.1 分子质量

图3 不同提取方法下果胶的分子质量分布
Fig. 3 Molecular mass distribution of pomegranate peel pectin extracted by different methods
不同提取方法得到的果胶在结构和功能性质方面存在较大差异。由图3可以看出,2 种果胶的分子质量分布均为双峰分布,推测可能是2 种方法所提取的果胶为粗果胶,其中还含有少量色素、蛋白质以及小分子物质等,但还有待下一步验证。电解水提取果胶的mw为7.294×106 g/mol,比超纯水提取果胶(9.977×106 g/mol)低26.89%,表明电解水提取比传统超纯水提取法具有更明显的降解效果。而超纯水提取果胶的多分散系数(1.156)较电解水提取果胶的多分散系数(1.169)低1.11%,表明超纯水提取果胶分子分布更集中。
2.3.2 果胶单糖组成与提取得率
表5 单糖的组成及提取得率
Table 5 Yield and monosaccharide composition of pectin extracted by different methods
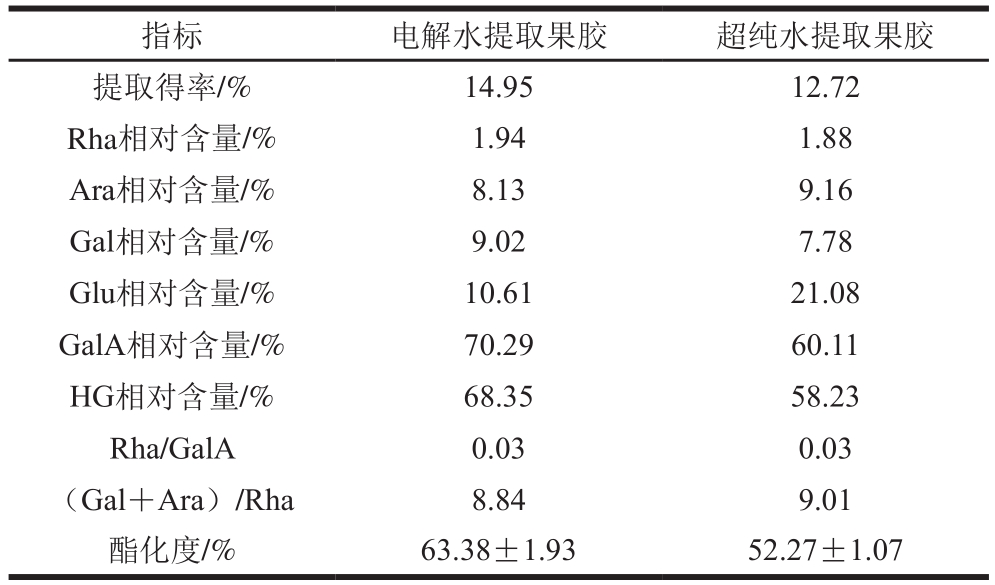
注:Rha/GalA.果胶RG的贡献度;(Gal+Ara)/Rha. RG-I中支链的长度。
images/BZ_257_1276_1229_2254_1280.png提取得率/% 14.95 12.72 Rha相对含量/% 1.94 1.88 Ara相对含量/% 8.13 9.16 Gal相对含量/% 9.02 7.78 Glu相对含量/% 10.61 21.08 GalA相对含量/% 70.29 60.11 HG相对含量/% 68.35 58.23 Rha/GalA 0.03 0.03(Gal+Ara)/Rha 8.84 9.01酯化度/% 63.38±1.93 52.27±1.07
使用电解水作提取溶剂制备的石榴皮渣果胶不仅提取得率高于超纯水,二者的单糖组成也存在较大差异。果胶主要是由以半乳糖醛酸(GalA)为主链的线型链构成,其中部分区域被L-鼠李糖(Rha)打断并连有其他中性糖侧链(主要是D-半乳糖(Gal)和L-阿拉伯糖(Ara))[27]。而GalA是构成果胶中同型半乳糖醛酸聚糖(homogalacturonan,HG)和鼠李糖半乳糖醛酸聚糖(rhamnogalacturonan,RG)区域的主要成分[28],占电解水提取果胶和超纯水提取果胶单糖中的绝大部分,其中电解水提取果胶的GalA含量达到了GB 25533—2010《食品添加剂 果胶》的要求(≥65%)。Rha与GalA物质的量比表示果胶主链的变化,由表5可知,电解水提取果胶与超纯水提取果胶的主链无明显差异。而(Gal+Ara)/Rha反映了RG-I区域侧链的平均长度,超纯水提取果胶略高于电解水提取。同时,2 种果胶相对应的其葡萄糖(Glu)相对含量(10.61%)仅为超纯水所提取的1/2。产生这种现象的原因有可能是电解水所提取果胶将其中的部分支链水解,导致电解水提取果胶有着更高的半乳糖醛酸含量和酯化度,且侧链长度较低。
2.3.3 果胶红外光谱分析

图4 不同提取方法下果胶红外光谱图
Fig. 4 Fourier transform infrared spectra of pectin extracted by different methods
如图4所示,2 种方法制备果胶的红外图谱相似,其中3 500~3 000 cm-1处的吸收峰是O—H的伸缩振动引起的;3 000~2 800 cm-1处的特征峰是由半乳糖醛酸甲酯或碳环上的C—H的伸缩振动引起的,1 760~1 730 cm-1处的峰为果胶羧羰基和酯羰基中C=O的伸缩振动,1 630~1 600 cm-1处的峰为果胶羧基中COO-的振动引起的;由于果胶的酯化度与其在1 742 cm-1处的峰面积与1 742 cm-1和1 626 cm-1处的峰面积之和的百分比呈线性关系[19,29],由样品在1 742 cm-1和1 626 cm-1处的峰面积可知电解水提取果胶的酯化度(68.4%)高于超纯水提取果胶(59.1%),该结果与化学测定法得出的结果吻合。
3 结 论
本实验从石榴工业生产废弃物石榴皮渣的再利用出发,研究了石榴皮渣果胶的提取方法并获得最佳电解水提取工艺。通过比较2 种提取方法制备的石榴皮渣果胶,发现以弱酸性电解水作为提取溶剂能够提高提取得率,且果胶具有更高的半乳糖醛酸含量以及较低的分子质量,并通多傅里叶变换红外光谱显示了电解水提取果胶具有更高的酯化度。因此,利用电解水提取法可减少强酸的使用量[30],缓解其对环境的破坏,是一种绿色高效的石榴皮渣果胶提取方法。
[1] 李佳川, 陶梦敏, 许世林, 等. 川产道地药食资源石榴的保健功能与开发利用[J]. 西南民族大学(自然科学版), 2017, 43(2): 142-148.DOI:10.11920/xnmdzk.2017.02.006.
[2] QU W, PAN P, ZHANG R, et al. Integrated Extraction and anaerobic digestion process for recovery of nutraceuticals and biogas from pomegranate marc[J]. Transactions of the ASABE, 2009, 52(6): 1997-2006. DOI:10.13031/2013.29196.
[3] 曹云刚, 李颖, 李春强, 等. 石榴皮提取物对猪肉饼冷藏过程中脂肪氧化稳定性的影响[J]. 肉类研究, 2018, 32(12): 14-18. DOI:10.7506/rlyj1001-8123-201812003.
[4] VERKEMPINK S H E, KYOMUGASHOA C, SALVIA L, et al.Emulsion stabilizing properties of citrus pectin and its interactions with conventional emulsifiers in oil-in-water emulsions[J]. Food Hydrocolloids,2018, 85: 144-157. DOI:10.1016/j.foodhyd.2018.07.014.
[5] WANG H Y, WAN L, CHEN D, et al. Unexpected gelation behavior of citrus pectin induced by monovalent cations under alkaline conditions[J]. Carbohydrate Polymers, 2019, 212: 51-58.DOI:10.1016/j.carbpol.2019.02.012.
[6] PEREIRA P H F, OLIVEIRA T, ROSA M F, et al. Pectin extraction from pomegranate peels with citric acid[J]. International Journal of Biological Macromolecules, 2016, 88: 373-379. DOI:10.1016/j.ijbiomac.2016.03.074.
[7] 王艳翠, 卢韵朵, 史吉平, 等. 复合酶法提取苹果渣中的果胶及产品性质分析[J]. 食品与生物技术学报, 2019, 38(5): 30-36.DOI:10.3969/j.issn.1673-1689.2019.05.005.
[8] 侯玉婷, 张鑫雨, 苏金芳, 等. 响应面优化酶法辅助提取山楂果胶及其体外抗氧化和抗糖化活性[J]. 食品工业科技, 2018, 39(22): 180-186.DOI:10.13386/j.issn1002-0306.2018.22.032.
[9] MARTINEZ J M, DELSO C, MAZA M, et al. Utilising pulsed electric field processing to enhance extraction processes[J]. Reference Module in Food Science, 2018. DOI:10.1016/B978-0-08-100596-5.22435-9.
[10] COLODEL C, PETKOWICA C L D O. Molecular biology, acid extraction and physicochemical characterization of pectin from cubiu(Solanum sessilif l orum D.) fruit peel[J]. Food Hydrocolloids, 2019, 86:193-200. DOI:10.1016/j.foodhyd.2018.06.013.
[11] ADETUNJI L R, ADEMOLA A, ORSAT V, et al. Advances in the pectin production process using novel extraction techniques: a review[J]. Food Hydrocolloids, 2017, 62: 239-250. DOI:10.1016/j.foodhyd.2016.08.015.
[12] 刘显明, 顾焰波, 陈冬年, 等. 响应曲面法优化离子交换法提取南瓜皮果胶工艺[J]. 食品工业, 2018, 39(7): 162-166.
[13] MARIC M, GRASSINO A N, ZHU Z Z, et al. An overview of the traditional and innovative approaches for pectin extraction from plant food wastes and by-products: ultrasound-, microwaves-, and enzymeassisted extraction[J]. Trends in Food Science & Technology, 2018,76: 28-37. DOI:10.1016/j.tifs.2018.03.022.
[14] 李向莹, 王存芳. 响应面法优化玉米南瓜酸羊乳的加工工艺[J].乳业科学与技术, 2018, 41(3): 25-31. DOI:10.15922/j.cnki.jdst.2018.03.005.
[15] 南松剑, 黄晓伶, 王朔, 等. 微酸性电解水对灰葡萄孢菌杀菌效果与作用机制研究[J]. 农业机械学报, 2019, 50(1): 354-358; 382.DOI:10.6041/j.issn.1000-1298.2019.01.040.
[16] 裴海生. 强电解水及其在食品工业中的应用[J]. 中国食品学报,2011, 11(9): 267-271. DOI:10.16429/j.1009-7848.2011.09.019.
[17] LIAO H, AI W J, ZHANG K, et al. Mechanisms of oligoguluronate modulating the calcium-induced gelation of alginate[J]. Polymer,2015, 74: 166-175. DOI:10.1016/j.polymer.2015.08.007.
[18] PINHEIRO E R, SILVA I M D A, GONZAGA L V et al. Optimization of extraction of high-ester pectin from passion fruit peel (Passif l ora edulis flavicarpa) with citric acid by using response surface methodology[J]. Bioresource Technology, 2008, 99(13): 5561-5566.DOI:10.1016/j.biortech.2007.10.058.
[19] PAPPAS C, MALOVIKOVA A, HROMADKOVA Z, et al.Determination of the degree of esterification of pectinates with decyl and benzyl ester groups by diffuse ref l ectance infrared Fourier transform spectroscopy (DRIFTS) and curve-fitting deconvolution method[J]. Carbohydrate Polymers, 2004, 56(4): 465-469.DOI:10.1016/j.carbpol.2004.03.014.
[20] 王文骏. 柑橘皮果胶超声辅助提取的作用机制研究[D]. 杭州: 浙江大学, 2018: 34-37.
[21] 洪亚男. 豆腐柴叶果胶的提取及其理化特性研究[D]. 杭州: 浙江工商大学, 2018: 20-22.
[22] ZHANG L, YE X, SOPHIA J, et al. Effect of high-intensity ultrasound on the physicochemical properties and nanostructure of citrus pectin[J]. Journal of the Science of Food and Agriculture, 2013, 93(8):2028-2036. DOI:10.1002/jsfa.6011.
[23] 张丽芬. 果胶多糖超声波定向降解途径及机理研究[D]. 杭州: 浙江大学, 2013: 24-31.
[24] 晋睿冲. 豆腐柴叶中果胶提取、理化性质表征及生物活性初步研究[D]. 郑州: 郑州大学, 2018: 15-16.
[25] 刘晓霞. 黄秋葵花果胶类多糖的提取工艺及其性质的研究[D].杭州: 浙江大学, 2014: 25-26.
[26] 宋思圆, 苏平, 王丽娟, 等. 响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J]. 食品科学, 2017, 38(2): 283-289.DOI:10.7506/spkx1002-6630-201702044.
[27] 易建勇, 毕金峰, 刘璇, 等. 果胶结构域精细结构研究进展[J].食品科学, 2020, 41(7): 292-299. DOI:10.7506/spkx1002-6630-20190328-356.
[28] 郭兴峰, 赵文婷, 廖小军, 等. 酸性条件下热处理对果胶流变和结构特性的影响[J]. 食品科学, 2018, 39(12): 40-46. DOI:10.7506/spkx1002-6630-201812007.
[29] 李梦. 果胶酯化度的测定及凝胶流变性与分子结构关系研究[D].广州: 暨南大学, 2017: 8-9.
[30] 李楚楚, 赵丹丹, 韩雪, 等. 利用酸性电解水提取柿子渣中果胶及其工艺优化[J]. 食品科技, 2019, 44(1): 274-279. DOI:10.13684/j.cnki.spkj.2019.01.0470.