近年来,食品智能包装由于能追踪实时食品安全而备受关注。智能包装旨在掌握和提供有关包装食品的安全性、对环境条件的响应或决定保质期的信息[1]。花青素是一种安全无毒对人体无危害的水溶性色素,且对pH值的变化十分敏感。目前国内外均有将红甘蓝、黑豆、蓝莓和紫薯花青素等作为食品智能包装的天然指示剂的研究报道[2-3]。鱼肉在贮藏过程中,由于蛋白质的变性以及分解会产生许多挥发性含氮化合物,从而导致鱼肉pH值快速升高,从而引起花青素色泽变化,因此常作为花青素指示膜应用的受试材料。Zhai Xiaodong等[4]将玫瑰茄花青素作为指示剂,淀粉和聚乙烯醇作为成膜基材制备指示膜,并用于实时监测鱼肉的新鲜度,指示膜颜色由红色变为浅蓝色。Huang Shaoyun等[5]将紫草根提取物作为指示剂,添加到成膜基材琼脂中用于实时检测鱼肉的新鲜度,随着鱼肉贮藏时间的延长,指示膜的颜色由原来的红色变为蓝色,结合挥发性盐基氮(tolal volatile basic nitrogen,TVB-N)表明此时指示膜为蓝色时鱼肉已经腐败变质。
为很好地固定天然花青素,并考虑食品的安全性,研究许多无毒和可生物降解的天然材料,例如淀粉、羧甲基纤维素钠、果胶[6]、琼脂等[7]。其中马铃薯淀粉价格低廉且成膜性优异,被广泛用于可降解薄膜的制作,但是单一的成膜基材制备出的薄膜性能较差,为了改善其机械性能将2 种或多种天然聚合物相结合[8]。根据课题组前期报道,将马铃薯淀粉、羧甲基纤维素钠、魔芋葡甘露聚糖两两混合为成膜基材制备指示膜,研究结果表明3 种混合物中马铃薯淀粉和羧甲基纤维素钠混合后相容性好,2 种成膜基材混合后能够形成氢键,并有较好的性能[9]。但指示膜的综合性能(力学性能、水溶性、颜色)都未达到最优。
本研究以马铃薯淀粉和羧甲基纤维素钠为成膜基材,通过添加紫薯花青素,采用流延方法制备指示膜,利用单因素试验研究成膜材料比例、花青素质量分数和甘油质量分数对膜性能的影响,结合响应面试验分析优化和建立各因素间的数学模型,得到制备淀粉-羧甲基纤维素钠-花青素(starch-sodium carboxymethyl celluloseanthocyanin,SCA)指示膜的最佳制备工艺条件,并将制备出最优的指示膜进行表征及用于鱼肉新鲜度检测研究,以期为天然花青素指示膜应用于食品货架期监测提供参考。
1 材料与方法
1.1 材料与试剂
紫薯由广东省农业科学院作物所提供;活草鱼(每尾约1 kg) 市购;马铃薯淀粉 宁夏万里淀粉有限公司;羧甲基纤维素钠、甘油、无水乙醇(分析纯)成都科龙化工试剂厂。
1.2 仪器与设备
101型电热鼓风干燥箱 北京永光明医疗仪器有限公司;RE-200B型旋转蒸发仪 上海亚荣生化仪器厂;Ultra型扫描电子显微镜 卡尔·蔡司股份公司;TA.XT Plus质构仪北京微讯超技仪器技术有限公司;is10型傅里叶变换红外光谱仪 美国Thermo Fisher公司;Q200 DSC差示扫描量热仪 美国TA仪器公司;UV-3100N紫外-可见分光光度计 上海美普达仪器有限公司;SC-10便携式色差仪 苏州欣美和仪器有限公司;D8 X射线衍射仪德国Bruker公司;自制有机成膜板。
1.3 方法
1.3.1 紫薯花青素的提取
将紫薯片烘至恒质量,粉碎过筛。将体积分数40%乙醇溶液作为提取剂,并按照料液比1∶10(g/mL),60 ℃水浴搅拌3 h,滤液在50 ℃避光旋蒸得到花青素浓缩液,冻干得到紫薯花青素粉[7]。
1.3.2 SCA指示膜的制备
将6 g马铃薯淀粉溶于100 mL蒸馏水中,95 ℃搅拌糊化15 min后备用;取1.2 g羧甲基纤维素钠溶于100 mL蒸馏水中备用;按照适当的比例混合2 种溶液,并依次加入适量甘油,适量紫薯花青素粉,均质后,将混合液真空-超声除去气泡后,倒入自制有机成膜板中,45 ℃烘箱中烘干成膜。揭膜后置于相对湿度(55±1)%、温度(25±1)℃的恒温恒湿箱中平衡48 h后测指示膜性能。
1.3.3 SCA指示膜的制备优化
1.3.3.1 单因素试验
按1.3.2节的制备工艺流程,对其中马铃薯淀粉-羧甲基纤维素钠质量比、紫薯花青素质量分数、甘油质量分数按表1设计进行单因素试验,所有试验至少重复3 次取平均值。
表1 单因素试验因素与水平
Table 1 Factors and levels used in single factor experiments

水平 马铃薯淀粉-羧甲基纤维素钠质量比紫薯花青素质量分数/%甘油质量分数/%1 4∶6 0.2 0.5 2 5∶5 0.3 0.6 3 6∶4 0.4 0.7 4 7∶3 0.5 0.8 5 8∶2 0.6 0.9
1.3.3.2 响应面试验
在单因素试验结果的基础上,设计3因素3水平响应面试验,将马铃薯淀粉-羧甲基纤维素钠质量比、紫薯花青素质量分数、甘油质量分数作为试验因素,以指示膜抗拉伸强度(tensile strength,TS)、断裂伸长率(elongation at break,EAB)、水溶性、颜色(a值)的性能综合评分作为响应值进行试验,试验因素与水平见表2。
表2 响应面试验因素与水平
Table 2 Factors and levels used in response surface analysis

images/BZ_261_201_1771_1178_1818.png水平X3甘油质量分数/%-1 6∶4 0.3 0.5 0 7∶3 0.4 0.6 1 8∶2 0.5 0.7 X1马铃薯淀粉-羧甲基纤维素钠质量比X2紫薯花青素质量分数/%
1.3.4 SCA指示膜的性能及结构表征
1.3.4.1 SCA指示膜的指标测定
力学性能测定:参照GB/T 1040.3-2006《塑料拉伸性能测定》膜厚度进行测定[10],并通过质构仪测定SCA指示膜的抗拉强度(tensile strength,TS)和EAB,将膜裁剪为80 mm×15 mm的薄条,初始距离50 mm,速率50 mm/min。每组指示膜测试10 个平行样品,TS、EAB按式(1)、(2)计算:

式中:F为膜断裂时张力/N;b为膜宽度/mm,H为膜厚度/mm;D为膜断裂时的长度/mm;L为膜的初始长度/mm。
水溶性测定:参照邹小波等[11]的方法。将SCA指示膜放在105 ℃烘箱中烘至恒质量W1(g)然后浸泡在50 mL蒸馏水中,24 h后倒出浸泡液,再次放入105 ℃烘箱中烘至恒质量并称取质量为W2(g),每组重复测定3 次。根据式(3)计算水溶性:
颜色测定:利用手持色差仪测定出指示膜的颜色(a值)。
指示膜物理性能综合指标评定:运用隶属度综合评分法和主成分分析法相结合确实指示膜性能指标的综合评分。其中,主成分分析主要用于各指标权重的确定。隶属度根据式(4)、(5)计算:

式中:P为隶属度;Ai为对应指标值;Amax为对应指标最大值;Amin为对应指标最小值。
对于正效应的TS、EAB、a值运用式(4)计算;负效应的水溶性运用式(5)计算[12]。
指示膜物理性能综合分S,按式(6)计算:
式中:P1~P4分别为TS、EAB、水溶性和a值的隶属度值;a1~a4别为4 个指标的权重。
1.3.4.2 SCA指示膜的表征
傅里叶变换红外光谱分析:将样品烘干后,利用is10型傅里叶变换红外光谱仪记录样品的红外光谱,扫描范围为650~4 000 cm-1。
扫描电镜分析:通过扫描电镜记录SCA指示膜的横截面结构并拍照,将2 cm×2 cm SCA指示膜试样干燥后,利用液氮将SCA指示膜冻裂喷金,加速电压为7 kV。
X射线衍射:用X射线衍射仪测得SCA指示膜X射线衍射的图像,扫描速率6°/min,扫描范围0°~55°[13]。
1.3.5 SCA指示膜的应用
将去皮后的鱼肉切成10 g/块并去刺备用,将SCA指示膜裁成大小为4 cm×4 cm的小块并覆盖在鱼肉上一起放入培养皿中,用保鲜膜包裹并置于25 ℃恒温恒湿条件下,根据GB 5009.228—2016《食品中挥发性盐基氮的测定》测定鱼肉的TVB-N值[14];根据GB 4789.2—2016《食品微生物学检验 菌落总数的测定》测定鱼肉的菌落总数[15];根据GB/T 9695.5—2008《肉与肉制品 pH的测定》测定鱼肉的pH值[16];同时对指示膜的颜色变化进行测定。
1.4 数据统计与分析
结果以 ±s表示,使用SPSS 20.0、Origin 9.0进行数据处理,采用方差分析(ANOVA)显著性差异(P<0.05),评价不同平均值之间的差异性。
2 结果与分析
2.1 SCA指示膜制备条件的优化
2.1.1 各成膜组分对指示膜性能的影响
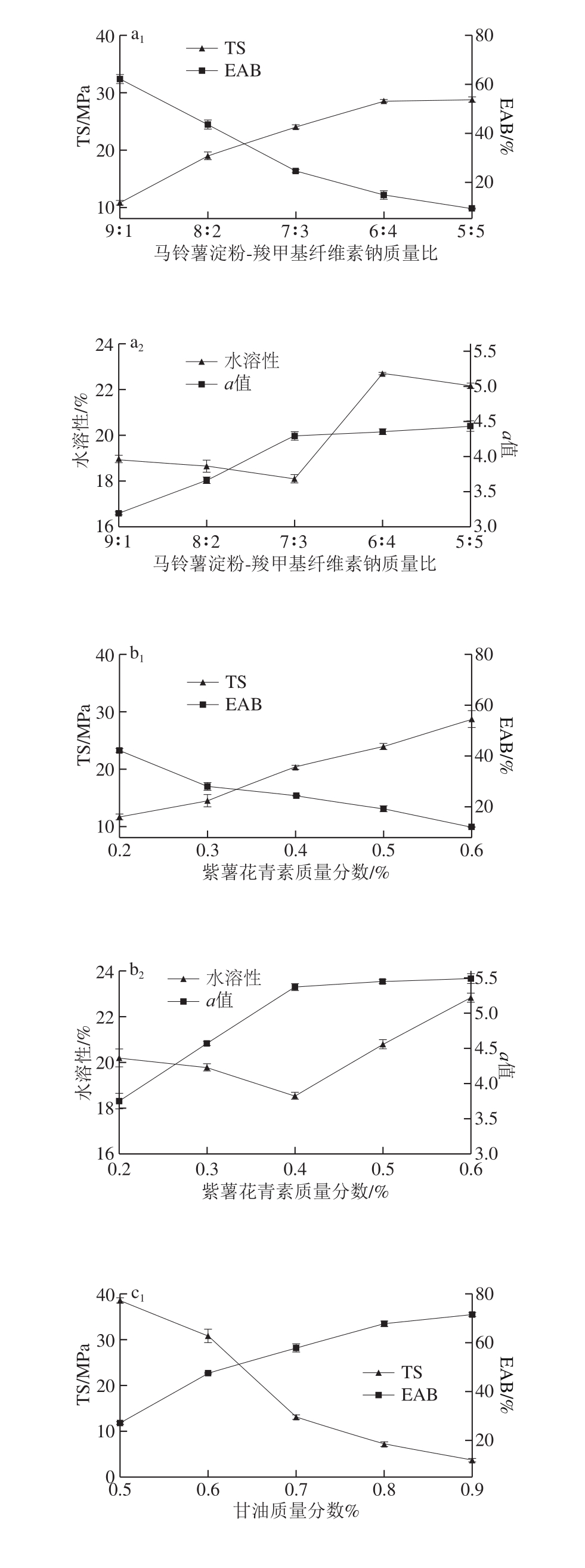
图1 各成膜组分对指示膜性能的影响
Fig. 1 Effect of film-forming materials on properties of indicator films
如图1a所示,随着淀粉与羧甲基纤维素钠质量比的减小TS呈逐渐上升的趋势,EAB呈逐渐下降趋势。Ghanbarzadeh等[17]提高羧甲基纤维素钠浓度,降低淀粉浓度,同样发现复合膜的TS增加EAB降低。这可能是羧甲基纤维素钠与淀粉都具有较好的相容性,共混成膜时,形成了分子间的网状结构,从而导致指示膜的TS增高。EAB的降低是由于淀粉中支链淀粉含量较高,淀粉占比较少,同时减少了分子中的支链结构,糊化后形成结晶容易,因而制备的指示膜柔软度较低,降低了膜的EAB[18]。随着羧甲基纤维素钠的占比增加,指示膜的水溶性先降低后增加,马铃薯淀粉-羧甲基纤维素钠质量比为7∶3时,水溶性达到最低值18.1%,水溶性的降低归因于淀粉和羧甲基纤维素钠指示膜分子新的排列,使两者之间形成了很强的氢键作用力,质量比为6∶4时指示膜的水溶性大幅度增加,由于羧甲基纤维素钠的分子链中含有大量的亲水基团—OH和—COOH,导致指示膜放入水中易溶解,羧甲基纤维素钠的含量不断增加,水溶性也不断上升[19]。指示膜的a值随着质量比的上升不断变大,红色越来越深,淀粉和羧甲基纤维素钠之间分子链的运动影响了淀粉分子的结晶度,结晶度越高,指示膜成膜基材越透明,加入的花青素颜色更容易显现出来[20]。综合上述分析当淀粉与羧甲基纤维素钠质量比为7∶3时可能最佳。
如图1b所示,TS和EAB随着紫薯花青素质量分数的升高,分别呈现出逐渐升高和下降的趋势。花青素与聚合物之间通过氢键形成界面相互作用,紫薯花青素质量分数不断上升,相互作用增强,TS不断升高[21]。但紫薯花青素加入后,由于天然植物花青素能抑制聚合物链的运动,同时导致柔软性降低,EAB随之降低,本结果与Huang Shaoyun等[5]研究结果一致。紫薯花青素质量分数不断升高,指示膜的水溶性先从20.2%降低至18.54%再逐渐升高,水溶性的降低可能是由于紫薯花青素的加入使之与淀粉和羧甲基纤维素钠分子中的亲水基团相结合,形成了分子之间作用力。当紫薯花青素质量分数为0.4%时,指示膜的水溶性开始升高,由于花青素属于亲水性物质,花青素过量添加导致指示膜吸水能力更强,从而指示膜的水溶性升高[22]。指示膜的颜色随着紫薯花青素的质量分数增加不断加深,原因与前述结晶度变高,成膜基材透明度变高,加入紫薯花青素后颜色变深一致。综合上述分析,选择紫薯花青素质量分数0.4%较合适。
如图1c所示,指示膜的TS随着甘油质量分数的提高从(38.58±0.56)MPa下降到(3.67±0.38)MPa,而EAB随着甘油质量分数的提高从(27.13±0.6)%升高到(71.57±0.81)%。孙海涛等[12]同样发现提高甘油质量分数,膜的TS不断减小,EAB不断增加。对于指示膜而言,甘油属于小分子,小分子物质很容易进入原料的大分子链间,破坏原有的分子结构导致分子间作用力不断的减弱,而增强了分子链的流动性,使膜变得更加柔软,同时可能由于甘油是亲水性物质将水分子保留在指示膜的成膜基质中,水分子不仅与聚合物的羟基直接作用,还存在于聚合物链与甘油分子之间,分子链间距增大,因此指示膜的TS减弱,EAB增加[23]。膜的水溶性整体呈现出上升的趋势,甘油的亲水性导致聚合物链间的分子间力降低,增加自由体积,遇水后更容易溶解在水中,从而造成指示膜的水溶性增加[24]。高丹丹等[25]也发现随着甘油质量分数的提高,膜的溶水时间减少,加快了膜的溶解速度。颜色变得更加明显,a值不断升高,是因为甘油使指示膜刚性结构得到软化,导致指示膜的结构得到有效的松弛和延展,透明度增大,紫薯花青素受干扰较少,颜色显示更加明显。综上分析甘油质量分数为0.6%时为可能的最佳配比。
2.1.2 指示膜性能综合评分分析
为了得到综合性能较优的指示膜,本研究采用主成分分析法与隶属度综合评分法相结合确定指示膜性能的综合评分。首先确定指示膜各性能指标的权重,从单因素试验中随机抽取9 组数据(表3)进行主成分分析,将指示膜的TS、EAB、水溶性、a值作为分析对象,相关成分特征值、贡献率及特征向量见表4、5。分析可知,第1主成分(2.479)和第2主成分(1.131)的特征值均大于1,第1主成分(Z1)的方差贡献率为61.98%,第2主成分(Z2)的方差贡献率为28.27%,累计方差贡献率为90.25%,大于85%,表明前2 个主成分能够反映出全部指标的信息[26]。根据表5结果可以构建主成分与各指标之间的线性关系式:Z1=0.934X1-0.908X2+0.69X3+0.552X4,Z2=0.209X1+0.237X2+0.652X3-0.778X4,结合各主成分的特征值、方差贡献率以及特征向量。求得指示膜4 个指标(TS、EAB、水溶性、a值)经归一化后的权重分别为0.36、0.25、0.38、0.01,结合公式(4)~(6)得到指示膜性能的综合评分:S=0.36P1+0.25P2+0.38P3+0.01P4。
表3 主成分分析实验数据
Table 3 Experimental data used in principal component analysis
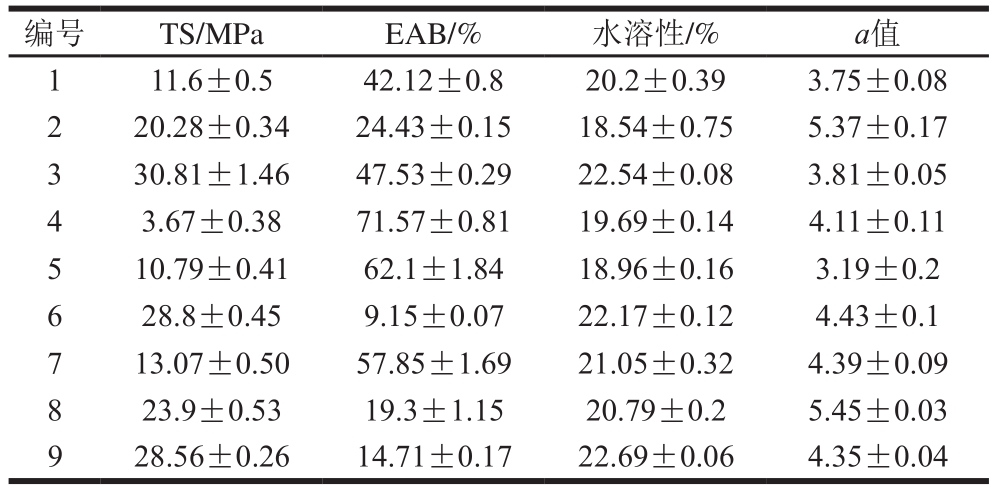
images/BZ_263_1276_436_2255_483.png1 11.6±0.5 42.12±0.8 20.2±0.39 3.75±0.08 2 20.28±0.34 24.43±0.15 18.54±0.75 5.37±0.17 3 30.81±1.46 47.53±0.29 22.54±0.08 3.81±0.05 4 3.67±0.38 71.57±0.81 19.69±0.14 4.11±0.11 5 10.79±0.41 62.1±1.84 18.96±0.16 3.19±0.2 6 28.8±0.45 9.15±0.07 22.17±0.12 4.43±0.1 7 13.07±0.50 57.85±1.69 21.05±0.32 4.39±0.09 8 23.9±0.53 19.3±1.15 20.79±0.2 5.45±0.03 9 28.56±0.26 14.71±0.17 22.69±0.06 4.35±0.04
表4 相关成分的特征值及贡献率
Table 4 Eigenvalues and cumulative variance contribution rates
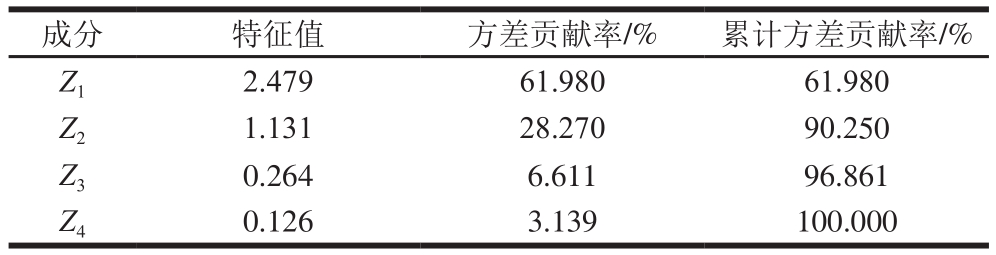
注:仅提取特征值大于1的主成分因子。
images/BZ_263_1276_1051_2255_1099.pngZ1 2.479 61.980 61.980 Z2 1.131 28.270 90.250 Z3 0.264 6.611 96.861 Z4 0.126 3.139 100.000
表5 前2 个主成分的特征向量
Table 5 Eigenvectors of the first two principal components
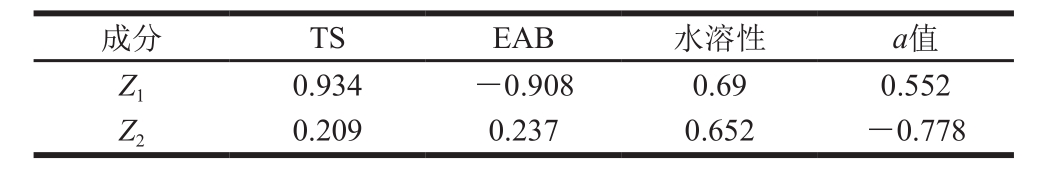
images/BZ_263_1276_1468_2256_1516.pngZ1 0.934 -0.908 0.69 0.552 Z2 0.209 0.237 0.652 -0.778
2.1.3 响应面试验优化的回归拟合
在单因素试验基础上,选择马铃薯淀粉-羧甲基纤维素钠质量比(X1)、紫薯花青素质量分数(X2)和甘油质量分数(X3)进行3因素3水平的响应面试验,综合分(S)为响应值。试验结果如表6所示,使用Design-Expert软件将试验数据进行回归拟合,得到方程如下:S=61.02+3.85X1-2.46X2-2.51X3+2.44X1X2+0.92X1X3-6.28X2X3+3.61X12-7.35X2
2-11.6X3
2。
表6 响应面试验设计及结果
Table 6 Experimental design and results for response surface analysis
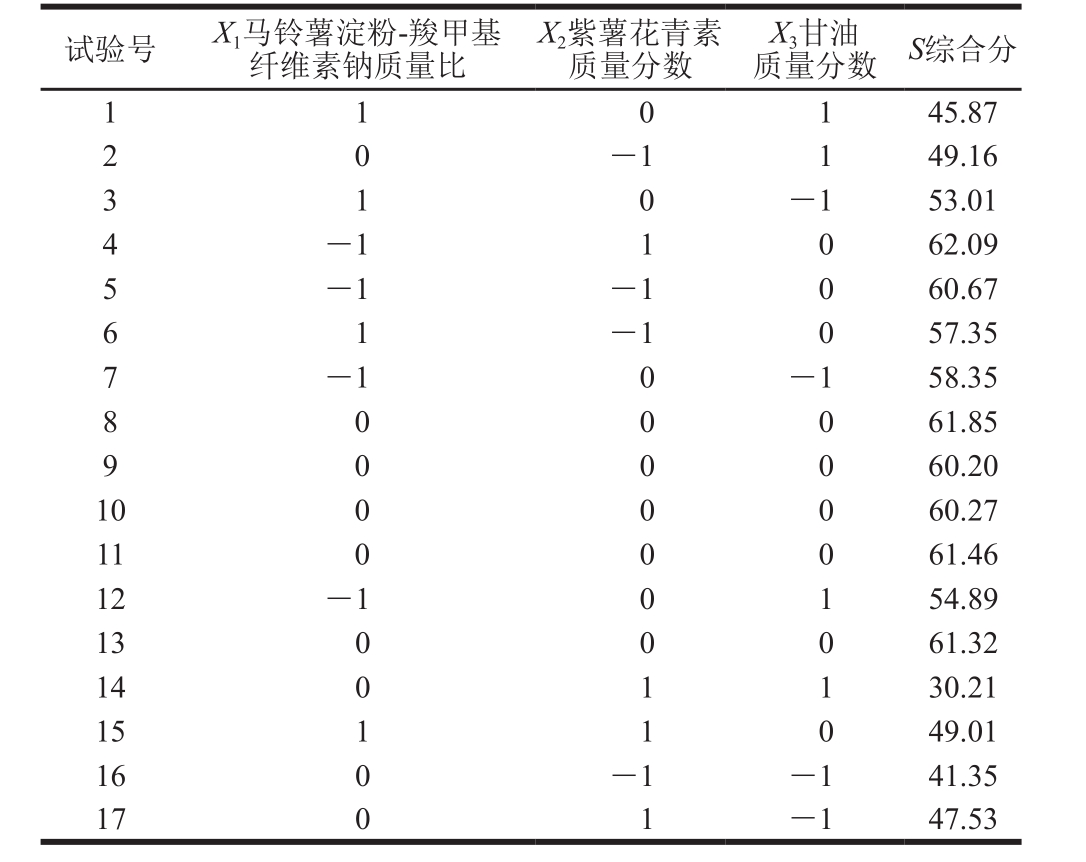
试验号 X1马铃薯淀粉-羧甲基纤维素钠质量比X2紫薯花青素质量分数X3甘油质量分数 S综合分1 1 45.87 2 0-1 1 49.16 1 0 3 0 -1 53.01 4-1 1 0 62.09 5-1 -1 0 60.67 6 1-1 0 57.35 1 7-1 0 -1 58.35 8 0 0 0 61.85 0 60.20 10 0 0 0 60.27 11 0 0 0 61.46 12 -1 0 1 54.89 13 0 0 0 61.32 14 0 1 1 30.21 15 1 1 0 49.01 16 0 -1 -1 41.35 17 0 1 -1 47.53 9 0 0
根据表7分析可知,回归方程模型的P值小于0.000 1,说明模型差异极显著;失拟项P=0.158 9>0.05,表明失拟不显著,本试验模型的决定因素系数R2为0.994 4,表明模型的预测结果与实际值拟合度高,因此该模型能够很好地对响应值综合分进行分析和预测。回归方程各项显著性表明,本研究一次项X1、X2、X3影响均达到极显著水平(P<0.01),同时二次项影响极显著,交互项X1X2、X2X3影响达到极显著水平,X1X3影响不显著,分析可知影响综合评分的主次顺序依次为X1>X3>X2。
表7 回归模型的方差分析
Table 7 Analysis of variance (ANOVA) of regression model
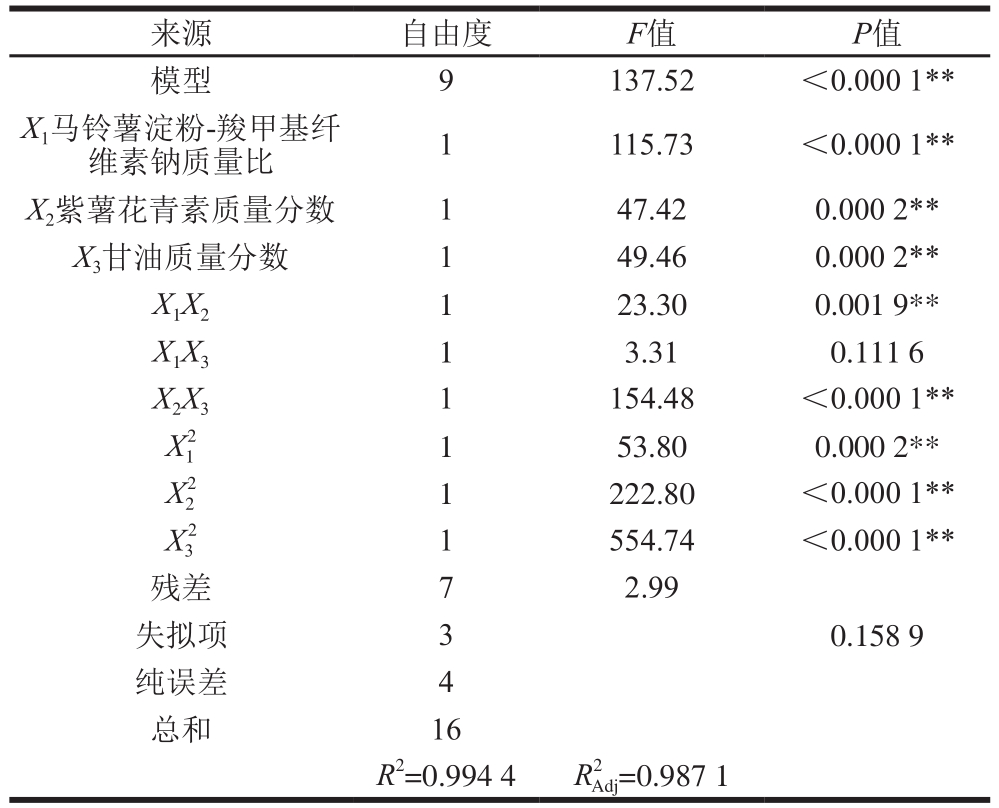
注:**. P<0.01,差异极显著;*. P<0.05,差异显著。
images/BZ_264_224_1109_1205_1156.png模型 9 137.52 <0.000 1**X1马铃薯淀粉-羧甲基纤维素钠质量比 1 115.73 <0.000 1**X2紫薯花青素质量分数 1 47.42 0.000 2**X3甘油质量分数 1 49.46 0.000 2**X1X2 1 23.30 0.001 9**X1X3 1 3.31 0.111 6 X2X3 1 154.48 <0.000 1**X12 1 53.80 0.000 2**X22 1 222.80 <0.000 1**X32 1 554.74 <0.000 1**残差 7 2.99失拟项 3 0.158 9纯误差 4总和 16 R2=0.994 4 R2Adj=0.987 1
使用Design-Expert分析出指示膜的最佳工艺条件为马铃薯淀粉-羧甲基纤维素钠质量比60.85∶39.15、紫薯花青素质量分数0.47%、甘油质量分数0.59%,预测得到指示膜的综合分为64.26。为了检验模型准确性和考虑实际情况,将最优工艺修改为质量比6∶4、紫薯花青素质量分数0.5%、甘油质量分数0.6%,在此条件下平行实验3 次,得出综合分为63.8,此时对应的TS为(21.48±0.12)MPa,EAB为(28.88±0.08)%,水溶性为(19.24±0.21)%,a值为4.95±0.02。由此可见综合评分的验证实验值与模型预测值比较接近,达到预测值的99.28%,表明预测结果较优。
2.2 SCA指示膜的表征
2.2.1 SCA指示膜的傅里叶变换红外光谱分析
如图2所示,其中,3 318 cm-1附近为—OH键的伸缩振动吸收峰,这与成膜原料(羧甲基纤维素钠、淀粉、紫薯花青素粉)中含有丰富的羟基结果一致,同时在2 931 cm-1和2 922 cm-1有2 个明显的特征峰为原料中—CH2和—CH的伸缩振动而产生[27]。在原料紫薯花青素粉中1 628 cm-1处的强吸收带和1 524 cm-1处的特征峰归因于C=C芳环的弯曲振动,与紫薯花青素粉属于芳香族化合物有关,此外,1 256 cm-1指定为类黄酮化合物的吡喃环段,1 048 cm-1处的吸收带归因于芳环的C—H产生[28]。在淀粉原料的光谱中1 161 cm-1和1 078 cm-1可能是C—O、C—C、O—H、C—O—C的共同作用产生了伸缩振动峰,而这些特征峰在马铃薯淀粉-羧甲基纤维素钠膜和SCA指示膜中均有体现[29]。马铃薯淀粉-羧甲基纤维素钠膜的吸收峰由原来的1 646 cm-1移至1 637 cm-1,这可能是加入紫薯花青素后与原料之间产生相互作用,形成了较强的分子之间作用力。根据光谱结果表明,原料的成分未发生改变,同时紫薯花青素粉很好地嵌入了成膜基材中。

图2 基材及膜的红外光谱图
Fig. 2 FT-IR spectra of film-forming materials and films
2.2.2 SCA指示膜的X射线衍射分析
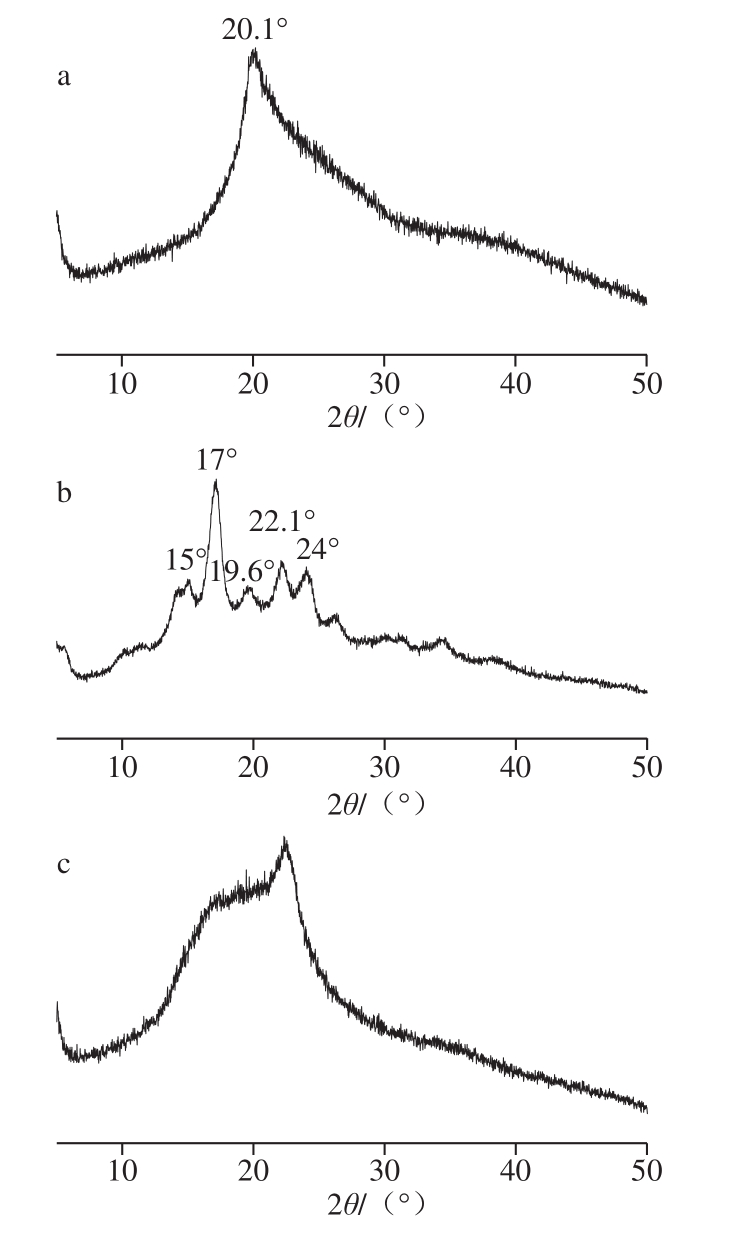

图3 原料和膜的X射线衍射图
Fig. 3 XRD spectra of film-forming materials and films
由图3可知,淀粉在17.0°处具有很强的衍射峰,在15.0°、19.6°、22.1°、24.0°处具有一些弱峰,另外,在5.5°处观察到最弱的特征峰。对于淀粉而言,通常,由于不同的晶体结构,XRD光谱图有3 种类型。A型淀粉在15°和23°附近有明显的衍射峰,在17°和18°处有未分辨的双峰;B型淀粉在约17.0°处产生更明显的衍射峰,在约5.6°处产生特征峰,同时在约15.0°、20.0°、22.0°和24°处产生一些小峰;C型是A型和B型的混合物[30]。该结果表明淀粉材料是第2类(B型)淀粉。由图3可知,羧甲基纤维素钠的特征峰为在20.1°附近的宽峰,归因于其特有的晶体结构。在马铃薯淀粉-羧甲基纤维素钠膜中未发现淀粉和羧甲基纤维素钠的特征峰,表明淀粉与羧甲基纤维素钠混合效果较好,同时二者的结晶区受加热搅拌的影响。加入紫薯花青素后SCA指示膜的宽峰强度变大,可能归因于紫薯花青素粉与淀粉和羧甲基纤维素钠的羟基之间形成的氢键。通过图谱分析表明各成分之间有较强的相互作用,打乱了各自原有的结晶结构,从而提高了指示膜的力学性能。
2.2.3 SCA指示膜的扫描电镜分析

图4 膜横截面的扫描电镜图
Fig. 4 Scanning electron micrographs of cross sections of films
由图4可知,2 种膜的表面大部分区域平整光滑,表明物质之间相容性好,而有轻微的颗粒状物质,可能是因为成膜基材的团聚现象,相对而言,在SCA指示膜中横截面表现更加光滑,截面出现没有褶皱和纹路,表明紫薯花青素粉加入后对淀粉和羧甲基纤维素钠之间的相容性有增强作用[31]。Zhang Junjun等[32]研究发现将玫瑰茄花青素加入两两混合的可降解生物聚合物基材中制备指示膜,玫瑰茄花青素改善了成膜基材的相容性,使得指示膜截面更加光滑。同时紫薯花青素粉中的酚羟基可以结合成膜基材中的羟基有效地降低了聚合物的链分子,从而提高了指示膜的力学性能,指示膜截面的均一性使得自由水不易从孔洞进入指示膜内部导致其水溶性降低[33]。
2.3 SCA指示膜应用于鱼肉新鲜度监测

图5 SCA指示膜48 h内的颜色变化情况
Fig. 5 Color change of SCA films within 48 h

图6 鱼肉存放期间膜品质的变化
Fig. 6 Changes in quality attributes during storage of fish
选择优化后综合性能较优的SCA指示膜用于实时监测鱼肉新鲜度。根据图5和图6可知,随着贮存时间的延长,鱼肉的TVB-N值、pH值以及菌落总数不断上升,SCA指示膜的颜色也随之不断改变。鱼肉的初始TVB-N为6.56 mg/100 g,根据GB 2733—2015《鲜、冻动物性水产品》规定新鲜鱼肉中TVB-N值应该小于20 mg/100 g,鱼肉可食用,此时SCA指示膜显示出红色。随着时间的延长TVB-N值不断的增大,当贮存时间达到36 h,鱼肉的TVB-N值达到21.55 mg/100 g,鱼肉的pH值为7.58,菌落总数为7.3(lg(CFU/g)),表明鱼肉已经不能食用,同时SCA指示膜显示出蓝紫色,ΔE值为16.78,与鱼肉新鲜时指示膜的颜色对比变化较大,肉眼可直接观察SCA指示膜颜色的改变。当贮存时间达到48 h时,TVB-N值、pH值以及菌落总数分别为36.79 mg/100 g、8.29、8.52(lg(CFU/g)),表明鱼肉已经完全腐败变质,此时SCA指示膜蓝色加深,ΔE值为24.55,视觉观察更加明显。由在鱼肉贮藏期间,TVB-N值不断增大,色差也不断上升,且具有线性关系,Y=0.525 6+0.020 02X,R2=0.968 61。在贮存期间,鱼的新鲜度随着微生物生长和发生的生化反应而降低,碳水化合物、蛋白质和脂肪被分解,产生许多挥发性含氮化合物,这些含氮化合物会改变鱼肉pH值,从而导致指示膜颜色的改变[34]。因此SCA指示膜能够用于检测鱼肉新鲜度。Huang Shaoyun等[5]提取紫草根花青素作为指示剂,将琼脂作为成膜基材制备指示膜用于检测鱼肉新鲜度,指示膜颜色由粉红色变成蓝紫色,与本研究结果相似。
3 结 论
马铃薯淀粉和羧甲基纤维素钠的比例、花青素质量分数、甘油质量分数对指示膜TS、EAB、水溶性,颜色(a值)共4 个指标有不同程度的影响,减少马铃薯淀粉和羧甲基纤维素钠的比例可提高指示膜的TS,降低指示膜的EAB,随着花青素质量分数提升指示膜的a值不断增大,甘油质量分数的增加显著提高指示膜的水溶性。采用主成分分析法和隶属度综合评分法相结合确定指示膜的综合评分,主成分分析法确定了前2 个主成分的累计方差贡献率达到90.250%,同时4 个指标归一化处理后TS、EAB、水溶性和a值4 个指标对应权重分别为0.36、0.25、0.38、0.01。通过响应面试验优化指示膜的最佳工艺参数为马铃薯淀粉和羧甲基纤维素钠质量比6∶4,紫薯花青素质量分数为0.5%,甘油质量分数为0.6%,可得指示膜的综合分为63.8,此时对应的TS为(21.48±0.12)MPa,EAB为(28.88±0.08)%,水溶性为(19.24±0.21)%,a值为4.95±0.02。红外光谱和X射线衍射结果分析显示紫薯花青素很好地嵌入了成膜基材中,并使得各成分之间作用力加强,提高了指示膜的力学性能。扫描电镜结果分析表明,指示膜截面平整光滑,各组分之间相容性好。利用最优SCA指示膜实时监测鱼肉新鲜度,鱼肉的TVB-N值从最初的6.56 mg/100 g达到21.55 mg/100 g时,指示膜的颜色由原来的红色变为蓝紫色,并结合pH值和菌落总数的变化,表示鱼肉不再新鲜,最后指示膜变为蓝色。结果表明SCA指示膜综合性能较优,各组分间相容性好,且能实时监测鱼肉新鲜度。
[1] Jr PEREIRAV A, ARRUDA I N Q D. Active chitosan/PVA films with anthocyanins from Brassica oleraceae (red cabbage) as Time-Temperature Indicators for application in intelligent food packaging[J].Food Hydrocolloids, 2015, 43(1): 180-188. DOI:10.1016/j.foodhyd.2014.05.014.
[2] LUCHESE C L, SPEROTTO N, SPADA J C, et al. Effect of blueberry agro-industrial waste addition to corn starch-based films for the production of a pH indicator film[J]. International Journal of Biological Macromolecules, 2017, 104: 11-18. DOI:10.1016/j.ijbiomac.2017.05.149.
[3] PRIETTO L, MIRAPALHETE T C, PINTO V Z, et al. pH-sensitive films containing anthocyanins extracted from black bean seed coat and red cabbage[J]. LWT-Food Science and Technology, 2017, 80: 492-500. DOI:10.1016/j.lwt.2017.03.006.
[4] ZHAI X D, SHI J Y, ZOU X B, et al. Novel colorimetric films based on starch/polyvinyl alcohol incorporated with roselle anthocyanins for fish freshness monitoring[J]. Food Hydrocolloids, 2017, 69: 308-317.DOI:10.1016/j.foodhyd.2017.02.014.
[5] HUANG S Y, XIONG Y B, ZOU Y, et al. A novel colorimetric indicator based on agar incorporated with Arnebiaeuchroma root extracts for monitoring fish freshness[J]. Food Hydrocolloids, 2019,90: 198-205. DOI:10.1016/j.foodhyd.2018.12.009.
[6] ŠEALIJA S, NESIC A, RUZIC J, et al. Edible blend films of pectin and poly(ethylene glycol): preparation and physico-chemical evaluation[J]. Food Hydrocolloids, 2018, 77: 494-501. DOI:10.1016/j.foodhyd.2017.10.027.
[7] CHOI I, LEE J Y, LACROIX M, et al. Intelligent pH indicator film composed of agar/potato starch and anthocyanin extracts from purple sweet potato[J]. Food Chemistry, 2017, 218: 122-128. DOI:10.1016/j.foodchem.2016.09.050.
[8] 高立红, 郑艳. 可食用膜在冷鲜肉保鲜中的应用研究进展[J]. 肉类研究, 2017, 31(12): 56-59.
[9] 蒋光阳, 肖力源, 王章英, 等. 不同基材复配紫薯花青素制备智能指示膜及应用研究[J]. 食品科学, 2019, 40(13): 267-273. DOI:10.7506/spkx1002-6630-20180706-083.
[10] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 塑料拉伸性能的测定第3部分: 薄膜和薄片的试验条件: GB/T 1040.3—2006[S].北京: 中国标准出版社, 2006: 1-13.
[11] 邹小波, 王圣, 石吉勇, 等. 天然花青素提取物与壳聚糖明胶复合膜的制备和表征[J]. 农业工程学报, 2016, 32(17): 294-300.DOI:10.11975/j.issn.1002-6819.2016.17.039.
[12] 孙海涛, 邵信儒, 姜瑞平, 等. 玉米磷酸酯淀粉/秸秆纤维素可食膜的制备及物理性能[J]. 食品科学, 2016, 37(24): 21-28. DOI:10.7506/spkx1002-6630-201624004.
[13] GUTIERREZ T J, HEMIOU-JULIEN C, ALVAREZL V A.Structural properties and in vitro digestibility of edible and pH-sensitive films made from guinea arrowroot starch and wastes from wine manufacture[J]. Carbohydrate Polymers, 2017, 18: 135-143.DOI:10.1016/j.carbpol.2017.12.039.
[14] 国家卫生和计划生育委员会. 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2016.
[15] 国家卫生和计划生育委员会. 食品微生物学检验 菌落总数测定:GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016.
[16] 国家质量监督检验检疫总局. 肉与肉制品pH测定: GB/T 9695.5—2008[S]. 北京: 中国标准出版社, 2008.
[17] GHANBARZADEH B, ALMASI H, ENTEZAMI A A. Physical properties of edible modified starch/carboxymethyl cellulose films[J].Innovative Food Science & Emerging Technologies, 2010, 11(4): 690-702. DOI:10.1016/j.ifset.2010.06.001.
[18] 王晓玲, 董海洲, 刘传富, 等. 木薯淀粉对改善可食性羧甲基纤维素膜性能的研究[J]. 食品与发酵工业, 2010, 36(2): 63-65.
[19] SANUJA S, AGALA A, UMAPATHY M J. Synthesis and characterization of zinc oxide-neem oil-chitosan bionanocomposite for food packaging application[J]. International Journal of Biological Macromolecules, 2015, 74: 76-84. DOI:10.1016/j.ijbiomac.2014.11.036.
[20] CHAMBI H, GROSSO C. Edible films produced with gelatin and casein cross-linked with transglutaminase[J]. Food Research International, 2006, 39(4): 458-466. DOI:10.1016/j.foodres.2005.09.009.
[21] PEREDA M, AMIXCA G, RACAZ I, et al. Preparation and characterization of sodium caseinate films reinforced with cellulose derivatives[J]. Carbohydrate Polymers, 2011, 86(2): 1014-1021.DOI:10.1016/j.carbpol.2011.05.063.
[22] WANG X C, YONG H M, GAO L, et al. Preparation and characterization of antioxidant and pH-sensitive films based on chitosan and black soybean seed coat extract[J]. Food Hydrocolloids,2019, 89(4): 56-66. DOI:10.1016/j.foodhyd.2018.10.019.
[23] ZHANG Y, HAN J H. Plasticization of pea starch films with monosaccharides and polyols[J]. Journal of Food Science, 2010, 71(6): 253-261.
[24] TONG Q Y, QIAN X, LIM L T, et al. Preparation and properties of pullulan-alginate-carboxymethylcellulose blend films[J]. Food Research International, 2008, 41(10): 1007-1014. DOI:10.1016/j.foodres.2008.08.005.
[25] 高丹丹, 江连洲, 张超, 等. 响应面法优化普鲁兰多糖-明胶可食性膜制备工艺[J]. 食品科学, 2012, 33(18): 21-24.
[26] 陈珊珊, 陶宏江, 王亚静, 等. 葵花籽壳纳米纤维素/壳聚糖/大豆分离蛋白可食膜制备工艺优化[J]. 农业工程学报, 2016, 32(8):306-314. DOI:10.11975/j.issn.1002-6819.2016.08.043.
[27] HONG J, CHEN R, ZENG X A, et al. Effect of pulsed electric fields assisted acetylation on morphological, structural and functional characteristics of potato starch[J]. Food Chemistry, 2016, 192: 15-24.DOI:10.1016/j.foodchem.2015.06.058.
[28] SILVA-PERAIR M C, TEIXEIRA J A, PEREIRA-JUNIOR V A, et al.Chitosan/corn starch blend films with extract from Brassica oleraceae(red cabbage) as a visual indicator of fish deterioration[J]. LWT-Food Science and Technology, 2015, 61(1): 258-262. DOI:10.1016/j.lwt.2014.11.041.
[29] CAPRON I, ROBERT P, COLONNA P, et al. Starch in rubbery and glassy states by FTIR spectroscopy[J]. Carbohydrate Polymers, 2007,68(2): 249-259. DOI:10.1016/j.carbpol.2006.12.015.
[30] GUO J J, LIU L, LIAN X, et al. The properties of different cultivars of JinHai sweet potato starches in China[J]. International Journal of Biological Macromolecules, 2014, 67(6): 1-6. DOI:10.1016/j.ijbiomac.2014.03.002.
[31] LIU B, XU H, ZHAO H Y, et al. Preparation and characterization of intelligent starch/PVA films for simultaneous colorimetric indication and antimicrobial activity for food packaging applications[J].Carbohydrate Polymers, 2017, 157: 842-849. DOI:10.1016/j.carbpol.2016.10.067.
[32] ZHANG J J, ZOU X B, ZHAI X D, et al. Preparation of an intelligent pH film based on biodegradable polymers and roselle anthocyanins for monitoring pork freshness[J]. Food Chemistry, 2019, 272: 306-312.DOI:10.1016/j.foodchem.2018.08.041.
[33] RIVERO S, GARCIA M A, PINOTTI A. Composite and bi-layer films based on gelatin and chitosan[J]. Journal of Food Engineering, 2009,90(4): 531-539. DOI:10.1016/j.jfoodeng.2008.07.021.
[34] HUNG L, ZHAO J W, CHEN Q S, et al. Nondestructive measurement of total volatile basic nitrogen (TVB-N) in pork meat by integrating near infrared spectroscopy, computer vision and electronic nose techniques[J]. Food Chemistry, 2014, 145(7): 228-236. DOI:10.1016/j.foodchem.2013.06.073.