苦荞麦(Fagopyrum tataricum (L.) Gaertn.)属于蓼目廖科1 a生双子叶草本植物,主要分布于中国、俄罗斯、乌克兰及法国等地,是自然界中较少的药食两用作物。苦荞黄酮作为苦荞麦的重要活性物质,是一种色原酮或色原烷的衍生物,具有极高的营养和医药价值,包括对链脲佐菌素诱导的糖尿病患者的抗高血糖和抗氧化活性[1-2]、显著降低心血管病人血清中过氧化物酶和胆固醇水平[3]、逆转多药耐药性恢复癌细胞的化学敏感性[4]、抑制胶质瘤细胞增殖并促进细胞凋亡[5]、对心脏损伤和脑损伤的保护作用[6-7]、抗血小板聚集、抗黏附活性[8]、清除自由基和高抗氧化作用[9]、免疫调节[10]等多种保健和医疗功效。但是苦荞黄酮颜色偏深、味道发苦,直接食用会使人产生不愉悦感,令消费者难以接受,而且苦荞黄酮在进入人体胃部时,容易被胃酸破坏,这限制了人体肠道对苦荞黄酮的吸收,大大降低了人体利用率。因此,选择一种恰当的方法掩盖苦荞黄酮的颜色及苦味,并切实提高人体利用率,对于苦荞黄酮的应用具有极其重要的价值和意义。
微胶囊化是利用一种或多种成膜性高分子原料或加聚物包裹目标物质的微型修饰技术,其产品直径在1~5 000 μm之间[11]。已经报道了几种用于微胶囊化黄酮类化合物的方法,包括喷雾干燥法、复合凝聚法和锐孔-凝固浴法等。锐孔-凝固浴微胶囊化是壁材与芯材混合液经锐孔处理后与凝固剂之间的物理和化学作用引起的[12]。当混合液滴与含有Ca2+等阳离子的硬化溶液接触时,聚合物包围核心,通过交联钙离子形成三维晶格结构[13]。微胶囊技术的应用效果很大程度上取决于壁材的选择,不同壁材决定着微胶囊产品的理化性质。海藻酸盐、β-环糊精、黄原胶和壳聚糖等天然多糖由于其资源丰富、价格便宜、无毒性和反应条件温和等特点,是目前微胶囊制备的常用壁材[14]。鲁晓翔等[15]以β-环糊精为壁材对玉米须黄酮进行微胶囊化,所得包埋率为85.6%,载药量为5.7%。潘明等[16]以黄原胶和β-环糊精作为复合壁材所得鼠曲草黄酮类物质微胶囊包埋率为91.14%,载药量为8.28%。但是,由于它们在胃肠道中遇到高比例的酸和胆汁浓度会发生裂解,对芯材的保护无效[17]。乳清蛋白作为干酪加工过程中的副产物,具有极高的营养价值和多种功能特性。将乳清蛋白的成膜性与凝胶特性相结合,可以用于一些特定物质的包埋。β-乳球蛋白是主要的乳清蛋白成分及主要的胶凝剂。乳清蛋白的物理化学性质表明它们可能适合开发pH值敏感的水凝胶以控制生物活性物质的输送[18]。Eratte等[19]报道了使用乳清蛋白-阿拉伯胶的微胶囊化富含ω-3脂肪酸的金枪鱼油。Zhang Yonggang等[20]报道了使用乳清蛋白-藻酸盐的微胶囊化香芹酚。关于热诱导的聚合乳清蛋白(polymerized whey protein,PWP)作为唯一壁材对活性物质的包埋,在现有文献中较少报道,PWP对黄酮类化合物微胶囊化的相关研究更是鲜见。本实验研究以PWP作为唯一壁材通过锐孔-凝固浴法制备苦荞黄酮微胶囊的工艺,并对苦荞黄酮微胶囊的表征、热稳定性、在胃肠道中的缓释性等理化特性进行分析,考察PWP作为微胶囊唯一壁材的可能性,旨在探究一种微胶囊化的新型壁材并为苦荞黄酮微胶囊的研究和开发提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
苦荞麦取自贵州师范大学试验基地,洗净烘干,粉碎过筛后密封保存,采用超声辅助醇提法[21]经旋转蒸发纯化后,冷冻干燥获得苦荞黄酮干燥粉末备用。
分离乳清蛋白(whey protein isolation,WPI,纯度≥90%) 山东文兴生物科技有限公司;无水氯化钙(分析纯) 天津市致远化学试剂有限公司;溴化钾(分析纯) 天津市兴复科技发展有限公司;胃蛋白酶(酶活力3 000 U/mg)、胰酶(酶活力4 000 U/mg)北京索莱宝科技有限公司;磷酸二氢钾(分析纯)重庆吉元化学有限公司;无水乙醇(分析纯) 天津市富宇精细化工有限公司;溴化钾(分析纯) 天津市兴复科技发展有限公司。
1.2 仪器与设备
FD-1-50冷冻干燥机 北京博医康实验仪器有限公司;THZ-82A数显气浴恒温振荡器 常州普天仪器制造有限公司;DW-86L828W超低温保存箱 北京盛科信德科技有限公司;GL-20G-型离心机 上海书培实验设备有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限公司;BCD-186D11D冰箱 海信容声(广东)冰箱有限公司;LS 13320激光粒度分析仪 美国贝克曼库尔特有限公司;Q2000差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA公司;S-3400N扫描电子显微镜 日本日立公司;Nicolet is50原位漫反射傅里叶变换红外光谱仪 美国赛默飞世尔科技有限公司;MB35型水分测定仪 奥豪斯国际贸易有限公司。
1.3 方法
1.3.1 苦荞黄酮微胶囊的制备
1.3.1.1 PWP的制备[22]
将WPI粉末溶于蒸馏水中,混合均匀,配制成10%乳清蛋白溶液,置于4 ℃冰箱中保存12 h后,取出静置至室温,调节pH值至7.0,85 ℃水浴恒温振荡30 min,迅速取出于冰水浴中,降至室温。再次置于4 ℃冰箱中24 h,得PWP凝胶。
1.3.1.2 微胶囊的制备
将无水CaCl2溶解于去离子水中配制CaCl2凝固浴,置于4 ℃冰箱冷藏。准确称取苦荞黄酮和PWP凝胶于锥形瓶中,720 r/min磁力搅拌后,将样品混合液移至针头为0.45 mm的2.5 mL一次性注射器中,快速均匀滴入预先配制好的CaCl2凝固浴中制珠成型,于4 ℃固化30 min。将制得的苦荞黄酮微胶囊用蒸馏水充分洗涤3 次、过滤,经真空冷冻干燥,得干燥的苦荞黄酮微胶囊产品。
1.3.2 苦荞黄酮微胶囊包埋率的测定
1.3.2.1 芸香苷标准曲线的绘制
苦荞黄酮的主要成分为芸香苷,因此苦荞黄酮的含量以芸香苷相对含量表示。参考李欣等[21]的方法,以吸光度为横坐标,芸香苷质量浓度(mg/mL)为纵坐标绘制标准曲线,得回归方程y=0.029 2x+0.000 01,r=0.999 56。
1.3.2.2 微胶囊包埋率的测定[23]
微胶囊表面苦荞黄酮含量的测定:准确称取干燥后的微胶囊产品0.2 g,以1∶30(g/mL)的比例加入无水乙醇,充分振荡,5 000 r/min离心10 min,取1 mL上清液,定容至10 mL,用1.3.2.1节方法测定。按式(1)计算表面黄酮质量分数:
式中:W1为表面黄酮质量分数/%;C1为由标准曲线所得待测液表面黄酮质量浓度/(mg/mL);V为待测液体积/mL;N为稀释倍数;M为样品质量/g。
微胶囊中苦荞黄酮总量的测定:准确称取干燥后的微胶囊产品0.2 g,以1∶30的比例加入70%乙醇溶液,摇匀,于40 ℃、30 min超声处理后,5 000 r/min离心10 min,取1 mL上清液,定容至10 mL,用1.3.2.1节方法测定,按式(2)计算微胶囊中苦荞黄酮总量:
式中:W2为微胶囊中苦荞黄酮总量/%;C2为由标准曲线所得待测液微胶囊中黄酮总质量浓度/(mg/mL);V为待测液体积/mL;N为稀释倍数;M为样品质量/g。
包埋率按式(3)计算:
1.3.3 微胶囊工艺单因素试验
当搅拌速率为720 r/min时,考察芯壁比、CaCl2质量分数、搅拌时间对微胶囊包埋率的影响。芯壁比分别为1∶6、1∶7、1∶8、1∶9、1∶10(g/g);CaCl2质量分数分别为1.0%、1.2%、1.4%、1.6%、1.8%;搅拌时间分别为30、40、50、60 min和70 min。以微胶囊包埋率为考察指标进行试验。
每组单因素试验做3 组平行。单因素试验中固定因素分别为芯壁比1∶9(g/g)、CaCl2质量分数1.4%,搅拌时间50 min。
1.3.4 微胶囊工艺的响应面试验
根据单因素试验结果分析,确定以芯壁比(A)、CaCl2质量分数(B)、搅拌时间(C)这3 个因素为自变量,以微胶囊包埋率(Y)为响应值,根据Box-Behnken设计原理,采用Design-Expert 8.0.6程序软件进行3因素3水平响应面优化试验。Box-Behnken试验因素及水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Independent variables and their levels used in Box-Behnken design

?因素 水平-1 0 1 A芯壁比(g/g) 1∶8 1∶9 1∶10 B CaCl2质量分数/% 1.2 1.4 1.6 C搅拌时间/min 40 50 60
1.3.5 苦荞黄酮微胶囊理化性质的测定
1.3.5.1 微胶囊水分质量分数的测定
称取最优条件下制备的苦荞黄酮微胶囊样品4 g,于105 ℃水分测定仪中测定微胶囊产品的水分含量。
1.3.5.2 微胶囊载药量的测定
微胶囊的载药量是指单位质量或单位体积微胶囊所负载的药量。按式(4)计算:
1.3.5.3 微胶囊粒径的测定
以蒸馏水作为分散剂,通过激光粒度分析仪测定苦荞黄酮微胶囊的粒径[24]。
1.3.5.4 微胶囊表面微观结构观察
用电子显微镜对苦荞黄酮微胶囊进行表面微观结构观察,用药匙将苦荞黄酮微胶囊产品轻轻置于黏有导电胶带的样品台上,喷金,选择合适的视野对苦荞黄酮微胶囊进行拍摄观察。
1.3.5.5 微胶囊的红外光谱测定
通过红外光谱分析,对样品化学结构进行表征。利用KBr对样品进行处理,即称取1 mg样品,加入100 mg烘干的KBr粉末于研钵中研磨均匀,压片,检测波长范围400~4 000 cm-1,分辨率4 cm-1,次数为32 次。
1.3.5.6 微胶囊DSC测定
采用差示扫描量热仪,设置升温速率10 ℃/min;升温范围20~240 ℃;每个样品重复测定3 次,并采集数据。
1.3.5.7 模拟胃、肠液消化实验测定微胶囊中苦荞黄酮释放率
参考Wang Mu等[24]的方法,配制模拟胃液及模拟肠液。体外模拟胃液的配制:精确吸取9 mL浓盐酸于1 000 mL烧杯中,加入800 mL去离子水及10 g胃蛋白酶,充分溶解混匀,移入1 000 mL容量瓶中,定容,4 ℃保存待用。体外模拟小肠液的配制:精确称取6.8 g KH2PO4于500 mL去离子水中,充分溶解,0.4% NaOH溶液调节溶液pH值为6.8;另取10 g胰酶溶解于水中,将两溶液一并移入1 000 mL容量瓶,定容,4 ℃保存待用。
准确称取新制备的苦荞黄酮微胶囊产品0.5 g于装有20 mL模拟胃液的离心管中,37 ℃、110 r/min摇床振荡处理4 h,4 000 r/min离心20 min,小心倒出上清液,加入20 mL模拟肠液,继续于37 ℃、110 r/min摇床振荡处理6 h。此间,间隔吸取1 mL消化液,测定其中苦荞黄酮的含量,同时补充相应体积的消化液,保持离心管中溶液体积不变。苦荞黄酮的释放率按式(5)计算:
1.4 数据处理
采用Design-Expert 8.0.6和DPS 7.05软件进行数据统计分析。P<0.05,差异显著;P<0.01,差异极显著。运用Origin 8.6软件完成图表的编辑与绘制。
2 结果与分析
2.1 芯壁比对苦荞黄酮微胶囊包埋率的影响
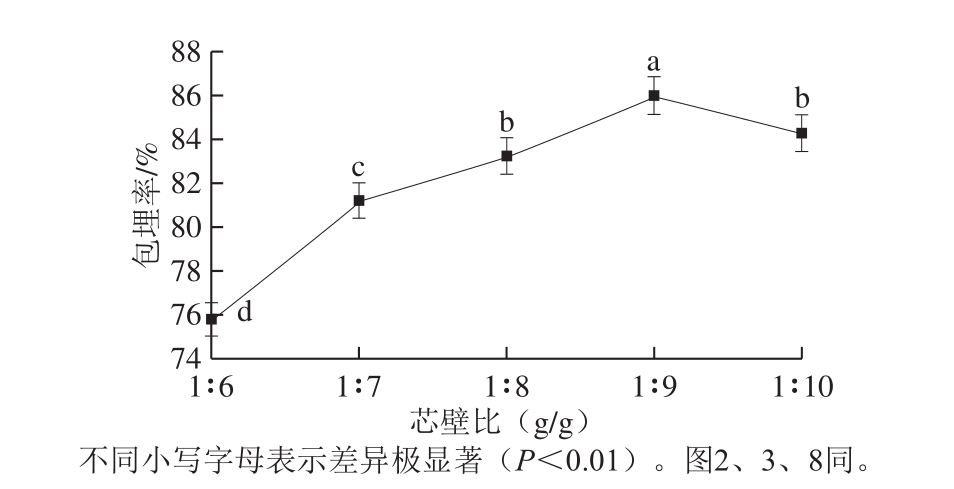
图1 芯壁比对苦荞黄酮微胶囊包埋率的影响
Fig. 1 Effect of core/wall ratio on microencapsulation efficiency of tartary buckwheat flavonoids
芯壁比对微胶囊的包埋率及制备成本的影响主要体现为苦荞黄酮的负载率。壁材过少则不能对芯材进行充分包埋,且苦荞黄酮相对过多会造成微胶囊表面黄酮含量增加使包埋率下降,产品壁材较薄也会对产品的保存带来不利影响。由图1差异性分析可知,1∶7、1∶8、1∶9及1∶10处理组分别与对照组(1∶6)有极显著差异(P<0.01)。当芯壁比范围为1∶6~1∶9 时,包埋率呈逐渐增大的趋势,当芯壁比超过1∶9时,包埋率呈下降趋势。这是由于壁材浓度过大不利于凝固浴中产品的固化,致使微胶囊化效率降低,同时造成原材料的浪费。综上,确定芯壁比1∶9较为适宜。
2.2 CaCl2质量分数对苦荞黄酮微胶囊包埋率的影响
由图2可知,CaCl2作为苦荞黄酮微胶囊的凝固剂,其质量分数对产品效果有不同程度的影响。经差异性分析,1.4%、1.6%及1.8%处理组分别与对照组(CaCl2质量分数1.0%)有极显著差异(P<0.01),1.2%处理组与对照组无显著差异。当CaCl2质量分数较低时(<1.4%),产品表面黏性较大,分散性较差,容易黏成团,不易成形;CaCl2质量分数偏高时(>1.4%),产品表层快速凝固,外层结构致密,凝固剂不能很好地向内层扩散,导致内层固化不充分,产品皮层偏薄,效果不佳。综上所述,制备苦荞黄酮微胶囊时,CaCl2质量分数为1.4%最佳。

图2 CaCl2质量分数对苦荞黄酮微胶囊包埋率的影响
Fig. 2 Effect of CaCl2 concentration on microencapsulation efficiency of tartary buckwheat flavonoids
2.3 搅拌时间对苦荞黄酮微胶囊包埋率的影响

图3 搅拌时间对苦荞黄酮微胶囊包埋率的影响
Fig. 3 Effect of stirring time on microencapsulation efficiency of tartary buckwheat flavonoids
由图3可知,包埋率随着对芯材与壁材混合液搅拌时间的不同呈先上升后下降的趋势。经差异性分析,40、50、60 min及70 min处理组分别与对照组(搅拌时间30 min)有极显著差异(P<0.01)。在30~50 min时,随着混合液搅拌时间的延长,包埋率有所增加,当搅拌时间达到50 min时,出现包埋率随时间延长而下降的趋势。这是因为搅拌可通过力的作用促进芯材的分散,在一定程度上乳化芯材,增大了芯材与壁材的接触面,促进PWP对苦荞黄酮的包埋,当搅拌时间过长时,反应时间延长,容易出现分子键和氢键的破裂现象,对分子缔合物的形成不利,造成包埋率降低[25]。所以选择50 min为最佳搅拌时间。
2.4 苦荞黄酮微胶囊工艺的响应面试验优化
2.4.1 响应面模型及方差分析
Box-Behnken试验设计方案与结果见表2。运用Design-Expert 8.0.6程序软件对表2的试验结果进行分析,得到苦荞黄酮微胶囊包埋率(R)对芯壁比(A)、CaCl2质量分数(B)、搅拌时间(C)编码后的二次多项式回归方程为R=92.54+1.14A+1.28B+1.67C+1.67AB+1.17AC+1.09BC-3.53A2-5.90B2-4.77C2。
表2 响应面试验设计与结果
Table 2 Response surface design with experimental and predicted values of microencapsulation efficiency

images/BZ_272_224_754_1204_848.png1 0 0 0 93.12±0.75 92.54 2 -1 1 0 82.00±0.21 81.58 3 0 0 0 92.97±0.69 92.54 4 0 -1 1 81.40±0.35 81.17 5 1 0 0 88.41±0.78 88.22 6 1 0 -1 82.68±0.62 82.54 7 0 0 0 92.00±0.21 92.54 8 1 1 0 87.28±0.28 87.19 9 -1 0 1 83.46±0.17 83.60 10 0 1 1 85.63±0.68 85.91 11 0 -1 -1 80.29±0.23 80.01 12 -1 0 -1 82.41±0.36 82.60 13 1 -1 0 80.88±0.84 81.30 14 0 1 -1 80.16±0.66 80.39 15 -1 -1 1 82.26±0.39 82.36 16 0 0 0 91.22±0.85 92.54 17 0 0 0 93.40±0.63 92.54
表3 回归模型方差分析
Table 3 Analysis of variance of regression model

注:*.影响显著(P<0.05);**.影响极显著(P<0.01);R2=0.989 9,
images/BZ_272_224_1714_1204_1757.png模型 394.79 9 43.87 76.12 <0.000 1**A芯壁比 10.36 1 10.36 17.99 0.003 8**B CaCl2质量分数 13.09 1 13.09 22.71 0.002 0**C搅拌时间 22.32 1 22.32 38.73 0.000 4**AB 11.11 1 11.11 19.28 0.003 2**AC 5.49 1 5.49 9.52 0.017 7*BC 4.75 1 4.75 8.24 0.024 0*A2 52.52 1 52.52 91.14 <0.000 1**B2 146.67 1 146.67 254.52 <0.000 1**C2 95.78 1 95.78 166.20 <0.000 1**残差 4.03 7 0.58失拟项 0.75 3 0.25 0.30 0.822 6误差 3.29 4 0.82总变异 398.83 16
回归模型中,通过F检验分析各自变量对响应值的影响是否显著,P值越低,显著性越高。由表3可得,以微胶囊包埋率为响应值时,交互项AC、BC对结果表现为显著(P<0.05);一次项(A、B、C)、二次项(A2、B2、C2)及交互项AB均对结果有极显著影响(P<0.01);在各因素交互作用下,对苦荞黄酮微胶囊包埋率的影响大小依次为芯壁比×CaCl2质量分数>芯壁比×搅拌时间>CaCl2质量分数×搅拌时间;就各因素而言,对苦荞黄酮微胶囊包埋率的影响大小顺序为搅拌时间>CaCl2质量分数>芯壁比。该回归模型中P值小于0.000 1,表现为极显著,失拟项不显著(P=0.822 6>0.05),R2为0.989 9,大于0.95, 为0.976 9,可见该模型与实际实验拟合程度较佳,误差小,可用于PWP制备苦荞黄酮微胶囊包埋率的理论预测。
为0.976 9,可见该模型与实际实验拟合程度较佳,误差小,可用于PWP制备苦荞黄酮微胶囊包埋率的理论预测。
2.4.2 各因素间交互作用响应面分析

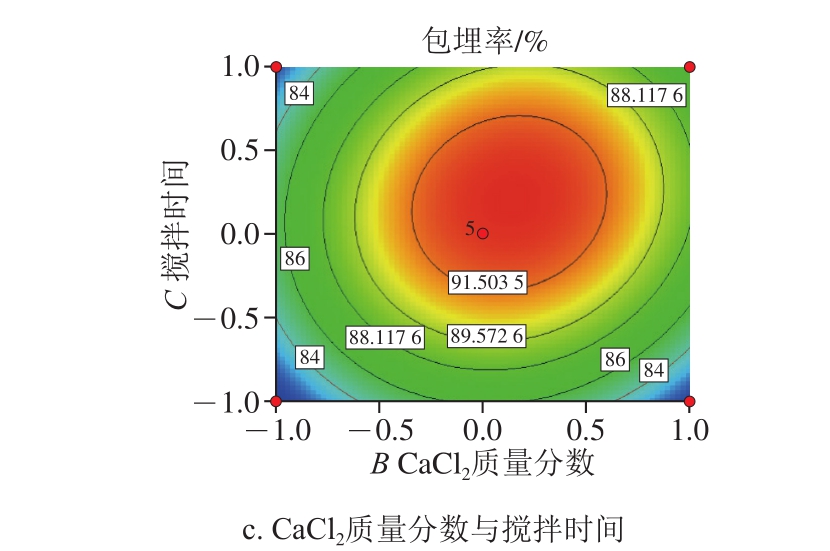
图4 各因素交互作用对苦荞黄酮微胶囊包埋率影响的响应面和等高线图
Fig. 4 Response surface and contour plots showing the interactive effects of various factors on microencapsulation efficiency of tartary buckwheat flavonoids
由图4可得,在各自变量的实验范围内存在最大值,即微胶囊包埋率最高。根据响应面与等高线图特性观察可知,芯壁比与CaCl2质量分数之间交互作用对包埋率的影响极显著,等高线图表现为椭圆形且曲面弯曲程度大、曲线陡;芯壁比与搅拌时间之间及CaCl2质量分数与搅拌时间之间的交互作用对包埋率的影响显著,等高线图表现为椭圆形,弯曲程度相对较小,坡度相对较缓。
2.5 验证实验
利用Design-Expert 8.0.6分析软件求得PWP制备苦荞黄酮微胶囊的最佳工艺参数为芯壁比1∶9.24(g/g)、CaCl2质量分数1.43%、搅拌时间52.23 min,得苦荞黄酮微胶囊包埋率为92.964 8%。实际操作时,根据所得最佳工艺参数进行3 次平行验证实验,测得实际微胶囊包埋率为92.85%,同预测值的误差为0.12%。实际值与预测值接近,说明该响应面所得最佳工艺参数稳定可靠。
2.6 苦荞黄酮微胶囊理化性质分析
2.6.1 微胶囊包埋率、载药量及水分含量的测定
使用PWP作为壁材料微胶囊化苦荞黄酮,其包埋率高达92.85%,载药量为9.29%,水分质量分数为7.10%。研究发现,微胶囊高包埋率可归因于钙诱导的PWP的紧密网络以及苦荞黄酮和暴露的乳清蛋白的疏水部分之间的强疏水相互作用[24]。研究表明,美国成年人黄酮摄入量为344.83 mg/d,爱尔兰和英国成年人黄酮的平均摄入量分别为177 mg/d和182 mg/d,而我国人均黄酮摄入量尚未见报道[26]。张楠楠等[27]对天津市糖尿病患者黄酮摄入量调查发现,男性黄酮摄入量为38.23 mg/d,女性为38.27 mg/d;郜明明等[26]调查发现盐城市青春期女性黄酮摄入量为57.09 mg/d;高蔚娜等[28]报道了天津和杭州两地55~82 岁成年人类黄酮摄入量分别为67.21 mg/d和96.34 mg/d,由此,每日摄入2 g该苦荞黄酮微胶囊产品即可有针对性的显著提高我国部分人群的黄酮摄入水平。将该微胶囊产品添加入食品中,还可作为辅料生产功能性食品,供人们日常食用。
2.6.2 微胶囊形态分析

图5 苦荞黄酮微胶囊形态分析
Fig. 5 Morphological analysis of tartary buckwheat flavonoid microcapsules
按照最佳工艺制备的苦荞黄酮微胶囊,呈现为圆整的球形状态,粒径分布比较集中,平均粒径为(1 708.67±309.32)μm。由图5a可以看出,微胶囊的形态良好,大小均一,乳白色,具有淡淡的乳香味,无不良感官性状,符合微胶囊制备要求。由图5b、c可知,其表面均匀疏松多孔,分析原因可能是游离的苦荞黄酮与PWP溶液混合,PWP具有成膜性,当冷冻干燥去除水分时,钙离子-PWP微粒表面及内部的水分均匀散失,进而形成许多细小的孔洞,另有报道,其与PWP的浓度较高也有关[29]。
2.6.3 苦荞黄酮微胶囊的红外光谱分析

图6 PWP微胶囊及其单体成分的红外图谱
Fig. 6 Infrared spectra of free and microencapsulated tartary buckwheat flavonoids and PWP
红外吸收光谱为振动-转动光谱。每个官能团都有几种振动形式,在红外区相应产生几个吸收峰,光谱复杂,特征性强。除了极个别化合物外,每个化合物都有其特征红外光谱,因而红外光谱是定性鉴别的有效手段[30]。由图6A可知,由于苦荞黄酮结合的糖上—OH的存在及黄酮自身含有许多酚羟基,在3 439.86 cm-1处有—OH缔合而成的宽而强的特征峰,在2 930.18、1 399.63 cm-1处有较强的—CH2和—CH3伸缩振动,说明饱和碳上存在的氢较多,在1 645.20 cm-1处为C=C的伸缩振动,1 160.74 cm-1处为羟基的弯曲振动,1 073.46 cm-1和1 013.65 cm-1处分别出现了C—O—C反对称及对称的伸缩振动峰。根据图6B红外光谱分析可得,同图6A相比,保留了苦荞黄酮的特征峰,只是在3 407.22、2 940.79 cm-1处的吸收峰强度减弱;1 073.46 cm-1和1 013.65 cm-1处C—O—C反对称及对称的伸缩振动峰消失。这是由于游离苦荞黄酮进入PWP空腔后,导致振动受限所引起的。如图6C所示,其主要特征峰有3 419.09 cm-1处的反对称伸缩振动,2 978.40、1 537.93 cm-1和1 156.29 cm-1处的对称伸缩引起的强度较弱的窄峰,以及弯曲振动引起的,在1 406.31 cm-1处的一个特征峰。分析图6可得,PWP苦荞黄酮微胶囊红外图谱中并未出现芯材与壁材中没有的特征吸收峰,即在包埋过程中并未生成其他的化学键,仅为芯材与壁材间的静电相互作用,而非化学反应。Kakran等[31]对槲皮素的包埋也有相似的结果。
2.6.4 DSC分析

图7 DSC分析图
Fig. 7 Differential scanning calorimetric analysis
DSC曲线分析可直观地显示样品相转变的起始温度及热分解温度。在实际生活和生产中,产品的贮藏温度必须低于玻璃态转变温度[32]。由图7可知,PWP囊壁及其苦荞黄酮微胶囊的玻璃态转变温度分别为139.61 ℃和152.06 ℃,热分解温度分别为140.04 ℃和153.52 ℃。即在室温下PWP苦荞黄酮微胶囊可保持在稳定的玻璃态,微胶囊分子表现为低流性,产品不会发生形态结构的变化,产品囊壁的通透性较小,可有效保证芯材的性质稳定,防止营养流失。同时有利于产品的保藏,延长保质期,提高产品品质。
2.6.5 模拟体外胃肠道消化缓释实验
对人体内黄酮类化合物代谢的研究发现,黄酮类化合物主要由大量肠道菌代谢,发生生物转化,代谢产物经吸收进入人体血液循环[33]。因此应保护微胶囊化的苦荞黄酮免受胃液的影响,并在肠道中释放,被人体充分吸收。设计苦荞黄酮微胶囊体外模拟胃肠道消化时间为10 h(胃排空时间4 h、小肠排空时间6 h)。由图8可知,在模拟体外胃液消化的4 h中,苦荞黄酮释放率随时间的延长而缓慢增大,最终在胃液中的释放率仅为15.75%,释放较少;当苦荞黄酮微胶囊产品处于模拟体外小肠液中时,仅在1 h内释放率就上升了50.24%(P<0.01),并在小肠液中4 h内快速释放(P<0.01),5~6 h趋于平缓(P>0.05)并释放完全。以上表明在模拟体外胃肠液消化4 h后,微胶囊囊壁逐渐降解,限制芯材释放速率的障碍逐渐消失,向外扩散速率增大,最终在小肠内全部释放。综上,PWP作为苦荞黄酮微胶囊的壁材,可有效保护苦荞黄酮的生物活性,满足苦荞黄酮微胶囊所应具备的特性,切实提高苦荞黄酮在人体中的利用率。
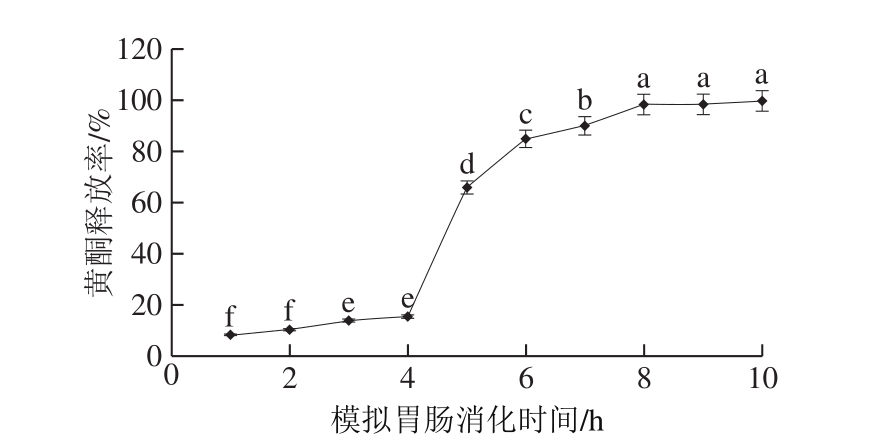
图8 PWP基苦荞黄酮微胶囊模拟胃肠道消化缓释分析
Fig. 8 Sustained release performance of tartary buckwheat flavonoid microcapsules during simulated gastrointestinal digestion
3 结 论
利用锐孔-凝固浴法以热诱导的PWP作为唯一壁材,苦荞黄酮为芯材制备了苦荞黄酮微胶囊。在单因素试验基础上,采用响应面试验对制备工艺进行优化,得到最佳工艺参数为芯壁比1∶9.24(g/g)、CaCl2质量分数1.43%、搅拌时间52.23 min,微胶囊包埋率达到92.85%,载药量为9.29%,水分质量分数为7.10%。这与鲁晓翔等[15]以β-环糊精为壁材制备的黄酮微胶囊包埋率85.5%、载药量5.7%相比,PWP对黄酮的包埋率和载药量均得到显著提高。由PWP为壁材制备的苦荞黄酮微胶囊产品呈圆整的球形状态,形态良好,大小均一,乳白色,具有淡乳香味,无不良感官性状。扫描电镜结果显示微胶囊表面疏松多孔且分布均匀。红外光谱分析表明,苦荞黄酮可被热诱导的PWP有效包埋,且芯材与壁材间不发生化学反应,保证了苦荞黄酮的天然性与完整性。苦荞黄酮微胶囊具有良好的热性质,其玻璃态转变温度为152.06 ℃,高于常温,可在常温贮藏使用。使用PWP作为微胶囊化的壁材料可有效保护苦荞黄酮免受胃液的破坏并在肠道中完全释放。实验表明热诱导的PWP可以作为苦荞黄酮壁材使用,所得苦荞黄酮微胶囊成球性较好,具有良好的缓释性及定向释放性,切实提高了人体对黄酮的利用率;乳清蛋白作为干酪加工过程中的副产物,生物效价高,是一种优质的蛋白质来源,对其进行热诱导用于微胶囊的制备,降低成本、解决环境污染问题的同时,赋予了产品更高的营养价值,因此,PWP有作为新型食品微胶囊壁材的极佳潜质。
[1] KAMALAKKANNAN N, PRINCE P S M. Antihyperglycaemic and antioxidant effect of rutin, a polyphenolic flavonoid, in streptozotocin-induced diabetic wistar rats[J]. Basic & Clinical Pharmacology & Toxicology, 2006,98(1): 97-103. DOI:10.1111/j.1742-7843.2006.pto_241.x.
[2] WATANABE M. Effects of buckwheat sprouts on plasma and hepatic parameters in type 2 diabetic db/db mice[J]. Journal of Food Science,2010, 75(9): H294-H299. DOI:10.1111/j.1750-3841.2010.01853.x.
[3] WIESLANDER G, FABJAN N, VOGRINCIC M, et al. Eating buckwheat cookies is associated with the reduction in serum levels of myeloperoxidase and cholesterol: a double blind crossover study in day-care centre staffs[J]. Tohoku Journal of Experimental Medicine,2011, 225(2): 123-130. DOI:10.1620/tjem.225.123.
[4] IRITI M, KUBINA R, COCHIS A, et al. Rutin, a quercetin glycoside,restores chemosensitivity in human breast cancer cells[J]. Phytotherapy Research, 2017, 31(10): 1529-1538. DOI:10.1002/ptr.5878.
[5] ZHANG P, SUN S, LI N, et al. Rutin increases the cytotoxicity of temozolomide in glioblastoma via autophagy inhibition[J]. Journal of Neuro-Oncology, 2017, 132(3): 393-400. DOI:10.1007/s11060-017-2387-y.
[6] ANNAPUMA A, REDDY C S, AKONDI R B, et al. Cardioprotective actions of two bioflavonoids, quercetin and rutin, in experimental myocardial infarction in both normal and streptozotocin-induced type I diabetic rats[J]. Journal of Pharmacy and Pharmacology, 2009, 61(10):1365-1374. DOI:10.1211/jpp/61.10.0014.
[7] THABET N M, MOUSTAFA E M. Protective effect of rutin against brain injury induced by acrylamide or gamma radiation: role of PI3K/AKT/GSK-3β/NRF-2 signalling pathway[J]. Archives of Physiology &Biochemistry, 2017, 124(2): 185-193. DOI:10.1080/13813455.2017.1 374978.
[8] HUBBARD G P, WOLFFRAM S, LOVEGROVE J A, et al. Ingestion of quercetin inhibits platelet aggregation and essential components of the collagen-stimulated platelet activation pathway in humans[J].Journal of Thrombosis and Haemostasis, 2004, 2(12): 2138-2145.DOI:10.1111/j.1538-7836.2004.01067.x.
[9] MERT D G, TURGUT N H, ARSLANBAS E, et al. The influence of quercetin on recognition memory and brain oxidative damage in a ketamine model of schizophrenia[J]. Psychiatry and Clinical Psychopharmacology, 2019, 29(1): 1-7. DOI:10.1080/24750573.2018.1442670.
[10] WEN L R, JIANG Y M, YANG J L, et al. Structure, bioactivity, and synthesis of methylated flavonoids[J]. Annals of the New York Academy of Sciences, 2017, 1398(1): 120-129. DOI:10.1111/nyas.13350.
[11] 廖霞, 杨小兰, 李瑶, 等. 槲皮素微胶囊的贮藏稳定性及抗氧化活性[J]. 食品科学, 2017, 38(1): 60-66. DOI:10.7506/spkx1002-6630-201701010.
[12] WU Z S, ZHAO Y F, KALEEM I, et al. Preparation of calciumalginate microcapsuled microbial fertilizer coating Klebsiella oxytoca Rs-5 and its performance under salinity stress[J]. European Journal of Soil Biology, 2011, 47(2): 152-159. DOI:10.1016/j.ejsobi.2010.11.008.
[13] SOLANKI H K, PAWAR D D, SHAH D A, et al. Development of microencapsulation delivery system for long-term preservation of probiotics as biotherapeutics agent[J]. BioMed Research International,2013(5): 1-21. DOI:10.1155/2013/620719.
[14] DIAS M I, FERREIRA I C F R, BARREIRO M F. Microencapsulation of bioactives for food applications[J]. Food & Function, 2015, 6(4):1035-1052. DOI:10.1039/c4fo01175a.
[15] 鲁晓翔, 陈甲, 连喜军, 等. 玉米须黄酮微胶囊制备条件的研究[J]. 食品科学, 2007, 28(9): 132-136. DOI:10.3321/j.issn:1002-6630.2007.09.027.
[16] 潘明, 王世宽, 郭脉玺, 等. 鼠曲草黄酮类物质微胶囊化研究[J]. 食品科学, 2009, 30(12): 94-97. DOI:10.3321/j.issn:1002-6630.2009.12.016.
[17] DIANAWATI D, MISHRA V, SHAH N P. Survival of bifidobacterium longum 1941 microencapsulated with proteins and sugars after freezing and freeze drying[J]. Food Research International,2013, 51(2): 503-509. DOI:10.1016/j.foodres.2013.01.022.
[18] GUNASEKARAN S, KO S, XIAO L. Use of whey proteins for encapsulation and controlled delivery applications[J].Journal of Food Engineering, 2007, 83(1): 31-40. DOI:10.1016/j.jfoodeng.2006.11.001.
[19] ERATTE D, DOWLING K, BARROW C J, et al. In-vitro, digestion of probiotic bacteria and omega-3 oil co-microencapsulated in whey protein isolate-gum Arabic complex coacervates[J]. Food Chemistry,2017, 227: 129-136. DOI:10.1016/j.foodchem.2017.01.080.
[20] ZHANG Y G, WANG Q C, YU H, et al. Evaluation of alginate-whey protein microcapsules for intestinal delivery of lipophilic compounds in pigs[J]. Journal of the Science of Food and Agriculture, 2016, 96(8):2674-2681. DOI:10.1002/jsfa.7385.
[21] 李欣, 王步军. 两种苦荞黄酮提取方法的优化及含量测定[J]. 食品科学, 2010, 31(6): 80-85.
[22] 蒋姗姗. 乳清浓缩蛋白的热聚合改性及其在凝固型酸奶中应用的研究[D]. 哈尔滨: 东北农业大学, 2017: 18-33.
[23] 潘明, 王世宽, 郭脉玺, 等. 鼠曲草黄酮类物质微胶囊化研究[J]. 食品科学, 2009, 30(12): 94-97. DOI:10.3321/j.issn:1002-6630.2009.12.016.
[24] WANG M, GAO F, ZHENG H, et al. Microencapsulation of ginsenosides using polymerised whey protein (PWP) as wall material and its application in probiotic fermented milk[J]. International Journal of Food Science &Technology, 2017, 52(4): 1009-1017. DOI:10.1111/ijfs.13365.
[25] 陈龙. 水酶法提取核桃油及其微胶囊的制备研究[D]. 贵阳: 贵州大学, 2015: 32-37.
[26] 郜明明, 吴康, 陆金凤, 等. 盐城市青春期女学生膳食黄酮及黄酮醇摄入量调查[J]. 职业与健康, 2018, 34(18): 2530-2532.
[27] 张楠楠, 郜鹏云, 高蔚娜, 等. 天津市糖尿病人群夏季膳食营养状况及类黄酮摄入量调查与评价[J]. 中国食物与营养, 2015, 21(2):80-83. DOI:10.3969/j.issn.1006-9577.2015.02.021.
[28] 高蔚娜, 蒲玲玲, 韦京豫, 等. 天津和杭州两地55~82 岁成年人类黄酮摄入量调查[J]. 中国食物与营养, 2016, 22(4): 74-77.DOI:10.3969/j.issn.1006-9577.2016.04.018.
[29] LEE S J, ROSENBERG M. Preparation and properties of glutaraldehyde cross-linked whey protein-based microcapsules containing theophylline[J]. Journal of Controlled Release, 1999,61(1/2): 123-136. DOI:10.1016/s0168-3659(99)00108-x.
[30] 杜雲. 傅里叶变换红外光谱仪高速采样系统的研究[D]. 合肥: 合肥工业大学, 2017: 6-14.
[31] KAKRAN M, SAHOO N G, LI L. Dissolution enhancement of quercetin through nanofabrication, complexation, and solid dispersion[J].Colloids & Surfaces B Biointerfaces, 2011, 88(1): 121-130.DOI:10.1016/j.colsurfb.2011.06.020.
[32] 李柯宏. 微胶囊化鱼油的制备及其在奶糖中的应用研究和工厂设计[D]. 南昌: 南昌大学, 2018: 15-16.
[33] JAGANATH I B, MULLEN W, EDWARDS C A, et al. The relative contribution of the small and large intestine to the absorption and metabolism of rutin in man[J]. Free Radical Research, 2006, 40(10):1035-1046. DOI:10.1080/10715760600771400.