胡萝卜因富含类胡萝卜素等营养成分,素有“小人参”之称,是春冬季的主要蔬菜之一[1]。据联合国粮农组织统计,2017年我国胡萝卜和萝卜总收获面积达41万 公顷,总产量达2 037万 t,分别占全球总收获面积和总产量的35%和48%,稳居全球第一。由于其季节性生产,为延长货架期、提高附加值,以及解决滞销所产生的资源浪费问题和脱水果蔬市场需求[2],大量胡萝卜被制成脱水干制品。当前,我国胡萝卜干燥方式以热风干燥为主,其设备成本低、操作简单[3],但易造成产品内外部品质参差不齐,影响经济效益。因此,需要开展对胡萝卜片干燥效果的检测。水分和类胡萝卜素含量作为评判胡萝卜干燥效果的重要指标,直接关联产品的营养特性和市场价值[3-4]。两者的常规检测方法分别为105 ℃烘箱干燥法[5]和分光光度法[6-7]。常规检测虽然在精确度和稳定性方面具有优势,但是耗时耗力,具有破坏性,只适用于抽检,无法实现对干燥全程的动态监测。因此需要寻找一种快速无损且适用于批量检测的方法。这对于提升胡萝卜干制品品质、促进胡萝卜干燥产业发展具有重要意义。
高光谱成像技术融合了光谱技术与机器视觉技术的优势,可以同时获取样品图像和光谱信息,从而实现对样品内外部品质的定性、定量分析和可视化表达[8]。目前国内外关于农产品干燥过程品质的高光谱无损检测研究多集中在水分含量和表观等方面。Nguyen-Do-Trong等[9]使用高光谱成像技术(400~1 000 nm)预测香蕉片热风干燥过程中水分含量、颜色和纹理变化,发现水分含量和b*值的偏最小二乘(partial least squares,PLS)预测模型效果好。Moscetti[10]和Amjad[11]等分别验证了基于高光谱成像技术(500~1 000 nm)预测马铃薯热风干燥过程中水分含量和颜色变化的可行性,发现基于特征波长建立的水分含量PLS预测模型效果好。此外,基于高光谱技术的苹果片[12]、大豆[13]、牛肉[14]、草鱼片[15]等干燥过程中水分含量的无损预测可行性也有相关验证。上述研究都是基于可见-近红外波段(400~1 000 nm),而Pu Yuanyuan等[16-17]使用短波红外高光谱成像技术(950~1 650 nm)建立了香蕉片微波真空干燥过程中水分含量和硬度变化的支持向量机(support vector machine,SVM)预测模型,并且建立了芒果片不同干燥方法干燥过程中水分分布的可视化模型。以上研究均表明了基于高光谱成像技术检测农产品干燥过程中水分含量的可行性。但是,产品干燥过程内部营养品质参数(如类胡萝卜素)的高光谱检测相关研究报道很少。
综上,本实验以不同干燥时长的胡萝卜片为研究对象,利用高光谱成像系统采集400~1 000 nm和1 000~2 200 nm波长范围光谱信息,基于PLS和SVM算法建立水分和类胡萝卜素含量的全波长范围和特征波长预测模型,并实现水分和类胡萝卜素含量空间分布的可视化,为后续在线检测的建立提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
新鲜胡萝卜购自江苏省南京市苏果超市。同一批次实验挑选大小均匀、无损伤的60 根胡萝卜,每根质量约150 g。
β-胡萝卜素标准品 上海源叶生物科技有限公司;2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)(分析纯) 上海麦克林生化科技有限公司;正己烷、乙醇(均为分析纯) 广东光华科技股份有限公司;丙酮(分析纯) 上海凌峰化学试剂有限公司。
1.2 仪器与设备
UV1800紫外-可见分光光度计 日本岛津公司;DHG-9070A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;冷冻粉碎机 德国IKA公司;振荡培养箱常州国华电器有限公司;3K15冷冻离心机 德国Sigma公司;高光谱成像系统:ImSpector V10E成像光谱仪(可见-近红外)、ImSpector N25E成像光谱仪(短波红外)芬兰Specim公司;ICLB1620CCD摄像机(可见-近红外)美国Imperx公司;Raptor EM285CL摄像机(短波红外)英国Raptor Photonics公司;IT3900ER 150W卤素光源美国Illumination Technologies公司;IRCP0076-ICOMB001移动平台、Spectra Image取像软件、HIS Analyzer分析软件台湾五铃光学股份有限公司。
1.3 方法
1.3.1 胡萝卜片的干燥处理
将胡萝卜洗净后,用切片机切成直径(36±3)mm,厚5 mm的切片。将胡萝卜片置于干燥箱中75 ℃热风干燥。经预实验发现,较其他干燥温度,75 ℃热风干燥后样品类胡萝卜素损失最少,干燥时间和能耗较低。取样点设计为0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7 h,共计15 个。每个取样点取40 片干燥样品,其中20 片用于水分含量预测实验,另20 片用于类胡萝卜素含量预测实验,实验样本共计600 片。每片胡萝卜片干燥前后称质量。
1.3.2 高光谱信息的采集
采用线扫描模式采集高光谱反射图像。为获得清晰且不失真图像,相机镜头和光源分别距样本30.0 cm和28.0 cm。两个光源分别固定于样品斜上方,调节光源角度,使光束在样本中心交叉,以减少阴影面积[18]。可见-近红外高光谱成像系统的有效范围为400~1 000 nm之间的420 个波长,光谱分辨率为2.8 nm。设置光源强度90 W、曝光时间2 ms、平台移动速率4.91 mm/s。短波红外高光谱成像系统的有效范围为1 000~2 200 nm之间的175 个波长,光谱分辨率为6.2 nm。设置光源强度255 W、曝光时间2.5 ms、平台移动速率13.78 mm/s。
为消除光源强度不均和相机暗电流噪声等对光谱信息的影响,需要在实验参数设置完成后进行黑白板校正。将聚四氟乙烯标准校正白板(反射率为99%)放置于样品处采集全白反射图像,盖上相机镜头盖采集全黑反射图像,计算得校正后的相对反射图像[19]。高光谱图像校正公式如下:
式中:R为校正后相对反射图像;R0为原始反射图像;B为全黑反射图像;W为全白反射图像。
1.3.3 水分和类胡萝卜素含量的测定
水分含量的测定参考GB 5009.3—2016《食品中水分的测定》直接干燥法[20]。
类胡萝卜素含量的测定参考文献[7]并进行改进。将胡萝卜片经液氮冷冻后研磨制粉,称取2 g(精确至0.001 g)与加入0.1% BHT的20 mL正己烷-丙酮-乙醇(2∶1∶1,V/V)溶剂混合并置于振荡培养箱振荡20 min,向混合物中加入6 mL超纯水后继续振荡10 min,1 500 r/min离心5 min以将有机层与水层分离。收集有机层,使用分光光度计在450 nm波长处测得吸光度,含0.1% BHT的正己烷作为空白对照。根据标准曲线计算类胡萝卜素含量。单次实验重复3 次,取平均值进行分析。
1.4 数据处理
1.4.1 光谱数据的提取
使用Matlab R2010b软件进行光谱数据的提取和分析。以全胡萝卜片为分析对象,分别选用样本689 nm和1 494 nm波长处的灰度图像为掩膜特征图像进行阈值分割和背景去除,因为在该波长下图像中样本和背景区域的光谱值相差最大[21-22]。统计样本图像像素点个数和光谱值总和,提取每个胡萝卜片的平均光谱值,经归一化计算得相对反射率用于后续数据处理和分析。
1.4.2 光谱预处理
为消除由机器运行和环境变化带来的基线漂移、高频噪声、光散射等对光谱信息的影响,需要进行光谱预处理[23]。实验采用标准化Autoscale、一阶导数1-st、二阶导数2-nd、多元散射校正(multiplicative scatter correction,MSC)、变量标准化算法(standard normalized varite,SNV)5 种预处理方法,比较建模后的交互验证均方根误差(root mean square error of cross validation,RMSECV),最小RMSECV所对应的方法即为最优预处理方法。
1.4.3 模型的建立与评估
采用连续投影算法(successive projection algorithm,SPA)筛选特征波长后,基于PLS和SVM算法分别建立400~1 000 nm和1 000~2 200 nm全波长范围和特征波长下水分和类胡萝卜素含量预测模型,分别比较不同建模方法、波长范围和波长个数下模型的建模效果,选出水分和类胡萝卜素含量的最优预测模型。以预测集决定系数R2P、预测集均方根误差(root mean square error of prediction,RMSEP)及剩余预测残差(residual predictive deviation,RPD)作为建模效果评估指标。R2P越接近1,RMSEP越接近0,RPD>3,说明模型稳定性好,预测能力强[24-25]。
1.4.4 水分和类胡萝卜素含量的可视化
利用预测模型将图像样本区域各像素点的光谱值转化为水分或类胡萝卜素含量值,结合伪彩色数据处理,以颜色的变化表征各像素点含量的变化,从而建立水分和类胡萝卜素含量分布的伪彩色图像。
2 结果与分析
2.1 水分含量、类胡萝卜素含量及光谱值变化
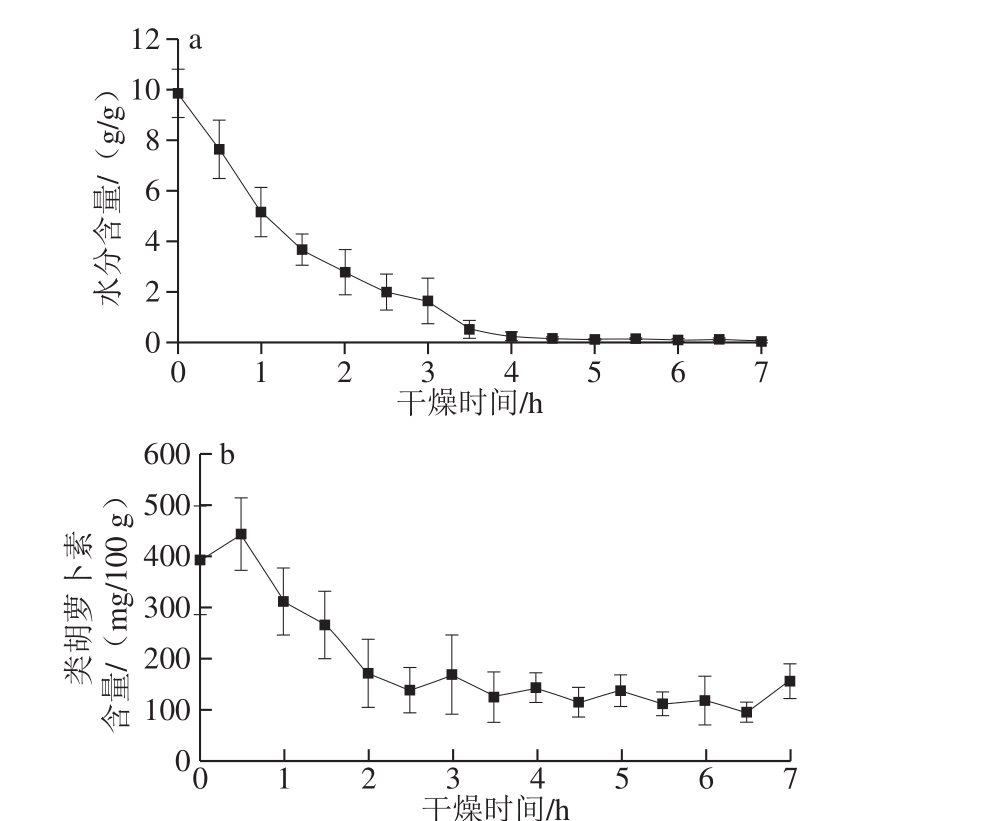
图1 胡萝卜片热风干燥过程中水分(a)和类胡萝卜素(b)含量变化趋势
Fig. 1 Changes in contents of moisture (a) and carotenoids (b) in carrot slices during hot air drying
如图1所示,随着干燥时间的延长,水分含量(以干基计算)在前4 h内快速下降,之后下降速度明显减缓,最终达到安全水分含量0.08 g/g以下[26]。而类胡萝卜素在光、热、氧等条件下易分解,因此其含量(以干基计算)在2.5 h之后不再明显减少,并受样本个体间差异的影响,在100~150 mg/100 g范围内波动。

图2 胡萝卜片热风干燥过程中400~1 000、1 000~2 200 nm波长范围相对反射率
Fig. 2 Relative ref l ectivity of carrot slices in the wavelength range of 400-1 000 nm and 1 000-2 200 nm during hot air drying
如图2所示,不同干燥时长胡萝卜片的平均光谱反射率的曲线变化具有较高相似性。由于2 个波长范围的信息采集分别使用不同高光谱设备,受设备差异和机器噪声影响,光谱反射率在1 000 nm波长处未能较好地衔接,因此两个波长范围的模型需要分开建立。在400~1 000 nm,不同干燥时长胡萝卜片的平均光谱反射率分布较集中,无统一变化规律[27]。在1 200~2 000 nm,随着干燥时间的延长,反射率整体呈现逐渐升高的变化趋势,与文献[11]和[16]结论较一致。较高的水分含量表示存在更多O—H键吸收能量。吸收能量增多,反射能量就会相对减少,从而表现为较低的反射率[11]。500 nm波长处的吸收谷与和胡萝卜颜色变化相关的类胡萝卜素有关。730 nm和970 nm附近的吸收谷来源于O—H的伸缩振动,与水分子的结构有关[28]。1 225 nm附近的吸收谷来源于C—H的伸缩振动,与类胡萝卜素的结构有关,1 450 nm附近的吸收谷来源于O—H的伸缩振动,与水分子的结构有关[29]。文献[16]在研究香蕉片干燥过程光谱变化时同样发现在约970 nm和1 450 nm波长处存在一些宽吸收谷,并认为与水的O—H键相关。
2.2 光谱预处理
2.2.1 样本集的划分
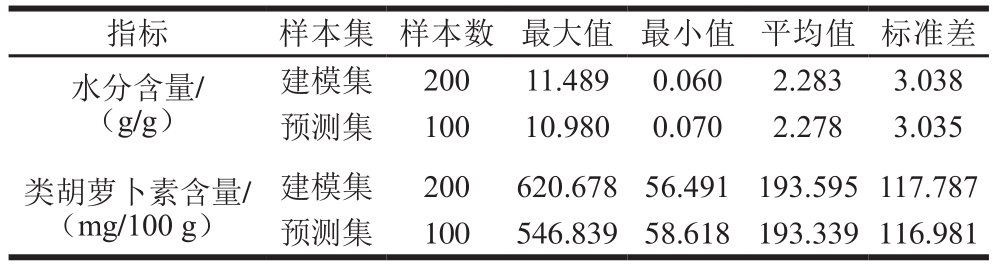
根据含量梯度法[30],分别将用于建立水分和类胡萝卜素含量预测模型的300 个样本以2∶1的比例进行建模集和预测集的划分。样本划分统计结果见表1。样本建模集范围均包含了预测集范围,且平均值和标准差较相近,表明样本的划分具有合理性。
表1 胡萝卜片水分和类胡萝卜素含量样本划分统计结果
Table 1 Statistics of moisture and carotenoid contents in carrot slices
images/BZ_297_1276_599_2252_646.png建模集 200 11.489 0.060 2.283 3.038预测集 100 10.980 0.070 2.278 3.035类胡萝卜素含量/(mg/100 g)水分含量/(g/g)建模集 200 620.678 56.491 193.595 117.787预测集 100 546.839 58.618 193.339 116.981
2.2.2 预处理方法的选择
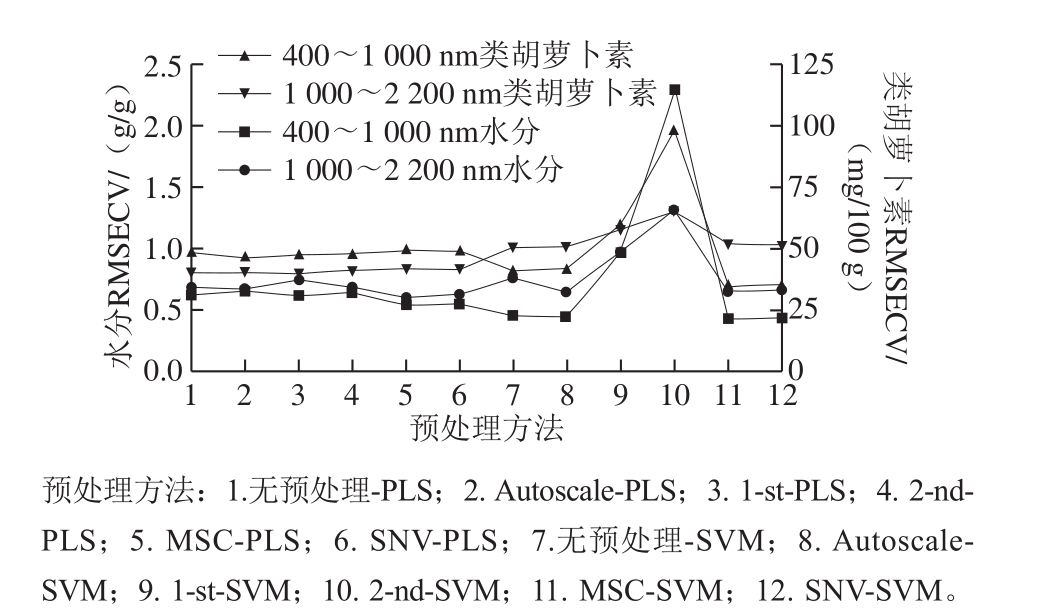
图3 光谱经不同预处理方法处理后水分和类胡萝卜素含量建模效果比较
Fig. 3 Comparison of predictive models for moisture and carotenoid contents established using different pretreatment methods
从图3可以看出,基于PLS和SVM算法建立的400~1 000 nm和1 000~2 200 nm波长范围共4 组水分含量预测模型中,均是经过MSC处理后的模型RMSECV最小,即MSC为最优预处理方法。这一结论与文献[31]一致。MSC的实质是建立一条“理想光谱”用以修正各样本光谱间的基线漂移,使光谱与样本成分变化满足直接线性关系。因此,MSC不仅能消除样本产生的散射影响,还可以强化与目标成分相关的光谱信息[32]。但是,Moscetti等[10]发现将MSC用于马铃薯的水分含量PLS预测模型反而会减低模型的预测精度。结合本实验结果,可以看出最优预处理方法的选择受样本类型的影响。
类胡萝卜素含量预测模型没有统一的最优预处理方法。在400~1 000 nm,经MSC-SVM处理的模型RMSECV为两组中最小,即MSC-SVM是400~1 000 nm类胡萝卜素含量预测模型的相对最优预处理方法。文献[31]研究发现,400~1 000 nm范围内紫薯干燥过程花青素含量预测模型的最优预处理方法同样是MSCSVM。但是,本实验中经MSC-PLS处理的模型RMSECV值是PLS这一组中最大的。由此可见,最优预处理方法的选择受到建模算法的影响。而在1 000~2 200 nm,只有经1st-PLS处理能降低模型的RMSECV,因此,1st-PLS是1 000~2 200 nm类胡萝卜素含量预测模型的最优预处理方法。从1 000~2 200 nm水分和类胡萝卜素含量预测模型不同的最优预处理方法可以看出,预处理方法的选择受到检测指标的影响。而从不同波长范围的类胡萝卜素含量预测模型对应不同最优预处理方法,还可以看出预处理方法的选择也受实验条件的影响。综上,虽然关于预处理方法的研究报道很多,但是从样本及检测指标的确定、实验条件的设置到建模算法的应用都会影响预处理方法的处理效果。因此,每一项新的建模实验都有进行预处理方法选择的必要,特别是大数据量的高光谱检测。
2.3 特征波长的提取
由于高光谱数据中相邻波长的光谱信息存在高度相关性,会阻碍后续模型建立效率,因此,本实验采用SPA减少冗余信息及简化模型[33]。表2列出了基于SPA提取的水分和类胡萝卜素特征波长。水分的特征波长中,929 nm接近于水的弱吸收谷点910 nm;1 131 nm接近于1 150 nm,与水的O—H的倍频相关;1 334、1 428 nm和1 479 nm位于水分强吸收带1 360~1 470 nm附近[34]。类胡萝卜素的特征波长中,416、419、450、570 nm和610 nm分别位于类胡萝卜素的强吸收带425~490 nm和次强吸收带490~600 nm附近[34]。其中450 nm代表的蓝色是胡萝卜自身黄色的互补色[35],而胡萝卜的颜色受类胡萝卜素含量的影响。近红外波段的特征波长与类胡萝卜素的结构相关,其中938 nm与—CH2结构相关;1 039 nm和1 085 nm接近于1 053 nm,同样和—CH2结构相关;1 145 nm接近于1 152 nm,与—CH3结构相关;1 220 nm接近于1 225 nm,与C—H结构相关;1 421 nm接近于1 415 nm,与—CH2结构相关;2 130 nm和2 149 nm接近于2 140 nm,与HC=CH结构相关[34]。
表2 基于SPA提取的水分和类胡萝卜素特征波长
Table 2 Characteristic wavelengths for moisture and carotenoid contents extracted using SPA

指标 波长范围/nm特征波长个数 特征波长/nm水分含量400~1 000 10 403、416、431、438、507、563、609、671、805、929 1 000~2 200 11 1 039、1 085、1 131、1 179、1 334、1 428、1 479、1 744、2 137、2 162、2 174类胡萝卜素含量400~1 000 12 401、403、408、416、419、450、570、610、698、805、938、972 1 000~2 200 11 1039、1 085、1 145、1 220、1 334、1 421、1 494、1 809、1 880、2 130、2 149
2.4 模型的建立与评估
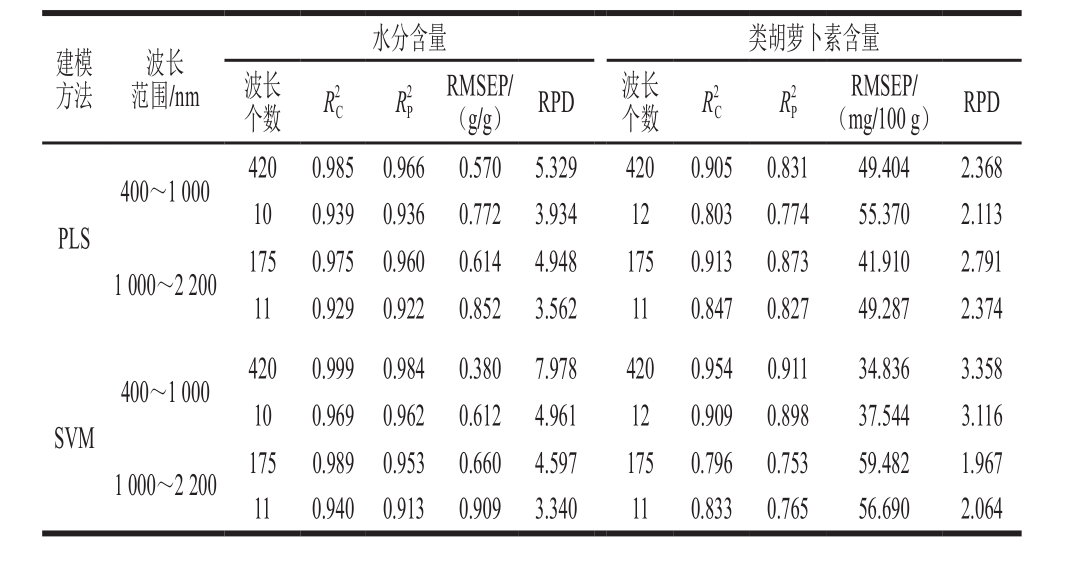
本实验基于PLS和SVM算法分别建立了水分和类胡萝卜素含量的全波长和特征波长预测模型,模型预测效果见表3。从建模方法看,400~1 000 nm水分和类胡萝卜素含量预测模型预测效果均为SVM模型优于PLS,而1 000~2 200 nm波长范围PLS模型优于SVM。从波长范围看,水分含量预测模型中,400~1 000 nm波长范围模型预测效果均优于1 000~2 200 nm,而类胡萝卜素含量预测模型中,400~1 000 nm波长范围SVM模型预测效果优于1 000~2 200 nm,PLS模型预测效果则相反。从波长个数看,1 000~2 200 nm类胡萝卜素含量SVM预测模型中,基于特征波长建模预测效果略优于基于全波长范围建模,但是其余均是基于全波长范围建模预测效果优于基于特征波长建模,说明SPA在减少冗余信息的同时可能会剔除少量有效信息,从而影响模型准确度。综上所述,水分和类胡萝卜素含量的最优预测模型均为基于400~1 000 nm全波长范围建立的SVM预测模型,模型R2P分别为0.984和0.911,RMSEP分别为0.380 g/g和34.836 mg/100 g 。文献[9]和[13]中香蕉片和大豆干燥过程水分含量预测模型R2P分别为0.97和0.971,文献[31]中紫薯干燥过程花青素含量预测模型R2P为0.881 7,文献[8]中菠菜贮藏过程类胡萝卜素含量预测模型R2P为0.889,本实验所建水分和类胡萝卜素含量预测模型R2P均接近甚至高于前人相似研究结果,证明了本实验较好的建模效果。虽然对应的基于特征波长建立的模型预测精度略低于基于全波长范围建模,但是模型的R2P仍能达到0.962和0.898,RMSEP分别为0.612 g/g和37.544 mg/100 g,且RPD均大于3,证明建模效果好。另外经SPA处理后只保留了不足3%的原始信息,可以极大提高模型的运算速度,因此更适用于实际生产。表 3 基于PLS和SVM算法的水分和类胡萝卜素含量全波长范围和特征波长预测模型
images/BZ_298_1299_2021_2278_2068.png建模方法波长范围/nm 波长个数 R2C R2P RMSEP/(g/g) RPD 波长个数 R2C R2P RMSEP/(mg/100 g) RPD PLS 400~1 000 420 0.985 0.966 0.570 5.329 420 0.905 0.831 49.404 2.368 10 0.939 0.936 0.772 3.934 12 0.803 0.774 55.370 2.113 1 000~2 200 175 0.975 0.960 0.614 4.948 175 0.913 0.873 41.910 2.791 11 0.929 0.922 0.852 3.562 11 0.847 0.827 49.287 2.374 SVM 400~1 000 420 0.999 0.984 0.380 7.978 420 0.954 0.911 34.836 3.358 10 0.969 0.962 0.612 4.961 12 0.909 0.898 37.544 3.116 1 000~2 200 175 0.989 0.953 0.660 4.597 175 0.796 0.753 59.482 1.967 11 0.940 0.913 0.909 3.340 11 0.833 0.765 56.690 2.064
Table 3 Prediction models with full-wavelength range and characteristic wavelengths for contents of moisture and carotenoid based on PLS and SVM algorithm
2.5 水分和类胡萝卜素含量的可视化
本实验基于水分和类胡萝卜素含量的最优预测模型进行两者空间分布的可视化,用红绿蓝色阶的变化表示胡萝卜片不同干燥阶段水分和类胡萝卜素含量的变化,红色表示含量最多,蓝色表示含量最少。从整体颜色变化来看,伪彩色图像可以清晰地展示水分和类胡萝卜素含量由多到少的变化趋势。水分的相对变化范围大于类胡萝卜素,与图像下方列出的水分和类胡萝卜素含量的实测值及括号内的预测值变化趋势一致。从个体颜色分布看,图4中前3 片胡萝卜片颜色分布较均匀,原因是热风干燥过程中,胡萝卜外圈韧皮部水分损失快于中心木质部[36]。这一现象在文献[5]中也有提及,原因是外圈部分与热空气接触的表面积大于中心部分。但是水分有从内向外的迁移过程,因此干燥初期胡萝卜片整体的水分损失较均匀。而第4~6片胡萝卜片颜色的不均匀分布主要因为随着干燥的进行,胡萝卜片表层失水出现板结,导致中心水分向外圈迁移速率逐渐变慢[37],从而出现中心水分含量高于外圈的现象。干燥末期,水分已损失殆尽,对应于图4中最后两幅整体呈现蓝色的胡萝卜片伪彩色图像。相较于图4中胡萝卜片的颜色分布从均匀到不均匀的变化过程,图5中胡萝卜片的颜色变化主要表现为蓝色部分由外圈向中心逐渐扩散。其原因是类胡萝卜素没有类似于水分的迁移过程,且受热易分解。因此受热风干燥由外向内传热过程的影响,类胡萝卜素也由外向内逐渐损失。
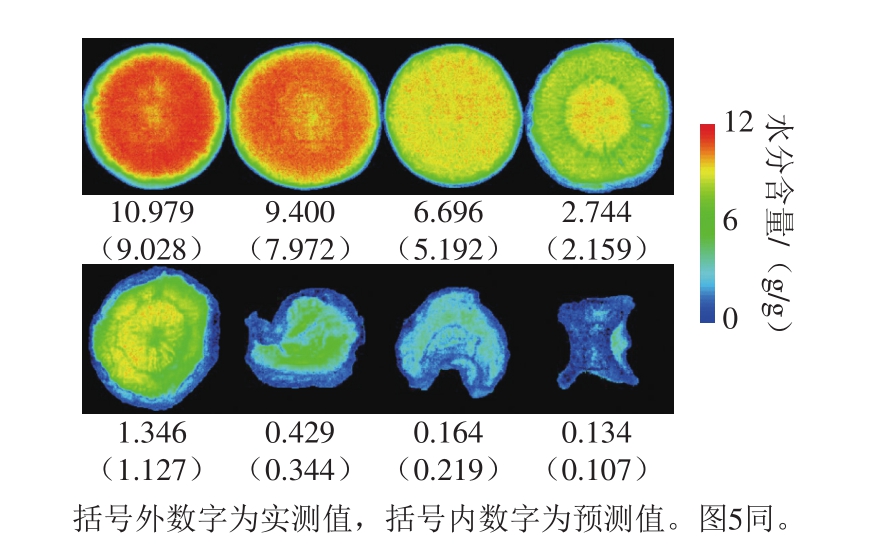
图4 基于400~1 000 nm全波长范围SVM预测模型的水分含量的可视化
Fig. 4 Visualization of moisture content with SVM prediction model based on full wavelength range from 400 to 1 000 nm
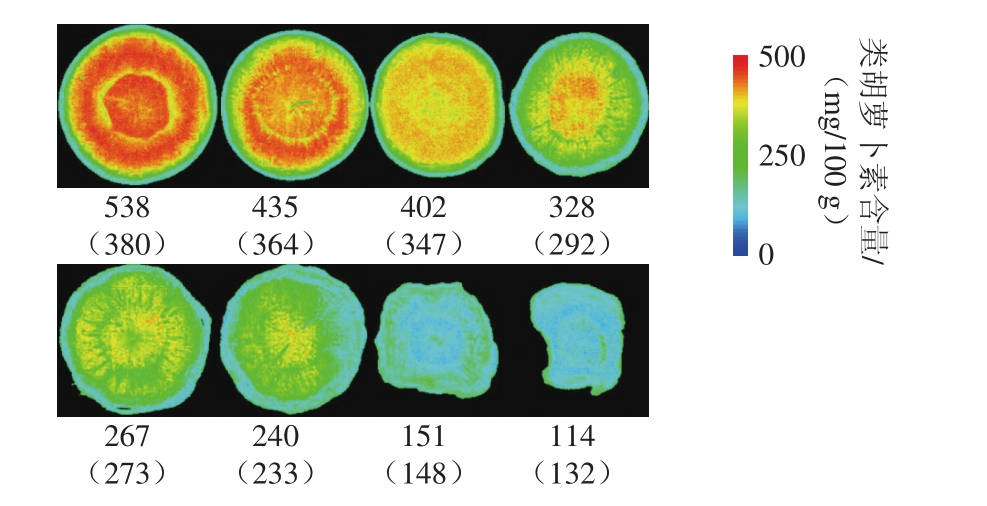
图5 基于400~1 000 nm全波长范围SVM预测模型的类胡萝卜素含量的可视化
Fig. 5 Visualization of carotenoid content with SVM prediction model based on full wavelength range from 400 to 1 000 nm
3 结 论
本实验以不同干燥时长的胡萝卜片为研究对象,利用高光谱成像系统采集400~1 000 nm和1 000~2 200 nm光谱信息,分别建立水分和类胡萝卜素含量预测模
型。对于水分含量预测模型的建立,MSC为最优预处理方法。基于SPA可分别提取400~1 000 nm的10 个和1 000~2 200 nm的11 个特征波长。对于类胡萝卜素含量预测模型的建立,MSC-SVM为400~1 000 nm波长范围最优预处理方法,而1st-PLS为1 000~2 200 nm波长范围最优预处理方法。基于SPA可分别提取400~1 000 nm的12 个和1 000~2 200 nm的11 个特征波长。通过比较不同波长范围和不同建模方法,发现水分和类胡萝卜素含量最优预测模型均是400~1 000 nm的MSC-SVM模型。基于全波长范围建立的预测模型R2P分别为0.984和0.911,RMSEP分别为0.380 g/g和34.836 mg/100 g;基于特征波长建立的预测模型R2P分别为0.962和0.898,RMSEP分别为0.612 g/g和37.544 mg/100 g。预测精度略低于基于全波长范围建模,但是模型RPD均大于3,证明建模效果非常好。综上所述,高光谱成像技术可以实现胡萝卜片干燥过程水分和类胡萝卜素含量的无损检测,为后续在线检测和胡萝卜片的干燥加工提供理论基础和技术支持。
[1] 陈瑞娟, 毕金峰, 陈芹芹, 等. 胡萝卜的营养功能、加工及其综合利用研究现状[J]. 食品与发酵工业, 2013, 39(10): 201-206.DOI:10.13995/j.cnki.11-1802/ts.2013.10.044.
[2] 石东岳. 胡萝卜红外薄层干燥机理研究及红外蔬菜干燥装备优化设计[D]. 淄博: 山东理工大学, 2017: 1-6.
[3] 种翠娟, 刘云宏, 朱文学, 等. 干燥温度及氧气含量对胡萝卜气调干燥特性的影响[J]. 食品科学, 2014, 35(32): 20-24. DOI:10.7506/spkx1002-6630-201423004.
[4] 王海鸥. 微波冷冻干燥中试设备及关键技术研究[D]. 南京: 南京农业大学, 2012: 11-13.
[5] LIU C H, LIU W, LU X Z, et al. Potential of multispectral imaging for real-time determination of colour change and moisture distribution in carrot slices during hot air dehydration[J]. Food Chemistry, 2016, 195:110-116. DOI:10.1016/j.foodchem.2015.04.145.
[6] BISWAS A K, SAHOO J, CHATLI M K. A simple UV-Vis spectrophotometric method for determination of β-carotene content in raw carrot, sweet potato and supplemented chicken meat nuggets[J].LWT-Food Science and Technology, 2011, 44(8): 1809-1813.DOI:10.1016/j.lwt.2011.03.017.
[7] PENG J, TANG J M, LUAN D L, et al. Microwave pasteurization of pre-packaged carrots[J]. Journal of Food Engineering, 2017, 202:56-64. DOI:10.1016/j.jfoodeng.2017.01.003.
[8] ZHANG C, WANG Q N, LIU F, et al. Rapid and non-destructive measurement of spinach pigments content during storage using hyperspectral imaging with chemometrics[J]. Measurement, 2017, 97:149-155. DOI:10.1016/j.measurement.2016.10.058.
[9] NGUYEN-DO-TRONG N, DUSABUMUREMYI J C, SAEYS W.Cross-polarized VNIR hyperspectral reflectance imaging for nondestructive quality evaluation of dried banana slices, drying process monitoring and control[J]. Journal of Food Engineering, 2018, 238:85-94. DOI:10.1016/j.jfoodeng.2018.06.013.
[10] MOSCETTI R, STURM B, CRICHTON S O J, et al. Postharvest monitoring of organic potato (cv. Anuschka) during hot-air drying using visible-NIR hyperspectral imaging[J]. Journal of the Science of Food and Agriculture, 2018, 98(7): 2507-2517. DOI:10.1002/jsfa.8737.
[11] AMJAD W, CRICHTON S O J, MUNIR A, et al. Hyperspectral imaging for the determination of potato slice moisture content and chromaticity during the convective hot air drying process[J].Biosystems Engineering, 2018, 166: 170-183. DOI:10.1016/j.biosystemseng.2017.12.001.
[12] CRICHTON S, SHRESTHA L, HURLBERT A, et al. Use of hyperspectral imaging for the prediction of moisture content and chromaticity of raw and pretreated apple slices during convection drying[J]. Drying Technology, 2018, 36(7): 804-816. DOI:10.1080/07 373937.2017.1356847.
[13] HUANG M, WANG Q G, ZHANG M, et al. Prediction of color and moisture content for vegetable soybean during drying using hyperspectral imaging technology[J]. Journal of Food Engineering,2014, 128: 24-30. DOI:10.1016/j.jfoodeng.2013.12.008.
[14] VON GERSDORFF G J E, PORLEY V E, RETZ S K, et al. Drying behavior and quality parameters of dried beef (biltong) subjected to different pre-treatments and maturation stages[J]. Drying Technology,2018, 36(1): 21-32. DOI:10.1080/07373937.2017.1295979.
[15] MA J, QU J H, SUN D W. Developing hyperspectral prediction model for investigating dehydrating and rehydrating mass changes of vacuum freeze dried grass carp fillets[J]. Food and Bioproducts Processing,2017, 104: 66-76. DOI:10.1016/j.fbp.2017.04.007.
[16] PU Y Y, ZHAO M, O’DONNELL C, et al. Nondestructive quality evaluation of banana slices during microwave vacuum drying using spectral and imaging techniques[J]. Drying Technology, 2018, 36(13):1542-1553. DOI:10.1080/07373937.2017.1415929.
[17] PU Y Y, SUN D W. Combined hot-air and microwave-vacuum drying for improving drying uniformity of mango slices based on hyperspectral imaging visualisation of moisture content distribution[J].Biosystems Engineering, 2017, 156: 108-119. DOI:10.1016/j.biosystemseng.2017.01.006.
[18] 胡鹏程, 孙晔, 吴海伦, 等. 高光谱图像对白萝卜糠心的无损检测[J].食品科学, 2015, 36(12): 171-176. DOI:10.7506/spkx1002-6630-201512032.
[19] TAKIZAWA K, NAKANO K, OHASHI S, et al. Development of nondestructive technique for detecting internal defects in Japanese radishes[J]. Journal of Food Engineering, 2014, 126: 43-47.DOI:10.1016/j.jfoodeng.2013.10.041.
[20] 国家卫生和计划生育委员会. 食品中水分的测定: GB 5009.3—2016[S]. 北京: 中国标准出版社, 2016.
[21] LIU Q, SUN K, PENG J, et al. Identification of bruise and fungi contamination in strawberries using hyperspectral imaging technology and multivariate analysis[J]. Food Analytical Methods, 2018, 11(5):1518-1527. DOI:10.1007/s12161-017-1136-3.
[22] 李瑞, 傅隆生. 基于高光谱图像的蓝莓糖度和硬度无损测量[J].农业工程学报, 2017, 33(增刊1): 362-366. DOI:10.11975/j.issn.1002-6819.2017.z1.054.
[23] 石吉勇, 吴胜斌, 邹小波, 等. 高光谱技术融合平板菌落法同步计数酸奶中益生菌[J]. 食品科学, 2018, 39(24): 102-107. DOI:10.7506/spkx1002-6630-201824016.
[24] 董金磊, 郭文川. 采后猕猴桃可溶性固形物含量的高光谱无损检测[J].食品科学, 2015, 36(16): 101-106. DOI:10.7506/spkx1002-6630-201516018.
[25] SAEYS W, MOUAZEN A M, RAMON H. Potential for onsite and online analysis of pig manure using visible and near infrared reflectance spectroscopy[J]. Biosystems Engineering, 2005, 91(4):393-402. DOI:10.1016/j.biosystemseng.2005.05.001.
[26] 农业部. 脱水蔬菜 根菜类: NY/T 959—2006[S]. 北京: 中国标准出版社, 2006.
[27] 于雷, 章涛, 朱亚星, 等. 基于IRIV算法优选大豆叶片高光谱特征波长变量估测SPAD值[J]. 农业工程学报, 2018, 34(16): 148-154.DOI:10.11975/j.issn.1002-6819.2018.16.019.
[28] YU K Q, ZHAO Y R, LIU Z Y, et al. Application of visible and nearinfrared hyperspectral imaging for detection of defective features in Loquat[J]. Food and Bioprocess Technology, 2014, 7(11): 3077-3087.DOI:10.1007/s11947-014-1357-z.
[29] 孙世鹏, 彭俊, 李瑞, 等. 基于近红外高光谱图像的冬枣损伤早期检测[J]. 食品科学, 2017, 38(2): 301-305. DOI:10.7506/spkx1002-6630-201702047.
[30] 吴静珠, 王一鸣, 张小超, 等. 近红外光谱分析中定标集样品挑选方法研究[J]. 农业机械学报, 2006, 37(4): 80-82; 101. DOI:10.3969/j.issn.1000-1298.2006.04.021.
[31] 孙悦. 基于高光谱成像技术的超声强化热风干燥紫薯的品质检测研究[D]. 洛阳: 河南科技大学, 2017: 29-37.
[32] 吴迪. 基于高光谱图像技术检测酿酒葡萄果皮中花色苷含量[D].杨凌: 西北农林科技大学, 2014: 12-13.
[33] 李晓丽, 魏玉震, 徐劼, 等. 基于高光谱成像的茶叶中EGCG分布可视化[J]. 农业工程学报, 2018, 34(7): 180-186. DOI:10.11975/j.issn.1002-6819.2018.07.023.
[34] 李民赞. 光谱分析技术及其应用[M]. 北京: 科学出版社, 2006:61-65; 176-178.
[35] 朱启兵, 冯朝丽, 黄敏, 等. 基于图像熵信息的玉米种子纯度高光谱图像识别[J]. 农业工程学报, 2012, 28(23): 271-276. DOI:10.3969/j.issn.1002-6819.2012.23.036.
[36] 徐建国, 徐刚, 张绪坤, 等. 利用核磁共振成像技术分析胡萝卜干燥过程中内部水分传递[J]. 农业工程学报, 2013, 29(12): 271-276.DOI:10.3969/j.issn.1002-6819.2013.12.034.
[37] 张绪坤, 祝树森, 黄俭花, 等. 用低场核磁分析胡萝卜切片干燥过程的内部水分变化[J]. 农业工程学报, 2012, 28(22): 282-287.DOI:10.3969/j.issn.1002-6819.2012.22.039.
 ) of 0.984 and 0.911, and root mean square error for prediction (RMSEP) of 0.380 g/g and 34.836 mg/100 g, respectively. The optimal models with the feature wavelengths selected by successive projections algorithm showed
) of 0.984 and 0.911, and root mean square error for prediction (RMSEP) of 0.380 g/g and 34.836 mg/100 g, respectively. The optimal models with the feature wavelengths selected by successive projections algorithm showed  of 0.962 and 0.898 and RMSEP of 0.612 g/g and 37.544 mg/100 g for MC and CC, respectively. The residual predictive deviation (RPD) in the new models was over 3,indicating good accuracy and stability. Moreover, the spatial distribution of moisture and carotenoid during the drying process were generated and visualized as pseudo-color images. The results indicated that the hyperspectral imaging could be used to effectively predict the MC and CC in carrot slices, demonstrating the potential of hyperspectral imaging as an analytical tool in quality control of carrot slices during drying.
of 0.962 and 0.898 and RMSEP of 0.612 g/g and 37.544 mg/100 g for MC and CC, respectively. The residual predictive deviation (RPD) in the new models was over 3,indicating good accuracy and stability. Moreover, the spatial distribution of moisture and carotenoid during the drying process were generated and visualized as pseudo-color images. The results indicated that the hyperspectral imaging could be used to effectively predict the MC and CC in carrot slices, demonstrating the potential of hyperspectral imaging as an analytical tool in quality control of carrot slices during drying.