据联合国粮食与农业组织估计,全球的粮食作物及其产品中大约有1/4存在霉菌毒素污染[1-2],给全球农业经济带来巨大损失[3]。这些毒素大部分具有肝脏毒性、肾脏毒性、致癌性、致畸性和致突变性等[4]。在所有霉菌毒素中,黄曲霉毒素(aflatoxin,AF)较为常见,而且毒性较强,据美国疾病控制中心报道,全球大约有45亿 人面临AF的暴露风险,主要集中在发展中国家[5]。AF是一大类结构相似的化合物,属于二氢呋喃香豆素的衍生物。其中,黄曲霉毒素B1(aflatoxin B1,AFB1)最为常见且毒素最强,其急性毒性是氰化钾的10 倍、砒霜的68 倍,主要存在于花生、核桃、大豆、稻谷、玉米、小麦等农作物及其油类副产品中,奶制品、调味品分布较少[6-9]。
我国GB 2761—2017《食品中真菌毒素限量》[10]规定花生油和玉米油中AFB1的限量值为20 μg/kg,其他植物油脂中AFB1的限量值为10 μg/kg。GB 5009.22—2016《食品中黄曲霉毒素B族和G族的测定》[11],包含同位素稀释液相色谱-串联质谱法、高效液相色谱-柱前衍生法、高效液相色谱-柱后衍生法等[12-14]。上述方法均为实验室检测方法,样品前处理过程繁琐、检测时间长、成本高,难以满足基层监管过程中快速出检测结果的需求[15]。当前,国内外市场上均有商品化的用于检测食品中AF的胶体金免疫层析试纸条,该类检测产品具有简便、快速、廉价、对操作人员要求较低、现场结果可视化等优点,基本满足基层监管的需求,可配备于农贸市场快检室、快检车等,对农产品及其制品中AF的监管控制和风险预警具有重要意义。到目前为止,国家食品安全监管部门先后共发布了11 项食品快速检测方法[16-18],其中9 项是胶体金免疫层析法。由此可见,胶体金免疫层析法是目前食品快速检测领域的主要方法。为规范快速检测产品在食品监管领域的应用,有必要对该类产品进行质量评价,保证它们的可靠性。
在国内,监管部门对快速检测试剂的管理还处于初步阶段。国家各相关监管部门先后发布了食品快速检测试剂评价的标准或规范,以评价机制促使市场的优胜劣汰,提高产品质量,保证行业良性发展,使快速检测在食品安全监管中真正发挥到有效作用。2017年,原国家食品药品监督管理局发布食药监科[2017]49号《关于规范食品快速检测方法使用管理的意见》[19],第五条规定各省(区、市)、计划单列市、副省级省会城市食品药品监管部门要按照食品药品监管总局制定发布的《食品快速检测方法评价技术规范》[20]和相应快速检测方法等要求,通过盲样测试、平行送实验室检验等方式对正在使用和拟采购的快速检测产品进行评价。评价结果显示不符合国家相应要求的,要立即停止使用或者不得采购。同时,在通知中强调,在执行上述规范时发现的问题,及时向总局科技标准司反馈。《食品快速检测方法评价技术规范》作为食品快速检测评价工作的纲领性文件,对食品快速检测方法的目的、适用范围、评价指标、评价方法、评价步骤、评价结果及报告出具等列出了指导性要求。但是,在快速检测试剂评价过程中的具体步骤未做说明,该规范有待逐步完善。例如,盲样的制备方法、盲样的均匀性和稳定性确定方法、样品添加量设置、样品数量设置、检测结果与参比方法的一致性判断方法等。
本研究以AFB1胶体金免疫层析试纸条的评价为切入点,系统性地研究胶体金免疫层析类食品快速检测产品评价过程中具体的操作问题,主要包括样品制备(均匀性、稳定性)、添加量设置、样品量设置等。以期在国家规范内,做好产品评价过程中的每一个细节,发现存在的问题并探讨在实际工作中的解决方法。本研究旨在为各级监管部门提供实践依据,为快速检测产品评价提供技术借鉴,有利于快速检测市场的规范化。
1 材料与方法
1.1 材料与试剂
本次评价实验使用的AFB1快速检测试纸条/卡,采取网上咨询,选择3 家行业内认可度较高的公司的产品。为避免评价结果对生产厂家造成影响,对生产厂家进行了编序(A、B、C公司)。
AFB1免疫亲和柱 美国Romer公司;AFB1标准品(纯度≥98%) 国家粮食局科学研究院;甲醇(色谱纯)西班牙Scharlab公司;乙醇(分析纯) 西陇科学股份有限公司;NY针头式过滤器 日本岛津公司;磷酸缓冲液(10 mmol/L,pH 7.4) 美国Sigma公司。
1.2 仪器与设备
Acquity UPLC H-class超高效液相色谱仪、Acquity UPLC BEH C18色谱柱 美国Waters公司;DHG-9420A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;M i l l i-Q超纯水处理系统 美国密理博公司;QUINTIX213-1CN电子天平 德国赛多利斯公司;MMV-1000W振荡器 上海爱朗仪器有限公司;RCT basic磁力搅拌器 德国艾卡公司。
1.3 方法
1.3.1 添加回收实验
快速检测产品评价实验涉及到盲样添加量实验室测定赋值、盲样均匀性和稳定性验证,为确保仪器检测方法的准确性,在开展盲样制备之前先开展食用油中AFB1添加回收实验。选取不含AFB1的花生油,添加AFB1标准品,然后用仪器分析,检测其含量,并计算回收率。具体步骤如下:1)选取花生油样本(AFB1含量低);2)制备9 个样品,平均分成3 组。每组样品中添加不同水平的标准品,3 个添加量分别为10、16、20 μg/kg。3)以GB 5009.22—2016[11]的第三法:高效液相色谱-柱后衍生法(大流通池直接检测),对上述样品进行检测,并计算样品的添加回收率。
1.3.2 盲样制备
根据《食品快速检测方法评价技术规范》[20],制备盲样的基质应与实际食品样品所含物质相似,本次评价实验所用基质为花生油。该规范同时对测试水平提出了要求,测试水平一般应包括食品基质空白样品,标准方法检出水平(或者标准限量值)的0.5、1、2 倍水平或者其他可检测区分的水平(不少于3 个),方法标称检测限0.5、1、2 倍水平或者其他可检测区分的水平(不少于3 个)。按照规范[9]附表,将样品按性质分为阳性和阴性两大类,则含量在20 μg/kg(限量值)以上的样品为阳性样品,其他含量的样品为阴性样品。本次评价实验设置4 个测试水平,分别为空白样品、10 μg/kg(阴性样品1)、16 μg/kg(阴性样品2)、20 μg/kg(阳性样品1)。
从市场上购买多种花生油,经仪器分析确证,AFB1都有检出,最终选取AFB1含量低(0.65 μg/kg)的花生油作为空白样品。向花生油中加入AFB1标准品,磁力搅拌器室温条件搅拌12 h,制备成上述4 个水平的样品,再用仪器检测盲样的均匀性和稳定性。
1.3.3 盲样的均匀性和稳定性检验
为保证快速检测评价实验的准确性和公正性,根据规范“盲样必须进行批内均匀性检查,对于一定时间范围内检测的样品,需要进行稳定性检查,保证在评价期限内样品稳定”。本实验参考CNAS-GL003∶2018《能力验证样品均匀性和稳定性评价指南》[21],将1.3.2节制备的各添加量的盲样进行分装(5 g/管),先用仪器进行检测,每个样品在重复条件下检测3 次。采用单因素方差分析对数据进行统计分析,使用的软件为IBM SPSS Statistics 22,通过F检验验证样品的均匀性[21]。
将其余样品置-20 ℃贮存,分别间隔1、2、3 周取出,每次取出3 个样品,每个样品重复检测3 次。参考CNAS-GL003∶2018[21]的方法,将不同贮存时间的检测平均值与初始检测平均值进行一致性比较,采用t检验法考察样品在评价期内的稳定性。
1.3.4 快速检测产品评价与结果统计
挑选有长期快速检测工作经验的人员进行评价实验,每种快速检测产品必需来源于同一个批次。在实验开展前对快速检测产品进行检查,主要针对外包装、试剂与辅助设备、产品说明书、产品基质的适用范围、标示检测限等。根据国家规范[22]中的指导性建议,每个测试添加量样品的数量不少于50 例。因此,4 个添加量的盲样共分装出了250 例测试样品,其中空白样品、阴性样品1、阴性样品2均为50 例,阳性样品1为100 例。按照AFB1的快速检测方法[23]和各产品说明书的要求进行样品前处理、快速检测测试、结果判读,并详细记录测试环境和快速检测结果。实验过程中,用每批样品测试快速检测产品的同时进行质控实验,分别选取2 份空白样品和2 份空白加标样品(20 μg/kg)与测试样品同时进行,确保评价结果的准确性。
按照国家规范[22]中“快速检测方法性能指标计算表”可计算出快速检测产品的各项性能指标。在评价测试的同时,对各快速检测产品的检测时间进行考察。按照3 个厂家自带的产品说明书进行样品前处理、快速检测产品测试、结果判读,记录3 种快速检测产品整个检测过程所需时间。
2 结果与分析
2.1 添加回收实验结果
花生油中普遍可检出AFB1,难以收集到不含该毒素的样品,因此本实验采用AFB1含量低(0.65 μg/kg)的样品作为空白样品,以GB 5009.22—2016[11]的第三法进行检测。为保证仪器检测盲样均匀性和稳定性结果的科学性,在开展评价实验前,先验证花生油中AFB1的添加回收率,见表1。此添加回收实验的回收率范围为89.52%~100.3%,符合GB/T 27417—2017《合格评定化学分析方法确认和验证指南》[24]中“方法回收率偏差范围”。
表1 花生油中AFB1回收率
Table 1 Recoveries of AFB1 spiked in peanut oil
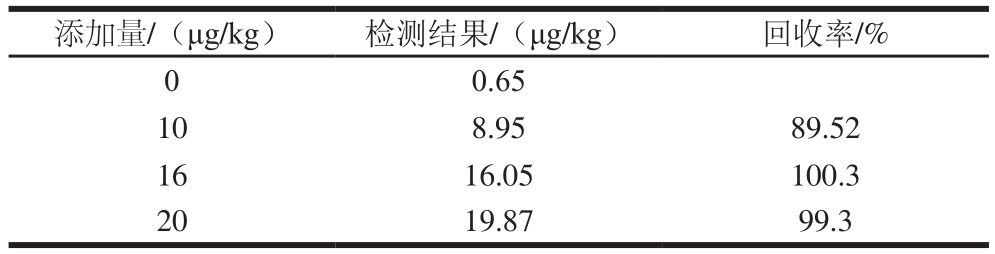
注:检测结果为3 个重复实验。
images/BZ_337_1276_1199_2254_1246.png00.65 10 8.95 89.52 16 16.05 100.3 20 19.87 99.3
2.2 样品的均匀性检验结果
表2 3 种添加量样品的均匀性检测结果
Table 2 Results for uniformity evaluation of samples spiked at three concentration levels

images/BZ_337_1276_1771_2254_1866.png9.56 9.46 9.69 9.57 10 9.58 9.56 9.42 9.52 9.56 9.52 9.77 9.62 9.59 9.55 9.41 9.52 9.49 9.46 9.57 9.51 9.54 9.45 9.55 9.51 9.58 9.49 9.59 9.56 9.53 9.54 9.53 9.54 9.61 9.51 9.59 9.57 9.56 9.49 9.56 9.53 9.54 0.074 0.76 15.66 15.5 15.43 15.53 16 15.59 15.51 15.46 15.52 15.68 15.61 15.76 15.68 15.77 15.61 15.72 15.70 15.62 15.64 15.55 15.60 15.63 15.53 15.68 15.61 15.71 15.58 15.52 15.60 15.71 15.60 15.76 15.69 15.75 15.64 15.76 15.72 15.63 0.097 0.62 18.58 18.61 18.65 18.61 20 18.53 18.64 18.57 18.58 18.63 18.56 18.73 18.64 18.74 18.54 18.57 18.62 18.68 18.84 18.76 18.76 18.63 18.71 18.74 18.69 18.72 18.64 18.75 18.70 18.66 0.085 0.46
按照CNAS-GL003∶2018[21]对样品的均匀性和稳定性进行验证。首先对各添加量的盲样均匀性进行检测。然后,采用F检验对数据进行统计分析,SPSS软件分析实验结果的F值,均匀性检测结果见表2、3。3 个添加量的F值均小于F临界值[25],P值均大于0.05,此结果表明在显著水平α=0.05时,同一添加量的所有样品间无显著性差异,即制备的样品均匀。
表3 测试样品的均匀性分析
Table 3 Uniformity analysis of tested samples

添加量/(μg/kg)变量来源 平方和 自由度 均方 F值 P值 F临界值10处理间 0.032 9 0.004 0.551 0.82 2.393处理内 0.127 20 0.006总变异 0.159 29 16处理间 0.125 8 0.016 2.364 0.062 2.51处理内 0.119 18 0.007总变异 0.244 26 20处理间 0.071 6 0.012 2.307 0.093 2.848处理内 0.072 14 0.005总变异 0.144 20
2.3 样品的稳定性检验结果
盲样制备完成后置于-20 ℃条件保存,从中取出用于稳定性检测的样品,每次取出3 个样品,按GB 5009.22—2016[11]第三法进行检测,每隔1 周检测1 次,每个样品重复检测3 次,检测结果见表4。
表4 测试样品的稳定性检测结果
Table 4 Results for stability evaluation of tested samples

images/BZ_338_224_1910_1203_1957.png相对标准偏差/%初始 9.54 0.77 15.63 0.62 18.66 0.46 1 周 9.28 0.96 15.17 1.34 18.19 2.2 2 周 9.22 5.5 14.48 0.69 20.47 1.0 3 周 9.12 1.3 14.58 1.4 19.40 2.3时间 平均值/(μg/kg)相对标准偏差/%平均值/(μg/kg)相对标准偏差/%平均值/(μg/kg)
表5 测试样品的稳定性分析
Table 5 Stability analysis of tested samples
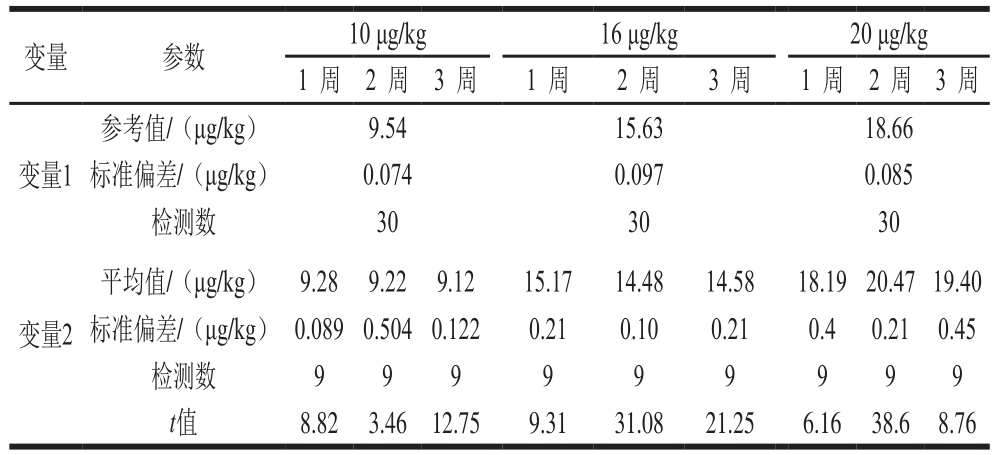
注:变量1.样品初始的检测结果;变量2.不同时间段稳定性实验检测结果。
images/BZ_338_224_2372_1202_2466.png变量1参考值/(μg/kg) 9.54 15.63 18.66标准偏差/(μg/kg) 0.074 0.097 0.085检测数 30 30 30变量2平均值/(μg/kg) 9.28 9.22 9.12 15.17 14.48 14.58 18.19 20.47 19.40标准偏差/(μg/kg) 0.089 0.504 0.122 0.21 0.10 0.21 0.4 0.21 0.45检测数 9 9 9 9 9 9 9 9 9 t值 8.82 3.46 12.75 9.31 31.08 21.25 6.16 38.6 8.76
将不同贮存时间样品的平均值与初始检测平均值进行一致性比较,按照CNAS-GL003∶2018[21]中稳定性检验的要求,计算t值,见表5。查GB/T 15000.5—1994的附录F可知t0.05(37)=2.026[25],t值均大于2.026,表明各贮存时间的检测结果与初始检测结果之间存在显著性差异。但是从各时间段检测结果的平均值表现出变异程度较小。快速检测产品本身只是对目标化合物进行初步筛查,对化合物的含量要求不需高度精确。因此,以本研究中的方法制备样品,在短时间内完成快速检测产品的评价,对评价结果的影响会较小。
2.4 产品的外观与适用性
实验前对3 个不同厂家的快速检测产品的包装、试剂和配件(滴管、96 孔架等)等进行检查。它们的外包装都完整(无破损)、试剂齐全且密封完好、附带说明书、基质适用范围合适、检测限描述清楚,见表6。各厂家快速检测产品的检测限分别为5~50、10、20 μg/kg和8~20 μg/kg。不同检测限所对应的样品前处理操作略有不同,开展实验前需要按照目标检测限对应的方法进行操作。GB 2761—2017[10]和AFB1快速检测方法 [23]要求花生油中的检测限均为20 μg/kg,各厂家的快速检测产品检测限符合要求。
表6 快速检测产品外观检查结果
Table 6 Characteristics of rapid test products

注:产品说明书内容包括检测原理、适用范围、检测限、产品组成、溶液配制、样品前处理方法、检测步骤、结果判断、特异性、贮存及有效期、注意事项等的描述;√.该项评价内容合格。
images/BZ_338_1299_1498_2277_1545.png厂家编号产品包装完整性和密封性标签(产品编号、规格、批号、有效期、贮存条件)完整性试剂、配套器材 产品说明书内容是否完整检测限/(μg/kg)A √ √ 滴管 √ 5~50 B √ √ 提取剂、萃取剂、稀释液、滴管 √ 10、20 C √ √ 滴管、96 孔板架 √ 8~20
在实际应用中,快速检测产品主要用于基层监管人员在市场上进行现场检查,需要考察快速检测产品在现场检查中的适用性,例如,环境条件(温度、湿度)、样品前处理复杂程度、配套辅助设备(冰箱、离心机等)等。本研究从贮存条件、测试环境条件、提取液配制、样品前处理步骤、配套辅助设备、检测时间6 个方面对各厂家快速检测产品的适用性进行评价,见表7。3 种快速检测产品都可在常温下贮存,便于携带和使用;测试环境可全部在室温下进行,无特定条件;A、B、C厂家的提取溶液分别为70%甲醇(现配)、提取剂(自带)、50%乙醇(现配)。3 种快速检测产品对应的样品前处理方法简单、辅助仪器少,都需要移液枪。其中,A厂家的前处理中有稀释步骤,B厂家的前处理中有稀释和静置分层过程,C厂家的前处理中有稀释、混匀、温育过程。由此可见,A厂家的样品前处理最简单,检测用时较少,C厂家的样品前处理最复杂,用时稍长。综上所述,3 种快速检测产品在现场应用中可较好地完成检测任务,适用性良好。
表7 快速检测产品的适用性评价
Table 7 Applicability evaluation of rapid test products
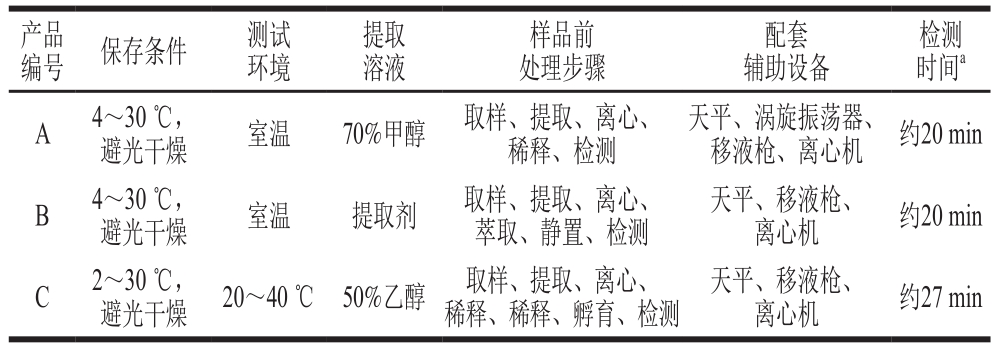
注:a. 4 个样品按产品说明书进行前处理、检测和判读,平行重复测试3 次,记录所需时间。
产品编号 保存条件 测试环境提取溶液样品前处理步骤配套辅助设备检测时间a A 4~30 ℃,避光干燥 室温 70%甲醇 取样、提取、离心、稀释、检测天平、涡旋振荡器、移液枪、离心机 约20 min B 4~30 ℃,避光干燥 室温 提取剂 取样、提取、离心、萃取、静置、检测天平、移液枪、离心机 约20 min C 2~30 ℃,避光干燥 20~40 ℃ 50%乙醇 取样、提取、离心、稀释、稀释、孵育、检测天平、移液枪、离心机 约27 min
2.5 产品测试结果
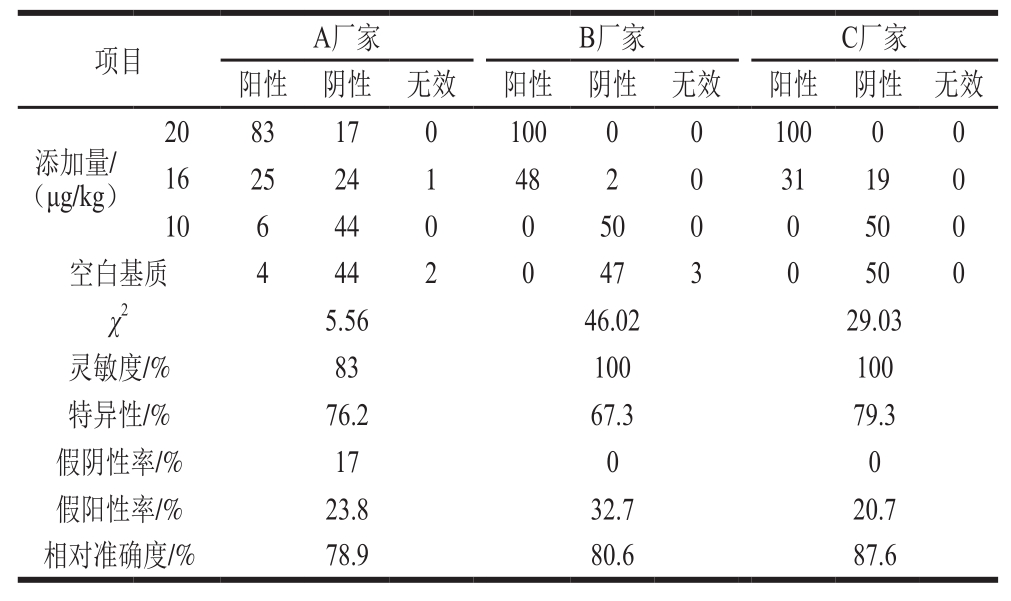
通过制备的样品对各厂家的快速检测产品进行测试,按照“快速检测方法性能指标计算表”[20]对检测结果进行统计分析,见表8。结果表明:添加量为1 倍限量值时,A、B、C厂家快速检测产品的阳性检测结果的概率分别为83%、100%、100%;添加量为0.8 倍限量值时,A、B、C厂家快速检测产品的阳性检测结果的概率分别为51%、96%、62%;添加量为0.5 倍限量值时,A、B、C厂家快速检测产品的阳性检测结果概率分别为12%、0%、0%。按照AFB1快速检测方法(KJ 201708)[23]中的快速检测产品性能指标的要求(假阳性率≤10%、假阴性率≤1%、灵敏度≥99%、特异性应≥90%),此3 种快速检测产品性能均不达标。
表8 AFB1快速检测产品评价统计结果
Table 8 Statistical results for evaluation of rapid test products
images/BZ_339_201_1791_1178_1885.png添加量/(μg/kg)20 83 17 0 100 0 0 100 0 0 16 25 24 1 48 2 0 31 19 0 10 6 44 0 0 50 0 0 50 0空白基质 4 44 2 0 47 3 0 50 0 χ2 5.56 46.02 29.03灵敏度/% 83 100 100特异性/% 76.2 67.3 79.3假阴性率/% 17 0 0假阳性率/% 23.8 32.7 20.7相对准确度/% 78.9 80.6 87.6
胶体金免疫层析法原理是抗原-抗体特异性结合,具较高的灵敏度和特异性[26-27]。但是,它们不能进行精确定量,对抗原浓度在小范围波动时难以准确识别,添加量在限量值水平附近时,很有可能检出为阳性结果。因此,本实验中0.8 倍限量值添加水平检出阳性结果的概率在50%以上。
快速检测方法性能指标计算表[20]仅将样品区分为“阳性”和“阴性”两类。GB 2761—2017[10]规定AFB1在花生油中的限量为20 μg/kg,含量低于20 μg/kg,则为阴性样品,高于20 μg/kg,则为阳性样品。所以,本研究中添加量20 μg/kg的样品为阳性样品,其他均为阴性样品。AFB1快速检测方法(KJ 201708)[23]规定快速检测产品的性能指标须达到:假阴性率≤1%、假阳性率≤10%。如果胶体试纸条方法要保证样品添加量大于20 μg/kg(阳性样品)时检出阳性结果概率大于99%,则无法做到样品中其含量在0~20 μg/kg(阴性样品)时检出阳性结果概率小于10%。
本研究结果表明,样品添加量的设置是决定评价结果的关键因素。如果不同机构使用不同浓度样品评价同一快速检测产品,必然得出不同的性能指标。如此,必然导致评价结果相互矛盾、评价系统混乱,评价机构将丧失权威性,从上到下的快速检测评价工作将难以进行。例如,贾丽华等[28]仅设置3 个添加量(阴性、1 倍限量水平、2 倍限量水平)用于快速检测产品评价,由于阴性样品浓度约为0.5 倍限量值(浓度较低),而两种阳性样品的浓度较高。绝大部分快速检测产品的假阴性率和假阳性率符合呕吐毒素的快速检测方法(KJ201702)[29]的要求。如果改变样品浓度,则得出的性能指标必然发生变化。因此,针对不同快速检测产品制定科学合理的评价方法是推进快速检测评价工作的基础。
对于胶体金免疫层析试纸条/卡的结果判定方法,有待进一步标准化。AFB1快速检测方法(KJ 201708)[23]分别对比色判定方法和消线判定方法作了说明,见图1。比色判定方法:无效,C线不显色;阳性,T线明显浅于C线;阴性,T线比C线深或T线与C线相当。消线判定方法:无效,C线不显色;阳性,C线显色,T线不显色;阴性,C线显色,T线显色。除快速检测方法对判定方法作了说明外,每个快速检测产品都附带了自身的判定方法说明,有的产品说明与快速检测方法基本一致,有的有略微差别。

图1 试纸条/检测卡目视判定示意图[23]
Fig. 1 Schematic of visual judgment of test strip/detection card
C线和T线的颜色深浅与试纸条/卡生产过程中划线抗原/抗体浓度有关,不同产品的划线浓度不同,导致颜色深浅不同。T线颜色深浅不仅与划线浓度有关,而且与待测液中目标化合物浓度有关。化合物浓度越高,T线颜色则越浅,反之,颜色则越深。总之,T线颜色的深浅呈现出连续变化的结果。在快速检测结果判定中,无统一的量化标准,操作人员都只能按个人判断判定结果,不同人员的判定结果必然存在差异。另外,人与人之间对颜色的敏感度差异也会进一步增加结果的判定差异。只有标准化的判定方法才能解决上述问题。将T线与C线的颜色深浅用仪器读取,以数字化的形式显示,不仅可避免操作人员之间的差异,而且便于规范结果判定方法。
3 结 论
本研究采用花生油基质加标的方法制备4 种不同添加量的AFB1样品,对3 个不同厂家的胶体金免疫层析试纸条/卡进行评价测试。根据评价结果可知,制备的盲样均匀性良好,快速检测产品的包装、说明书、试剂和配备器具等完好,检测限符合标准要求,现场使用的适用性良好。各快速检测产品的假阴性率和假阳性率不符合快速检测方法的要求。另外,本研究发现样品添加量设置是决定评价结果的关键因素,快速检测产品评价亟需一套更加科学合理的评价方法。
[1] 鲍蕾, 梁成珠, 刘学惠, 等. 出入境农产品中真菌毒素的污染、检测及控制[J]. 中国食品工业, 2005(1): 60-61.
[2] RICHARD J L. Some major mycotoxins and their mycotoxicoses:an overview[J]. International Journal of Food Microbiology, 2007,119(1/2): 3-10. DOI:10.1016/j.ijfoodmicro.2007.07.019.
[3] SCHATZMAYR G, ZEHNER F, TÄUBEL M, et al. Microbiologicals for deactivating mycotoxins[J]. Molecular Nutrition & Food Research,2006, 50(6): 543-551. DOI:10.1002/mnfr.200500181.
[4] BHAT R, REDDY K R N. Challenges and issues concerning mycotoxins contamination in oil seeds and their edible oils:updates from last decade[J]. Food Chemistry, 2017, 215: 425-437.DOI:10.1016/j.foodchem.2016.07.161.
[5] CARVAJAL-MORENO M. Metabolic changes of aflatoxin B1 to becomean active carcinogen and the control of this toxin[J].Immunome Research, 2015, 11(3): 2-14. DOI:10.4172/1745-7580.10000104.
[6] ABRAR M, ANJUM F M, BUTT M S, et al. Af l atoxins: biosynthesis,occurrence, toxicity, and remedies[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(8): 862-874. DOI:10.1080/104083982 011.563154.
[7] WILLIAMS J H, PHILLIPS T D, JOLLY P E, et al. Human af l atoxicosis in developing countries: a review of toxicology, exposure,potential health consequences, and interventions[J]. The American Journal of Clinical Nutrition, 2004, 80(5): 1106-1122. DOI:10.1093/ajcn/80.5.1106.
[8] WU F, GROOPMAN J D, PESTKA J J. Public health impacts of foodborne mycotoxins[J]. Annual Review of Food Science and Technology, 2014, 5(1): 351-372. DOI:10.1146/annurevfood-030713-092431.
[9] CHEN C, MITCHELL N J, GRATZ J, et al. Exposure to aflatoxin and fumonisin in children at risk for growth impairment in rural Tanzania[J]. Environment International, 2018, 115: 29-37.DOI:10.1016/j.envint.2018.03.001.
[10] 国家卫生和计划生育委员会. 食品中真菌毒素限量: GB 2761—2017[S]. 北京: 中国标准出版社, 2017: 2.
[11] 国家卫生和计划生育委员会. 食品中黄曲霉毒素B族和G族的测定:GB 5009.22—2016[S]. 北京: 中国标准出版社, 2016: 11-17.
[12] 韩伟, 向红莉. 谷物中黄曲霉毒素检测方法的研究进展[J].现代食品, 2018(21): 122-124. DOI:10.16736/j.cnki.cn41-1434/ts.2018.21.038.
[13] 陈强胜. 高效液相色谱-柱后衍生法检测大米中黄曲霉毒素B1方法分析[J]. 现代食品, 2018(15): 147-149. DOI:10.16736/j.cnki.cn41-1434/ts.2018.15.045.
[14] 李梅. 食品中生物毒素类有害物质质谱分析方法研究及应用[D].北京: 军事科学院, 2018: 1-65.
[15] KOKKONEN M K, JESTOI M N. A multi-compound LC-MS/MS method for the screening of mycotoxins in grains[J]. Food Analytical Methods, 2009, 2(2): 128-140. DOI:10.1007/s12161-009-9078-z.
[16] 国家食品药品监督管理总局. 总局关于发布《水产品中孔雀石绿的快速检测 胶体金免疫层析法》等6 项食品快速检测方法的公告(2017年第58号)[EB/OL]. (2017-05-25)[2019-02-24]. http://samr.cfda.gov.cn/WS01/CL0087/173000.html.
[17] 国家食品药品监督管理总局. 总局关于发布《食品中吗啡、可待因成分的快速检测 胶体金免疫层析法》等3 项食品快速检测方法的公告(2017年第92号)[EB/OL]. (2017-08-04)[2019-02-24]. http://samr.cfda.gov.cn/WS01/CL0087/176020.html.
[18] 国家食品药品监督管理总局. 总局关于发布《蔬菜中敌百虫、丙溴磷、灭多威、克百威、敌敌畏残留的快速检测》食品快速检测方法的公告(2017年第113号)[EB/OL]. (2017-09-20)[2019-02-24].http://samr.cfda.gov.cn/WS01/CL0087/177718.html.
[19] 国家食品药品监督管理局. 食药监科[2017]49号 总局关于规范食品快速检测方法使用管理的意见[EB/OL]. (2017-06-08) [2019-02-24]. http://samr.cfda.gov.cn/WS01/CL1605/173600.html.
[20] 国家食品药品监督管理局. 食药监办科[2017]43号 总局办公厅关于印发食品快速检测方法评价技术规范的通知[EB/OL]. (2017-03-31)[2019-02-24]. http://samr.cfda.gov.cn/WS01/CL1605/171311.html.
[21] 中国合格评定国家认可委员会. 能力验证样品均匀性和稳定性评价指南: CNAS-GL003:2018[S]. 北京: 中国标准出版社, 2018: 1-7.
[22] 国家食品药品监督管理局. 食药监办科[2017]43号 总局办公厅关于印发食品快速检测方法评价技术规范的通知[EB/OL]. (2017-03-31)[2019-02-24]. http://samr.cfda.gov.cn/WS01/CL1605/171311.html.
[23] 国家食品药品监督管理局. 食用油中黄曲霉毒素B1的快速检测胶体金免疫层析法KJ201708[EB/OL]. (2017-08-11) [2019-02-24].http://samr.cfda.gov.cn/WS01/CL0087/176020.html.
[24] 国家质量监督检验检疫总局. 合格评定 化学分析方法确认和验证指南: GB/T 27417—2017[S]. 北京: 中国标准出版社, 2017: 13.
[25] 国家技术监督局. 标准样品工作导则(5)化学成分标准样品技术通则: GB/T 15000.5—1994[S]. 北京: 中国标准出版社, 1994: 13-14.
[26] 蔡新发, 张帆, 张家赫, 等. 氟喹诺酮类药物免疫分析方法研究进展[J].现代农业科技, 2018(9): 266-267; 272.
[27] GUO S, ZHANG W, HE L, et al. Rapid evaluation of artesunate quality with a specific monoclonal antibody-based lateral flow dipstick[J]. Analytical and Bioanalytical Chemistry, 2016, 408(22):6003-6008. DOI:10.1007/s00216-016-9363-9.
[28] 贾丽华, 袁磊, 林芳, 等. 粮食加工品中呕吐毒素快速检测产品的评价与质量分析[J]. 食品安全质量检测学报, 2018, 9(18): 4940-4946.
[29] 国家食品药品监督管理局. 食品中呕吐毒素的快速检测 胶体金免疫层析法KJ201702[EB/OL]. (2017-05-25) [2019-02-24]. http://samr.cfda.gov.cn/WS01/CL0087/173000.html.