蓝靛果,学名蓝靛果忍冬(Lonicera caerulea L.),又名黑瞎子果、山茄子、羊奶子等,属于忍冬科忍冬属,是一种新兴的小浆果,主要分布在俄罗斯、日本、韩国、中国东北部和北美部分地区[1]。蓝靛果果实含有丰富的花色苷、黄酮、多糖、维生素、矿物质和微量元素等多种活性物质,具有抗肿瘤、抗菌、抗炎、抗氧化、降血糖、肝脏保护等功效[2-4],在俄罗斯北部、中国和日本的民间医学中得到了广泛应用[5]。目前,国内外针对蓝靛果果实的研究主要集中在黄酮类、花色苷及多酚类物质,但对于蓝靛果多糖的研究鲜有报道[6-7]。
近年来很多研究已证实从天然产物中提取的多糖,具有抗肿瘤、抗炎、抗菌、降血糖、增强免疫等生物活性[8-9],目前对多糖结构和功能的研究已经成为继蛋白质和核酸之后探索生命奥秘的第3个里程碑[10]。
本实验采用超声波辅助复合酶法提取蓝靛果多糖,对多糖结构和功能特性进行表征,并测定多糖抗糖基化活性,为进一步开发利用蓝靛果资源提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
蓝靛果果实 黑龙江省农科院牡丹江农科所;果胶酶(>40 U/mg) 上海蓝季生物科技有限公司;纤维素酶(>400 U/mg) 北京博奥拓达科技有限公司;大孔吸附树脂D4006 南开大学化工厂;刚果红 天津巴斯夫化工有限公司;氨基胍 国药集团化学试剂有限 公司;所用试剂均为分析纯。
1.2 仪器与设备
JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;STA 449/F5热失重(thermal gravity,TG)分析仪 耐驰科学仪器商贸(上海)有限公司;DHR-1旋转流变仪 沃特世科技(上海)有限公司;FTS135型傅里叶变换红外光谱仪 美国Bid-Bad公司;UV-2700双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;S-3400N扫描电子显微镜 日本Hitachi公司;X’Pert3 Powedr X射线衍射仪 荷兰帕纳科公司;LS55荧光分光光度计 美国PerkinElmer公司。
1.3 方法
1.3.1 蓝靛果多糖的制备
超声辅助复合酶法制备多糖:称取一定量的蓝靛果果实匀浆,以去离子水为提取剂,在料液比为1∶25,果胶酶添加量为质量分数0.8%,纤维素酶添加量为质量分数0.5%,pH 3.5(0.1 mol/L NaOH溶液调节),超声功率300 W的条件下,超声提取40 min,沸水浴灭酶10 min,提取液经抽虑,浓缩,80%乙醇醇沉,在冰箱(4 ℃)中静置过夜,所得沉淀即为蓝靛果粗多糖。
选取D4006型大孔树脂纯化蓝靛果粗多糖溶液,洗脱条件:温度25 ℃,上样量20.0 mL(4.0 mg/mL),洗脱流速1.0 mL/min,去离子水作为洗脱剂,苯酚-硫酸法跟踪检测[11],收集多糖洗脱液,经透析、离心、浓缩、冻干后即得到蓝靛果多糖,苯酚-硫酸法测定多糖纯度为67.11%f 0.99%。
1.3.2 蓝靛果多糖的功能特性测定
1.3.2.1 持水性和持油性测定
参考Wang Lei等[12]的方法,准确称取一定量的多糖样品,分别用去离子水和大豆油配成质量浓度为10 mg/mL 的多糖溶液,测定蓝靛果多糖的持水性与持油性。
1.3.2.2 乳化活性指数及乳化稳定性测定
参考Romdhane等[13]的方法,以大豆卵磷脂为阳性对照,在蓝靛果多糖质量浓度为10 mg/mL的条件下,测定蓝靛果多糖的乳化活性指数及乳化稳定性。
1.3.2.3 蓝靛果多糖的TG分析
称取蓝靛果多糖2 0 m g,采用T G 分析和微分热重(differential thermogravimetry,DTG)分析样品的热行为。实验在N2流速为50 mL/min的条件下进行,测定温度范围为室温至600 ℃,升温速率 为10 ℃/min。
1.3.2.4 蓝靛果多糖的流变学特性测定
配制质量浓度为10 mg/mL的蓝靛果多糖溶液,使用流变仪在温度(25.0f 0.1)℃,平板Ф 60 mm的条件下,研究多糖的流变学行为。剪切速率扫描范围1~100 s-1的条件下,测定表观黏度变化;在1%的恒定应力,角频率范围1~100 r/s,测定样品的储能模量(G’)和损耗模量(G”)变化。
1.3.3 蓝靛果多糖的结构表征
1.3.3.1 蓝靛果多糖单糖组成的测定
采用气相色谱仪测定蓝靛果多糖的单糖组成,参考Yu Zeyuan等[14]的方法,首先将蓝靛果多糖酸水解,水解产物衍生化后进样,对比各单糖标准品衍生物的出峰时间,确定蓝靛果多糖的单糖组成。
气相色谱的条件:石英毛细管色谱柱RTX-1701(30.0 mh 0.25 mm);检测器:氢火焰离子化检测器;程序升温:180(5 ℃/min)~220 ℃(5 min),220(10 ℃/min)~280 ℃(20 min);气化温度:280 ℃;检测器温度:280 ℃;载气:高纯氮气;进样量:1 μL。
1.3.3.2 蓝靛果多糖的红外光谱和紫外-可见光谱分析
采用傅里叶变换红外光谱仪,在4 000~500 cm-1波数范围内对多糖进行红外扫描以鉴定其主要官能团;配制蓝靛果多糖溶液(0.1 mg/mL),利用TU-1901型双光束紫外-可见分光光度计在波长190~600 nm范围内扫描。
1.3.3.3 刚果红实验、扫描电镜和X射线衍射分析
参考Liu Wei等[15]的方法,将蓝靛果多糖和刚果红试剂配制成不同浓度(0~0.5 mol/L)NaOH溶液,在700~400 nm范围内,利用TU-1901型双光束紫外-可见分光光度计对上述不同的反应体系进行扫描,测定溶液的最大吸收波长。用去离子水代替多糖溶液作为空白对照组。
将样品蓝靛果多糖放入离子溅射镀膜仪,在真空下样品表面镀一层100 nm左右的金膜,然后采用扫描电镜观察多糖的形貌特征。
蓝靛果多糖的晶体构型使用X’Pert3 Powedr X射线衍射仪测定。实验条件参数为电压40 kV,电流40 mA;起始角5°;终止角70°。
1.3.4 蓝靛果多糖抗糖基化反应活性测定
根据文献[16]报道的方法,建立牛血清白蛋白-葡萄糖糖基化反应体系,以氨基胍作为阳性对照,测定蓝靛果多糖溶液(0.1、0.5 mg/mL)在不同时间对Amadori产物、二羰基化合物、糖基化终产物(advanced glycation end products,AGEs)的抑制作用。
1.4 数据处理
所有数据均以3 次实验结果的 s表示。采用Origin 8.0软件绘图,并用DPS软件进行差异显著性分析, P<0.05,差异显著。
s表示。采用Origin 8.0软件绘图,并用DPS软件进行差异显著性分析, P<0.05,差异显著。
2 结果与分析
2.1 蓝靛果多糖的功能特性
2.1.1 蓝靛果多糖的持水持油性、乳化活性指数及乳化稳定性
表 1 蓝靛果多糖的持水(油)性及乳化活性
Table 1 Water- and oil-holding capacities, emulsifying activity and emulsion stability of the polysaccharide
持水性/(g/g) 持油性/(g/g) 乳化活性指数/(m2/g) 乳化稳定性/%0.37f 0.05 4.60f 0.45 26.08f 0.28 74.83f 1.19
持水性用于评价样品的稳定性、质地和感官品质。由表1可知,蓝靛果多糖的持水性为(0.37f 0.05)g/g,高于刺梨果实多糖(0.25f 0.04)g/g[12],但是低于商品面筋(1.40f 0.05)g/g[13]。持油性是样品吸油能力的最显著的功能特性,较高的持油力可保持食品风味,增加食物的口感。蓝靛果多糖的持油性为(4.60f 0.45)g/g, 高于商品面筋(1.19f 0.13)g/g[13]。由表1可知,当蓝靛果多糖质量浓度为10 mg/mL时,乳化活性指数和乳化稳定性分别为(26.08f 0.28)m2/g和74.83%f 1.19%。相同质量浓度条件下,阳性对照大豆卵磷脂的乳化活性指数和乳化稳定性分别为(50.83f 0.13)m2/g和93.89%f 1.19%。大豆卵磷脂是一种广泛应用于食品、医药、化妆品、饲料中的乳化剂[17],对比二者可知,蓝靛果多糖同样具有一定的乳化性,这是由于多糖本身具有亲水亲油基团,能改善乳状液中的表面张力[18-19]。此外文献报道西瓜多糖在质量浓度为 10 mg/mL时,没有明显的乳化性和乳化稳定性,当质量浓度提高至40 mg/mL时,乳化活性指数和乳化稳定性分别为(58.73f 0.97)m2/g和 27.54%f 0.34%,仍低于蓝靛果多糖的乳化稳定性[13]。
2.1.2 蓝靛果多糖的TG分析

图 1 蓝靛果多糖的TG分析曲线
Fig. 1 TG and DTG curves of the polysaccharide
TG曲线(图1)显示,蓝靛果多糖的质量损失可以大致归纳为3 个阶段。第1阶段样品在从25 ℃升至150 ℃过程中,质量损失率约为6.01%,这是由于多糖游离水和结合水的蒸发,表明蓝靛果多糖对水有一定的吸附 能力[20]。第2阶段在200~450 ℃,蓝靛果多糖样品有明显质量损失现象,质量损失率约为61.31%,表明在本阶段蓝靛果多糖受热大量分解。第3阶段在450~600 ℃,样品分解速率变缓,仅显示出缓慢的质量损失,质量损失率约为4.93%,在600 ℃时最终残留量为26.78%。与TG曲线相对应,DTG曲线可以反映样品质量损失速率随温度的变化情况,峰值表示样品达最大质量损失速率时的温度,由图1可知,在85.41 ℃和307.25 ℃时样品分别达到了对应阶段的最大质量损失速率,分别为1.09%/min和 8.07%/min。以上结果表明蓝靛果多糖热稳定性较好,可作为添加物应用到灭菌或焙烤处理等食品热加工中。
2.1.3 蓝靛果多糖的流变特性分析
多糖的流变学特性使其在食品和生物医药行业中可广泛用作质地改性剂、增稠剂、胶凝剂和乳化剂[12]。剪切速率对蓝靛果多糖溶液表观黏度的影响如图2a所示,随着剪切速率的升高,多糖溶液的表观黏度逐渐降低,变化范围为0.161~0.002 Pag s,呈现出剪切稀释现象,表明蓝靛果多糖为假塑性非牛顿流体,主要原因是随着多糖溶液剪切速率的升高,多糖分子间相互作用力越来越小,链缠结的数目减少[12]。G’和G”随角频率变化如图2b所示,随着角频率的增加,蓝靛果多糖溶液的G’和G”表现出不同程度的增加,G’和G”在角频率为17.71 rad/s处发生交叠,此角频率称为交叉频率。当角频率低于交叉频率时,G”>G’,蓝靛果多糖溶液主要表现为液体黏性性质;角频率高于交叉频率时,G’>G”,蓝靛果多糖主要表现为固体弹性性质。综上所述,蓝靛果多糖为典型的非牛顿流体,具有一定的黏弹性,以上数据为蓝靛果多糖作为功能性添加剂应用到食品工业中提供了理论依据。

图 2 蓝靛果多糖的流变特性
Fig. 2 Rheological properties of the polysaccharide
a.表观黏度随剪切速率的变化;b. G’和G”随角频率的变化。
2.2 蓝靛果多糖的结构表征
2.2.1 蓝靛果多糖的单糖组成

图 3 单糖标准品(a)和多糖(b)的气相色谱图
Fig. 3 GC profiles of mixed monosaccharide standards (a) and the
polysaccharide (b)
在相同色谱条件下,保留时间可作为定性分析的依据。根据单糖标准品和蓝靛果多糖的保留时间和峰面积(图3),可知蓝靛果多糖是由6 种单糖组成的酸性杂多糖,单糖组成及物质的量比为:半乳糖醛酸-鼠李糖-阿拉伯糖-甘露糖-葡萄糖-半乳糖=2.84∶10.02∶15.47∶ 1.00∶2.48∶36.12。
2.2.2 蓝靛果多糖的红外光谱与紫外-可见光谱分析
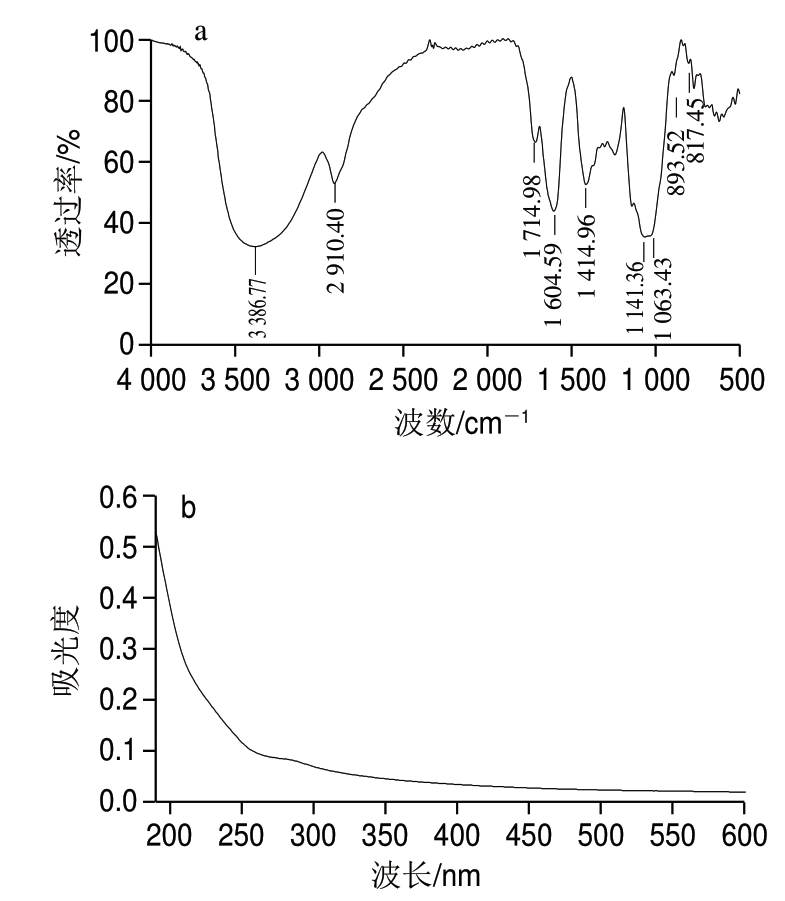
图 4 蓝靛果多糖的红外光谱(a)和紫外-可见光谱(b)图
Fig. 4 Fourier transform infrared spectrum (a) and ultraviolet spectrum (b) of the polysaccharide
蓝靛果多糖红外光谱见图4a。多糖在4 000~500 cm-1 波数范围内具有明显的多糖特征吸收峰。3 386 cm-1和2 910 cm-1波数处分别为Oü H的伸缩振动峰和Cü H伸缩振动峰,1 714 cm-1和1 604 cm-1波数的吸收峰是由 C=O和COO—的伸缩振动引起,此外在1 414 cm-1波数处有吸收峰,表明蓝靛果多糖中含有糖醛酸[21],这和气相色谱测定结果一致。在1 200~1 000 cm-1波数之间的强吸收峰,表明蓝靛果多糖内含有吡喃糖环[22]。 893 cm-1和817 cm-1波数处均有吸收峰,表明多糖中存在α-和β-糖苷键[22]。
紫外-可见光谱扫描结果如图4b所示,在260、280、520 nm波长处无明显吸收,表明蓝靛果多糖中不含核酸、蛋白质、花色苷[23]。
2.2.3 蓝靛果多糖的刚果红实验、扫描电镜和X射线衍射分析

图 5 蓝靛果多糖的刚果红实验结果(a)、扫描电镜图像(b)(×100)和X射线衍射图(c)
Fig. 5 Congo red test results (a), SEM image (b) (× 100) and X-ray diffraction pattern (c) of the polysaccharide
在碱性条件下多糖与刚果红反应,根据最大吸收波长的变化趋势可以判断多糖有无三股螺旋结构。在一定范围内,如果多糖含有三股螺旋结构,随着NaOH质量浓度升高,刚果红与多糖形成复合物的最大吸收波长会产生红移现象,若多糖不含三股螺旋结构,则紫外光谱的最大吸收波长与刚果红溶液变化的趋势相似[15]。蓝靛果多糖在不同质量浓度NaOH溶液条件下与刚果红复合物最大吸收波长的变化如图5a所示,随着NaOH溶液质量浓度的增大,多糖与刚果红混合溶液最大吸收波长与刚果红溶液的最大吸收波变化趋势相似,均呈现逐渐减小的趋势,说明蓝靛果多糖不具有三股螺旋结构,这与Mao等[24] 研究结果一致,一般杂多糖不易形成三股螺旋结构。
扫描电镜照片可提供多糖的微观形态,是研究多糖形貌特征的重要方法。由图5b可知,蓝靛果多糖呈片状、不规则的状态。
由图5c所示,蓝靛果多糖在衍射角2θ 5~70°的范围内并没有特别明显的衍射峰,在18.5°左右呈现“发髻形”结晶反射,这说明蓝靛果多糖是一种半结晶或非结晶物质,在常态下不能形成单晶,属于无定形态,这与多糖分子本身庞大而复杂的分子结构有关[25-26]。
2.3 蓝靛果多糖的抗糖基化活性

图 6 蓝靛果多糖对蛋白非酶糖基化的抑制作用
Fig. 6 Inhibitory effects of the polysaccharide versus aminoguanidine on glycosylation
a.Amadori产物;b.二羰基化合物;c. AGEs的抑制作用。字母不同表示差异显著(P<0.05)。
AGEs的产生的过程称为蛋白非酶糖基化反应,该反应可分为3 个阶段:反应初期Amodori产物形成阶段、反应中期二羰基化合物形成阶段和反应末期终产物AGEs形成阶段。AGEs在各组织中的形成和积累与糖尿病慢性并发症、动脉粥样硬化、心管疾病、阿尔茨海默病等疾病的发生和发展均有密切的关系。抑制3 个阶段中的任一产物的生成,都可以减少AGEs的形成,有利于预防糖尿病及其并发症的发生[27]。
氨基胍是一种亲核的小分子肼类化合物,可通过与葡萄糖的羰基发生亲核加成反应,从而阻止AGEs的形成,可以用来治疗糖尿病等血管并发症。但研究表明其对人体有一定的毒性作用,使其应用范围有了一定的局限性[28-29]。蓝靛果多糖的抗糖基化活性结果如图6所示,蓝靛果多糖(0.1、0.5 mg/mL)对糖基化反应的3 个阶段的产物均有一定的抑制作用,且高质量浓度(0.5 mg/mL) 抑制率大于低质量浓度(0.1 mg/mL)的抑制率。如图6a所示,相同质量浓度下,多糖对Amodori产物的抑制率高于对照氨基胍,在第13天时抑制作用达到最大,抑制率分别为27.39%f 1.44%(0.1 mg/mL,多糖),35.24%f 1.44%(0.5 mg/mL,多糖),21.77%f 1.14%(0.1 mg/mL,氨基胍),28.38%f 2.01%(0.5 mg/mL,氨基胍)。13~16 d内,抑制率略有下降。相似结果在霍山石斛多糖和黑穗醋栗果实多糖对Amodori产物的抑制实验中观察到,两种多糖也同样出现抑制率随时间延长而增加,但后期略有下降的结果[29-30]。目前产生的原因尚不明确,可能和多糖抑制作用机理有关,有待于进一步探讨。此外由图6b、c可知,随着时间延长和多糖质量浓度的增加,多糖对二羰基化合物和AGEs形成抑制率显著增加,呈现剂量效应依赖关系(P<0.05)。第16天时,多糖对二羰基化合物和AGEs的抑制作用均达到最大,对二羰基化合物的最大抑制率分别为28.29%f 0.79% (0.1 mg/mL,多糖),33.41%f 1.01%(0.5 mg/mL, 多糖),20.54%f 0.90%(0.1 mg/mL,氨基胍)24.98%f 0.91%(0.5 mg/mL,氨基胍);对AGEs最大抑制率分别为35.97%f 1.20%(0.1 mg/mL,多糖),42.62%f 0.70%(0.5 mg/mL,多糖),24.89%f 1.30%(0.1 mg/mL,氨基胍),30.47%f 0.84%(0.5 mg/mL,氨基胍)。由此可见,在实验质量浓度范围内,蓝靛果多糖对二羰基化合物和AGEs的抑制作用均高于对照氨基胍。
综上所述,蓝靛果多糖对糖基化反应3 个阶段产物的形成均表现出良好的抑制作用,并随着质量浓度和时间的增加抑制效果增强且抑制率高于血糖控制药物氨基胍。已有研究表明氨基胍用于治疗糖尿病有一定的副作用,寻找更有效、更安全的抗糖基化药物受到广泛关注。蓝靛果多糖具有易得、安全、无毒、无致癌性等特点,作为较好的糖基化反应抑制剂,在治疗糖尿病以及糖尿病并发症方面具有潜在的应用前景。
3 结 论
蓝靛果多糖是由6 种单糖组成的酸性杂多糖,不含核酸、蛋白和花色苷类物质。蓝靛果多糖具有一定的持水性、持油性、乳化能力,同时多糖溶液为假塑性非牛顿流体,呈现黏弹特性,可加入食品中用作质地改性剂、增稠剂、胶凝剂,改进食品组织结构、增加口感。TG分析结果表明蓝靛果多糖具有较好的热稳定性,可作为添加物应用到灭菌或焙烤处理等食品热加工中。结构表征显示蓝靛果多糖具有多糖的特征吸收,不具有三股螺旋结构,表面呈片状,形态不规则。蓝靛果多糖对糖基化反应3 个阶段产物的形成均表现出良好的抑制作用,效果高于对照氨基胍,对糖尿病的治疗具有潜在的应用前景。
[1] CHAOVANALIKIT A, THOMPSON M M, WROLSTAD R E. Characterization and quantification of anthocyanins and polyphenolics in blue honeysuckle (Lonicera caerulea L.)[J]. Journal of Agriculture and Chemistry, 2004, 52: 848-852. DOI:10.1021/jf030509o.
[2] 于伟, 张桂芳, 甄井龙, 等. 蓝靛果花色苷对高脂血症大鼠肝脏内与胆固醇代谢相关基因的作用[J]. 食品科学, 2018, 39(17): 171-176. DOI:10.7506/spkx1002-6630-201817028.
[3] RAUDSEPP P, ANTON D, ROASTO M, et al. The antioxidative and antimicrobial properties of the blue honeysuckle (Lonicera caerulea L.), Siberian rhubarb (Rheum rhaponticum L.) and some other plants, compared to ascorbic acid and sodium nitrite[J]. Food Control, 2013, 31(1): 129-135. DOI:10.1016/j.foodcont.2012.10.007.
[4] WANG Y, LI B, YANG L, et al. Effects of Lonicera caerulea berry extract on lipopolysaccharide-induced toxicity in rat liver cells: antioxidant, anti-inflammatory, and anti-apoptotic activities[J]. Journal of Functional Foods, 2017, 33: 217-226. DOI:10.1016/j.jff.2017.03.041.
[5] VASANTHA R P, JUAN Y L, BHULLARKHUSHWANT S, et al. Short communication: haskap (Lonicera caerulea): a new berry crop with high antioxidant capacity[J]. Canadian Journal of Plant Science, 2012, 92(7): 1311-1317. DOI:10.4141/CJPS2012-073.
[6] WANG Y H. Comparative analysis of the polyphenols profiles and the antioxidant and cytotoxicity properties of various blue honeysuckle varieties[J]. Open Chemistry, 2018, 16: 637-646. DOI:10.1515/chem-2018-0072.
[7] SENICA M, STAMPAR F, MIKULIC-PETKOVSEK M. Blue honeysuckle (Lonicera cearulea L. subs. edulis) berry: a rich source of some nutrients and their differences among four different cultivars[J]. Scientia Horticulturae, 2018, 238: 215-221. DOI:10.1016/j.scienta.2018.04.056.
[8] YU Y, SHEN M, SONG Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources: a review[J]. Carbohydrate Polymers, 2018, 183: 91-101. DOI:10.1016/j.carbpol.2017.12.009.
[9] 周思静, 刘桂君, 周敏, 等. 石斛多糖的研究进展[J]. 食品科学, 2018, 39(21): 316-322. DOI:10.7506/spkx1002-6630-201821047.
[10] SHI L. Bioactivities, isolation and purification methods of polysaccharides from natural products: a review[J]. International Journal of Biological Macromolecules, 2016, 92: 37-48. DOI:10.1016/j.ijbiomac.2016.06.100.
[11] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28: 350-356. DOI:10.1021/ac60111a017.
[12] WANG L, ZHANG B, XIAO J, et al. Physicochemical, functional, and biological properties of water-soluble polysaccharides from Rosa roxburghii Tratt fruit[J]. Food Chemistry, 2018, 249: 127-135. DOI:10.1016/j.foodchem.2018.01.011.
[13] ROMDHANE M B, HADDAR A, GHAZALA I, et al. Optimization of polysaccharides extraction from watermelon rinds: structure, functional and biological activities[J]. Food Chemistry, 2017, 216: 355-364. DOI:10.1016/j.foodchem.2016.08.056.
[14] YU Z Y, LIU L, XU Y Q, et al. Characterization and biological activities of a novel polysaccharide isolated from raspberry (Rubus idaeus L.) fruits[J]. Carbohydrate Polymers, 2015, 132: 180-186. DOI:10.1016/j.carbpol.2015.06.068.
[15] LIU W, WANG H, YU J P, et al. Structure, chain conformation, and immunomodulatory activity of the polysaccharide purified from Bacillus Calmette Guerin formulation[J]. Carbohydrate Polymers, 2016, 150: 149-158. DOI:10.1016/j.carbpol.2016.05.011.
[16] 齐睿婷. 竹茹多糖的分离纯化及其抗糖化作用研究[D]. 杭州: 浙江大学, 2015: 25-29.
[17] 孟凡钢, 杨振宇, 闫日红, 等. 大豆卵磷脂研究现状[J]. 大豆科技, 2013(2): 40-44. DOI:10.3969/j.issn.1674-3547.2013.02.014.
[18] 赵丽. 大豆种皮多糖的乳化特性及机制研究[D]. 锦州: 渤海大学, 2016: 1-2.
[19] 曹永强, 张健, 赵雯, 等. 植物乳杆菌胞外多糖的分离纯化及其乳化特性[J]. 食品科学, 2016, 37(17): 7-13. DOI:10.7506/spkx1002-6630-201617002.
[20] LI X Y, WANG L, WANG Y, et al. Effect of drying method on physicochemical properties and antioxidant activities of Hohenbuehelia serotina polysaccharides[J]. Process Biochemistry, 2016, 51(8): 1100-1108. DOI:10.1016/j.procbio.2016.05.006.
[21] HU H B, LIANG H P, WU Y. Isolation, purification and structural characterization of polysaccharide from Acanthopanax brachypus[J]. Carbohydrate Polymers, 2015, 127: 94-100. DOI:10.1016/j.carbpol.2015.03.066.
[22] FARHADI N. Structural elucidation of a water-soluble polysaccharide isolated from Balangu shirazi (Lallemantia royleana) seeds[J]. Food Hydrocolloids, 2017, 72: 263-270. DOI:10.1016/j.foodhyd.2017.05.028.
[23] 景永帅, 张瑞娟, 吴兰芳, 等. 北沙参多糖铁配合物的制备、结构特征及生物活性[J]. 食品科学, 2018, 39(24): 65-70. DOI:10.7506/spkx1002-6630-201824011.
[24] MAO C F, HSU M C, HWANG W H. Physicochemical characterization of grifolan: thixotropic properties and complex formation with Congo Red[J]. Carbohydrate Polymers, 2007, 68: 502-510. DOI:10.1016/j.carbpol.2006.11.003.
[25] WANG L, LI X Y, WANG B B. Synthesis, characterization and antioxidant activity of selenium modified polysaccharides from Hohenbuehelia serotina[J]. International Journal of Biological Macromolecules, 2018, 120: 1362-1368. DOI:10.1016/j.ijbiomac.2018.09.139.
[26] 叶丹蕾. 马齿苋多糖结构表征及其修复铅致学习记忆损伤的 研究[D]. 合肥: 合肥工业大学, 2018: 25.
[27] WANG X, ZHANG L S, DONG L L. Inhibitory effect of polysaccharides from pumpkin on advanced glycation end-products formation and aldose reductase activity[J]. Food Chemistry, 2012, 130(4): 821-825. DOI:10.1016/j.foodchem.2011.07.064.
[28] WANG P C, ZHAO S, YANG B Y, et al. Anti-diabetic polysaccharides from natural sources: a review[J]. Carbohydrate Polymers, 2016, 148: 86-97. DOI:10.1016/j.carbpol.2016.02.060.
[29] QIAN X P, ZHA X Q, XIAO J J, et al. Sulfated modification can enhance antiglycation abilities of polysaccharides from Dendrobium huoshanense[J]. Carbohydrate Polymer, 2014, 101(1): 982-989. DOI:10.1016/j.carbpol.2013.10.035.
[30] XU Y Q, GUO Y Y, GAO Y K, et al. Purification, characterization and antiglycation activity of a novel polysaccharide from black currant[J]. Food Chemistry, 2016, 199: 694-701. DOI:10.1016/j.foodchem.2015.12.078.