小麦面筋蛋白是由麦谷蛋白和醇溶蛋白通过二硫键连接组成的复合物,具有独特的黏弹特性[1],在面制品制作过程中发挥重要作用[2-3]:面粉加水混合过程中原先紧密堆积的面筋蛋白去折叠,肽链舒展并形成黏弹性网络将淀粉颗粒包裹其中,蛋白构象和蛋白可提取性发生改变[4]; 面筋的质量和数量,尤其是麦谷蛋白大聚体(glutenin macropolymer,GMP)的含量与面制品品质密切相关[5-6]。
用大豆蛋白均衡并丰富小麦蛋白中的氨基酸是常用的强化面制品营养的手段,但大豆蛋白的加入通常会影响面筋的网络结构,导致面团的流变学特性和面制品的品质发生改变[7-9]。同时,大豆中存在天然的抗营养素也影响了大豆蛋白在面制品中的应用[10],酶水解或质构化等改性方法处理可有效降低其中抗营养成分。酶水解使蛋白质中的肽键断裂生成小分子的多肽和氨基酸等,蛋白质的溶解度和生物活性物质增加[11-12];质构化处理是在高温高压和高剪切力作用下使蛋白质分子变性,相邻蛋白质分子间发生交联的几率增加,分子质量增大[13-14],其质构特性也发生变化。
基于此,本实验室前期对2 种改性大豆蛋白在添加到面粉中,发现添加水解大豆蛋白(soy protein hydrolyzate,SPH)的面条的蒸煮品质变差,而添加质构化大豆蛋白(texturized soy protein,TSP)在一定程度上改善了面条的蒸煮品质[7,15-17]。因此将TSP和SPH进行复配添加到面粉,以面条的质构特性和蒸煮品质为目标值,优化出TSP-SPH复配的比例及替代面粉量分别为6.0%和2.2%。在此基础上,分析TSP-SPH复合物对面粉粉质特性、面筋特性和面条品质的影响,考察面团流变学特性、蛋白组分和二硫键含量等变化,并与原面粉和分别添加TSP和SPH的面粉进行对比,探究大豆蛋白对面团特性及其对面条品质的影响机制,以期为面制品的品质改良提供一定理论参考。
1 材料与方法
1.1 材料、试剂与仪器
大豆分离蛋白(soy protein isolate,SPI) 山东谷神生物科技集团有限公司;金苑特一粉 郑州金苑面业有限公司;其他试剂均为分析纯。
TA-XTPlus型物性仪 英国Stable Micro System公司;DS32II双螺杆挤压机 济南赛信膨化机械有限公司;FOSS KJELTEC 2300全自动凯氏定氮仪 瑞典Foss Kjeltec公司;Gluten Index面筋指数仪 瑞典Perten公司;RS6000哈克流变仪 德国Thermo Fisher Haake公司。
1.2 方法
1.2.1 TSP和SPH的制备以及水解度的测定
参考豆洪启[18]的方法对SPI进行质构化处理,方法略有改动。物料含水量60%、挤压温度120 ℃、喂料速率50 r/min、出料速率50 r/min。参考崔会娟等[15]的方法制备SPH,加酶量1.0%,底物7.57%,酶解温度47.4 ℃,酶解pH 6.92,酶解时间15 min,水解结束后90 ℃灭酶15 min,冷却至室温,冷冻干燥,茚三酮比色法测得水解度为(4.54f 0.03)%。
1.2.2 混合粉的配制
TSP-SPH面粉:TSP替代面粉的量为6.0%,SPH替代面粉的量为2.2%,将TSP和SPH与面粉按上述比例混合均匀,备用。
TSP面粉:TSP替代面粉的量为8.2%,将TSP和面粉按比例混合均匀,备用。
SPH面粉:SPH替代面粉的量为8.2%,将SPH和面粉按比例混合均匀,备用。
1.2.3 面条制作与最佳蒸煮时间的确定
参考孙小红等[16]的方法。称取混合粉100 g,加水32 mL,搅拌5 min,使之呈絮状,25 ℃醒发20 min;调整电动压面条机,在压辊间距为2 mm的厚度下压片、合片成型,再调节压辊间距从3.5 mm至1.0 mm依次压片,之后切成宽度2.0 mm的面条备用。
蒸煮时间确定为面条煮至白芯刚消失的时间。
1.2.4 面条质构特性和蒸煮品质的测定
参考孙小红等[16]的方法略有改动。取在最佳蒸煮时间煮制的面条进行测定,HDP/PFS探头,压缩模式;测前速率2.0 mm/s,测试速率1.0 mm/s,测后速率 1.0 mm/s,压缩应变70%,两次压缩之间的时间间隔为1 s,触发力10 g。
蒸煮品质测定参考孙小红等[16]的方法。
1.2.5 面粉粉质特性和面筋特性的测定
分别参考GB/T 14614ü 2006《小麦粉 面团的物理特性 吸水量和流变学特性的测定 粉质仪法》和GB/T 5506.2ü 2008《小麦和小麦粉 面筋含量第2部分:仪器法测湿面筋》进行测定。
1.2.6 面团动态流变学特性的测定
参考Singh等[19]的方法并略有改动。按照1.2.3节方法制备1 mm厚的面片,将面片切成3.5 cmh 3.5 cm大小,置于直径30 mm平行板之间,去除多余部分。频率扫描参数:温度25 ℃,应变0.5%,扫描频率范围0.1~10 Hz。
1.2.7 面团中蛋白质组分含量的测定
参考Mueller等[5]的方法提取不同种类的蛋白质,略有改动。
清蛋白:1 g新鲜面团溶于10 mL蒸馏水中,水浴振荡提取30 min,5 000 r/min离心20 min,收集上清液。残渣分别用10 mL蒸馏水洗涤2 次,离心,合并上清液。
球蛋白:向上述残渣中加入10 mL 10%的氯化钠溶液,方法同清蛋白提取,提取3 次,合并上清液。其中清蛋白和球蛋白合并称为盐溶蛋白。
醇溶蛋白:向球蛋白提取的残渣中加入10 mL 75%的乙醇溶液,同前提取3 次,合并上清液。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)可溶性麦谷蛋白:向醇溶蛋白的残渣中加入10 mL 1.5%的SDS溶液,同前提取3 次,上清液中蛋白即为可溶性麦谷蛋白,沉淀中的蛋白质为GMP。
蛋白质的测定采用凯氏定氮方法,具体步骤参考 GB/T 5009.5ü 2016《食品中蛋白质的测定》,每种蛋白组分含量以占面团的百分比表示。
1.2.8 面团中游离巯基和二硫键含量的测定
参考Chan等[20]的方法略有改动。用0.2 mol/L的Tris-Gly缓冲溶液(pH 8.0,8 mol/L尿素,1% SDS,3 mmol/L 乙二胺四乙酸)配制2 mmol/L的L-半胱氨酸标准溶液,并进行梯度稀释,其浓度分别为0、0.01、0.02、0.03、0.04、0.05、0.06 mmol/L的标准溶液。分别取4 mL稀释后的标准溶液加入10 mmol/L 5,5’-二硫硝基苯甲酸(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)0.1 mL,室温条件下显色20 min,以蒸馏水做空白对照,在412 nm波长处测定吸光度,绘制标准曲线。
取0.5 g新鲜面团溶解于10 mL的0.2 mol/L Tris-Gly缓冲溶液中,4 000 r/min离心15 min,收集上清液。取上清液4 mL,加入10 mmol/L的DTNB溶液0.1 mL,显色20 min,在波长412 nm处测定吸光度,通过L-半胱氨酸标准曲线计算得到面团中游离巯基含量(μmol/g)。 另取上清液1 mL于4 mL缓冲液中,加入0.1 mL β-巯基乙醇混匀,25 ℃保温1 h后加入10 mL 12%三氯乙酸溶液混匀,25 ℃再次保温1 h,4 500 r/min离心15 min,弃去上清液,分别用5 mL三氯乙酸溶液洗沉淀2 次,沉淀物中加入10 mL缓冲液,复溶后加入0.1 mL DTNB,显色20 min,于412 nm波长处测定吸光度,以L-半胱氨酸标准曲线计算得到面团中总巯基含量(μmol/g)。
二硫键含量按式(1)计算:
1.2.9 面团分子间作用力的测定
参考Liao Lan等[21]的方法略有改动。利用面团蛋白质在不同溶剂中的溶解度评估蛋白质的分子间作用力,测定不同分子间作用力的溶剂配制方法如下:1)疏水性相互作用:30 mmol/L pH 8.0的Tris-HCl含1% SDS溶液;2)氢键:30 mmol/L pH 8.0的Tris-HCl含6 mol/L尿素;3)二硫键:30 mmol/L pH 8.0的Tris-HCl含2% β-巯基乙醇溶液;4)疏水性相互作用与二硫键:30 mmol/L pH 8.0的Tris-HCl含1% SDS溶液和2% β-巯基乙醇溶液;5)氢键与疏水性相互作用:30 mmol/L pH 8.0的Tris-HCl含6 mol/L尿素溶液和1% SDS溶液。
用牛血清蛋白分别添加到溶剂1~5中,再加入双缩脲试剂做标准曲线。将300 mg的新鲜面团加入上述溶液中磁力搅拌至面团完全溶解,4 000 r/min离心10 min。取上清液2 mL与2 mL 20%的三氯乙酸混合均匀,静置30 min后4 000 r/min离心10 min以除去上清液。将沉淀溶解在10 mL的0.5 mol/L NaOH溶液中,加入4 mL的双缩脲试剂,并在540 nm波长处测吸光度。分子间作用力按 式(2)计算:
式中:P为分子间作用力;n为查标曲或按照回归方程计算的蛋白质质量浓度/(mg/mL);c为单位体 积溶液中湿面团的质量浓度/(mg/mL);V1为上清液体积/mL;V2为沉淀复溶后的体积/mL。
1.3 数据处理
质构测试中每个样品至少重复测定6 次,其他指标测试每个样品至少重复3 次,实验结果表示为f s。采用SPSS 16.0和Excel软件进行数据处理和分析,均值的多重比较采用Duncan法,P<0.05,差异显著。
2 结果与分析
2.1 面条的质构特性和蒸煮品质
表 1 面条的质构特性和蒸煮品质
Table 1 Texture characteristics and cooking quality of noodles
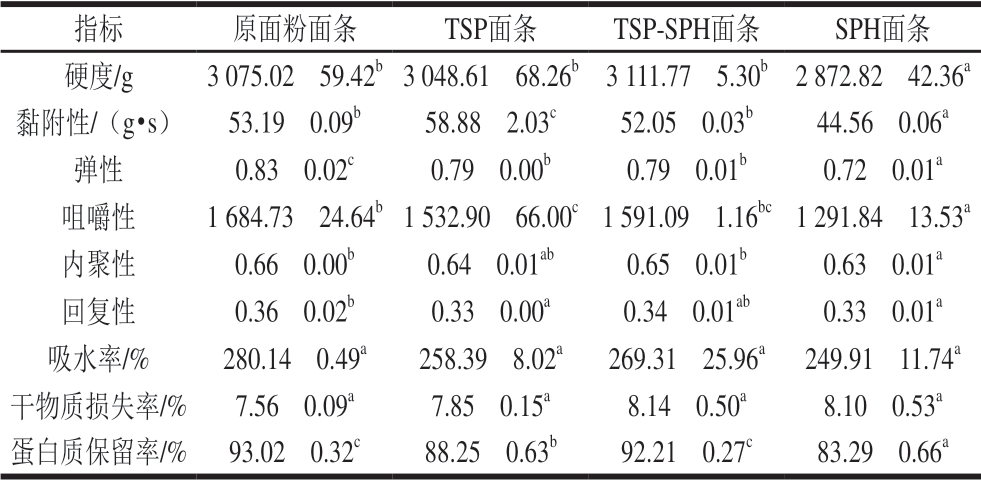
注:同行不同字母表示差异显著(P<0.05)。
指标 原面粉面条 TSP面条 TSP-SPH面条 SPH面条硬度/g 3 075.02f 59.42b 3 048.61f 68.26b 3 111.77f 5.30b 2 872.82f 42.36a黏附性/(g•s) 53.19f 0.09b 58.88f 2.03c 52.05f 0.03b 44.56f 0.06a弹性 0.83f 0.02c 0.79f 0.00b 0.79f 0.01b 0.72f 0.01a咀嚼性 1 684.73f 24.64b 1 532.90f 66.00c 1 591.09f 1.16bc 1 291.84f 13.53a内聚性 0.66f 0.00b 0.64f 0.01ab 0.65f 0.01b 0.63f 0.01a回复性 0.36f 0.02b 0.33f 0.00a 0.34f 0.01ab 0.33f 0.01a吸水率/% 280.14f 0.49a 258.39f 8.02a 269.31f 25.96a 249.91f 11.74a干物质损失率/% 7.56f 0.09a 7.85f 0.15a 8.14f 0.50a 8.10f 0.53a蛋白质保留率/% 93.02f 0.32c 88.25f 0.63b 92.21f 0.27c 83.29f 0.66a
如表1所示,与原面粉面条相比,TSP-SPH面条的弹性降低;与单独添加TSP的面条相比,TSP-SPH面条的黏附性降低,蛋白质保留率增大;与单独添加SPH的面条相比,TSP-SPH面条的硬度、弹性、黏附性和咀嚼性等质构指标以及面条的蛋白质保留率均显著提高。由此可知,3 种添加大豆蛋白的面条中,TSP-SPH面条在质构特性和蒸煮品质上最接近原面粉面条,与单独添加TSP或SPH的面条相比,TSP-SPH在一定程度上改善了面条的质构特性和蒸煮品质。面条的品质与面筋有很大的关系,He Ludan等[22]研究发现在制作过程中添加豆浆一方面可抑制冷冻过程中冰晶增大从而减小冰晶对面筋网络的损害,另一方面豆浆增强了面条的面筋网络结构并提高了面筋对淀粉颗粒的束缚能力,面条质量因此提高;Guo Xingfeng等[7]发现随着SPH在面粉中添加比例的增大,混合粉的面筋含量和面筋指数逐渐降低,SPH与麦谷蛋白通过二硫键形成小分子质量聚合物,抑制麦谷蛋白间二硫键的连接,蛋白网络形成受阻。据此推测:TSP、TSP-SPH和SPH对面团面筋网络产生不同程度的影响,TSP-SPH面条的蛋白质保留率与原面粉面条相比无显著性差异,与单独添加TSP或SPH的面条相比蛋白质保留率显著提高,说明与单独添加TSP或SPH的面条相比,TSPSPH与面筋蛋白相互作用可一定程度改善面筋特性。
2.2 TSP-SPH对面粉粉质特性和面筋特性的影响
表 2 TSP-SPH对面粉粉质特性和面筋特性的影响
Table 2 Effects of TSP-SPH on farinographic characteristics and gluten characteristics of dough
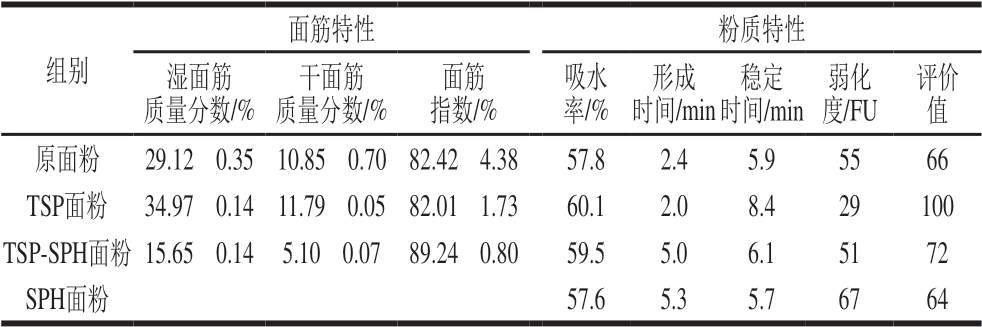
注:—.未检出。
组别面筋特性 粉质特性湿面筋质量分数/%干面筋质量分数/%面筋指数/%吸水率/%形成时间/min稳定时间/min弱化度/FU评价值原面粉 29.12f 0.35 10.85f 0.70 82.42f 4.38 57.8 2.4 5.9 55 66 TSP面粉 34.97f 0.14 11.79f 0.05 82.01f 1.73 60.1 2.0 8.4 29 100 TSP-SPH面粉15.65f 0.14 5.10f 0.07 89.24f 0.80 59.5 5.0 6.1 51 72 SPH面粉 ü ü ü 57.6 5.3 5.7 67 64
由表2可知,与原面粉相比,添加TSP-SPH面粉的湿面筋含量和干面筋质量分数分别降至15.65%和5.10%,面筋指数由82.42%增至89.24%,单独添加SPH的面粉中无面筋洗出,而单独添加TSP的面粉的湿面筋质量分数和干面筋质量分数分别增至34.97%和11.79%,面筋指数为由82.42%降至82.01%。以上数据说明SPH阻碍面筋网络的形成,单独添加SPH后面条的蛋白质保留率降低,是由于SPH阻碍面筋网络形成,面筋网络遭到破坏,小分子蛋白在蒸煮过程中流失;TSP与SPH复配在一定程度上缓解了SPH对面筋网络的弱化作用,同时验证了表1的推测:TSP-SPH在一定程度上改善面筋特性;而单独添加TSP的面粉面筋特性测定结果表明,TSP有助于面筋形成,但面条的蛋白质保留率下降,其部分原因在于TSP与面筋蛋白竞争吸水,在有限的水分供给时面筋蛋白未能完全水合,面筋网络形成受限。
与原面粉相比,添加TSP-SPH的面团弱化度减小7.4%,评价值增大9.1%,面团形成时间和稳定时间分别延长108.3%和3.4%;添加TSP的面团评价值最高,而添加SPH的面团评价值小,综合评价TSP-SPH和TSP改善了面粉粉质特性。而SPH对面粉粉质特性的影响结果与Schmiele等[23]的研究结果一致:添加SPH后面团形成时间延长,稳定时间缩短,且SPH与小麦蛋白发生作用,影响面筋网络水合,共价键和非共价键发生改变。
2.3 TSP-SPH对面团动态流变学特性的影响
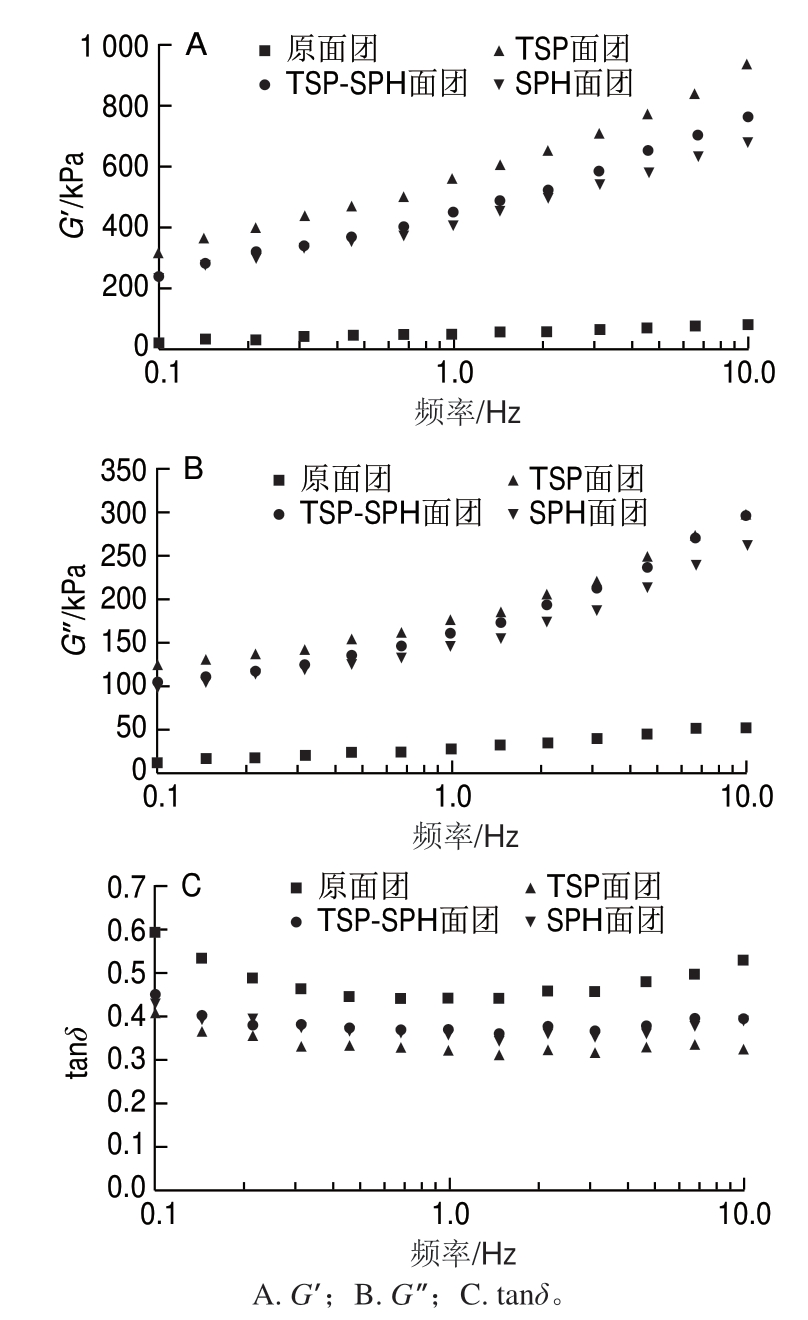
图 1 TSP-SPH对面团动态流变学特性的影响
Fig. 1 Effect of TSP-SPH on dynamic rheological properties of dough
由图1可知,面团的储能模量(G’)和损耗模量(G”)都表现出频率依赖性,即2 个模量随着扫描频率的增大而增大。在扫描频率范围内,样品的G’明显大于G”,即样品的弹性大于黏性,且大豆面团弹性和黏性符合SPH面团<TSP-SPH面团<TSP面团的顺序,这与粉质特性测定的粉质评价值的顺序一致(表2)。Singh等[19]研究发现蛋白质交联引起GMP含量的变化是导致G’和G”变化的主要原因,GMP含量增加会导致G’和G”增大。3 种添加大豆蛋白的面团的G’和G”均增大,推测是大豆蛋白与面筋蛋白交联使GMP含量增加。如图1C所示,tanδ是黏性组分与弹性组分的比值,tanδ值越小说明面团弹性组分越高[24-25]。tanδ值减小,说明面团弹性比例增加。综合评价,面团中加入TSP-SPH后G’和G”增大,tanδ值减小,即面团黏弹性增大,弹性比例提高。
2.4 TSP-SPH对面团中蛋白组分的影响
由图2可知,TSP-SPH面团醇溶蛋白、SDS可溶性麦谷蛋白以及盐溶蛋白含量与原面团相比无显著性差异,GMP质量分数较原面粉面团显著增大,由2.86%增至5.04%,TSP面团的GMP质量分数为4.35%,SPH面团的GMP质量分数为0.66%。GMP是面粉中最大的蛋白质聚合物,可通过疏水作用、氢键等作用方式与其他蛋白结合形成网络结构,在小麦蛋白的多种蛋白组分中GMP对面团特性和产品质量贡献最大[2,4,6]。TSP、TSP-SPH面团中GMP含量增大验证了大豆蛋白与面筋蛋白交联使GMP含量增加的推测(图1)。然而单独添加SPH的面团的GMP含量低于原面粉面团,结合图1 SPH面团的G′和G′′较原面粉面团增大的实验结果,与Singh等[19]的结论相驳:GMP含量增加会导致G′和G′′增大;造成这种差异的原因可能是研究对象不同,Singh等[19]研究的是从不同品种小麦粉中提取的面筋,而本实验的研究对象是面团。实验结果说明SPH面团中GMP的形成受阻,面筋网络结构弱化,与面筋特性测定结果相符(表2,SPH面团无面筋洗出)。SPH作为一种小分子可溶性蛋白,在蛋白组分分级提取过程中随盐溶蛋白一起被提取出来造成盐溶蛋白含量增加。而TSP由SPI经过质构化处理,相邻蛋白质分子间发生交联的几率增加[13,26],TSP可能通过二硫键与面筋蛋白交联,有利于面筋网络的形成,TSP面团的GMP含量较原面粉面团增加,与此对应单独添加TSP的面粉的面筋含量增加(表2),G’和G”增大(图1)。
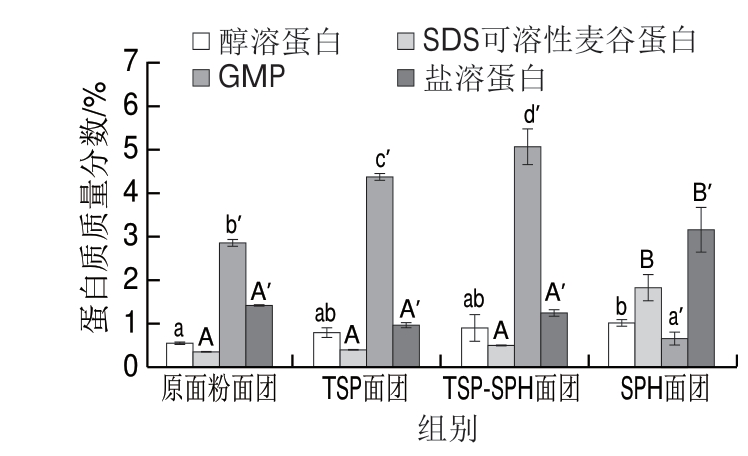
图 2 TSP-SPH对面团中蛋白组分的影响
Fig. 2 Effect of TSP-SPH on protein components in dough
不同字母表示差异显著(P<0.05)。
2.5 TSP-SPH对面团中游离巯基及二硫键含量的影响
表 3 TSP-SPH对面团中游离巯基及二硫键含量的影响
Table 3 Effect of TSP-SPH on the contents of free sulfhydryl groups
and disulfide bonds in dough μmol/g
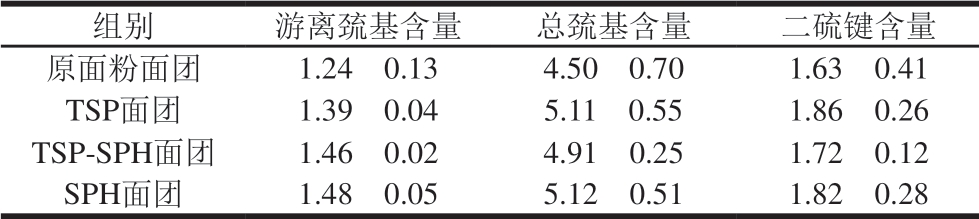
组别 游离巯基含量 总巯基含量 二硫键含量原面粉面团 1.24f 0.13 4.50f 0.70 1.63f 0.41 TSP面团 1.39f 0.04 5.11f 0.55 1.86f 0.26 TSP-SPH面团 1.46f 0.02 4.91f 0.25 1.72f 0.12 SPH面团 1.48f 0.05 5.12f 0.51 1.82f 0.28
研究认为二硫键和游离巯基的数量在一定程度上反映了面团形成期间面筋网络的交联程度,二者的相互转换和面筋网络的结构稳定性有关[27-28]。在面团形成过程中麦谷蛋白和醇溶蛋白中固的二硫键发生断裂和重组,同时游离巯基结合形成新的二硫键,二硫键增加促进面筋网络形成[27]。如表3所示,本实验添加大豆蛋白的面团与原面粉面团相比二硫键含量增加,说明面团中交联结构增加,这与图2中TSP-SPH和TSP面团的GMP含量较原面粉面团显著增加的结果相一致;Lamacchia等[29]也发现热处理后大豆粉中的大豆蛋白通过二硫键与小麦蛋白交联。而与原面粉面团相比,面团中添加SPH后二硫键数量增加,但GMP含量降低,这个结果看似矛盾,但SPH面团中醇溶蛋白和SDS可溶性麦谷蛋白含量显著增加(图2),面团中添加SPH后蛋白组分变化结果与Guo Xingfeng等[7]的实验结果一致,SPH与麦谷蛋白通过二硫键形成小分子质量聚合物,抑制麦谷蛋白间二硫键的连接,蛋白网络形成受阻。
2.6 TSP-SPH对面团中蛋白质分子间作用力的影响
表 4 TSP-SPH对面团中蛋白质分子间作用力的影响
Table 4 Effect of TSP-SPH on intermolecular interactions in dough
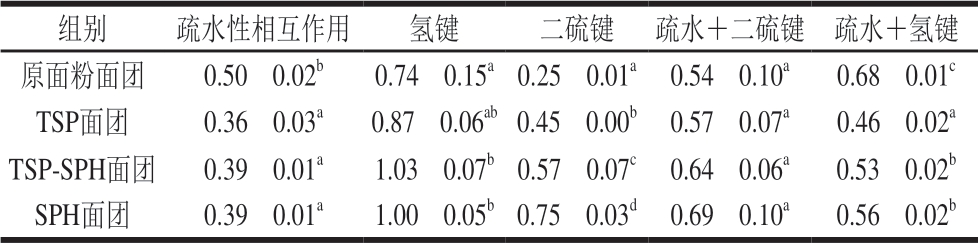
注:同列不同字母表示差异显著(P<0.05)。
组别 疏水性相互作用 氢键 二硫键 疏水+二硫键 疏水+氢键原面粉面团 0.50f 0.02b 0.74f 0.15a 0.25f 0.01a 0.54f 0.10a 0.68f 0.01c TSP面团 0.36f 0.03a 0.87f 0.06ab 0.45f 0.00b 0.57f 0.07a 0.46f 0.02a TSP-SPH面团 0.39f 0.01a 1.03f 0.07b 0.57f 0.07c 0.64f 0.06a 0.53f 0.02b SPH面团 0.39f 0.01a 1.00f 0.05b 0.75f 0.03d 0.69f 0.10a 0.56f 0.02b
为进一步探究TSP-SPH与面筋蛋白在面团中的相互作用,分析了TSP-SPH面团中分子间作用力变化,结果见表4。有研究证实,大豆和小麦蛋白通过共价键(二硫键)和非共价键相互作用 [30],其中疏水性相互作用是维持蛋白质三级结构的主要作用力[31]。Li Zhenni等[32]将糯米粉经过尿素和SDS等试剂处理后发现其形成的凝胶基质变弱,黏弹性降低,由此说明大豆面团非共价键的变化也是导致面团G’和G”变化的原因之一;加入大豆蛋白后,面团疏水性相互作用减弱,氢键和二硫键作用增强,对面团黏弹性的综合影响是大豆面团的黏弹性增大,弹性比例增加(图1)。面团中加入大豆蛋白后,面团中共价键和非共价键都发生显著变化,可见大豆蛋白和面筋蛋白通过共价键和非共价键共同维持面筋网络结构的稳定性。
3 结 论
与原面粉面条相比,TSP-SPH面条的弹性降低;3 种大豆面条中TSP-SPH面条在质构特性和蒸煮品质上最接近原面粉面条;与单独添加TSP或SPH相比,TSPSPH在一定程度上改善了面条的质构特性和蒸煮品质。与原面粉相比,TSP-SPH面粉的弱化度减小7.4%,评价值增大9.1%,面团形成时间和稳定时间分别增大108.3%和3.4%,湿面筋和干面筋质量分数分别降至15.65%和5.10%,面筋指数由82.42%增至89.24%。面团中加入TSP-SPH后G’和G”增大,tanδ值减小。TSP-SPH面团醇溶蛋白、SDS可溶性麦谷蛋白以及盐溶蛋白含量与原面团相比无显著性差异,GMP含量较原面粉面团显著增大。与原面粉面团相比,添加大豆蛋白的面团中氢键和二硫键数量增加,疏水性相互作用减弱,共价键和非共价键都发生显著变化。总之,TSP-SPH提高了面粉粉质特性、面筋指数、面团黏弹性和弹性比例;TSP-SPH通过二硫键与面筋蛋白相互作用,促进面团内部交联结构增加,GMP含量增大,在一定程度上缓解了单独使用SPH对面筋网络的弱化作用,面条品质得到改善。
[1] WIESER H. Chemistry of gluten proteins[J]. Food Microbiology, 2007, 24(2): 115-119. DOI:10.1016/j.fm.2006.07.004.
[2] WANG X Y, GUO X N, ZHU K X. Polymerization of wheat gluten and the changes of glutenin macropolymer (GMP) during the production of Chinese steamed bread[J]. Food Chemistry, 2016, 201: 275-283. DOI:10.1016/j.foodchem.2016.01.072.
[3] GEISSLITZ S, WIESER H, SCHERF K A, et al. Gluten protein composition and aggregation properties as predictors for bread volume of common wheat, spelt, durum wheat, emmer and einkorn[J]. Journal of Cereal Science, 2018, 83: 204-212. DOI:10.1016/j.jcs.2018.08.012.
[4] WANG P, JIN Z Y, XU X M. Physicochemical alterations of wheat gluten proteins upon dough formation and frozen storage: a review from gluten, glutenin and gliadin perspectives[J]. Trends in Food Science & Technology, 2015, 46(2): 189-198. DOI:10.1016/j.tifs.2015.10.005.
[5] MUELLER E, WIESER H, KOEHLER P. Preparation and chemical characterisation of glutenin macropolymer (GMP) gel[J]. Journal of Cereal Science, 2016, 70: 79-84. DOI:10.1016/j.jcs.2016.05.021.
[6] BARAK S, MUDGIL D, KHATKAR B S. Relationship of gliadin and glutenin proteins with dough rheology, flour pasting and bread making performance of wheat varieties[J]. LWT-Food Science and Technology, 2013, 51(1): 211-217. DOI:10.1016/j.lwt.2012.09.011.
[7] GUO X F, SUN X H, ZHANG Y Y, et al. Interactions between soy protein hydrolyzates and wheat proteins in noodle making dough[J]. Food Chemistry, 2018, 245: 500-507. DOI:10.1016/j.foodchem.2017.10.126.
[8] 郭兴凤, 张莹莹, 任聪, 等. 小麦蛋白质的组成与面筋网络结构、面制品品质关系的研究进展[J]. 河南工业大学学报(自然科学版), 2018, 39(6): 119-124. DOI:10.16433/j.cnki.issn1673-2383.2018.06.021.
[9] 冯蕾, 李梦琴, 李超然. SPI挂面特性与其蛋白质结构特征的相关性[J]. 现代食品科技, 2014, 30(1): 55-62. DOI:10.13982/j.mfst.1673-9078.2014.01.027.
[10] GU C M, PAN H B, SUN Z W, et al. Effect of soybean variety on anti-nutritional factors content, and growth performance and nutrients metabolism in rat[J]. International Journal of Molecular Sciences, 2010, 11(3): 1048-1056. DOI:10.3390/ijms11031048.
[11] 庞美蓉, 丁秀臻, 孔祥珍, 等. 胃蛋白酶水解大豆分离蛋白的研究[J]. 食品与发酵工业, 2012, 38(7): 103-107. DOI:10.13995/j.cnki.11-1802/ts.2012.07.033.
[12] COSCUETA E R, CAMPOS D A, OSÓRIO H, et al. Enzymatic soy protein hydrolysis: a tool for biofunctional food ingredient production[J]. Food Chemistry: X, 2019. DOI:10.1016/j.fochx.2019.100006.
[13] 石彦国. 食品挤压与膨化技术[M]. 北京: 科学出版社, 2011: 111-118.
[14] FANG Y Q, ZHANG B, WEI Y M. Effects of the specific mechanical energy on the physicochemical properties of texturized soy protein during high-moisture extrusion cooking[J]. Journal of Food Engineering, 2014, 121: 32-38. DOI:10.1016/j.jfoodeng.2013.08.002.
[15] 崔会娟, 王璐, 郭兴凤. 大豆蛋白酶水解产物对面粉糊化特性的影响[J]. 河南工业大学学报(自然科学版), 2015, 36(1): 40-44. DOI:10.16433/j.cnki.issn1673-2383.2015.01.009.
[16] 孙小红, 崔会娟, 王瑞红, 等. 大豆蛋白酶水解产物的添加量对面粉及面条品质的影响[J]. 河南工业大学学报(自然科学版), 2016, 37(2): 44-49. DOI:10.16433/j.cnki.issn1673-2383.2016.02.009.
[17] 王瑞红, 朱笛, 陈复生, 等. 质构化大豆蛋白对面粉糊化特性及面条品质的影响[J]. 河南工业大学学报(自然科学版), 2017, 38(2): 33-39. DOI:10.16433/j.cnki.issn1673-2383.2017.02.006
[18] 豆洪启. 挤压膨化大豆工艺及其品质的研究[D]. 郑州: 河南工业大学, 2013: 43-59.
[19] SINGH S, SINGH N. Relationship of polymeric proteins and empirical dough rheology with dynamic rheology of dough and gluten from different wheat varieties[J]. Food Hydrocolloids, 2013, 33(2): 342-348. DOI:10.1016/j.foodhyd.2013.04.007.
[20] CHAN K Y, WASSERMAN B P. Direct colorimetric assay of free thiol groups and disulfide bonds in suspensions of solubilized and particulate cereal proteins[J]. Cereal Chemistry, 1993, 70(1): 22-26. DOI:10.1021/bp00019a017.
[21] LIAO L, LIU T X, ZHAO M M, et al. Aggregation behavior of wheat gluten during carboxylic acid deamidation upon hydrothermal treatment[J]. Journal of Cereal Science, 2011, 54(1): 129-136. DOI:10.1016/j.jcs.2011.01.017.
[22] HE L D, GUO X N, ZHU K X. Effect of soybean milk addition on the quality of frozen-cooked noodles[J]. Food Hydrocolloids, 2019, 87: 187-193. DOI:10.1016/j.foodhyd.2018.07.048.
[23] SCHMIELE M, ARAUJO T L, GURGUEIRA M D, et al. Determination of the concentration of different solvents systems in the protein solubilization of meat analogue[J]. Ciencia Rural, 2015, 45(6): 1120-1125. DOI:10.1590/0103-8478cr20131630.
[24] LI M, ZHU K X, PENG J, et al. Delineating the protein changes in Asian noodles induced by vacuum mixing[J]. Food Chemistry, 2014, 143(2): 9-16. DOI:10.1016/j.foodchem.2013.07.086.
[25] 邹奇波, 袁永利, 黄卫宁. 食品添加剂对面团动态流变学及冷冻面团烘焙特性的影响研究[J]. 食品科学, 2006, 27(11): 35-40. DOI:10.3321/j.issn:1002-6630.2006.11.002.
[26] KRISTIAWAN M, MICARD V, MALADIRA P, et al. Multi-scale structural changes of starch and proteins during pea flour extrusion[J]. Food Research International, 2018, 108: 202-215. DOI:10.1016/j.foodres.2018.03.027.
[27] LAMACCHIA C, BAIANO A, LAMPARELLI S, et al. Polymeric protein formation during pasta-making with barley and semolina mixtures, and prediction of its effect on cooking behaviour and acceptability[J]. Food Chemistry, 2011, 129(2): 319-328. DOI:10.1016/j.foodchem.2011.04.063.
[28] WANG K Q, LUO S Z, CAI J, et al. Effects of partial hydrolysis and subsequent cross-linking on wheat gluten physicochemical properties and structure[J]. Food Chemistry, 2016, 197(Pt A): 168-174. DOI:10.1016/j.foodchem.2015.10.123.
[29] LAMACCHIA C, BAIANO A, LAMPARELLI S, et al. Study on the interactions between soy and semolina proteins during pasta making[J]. Food Research International, 2010, 43(4): 1049-1056. DOI:10.1016/j.foodres.2010.01.016.
[30] RIBOTTA P D, LEON A E, PEREZ G T, et al. Electrophoresis studies for determining wheat-soy protein interactions in dough and bread[J]. European Food Research and Technology, 2005, 221(1): 48-53. DOI:10.1007/s00217-005-1135-2.
[31] NICK PACE C, FUH L, FRYAR K L, et al. Contribution of hydrophobic interactions to protein stability[J]. Journal of Molecular Biology, 2011, 408(3): 514-528. DOI:10.1016/j.jmb.2011.02.053.
[32] LI Z N, WANG L, CHEN Z X, et al. Impact of binding interaction characteristics on physicochemical, structural, and rheological properties of waxy rice flour[J]. Food Chemistry, 2018, 266: 551-556. DOI:10.1016/j.foodchem.2018.05.010.