多酚与果胶是食品中常见的成分,且都具有良好的生物活性,拥有减肥、降血糖、抗癌、防辐射等 功效[1-3]。果胶是由聚α-(1,4)-D-半乳糖醛酸与甲酯形式的羧基组成,平均分子质量为50 000~150 000 Da的聚合物多糖[4]。果胶根据酯化程度可分为高酯果胶和低酯果胶(low ester pectin,LEP)[5]。高甲氧基果胶是指酯化度大于50%的果胶,而酯化度小于50%的则为LEP。果胶的甲氧基含量高低决定了高酯果胶和LEP的不同性质和不同的凝胶机制[6-7]。而因仅需要少量的可溶性固形物和一定量的多价金属离子即可形成凝胶的凝胶机制,常被作为胶凝剂应用于生产低糖低热量健康食品[8]。此外,LEP在医药品、化妆品等领域应用范围也相当广阔,其作为安全的食品添加剂用于制造健康食品、保健品的前景广阔,消费者诉求广泛,在市场上供不应求,所占市场份额逐年增长。果胶有较多功能特性,研究表明,LEP作为一种健康安全的可溶性膳食纤维可以预防多种疾病,如糖尿病和结肠癌[9]。用不同方法改性后的LEP还被证明具有抗癌、降低胆固醇、减少体内重金属离子含量等作用,还可在生物体内作细胞载体、药物载体,具备一定的抗凝血功效[10]。
多酚是水果、蔬菜中常见且含量丰富的生物活性物质,其作为抗氧化剂在食品、医药品中的应用也越来越普遍。根皮苷是根皮素的葡萄糖苷,化学式为C12H24O10•2H2O,属于二氢查尔酮类物质,是苹果多酚的重要特征组分,主要分布在苹果属植物中,而在其他属中只有少量[11]。研究表明根皮苷及其衍生物具有降血糖、降脂减肥、抗炎、抗氧化、改善肝纤维化、提高膜通透性等作用[12-15]。因此被广泛应用于食品、饮料、食品添加剂、医药和化妆品中。近年来关于多酚-果胶间相互作用及多酚-果胶复合物的功能特性的研究越来越受到关注。研究表明结构上不同的多酚可以与果胶大分子结合,果胶可借助与酚酸及其他可能的多酚化合物的共价连接交联构建空间三维结构[16]。梁迪等[17]研究表明,加入苹果多酚后,多酚-果胶复合膜液的抗氧化性增强,表观黏度增加,机械强度增强。Xu Juan等[18]研究表明,制备多种尺寸的果胶/多酚珠可用于水下软物质的无污染荧光跟踪;Soohwan等[19]研究表明使用Ca2+进行多酚缀合果胶后,缀合物相比纯果胶水凝胶有更高的剪切模量和抗氧化性质。通过自由基清除实验可证实多酚在与果胶偶联后仍具有抗氧化活性[20]。因此多酚-果胶复合物在生物医学、化妆品、食品和制药工业等各领域具有新的应用潜力。而LEP作为结构复杂的大分子质量多糖化合物,其凝胶特性及流变学特性决定了其实际应用 方式[21-22]。为了探究苹果多酚的重要特征组分根皮苷对LEP凝胶、流变性的影响,考察与根皮苷复合后LEP-根皮苷复合物的抗氧化活性以及微观结构的变化,为 LEP-多酚类化合物复配体系的开发及其在食品、药品领域的应用提供理论参考依据。本实验以LEP和根皮苷的复合物为原料,研究不同根皮苷添加量条件下根皮苷-LEP复合凝胶的流变性、质构特性、抗氧化性及微观结构的变化,从而确定该复合凝胶在生产过程中的最适添加量,为根皮苷-LEP体系的应用提供理论参考依据。
1 材料与方法
1.1 材料与试剂
低酯苹果果胶(酯化度20%) 上海天宸生物科技有限公司;根皮苷(纯度98%) 成都康辉生物科技有限公司;ABAP(纯度97%)、DCFH-DA 上海麦克林生物科技有限公司。其余试剂均为国产分析纯。
1.2 仪器与设备
AX124ZH/E电子天平 奥豪斯(常州)有限公司;NB-HJ-6A多头磁力搅拌器 郑州南北仪器设备有限 公司;Infinite M200PRO酶标仪 美国Thermo公司;S4800扫描电子显微镜 日本日立公司;Brookfield CT-3质构仪 中科美仪(北京)科技有限公司;DHR-1流 变仪 美国TA公司。
1.3 方法
1.3.1 样品制备
使用无水乙醇溶解根皮苷,加入pH值为4.2的柠檬酸-柠檬酸钠缓冲溶液,加热至60 ℃,在1 000 r/min磁力搅拌条件下缓慢加入LEP-蔗糖混合粉末,65 ℃磁力搅拌1.5 h,使LEP完全溶解。缓慢滴入氯化钙,70 ℃继续磁力搅拌30 min。最终配制成100 mL体积分数15%乙醇溶液,LEP质量分数为1%,蔗糖质量为15 g,氯化钙含量为45 mg/g,根皮苷添加量分别为0%、0.05%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%的根皮苷-LEP复合凝胶体系,在4 ℃冰箱中静置24 h,待测。
1.3.2 质构性测定
使用质构仪对根皮苷-LEP复合凝胶体系进行分析[23]。采用TPA测试模式,使用P/0.5探头,测前速率1.00 mm/s;测试速率1.00 mm/s;返回速率1.00 mm/s,触发力35 g;压缩变形程度为40%。每组样品测试3 次,结果取平均值。
1.3.3 流变性测定
参考相关文献[24-25],采用平板-平板测量系统,平行板直径40 mm,设置间隙1 mm,使用称量勺挖取适量样品于平行板上,待平行板下压后,刮去多余样品,使用甲基硅油密封防止水分蒸发。
静态剪切流变测定:在25 ℃条件下,设置剪切速率从0~300 s-1上升,再从300~0 s-1下降,测定过程中剪切应力和黏度的变化情况。采用Power-Law模型对所得数据点进行拟合,用R2表示方程拟合精度。Power-Law方程如式(1)所示:
式中:σ为剪切应力/Pa;K为稠度系数/(Pag sn);γ为剪切速率/s-1;n为流体指数。
动态黏弹性测定:在25 ℃条件下,设置扫描应变值为1%,振荡频率设定为0~10 Hz,测定不同样品损耗角正切tanδ的变化情况。
在25 ℃条件下,设置扫描应变值为1%,振荡角频率设定为0~100 rad/s,测定储能模量(G’)、损耗模量(G”)的变化情况。
动态时间扫描测定:设置温度为25 ℃,固定振荡频率1 rad/s,扫描应变1%,观察不同样品的G′、tanδ在3 600 s内的变化。
动态温度扫描测定: 设置温度扫描范围25~80 ℃,以2 ℃/min的速率从80 ℃开始降温,固定振荡频率1 Hz,保留时间300 s,观察不同样品的G′与tanδ随温度的变化情况。
1.3.4 过氧化氢自由基清除能力(hydrogen peroxide radical scavenging capacity,HPSC)分析
取893 μL 1.0 mmol/L KOH溶液于10 mL试管,再加107 μL 2.48 mmol/L DCFH-DA,混匀,避光反应5 min(可以用锡箔纸包裹),然后加7 mL磷酸缓冲溶液(pH 7.4),获得DCFH溶液,待用。称取0.275 g ABAP,溶解在5 mL的缓冲溶液中,现用现配制成200 mmol/L的ABAP溶液,在4 ℃条件下,可保存4~6 h。用磷酸缓冲液将样品稀释成300 倍的样液,加入60 μL样液到96 孔板上,再加入60 μL DCFH。将96 孔板放入到荧光酶标仪中进行测定,每孔加入40 μL 200 mmol/L的ABAP。反应在40 min内达到最大荧光性。采用Ascent软件处理数据。计算平均荧光面积(对于提取液和标准品的反应时间动力学曲线AUC)并且计算抗氧化能力。根据式(2)计算抗氧化能力[26]:
式中:SA为样品和标准品的荧光积累量;CA为空白对照的荧光积累量。
由剂量-反应曲线计算出样品的EC50值(每个样品引起50%抑制(HPSC=0.5)所需要的剂量)。 用μmol/mL表示样品抗氧化能力,以VC计,每个样品至少平行测定3 次。
1.3.5 微观结构的观察
将制好样品平铺于培养皿中,放入超低温冰箱中冷冻,再转移至-50 ℃真空冷冻干燥机内,冷冻干燥72 h。将干燥后的样品固定在双面导电的样品台上,使用离子溅射仪使样品具有导电性。在3 000放大倍率下,使用扫描电子显微镜观察样品微观结构,选择具有代表性的视野记录拍照[27]。
1.4 数据处理
所得数据使用Origin 8.0和Microsoft Excel软件绘制相关图表。每次测试前需更换样品,且每组实验均重复3 次。
2 结果与分析
2.1 根皮苷对LEP质构特性的影响
表 1 根皮苷添加量对根皮苷-LEP复合体系的硬度、弹性和胶黏性的影响
Table 1 Hardness, elasticity and gumminess of phlorizin-LEP mixed systems with different concentrations of phlorizin

注:同列不同字母表示差异显著(P<0.05)。
根皮苷添加量/% 硬度/g 弹性 胶黏性/g 0.00 22.073f 0.875 5a 0.329f 0.003a 19.269f 0.378a 0.05 22.495f 0.517 6ab 0.348f 0.005 8b 19.531f 1.032 7ab 0.10 22.768f 0.251 1ab 0.383f 0.003 7c 20.576f 1.133 3bc 0.15 22.95f 0.622 2ab 0.403f 0.002 4c 20.995f 0.608 9cd 0.20 23.002f 0.763 9abc 0.432f 0.010 7d 21.573f 0.332 1cde 0.25 23.309f 0.317 8bc 0.439f 0.001 8de 22.074f 0.901 3def 0.30 23.532f 0.880 6bc 0.445f 0.004 1ef 22.702f 0.530 91ef 0.35 23.632f 0.252 7bc 0.452f 0.007fg 22.911f 0.437 6f 0.40 24.117f 0.359 6c 0.458f 0.003 3g 23.369f 0.624 9f
如表1所示,随着根皮苷添加量从0.05%增加至0.40%,体系硬度、弹性和胶黏性呈上升趋势。这说明根皮苷添加量从0.00%增加到0.40%的过程中,始终可以增强LEP的凝胶强度。
2.2 根皮苷对LEP流变特性的影响
2.2.1 静态剪切流变特性

图 1 根皮苷-LEP复合体系剪切应力随剪切速率变化曲线
Fig. 1 Shear stress versus shear rate curves of phloretin-LEP mixed systems
表 2 根皮苷-LEP复合体系Power-Law方程拟合参数
Table 2 Power-Law parameters for phloretin-LEP mixed systems

根皮苷添加量/% 稠度系数/(Pag sn) 流体指数 决定系数(R2)0.00 5.591 4/5.615 9 0.360 2/0.361 9 0.978 7/0.967 1 0.05 6.466 8/6.348 7 0.341 4/0.347 6 0.962 2/0.991 4 0.10 7.916 7/7.885 2 0.315 7/0.314 2 0.938 7/0.981 9 0.15 9.127 4/8.297 9 0.297 9/0.316 3 0.951 7/0.948 2 0.25 11.043 9/11.051 7 0.275 4/0.277 2 0.965 7/0.924 8 0.30 16.757 8/15.974 0 0.223 1/0.234 5 0.946 9/0.971 3 0.35 21.653 8/20.943 7 0.184 6/0.188 2 0.959 9/0.935 7 0.40 24.373 9/24.224 4 0.167 2/0.167 1 0.957 6/0.922 1
由图1可知,随着剪切速率的增大,复合体系的剪切应力随之增大。根皮苷添加量越高,复合体系剪切应力越大。在升速和降速的过程中,曲线走势较为重合,这表明该体系具有良好的触变性能[28]。在根皮苷添加量从0.00%增加到0.40%过程中,体系的剪切应力随之逐渐增大,当根皮苷的添加量从0.00%增加到0.10%时,体系的剪切应力小幅增加,继续添加根皮苷至0.30%,剪切应力增幅变大,根皮苷添加量从0.30%继续增加到0.40%时,体系的剪切应力增幅逐步减缓。体系随着剪切速率的增加黏稠度逐渐降低,表现出典型的剪切变稀的非牛顿流体的特性。与不添加根皮苷的对照组相比,添加根皮苷的LEP凝胶体系的黏度增加。这可能是因为,一部分的LEP在溶液中呈现出链状结构,与Ca2+相互缠结,形成“蛋盒”模式结合区[29],而另一部分带负电荷的LEP与根皮苷通过静电作用结合,LEP中部分甲基与根皮苷的吡喃杂环(C环)之间发生了一定的疏水相互作用,同时在根皮苷的羟基与LEP的毛状区域之间产生了大量的氢键,使得分子间作用力逐渐增强,分子链间以及分子间的相互缠结也加剧[30]。根皮苷的加入可能导致了更多的果胶大分子链内与链间相互缠结增多,产生了根皮苷-LEP复合凝胶体系,使得由分子间相对运动引起的体系流动阻力增大,令体系剪切难度增大从而使体系黏度增加[31]。
根据Power-Law模型对数据点进行拟合,由表2可知,决定系数R2均在大于0.92,这表明模型具有较高的拟合精度。曲线流体指数小于1,表示在剪切速率的变化范围(0~300 s-1)内,体系属典型的假塑性流体。添加根皮苷后,复合凝胶体系的稠度系数升高,随着根皮苷添加量的提高,体系表观黏度也增大,流体指数减小。流体指数代表流体假塑性程度,说明随着根皮苷添加量的提升,体系表现出更强的假塑性,剪切变稀现象 增强[32]。这可能是因为根皮苷和LEP与水之间发生了大量的氢键联结,形成了致密稳定的三维空间结构,使得体系的黏度升高。
2.2.2 动态黏弹流变特性
通过动态流变学的特性研究根皮苷-LEP复合凝胶体系的动态黏弹性,利用动态黏弹性借以表征果胶与根皮苷之间的三维网络结构[33]。G’为样品弹性的反映指标,G”为样品黏性的反映指标[34]。由图2A可知,体系的G’和G”均随角频率的增加而增加,并且G’均大于G”,说明体系主要表现为弹性[35],胶体行为较为突出[36]。同时也能发现随着根皮苷添加量增加,体系的G’和G”均有提高,说明体系的弹性逐渐增强。这可能是由于大量根皮苷加入之后,与LEP和水之间存在氢键作用力,加强了果胶的凝胶结构,形成了空间位阻[37],由于网状结构的形成,复合体系弹性性能增强。高分子化合物中,分子内部的摩擦力会导致链状分子运动滞后,与交变应力的运动产生不一致的现象,因此会产生应力与应变的相位差角损耗角δ,tanδ即为G”与G’的比值[38]。如图2B所示,体系tanδ随着频率增大而下降,说明频率越大,LEP的链间运动越易发生,tanδ值均在0.1~1之间,表明样品主要显现出弹性,这是典型的弱凝胶体系特征[39],当添加量从0.10%增加到0.30%时,弹性增强现象更加突出。可能是由于这期间根皮苷与果胶间相互作用大范围发生。而添加量从0.30%变化到0.40%时,这种增强趋势减弱,说明根皮苷与果胶的作用位点逐步饱和,其增强果胶凝胶性能作用不再明显。

图 2 根皮苷-LEP复合体系动态模量(A)和tanδ(B)随频率变化曲线
Fig. 2 Curves of dynamic modulus (A) and tanδ (B) of phloretin-LEP
mixed systems as a function of frequency
2.2.3 动态温度扫描
由图3可知,随着温度的升高,G’不断减小,体系的弹性降低,可能是由于温度升高导致了果胶内部凝胶结构的巨大变化[40]。高温下,体系分子运动剧烈,果胶分子链间相互缠绕被打乱,导致凝胶强度降低,弹性性能变小,低温下具有较高G’,说明低温时分子内部结构较为有序,凝胶强度较强。添加根皮苷的果胶凝胶与单一的果胶凝胶体系相比有着相对较高的G’,在根皮苷添加量为0.1%~0.3%时增加显著,而添加量大于0.3%后,体系的G’增加趋势变缓。适量的根皮苷能够使果胶凝胶分子间交联作用加强,这可能是因为根皮苷分子中存在较多羟基,增加凝胶分子间氢键的形成,使凝胶结构致密,不易被高温破坏。

图 3 根皮苷-LEP复合体系G’随温度变化曲线
Fig. 3 Curves of storage modulus of phloretin-LEP mixed systems as a function of temperature
2.2.4 动态时间扫描
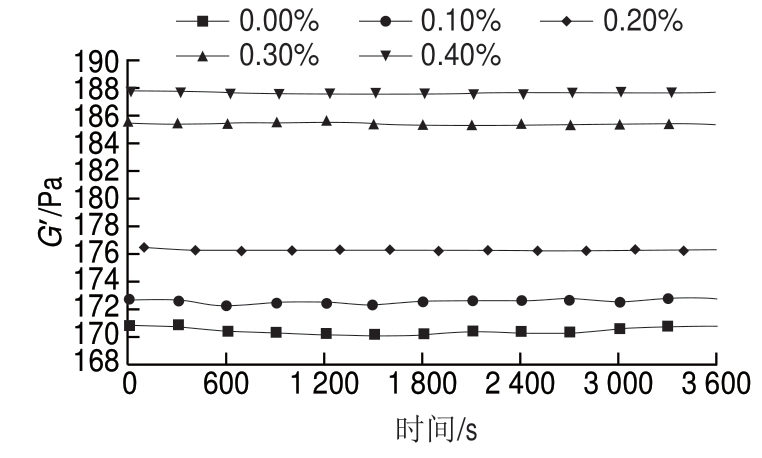
图 4 根皮苷-LEP复合体系G’随时间变化曲线
Fig. 4 Time-dependent curves of storage modulus of phloretin-LEP mixed systems
由图4可知,随着根皮苷添加量的增大,体系的G’增大。这可能是由于根皮苷分子中的羟基与LEP毛状区域间存在氢键导致分子间交联作用加强,使凝胶结构致密,当根皮苷添加量从0.20%增加至0.30%时这一现象更为显著,这与动态黏弹体现出的性质相一致。
2.3 根皮苷对LEP-HPSC的影响
如图5所示,空白对照为不添加根皮苷与蔗糖的果胶溶液,阳性对照为仅添加蔗糖制备的果胶溶液,空白对照的HPSC为1.486 1 μmol/mL,添加蔗糖制备的阳性对照则为1.517 0 μmol/mL,说明15%的蔗糖添加量对复合体系产生了少量的抗氧化性影响,但并不显著。对比相同根皮苷与蔗糖添加量的根皮苷溶液和根皮苷-LEP复合体系的抗氧化性,可以发现,在与LEP复合之后,复合体系的抗氧化性略优于单独根皮苷-蔗糖或者单独果胶-蔗糖体系,说明两者的复合可能发生了一定的协同抗氧化作用。从整体看,随着根皮苷添加量的增加,无论是根皮苷溶液还是根皮苷-LEP复合体系的HPSC均呈现上升趋势,可能是由于根皮苷添加量受其溶解度限制而添加较少,稀释倍数较大,使得上升幅度较小,但是上升趋势较为明显,说明该实验结果可信。这可能是由于根皮苷与LEP复合后,促使果胶形成了更为稳定的结构,从而对根皮苷产生了保护作用,因而提升了彼此的抗氧化能力。

图 5 不同根皮苷添加量样品的HPSC
Fig. 5 HPSC of phloretin-LEP mixed systems
2.4 根皮苷对低酯苹果果胶微观结构的影响

图 6 根皮苷-LEP复合体系扫描电子显微镜图(×3 000)
Fig. 6 SEM photomicrographs of phloretin-LEP mixed systems (× 3 000)
A~E.根皮苷添加量分别为0.0%、0.10%、0.20%、0.30%、0.40%。
如图6A所示,当不添加根皮苷时凝胶表面粗糙,而与根皮苷结合的果胶表面变得光滑,这说明添加的根皮苷对果胶多糖链结构产生了影响[41]。图6B~E可以看出,根皮苷的加入对复合体系微观结构的影响较为明显,随着根皮苷添加量的增大,凝胶结构中孔隙增多,结构变得更加致密,连续性增强。由图6B可看出,添加0.10%的根皮苷后,复合体系内部产生了较为明显的孔状结构,但其余部分的平滑区域仍旧较多;当根皮苷添加量为0.20%时,大部分的平滑区域内已经产生较为明显的空隙,已有出现蜂窝状结构的趋势(图6C)。由图6D、E可以看出,当根皮苷添加量为0.30%时已经出现了规整致密的蜂窝网状结构,当根皮苷添加量达到40%时,这种结构更加均匀,空隙更加匀称,形状更加规整。其对应了流变学测定的结果。当根皮苷添加量从0.10%上升到0.30%时,根皮苷与LEP之间通过氢键相互作用开始形成网状三维结构,当添加量达到0.30%时该结构已经基本形成,继续添加对其影响减小。随着添加量的增大可以发现体系中平滑的LEP结构有所减少,呈现更加明显的蜂窝结构,体系中孔洞开始变得规则而致密的,链状果胶之间形成的架构的连续性增强,体系在宏观上表现出弹性增大,凝胶结构更加稳定,与流变学测定的结果相吻合,并从一定程度上可以解释根皮苷与LEP复合后抗氧化能力协同增强的现象。
3 结 论
采用质构和流变学方法分析了根皮苷对LEP凝胶性能的影响。结果表明,添加根茎苷对果胶凝胶的G’、G”和tanδ值均都有影响,随着根皮苷添加量的增加,根皮苷-LEP复合凝胶体系的硬度、胶黏性、弹性均增加,凝胶强度增强。在整个添加范围内,随着根皮苷添加量的增加,形成了复合凝胶体系。G’、G”和tanδ值均随之增大,表现出更强的凝胶强度,表明根皮苷的添加有利于果胶的形成。
考察不同添加量的根皮苷对根皮苷-LEP复合体系抗氧化能力的影响,发现根皮苷与LEP复合后,两者之间产生了协同抗氧化作用,并且根皮苷添加量越多,复合体系抗氧化能力越强。
采用扫描电子显微镜观察凝胶的微观形貌。结果表明,随着根皮苷添加量的增加,果胶凝胶产生了更多的网状结构,且当根皮苷添加量在0.30%以上,该结构表现得更加均匀致密。说明根皮苷的加入使得果胶形成了稳定的三维网状结构。
本研究实验结果说明,酸性条件下制备低酯苹果果胶,适量添加根皮苷,可促进低酯钙果胶凝胶的形成,增强其凝胶强度,复合体系具有更加稳定的结构。根皮苷可提高LEP的抗氧化性,为根皮苷-LEP体系的应用提供理论依据。有必要进一步研究根皮苷-LEP在不同产品中的作用,拓宽根皮苷-LEP复合凝胶体系在功能性食品行业中的应用。
[1] SAMOUT N, BOUZENNA H, DHIBI S, et al. Therapeutic effect of apple pectin in obese rats[J]. Biomedicine & Pharmacotherapy, 2016, 83: 1233-1238. DOI:10.1016/j.biopha.
[2] LECLERE L, CUTSEM P V, MICHIELS C. Anti-cancer activities of pH- or heat-modified pectin[J]. Frontiers in Pharmacology, 2013, 4(4): 128. DOI:10.3389/fphar.
[3] NAQASH F, MASOODI F A, RATHER S A, et al. Emerging concepts in the nutraceutical and functional properties of pectin: a review[J]. Carbohydrate Polymers, 2017, 168: 227-239. DOI:10.1016/j.carbpol.
[4] YAN J, DU Y, ZHU X, et al. Physicochemical and comparative properties of pectins extracted from Akebia trifoliata var. australis peel[J]. Carbohydrate Polymers, 2012, 87(2): 1663-1669. DOI:10.1016/j.carbpol.
[5] MATIA-MERINO L, LAU K, DICKINSON E. Effects of lowmethoxyl amidated pectin and ionic calcium on rheology and microstructure of acid-induced sodium caseinate gels[J]. Food Hydrocolloids, 2004, 18(2): 271-281. DOI:10.1016/S0268-005X(03)00083-3.
[6] 方小东. 果胶凝胶机理及影响凝胶的因素[J]. 食品科学, 1983, 4(11): 34-36.
[7] WILLATS W G T, KNOX J P, MIKKELSEN J D. Pectin: new insights into an old polymer are starting to gel[J]. Trends in Food Science & Technology, 2006, 17(3): 97-104. DOI:10.1016/j.tifs.
[8] JEAN P V, SCHOLS H A, OOMEN J F J, et al. If homogalacturonan were a side chain of rhamnogalacturonan I. Implications for cell wall architecture[J]. Plant Physiology, 2003, 132(4): 1781-1789. DOI:10.1104/pp.103.022350
[9] 支梓鉴, 邹明明, 李珊, 等. 柑橘果肉果胶的流变和结构特性[J]. 高等学校化学学报, 2016, 37(6): 1175-1181.
[10] GUNTER E A, POPEYKO O V. Calcium pectinate gel beads obtained from callus cultures pectins as promising systems for colon-targeted drug delivery[J]. Carbohydrate Polymers, 2016, 147: 490-499. DOI:10.1016/j.carbpol.
[11] 谭飔, 周志钦. 根皮苷研究进展[J]. 食品与发酵工业, 2013, 39(8): 182-186.
[12] PEI F, LI B Y, ZHANG Z, et al. Beneficial effects of phlorizin on diabetic nephropathy in diabetic db/db mice[J]. Journal of Diabetes & Its Complications, 2014, 28(5): 596-603. DOI:10.1016/j.jdiacomp.
[13] XIN Y, WU Y, JIAN L, et al. Phlorizin treatment attenuates obesity and related disorders through improving BAT thermogenesis[J]. Journal of Functional Foods, 2016, 27: 429-438. DOI:10.1016/j.jff.
[14] CHANG W T, HUANG W C, LIOUB C J. Evaluation of the antiinflammatory effects of phloretin and phlorizin in lipopolysaccharidestimulated mouse macrophages[J]. Food Chemistry, 2012, 134(2): 972-979. DOI:10.1016/j.foodchem.
[15] ANTIKA L D, LEE E J, KIM Y H, et al. Dietary phlorizin enhances osteoblastogenic bone formation through enhancing β-catenin activity via GSK-3β inhibition in a model of senile osteoporosis[J]. Journal of Nutritional Biochemistry, 2017, 49: 42. DOI:10.1016/j.jnutbio.
[16] CAFFALL K H, MOHNEN D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J]. Carbohydrate Research, 2009, 344(14): 1879-1900. DOI:10.1016/j.carres.
[17] 梁迪, 杨曦, 侯燕杰, 等. 苹果果胶-多酚复合膜液制备、流变特性及抗氧化性研究[J]. 食品与发酵工业, 2018, 44(8): 99-106.
[18] XU J, HONG P, ZHOU K, et al. Multi-scale pectin/polyphenol beads for non-fouling fluorescence[J]. Tracking on Soft Matter Under Water Carbohydrate Polymers, 2018, 199(1): 186-192. DOI:10.1016/j.carbpol
[19] SOOHWAN A K, ANTAOOA H, JONGHWI L. Antioxidant and ion-induced gelation functions of pectins enabled by polyphenol conjugation author links open overlay panel[J]. International Journal of Biological Macromolecules, 2017, 101(8): 776-782. DOI:10.1016/j.ijbiomac.
[20] AHN S, HALAKE K, LEE J. Antioxidant and ion-induced gelation functions of pectins enabled by polyphenol conjugation[J]. International Journal of Biological Macromolecules, 2017, 101: 776-782. DOI:10.1016/j.ijbiomac.
[21] 陈剑兵, 尹颖, 陆胜民, 等. 亚临界水处理制备低分子柑橘果胶及其性质研究[J]. 现代食品科技, 2014, 30(6): 186-190.
[22] 陈贺, 李影, 韩立杰, 等. 蓝莓果冻中明胶和果胶添加比例的确定[J]. 食品科技, 2014, 39(1): 272-276.
[23] TIAGO B L, GUERREROA M G, CUBARSI T, et al. Textural properties of different melon (Cucumis melo L.) fruit types: sensory and physical-chemical evaluation[J]. Scientia Horticulturae, 2016, 201: 46-56. DOI:10.1016/j.scienta.
[24] 张倩钰, 徐秋雄, 樊巧, 等. 竹笋膳食纤维对高酯果胶流变及其凝胶质构特性的影响[J]. 食品与发酵工业, 2016, 42(7): 91-95. DOI:10.13995/j.cnki.11-1802/ts.201607016.
[25] 曾瑞琪, 苗钟化, 李苇舟, 等. 羧甲基纤维素钠对低酯果胶凝胶流变特性及凝胶形成的影响[J]. 食品与发酵工业, 2017, 43(8): 108-114. DOI:10.13995/j.cnki.11-1802/ts.013359.
[26] ADOM K K, SORRELLS M E, LIU R H. Phytochemicals and antioxidant activity of milled fractions of different wheat varieties[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2297-2306. DOI:10.1021/jf048456d.
[27] MA F, WU J, PU L, et al. Effect of solution plasma process with hydrogen peroxide on the degradation of water-soluble polysaccharide from Auricularia auricula. II: Solution conformation and antioxidant activities in vitro[J]. Carbohydrate Polymers, 2018, 198: 575-580. DOI:10.1016/j.ijbiomac.
[28] 赵正涛, 李全阳, 卫晓英, 等. 黄原胶对酸乳凝胶特性的影响及其作用机理探讨[J]. 食品工业科技, 2009, 30(5): 154-157.
[29] 胡文玥, 单杨, 李高阳, 等. 低酯果胶凝胶质构特性的研究[J]. 食品与机械, 2016, 32(3): 45-48.
[30] WATRELOT A A, LE B C, IMBERTY A, et al. Neutral sugar side chains of pectins limit interactions with procyanidins[J]. Carbohydrate Polymers, 2014, 99(1): 527-536. DOI:10.1016/j.carbpol.
[31] MYOUNGLAE C, WONSEOK C, YOU S G. Steady and dynamic shear rheology of fucoidan-buckwheat starch mixtures[J]. Starch- Stärke, 2010, 61(5): 282-290. DOI:10.1002/star.200800083.
[32] NASCIMENTO G E, SIMAS-TOSIN F F, IACOMINI M, et al. Rheological behavior of high methoxyl pectin from the pulp of tamarillo fruit (Solanum betaceum)[J]. Carbohydrate Polymers, 2016, 139: 125-130. DOI:10.1016/j.carbpol.
[33] 吴银琴. 不同直链淀粉含量的甘薯淀粉及其与瓜尔胶复配体系性质的研究[D]. 无锡: 江南大学, 2014: 20-30.
[34] SILVER F H, BRADICA G, TRIA A. Elastic energy storage in human articular cartilage: estimation of the elastic modulus for type II collagen and changes associated with osteoarthritis[J]. Matrix Biology, 2002, 21(2): 129-137. DOI:10.1016/s0945-053x(01)00195-0.
[35] MCCANN T H, FABRE F, LI D. Microstructure, rheology and storage stability of low-fat yoghurt structured by carrot cell wall particles[J]. Food Research International, 2011, 44(4): 884-892. DOI:10.1016/j.foodres.2011.01.045.
[36] 李成倍. 高酰基结冷胶/酪蛋白酸钠凝胶特性研究[D]. 杭州: 浙江工商大学, 2014: 30-50.
[37] 李全阳, 夏文水, 祝丽香, 等. 一种乳酸菌多糖对酸乳凝胶的影响机理[J]. 高等学校化学学报, 2007, 28(5): 868-871.
[38] 王冠群. 乙酰化交联淀粉在凝固型酸奶体系中的应用及作用 机理[D]. 济南: 山东轻工业学院, 2012: 33-39.
[39] OH H E, ANEMA S G, WONG M, et al. Effect of potato starch addition on the acid gelation of milk[J]. International Dairy Journal, 2007, 17(7): 808-815. DOI:10.1016/j.idairyj.
[40] PTASZEK P, GRZESIK M. Viscoelastic properties of maize starch and guar gum gels[J]. Journal of Food Engineering, 2007, 82(2): 227-237. DOI:10.1016/j.jfoodeng.
[41] KARAKI N, ALJAWISH A, MUNGLIA L, et al. Physicochemical characterization of pectin grafted with exogenous phenols[J]. Food Hydrocolloids, 2016, 60: 486-493. DOI:10.1016/j.foodhyd.