大豆分离蛋白具有许多功能特性,因此广泛应用于食品工业[1],例如添加至肉制品中可以改善产品的质构和保水性[2]。大豆7S和11S蛋白是大豆分离蛋白的主要组分,约占组分70%以上[3],与大豆分离蛋白的功能性质密切相关[4]。大豆7S蛋白,也被称为β-伴大豆球蛋白[5],约占大豆球蛋白的34%[5],是分子质量约为150~200 kDa的三聚体共轭型糖蛋白[1],主要由α′(≈71 kDa)、 α(≈67 kDa)和β(≈50 kDa)亚基[6]组成。大豆11S蛋白,又称为大豆球蛋白[5],约占大豆种子中球蛋白的42%[7],是分子质量为300~380 kDa的六聚体非糖蛋白[1],由酸性亚基(35~37 kDa)[8]和碱性亚基(20 kDa)[8]通过二硫键连接在一起[9],大豆11S蛋白含硫氨基酸丰富,具有良好的凝胶保水性[5]。
凝胶性作为大豆分离蛋白的重要功能性质之一,不仅应用于食品工业,同时其展现的优良性能也为其他领域的应用提供广阔前景[10]。大豆分离蛋白成胶方式较多,例如加热、加酸、离子诱导等,均使蛋白形成凝胶[11]。蛋白凝胶性受多种因素的影响,包括内在因素如表面疏水性、巯基等因素,这些因素影响着蛋白凝胶的形成。除此之外,外在因素如蛋白质量浓度、加热温度、pH值、Na+质量浓度等也是影响凝胶作用的重要因素[12]。
凝胶形成的过程首先是巯基、疏水基团等功能性基团的逐渐暴露,紧接着暴露的基团通过疏水、氢键、静电相互作用或二硫键形成聚集体,当蛋白质浓度足够高,会进一步形成凝胶[13]。由于蛋白质在热凝胶形成过程中产生结构变化,因此官能团的变性以及暴露程度会影响凝胶的形成[14]。
本研究通过对大豆7S和11S蛋白的表面疏水性、巯基、粒径等理化性质进行测定,通过傅里叶红外光谱法对蛋白质的二级结构进行分析,并研究蛋白质量浓度、加热温度、pH值、Na+质量浓度对凝胶的影响通过蛋白凝胶的硬度、胶黏性及弹性反映凝胶特性,进而探讨大豆7S和11S蛋白的结构与凝胶性的关系,为改善其凝胶性及扩大应用范围提供实验基础及理论依据。
1 材料与方法
1.1 材料与试剂
脱脂大豆粉购于秦皇岛金海食品工业有限公司。
三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris) 北京索莱宝科技有限公司;亚硫酸氢钠 成都市科龙化工试剂厂;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甘氨酸、β-巯基乙醇、溴酚蓝 Biosharp生物科技公司;乙二胺四乙酸二钠(ethylenediaminetetraacetic acid,EDTA) 国药集团化学试剂有限公司;ANS-Mg、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio-bis-(2-nitrobenzoic acid),DTNB)、四甲基乙二胺 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
DYY-7C型电泳仪 北京六一生物科技公司;Lab Tech紫外-可见分光光度计 北京莱伯泰科仪器有限 公司;Varioskan Flash多功能酶标仪 美国赛默飞世尔科技公司;Zetasizer Nano-zeta电位仪 英国马尔文 公司;J-26S冷冻离心机 美国贝克曼公司;IR200傅里叶变换红外光谱仪 美国Thermo Fisher公司;TLP质 构仪 美国Food Technology Corporation公司。
1.3 方法
1.3.1 大豆7S及11S蛋白的制备与纯化
采用Liu Chun等[15]的方法进行大豆7S及11S蛋白组分的制备。通过G200柱分子筛纯化大豆7S蛋白:取实验室自制大豆7S蛋白1 mL,加入50%硫酸铵沉淀后取上清液,调pH值为6.2,离心取上清液,加0.2% TCEP。用上样缓冲液(2.6 mmol/L KH2PO4、32.5 mmol/L K2HPO4、400 mmol/L NaCl,0.1% TCEP,pH 7.5)平衡柱后,缓慢加入蛋白溶液。
通过G200柱分子筛纯化大豆11S蛋白:取实验室自制大豆11S蛋白1 mL,加入0.2% TCEP,0.45 μm过膜后,用上样缓冲液(2.6 mmol/L KH2PO4、32.5 mmol/L K2HPO4、400 mmol/L NaCl,pH 8.8)平衡层析柱后,缓慢加入蛋白溶液。
1.3.2 SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)分析
用不连续垂直板状凝胶电泳,浓缩胶为4%,分离胶为15%,凝胶厚度1 mm,上样量10 μL。分离胶时恒压80 V,浓缩胶时恒压120 V,考马斯亮蓝R-250染色30 min,用脱色液进行多次脱色直至背景清晰。
1.3.3 傅里叶变换红外光谱分析
将干燥的溴化钾与待测样品按质量比100∶30充分混合,玛瑙研钵研磨至细粉末状,置于专用压片机中,在10 N压力下保持60 s,压制成均匀透明的圆形薄片,用单纯溴化钾压片作为空白对照。扫描范围4 000~400 cm-1, 分辨率4 cm-1,扫描次数32 次/s。由于大豆7S和11S蛋白的二级结构信息重叠在红外光谱的酰胺I 带(1 600~1 700 cm-1)[16],酰胺I带谱峰主要归属于C=O键伸缩振动[7],可反映蛋白质的二级结构。通过对酰胺I带进行基线校正,平滑处理,在二阶导数基础上采用Gauss分峰拟合的方法[17],得到大豆7S及11S蛋白拟合图。
1.3.4 大豆7S及11S蛋白理化性质的测定
1.3.4.1 表面疏水性的测定
采用ANS荧光探针法[17]。将0.06 g蛋白溶于30 mL磷酸盐缓冲溶液(2.6 mmol/L KH2PO4、32.5 mmol/L K2HPO4,pH 7.6)缓冲液中,20 ℃搅拌1 h,8 000 r/min离心30 min。分别将大豆7S及11S蛋白稀释成一系列质量浓度40、80、120、160、200、240、280 μg/mL,用相同的缓冲液配制8 mol/L ANS-Mg溶液。每2 mL样品加入10 μL ANS-Mg溶液,8 000 r/min离心5 min,在390 nm激发波长,470 nm发射波长下测样品溶液的荧光强度,同时测定未加ANS的相应质量浓度的样品溶液的荧光强度做空白。以蛋白质量浓度为横坐标,荧光强度为纵坐标作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数S0[18]。
1.3.4.2 游离巯基含量的测定
用Ellman试剂法[19-20]测定游离巯基含量。配制Tris-Gly缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、0.04 mol/L EDTA),用2 mol/L HCl溶液调pH值至8.0。用相同的Tris-Gly缓冲液配制质量浓度为 4 mg/mL的DTNB溶液即Ellman试剂。将5 mg/mL的蛋白溶液和Tris-Gly缓冲液1∶1混合稀释,每5 mL稀释溶液加入50 μL Ellman试剂,涡旋振荡,每个样品测3 个平行。以加入Ellman试剂的Tris-Gly缓冲液作为空白对照。样品及空白25 ℃保温1 h,3 000h g离心30 min,取上清液。用分光光度计测定其在412 nm波长处的吸光度,按 下式[20]计算游离巯基含量:
式中:A为吸光度;D为稀释倍数;C为样品质量浓度/(mg/mL)。
1.3.4.3 总巯基含量的测定
配制Tris-Gly缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、0.04 mol/L EDTA、8 mol/L尿素),用2 mol/L HCl溶液调pH值至8.0,其他条件同1.3.4.2节。
1.3.4.4 粒径的测定
将大豆7S及11S蛋白配制为50 μg/mL的溶液,上清液用0.45 μm水系滤膜过滤,然后用Zeta电位仪测定粒径,参数设置如下:分散介质为蛋白质;分散剂为水;温度25 ℃,平衡时间60 s,样品池DTS0012。
1.3.5 凝胶性的测定
用质构仪对凝胶的硬度、胶黏性及弹性进行测定。测定模式和选项为TPA,测定时参数设置如下:力量感应元为50 N,选用凝胶专用探头P12.7,形变量30%,速率60 mm/min,间隔时间3 s,最小起始力0.05 N。
1.3.5.1 蛋白质量浓度对凝胶性的影响
凝胶的制备参照唐晓婷等[21]的方法,稍作修改。
将蛋白样品配制成蛋白质量浓度0.07~0.12 g/mL的蛋白溶液,充分溶解。用保鲜膜密封,在90 ℃的恒温水浴锅中加热30 min,快速冷却至室温,在4 ℃冰箱内放置24 h,制得的凝胶用于测定凝胶性。
1.3.5.2 温度对凝胶性的影响
将蛋白样品配制成蛋白质量浓度0.12 g/mL的溶液,充分溶解,用保鲜膜密封,分别在70、75、80、85、90、95 ℃的恒温水浴锅中加热30 min,其他条件同1.3.5.1节。
1.3.5.3 pH值对凝胶性的影响
将蛋白样品配制成蛋白质量浓度0.12 g/mL的溶液,充分溶解,分别调节pH值为2~10,于90 ℃恒温水浴锅中加热30 min,其他条件同1.3.5.1节。
1.3.5.4 Na+质量浓度对凝胶性的影响
将蛋白样品配制成蛋白质量浓度0.12 g/mL的溶液,充分溶解,分别添加NaCl,制成0.002、0.004、0.006、0.008、0.010、0.012 g/mL的溶液,于90 ℃恒温水浴锅中加热30 min,其他条件同1.3.5.1节。
1.4 数据处理
数据以f s表示,采用IBM SPSS Statistics 20软件进行数据分析,并用OriginPro 9.1软件绘图。
2 结果与分析
2.1 大豆7S及11S蛋白的SDS-PAGE结果分析
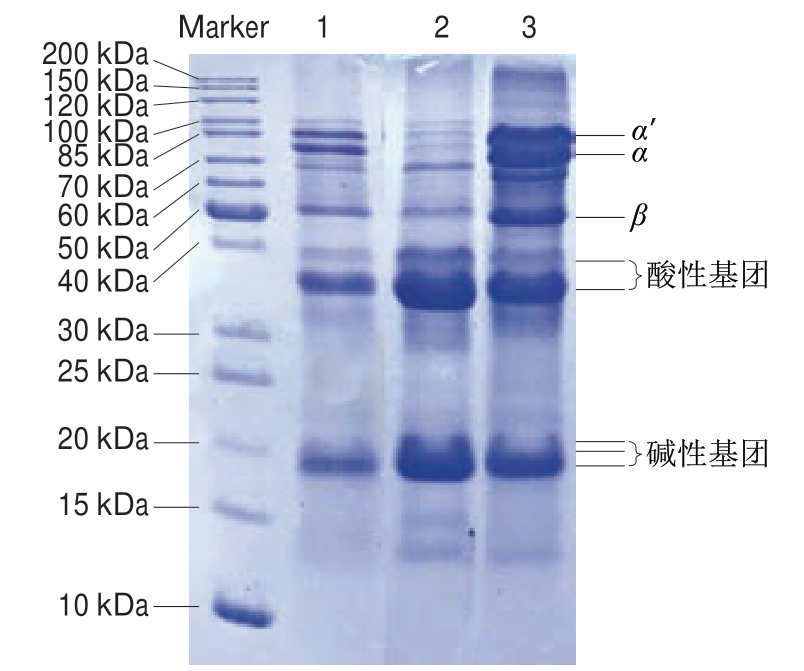
图 1 大豆7S和11S蛋白SDS-PAGE图谱
Fig. 1 SDS-PAGE patterns of soybean 7S and 11S proteins
1.脱脂大豆粉;2.实验室自提大豆11S蛋白;3.实验室自提大豆7S蛋白。
由图1可以看出,泳道2显示实验室自提大豆11S蛋白被大豆7S蛋白轻微污染,而实验室自提大豆7S蛋白主要被大豆11S蛋白的酸性亚基和碱性亚基污染。这主要是因为提取大豆7S蛋白的pH值为4.8,在此pH值条件下,溶液中所有的蛋白均被提取出来,因此溶液中残留的大豆11S蛋白亚基及其他蛋白会污染大豆7S蛋白,使大豆7S蛋白纯度降低。因此实验室自提条件下,大豆11S蛋白纯度高于大豆7S蛋白。
2.2 大豆7S和11S蛋白纯化
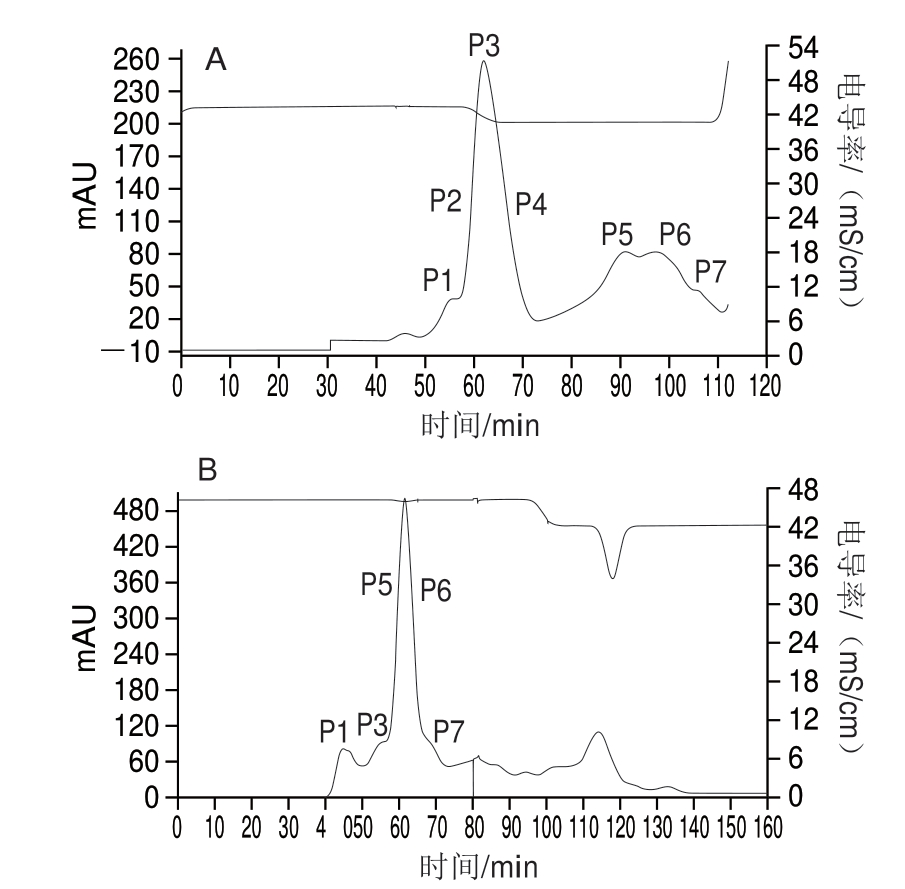
图 2 分子筛G200纯化大豆7S(A)及11S(B)蛋白图谱
Fig. 2 Sephadex G-200 molecular-sieve chromatograms of soybean 7S (A) and 11S (B) proteins
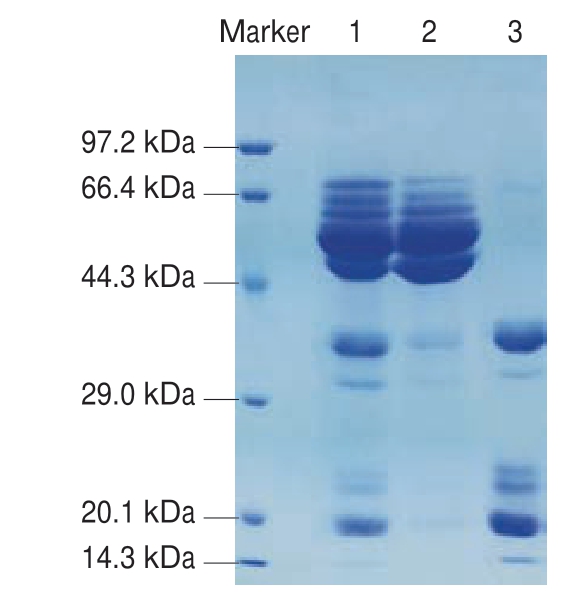
图 3 纯化后大豆7S及11S蛋白SDS-PAGE图谱
Fig. 3 SDS-PAGE patterns of purified soybean 7S and 11S proteins
1.脱脂大豆粉;2.纯化后大豆7S蛋白;3.纯化后大豆11S蛋白。
大豆7S蛋白纯化(图2A),对P1~P7处的蛋白进行SDS-PAGE分析后,P4处的蛋白纯度较高,即图3泳道2,纯化后的大豆7S蛋白纯度在95%以上。大豆11S蛋白纯化(图2B),对P1~P7处的蛋白进行SDS-PAGE分析后,P5处的蛋白纯度较高,即图3泳道3,纯化后的大豆11S蛋白纯度在95%以上。
2.3 蛋白结构性质
如图4所示,酰胺I带中各子峰与二级结构的对应关系:1 612 cm-1附近的吸收峰为蛋白质和多肽的侧链吸收;1 618~1 640 cm-1为β-折叠结构;1 640~1 649 cm-1 为无规卷曲结构;1 650~1 660 cm-1为α-螺旋结构;1 660~1 700 cm-1为β-转角结构[7]。通过对各子峰积分面积的计算,得出大豆7S及11S蛋白的二级结构信息, 见表1。大豆7S及11S蛋白的二级结构中β-折叠、β-转角含量较高;α-螺旋和无规卷曲相对含量较少。大豆7S蛋白的β-转角及无规卷曲的相对含量略高于大豆11S蛋白,而大豆11S蛋白α-螺旋及β-折叠含量略高于大豆7S蛋白。
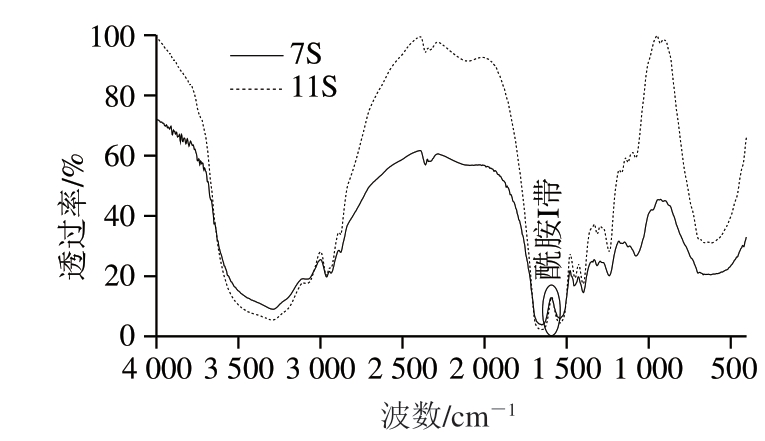
图 4 大豆7S和11S蛋白红外光谱图
Fig. 4 FT-IR spectra of soybean 7S and 11S proteins
表 1 大豆7S及11S蛋白红外光谱酰胺I带拟合结果
Table 1 Secondary structure contents of 7S and 11S proteins based on second-derivative FT-IR spectra in the amide I region
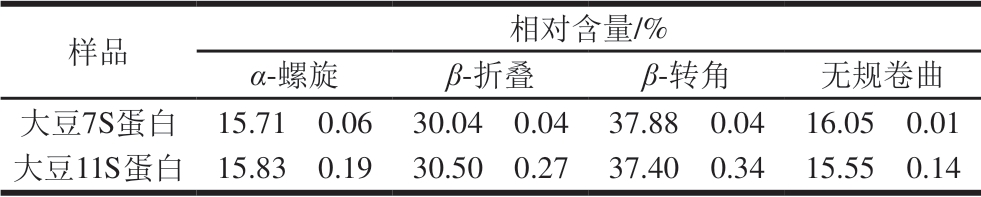
样品 相对含量/%α-螺旋 β-折叠 β-转角 无规卷曲大豆7S蛋白 15.71f 0.06 30.04f 0.04 37.88f 0.04 16.05f 0.01大豆11S蛋白 15.83f 0.19 30.50f 0.27 37.40f 0.34 15.55f 0.14
2.4 蛋白理化性质
表 2 大豆7S和11S蛋白理化性质
Table 2 Physicochemical properties of soybean 7S and 11S proteins
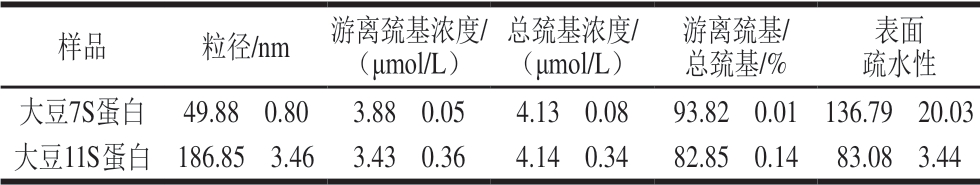
样品 粒径/nm 游离巯基浓度/(μmol/L)总巯基浓度/(μmol/L)游离巯基/总巯基/%表面疏水性大豆7S蛋白 49.88f 0.80 3.88f 0.05 4.13f 0.08 93.82f 0.01 136.79f 20.03大豆11S蛋白 186.85f 3.46 3.43f 0.36 4.14f 0.34 82.85f 0.14 83.08f 3.44
游离巯基与总巯基的比值反映了蛋白质三级结构的解折叠程度,游离巯基与总巯基的比值越大,蛋白的解折叠程度越高,分子结构越趋于暴露式,疏水性残基的增强使得表面疏水性增强[22]。研究表明,蛋白质的表面疏水性显著影响蛋白质的凝胶性等功能特性[23]。由表2可知,大豆7S蛋白的游离巯基/总巯基的比值为93.82%,高于大豆11S蛋白的82.85%,这说明大豆7S蛋白的解折叠程度高于大豆11S蛋白,蛋白质的表面疏水性主要取决于暴露在蛋白质分子表面的疏水性残基[24],疏水基团暴露程度大,使得大豆7S蛋白表面疏水性(136.79)也大于大豆11S蛋白(83.08),符合解折叠程度大,表面疏水性增大的规律。
由表2可以看出,大豆11S蛋白粒径分布主要在100 nm以上,大豆7S蛋白粒径分布主要在10~100 nm,这是由于大豆11S蛋白在中性条件下的溶解性小于在碱性条件下的溶解性,溶于水后的大豆11S蛋白形成了聚集体。蛋白质的粒径分布越大,说明聚集体形成的越多,这会减少蛋白质表面疏水基团的暴露,从而导致蛋白质表面疏水性降低[25],与表2结果一致。蛋白的表面疏水性也与二级结构相关,表面疏水性随着α-螺旋、β-折叠的增大而减小,随着β-转角和无规卷曲的增大而增大。大豆7S蛋白的α-螺旋、β-折叠含相对量均低于大豆11S蛋白,β-转角和无规卷曲含量均高于大豆11S蛋白(表1),因此大豆7S蛋白的表面疏水性高于大豆11S蛋白(表2)。
2.5 凝胶性结果

图 5 蛋白质量浓度(A)、温度(B)、pH值(C)和Na+ 质量浓度(D)对大豆7S及11S蛋白凝胶的影响
Fig. 5 Effects of protein concentration (A), temperature (B), pH (C) and Na+ concentration (D) on appearance of soybean 7S and 11S protein gels
1.大豆7S蛋白;2.大豆11S蛋白;A、D中数据单位均为g/mL。
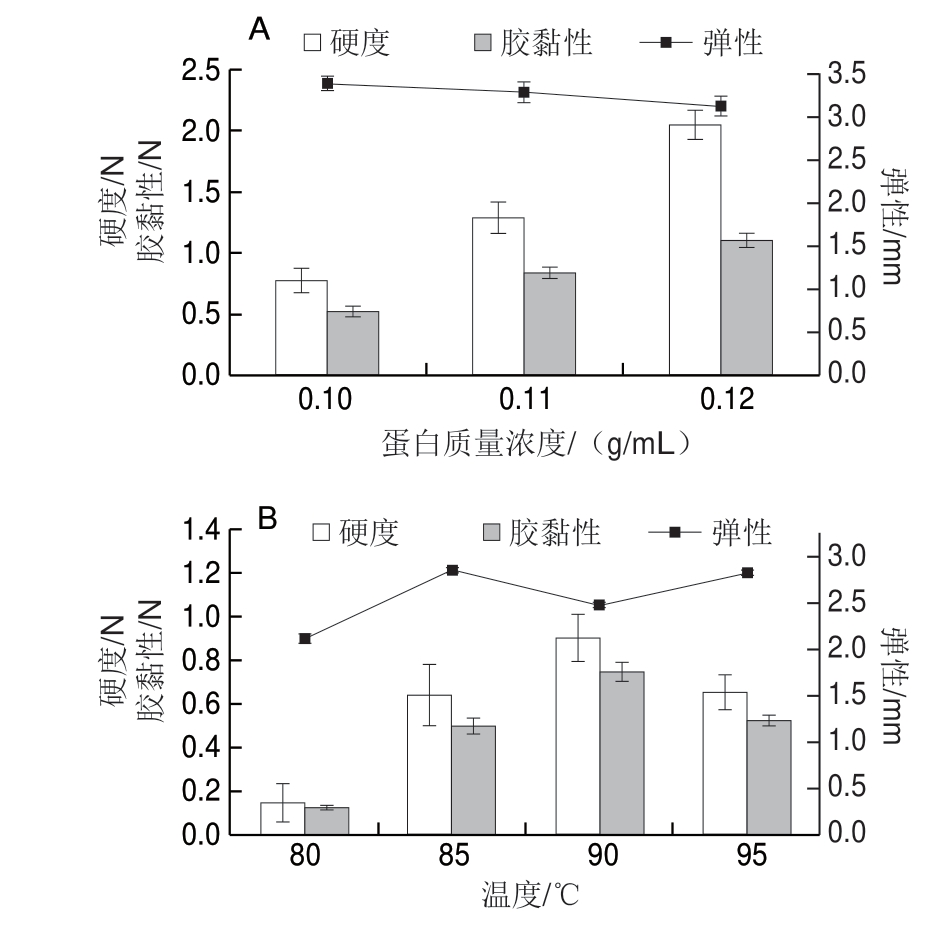
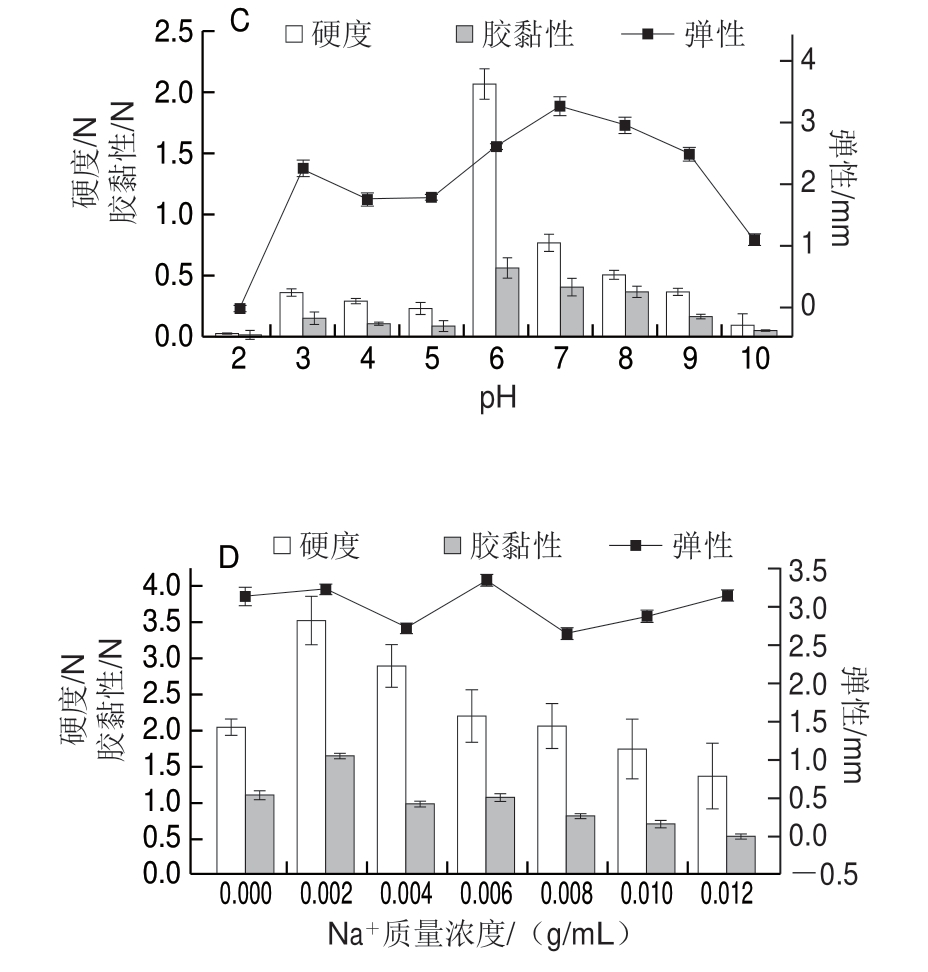
图 6 蛋白质量浓度(A)、温度(B)、pH值(C)及 Na+ 质量浓度(D)对大豆7S蛋白凝胶的影响
Fig. 6 Effects of protein concentration (A), temperatures (B), pH (C) and Na+ concentration of (D) on gel texture properties of soybean 7S protein
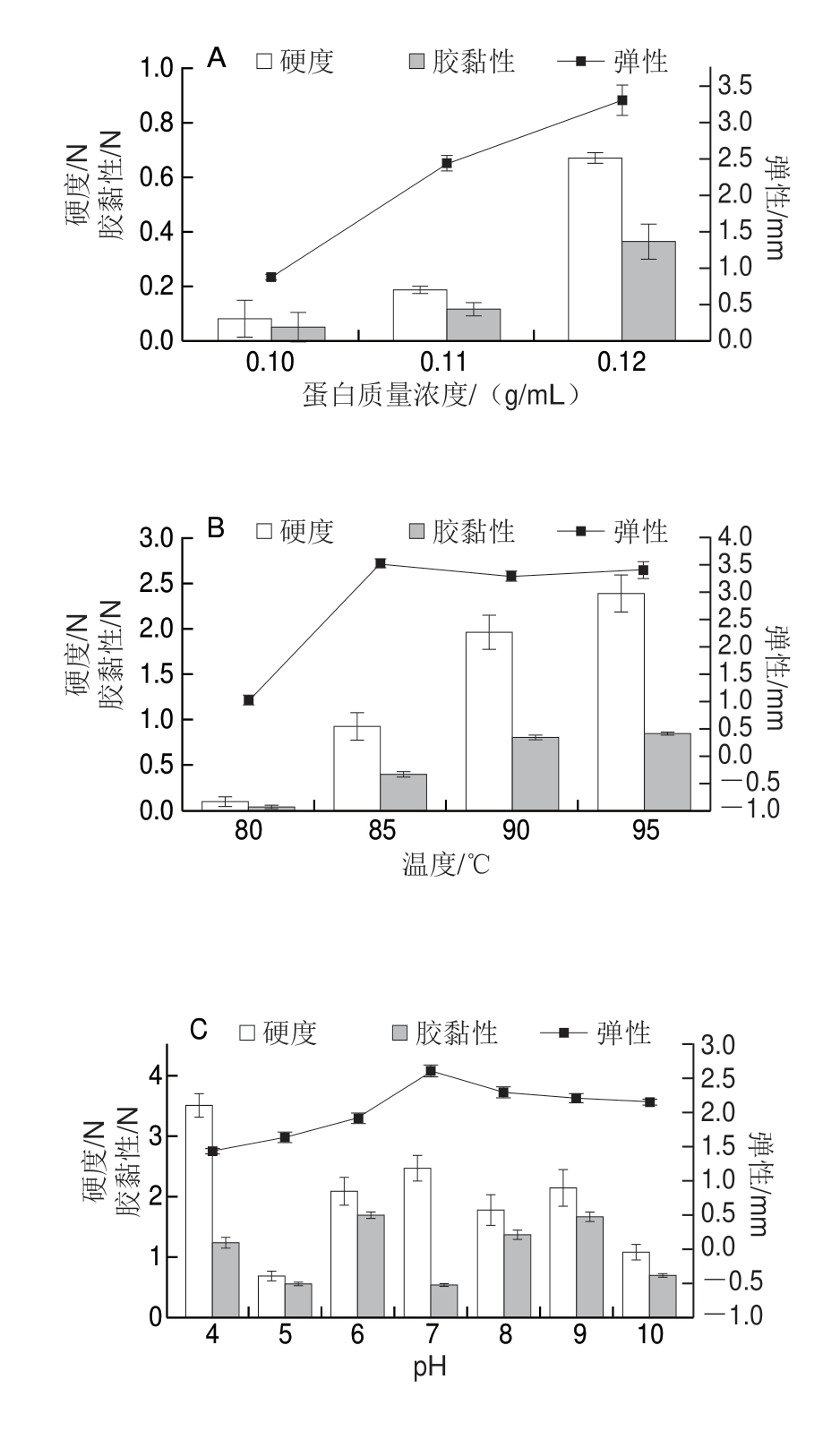
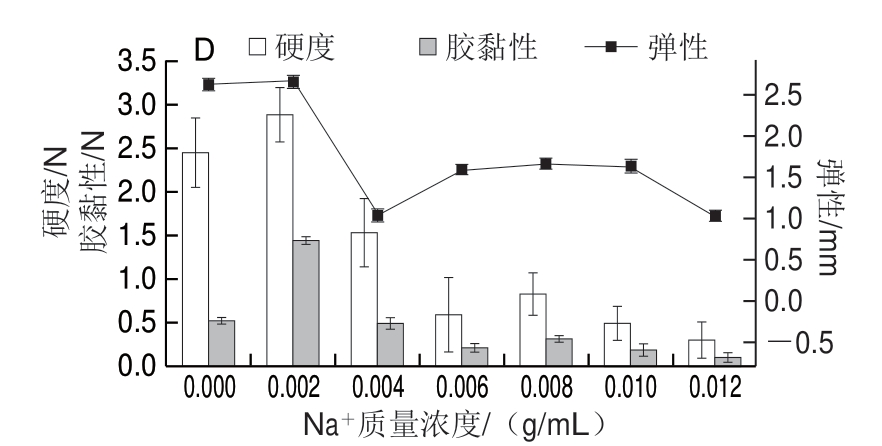
图 7 蛋白质量浓度(A)、温度(B)、pH值(C)及 Na+ 质量浓度(D)对大豆11S蛋白凝胶的影响
Fig. 7 Effects of protein concentration (A), temperature (B), pH (C) and Na+ concentrations (D) on gel texture properties of soybean 11S protein
蛋白浓度是凝胶形成的决定性因素之一[26]。浓度过低时,蛋白质-溶剂的相互作用起主导作用,随着蛋白浓度的增加,蛋白质间相互作用加强,形成的凝胶网络结构较密实[10]。如图5~7所示,在蛋白质量浓度为0.07~0.09 g/mL时,大豆7S及11S蛋白形成的凝胶仍具有流动性。从图6A、7A可以看出,在蛋白质量浓度为0.1~0.12 g/mL时,凝胶硬度及胶黏性均随着质量浓度的增大而增大,而蛋白质量浓度对大豆7S蛋白的弹性影响较小(弹性变化范围在3.13~3.39 mm),对大豆11S蛋白弹性影响较大(弹性变化范围在0.88~3.31 mm)。
加热处理是使蛋白质凝胶化的常见方法[13],随着温度的升高,蛋白质分子受热变性,环状结构展开成伸展的链状,原本埋在卷曲结构内部的疏水基团暴露 出来[27],有利于分子间通过疏水性相互作用形成交联。当温度为70、75 ℃时,大豆7S及11S蛋白无法形成凝胶(图5B)。温度低于80 ℃时,蛋白质游离巯基含量较少,且蛋白质分子间的相互接触少,因此容易导致聚集体的形成,而不利于凝胶网络的形成[28]。图6B显示,当温度高于90 ℃,大豆7S蛋白的网络结构破坏越严重,因此凝胶的硬度及胶黏性呈下降趋势。图7B显示,随着温度升高至95 ℃,凝胶硬度及胶黏性持续增加。由图6B、7B可知,大豆11S蛋白形成凝胶比大豆7S蛋白形成凝胶需要更高温度,且硬度、胶黏性大豆11S蛋白也更高,主要是因为大豆11S蛋白凝胶中形成的二硫键数量比大豆7S蛋白形成的多[4]。
pH值的改变会影响蛋白质分子的离子化作用和净电荷值,从而改变蛋白质分子间的相互作用以及蛋白质分子与溶剂分子结合的能力,因此会影响凝胶形成和维持的作用力[29]。实验结果表明,大豆7S蛋白在pH 2和pH 10时不能形成凝胶,整体呈流体;pH 4和pH 5时由于靠近大豆7S蛋白的等电点(pI 4.8),蛋白质絮凝聚集不能形成凝胶(图5C1)。图6C显示,大豆7S蛋白凝胶硬度在pH 6时最大,弹性在pH 7时最大。大豆11S蛋白在pH 2和pH 3时不能形成凝胶,可能是由于强酸条件下,球蛋白的空间结构在很大程度上展开,分子间的二硫键断裂[30]; pH 4、pH 5和pH 6时由于靠近大豆11S蛋白的等电点(pI 6.4),蛋白质聚集不能形成凝胶,尤其是pH 6时,蛋白质聚集的同时有大量的水析出(图5C2)。由图7C可看出,碱性条件更适合大豆11S蛋白凝胶的形成。当pH值在等电点附近时,蛋白质分子的电荷降低,分子间相互排斥作用下降,蛋白质随机聚合形成“粗凝胶”,这种凝胶弹性差,表面粗糙,有水析出;当pH值逐渐远离等电点时,分子间相互排斥作用增强,聚合变得缓慢从而形成规则有序的凝胶网络,凝胶变得透明弹性增加[31]。
中性盐对蛋白质溶液可产生2 种影响:一是盐离子与蛋白质分子中的极性和离子基团作用,降低蛋白质分子的活度系数,使其溶解度增加;二是盐离子也与偶极分子水作用,使水的活度系数降低,导致蛋白质水合程度降低,使蛋白质溶解度减少,蛋白质沉淀[32]。从图6D、7D可看出,随着Na+质量浓度的增加,凝胶硬度和胶黏性呈现先增大后下降的趋势,因为低质量浓度时,Na+屏蔽了蛋白质表面的电荷,从而减少了蛋白质分子间的静电斥力[33],促进了蛋白质的溶解度,同时加热更有利于蛋白质结构的展开和基团的暴露,随着Na+质量浓度的加入,蛋白的变性温度变高,蛋白质结构的展开和基团的暴露较少,同时蛋白质的重新折叠作用,不利于凝胶的形成[31],从实验现象也可看出,随着Na+质量浓度增加,蛋白质逐渐析出,凝胶的外观形态由透明细腻变得发白粗糙(图5D)。
因此,形成凝胶的最优条件,要同时考量凝胶的硬度,胶黏性以及弹性。大豆7S蛋白形成凝胶最优条件为蛋白质量浓度0.12 g/mL、温度90 ℃、pH 6~8、Na+质量浓度0.002 g/mL。大豆11S蛋白形成凝胶最优条件为蛋白质量浓度0.12 g/mL、温度95 ℃、pH 8~9、Na+质量浓度0.002 g/mL。
3 结 论
本研究表明凝胶性受多种因素共同影响,主要分为内在因素以及外在因素。凝胶形成首先是通过蛋白质的变性,即蛋白质构象的改变以及功能性基团(巯基、疏水基团等)的暴露[13],这将有利于蛋白质接下来通过二硫键、氢键等相互作用,从而进一步形成凝胶。巯基、粒径和表面疏水性这些理化指标可以反映出蛋白质分子暴露的程度,通过实验发现实验室自提大豆7S及11S蛋白,在水溶液中大豆7S蛋白暴露程度更大,表面疏水性也更大,这更有利于蛋白间的相互作用。但是,外界条件的改变会影响蛋白的内在因素,因此外在因素对凝胶形成也起到重要作用。
当蛋白浓度较低时,蛋白间的相互作用较弱,网络结构薄弱不利于凝胶的形成。温度在热凝胶起始的变性阶段起到了重要作用,蛋白质分子受热变性,环状结构变成链状结构,疏水基团暴露更有利于分子间交联,但是当温度高于90 ℃时,大豆7S蛋白的凝胶网络结构遭到了破坏,凝胶质构性下降,由于大豆11S蛋白凝胶中二硫键更多,因此温度的升高更有利于大豆11S蛋白凝胶的形成。pH值影响蛋白质分子的吸引力和排斥力,因此在等电点附近,大豆7S和11S蛋白聚集沉淀,而远离等电点凝胶变得透明且富有弹性。Na+质量浓度在0.002 g/mL时,大豆7S和11S蛋白均能形成较好的凝胶,而随着Na+质量浓度的增大,凝胶质构特性逐渐降低。
凝胶的形成是内外因素共同作用的结果,分析凝胶形成的条件应该从多因素相互影响相互制约的角度分析。本研究表明,蛋白质的二级结构决定了蛋白的表面疏水性,而表面疏水性影响了凝胶的形成,同时凝胶形成的各外在因素又影响着蛋白的表面疏水性。同时,本研究对于蛋白的其他功能性质研究提供了新策略,具有一定参考价值。
[1] KEERATI-U-RAI M, CORREDIG M. Heat-induced changes in oil-inwater emulsions stabilized with soy protein isolate[J]. Food Hydrocolloids, 2009, 23: 2141-2148. DOI:10.1016/j.foodhyd.2009.05.010.
[2] 邹金, 徐宝钗, 尚雪娇, 等. 添加大豆分离蛋白对鲊广椒肉丸品质的影响[J]. 肉类研究, 2018, 32(4): 27-32. DOI:10.7506rl yj1001-8123-201804005.
[3] BECKWITH A C. Interaction of phosphatidylcholine vesicles with soybean 7S and 11S globulin proteins[J]. Journal of Agricultural and Food Chemistry, 1984, 32: 1397-1402. DOI:10.1021/jf00126a045.
[4] ROSENBERG M, ROSENBERG Y, FRENKEL L. Microencapsulation of model oil in wall matrices consisting of SPI and maltodextrins[J]. AIMS Agriculture and Food, 2016, 1(1): 33-51. DOI:10.3934/agrfood.2016.1.33.
[5] BAINY E M, TOSH S M, CORREDIG M, et al. Protein subunit composition effects on the thermal denaturation at different stages during the soy protein isolate processing and gelation profiles of soy protein isolates[J]. Journal of the American Oil Chemists’ Society, 2008, 85: 581-590. DOI:10.1007/s11746-008-1238-6.
[6] RUÍZ-HENESTROSA V P, SÁNCHEZ C C, ESCOBAR M D M Y, et al. Interfacial and foaming characteristics of soy globulins as a function of pH and ionic strength[J]. 2007, 309: 202-215. DOI:10.1016/j.colsurfa.2007.01.030.
[7] ZHAO X Y, CHEN F S, XUE W T, et al. FTIR spectra studies on the secondary structures of 7S and 11S globulins from soybean proteins using AOT reverse micellar extraction[J]. Food Hydrocolloids, 2008, 22: 568-575. DOI:10.1016/j.foodhyd.2007.01.019.
[8] TARONE A G, FASOLIN L H, PERRECHIL F A, et al. Influence of drying conditions on the gelling properties of the 7S and 11S soy protein fractions[J]. Food and Bioproducts Processing, 2013, 91: 111-120. DOI:10.1016/j.fbp.2012.11.010.
[9] STASWICK P E, HERMODSON M A, NIELSEN N C. Identification of the cystines which link the acidic and basic components of the glycinin subunits[J]. Journal of Biological Chemistry, 1984, 259(21): 13431-13435.
[10] 刘德阳. 盐离子对大豆分离蛋白凝胶特性和微结构影响研究[D]. 无锡: 江南大学, 2015: 2-18.
[11] 金郁葱. 大豆蛋白凝胶结构和质构的控制研究[D]. 广州: 华南理工大学, 2013: 3.
[12] 陈利梅, 李德茂, 李燕. 大豆分离蛋白流变学特性研究[J]. 粮油加工, 2010(10): 25-28.
[13] 吴超. 大豆蛋白凝胶结构与非网络蛋白扩散行为或网络蛋白性质相关的研究[D]. 无锡: 江南大学, 2017.
[14] 李丹, 刘春雷, 江连洲, 等. 纯品7S和11S蛋白结构与表面疏水性的相关性研究[J]. 食品研究与开发, 2015, 36(7): 5-9. DOI:10.3969/j.issn.1005-6521.2015.07.002.
[15] LIU C, WANG H L, CUI Z M, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102: 1310-1316. DOI:10.1016/j.foodchem.2006.07.017.
[16] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J]. Biochimica et Biophysica Acta, 1988, 952: 115-130. DOI:10.1016/0167-4838(88)90107-0.
[17] 刘春雷, 孙立斌, 李相昕, 等. 大豆7S和11S蛋白二级结构与表面疏水性相关性的研究[J]. 食品科学, 2015, 36(17): 28-32. DOI:10.7506/spkx1002-6630-201517006.
[18] 巫庆华. 木瓜蛋白酶凝固大豆蛋白质机理[J]. 乳液科学与技术, 2002, 98(1): 6-9. DOI:10.15922/j.cnki.jdst.2002.01.002.
[19] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82: 70-77.
[20] HUANG Y, HUA Y F, QIU A Y. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International, 2006, 39: 240-249. DOI:10.1016/j.foodres.2005.07.012.
[21] 唐晓婷, 孔保华, 刘骞, 等. 高压均质处理淀粉及大豆分离蛋白凝胶性质研究[J]. 中国食品学报, 2016, 16(9): 68-76. DOI:10.16429/j.1009-7848.2016.09.010.
[22] 许晶, 齐宝坤, 赵青山, 等. 大豆分离蛋白结构特性与表面疏水性的关系[J]. 中国粮油学报, 2015, 30(8): 32-36. DOI:10.3969/j.issn.1003-0174.2015.08.006.
[23] NISHINARI K, FANG Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsification[J]. Food Hydrocolloids, 2014, 39: 301-318. DOI:10.1016/j.foodhyd.2014.01.013.
[24] 李丹, 魏东旭, 贾烨, 等. 大豆7S球蛋白结构特性与表面疏水性相关性研究[J]. 中国油脂, 2017, 42(4): 93-98. DOI:10.3969/j.issn.1003-7969.2017.04.021.
[25] 齐宝坤, 李杨, 王中江. 不同品种大豆分离蛋白Zeta电位和粒径分布与表面疏水性的关系[J]. 食品科学, 2017, 38(3): 114-118. DOI:10.7506/spkx1002-6630-201703019.
[26] 张学盈. 大豆分离蛋白的凝胶化及其性能研究[D]. 天津: 天津科技大学, 2016: 6.
[27] 杨岚, 成玉梁, 郭亚辉, 等. 热处理强度对大豆分离蛋白凝胶形成能力的影响[J]. 大豆科学, 2018, 37(1): 141-148. DOI:10.11861/j.issn.1000-9841.2018.01.0141.
[28] 陶汝青, 夏宁, 滕建文. 热处理对大豆分离蛋白结构和凝胶性的影响[J]. 食品科学, 2018, 39(9): 60-66. DOI:10.7506/spkx1002-6630-201809010.
[29] 牛祥臣, 王洪彩, 马军, 等. 食盐浓度和热处理条件对大豆蛋白凝胶特性影响的研究[J]. 食品研究与开发, 2018, 39(6): 19-22. DOI:10.3969/j.issn.1005-6521.2018.06.004.
[30] 魏东旭, 江连洲, 王辰, 等. pH值对大豆11S球蛋白结构和表面疏水性的影响[J]. 食品科学, 2015, 36(11): 1-5. DOI:10.7506/spkx1002-6630-201511001.
[31] 叶荣飞. 大豆分离蛋白凝胶性影响因素研究进展[J]. 畜牧与饲料科学, 2009, 30(1): 29-30. DOI:10.16003/j.cnki.issn1672-5190.2009.01.011.
[32] 宋莲军, 刘捷, 乔明武. 大豆分离蛋白-脂肪复合凝胶制备条件响应曲面优化研究[J]. 河南农业大学学报, 2015, 49(3): 380-388. DOI:10.16445/j.cnki.1000-2340.2015.03.018.
[33] 张红娟, 陈振昌, 周瑞宝. pH值对11S球蛋白结构与凝胶性的影响[J]. 食品科技, 2003, 28(5): 26-31. DOI:10.13684/j.cnki.spkj.2003.05.008.