 迫对冷冻干燥发酵乳杆菌(Lactobacillus fermentum)ATm的影响,考察酸-冷交互
迫对冷冻干燥发酵乳杆菌(Lactobacillus fermentum)ATm的影响,考察酸-冷交互 迫的处理方式对细胞存活率、滞后时间以及酸化速率的影响,同时测定交互
迫的处理方式对细胞存活率、滞后时间以及酸化速率的影响,同时测定交互 迫对乳酸脱氢酶、ATP酶活性以及细胞膜完整性的影响。结果表明,pH 4.5、4 ℃酸-冷交互
迫对乳酸脱氢酶、ATP酶活性以及细胞膜完整性的影响。结果表明,pH 4.5、4 ℃酸-冷交互 迫能够显著提高细胞冷冻干燥存活率及酸化速率,其中冷冻干燥存活率能够达到87.19%,优于单因
迫能够显著提高细胞冷冻干燥存活率及酸化速率,其中冷冻干燥存活率能够达到87.19%,优于单因
 迫;pH 4.5、4 ℃酸-冷交互
迫;pH 4.5、4 ℃酸-冷交互 迫能够提高发酵乳杆菌ATm的冷冻干燥存活率保护其活性,提高酶活性,维持细胞膜完整性。
迫能够提高发酵乳杆菌ATm的冷冻干燥存活率保护其活性,提高酶活性,维持细胞膜完整性。乳酸菌为益生菌,人们常通过食用含该类活菌的制品或者含菌体组分及代谢产物的制品维持人体肠道内菌群的平衡[1],发酵乳制品因为具有丰富的营养价值与良好益生作用而受到消费者的青睐[2],其中乳酸菌发酵剂在乳制品发酵过程中起到至关重要的作用[3]。而在发酵剂中乳酸菌的细胞数量与细胞活力则是影响发酵乳制品质量的关键因 。目前冷冻干燥技术被认为是最有利于保持菌种活性的方法[4],尽管使用冷冻干燥的成本较高,但能长时间保持菌种的活力,便于贮藏和应用。
。目前冷冻干燥技术被认为是最有利于保持菌种活性的方法[4],尽管使用冷冻干燥的成本较高,但能长时间保持菌种的活力,便于贮藏和应用。
乳酸菌在实际应用中往往是各种 迫同时出现[5],在某些单因
迫同时出现[5],在某些单因
 迫实验中,发现不同的
迫实验中,发现不同的 迫之间似乎有某种关联。研究表明,除冷
迫之间似乎有某种关联。研究表明,除冷 迫之外酸
迫之外酸 迫以及热
迫以及热 迫也会使乳酸菌产生大量的冷休克蛋白,热
迫也会使乳酸菌产生大量的冷休克蛋白,热 迫、酸
迫、酸 迫与冷
迫与冷 迫之间很可能存在交叉保护[6-7],交叉保护是细胞在处于多种环境
迫之间很可能存在交叉保护[6-7],交叉保护是细胞在处于多种环境 迫时由某一种
迫时由某一种 迫的应激反应所诱导,这对细胞的生存很有利[8]。目前微生物的交叉保护现象被广泛研究并应用于很多领域,例如嗜酸乳杆菌LA1-1胆盐预
迫的应激反应所诱导,这对细胞的生存很有利[8]。目前微生物的交叉保护现象被广泛研究并应用于很多领域,例如嗜酸乳杆菌LA1-1胆盐预 迫能提高热
迫能提高热 迫存活率,但热处理不能提高其胆盐
迫存活率,但热处理不能提高其胆盐 迫的存活率[9];冷和渗透
迫的存活率[9];冷和渗透 迫诱导的交叉保护可以在贮存期间保持冷冻干燥枯草芽孢杆菌的稳定性[10];Shen Qian等[11]报道了酸适应引发的交叉保护可以使单核细胞性李斯特菌抵抗月桂酸精氨酸(一种抑制单增李斯特菌生长的食品添加剂),该现象可用于评估食品加工中的风险[11];Wu Hao等[12]探索并建立了H
迫诱导的交叉保护可以在贮存期间保持冷冻干燥枯草芽孢杆菌的稳定性[10];Shen Qian等[11]报道了酸适应引发的交叉保护可以使单核细胞性李斯特菌抵抗月桂酸精氨酸(一种抑制单增李斯特菌生长的食品添加剂),该现象可用于评估食品加工中的风险[11];Wu Hao等[12]探索并建立了H 和乳酸交叉应激全局反应机制模型,为构建工业菌株奠定了基础[12];研究表明冷应激、酸
和乳酸交叉应激全局反应机制模型,为构建工业菌株奠定了基础[12];研究表明冷应激、酸 迫和热应激诱导的冷休克蛋白可以保护细胞免于低温致死[13]。
迫和热应激诱导的冷休克蛋白可以保护细胞免于低温致死[13]。
在冷冻干燥过程中,乳酸菌发酵剂难以避免冷冻与干燥过程对其造成的各种损伤。低温使得菌体内酶活性降低以及酶发挥作用延迟,进而可能改变代谢通路;低温也可能降低一些代谢调节过程中的灵敏度,使代谢失衡或生长停滞[14]。这些损伤使得发酵剂中菌株的存活率降低,活力下降,造成生产成本增加以及产品质量不稳定等问题。近年来常通过添加合适的保护剂,调整冷冻干燥工艺或者各种 迫提高乳酸菌的存活率和活力,但是利用交叉保护提高乳酸菌在冷冻干燥过程中冷冻抗性方面的研究较少,因
迫提高乳酸菌的存活率和活力,但是利用交叉保护提高乳酸菌在冷冻干燥过程中冷冻抗性方面的研究较少,因 探究运用交叉保护这一方法对于乳酸菌冷冻干燥活性的提高具有一定意义。
探究运用交叉保护这一方法对于乳酸菌冷冻干燥活性的提高具有一定意义。
本实验室前期筛选出的发酵乳杆菌(Lactobacillus fermentum)ATm具有滞后时间短以及酸化速率快的特点[15], 能够缩短发酵时间、降低能耗,是1 株潜在的适合工业生产用的菌株,因 选用该菌株为研究对象。通过比较不同
选用该菌株为研究对象。通过比较不同 迫条件下细胞的冷冻干燥存活率,研究不同
迫条件下细胞的冷冻干燥存活率,研究不同 迫条件影响发酵乳杆菌冷冻干燥后活性的差异性,为高活性乳酸菌发酵剂的生产提供实验依据。
迫条件影响发酵乳杆菌冷冻干燥后活性的差异性,为高活性乳酸菌发酵剂的生产提供实验依据。
脱脂乳由新疆花园乳业提供;发酵乳杆菌ATm为石河子大学畜产实验室筛选分离,NCBI登录号为KY310724。
MRS培养基、固体MRS培养基均购自青岛海博技术生物有限公司;121 ℃灭菌20 min。
乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒 索莱宝生物公司;ATP酶试剂盒 南京建成生物公司;LIVE/DEAD™ BacLight™ Bacterial Viability Kit L7012 美国Life生物公司;海藻糖 南京奥多福尼生物科技有限公司。
F D U-1 2 0 0 冷冻干燥机 日本E y e l a 公司;NEOFUGE15R/15高速冷冻离心机 郑州南北仪器设备有限公司;995超低温冰箱 美国赛默飞世尔公司;IX71倒置荧光显微镜 日本奥林巴斯公司;DK-8D恒温水浴锅 江苏金坛仪器有限公司;PHS-3C酸度计 上海雷磁仪器厂;ZXSD-1160全自动生化培养箱 上海智诚仪器有限公司;EON多功能酶标仪 美国BioTek仪器有限公司;VCX750超声波破碎仪 美国Sonics公司。
1.3.1 冷冻干燥
将发酵乳杆菌ATm以3%的接种量,接种至MRS培养基中,于37 ℃培养18 h,将菌液于6 791h g离心10 min,去上清液,将菌泥用生理盐水洗涤2 次,加入等体积保护剂(脱脂乳12% 海藻糖10%)。将混合有保护剂的菌悬液分装在无菌西林瓶中,每瓶1 mL,盖上橡胶塞,放入超低温冰箱中预冻4 h。将预冻好的
海藻糖10%)。将混合有保护剂的菌悬液分装在无菌西林瓶中,每瓶1 mL,盖上橡胶塞,放入超低温冰箱中预冻4 h。将预冻好的 品放入冷冻干燥机中,冷冻干燥12 h,真空压盖,
品放入冷冻干燥机中,冷冻干燥12 h,真空压盖, 品备用。
品备用。
1.3.2 冷冻干燥存活率测定
将冷冻干燥后的菌粉用MRS培养基复水至冷冻干燥前相同体积,用平板计数法测定冷冻干燥前后活菌数。重复3 次实验,每次3 个平行。存活率计 如式(1)所示:
如式(1)所示:
式中:NA为冷冻干燥后的细胞数;NB为冷冻干燥前的细胞数。
1.3.3 单因
 迫
迫
将活化后的菌种培养液以3%接种量接入MRS培养基中,在37 ℃静置培养至对数末期,将菌种离心并重悬于磷酸盐缓冲液中。将重悬液在酸 迫(pH 3.2、3.8、4.0、4.5、5.0)静置90 min,冷
迫(pH 3.2、3.8、4.0、4.5、5.0)静置90 min,冷 迫(4、10 ℃)静置180 min,将
迫(4、10 ℃)静置180 min,将 迫后的细胞进行冷冻干燥。
迫后的细胞进行冷冻干燥。
1.3.4 交互 迫
迫
根据1.3.3节 迫处理后细胞的冷冻干燥存活率,选出最佳
迫处理后细胞的冷冻干燥存活率,选出最佳 迫条件。将活化后的菌液以3%接种量接入MRS培养基中,37 ℃静置培养18 h至对数末期,先将菌种在最佳
迫条件。将活化后的菌液以3%接种量接入MRS培养基中,37 ℃静置培养18 h至对数末期,先将菌种在最佳 迫条件下进行酸
迫条件下进行酸 迫处理,再进行冷
迫处理,再进行冷 迫处理,将交互
迫处理,将交互 迫的细胞进行冷冻干燥。
迫的细胞进行冷冻干燥。
1.3.5 酸化曲线测定
将冷冻干燥复水后的菌种以3%接种量接种到新培养基中,每隔1 h取3 支试管测量其pH值,实验重复3 次,取平均值。以pH值为纵坐标,培养时间为横坐标,绘制酸化曲线。酸化曲线根据式(2)拟合[16]:
式中:t为培养时间/h;pH0为t=0时培养基的pH值;pHf为达到稳定期时的pH值;c为对应曲线中拐点的时间/h;p为指数拟合因子。
滞后时间为曲线上t=0点切线与t=c点切线的交点,酸化速率为指数阶段切线斜率的模量,按式(3)计 :
:
式中:tc为滞后时间;tf为pH值达到稳定期的时间。
1.3.6 相关酶活性的测定
1.3.6.1 无细胞提取液的制备
将菌体复水后离心,并用0.85%生理盐水洗涤2 次。取5 mL于冰水浴中进行超声波破碎(超声时间3 s,间隔时间9 s),持续6.5 min。4 ℃、6 791h g离心10 min,取上清液进行相关酶活性测定。
1.3.6.2 LDH活性测定
采用索莱宝公司试剂盒进行测定。测定原理:LDH催化NAD 氧化乳酸生成丙酮酸,丙酮酸进一步与2,4-
氧化乳酸生成丙酮酸,丙酮酸进一步与2,4- 硝基苯肼作用生成丙酮酸
硝基苯肼作用生成丙酮酸 硝基苯腙,在碱性溶液中显棕红色,颜色深浅与丙酮酸浓度呈正比。每104 个细菌或细胞每分钟催化产生1 nmol丙酮酸定义为1 个酶活性单位,LDH活性单位为U/104 cell。
硝基苯腙,在碱性溶液中显棕红色,颜色深浅与丙酮酸浓度呈正比。每104 个细菌或细胞每分钟催化产生1 nmol丙酮酸定义为1 个酶活性单位,LDH活性单位为U/104 cell。
1.3.6.3 ATP酶活性测定
采用南京建成公司试剂盒进行测定。其中蛋白质浓度根据考马斯亮蓝法[17]测定。
测定原理:Na -K
-K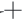 ATP酶与Ca2
ATP酶与Ca2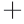 -Mg2
-Mg2 ATP酶可分解ATP生成ADP及无机磷,通过测定无机磷的量确定ATP酶活性。每小时每毫克组织蛋白中Na
ATP酶可分解ATP生成ADP及无机磷,通过测定无机磷的量确定ATP酶活性。每小时每毫克组织蛋白中Na -K
-K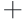 ATP/ Ca2
ATP/ Ca2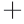 -Mg2
-Mg2 ATP酶分解ATP产生1 μmol无机磷的量为1 个酶活性单位,ATP酶活性单位为U/mg。
ATP酶分解ATP产生1 μmol无机磷的量为1 个酶活性单位,ATP酶活性单位为U/mg。
1.3.7 细胞膜完整性测定
利用LIVE/DEAD™ BacLight™ Bacterial Viability Kit L7012试剂盒测定。将等体积的荧光染料碘化丙啶和免疫荧光染料(SYT09)均匀混合。取1 μL混合染料,加入到300 μL菌悬液中,均匀混合,室温避光孵育15 min。取5 μL已染色菌液滴加于载玻片并盖上盖玻片于倒置荧光显微镜下进行观察。
数据采用SPSS 25.0软件进行分析,实验重复3 次,显著性分析采用Duncan检验。图像处理采用Origin 2018软件。

 迫对冷冻干燥存活率的影响
迫对冷冻干燥存活率的影响
图 1 酸胁迫(A)和冷胁迫(B)对发酵乳杆菌ATm 冷冻干燥存活率的影响
Fig. 1 Effect of acid stress (A) and cold stress (B) on the survival rate of freeze-dried L. fermentum ATm
字母不同表示差异显著(P<0.05),下同。
如图1所示,经过 迫后菌株冷冻干燥存活率均高于未经
迫后菌株冷冻干燥存活率均高于未经 迫的对照组,说明酸、冷两种
迫的对照组,说明酸、冷两种 迫方式都能够不同程度提高发酵乳杆菌ATm存活率,使得冷冻干燥后的活菌数增加,其中pH 4.5与4 ℃
迫方式都能够不同程度提高发酵乳杆菌ATm存活率,使得冷冻干燥后的活菌数增加,其中pH 4.5与4 ℃ 迫下冷冻干燥存活率最高,分别为67.42%、44.66%。这与Fernanda等[18] 以及张国强[19]用酸
迫下冷冻干燥存活率最高,分别为67.42%、44.66%。这与Fernanda等[18] 以及张国强[19]用酸 迫增加冷冻干燥抗性、李宝坤等[20]冷
迫增加冷冻干燥抗性、李宝坤等[20]冷 迫提高冷冻干燥存活率的结果相似,这是因为微生物能够通过调节生理代谢适应环境的变化,提高自身 抗性[21],从而提高菌株在冷冻干燥过程中抵御恶劣环境的抗性,使得存活率增加。但并不是所有菌株都能通过酸
迫提高冷冻干燥存活率的结果相似,这是因为微生物能够通过调节生理代谢适应环境的变化,提高自身 抗性[21],从而提高菌株在冷冻干燥过程中抵御恶劣环境的抗性,使得存活率增加。但并不是所有菌株都能通过酸 迫增加冷冻抗性,罗伊氏乳杆菌I5007在pH 6.7的存活率与对照组pH 5.7相比提高了14.3%[22]。10 ℃
迫增加冷冻抗性,罗伊氏乳杆菌I5007在pH 6.7的存活率与对照组pH 5.7相比提高了14.3%[22]。10 ℃ 迫下冷冻干燥存活率仅为14.24%,与对照组相比存活率降低,而Broadbent等[23]研究却表明10 ℃
迫下冷冻干燥存活率仅为14.24%,与对照组相比存活率降低,而Broadbent等[23]研究却表明10 ℃ 迫增加乳酸乳球菌在冷冻干燥过程中的抗性,这可能是因为菌种不同引起的差异。pH 3.2时存活率与未经
迫增加乳酸乳球菌在冷冻干燥过程中的抗性,这可能是因为菌种不同引起的差异。pH 3.2时存活率与未经 迫的对照组相比没有显著差异,可能是因为pH值太低使得菌株在
迫的对照组相比没有显著差异,可能是因为pH值太低使得菌株在 迫时受损伤过大,导致存活率过低。因
迫时受损伤过大,导致存活率过低。因 选取pH 4.5、4 ℃作为交互
选取pH 4.5、4 ℃作为交互 迫的条件。
迫的条件。
 迫对冷冻干燥存活率的影响
迫对冷冻干燥存活率的影响如图2所示,未经 迫对照组冷冻干燥存活率为30.86%,而经过酸-冷交互
迫对照组冷冻干燥存活率为30.86%,而经过酸-冷交互 迫处理后冷冻干燥存活率可以达到87.19%,是对照组的2.61 倍,且与单因
迫处理后冷冻干燥存活率可以达到87.19%,是对照组的2.61 倍,且与单因
 迫相比有显著差异(P<0.05)。说明交互
迫相比有显著差异(P<0.05)。说明交互 迫能够在冷冻干燥过程中对乳酸菌提供保护,且交互
迫能够在冷冻干燥过程中对乳酸菌提供保护,且交互 迫比单因
迫比单因
 迫的处理方式更有效。这可能是因为乳酸菌常处于复杂的生长环境,使得乳酸菌在面临不同
迫的处理方式更有效。这可能是因为乳酸菌常处于复杂的生长环境,使得乳酸菌在面临不同 迫时产生了交叉保护,即乳酸菌在暴露于第1种
迫时产生了交叉保护,即乳酸菌在暴露于第1种 迫期间所诱导的分子机制能够保护细胞免受之后的致死性攻击[24]。这种交叉保护机制使得乳酸菌在交互
迫期间所诱导的分子机制能够保护细胞免受之后的致死性攻击[24]。这种交叉保护机制使得乳酸菌在交互 迫处理后能够更好地抵抗冷冻干燥过程中的各种损伤。
迫处理后能够更好地抵抗冷冻干燥过程中的各种损伤。

图 2 交互胁迫对发酵乳杆菌ATm冷冻干燥存活率的影响
Fig. 2 Effect of cross-stress on the survival rate of freeze-dried L. fermentum ATm
 迫对冷冻干燥发酵乳杆菌ATm酸化曲线的影响
迫对冷冻干燥发酵乳杆菌ATm酸化曲线的影响冷冻干燥过程中的脱水会对细胞造成不同程度的结构损伤[25],但仅通过平板计数评估交互 迫对乳酸菌活性保护的能力有局限性。因
迫对乳酸菌活性保护的能力有局限性。因 ,对冷冻干燥后的乳酸菌进行酸化曲线测定可提供细菌修复损伤的能力和冷冻干燥后活性恢复的情况[16]。
,对冷冻干燥后的乳酸菌进行酸化曲线测定可提供细菌修复损伤的能力和冷冻干燥后活性恢复的情况[16]。
菌株冷冻干燥并复水后,每小时测定细胞培养液pH值变化,选取 迫处理菌株、未经冷冻干燥原始菌株和未经
迫处理菌株、未经冷冻干燥原始菌株和未经 迫处理的冷冻干燥菌株(对照),得到菌株的酸化曲线(图3)。
迫处理的冷冻干燥菌株(对照),得到菌株的酸化曲线(图3)。

图 3 交互胁迫对冷冻干燥发酵乳杆菌ATm酸化曲线的影响
Fig. 3 Effect of cross-stress on acidification curves of freeze-dried L. fermentum ATm
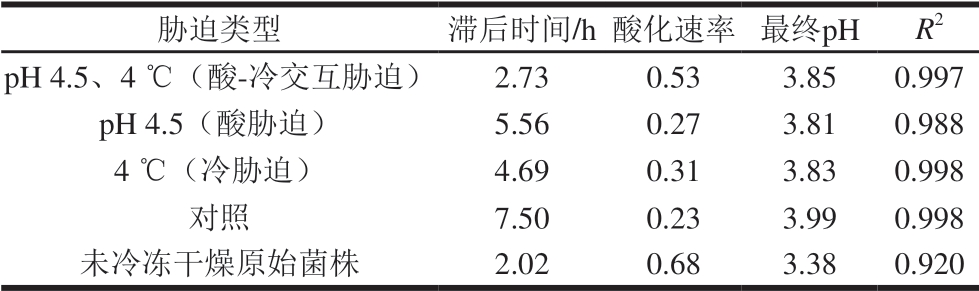
表 1 交互胁迫对发酵乳杆菌ATm生长动力学参数的影响
Table 1 Effect of cross-stress on growth kinetic parameters of freeze-dried L. fermentum ATm
images/BZ_124_392_2892_423_2923.png迫类型 滞后时间/h 酸化速率 最终pH R2 pH 4.5、4 ℃(酸-冷交互images/BZ_124_577_2939_608_2970.png迫) 2.73 0.53 3.85 0.997 pH 4.5(酸images/BZ_124_482_2985_513_3017.png迫) 5.56 0.27 3.81 0.988 4 ℃(冷images/BZ_124_466_3033_498_3064.png迫) 4.69 0.31 3.83 0.998对照 7.50 0.23 3.99 0.998未冷冻干燥原始菌株 2.02 0.68 3.38 0.920
如表1所示,未冷冻干燥的原始菌株滞后时间最短,酸化速率(每小时pH值变化量)最快,分别为2.02 h、0.68。相反,未经 迫处理的冷冻干燥乳酸菌滞后时间最长,酸化速率最慢,分别为7.50 h、0.23。任何处理下冷冻干燥后微生物的滞后时间都有不同程度的延长,且酸化速率减慢。这可能是因为冷冻干燥的脱水过程使得乳酸菌的细胞膜受到损伤,以及酶活力下降[26],使得乳酸菌在冷冻干燥后的产酸能力受到影响。经过交互
迫处理的冷冻干燥乳酸菌滞后时间最长,酸化速率最慢,分别为7.50 h、0.23。任何处理下冷冻干燥后微生物的滞后时间都有不同程度的延长,且酸化速率减慢。这可能是因为冷冻干燥的脱水过程使得乳酸菌的细胞膜受到损伤,以及酶活力下降[26],使得乳酸菌在冷冻干燥后的产酸能力受到影响。经过交互 迫处理后的乳酸菌滞后时间和酸化速率与原始菌株相近,分别为 2.73 h、0.53,该处理比其他
迫处理后的乳酸菌滞后时间和酸化速率与原始菌株相近,分别为 2.73 h、0.53,该处理比其他 迫的保护方式更有效,说明用交互
迫的保护方式更有效,说明用交互 迫的前处理方式保护冷冻干燥乳酸菌的活性是很有必要的。
迫的前处理方式保护冷冻干燥乳酸菌的活性是很有必要的。
 迫对冷冻干燥发酵乳杆菌ATm LDH活性的影响
迫对冷冻干燥发酵乳杆菌ATm LDH活性的影响LDH是乳酸菌冷冻干燥过程受损伤的关键酶,因 选择LDH进一步阐述交互
选择LDH进一步阐述交互 迫对乳酸菌冷冻干燥的活性保护作用,如图4所示,不同
迫对乳酸菌冷冻干燥的活性保护作用,如图4所示,不同 迫处理下LDH活性有显著差异。酸
迫处理下LDH活性有显著差异。酸 迫、冷
迫、冷 迫以及交互
迫以及交互 迫与未
迫与未 迫对照组都具有显著差异(P<0.05),LDH活性分别为0.043、0.038、0.074 U/104 cell。而未经过
迫对照组都具有显著差异(P<0.05),LDH活性分别为0.043、0.038、0.074 U/104 cell。而未经过 迫处理的冷冻干燥乳酸菌LDH活性为0.018 U/104 cell,说明LDH在冷冻干燥过程中受到损伤与李宝坤[27]的研究结果一致。LDH活性与存活率(图2)的变化一致,表明存活率的提高与LDH有关。除
迫处理的冷冻干燥乳酸菌LDH活性为0.018 U/104 cell,说明LDH在冷冻干燥过程中受到损伤与李宝坤[27]的研究结果一致。LDH活性与存活率(图2)的变化一致,表明存活率的提高与LDH有关。除 之外,酸-冷交互
之外,酸-冷交互 迫处理后的LDH活性相比于其他处理具有显著差异,且LDH活性明显高于其他处理组,这说明经过交互
迫处理后的LDH活性相比于其他处理具有显著差异,且LDH活性明显高于其他处理组,这说明经过交互 迫处理后的细胞的LDH活性在冷冻干燥过程中受损伤最小,能够保护乳酸菌细胞的活性。另一方面LDH能够在发酵过程中催化丙酮酸使其还原为乳酸,是乳酸菌代谢过程中的关键酶,LDH活性的大小反映了菌株的产酸能力[27-28],与2.3节一致,进一步说明交互
迫处理后的细胞的LDH活性在冷冻干燥过程中受损伤最小,能够保护乳酸菌细胞的活性。另一方面LDH能够在发酵过程中催化丙酮酸使其还原为乳酸,是乳酸菌代谢过程中的关键酶,LDH活性的大小反映了菌株的产酸能力[27-28],与2.3节一致,进一步说明交互 迫能够保护LDH活性从而使得冷冻干燥乳酸菌的滞后时间和酸化速率与原始菌株相近。
迫能够保护LDH活性从而使得冷冻干燥乳酸菌的滞后时间和酸化速率与原始菌株相近。
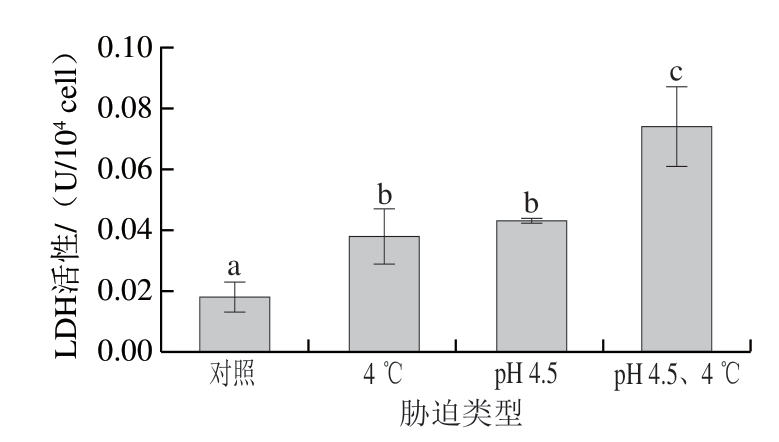
图 4 交互胁迫对冷冻干燥发酵乳杆菌ATm LDH活性的影响
Fig. 4 Effect of cross-stress on LDH activity of freeze-dried L. fermentum ATm
 迫对冷冻干燥发酵乳杆菌ATm ATP酶的影响
迫对冷冻干燥发酵乳杆菌ATm ATP酶的影响ATP酶是一种广泛分布的生物膜酶系统,对于维持细胞正常生理功能有至关重要的作用[20]。Na -K
-K ATP酶又称Na
ATP酶又称Na -K
-K 泵或者钠泵,镶嵌在细胞质膜的脂质双分子层中,能够催化ATP酶水解供给能量,有载体和酶的活性,在维持膜电位、调节渗透压以及为主动运输供能方面起着重要的作用[29]。Ca2
泵或者钠泵,镶嵌在细胞质膜的脂质双分子层中,能够催化ATP酶水解供给能量,有载体和酶的活性,在维持膜电位、调节渗透压以及为主动运输供能方面起着重要的作用[29]。Ca2 -Mg2
-Mg2 ATP酶能够调节Ca2
ATP酶能够调节Ca2 和Mg2
和Mg2 的浓度,也是重要的膜酶[30]。因
的浓度,也是重要的膜酶[30]。因 ATP酶是冷冻干燥过程中损伤的关键酶之一,本研究测定冷冻干燥后 Na
ATP酶是冷冻干燥过程中损伤的关键酶之一,本研究测定冷冻干燥后 Na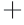 -K
-K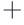 ATP酶与Ca2
ATP酶与Ca2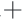 -Mg2
-Mg2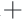 ATP酶的活性结果见图5。
ATP酶的活性结果见图5。

图 5 交互胁迫对冷冻干燥发酵乳杆菌ATm Na+ -K+ATP酶(A)和Ca2+-Mg2+ATP酶(B)活性的影响
Fig. 5 Effect of cross-stress on Na+-K+ATPase (A) and Ca2+-Mg2+ATPase (B) activities of freeze-dried L. fermentum ATm
从图5可以看出,冷冻干燥后不同 迫条件对冷冻干燥乳酸菌Na
迫条件对冷冻干燥乳酸菌Na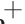 -K
-K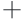 ATP酶与Ca2
ATP酶与Ca2 -Mg2
-Mg2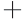 ATP酶具有显著差异。对于3 种不同
ATP酶具有显著差异。对于3 种不同 迫处理,交互
迫处理,交互 迫和ATP酶活性的影响不同,其中酸-冷交互
迫和ATP酶活性的影响不同,其中酸-冷交互 迫处理后,冷冻干燥发酵乳杆菌ATm的Na
迫处理后,冷冻干燥发酵乳杆菌ATm的Na -K
-K ATP酶与Ca2
ATP酶与Ca2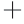 -Mg2
-Mg2 ATP酶活性分别为2.254 5 U/mg和2.335 5 U/mg。而未经
ATP酶活性分别为2.254 5 U/mg和2.335 5 U/mg。而未经 迫处理的 Na
迫处理的 Na -K
-K ATP酶与Ca2
ATP酶与Ca2 -Mg2
-Mg2 ATP酶活性分别为0.756 U/mg和0.949 5 U/mg。一方面ATP酶在冷冻干燥过程中受到损伤,ATP酶的失活会使得冷冻干燥乳酸菌的活性降低,另一方面也说明交互
ATP酶活性分别为0.756 U/mg和0.949 5 U/mg。一方面ATP酶在冷冻干燥过程中受到损伤,ATP酶的失活会使得冷冻干燥乳酸菌的活性降低,另一方面也说明交互 迫能够保护ATP酶活性从而保护冷冻干燥乳酸菌的活性。
迫能够保护ATP酶活性从而保护冷冻干燥乳酸菌的活性。
 迫对冷冻干燥发酵乳杆菌ATm细胞膜完整性的影响
迫对冷冻干燥发酵乳杆菌ATm细胞膜完整性的影响细胞膜能够将细胞内外的环境隔离开,对于细胞的生殖,能量传递及物质代谢等具有重要作用[31],是细胞遭受外界环境迫害的第一道防线,细胞膜的破坏会直接导致菌体的死亡,因 细胞膜完整性真实地反映了菌体生理活性[32]。当细胞膜完整性被破坏时,碘化丙啶能够透过生物膜与核酸结合在绿光的照射下发出红色荧光,所以当荧光显微镜观察到细胞呈红色,说明细胞膜完整性被破坏[33]。
细胞膜完整性真实地反映了菌体生理活性[32]。当细胞膜完整性被破坏时,碘化丙啶能够透过生物膜与核酸结合在绿光的照射下发出红色荧光,所以当荧光显微镜观察到细胞呈红色,说明细胞膜完整性被破坏[33]。
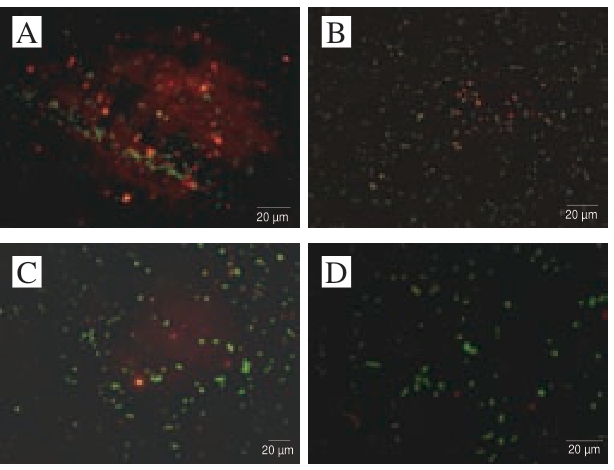
图 6 交互胁迫对冷冻干燥发酵乳杆菌ATm细胞膜完整性的影响
Fig. 6 Effect of cross-stress on cell membrane integrity of freeze-dried L. fermentum ATm
A.未 迫;B. 4 ℃
迫;B. 4 ℃ 迫;C. pH 4.5
迫;C. pH 4.5 迫;D. pH 4.5、4 ℃交互
迫;D. pH 4.5、4 ℃交互 迫。
迫。
未经过 迫的菌体冷冻干燥后几乎全部发出红色荧光,说明菌体冷冻干燥后的细胞膜完整性几乎全部被破坏(图6A),这与Beales[34]研究结果相同,这是因为在乳酸菌在冷冻干燥的预冷阶段,温度迅速降低形成冰晶,对细胞膜造成机械损伤,从而破坏细胞膜完整性[27]。然而,在经过酸
迫的菌体冷冻干燥后几乎全部发出红色荧光,说明菌体冷冻干燥后的细胞膜完整性几乎全部被破坏(图6A),这与Beales[34]研究结果相同,这是因为在乳酸菌在冷冻干燥的预冷阶段,温度迅速降低形成冰晶,对细胞膜造成机械损伤,从而破坏细胞膜完整性[27]。然而,在经过酸 迫与冷
迫与冷 迫及未
迫及未 迫的细胞相比,发出绿色荧光的细胞数明显增多,这是因为酸
迫的细胞相比,发出绿色荧光的细胞数明显增多,这是因为酸 迫能够增加细胞膜的刚性和不可渗透性,使得细胞膜增加在低温和干燥环境中的抗性[35]。其中交互
迫能够增加细胞膜的刚性和不可渗透性,使得细胞膜增加在低温和干燥环境中的抗性[35]。其中交互 迫处理 (图6D)后发与单因
迫处理 (图6D)后发与单因
 迫处理(图6B、C)相比有显著差异,说明冷冻干燥过程破坏细胞膜的完整性而交互
迫处理(图6B、C)相比有显著差异,说明冷冻干燥过程破坏细胞膜的完整性而交互 迫能够较好地维持细胞膜完整性。这也为之前交互
迫能够较好地维持细胞膜完整性。这也为之前交互 迫能够保护ATP酶活性提供了直接证据,证明了交互
迫能够保护ATP酶活性提供了直接证据,证明了交互 迫在冷冻干燥过程中可以维持细胞膜的功能,从而可以保护ATP酶活性。
迫在冷冻干燥过程中可以维持细胞膜的功能,从而可以保护ATP酶活性。
本实验采用交互 迫的方法,以发酵乳杆菌ATm作为研究菌株,提高冷冻干燥后乳酸菌的存活率并保护其活性,结果表明在pH 4.5、4 ℃的酸-冷交互
迫的方法,以发酵乳杆菌ATm作为研究菌株,提高冷冻干燥后乳酸菌的存活率并保护其活性,结果表明在pH 4.5、4 ℃的酸-冷交互 迫条件下能够使菌体的冷冻干燥存活率达到87.19%。酸-冷交互
迫条件下能够使菌体的冷冻干燥存活率达到87.19%。酸-冷交互 迫与对照组相比能够缩短滞后时间,提高酸化速率,保护LDH与ATP酶活性,很好地维持细胞膜完整性,有效保护乳酸菌冷冻干燥后的活力。研究结果表明交互
迫与对照组相比能够缩短滞后时间,提高酸化速率,保护LDH与ATP酶活性,很好地维持细胞膜完整性,有效保护乳酸菌冷冻干燥后的活力。研究结果表明交互 迫为提高冷冻干燥存活率提供一种新方法,也为高活性乳酸菌发酵剂的生产提供实验依据。
迫为提高冷冻干燥存活率提供一种新方法,也为高活性乳酸菌发酵剂的生产提供实验依据。
[1] 曹振辉, 刘永仕, 潘洪彬, 等. 乳酸菌的益生功能及作用机制研究进展[J]. 食品工业科技, 2015, 36(24): 366-370. DOI:10.13386/j.issn1002-0306.2015.24.072.
[2] 周凌华, 王豪, 王荫榆, 等. 功能性益生乳酸菌的研究进展[J]. 天然产物研究与开发, 2012, 24(7): 990-997. DOI:10.16333/j.1001-6880.2012.07.006.
[3] 杨亚楠. 乳酸菌发酵剂生物工程技术研究[J]. 现代食品, 2015, 13(3): 59-61. DOI:10.16736/j.cnki.cn41-1434/ts.2015.13.003.
[4] BISUTTI I L, HIRT K, STEPHAN D. Influence of different growth conditions on the survival and the efficacy of freeze-dried Pseudomonas fluorescens strain Pf153[J]. Biocontrol Science & Technology, 2015, 25(11): 1-25. DOI:10.1080/09583157.2015.1044498.
[5] 张娟, 薛 , 吴重德, 等. 基于蛋白表达分析的干酪乳杆菌ATCC393交互
, 吴重德, 等. 基于蛋白表达分析的干酪乳杆菌ATCC393交互 迫保护机制[J]. 工业微生物, 2012, 42(4): 13-20. DOI:10.3969/j.i88n.1001-6678.2012.04.003.
迫保护机制[J]. 工业微生物, 2012, 42(4): 13-20. DOI:10.3969/j.i88n.1001-6678.2012.04.003.
[6] SPANO G, CAPOZZI V A, MASSA S. Cloning, molecular characterization and expression analysis of two small heat shock genes isolated from wine Lactobacillus plantarum[J]. Journal of Applied Microbiology, 2010, 97(4): 774-782. DOI:10.1111/j.1365-2672.2004.02359.x.
[7] SPANO G, BENEDUCE L, PERROTTA C, et al. Cloning and characterization of the hsp 18.55 gene, a new member of the small heat shock gene family isolated from wine Lactobacillus plantarum[J]. Research in Microbiology, 2005, 156(2): 219-224. DOI:10.1016/j.resmic.2004.09.014.
[8] GUCHTE M V D, SERROR P, CHERVAUX C, et al. Stress responses in lactic acid bacteria[M]//Lactic acid bacteria: genetics, metabolism and applications. Netherlands: Springer, 2002: 187-216.
[9] KIM W S, PERL L, PARK J H, et al. Assessment of stress response of the probiotic Lactobacillus acidophilus[J]. Current Microbiology, 2014, 43(5): 346-350. DOI:10.1007/s002840010314.
[10] GASALUCK P, MAHIDSANAN T. The consequences of implicit factors as cross-protective stresses on freeze-dried Bacillus subtilis SB-MYP-1 with soybean flour during storage[J]. LWT, 2018, 90: 475-482. DOI:10.1016/j.lwt.2017.12.068.
[11] SHEN Q, SONI K A, NANNAPANENI R. Stability of sublethal acid stress adaptation and induced cross protection against lauric arginate in Listeria monocytogenes[J]. International Journal of Food Microbiology, 2015, 203: 49-54. DOI:10.1016/j.ijfoodmicro.2015.02.027.
[12] WU H, ZHAO Y, DU Y, et al. Quantitative proteomics of Lactococcus lactis F44 under cross-stress of low pH and lactate[J]. Journal of Dairy Science, 2018, 101(8): 6872-6884. DOI:10.3168/jds.2018-14594.
[13] PAPADIMITRIOU K, ALEGRIA Á, BRON P A, et al. Stress physiology of lactic acid bacteria[J]. Microbiology & Molecular Biology Reviews Mmbr, 2016, 80(3): 837-890. DOI:10.1128/MMBR.00076-15.
[14] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因 及规律[D]. 无锡: 江南大学, 2017.
及规律[D]. 无锡: 江南大学, 2017.
[15] 蒋艾廷, 李宝坤, 金丹, 等. PB试验优化德氏乳杆菌增殖培养基的研究[J]. 中国酿造, 2017, 36(7): 32-36. DOI:10.11882/j.issn.0254-5071.2017.07.008.
[16] ROMANO N, SCHEBOR C, MOBILI P, et al. Role of mono- and oligosaccharides from FOS as stabilizing agents during freezedrying and storage of Lactobacillus delbrueckii subsp. bulgaricus[J]. Food Research International, 2016, 90(1): 251-258. DOI:10.1016/j.foodres.2016.11.003.
[17] 林加涵. 现代生物学实验[M]. 厦门: 高等教育出版社, 2000.
[18] FERNANDA S, GEORGES C, CATHERINE B. Acidification improves cryotolerance of Lactobacillus delbrueckii subsp. bulgaricus CFL1[J]. Journal of Biotechnology, 2007, 128(3): 659-667. DOI:10.1016/j.jbiotec.2006.11.012.
[19] 张国强. 酒酒球菌 迫诱导抗冷冻干燥机制研究[D]. 杨凌: 西北农林科技大学, 2013.
迫诱导抗冷冻干燥机制研究[D]. 杨凌: 西北农林科技大学, 2013.
[20] 李宝坤, 田丰伟, 刘小鸣, 等. 冷 迫对冷冻干燥罗伊氏乳酸杆菌细胞膜流动性的影响[J]. 食品工业科技, 2012, 33(8): 137-142. DOI:10.13386/j.issn1002-0306.2012.08.001.
迫对冷冻干燥罗伊氏乳酸杆菌细胞膜流动性的影响[J]. 食品工业科技, 2012, 33(8): 137-142. DOI:10.13386/j.issn1002-0306.2012.08.001.
[21] DESMOND C, STANTON C, FITZGERALD G F, et al. Environmental adaptation of probiotic lactobacilli towards improvement of performance during spray drying[J]. International Dairy Journal, 2002, 11(10): 801-808. DOI:10.1016/S0958-6946(02)00040-7.
[22] LIU X T, HOU C L, ZHANG J, et al. Fermentation conditions influence the fatty acid composition of the membranes of Lactobacillus reuteri I5007 and its survival following freeze-drying[J]. Letters in Applied Microbiology, 2014, 59(4): 398-403. DOI:10.1111/ lam.12292.
[23] BROADBENT J R, LIN C. Effect of heat shock or cold shock treatment on the resistance of lactococcus lactis to freezing and lyophilization[J]. Cryobiology, 1999, 39(1): 88-102. DOI:10.1006/cryo.1999.2190.
[24] STREIT F, CORRIEU G, BÉAL C. Acidification improves cryotolerance of Lactobacillus delbrueckii subsp. bulgaricus CFL1[J]. Journal of Biotechnology, 2007, 128(3): 659-667. DOI:10.1016/j.jbiotec.2006.11.012.
[25] 曾小群, 潘道东, 包红燕, 等. 干酪乳杆菌冻干保护剂研究[J]. 中国食品学报, 2013, 13(1): 44-50. DOI:10.16429/j.1009-7848.2013.01.015.
[26] 王飚. 乳酸菌冷冻干燥生理损伤的研究[D]. 无锡: 江南大学, 2009.
[27] 李宝坤. 乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D]. 无锡: 江南大学, 2011.
[28] SINGHVI M, ZENDO T, IIDA H, et al. Stimulation of D- and L-lactate dehydrogenases transcriptional levels in presence of diammonium hydrogen phosphate resulting to enhanced lactic acid production by Lactobacillus strain[J]. Journal of Bioscience & Bioengineering, 2017, 124(6): 674-679. DOI:10.1016/j.jbiosc.2017.07.009.
[29] 朱敏, 李宝坤, 李开雄, 等. 乙醇 迫对乳酸杆菌关键酶活力的影响[J]. 食品与发酵工业, 2015, 41(1): 40-45. DOI:10.13995/j.cnki.11/1802/ts.201501008.
迫对乳酸杆菌关键酶活力的影响[J]. 食品与发酵工业, 2015, 41(1): 40-45. DOI:10.13995/j.cnki.11/1802/ts.201501008.
[30] BAO-KUN L I, TIAN F W, LIU X M, et al. Effect of freeze drying on the metabolic viability of lactic acid bacteria[J]. Science & Technology of Food Industry, 2011, 32(9): 203-209. DOI:10.13386/j.issn1002-0306.2011.09.061.
[31] LI B, TIAN F, LIU X, et al. Effects of cryoprotectants on viability of Lactobacillus reuteri CICC6226[J]. Applied Microbiology & Biotechnology, 2011, 92(3): 609-616. DOI:10.1007/s00253-011-3269-4.
[32] 屈方宁. 海藻酸钠微胶囊对植物乳杆菌ST-III保护效果的研究[D]. 武汉: 湖北工业大学, 2016.
[33] 刘唤明, 张文滔, 吴燕燕, 等. 脂肽和茶多酚对副溶血弧菌的协同抑菌效应和机理[J]. 食品科学, 2017, 38(13): 14-19. DOI:10.7506/spkx1002-6630-201713003.
[34] BEALES N. Adaptation of microorganisms to cold temperatures, weak acid preservatives, low pH, and osmotic stress: a review[J]. Comprehensive Reviews in Food Science & Food Safety, 2010, 3(1): 1-20. DOI:10.1111/j.1541-4337.2004.tb00057.x.
[35] ANNABELLE F, JUN O, STÉPHANIE P, et al. Rerouting of pyruvate metabolism during acid adaptation in Lactobacillus bulgaricus[J]. Proteomics, 2010, 8(15): 3154-3163. DOI:10.1002/pmic.200700974.
Cryoprotective Effect of Acid-Cold Cross Stress on Lactobacillus fermentum
YANG Jie, GUO Jinfeng, LI Baokun, et al. Cryoprotective effect of acid-cold cross stress on Lactobacillus fermentum[J]. Food Science, 2020, 41(2): 101-106. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181228-343. http://www.spkx.net.cn