叶酸,也称为VB9,在嘌呤、甲酰甲硫氨酸、胸腺嘧啶、泛酸、甘氨酸、丝氨酸和蛋氨酸合成过程中作为一种碳转移反应的辅因子,对于人体健康极为重要[1]。作为一碳供体,叶酸参与核苷酸生物合成过程中发生的甲基化和甲酰化反应[2]。在妊娠期,如果缺乏叶酸将损害胚胎组织中的DNA合成,导致细胞分裂率降低[3]。植物、真菌、某些原生动物和大多数细菌可以从头开始合成叶酸,但高等动物缺乏叶酸生物合成途径的关键酶[4]。生物来源的叶酸多为多聚谷氨酸叶酸,而化学合成的叶酸膳食补充剂则多为单谷氨酸叶酸,然而,在生物体内,大多数依赖叶酸的酶更倾向于使用多聚谷氨酸叶酸而不是单体谷氨酸叶酸[5]。因 ,对于人体来说,从膳食中摄入叶酸比直接通过化学制剂摄取更有优势。
,对于人体来说,从膳食中摄入叶酸比直接通过化学制剂摄取更有优势。
在细菌和植物等模式生物中,叶酸合成和补救途径已经被广泛研究,并且在细菌和植物主要通过诱导相关基因高表达提高其叶酸产量[6-8]。乳酸菌是一类低GC含量的革兰氏阳性菌,有助于改善食品品质,改良风味,并有助于改善营养和有利于人体健康,越来越多用于生产健康的功能性食品。但在乳酸菌中,Lactococcus lactis和Streptococcus thermophilus不能合成叶酸,研究发现,植物乳杆菌(Lactobacillus plantarum)能产生叶酸[9-10]。L. plantarum可利用不同的食品基质进行发酵,包括乳制品、蔬菜、淀粉类和肉类等[11-12]。L. plantarum可以产生 B族维生 包括叶酸,且菌株合成叶酸的能力具有一定的差异性,如L. plantarum WCSF1具有较好的合成叶酸能力。产生叶酸的谷氨酸残基数量和产量主要取决于菌株本身和培养条件[13]。在分析叶酸产量的研究中,大多关注在培养末期叶酸的最终产量,而很少研究在其培养过程中叶酸产量发生的变化,对这些过程进行深入了解对更好调控叶酸产量极为重要[8,14]。
包括叶酸,且菌株合成叶酸的能力具有一定的差异性,如L. plantarum WCSF1具有较好的合成叶酸能力。产生叶酸的谷氨酸残基数量和产量主要取决于菌株本身和培养条件[13]。在分析叶酸产量的研究中,大多关注在培养末期叶酸的最终产量,而很少研究在其培养过程中叶酸产量发生的变化,对这些过程进行深入了解对更好调控叶酸产量极为重要[8,14]。
在乳酸菌叶酸合成的两条代谢支路中存在较多有调节作用的酶,在喋呤代谢支路中,三磷酸鸟苷(guanosine triohosphte,GTP)在环化水解酶I、  氢新喋呤三磷酸焦磷酸酶(d i h y d r o n e o p t e r i n triphosphate pyrophosphatase,DHNTPase)、
氢新喋呤三磷酸焦磷酸酶(d i h y d r o n e o p t e r i n triphosphate pyrophosphatase,DHNTPase)、 氢新喋呤醛缩酶及6-羟甲基
氢新喋呤醛缩酶及6-羟甲基 氢蝶呤焦磷酸激酶(6-hydroxymethyldihydropterin pyrophosphate kinase,DHPPK)的催化作用下合成6-羟甲基
氢蝶呤焦磷酸激酶(6-hydroxymethyldihydropterin pyrophosphate kinase,DHPPK)的催化作用下合成6-羟甲基 氢蝶呤焦磷酸(6-hydroxymethyldihydropterin pyrophosphate,DHPPP),这是叶酸生物合成的一个原料,该生物合成涉及的相关酶分别由folE、folQ、folB和folK基因编码表达而成,DHPPP与对氨基苯甲酸(p-aminobenzoic acid,pABA)在
氢蝶呤焦磷酸(6-hydroxymethyldihydropterin pyrophosphate,DHPPP),这是叶酸生物合成的一个原料,该生物合成涉及的相关酶分别由folE、folQ、folB和folK基因编码表达而成,DHPPP与对氨基苯甲酸(p-aminobenzoic acid,pABA)在 氢蝶酸合酶(dihydropteroate synthase,DHPS)作用下结合生成
氢蝶酸合酶(dihydropteroate synthase,DHPS)作用下结合生成 氢蝶酸,该酶由folP基因编码表达。这些基因在乳酸菌中通常以基因簇的形式存在,上述5 个基因的表达与否可直接影响整个代谢通路[15]。
氢蝶酸,该酶由folP基因编码表达。这些基因在乳酸菌中通常以基因簇的形式存在,上述5 个基因的表达与否可直接影响整个代谢通路[15]。
本研究使用2 种基质发酵,研究不同基质对叶酸产生的影响。酸性条件下叶酸不稳定,pH值低于4.5时会完全分解;而碱性或中性条件下叶酸较稳定[16-17],因 ,在本研究中,用1 株已发现的高产叶酸的L. plantarum 4-3对脱脂奶和豆浆两种基质进行发酵,通过调节其发酵过程中的pH值,探索不同发酵基质以及pH值对叶酸产量和合成叶酸相关基因表达量的影响。
,在本研究中,用1 株已发现的高产叶酸的L. plantarum 4-3对脱脂奶和豆浆两种基质进行发酵,通过调节其发酵过程中的pH值,探索不同发酵基质以及pH值对叶酸产量和合成叶酸相关基因表达量的影响。
1 材料与方法
1.1 材料与试剂
从云南传统发酵食品分离得到的L. plantarum 4-3菌株,保存于昆明理工大学生命科学与技术学院应用微生物实验室。
MRS培养基:蛋白胨10.0 g,牛肉粉 8.0 g,酵母提取物4.0 g,葡萄糖20.0 g,Tween-80 1 mL,磷酸氢 钾2.0 g,醋酸钠5.0 g,柠檬酸三铵2.0 g,七水硫酸镁0.2 g,四水硫酸锰0.05 g,加蒸馏水定容至1 L,121 ℃灭菌15 min,冷却后4 ℃保存备用。
钾2.0 g,醋酸钠5.0 g,柠檬酸三铵2.0 g,七水硫酸镁0.2 g,四水硫酸锰0.05 g,加蒸馏水定容至1 L,121 ℃灭菌15 min,冷却后4 ℃保存备用。
cowala脱脂奶购于GMP Dairy Limited公司,按10%的比例用蒸馏水溶解,105 ℃灭菌40 min。
豆浆:将温水浸泡15 h的1 kg黄豆制备成原始豆浆,采用100 目筛对原始豆浆进行过滤,并用纯水将过滤后的豆浆稀释至5 L,105 ℃灭菌40 min。
1.2 仪器与设备
BIOFLO 415发酵罐 德国Eppendorf公司;Applied Biosystems 7300实时聚合酶链式反应(polymerase chain reaction,PCR)系统 美国Thermo Fisher公司;QTRAP® 4500高效液相色 -质
-质 联用仪 美国AB Sciex公司。
联用仪 美国AB Sciex公司。
1.3 方法
1.3.1 L. plantarum 4-3菌株发酵条件
取冷冻保存的L. plantarum 4-3菌株解冻,涂布后37 ℃培养,挑取单菌落于MRS液体培养基中,37 ℃静置培养12 h,按1%比例接种至5 mL MRS肉汤培养基中,37 ℃恒温静置培养12 h,再将其按1%接种至50 mL MRS培养基中,37 ℃扩大培养12 h,通过活菌计数法计 菌液浓度,按107 CFU/mL的终浓度将其接种至5 L脱脂奶或豆浆中,37 ℃、150 r/min发酵。在控制pH值发酵过程中,使用10 mol/L NaOH溶液使MRS发酵液pH值维持在6.0。
菌液浓度,按107 CFU/mL的终浓度将其接种至5 L脱脂奶或豆浆中,37 ℃、150 r/min发酵。在控制pH值发酵过程中,使用10 mol/L NaOH溶液使MRS发酵液pH值维持在6.0。
1.3.2 L. plantarum 4-3菌株生长动态监测
发酵过程中间隔3 h取 ,将所取
,将所取 品用生理盐水按10 倍梯度稀释,分别取100 μL稀释液涂布固体MRS平板,每个
品用生理盐水按10 倍梯度稀释,分别取100 μL稀释液涂布固体MRS平板,每个 品做3 个生物学重复,37 ℃恒温培养48 h后计数。
品做3 个生物学重复,37 ℃恒温培养48 h后计数。
1.3.3 叶酸合成相关基因表达量测定
取L. plantarum 4-3菌株12、24、36、48 h发酵液进行RNA提取,使用UNIQ-10柱式Trizol总RNA抽提试剂盒(生工生物工程(上海)股份有限公司),使用反转录试剂盒HiScript II Q RT SuperMix for qPCR(南京诺唯赞生物科技有限公司)进行反转录,最后进行荧光实时定量PCR(quantitative PCR,qPCR)测定L. plantarum 4-3叶酸合成相关基因表达情况。qPCR所使用的引物均为本研究自行设计,具体序列信息见表1,使用ChamQTM SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司)对反转录后的产物进行扩增,以16S rRNA基因为内参,每个 品做3 个重复,经过梯度PCR测试。虽然每对引物溶解温度不完全一
品做3 个重复,经过梯度PCR测试。虽然每对引物溶解温度不完全一 ,但在60 ℃退火温度条件下均能达到较好的扩增效率,因
,但在60 ℃退火温度条件下均能达到较好的扩增效率,因 扩增程序统一为:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃复性30 s,扩增40 个循环后置于4 ℃保存。qPCR结果用
扩增程序统一为:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃复性30 s,扩增40 个循环后置于4 ℃保存。qPCR结果用  ΔΔCt代表相对表达量,以MRS培养基中12 h
ΔΔCt代表相对表达量,以MRS培养基中12 h 品各个基因表达量作对照。
品各个基因表达量作对照。
表 1 qPCR所使用引物及扩增效率
Table 1 Sequences of primers used in qPCR and their amplification efficiency

扩增目标基因 引物序列 扩增效率/%folE 5’-CGGGATTAGTAGAAACACCAGC-3’ 110 5’-CAACTTGAACCGTGCCAAAAAAC-3’folQ 5’-GTGTTTGGCTTATTATGGCTTG-3’ 107 5’-CCGCTCGTTGTCAGGGAT-3’folB 5’-AAGAACGGCGTAATGGTCAACAACT-3’ 93.2 5’-TCCACATCATCAAAGATTCCAGGCA-3’folK 5’-CAAGCCCTTAGCCGATTACG-3’ 104 5’-GCTTTCCCCACGGTTGAGTC-3’folP 5’-TTAGATGGGGTCGTGCTGG-3’ 109 5’-ACCCGCTTGCCAAAAAACA-3’16S rRNA 5’-AACCCAACATCTCACGACAC-3’ 98.2 5’-GCAAGGCTGAAACTCAAAGG-3’
1.3.4 叶酸含量测定
取L. plantarum 4-3在12、24、36、48、60、72、84、96 h发酵液超声破碎10 min,12 000 r/min离心5 min,将处理好的 品用高效液相色
品用高效液相色 -质
-质 联用仪进行叶酸含量测定。质
联用仪进行叶酸含量测定。质 条件:气帘气压力25 psi,碰撞气中等,离子源气1压力45 psi,离子源气2压力50 psi,电喷雾电压5 500 V,加热器温度350 ℃,选用正离子模式进行检测,离子源为电喷雾电离源。
条件:气帘气压力25 psi,碰撞气中等,离子源气1压力45 psi,离子源气2压力50 psi,电喷雾电压5 500 V,加热器温度350 ℃,选用正离子模式进行检测,离子源为电喷雾电离源。
1.4 数据统计分析
每组实验重复3 次,使用GraphPad Prism 6软件对实验所得数据进行统计分析。
2 结果与分析
2.1 L. plantarum 4-3发酵过程中生长特性
L. plantarum在发酵过程中会产生大量的有机酸,使得培养环境处于酸性条件,微生物细胞对pH值的改变非常敏感,即使是乳酸菌,在较低pH值条件下也会抑制其生命活动[17-18]。用脱脂奶发酵时,42 h的pH值降到最低,约为3.9(图1A);而以豆浆为发酵基质时,12 h时pH值降到最低,约为4(图1B)。熊涛等[19]研究发现,pH值控制在5.8~6.3之间,乳酸菌活菌数最高,不在 范围内的乳酸菌生长的活菌数较低,特别是控制pH 4.8~5.3内活菌数最低。在本研究中,使用可以自动监测并调节pH值的发酵罐培养,在整个培养周期内pH值维持在6.0时,不仅延长了平台期,而且在较长时间内维持较高的活菌数。在没有调节pH值的情况下,L. plantarum达到稳定期后在较短时间内活菌数迅速减少(图1),结果表明,调节pH值保持在6.0可以使L. plantarum 4-3菌株细胞死亡速度降低,使培养基内的活细胞密度长时间维持在较高水平。
范围内的乳酸菌生长的活菌数较低,特别是控制pH 4.8~5.3内活菌数最低。在本研究中,使用可以自动监测并调节pH值的发酵罐培养,在整个培养周期内pH值维持在6.0时,不仅延长了平台期,而且在较长时间内维持较高的活菌数。在没有调节pH值的情况下,L. plantarum达到稳定期后在较短时间内活菌数迅速减少(图1),结果表明,调节pH值保持在6.0可以使L. plantarum 4-3菌株细胞死亡速度降低,使培养基内的活细胞密度长时间维持在较高水平。 外,从菌株生长曲线可知,当以豆浆为发酵基质且维持pH 6.0时, L. plantarum 4-3达到稳定期的时间最短,且维持稳定期的时间最长,有利于次级代谢产物的产生。
外,从菌株生长曲线可知,当以豆浆为发酵基质且维持pH 6.0时, L. plantarum 4-3达到稳定期的时间最短,且维持稳定期的时间最长,有利于次级代谢产物的产生。

图 1 L. plantarum 4-3的脱脂奶(A)和豆浆(B)发酵pH值及 活菌数动态变化
Fig. 1 Dynamic changes in pH and viable cell count during culture of L. plantarum 4-3 in skim milk (A) and soybean milk (B)
2.2 L. plantarum 4-3叶酸产量
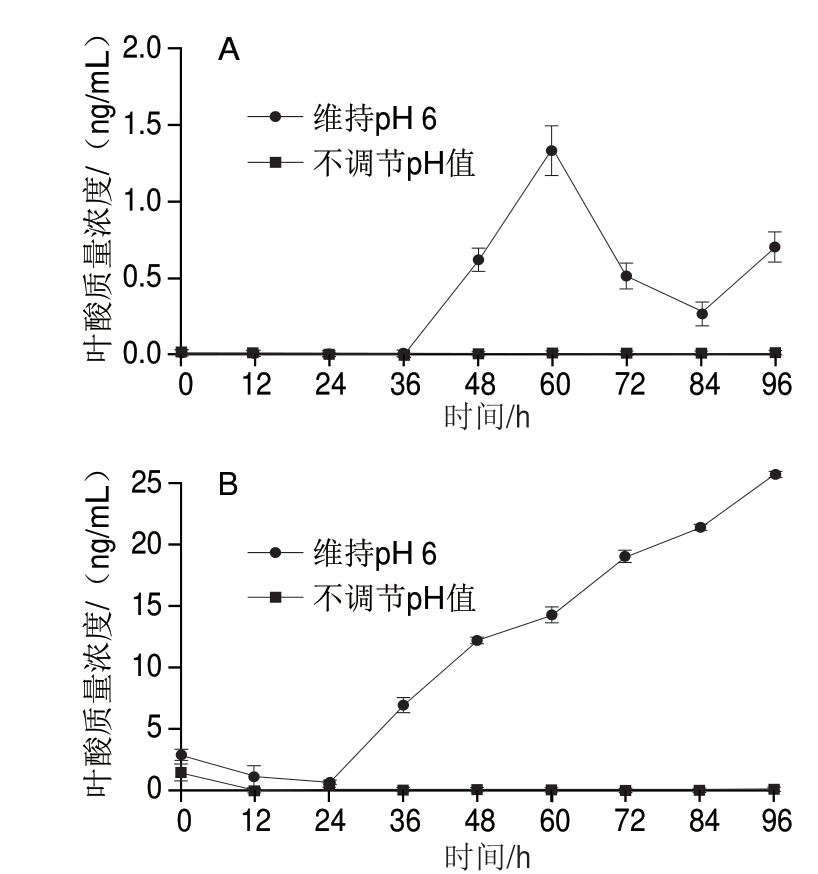
图 2 L. plantarum 4-3发酵的脱脂奶(A)和豆浆(B)叶酸含量
Fig. 2 Change in folate concentration in skim milk (A) and soybean milk (B) inoculated with L. plantarum 4-3
采用高效液相色 -质
-质 联用仪对培养96 h发酵基质中的叶酸含量进行测定(图2),结果显示,初始脱脂奶不含叶酸。Lin等[20]研究表明,叶酸作为嘌呤嘧啶合成时一碳转移的辅助因子,缺乏叶酸时,DNA合成可能会受到影响,从而影响细菌的生长。由图1菌株生长曲线可知,以脱脂奶为发酵基质时,菌株生长缓慢,到达稳定期的时间较长,约24 h。随着发酵时间的延长,未控制pH值脱脂奶中仍未检测到叶酸。当控制pH值发酵时,36 h后叶酸开始积累,第60小时达到最大值,60 h后活菌数开始下降,叶酸含量也出现下降(图2A)。
联用仪对培养96 h发酵基质中的叶酸含量进行测定(图2),结果显示,初始脱脂奶不含叶酸。Lin等[20]研究表明,叶酸作为嘌呤嘧啶合成时一碳转移的辅助因子,缺乏叶酸时,DNA合成可能会受到影响,从而影响细菌的生长。由图1菌株生长曲线可知,以脱脂奶为发酵基质时,菌株生长缓慢,到达稳定期的时间较长,约24 h。随着发酵时间的延长,未控制pH值脱脂奶中仍未检测到叶酸。当控制pH值发酵时,36 h后叶酸开始积累,第60小时达到最大值,60 h后活菌数开始下降,叶酸含量也出现下降(图2A)。
L. plantarum在生长过程中需要消耗叶酸,因 在培养过程中,L. plantarum首先消耗培养基中的叶酸继而自行合成供给细胞消耗[21]。图2B显示,初始豆浆中叶酸质量浓度约为1~2.5 ng/mL,随后叶酸含量下降,未控制pH值发酵时,第12小时叶酸质量浓度为0 ng/mL,随着发酵时间的延长也仍未检测到叶酸,而控制pH值发酵时,叶酸下降到第24小时开始逐渐累积。由于酸性条件下叶酸不稳定,pH值低于4.5时会完全分解;而碱性或中性条件下叶酸较稳定[16-17],因
在培养过程中,L. plantarum首先消耗培养基中的叶酸继而自行合成供给细胞消耗[21]。图2B显示,初始豆浆中叶酸质量浓度约为1~2.5 ng/mL,随后叶酸含量下降,未控制pH值发酵时,第12小时叶酸质量浓度为0 ng/mL,随着发酵时间的延长也仍未检测到叶酸,而控制pH值发酵时,叶酸下降到第24小时开始逐渐累积。由于酸性条件下叶酸不稳定,pH值低于4.5时会完全分解;而碱性或中性条件下叶酸较稳定[16-17],因 ,控制pH值可能减少了叶酸的降解,
,控制pH值可能减少了叶酸的降解, 外,控制pH值还可能促进叶酸的产生,所以,将通过验证叶酸相关合成基因的表达情况对
外,控制pH值还可能促进叶酸的产生,所以,将通过验证叶酸相关合成基因的表达情况对 分析。
分析。
临床推荐孕妇叶酸摄入量为400 μg/d,但主要补充化学合成叶酸,研究表明,化学合成叶酸存在一定的副作用[22-23];因 ,虽然L. plantarum 4-3发酵的脱脂奶和豆浆不能提供足够的叶酸,但可以作为天然叶酸的膳食补充剂。与其他L. plantarum野生型菌株相比[8],本研究发酵条件下,叶酸产量更高,尤其是在基因改造菌株难以直接进入食品的情况下,对其发酵条件进行调整和优化获得更多的生物合成叶酸产量极为必要[24-25]。
,虽然L. plantarum 4-3发酵的脱脂奶和豆浆不能提供足够的叶酸,但可以作为天然叶酸的膳食补充剂。与其他L. plantarum野生型菌株相比[8],本研究发酵条件下,叶酸产量更高,尤其是在基因改造菌株难以直接进入食品的情况下,对其发酵条件进行调整和优化获得更多的生物合成叶酸产量极为必要[24-25]。
2.3 L. plantarum 4-3合成叶酸基因表达量
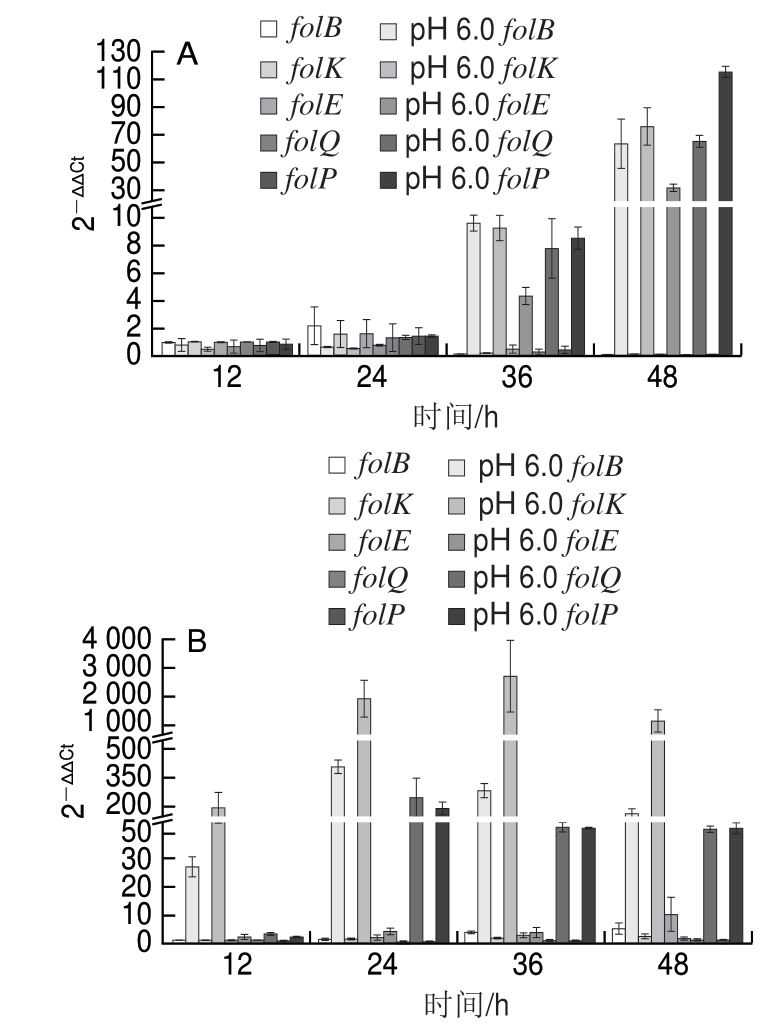
图 3 L. plantarum 4-3发酵的脱脂奶(A)和豆浆(B)叶酸合成中 主要基因的相对表达量
Fig. 3 Expression levels of major genes involved in folate biosynthesis in L. plantarum 4-3 cultured in skim milk (A) and soybean milk (B)
为研究在培养过程中pH值对叶酸合成相关基因的影响,使用qPCR方法对叶酸生物合成过程中合成DHPPP和 氢蝶酸的主要基因进行定量检测。
氢蝶酸的主要基因进行定量检测。
图3显示,在pH 6.0条件下,叶酸相关合成基因在脱脂奶和豆浆两种基质中的表达均显著提高,当维持pH 6.0时,叶酸分别在第36小时和第24小时开始积累,说明pH 6.0有利于叶酸的合成。Sybesma等[26]研究发现,乳酸菌中的DHPPK与GTP环化水解酶I是由一个folKE基因编码的双功能蛋白,过量表达该基因可以使胞外叶酸从 10 ng/mL明显增加到80 ng/mL;folE基因编码的GTP环化水解酶I是喋呤代谢支路反应的第1步,也是限速步骤[27]。维持pH 6.0发酵时,在脱脂奶和豆浆两种基质中folE基因表达量显著提高,但与其他基因相比其表达量相对较低,可能限制了叶酸的合成。folQ基因编码DHNTPase,据报道,目前只在乳酸菌和植物中被发现[28-29]。然而大部分乳杆菌属的乳酸菌中没有folQ基因,使该类乳酸菌不能有效合成叶酸[30-32]。结果显示,L. plantarum 4-3在两种基质中都具有较高的表达量;DHPS由folP基因编码表达,梁业红[33]研究表明,过量表达细菌中的folP基因可以显著提高拟南芥植株的叶酸含量。 外,DHPS催化合成的底物
外,DHPS催化合成的底物 氢蝶酸对DHPS有强烈的抑制作用[34],因
氢蝶酸对DHPS有强烈的抑制作用[34],因 过量表达folP基因可能提高了
过量表达folP基因可能提高了 氢蝶酸的含量,但
氢蝶酸的含量,但 氢蝶酸被竞争性地用于叶酸的合成和抑制DHPS的活性,两种反应竞争的结果导致叶酸的合成速度只能有限度增加。folP基因在两种基质中都有很高的表达量,但叶酸含量相对较低,也可能是由反馈抑制造成的。
氢蝶酸被竞争性地用于叶酸的合成和抑制DHPS的活性,两种反应竞争的结果导致叶酸的合成速度只能有限度增加。folP基因在两种基质中都有很高的表达量,但叶酸含量相对较低,也可能是由反馈抑制造成的。
叶酸合成的其他基因,如pABA合成通路上的相关基因,也与叶酸产量密切相关。pABA是叶酸的重要前体[13],较多叶酸合成的研究在培养基中额外添加pABA提高叶酸产率[14,24]。后续研究将深入分析 支路对 L. plantarum叶酸合成的影响,为开发富含叶酸的发酵食品提供理论支持。
支路对 L. plantarum叶酸合成的影响,为开发富含叶酸的发酵食品提供理论支持。
3 结 论
L. plantarum是应用广泛的益生菌,其可以合成叶酸的特性赋予了这类细菌更好的应用价值。乳酸菌叶酸相关合成基因数量很多,发酵条件对叶酸的合成影响很大。结果显示,与脱脂奶相比,用豆浆发酵能产生更多的叶酸。 外,L. plantarum在生长过程中持续产生有机酸使得培养基的pH值降低,将pH值稳定在6.0有利于细菌长时间保持高密度生长,在
外,L. plantarum在生长过程中持续产生有机酸使得培养基的pH值降低,将pH值稳定在6.0有利于细菌长时间保持高密度生长,在 条件下,叶酸合成相关基因也有较高的表达,大大提高了叶酸的生产水平。
条件下,叶酸合成相关基因也有较高的表达,大大提高了叶酸的生产水平。
[1] CAPOZZI V, RUSSO P, DUENAS M T, et al. Lactic acid bacteria producing b-group vitamins: a great potential for functional cereals products[J]. Applied Microbiology and Biotechnology, 2012, 96(6): 1383-1394. DOI:10.1007/s00253-012-4440-2.
[2] STOVER P J. Physiology of folate and vitamin B12 in health and disease[J]. Nutrition Reviews, 2004, 62: S3-S13. DOI:10.1111/j.1753-4887.2004.tb00070.x.
[3] ROTH C, BJORKE-MONSEN A L, REICHBOM-KJENNERUD T, et al. Use of folic acid supplements in early pregnancy in relation to maternal plasma levels in week 18 of pregnancy[J]. Molecular Nutrition & Food Research, 2013, 57(4): 653-660. DOI:10.1002/mnfr.201200116.
[4] COSSINS E A, CHEN L. Folates and one-carbon metabolism in plants and fungi[J]. Phytochemistry, 1997, 45(3): 437-452. DOI:10.1016/S0031-9422(96)00833-3.
[5] LUCOCK M. Folic acid: nutritional biochemistry, molecular biology, and role in disease processes[J]. Molecular Genetics and Metabolism, 2000, 71(1/2): 121-138. DOI:10.1006/mgme.2000.3027.
[6] KARILUOTO S, EDELMANN M, NYSTROM L, et al. In situ enrichment of folate by microorganisms in beta-glucan rich oat and barley matrices[J]. International Journal of Food Microbiology, 2014, 176: 38-48. DOI:10.1016/j.ijfoodmicro.2014.01.018.
[7] HOSSAIN T, ROSENBERG I, SELHUB J, et al. Enhancement of folates in plants through metabolic engineering[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(14): 5158-5163. DOI:10.1073/pnas.0401342101.
[8] WALKEY C J, KITTS D D, LIU Y, et al. Bioengineering yeast to enhance folate levels in wine[J]. Process Biochemistry, 2015, 50(2): 205-210. DOI:10.1016/j.procbio.2014.12.017.
[9] SYBESMA W, STARRENBURG M, TIJSSELING L, et al. Effects of cultivation conditions on folate production by lactic acid bacteria[J]. Applied & Environmental Microbiology, 2003, 69(8): 4542-4548. DOI:10.1128/AEM.69.8.4542-4548.2003.
[10] CRITTENDEN R G, MARTINEZ N R, PLAYNE M J. Synthesis and utilisation of folate by yoghurt starter cultures and probiotic bacteria[J]. International Journal of Food Microbiology, 2003, 80(3): 217-222. DOI:10.1016/s0168-1605(02)00170-8.
[11] SIEZEN R J, TZENEVA V A, CASTIONI A, et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches[J]. Environmental Microbiology, 2010, 12(3): 758-773. DOI:10.1111/j.1462-2920.2009.02119.x.
[12] VRANCKEN G, DE V L, RIMAUX T, et al. Adaptation of Lactobacillus plantarum imdo 130201, a wheat sourdough isolate, to growth in wheat sourdough simulation medium at different pH values through differential gene expression[J]. Applied and Environmental Microbiology, 2011, 77(10): 3406-3412. DOI:10.1128/AEM.02668-10.
[13] ROSSI M, AMARETTI A, RAIMONDI S. Folate production by probiotic bacteria[J]. Nutrients, 2011, 3(1): 118-134. DOI:10.3390/nu3010118.
[14] WEGKAMP A, MARS A E, FAIJRS M, et al. Physiological responses to folate overproduction in Lactobacillus plantarum WCFS1[J]. Microbial Cell Factories, 2010, 9: 100. DOI:10.1186/1475-2859-9-100.
[15] 何树芬, 李晓然, 柳陈坚. 乳酸菌合成叶酸的研究进展[J]. 微生物学通报, 2015, 42(10): 1994-2001. DOI:10.13344/j.microbiol.china.150001.
[16] 杨玉柱, 王储炎, 焦必宁. 叶酸的研究进展[J]. 农产品加工: 学刊, 2006(5): 31-35. DOI:10.3969/j.issn.1671-9646-B.2006.05.009.
[17] HUGENSCHMIDT S, SCHWENNINGER S M, GNEHM N, et al. Screening of a natural biodiversity of lactic and propionic acid bacteria for folate and vitamin B12 production in supplemented whey permeate[J]. International Dairy Journal, 2010, 20(12): 852-857. DOI:10.1016/j.idairyj.2010.05.005.
[18] 姜黎明, 罗义勇, 王良才, 等. 植物乳杆菌 产生条件及分离方法的优化[J]. 现代食品科技, 2014, 30(10): 218-226.
产生条件及分离方法的优化[J]. 现代食品科技, 2014, 30(10): 218-226.
[19] 熊涛, 徐立荣, 范镭, 等. 蔬菜发酵专用乳酸菌的菌体高密度培养[J]. 食品科学, 2007, 28(12): 345-350. DOI:10.3321/j.issn:1002-6630.2007.12.082.
[20] LIN M Y, YOUNG C M.Folate levels in cultures of lactic acid bacteria[J]. International Dairy Journal, 2000, 10(5/6): 409-413. DOI:10.1016/S0958-6946(00)00056-X.
[21] KURATSU M, HAMANO Y, DAIRI T. Analysis of the Lactobacillus metabolic pathway[J]. Applied and Environmental Microbiology, 2010, 76(21): 7299-7301. DOI:10.1128/aem.01514-10.
[22] CHRISTENSEN K E, MIKAEL L G, LEUNG K Y, et al. High folic acid consumption leads to pseudo-MTHFR deficiency, altered lipid metabolism, and liver injury in mice[J]. American Journal of Clinical Nutrition, 2015, 101(3): 646-658. DOI:10.3945/ajcn.114.086603.
[23] HU J, WANG B, SAHYOUN N R. Application of the key events doseresponse framework to folate metabolism[J]. CRC Critical Reviews in Food Technology, 2016, 56(8): 1325-1333. DOI:10.1080/10408398.2 013.807221.
[24] HUGENSCHMIDT S, SCHWENNINGER S M, LACROIX C. Concurrent high production of natural folate and vitamin B12 using a co-culture process with Lactobacillus plantarum SM39 and Propionibacterium freudenreichii DF13[J]. Process Biochemistry, 2011, 46(5): 1063-1070. DOI:10.1016/j.procbio.2011.01.021.
[25] PADALINO M, PEREZ-CONESA D, LOPEZ-NICOLAS R, et al. Effect of fructooligosaccharides and galactooligosaccharides on the folate production of some folate-producing bacteria in media cultures or milk[J]. International Dairy Journal, 2012, 27(1/2): 27-33. DOI:10.1016/j.idairyj.2012.06.006.
[26] SYBESMA W, STARRENBURG M, KLEEREBEZEM M, et al. Increased production of folate by metabolic engineering of Lactococcus lactis[J]. Applied & Environmental Microbiology, 2003, 69(6): 3069-3076. DOI:10.1128/AEM.69.6.3069-3076.2003.
[27] EL Y B, BONNETT S, ANDERSON J N, et al. Discovery of a new prokaryotic type I GTP cyclohydrolase family[J]. Journal of Biological Chemistry, 2007, 281(49): 37586-37593. DOI:10.1074/jbc.M607114200.
[28] CRECY-LAGARD V D, YACOUBI B E, GARZA R D D L, et al. Comparative genomics of bacterial and plant folate synthesis and salvage: predictions and validations[J]. BMC Genomics, 2007, 8(1): 245. DOI:10.1186/1471-2164-8-245.
[29] KLAUS S M, WEGKAMP A, SYBESMA W, et al. A nudix enzyme removes pyrophosphate from dihydroneopterin triphosphate in the folate synthesis pathway of bacteria and plants[J]. Journal of Biological Chemistry, 2005, 280(7): 5274. DOI:10.1074/jbc.m413759200.
[30] SYBESMA W, STARRENBURG M, TIJSSELING L, et al. Effects of cultivation conditions on folate production by lactic acid bacteria[J]. Applied & Environmental Microbiology, 2003, 69(8): 4542-4548. DOI:10.1128/AEM.69.8.4542-4548.2003.
[31] LEBLANC J G, MILANI C, DE-GIORI G S, et al. Bacteria as vitamin suppliers to their host: a gut microbiota perspective[J]. Current Opinion in Biotechnology, 2013, 24(2): 160-168. DOI:10.1016/j.copbio.2012.08.005.
[32] CRITTENDEN R G, MARTINEZ N R, PLAYNE M J. Synthesis and utilisation of folate by yoghurt starter cultures and probiotic bacteria[J]. International Journal of Food Microbiology, 2003, 80(3): 217-222. DOI:10.1016/s0168-1605(02)00170-8.
[33] 梁业红. 过量表达细菌的FolC和FolP基因对提高拟南芥叶酸含量的研究[D]. 北京: 中国农业科学院, 2005.
[34] NEUBURGER M, REBEILLE F, JOURDAIN A, et al. Mitochondria are a major site for folate and thymidylate synthesis in plants[J]. Journal of Biological Chemistry, 1996, 271(16): 9466. DOI:10.1074/jbc.271.16.9466.