 对酶的活性有促进作用。利用菌株ZX-5 β-D-半乳糖苷酶分解乳糖并合成低聚半乳糖(galacto-oligosaccharide,GOS),在35 ℃、乳糖质量浓度60 g/100 mL、酶浓度1.0 U/mL条件下,乳糖水解率达68.34%(50 h),GOS产率达34.70%(40 h),具有潜在的应用前景。
对酶的活性有促进作用。利用菌株ZX-5 β-D-半乳糖苷酶分解乳糖并合成低聚半乳糖(galacto-oligosaccharide,GOS),在35 ℃、乳糖质量浓度60 g/100 mL、酶浓度1.0 U/mL条件下,乳糖水解率达68.34%(50 h),GOS产率达34.70%(40 h),具有潜在的应用前景。β-D-半乳糖苷酶,俗称乳糖酶,能够催化乳糖水解生成葡萄糖和半乳糖[1];有些酶还具有良好的转糖基活性,即能以乳糖为底物催化合成低聚糖[2]。β-D-半乳糖苷酶不仅可以用于降低乳中乳糖含量,生产低乳糖乳制品,并防止浓缩乳制品结晶,还可以用于生产低聚半乳糖(galacto-oligosaccharide,GOS)[3]。GOS是在乳糖分子的半乳糖基侧以β-1,4糖苷键的形式连接了1~7 个半乳糖基形成的混合杂聚糖[4]。作为一种新型功能性益生元,GOS具有促进肠道双歧杆菌增殖、改善矿物质元 吸收、改善脂质代谢、预防和治疗便秘等功能[5-7]。利用安全、高效的β-D-半乳糖苷酶,采用酶法合成GOS近年来受到了广泛的关注[8]。
吸收、改善脂质代谢、预防和治疗便秘等功能[5-7]。利用安全、高效的β-D-半乳糖苷酶,采用酶法合成GOS近年来受到了广泛的关注[8]。
β-D-半乳糖苷酶可从植物、动物和微生物(细菌、霉菌或酵母)中获得[9]。不同来源β-D-半乳糖苷酶的酶学性质差异很大[10],其中,微生物源酵母产β-D-半乳糖苷酶活性较高。Chockchaisawasdee等[11]用乳酸克鲁维酵母所产β-D-半乳糖苷酶处理乳糖,乳糖水解率高达92%;剧淑君[12]用马克斯克鲁维酵母β-D-半乳糖苷酶制备GOS,乳糖转化率为30.1%。通常乳酸克鲁维酵母、脆壁克鲁维酵母等产生的β-D-半乳糖苷酶具有较强的水解活性[13];米曲霉、保加利亚乳杆菌、嗜热链球菌等产生的β-D-半乳糖苷酶具有较强的转糖基活性[14]。在安全性方面,通常克鲁维酵母、黑曲霉等来源的酶比较安全[15],来源于大肠杆菌的β-D-半乳糖苷酶易受到内毒 污染[12]。微生物源性β-D-半乳糖苷酶具有良好的工业应用价值[1];克鲁维酵母的Maxilact系列是当前主要的商品β-D-半乳糖 苷酶[16]。由于来源于酵母的β-D-半乳糖苷酶的最适pH值偏弱酸性,因
污染[12]。微生物源性β-D-半乳糖苷酶具有良好的工业应用价值[1];克鲁维酵母的Maxilact系列是当前主要的商品β-D-半乳糖 苷酶[16]。由于来源于酵母的β-D-半乳糖苷酶的最适pH值偏弱酸性,因 更适于生产低乳糖乳制品及GOS,并应用于预防乳糖不耐受症及其他相关功能性食品的 研发[17]。但当前仍然缺乏优良的产β-D-半乳糖苷酶并具有良好的转糖基活性的菌株。
更适于生产低乳糖乳制品及GOS,并应用于预防乳糖不耐受症及其他相关功能性食品的 研发[17]。但当前仍然缺乏优良的产β-D-半乳糖苷酶并具有良好的转糖基活性的菌株。
藏灵菇是一种由乳酸菌、酵母、醋酸菌等微生物形成的共生体[18]。藏灵菇发酵产物具有β-D-半乳糖苷酶活性,能够有效地水解乳糖,可用于治疗乳糖不耐症等多种代谢性疾病[19]。前期研究还发现藏灵菇能有效地将乳糖水解后转化为低聚糖[20]。本研究拟从藏灵菇中分离高产β-D-半乳糖苷酶菌株,通过培养基和发酵条件优化,制备高活性的β-D-半乳糖苷酶,并明确其酶学特性及产酶条件,制备GOS,为其实际应用奠定技术基础。
藏灵菇取自西藏林芝牧户发酵剂;邻硝基苯-β-D-半乳糖苷(o-nitrophenyl β-D-galactopyranoside,ONPG)、邻硝基苯酚(o-nitrophenol,ONP)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)、乳糖、葡萄糖、磷酸 氢钠、磷酸氢
氢钠、磷酸氢 钠、十
钠、十 水合磷酸氢
水合磷酸氢 钠、
钠、 水合磷酸
水合磷酸 氢钠、氯化钠、碳酸钠、硫酸镁、硫酸锰、硫酸铵、硫酸亚铁、硫酸铁(均为分析纯),蛋白胨、酵母浸膏和牛肉膏(生化 试剂) 中国医药集团有限公司;酵母抽提物(生化 试剂) 英国Oxoid公司;Ezup柱式真菌基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司。
氢钠、氯化钠、碳酸钠、硫酸镁、硫酸锰、硫酸铵、硫酸亚铁、硫酸铁(均为分析纯),蛋白胨、酵母浸膏和牛肉膏(生化 试剂) 中国医药集团有限公司;酵母抽提物(生化 试剂) 英国Oxoid公司;Ezup柱式真菌基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司。
PL203型电子天平 梅特利-托利多(上海)仪器有限公司;1-4/2-4 LSC型冷冻干燥机 北京五洲东方科技发展有限公司;CR21GIII型高速冷冻离心机、U-3900型紫外-可见分光光度计 日本Hitachi公司;VORTEX-5型旋涡振荡器 上海精科实业有限公司;BX53F型荧光显微镜 日本Olympus公司;MLS-3781L型自动灭菌锅 日本Panasonic公司;THZ-D型电热恒温培养箱 上海一恒仪器科技有限公司;041BR101783型基础电泳仪 美国Bio-Rad公司;DDBJ-350型便携式电导率仪 上海仪电科学仪器股份有限公司;MLS-3750型高压蒸汽灭 菌器 日本三洋公司;HPLC-20A高效液相色 仪 日本岛津公司。
仪 日本岛津公司。
1.3.1 高产β-半乳糖苷酶菌株的筛选、分离及鉴定
1.3.1.1 培养基的制备
筛选培养基:乳糖10 g/L,胰蛋白胨5 g/L,酵母浸膏 10 g/L,NaCl 4 g/L,X-gal 0.035 g/L,琼脂20 g/L,pH 7.0。
活化培养基:蛋白胨10 g/L,酵母膏20 g/L,葡萄糖 40 g/L;装液量1 mL/1.5 mL离心管,接种量2.0%(V/V)。
发酵培养基:蛋白胨20 g/L,酵母膏10 g/L,葡萄糖20 g/L;装液量30%,接种量2.0%(V/V),温度30 ℃,摇床转速150 r/min。
1.3.1.2 菌株初筛
将藏灵菇以10 g/100 mL接种于纯牛乳中,在28 ℃恒温箱中培养24 h,重复3 次。取第3次的发酵乳1 mL,加入9 mL无菌蒸馏水,均匀混和后进行梯度稀释。分别移取200 μL不同梯度浓度菌液均匀涂布于筛选培基上,置于30 ℃恒温箱中培养24~36 h。从筛选培养基上挑取带有较深蓝色水解圈的单菌落进行平板划线,重复划线3 次,得到纯菌。将菌体转接到种子培养基中,在30 ℃培养16 h,之后置于 80 ℃甘油管冷冻保藏。
80 ℃甘油管冷冻保藏。
1.3.1.3 菌株复筛
将甘油管中菌体以2%接种量(V/V)接到装有100 mL发酵培养基的三 瓶中,30 ℃、100 r/min条件下发酵36 h。离心(4 ℃,10 000 r/min,10 min)后,分别测定上清液和菌体沉淀物的水解酶活力,以确定所产酶为胞内酶或胞外酶,并进行高产酶菌株的筛选。
瓶中,30 ℃、100 r/min条件下发酵36 h。离心(4 ℃,10 000 r/min,10 min)后,分别测定上清液和菌体沉淀物的水解酶活力,以确定所产酶为胞内酶或胞外酶,并进行高产酶菌株的筛选。
1.3.1.4 菌落及细胞形态观察
取发酵后的菌液,稀释后进行平板涂布,于30 ℃恒温箱中培养36 h,观察菌落形态。挑取一环甘油管保藏的菌种,进行镜检观察。
1.3.1.5 菌株的鉴定
用Ezup柱式真菌基因组DNA抽提试剂盒对纯化后的菌株进行DNA的提取。利用提取的总DNA对ITS保守序列进行PCR扩增获得目的基因片段。采用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)扩增序列,PCR体系:2h Mix 25 μL、引物各l μL、模板DNA 2 μL,ddH2O补足至50 μL。PCR条件:94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸50 s,35 个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检验后送生工生物工程(上海)股份有限公司进行测序。
1.3.2 β-D-半乳糖苷酶生产单因 试验
试验
对影响马克斯克鲁维酵母菌ZX-5产β-D-半乳糖苷酶的主要因 (培养基的碳源和氮源、发酵温度、培养基初始pH值、摇瓶转速)分别进行单因
(培养基的碳源和氮源、发酵温度、培养基初始pH值、摇瓶转速)分别进行单因 试验。以酶活力为指标,选用发酵培养基,接种量2%,发酵36 h。将发酵培养基中的碳源(葡萄糖)分别以等量的乳糖、半乳糖、果糖、蔗糖作为碳源进行替换;将发酵培养基中的氮源(蛋白胨)分别以等量的胰蛋白胨、大豆蛋白胨、酵母膏、硫酸铵作为氮源进行替换;选取发酵温度分别为20、25、30、35、40 ℃(其他发酵条件为pH 6.5,转速 150 r/min);调节培养基初始pH值分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0(其他发酵条件为发酵温度30 ℃,转速150 r/min);选取发酵转速分别为0、50、100、150、200 r/min(其他发酵条件为发酵温度30 ℃,pH 6.5)。
试验。以酶活力为指标,选用发酵培养基,接种量2%,发酵36 h。将发酵培养基中的碳源(葡萄糖)分别以等量的乳糖、半乳糖、果糖、蔗糖作为碳源进行替换;将发酵培养基中的氮源(蛋白胨)分别以等量的胰蛋白胨、大豆蛋白胨、酵母膏、硫酸铵作为氮源进行替换;选取发酵温度分别为20、25、30、35、40 ℃(其他发酵条件为pH 6.5,转速 150 r/min);调节培养基初始pH值分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0(其他发酵条件为发酵温度30 ℃,转速150 r/min);选取发酵转速分别为0、50、100、150、200 r/min(其他发酵条件为发酵温度30 ℃,pH 6.5)。
1.3.3 β-D-半乳糖苷酶活力测定方法
1.3.3.1 ONP标准曲线
称取13.92 mg的ONP(精确到0.001 g)溶于10 mL水中,配制成10 mmol/L的标准溶液。取0、0.4、0.8、1.2、1.6、2.0 mL的上述溶液于1~6号试管中,分别添加2.0、1.6、1.2、0.8、0.4、0 mL的水,定容到2.0 mL,配制成0、2、4、6、8、10 mmol/L的ONP标准液。用分光光度计测量产物在420 nm波长处的吸光度。
1.3.3.2 酶活力测定方法
以50 mmol/L pH 6.5的PBS为溶剂配制质量浓度为1 mg/mL的ONPG溶液。取2 mL上述溶液于试管中,在35 ℃的环境下预热10 min后,加入1 mL稀释后的β-D-半乳糖苷酶液,于35 ℃反应15 min,然后加入2.5 mL 0.15 mol/L的Na2CO3溶液终止反应,静置5 min,用分光光度计测量产物在420 nm波长处的吸光度。
β-D-半乳糖苷酶活定义:在35 ℃条件下,1 min催化ONPG反应生成1 μmol ONP的酶量定义为一个标准酶活力单位。
1.3.4 粗酶液的制备
冷冻的菌株解冻后,接种到活化培养基中,接种量2%,35 ℃恒温培养16 h,重复3 代。后接种于发酵培养基中,接种量2%,150 r/min,30 ℃恒温培养36 h。取30 mL充分摇匀后的菌液装于离心管中,在4 ℃、10 000 r/min离心10 min,倒掉上清液。用pH 6.5的磷酸盐缓冲液(phosphate buffer saline,PBS)清洗2 次,离心后倒掉上清液,再加入30 mL PBS,充分振荡后,使用超声波细胞破碎仪进行细胞破碎,得到粗酶液。
1.3.5 β-D-半乳糖苷酶的提纯
1.3.5.1 硫酸铵分级沉淀
在冰水浴中放置9 个分别装有10 mL粗酶液的烧杯,在磁力搅拌条件下缓慢加入研磨过的(NH4)2SO4粉末,分别添加至不同饱和度(20%~90%),旋涡搅拌20 min,然后在4 ℃静置30 min,离心(4 ℃,8 000 r/min,15 min),取上清液测定酶活力[21]。空白组只添加各饱和度的PBS。以上清液中水解酶活对(NH4)2SO4的饱和度作图,得到硫酸铵分级沉淀的曲线,确定(NH4)2SO4分级沉淀的饱和度。
1.3.5.2 透析脱盐处理
将硫酸铵分级沉淀后酶液装入透析袋中,进行透析操作。透析缓冲液为浓度50 mmol/L的PBS。在4 ℃的环境中透析,平均每4 h换一次透析液,透析1~2 d,用电导率仪测定缓冲液的电导率,直至电导率不变时脱盐完成。
1.3.5.3 DEAE-Sepharose离子交换柱层析
DEAE-Sepharose Fast Flow离子交换柱用浓度 50 mmol/L,pH 6.5的PBS冲洗平衡4 个柱体积后,将透析后得到的酶液溶解在PBS中,上 10 mL。先用PBS洗脱,流速为1.0 mL/min,换用不同浓度的NaCl缓冲液进行浓度梯度冲洗,浓度分别为0.3、0.5、0.9 mol/L。分别收集每一个
10 mL。先用PBS洗脱,流速为1.0 mL/min,换用不同浓度的NaCl缓冲液进行浓度梯度冲洗,浓度分别为0.3、0.5、0.9 mol/L。分别收集每一个 的洗脱液,然后检测酶活性。经透析、冷冻干燥得到纯化酶。
的洗脱液,然后检测酶活性。经透析、冷冻干燥得到纯化酶。
1.3.6 酶学性质研究
1.3.6.1 酶反应的最适温度
取6 支试管,分别加入2 mL ONPG溶液,再添加1 mL稀释后的纯化酶液,分别置于25、30、35、40、45、50 ℃的水浴锅中反应15 min,测定其相对酶活力。
1.3.6.2 酶反应的最适pH值和pH值稳定性
取6 支试管分别加入稀释后的纯化酶液1 mL,用pH值分别为4、5、6、7、8、9的PBS配制ONPG溶液,测定其相对酶活。
1.3.6.3 金属离子对酶活的影响
用50 mmol/L pH值为6.5的PBS制备浓度为10 mmol/L 的含有不同金属离子化合物(CuCl2、CaCl2、MgCl2、MnSO4、FeCl3、ZnCl2、FeCl2)的溶液,然后以 溶液配制质量浓度为1 mg/mL的ONPG溶液,测定含不同金属离子溶液中β-D-半乳糖苷酶的相对酶活变化。
溶液配制质量浓度为1 mg/mL的ONPG溶液,测定含不同金属离子溶液中β-D-半乳糖苷酶的相对酶活变化。
1.3.7 β-D-半乳糖苷酶产低聚糖的特性
将3.0 g乳糖溶于4.5 mL pH 6.0的PBS中(乳糖终质量分数为60%),置于35 ℃保温30 min。取一定量来源于菌株ZX-5所产的β-D-半乳糖苷酶溶于5 mL缓冲液中,轻摇混合均匀,从中取0.5 mL酶液加入乳糖溶液,制成5.0 mL的终反应体系,酶的终浓度为1.0 U/mL。在35 ℃条件下进行反应,分别于0、4、8、12、20、30、40、50 h从中取 100 μL,迅速置于沸水浴10 min终止酶反应。冷却后稀释10 倍,再过0.45 μm的滤膜除去杂质,采用高效液相色
100 μL,迅速置于沸水浴10 min终止酶反应。冷却后稀释10 倍,再过0.45 μm的滤膜除去杂质,采用高效液相色 法测定其中各种产物的产量。每个
法测定其中各种产物的产量。每个 品、每个时间点重复3 次。
品、每个时间点重复3 次。
实验数据均采用3 次平行实验取平均值,采用SPSS软件进行方差分析,P<0.05,差异显著。
2.1.1 菌株初筛
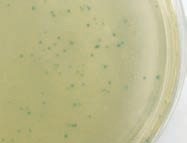
图 1 从藏灵菇中分离得到具有蓝色水解圈的菌落
Fig. 1 Bacterial colonies with blue hydrolysis circles isolated from Tibet kefir
X-gal可以在β-D-半乳糖苷酶的催化下生成蓝色产物,是β-D-半乳糖苷酶的显色底物,且蓝色越深, β-D-半乳糖苷酶的活力越高[19]。如图1所示,使用以乳糖为唯一碳源、添加X-gal的筛选培养基平板,从藏灵菇中分离得到大量的呈现蓝色水解圈的菌落。选择水解圈较大、颜色较深的菌落用于产β-D-半乳糖苷酶菌株的复筛。
2.1.2 菌种复筛
挑取上述所得呈现蓝色水解圈较大的菌落接种于发酵培养基,经摇瓶发酵培养,对发酵液离心所得菌体进行破壁处理,进一步离心,经酶活测定,酶活力主要集中在上清液中,即所产β-D-半乳糖苷酶为胞内酶。挑选酶活力最高的菌落,命名为ZX-5。
2.1.3 菌落及细胞形态观察

图 2 ZX-5菌落及细胞形态观察
Fig. 2 Colony morphology and microscopic graph of ZX-5
a. ZX-5菌落形态;b.显微镜观察细胞形态(10h 100)。
将ZX-5在培养基平板中培养后,对其所形成的菌落进行观察,如图2a所示,菌落为乳白色,大而厚,湿润,表面光滑不透明,黏稠。镜检观察的结果如图2b所示,根据细胞形态,初步确定该菌株为酵母。
2.1.4 菌株的鉴定
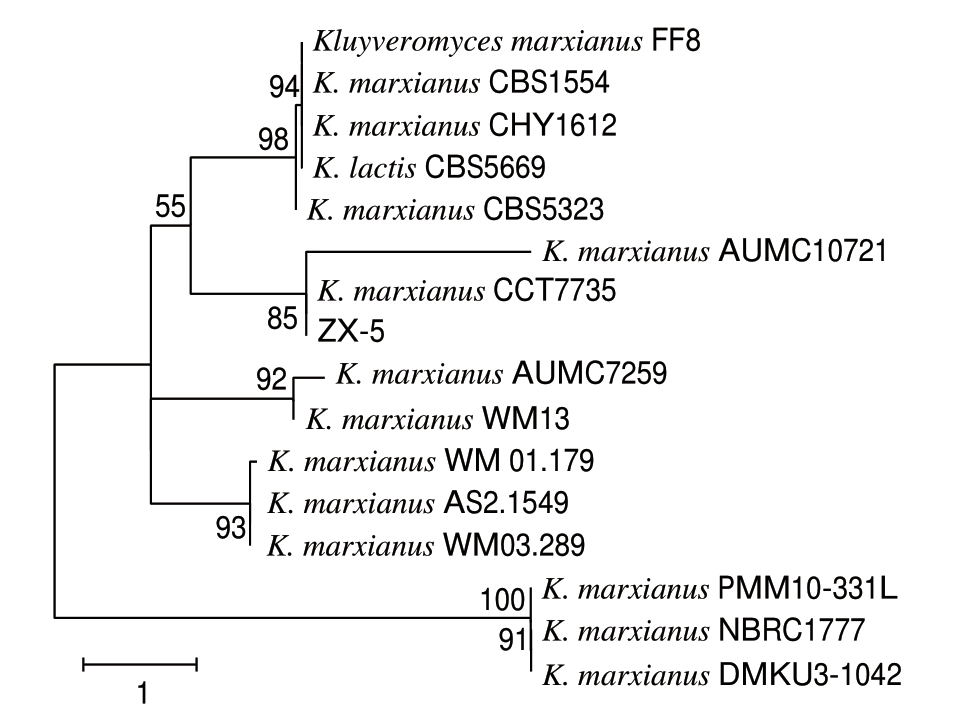
图 3 菌株ZX-5 ITS序列系统进化树
Fig. 3 Phylogenetic tree based on ITS sequences of ZX-5
ITS序列分析具有技术简单、结果准确、重复性好等优点,近年来广泛应用于真菌菌株的鉴定,是一种重要分子标记[22]。以引物ITS1、ITS4扩增序列,结果显示扩增产物长度为726 bp。通过BLAST搜索相关序列,将测序结果与GenBank中已知序列进行比较分析,发现其序列与 K. marxianus CCT7735(CP009307.1)相似度为100%;选取与ZX-5 ITS序列相似度高的15 株菌株构建系统进化树(图3)。根据序列分析结合形态学观察,可以确定ZX-5为马克斯克鲁维酵母。
ONP标准曲线回归方程:y=0.176 2x 0.163 4, R2=0.999 7。
0.163 4, R2=0.999 7。
 试验
试验2.3.1 碳源、氮源对产酶的影响
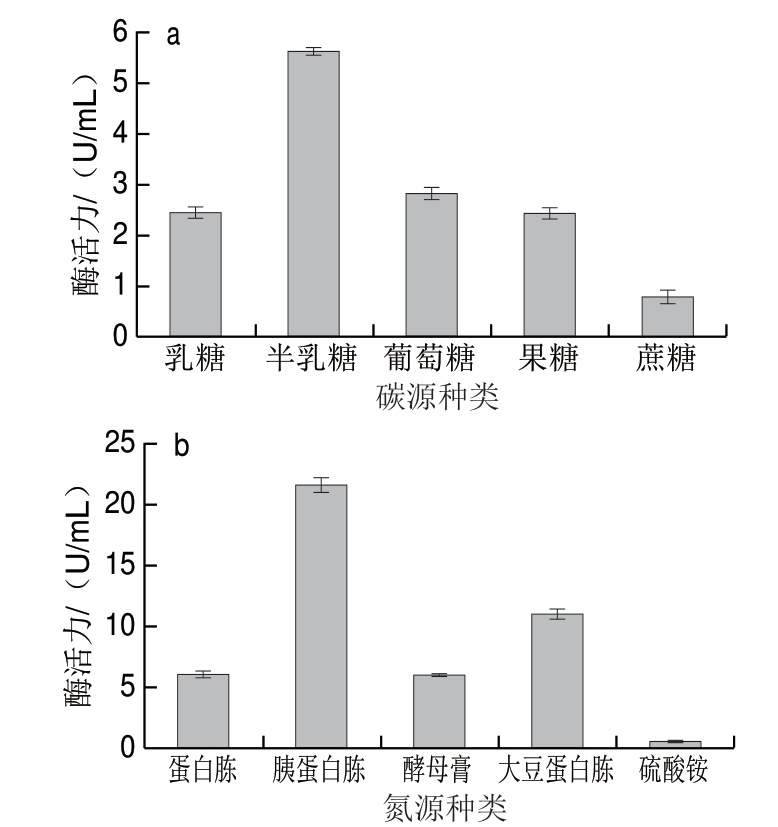
图 4 碳源(a)、氮源(b)对菌株ZX-5发酵产酶的影响
Fig. 4 Effects of carbon (a) and nitrogen (b) sources on β-D-galactosidase activity of ZX-5
碳源、氮源是酵母产酶所需的主要营养物质和能量来源[23]。如图4所示,不同碳源、氮源对菌株产酶活性存在着显著性的差异。以半乳糖、葡萄糖、果糖为碳源的水解酶活力比以乳糖和蔗糖的高,其中以半乳糖为碳源时菌株所产酶活力最高,这可能与半乳糖、葡萄糖和果糖作为单糖易于被菌体直接吸收利用有关;以胰蛋白胨为氮源的水解酶活力最高,以硫酸铵为氮源的水解酶活力最低,其原因可能是蛋白胨类有机氮源降解后形成的小分子肽类物质易于被微生物直接利用[23],而使用无机氮源时,氮源利用率低,菌体生长缓慢,产生的水解酶活力偏低。
2.3.2 发酵温度、初始pH值、摇床转速对产酶的影响
如图5a所示,温度能影响细胞内相关生物酶的催化效率,从而间接影响菌体的生长及代谢产物的产率[24]。培养温度为30 ℃时,马克斯克鲁维酵母产β-D-半乳糖苷酶的水解酶活力达到最大值;低于30 ℃时,酶活力与温度呈正相关,即菌株产酶随着培养温度的升高而增加;高于30 ℃时,随着温度升高可能会对酵母代谢产生不利的影响,从而使菌株产酶呈现下降趋势。该菌的最适发酵温度与文献报道的K. marxianus Z-5较为相似[25]。由 ,选择30 ℃为适宜的发酵温度。
,选择30 ℃为适宜的发酵温度。
图5b显示了不同初始pH值的培养基对菌株ZX-5产酶的影响。在较低或者较高pH值环境下发酵,菌株的水解酶活力普遍较低;而在偏中性的pH值环境,菌株水解酶活力相对较高。当pH值小于6.5时,菌株产水解酶活力与pH值呈正相关,在pH 6.5时酶活力达到最大值;当pH值大于6.5时,菌株产水解酶活力与pH值呈负相关。由 ,选择培养基初始pH 6.5进一步研究。
,选择培养基初始pH 6.5进一步研究。

图 5 发酵温度(a)、培养基初始pH值(b)、摇床转速(c) 对菌株ZX-5发酵产酶的影响
Fig. 5 Effects of temperature (a), initial medium pH (b) and shaking speed (c) on β-D-galactosidase activity of ZX-5
发酵产酶效率很大程度上受培养基中溶解氧速度的影响。当培养基中氧含量过低时,培养基稠度较高;培养基中氧含量过高时,产物的积累效率会大大降低[26]。由图5c可以看出,转速在0~100 r/min范围内,β-D-半乳糖苷酶的水解酶活力随着摇床转速的增加而升高,当转速达到100 r/min时,水解酶活力达到 值。而后随转速增加,水解酶活力呈下降趋势。由
值。而后随转速增加,水解酶活力呈下降趋势。由 ,选择100 r/min为适宜的摇床转速。
,选择100 r/min为适宜的摇床转速。
2.4.1 硫酸铵分级沉淀
由图6可知,当粗酶液中添加的硫酸铵的饱和度在0%~50%范围时,上清液中酶活力变化不大;随着硫酸铵的饱和度逐渐增大,尤其当饱和度达60%以上时,上清液中残余酶活大幅度下降;当饱和度达到80%时,上清液中酶活力已很低,这表明大部分的酶已经沉淀下来。因 ,在用硫酸铵分级沉淀提取酶时,可以先在硫酸铵饱和度30%时沉淀去除一部分杂质蛋白,然后继续添加硫酸铵,使饱和度达到80%,收集所得的沉淀于50 mmol/L PBS中保存。
,在用硫酸铵分级沉淀提取酶时,可以先在硫酸铵饱和度30%时沉淀去除一部分杂质蛋白,然后继续添加硫酸铵,使饱和度达到80%,收集所得的沉淀于50 mmol/L PBS中保存。
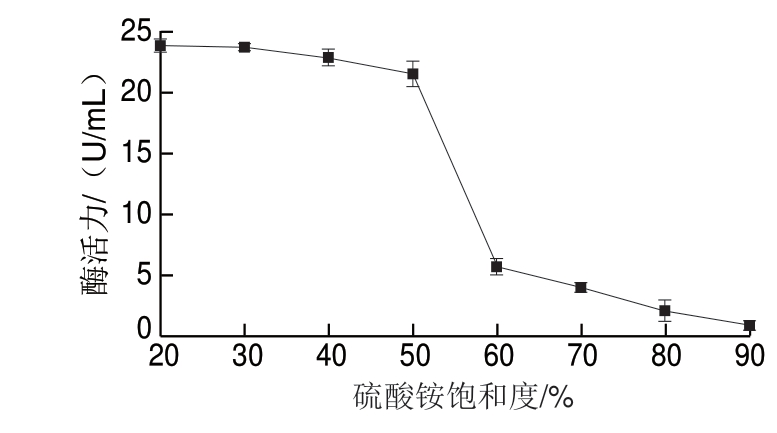
图 6 硫酸铵沉淀上清液中β-D-半乳糖苷酶活力变化曲线
Fig. 6 Enzymatic activity of β-D-galactosidase in supernatants after precipitation with various degrees of (NH4)2SO4 saturation
2.4.2 DEAE-Sepharose Fast Flow离子交换柱层析
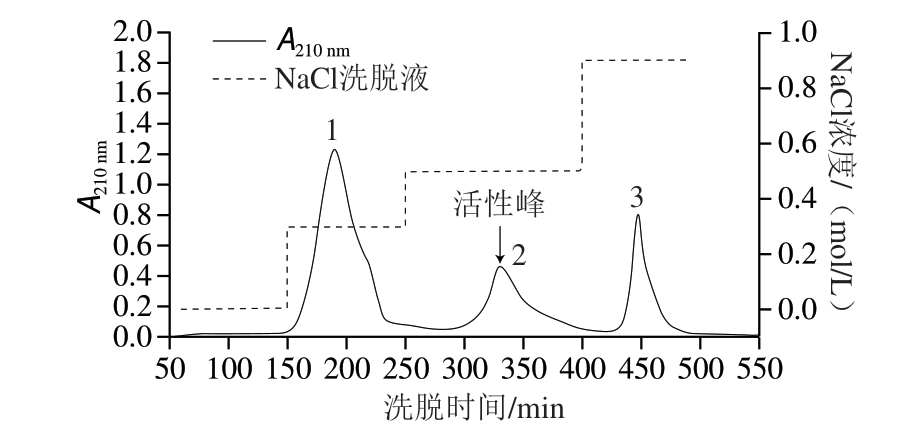
图 7 DEAE-Sepharose Fast Flow离子交换色谱分离纯化β-D-半乳糖苷酶
Fig. 7 Purification of β-D-galactosidase on DEAE-Sepharose Fast Flow
如图7所示,用PBS洗脱时,没有出现活性 。后用浓度为0.3、0.5、0.9 mol/L的NaCl缓冲液进行线性梯度洗脱,出现3 个
。后用浓度为0.3、0.5、0.9 mol/L的NaCl缓冲液进行线性梯度洗脱,出现3 个 ,经检测第2个
,经检测第2个 具有水解酶活性,表明β-D-半乳糖苷酶主要在含0.5 mol/L NaCl缓冲液中被洗脱下来。因
具有水解酶活性,表明β-D-半乳糖苷酶主要在含0.5 mol/L NaCl缓冲液中被洗脱下来。因 ,经过DEAE-Sepharose Fast Flow离子交换层析,杂蛋白被去除,获得了纯化酶,其比活力为157.35 U/mg。
,经过DEAE-Sepharose Fast Flow离子交换层析,杂蛋白被去除,获得了纯化酶,其比活力为157.35 U/mg。
2.4.3 温度对β-D-半乳糖苷酶活性的影响
温度的高低对酶的催化活性和酶的稳定性具有明显影响[27]。由图8a可知,当温度低于35 ℃时,水解酶活力与温度呈正相关,35 ℃时,酶活力达到最大值。继续升高温度,酶活力呈现下降趋势。如图8b所示,在20~40 ℃范围内处理酶液30 min后,酶活力仍保留在80%以上,可见菌株ZX-5的β-D-半乳糖苷酶在低于40 ℃时稳定性较好;当温度高于50 ℃时处理30 min后,β-D-半乳糖苷酶的残余酶活力约为40%,酶活力损失比较大;当温度60 ℃时处理30 min,残余酶活力不足20%。据文献报道,乳酸克鲁维酵母产酶在温度超过35 ℃后失活较快,60 ℃保温15 min,酶即失活90%[28]。这也与本实验所得的结论相接近。
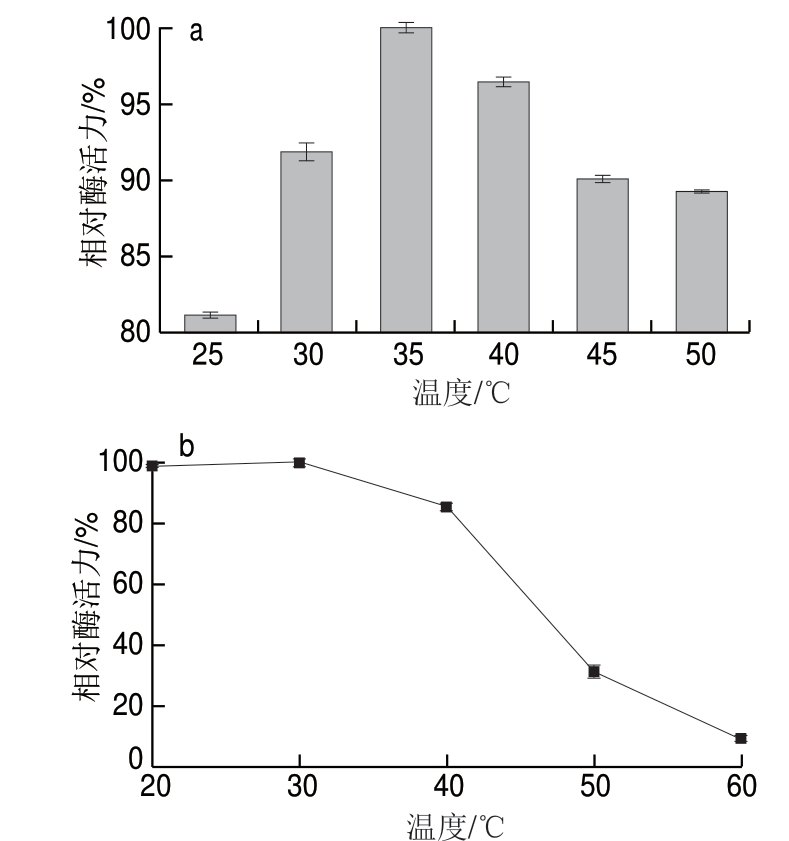
图 8 温度对β-D-半乳糖苷酶活性(a)及热稳定性(b)的影响
Fig. 8 Effect of temperatures on β-D-galactosidase activity (a) and thermal stability (b)
2.4.4 pH值对β-D-半乳糖苷酶活性的影响

图 9 pH值对β-D-半乳糖苷酶活性的影响
Fig. 9 Effect of pH value on β-D-galactosidase activity
pH值能影响酶的分子构象、酶和底物的解离状态以及酶活力的稳定性[29]。如图9所示,马克斯克鲁维酵母ZX-5产的β-D-半乳糖苷酶的最适pH值为6.0。该酶在pH 5.0~7.0的范围内,其相对酶活力在90%以上,酶活性比较稳定,而在较强酸性(pH 4.0)或者碱性(pH 9.0)环境中,其酶活力损失很大。该酶与已报道菌株LW106的β-D-半乳糖苷酶最适pH值较为相似[30],而与Katrolia等[31]研究的基因重组菌株的酶最适pH 5.5有所差别。
2.4.5 金属离子对β-D-半乳糖苷酶活性的影响
金属离子能够影响酶活性,可以激活或抑制酶的活性位点[32]。由图10可知,金属离子Ca2 、Mg2
、Mg2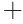 、Fe2
、Fe2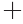 能轻微抑制β-D-半乳糖苷酶水解活性,而Cu2
能轻微抑制β-D-半乳糖苷酶水解活性,而Cu2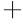 、Fe3
、Fe3 、 Zn2
、 Zn2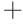 对酶活性的抑制作用较大,其中Cu2
对酶活性的抑制作用较大,其中Cu2 对酶活性抑制作用最大,可使酶活力下降至20%左右;Mn2
对酶活性抑制作用最大,可使酶活力下降至20%左右;Mn2 对酶活性具有一定的激活作用。据报道,某些金属离子如Cu2
对酶活性具有一定的激活作用。据报道,某些金属离子如Cu2 能与酶分子中游离的羧基结合,生成不溶性的盐类物质,改变酶的结构,从而抑制其催化活性;而Mn2
能与酶分子中游离的羧基结合,生成不溶性的盐类物质,改变酶的结构,从而抑制其催化活性;而Mn2 能激活酶的活性位点,对酶的最佳活性构象起到稳定作用,金属离子构成辅酶,促进酶的催化活性[12]。
能激活酶的活性位点,对酶的最佳活性构象起到稳定作用,金属离子构成辅酶,促进酶的催化活性[12]。
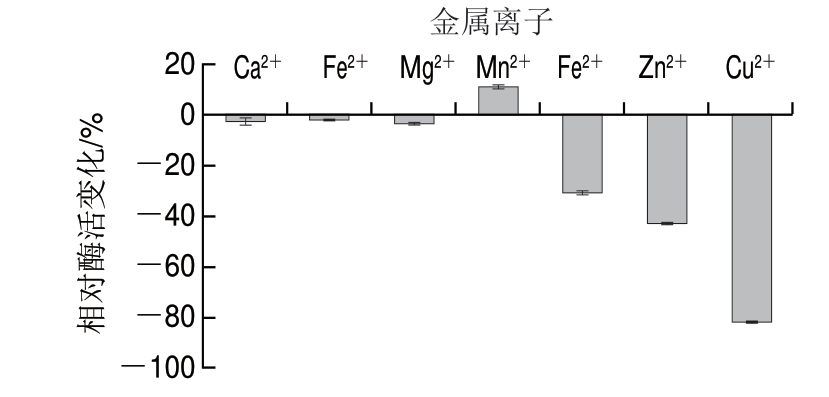
图 10 金属离子对β-D-半乳糖苷酶活性的影响
Fig. 10 Effect of various metal ions on β-D-galactosidase activity

图 11 乳糖水解率和低聚糖产率变化曲线
Fig. 11 Lactose hydrolysis rate and oligosaccharide production rate with the microbial β-D-galactosidase
基于酶法利用乳糖合成低聚糖被认为是大量生产低聚糖的唯一有效方法[2]。如图11所示,在35 ℃、乳糖质量浓度60 g/100 mL、酶浓度1.0 U/mL条件下酶促反应过程中乳糖水解及低聚糖合成的情况。在乳糖作为唯一底物的情况下,酶催化反应形成的低聚糖主要为低聚半乳三糖和低聚半乳四糖,同时还有部分葡萄糖和半乳糖生成。随着酶反应的进行,乳糖不断被水解。到40 h左右,总低聚糖质量浓度为208.19 g/L,产率达到34.70%。 后低聚糖的产率下降,这可能是在反应液中乳糖质量浓度降低的情况下,其中部分低聚糖被β-D-半乳糖苷酶分解的结果。反应至50 h时的乳糖水解率达到68.34%。邢肖肖等[33]用乳酸克鲁维酵母β-D-半乳糖苷酶合成GOS,产率为18.9%;Kim等[34]采用部分纯化的黑曲霉β-D-半乳糖苷酶合成GOS,产率为20%;Splechtna等[35]利用长双歧杆菌产生的β-D-半乳糖苷酶合成GOS,产率为32.5%。因
后低聚糖的产率下降,这可能是在反应液中乳糖质量浓度降低的情况下,其中部分低聚糖被β-D-半乳糖苷酶分解的结果。反应至50 h时的乳糖水解率达到68.34%。邢肖肖等[33]用乳酸克鲁维酵母β-D-半乳糖苷酶合成GOS,产率为18.9%;Kim等[34]采用部分纯化的黑曲霉β-D-半乳糖苷酶合成GOS,产率为20%;Splechtna等[35]利用长双歧杆菌产生的β-D-半乳糖苷酶合成GOS,产率为32.5%。因 ,ZX-5菌株β-D-半乳糖苷酶的GOS产率与已报道的相比较好,具有潜在的应用价值。
,ZX-5菌株β-D-半乳糖苷酶的GOS产率与已报道的相比较好,具有潜在的应用价值。
本研究从藏灵菇 品中分离筛选并鉴定出一株高产β-D-半乳糖苷酶的马克斯克鲁维酵母ZX-5。使用含2.0%半乳糖和1.0%胰蛋白酶的培养基,在发酵温度30 ℃,培养基初始pH 6.5,装液量30%,转速100 r/min,接种量2.0%条件下发酵36 h,菌株产酶最高。将所得粗酶液经硫酸铵分级沉淀和DEAE离子交换层析,获得纯化酶的比活力为157.35 U/mg。酶学性质研究表明,酶最适反应温度为35 ℃,在20~40 ℃酶的热稳定性较好;最适pH值为6.0,在pH 5.0~7.0时酶的稳定性较好;Mn2
品中分离筛选并鉴定出一株高产β-D-半乳糖苷酶的马克斯克鲁维酵母ZX-5。使用含2.0%半乳糖和1.0%胰蛋白酶的培养基,在发酵温度30 ℃,培养基初始pH 6.5,装液量30%,转速100 r/min,接种量2.0%条件下发酵36 h,菌株产酶最高。将所得粗酶液经硫酸铵分级沉淀和DEAE离子交换层析,获得纯化酶的比活力为157.35 U/mg。酶学性质研究表明,酶最适反应温度为35 ℃,在20~40 ℃酶的热稳定性较好;最适pH值为6.0,在pH 5.0~7.0时酶的稳定性较好;Mn2 对酶活有促进作用,Cu2
对酶活有促进作用,Cu2 、Zn2
、Zn2 等对酶活有较强的抑制作用。利用β-D-半乳糖苷酶分解乳糖并合成GOS,乳糖水解率达68.34%,GOS产率达34.70%。因
等对酶活有较强的抑制作用。利用β-D-半乳糖苷酶分解乳糖并合成GOS,乳糖水解率达68.34%,GOS产率达34.70%。因 ,本研究获得了安全性好、乳糖水解及GOS合成活性较高的马克斯克鲁维酵母β-D-半乳糖苷酶,具有良好的应用前景。
,本研究获得了安全性好、乳糖水解及GOS合成活性较高的马克斯克鲁维酵母β-D-半乳糖苷酶,具有良好的应用前景。
[1] SANFWAN V, TOMAR S K, ALI B, et al. Production of β-galactosidase from Streptococcus thermophilus for galactooligosaccharides synthesis[J]. Journal of Food Science and Technology, 2015, 52(7): 4206-4215. DOI:10.1007/s13197-014-1486-4.
[2] KLEIN M P, FALLAVENA L P, SCHÖFFER J N, et al. High stability of immobilized β-D-galactosidase for lactose hydrolysis and galactooligosaccharides synthesis[J]. Carbohydrate Polymers, 2013, 95(1): 465-470. DOI:10.1016/j.carbpol.2013.02.044.
[3] 孟繁一. β-半乳糖苷酶产生菌的筛选和发酵条件优化[J]. 广东化工, 2013, 40(13): 23-25. DOI:10.3969/j.issn.1007-1865.2013.13.011.
[4] 薛雅莺, 张翼鹏, 杨海军. 低聚半乳糖的制备和应用进展[J]. 中国食品添加剂, 2012(增刊1): 93-95. DOI:10.3969/j.issn.1006-2513.2012.z1.019.
[5] 贾少婷, 邢慧敏, 桂仕林, 等. 低聚半乳糖研究进展[J]. 农产品加工, 2010(5A): 71-73. DOI:10.3969/j.issn.1671-9646-C.2010.05.044.
[6] GIBSON G R, RASTALL R A. Prebiotics: development & application-emerging prebiotic carbohydrates[M]. Australia: John Wiley & Sons Ltd., 2012: 111-120.
[7] CUMMINGS J H, MACFARLANE G T. Gastrointestinal effects of prebiotics[J]. British Journal of Nutrition, 2002, 87(Suppl 2): S145-S151. DOI:10.1079/BJN/2002530.
[8] 孙纯, 祝文兴, 刘新利. 低聚半乳糖的研究进展[J]. 中国调味品, 2017(11): 170-174. DOI:10.3969/j.issn.1000-9973.2017.11.038.
[9] 曹永强, 余志坚, 陈超, 等. 一株嗜热链球菌乳糖酶的分离纯化及酶学特性研究[J]. 食品科学技术学报, 2018, 36(2): 42-51. DOI:10.3969/j.issn.2095-6002.2018.02.006.
[10] GOSLING A, STEVENS G W, BARBER A R, et al. Effect of the substrate concentration and water activity on the yield and rate of the transfer reaction of β-galactosidase from Bacillus circulans[J]. Journal of Agricultural and Food Chemistry, 2011, 59(7): 3366-3372. DOI:10.1021/jf104397w.
[11] CHOCKCHAISAWASDEE S, ATHANASOPOULOS V I, NIRANJAN K, et al. Synthesis of galacto-oligosaccharide from lactose using β-galactosidase from Kluyveromyces lactis: studies on batch and continuous UF membrane-fitted bioreactors[J]. Biotechnology and Bioengineering, 2005, 89(4): 434-443. DOI:10.1002/bit.20357.
[12] 剧淑君. β-D-半乳糖苷酶的发酵生产、分离纯化和性质研究[D]. 无锡: 江南大学, 2011: 26-30.
[13] 陈真真. β-半乳糖苷酶菌株筛选、酶的分离纯化和性质及酶法合成低聚半乳糖的研究[D]. 无锡: 江南大学, 2013: 30-42.
[14] 沈莲莲. 低温乳糖酶产生菌株的选育、产酶条件优化及其粗酶性质研究[D]. 无锡: 江南大学, 2013: 20-25.
[15] ROSOLEN M D, GENNARI A, VOLPATO G, et al. Lactose hydrolysis in milk and dairy whey using microbial β-galactosidases[J]. Enzyme Research, 2015, 2015. DOI:10.1155/2015/806240.
[16] SANTIBÁÑEZ L, FERNÁNDEZ-ARROJO L, GUERRERO C, et al. Removal of lactose in crude galacto-oligosaccharides by β-galactosidase from Kluyveromyces lactis[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 133: 85-91. DOI:10.1016/j.molcatb.2016.07.014.
[17] DEMIRHAN E, APAR D K, ÖZBEK B. Effect of hydrolysis products and Mg2+, Mn2+ and Ca2+ ions on whey lactose hydrolysis and β-galactosidase stability[J]. Journal of Chemical Technology & Biotechnology: International Research in Process, Environmental & Clean Technology, 2008, 83(5): 625-636. DOI:10.1002/jctb.1840.
[18] 卢曼, 陈小兵, 王兴兴, 等. 西藏开菲尔粒中酵母菌的分离与初步 鉴定[J]. 上海海洋大学学报, 2015, 24(1): 138-145.
[19] FINA B L, BRUN L R, RIGALLI A. Increase of calcium and reduction of lactose concentration in milk by treatment with kefir grains and eggshell[J]. International Journal of Food Sciences and Nutrition, 2016, 67(2): 133-140. DOI:10.3109/09637486.2015.1137888.
[20] BAÚ T R, GARCIA S, IDA E I. Changes in soymilk during fermentation with kefir culture: oligosaccharides hydrolysis and isoflavone aglycone production[J]. International Journal of Food Sciences and Nutrition, 2015, 66(8): 845-850. DOI:10.3109/09637486. 2015.1095861.
[21] 张雪, 华霄, 许琪, 等. 低温β-半乳糖苷酶分离纯化及酶学性质研究[J]. 食品与机械, 2014(3): 174-178. DOI:10.3969/j.issn.1003-5788.2014.03.043.
[22] 杨成龙, 陈章娥, 吴小平, 等. 基因组ITS序列分析鉴定红曲霉菌株[J]. 核农学报, 2015, 29(2): 252-259. DOI:10.11869/j.issn.100-8551.2015.02.0252.
[23] 康远军, 杨华, 李欣, 等. 基于响应面法的鲁氏酵母发酵培养基优化[J]. 中国酿造, 2015, 34(4): 25-29. DOI:10.11882/j.issn.0254-5071.2015.04.007.
[24] 李文婷, 边斐, 王翠萍, 等. 凝结芽孢杆菌RY237 β-半乳糖苷酶酶学性质研究[J]. 食品工业科技, 2017, 38(14): 111-115. DOI:10.13386/j.issn1002-0306.2017.14.022.
[25] 刘飞, 郑晓吉, 李宝坤, 等. 新疆哈萨克族奶酪产脂肪酶酵母菌的筛选及产酶条件优化[J]. 食品与机械, 2018(3): 54-58. DOI:10.13652/j.issn.1003-5788.2018.03.011.
[26] 郭文文, 陈献忠, 沈微, 等. 重组毕赤酵母产果糖基转移酶发酵条件的优化[J]. 食品与发酵工业, 2016, 42(10): 39-43. DOI:10.13995/j.cnki.11-1802/ts.201610007.
[27] GONZÁLEZ-DELGADO I, LÓPEZ-MUÑOZ M J, MORALES G, et al. Optimisation of the synthesis of high galacto-oligosaccharides (GOS) from lactose with β-galactosidase from Kluyveromyces lactis[J]. International Dairy Journal, 2016, 61: 211-219. DOI:10.1016/j.idairyj.2016.06.007.
[28] 谢毅, 江培翝, 郭杰炎. 乳酸克鲁维酵母 (Kluveromces lactis) β-半乳糖苷酶的稳定性研究[J]. 复旦学报(自然科学版), 1999(5): 39-44. DOI:10.15943/j.cnki.fdxb-jns.1999.05.008.
[29] 王魁, 宿玲恰, 吴敬, 等. 重组Athrobacter ramosus S34MTSase和MTHase的酶学性质及其制备海藻糖的应用条件优化[J]. 食品与发酵工业, 2017, 43(7): 1-6. DOI:10.13995/j.cnki.11-1802/ts.013741.
[30] 张宇洁, 王丽军, 李梦, 等. 一株产低温β-半乳糖苷酶微杆菌的筛选鉴定、产酶条件及其酶学特性[J]. 微生物学通报, 2019, 46(3): 609-617. DOI:10.13344/j.microbiol.china.180241.
[31] KATROLIA P, ZHANG M, YAN Q, et al. Characterisation of a thermostable family 42 β-galactosidase (BgalC) family from Thermotoga maritima showing efficient lactose hydrolysis[J]. Food Chemistry, 2011, 125(2): 614-621. DOI:10.1016/j.foodchem.2010.08.075.
[32] 王欣, 吴斌, 何冰芳. β-半乳糖苷酶的筛选、克隆表达、酶学性质及其酶法合成低聚半乳糖[J]. 生物加工过程, 2015(6): 30-35. DOI:10.3969/j.issn.1672-3678.2015.06.006.
[33] 邢肖肖, 齐崴, 王梦凡, 等. β-半乳糖苷酶酶学性质及其在低聚半乳糖合成中的应用[J]. 生物加工过程, 2015, 13(2): 30-34. DOI:10.3969/j.issn.1672-3678.2015.02.006.
[34] KIM C R, LEE S R, LEE Y K. Formation of galactooligosaccharides by the partially purified beta-galactosidase from Aspergillus niger CAD 1[J]. Korean Journal of Animal Sciences (Korea Republic), 1990, 32(6): 323-333.
[35] SPLECHTNA B, NGUYEN T, STEINBÖCK M, et al. Production of prebiotic galacto-oligosaccharides from lactose using β-galactosidases from Lactobacillus reuteri[J]. Journal of Agricultural and Food Chemistry, 2006, 54(14): 4999-5006. DOI:10.1021/jf053127m.
Isolation, Identification and Enzymatic Characteristics of Kluyveromyces marxianus Producing β-D-Galactosidase
ZHENG Yi, ZHANG Jian, CAO Yongqiang, et al. Isolation, identification and enzymatic characteristics of Kluyveromyces marxianus producing β-D-galactosidase[J]. Food Science, 2020, 41(2): 158-165. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181120-226. http://www.spkx.net.cn