中国浓香型白酒发酵是重要的微生物发酵研究领域,老窖池窖泥丰富的菌群对提高白酒发酵质量具有重要作用。目前,很多研究着眼于不同窖龄的窖泥菌群组成差异[1-4]。已知,随着窖龄增加,窖泥菌群丰度增加,窖泥逐渐老熟。窖泥的老熟本质上是窖泥菌群的老熟,窖泥菌群老熟过程中,受酒醅菌群的影响,即“万年糟”的作用。Wang Xueshan等[5]发现酒醅中的厌氧菌主要来自窖泥,即酒醅菌群也受窖泥菌群的影响。窖泥菌群和酒醅菌群具有相互影响的关系,黄水对维系两个固体菌群的相互关系具有重要作用。黄水又称黄浆水,是白酒发酵过程中原材料经微生物分解代谢形成的游离水,其与各种有机物和微生物一起沉降于窖池底部。黄水被认为含有窖池发酵过程中驯化的所有微生物菌种[6],一方面,黄水对窖泥的影响类似于降雨/灌溉对土壤的影响,黄水菌群随黄水渗入窖泥,对窖泥菌群产生影响;另一方面,窖泥菌群中带有鞭毛的厌氧菌随黄水游弋到酒醅中影响酒醅菌群,如梭菌、瘤 菌等。因
菌等。因 黄水又被称为“液体窖泥”,是“万年糟”作用的执行者。
黄水又被称为“液体窖泥”,是“万年糟”作用的执行者。
目前,黄水菌群的研究方法有传统的纯化培养方法、非培养的聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)方法和磷脂分析法[7-9]。韩永胜等[10]通过纯培养方法发现,随着窖龄增加,黄水的总酸、总酯等有机物含量和微生物数量有增加趋势。王传荣等[11]进一步通过纯化培养方法发现黄水中的优势菌群为乳酸菌、丁酸菌和己酸菌。李可等[7]通过纯培养并构建克隆文库的方法发现黄水中的优势菌群为梭菌属、乳酸菌属和沙雷氏菌属,并检测到了甲烷菌的存在。Li Hui等[8]通过非培养的PCR-DGGE方法,发现黄水中的菌群组成主要有乳酸杆菌(Lactobacillus)、梭菌属(Clostridium)和沉积菌属(Sedimentibacter)。 外,醋酸杆菌属(A c e t o b a c t e r)、蛋白杆菌属(Proteiniphilum)、喜热菌属(Caloramator)和甲烷菌也在黄水中检测到[8-9]。而目前传统培养方法得到的结果为可以培养的菌属,PCR-DGGE方法也不能给出菌属的具体定量结果。因
外,醋酸杆菌属(A c e t o b a c t e r)、蛋白杆菌属(Proteiniphilum)、喜热菌属(Caloramator)和甲烷菌也在黄水中检测到[8-9]。而目前传统培养方法得到的结果为可以培养的菌属,PCR-DGGE方法也不能给出菌属的具体定量结果。因 ,基于自然界中未知菌/未培养菌占多数的情况[12],需要相对更准确的免培养方法全面解析黄水中的菌群组成。已知Clostridium、Sedimentibacter、Proteiniphilum和Caloramator是老窖泥中常见的厌氧菌属,而甲烷菌的存在被认为是浓香型窖泥老熟的标志[13]。 可知,黄水菌群中含有老窖泥中典型的厌氧菌。与黄水相比,窖泥给菌群提供了一个相对封闭、稳定、厌氧的生存环境。已知窖泥菌多数为厌氧菌[4],因
,基于自然界中未知菌/未培养菌占多数的情况[12],需要相对更准确的免培养方法全面解析黄水中的菌群组成。已知Clostridium、Sedimentibacter、Proteiniphilum和Caloramator是老窖泥中常见的厌氧菌属,而甲烷菌的存在被认为是浓香型窖泥老熟的标志[13]。 可知,黄水菌群中含有老窖泥中典型的厌氧菌。与黄水相比,窖泥给菌群提供了一个相对封闭、稳定、厌氧的生存环境。已知窖泥菌多数为厌氧菌[4],因 ,黄水菌群中的厌氧菌有可能对窖泥菌群的老熟起重要作用。
,黄水菌群中的厌氧菌有可能对窖泥菌群的老熟起重要作用。
因 ,有必要全面了解新老窖池新鲜黄水中的菌群组成差异及封闭静置培养对黄水菌群,尤其是对厌氧菌群的影响。窖池发酵25 a,窖泥基本达到老熟[2]。本研究从安徽省某著名浓香型白酒公司的新窖池(6 a窖龄)和老窖池(50 a以上窖龄)中取新鲜黄水,分别对新鲜黄水和封闭静置5 个月的黄水分析其原核微生物组成和理化性质。鉴于未知菌/未培养菌占自然界大多数 的现状[12],本研究采用高通量测序方式全面解读新老窖池黄水原核微生物组成差异,以及封闭静置培养(厌氧环境)对黄水中的菌群组成的影响。
,有必要全面了解新老窖池新鲜黄水中的菌群组成差异及封闭静置培养对黄水菌群,尤其是对厌氧菌群的影响。窖池发酵25 a,窖泥基本达到老熟[2]。本研究从安徽省某著名浓香型白酒公司的新窖池(6 a窖龄)和老窖池(50 a以上窖龄)中取新鲜黄水,分别对新鲜黄水和封闭静置5 个月的黄水分析其原核微生物组成和理化性质。鉴于未知菌/未培养菌占自然界大多数 的现状[12],本研究采用高通量测序方式全面解读新老窖池黄水原核微生物组成差异,以及封闭静置培养(厌氧环境)对黄水中的菌群组成的影响。
1 材料与方法
1.1 材料与试剂
黄水 本采自安徽北部某知名浓香型白酒企业。
本采自安徽北部某知名浓香型白酒企业。
土壤DNA提取试剂盒(D5625) 美国Omega Bio公司;AP-GX-50凝胶回收试剂盒 美国Axygen 公司;其他试剂为国产分析纯。
1.2 仪器与设备
6 8 9 0 气相色 仪(配C P-W A X 5 7 C B色
仪(配C P-W A X 5 7 C B色 柱(50 mh 0.25 mm,0.2 μm)) 美国Agilent公司;Acquity超高效液相色
柱(50 mh 0.25 mm,0.2 μm)) 美国Agilent公司;Acquity超高效液相色 (配
(配 极管阵列检测器和Waters HSS T3色
极管阵列检测器和Waters HSS T3色 柱(100 mmh 2.1 mm,1.8 μm)) 美国Waters公司;TU-1810S紫外-可见分光光度计 北京普析通用分析仪器有限公司。
柱(100 mmh 2.1 mm,1.8 μm)) 美国Waters公司;TU-1810S紫外-可见分光光度计 北京普析通用分析仪器有限公司。
1.3 方法
1.3.1 黄水 本采集
本采集
2018年10月,选取两组窖龄不同而发酵工艺相同的新老窖池,发酵结束时抽取黄水 本。取6 个新窖池(窖龄6 a)新鲜黄水
本。取6 个新窖池(窖龄6 a)新鲜黄水 本,标记为YN-1~YN-6;6 个老窖池(窖龄≥50 a)新鲜黄水
本,标记为YN-1~YN-6;6 个老窖池(窖龄≥50 a)新鲜黄水 本,标记为YO-1~YO-6。另外取3 个老窖池黄水
本,标记为YO-1~YO-6。另外取3 个老窖池黄水 本封闭静置培养5 个月,标记为YO5-1~YO5-3;另外取3 个新窖池黄水
本封闭静置培养5 个月,标记为YO5-1~YO5-3;另外取3 个新窖池黄水 本封闭静置培养5 个月,标记为YN5-1~YN5-3。以上18 个黄水
本封闭静置培养5 个月,标记为YN5-1~YN5-3。以上18 个黄水 本用于提取基因组后高通量测序。
本用于提取基因组后高通量测序。
1.3.2 理化性质分析
采用紫外分光光度计法检测铵态氮含量;采用酸碱中和法测定酸度;采用标准葡萄糖液反滴定法检测淀粉和还原糖含量[14];采用GB 11893ü 1989《水质 总磷的测定》钼酸铵分光光度法检测黄水中的总磷。
将黄水 本与15%甲醇溶液按照1∶9体积比混匀,0.22 μm滤膜过滤得到浸提液,用于检测其中有机酸醇含量。通过气相色
本与15%甲醇溶液按照1∶9体积比混匀,0.22 μm滤膜过滤得到浸提液,用于检测其中有机酸醇含量。通过气相色 仪检测黄水中挥发性有机酸和乙醇的含量:进
仪检测黄水中挥发性有机酸和乙醇的含量:进 量1 µL,柱流速1 mL/min,进
量1 µL,柱流速1 mL/min,进 口温度250 ℃,分流比30∶1;升温条件:初始温度35 ℃, 2 ℃/min升温至60 ℃,保持4 min,6 ℃/min升温至195 ℃,保持20 min;氢火焰离子检测器温度250 ℃。采用液相色
口温度250 ℃,分流比30∶1;升温条件:初始温度35 ℃, 2 ℃/min升温至60 ℃,保持4 min,6 ℃/min升温至195 ℃,保持20 min;氢火焰离子检测器温度250 ℃。采用液相色 仪检测乳酸含量:进
仪检测乳酸含量:进 量1 µL,流动相为
量1 µL,流动相为
KH2PO4(0.02 mol/L),柱流速0.1 mL/min,检测波长208 nm,柱箱温度30 ℃。
1.3.3 DNA提取与Illumina高通量测序
使用Omega DNA提取试剂盒(D5625)提取 本DNA。由上海派森诺生物科技股份有限公司进行Illumina MiSeq高通量测序16S V4可变区。引物:520F(5’-7 bp barcode
本DNA。由上海派森诺生物科技股份有限公司进行Illumina MiSeq高通量测序16S V4可变区。引物:520F(5’-7 bp barcode GCA CCT AAY TGG GYD TAA AGNG-3’)和802R(5’-TAC NVG GGT ATC TAA TCC-3’)。25 μL PCR扩增体系:0.25 μL Q5高保真DNA聚合酶,5 μL 5h PCR Buffer,5 μL 5h High GC Buffer,2 μL dNTP(2.5 mmol/L),2 μL DNA模板,1 μL上下游引物(10 μmol/L),8.75 μL双蒸水。PCR扩增程序:98 ℃预变性2 min;25 个循环扩增:98 ℃变性20 s,55 ℃退火30 s,72 ℃延伸15 s;72 ℃完全延伸5 min。PCR扩增产物经纯化后,Quant-iT PicoGreen dsDNA Assay Kit荧光定量,构建克隆文库(TruSeq Nano DNA LT Library Prep Kit,Illumina),经Agilent 2100 Bioanlyzer检验DNA文库合格后,Illumina MiSeq双向测序(MiSeq Reagent Kit V3)。
GCA CCT AAY TGG GYD TAA AGNG-3’)和802R(5’-TAC NVG GGT ATC TAA TCC-3’)。25 μL PCR扩增体系:0.25 μL Q5高保真DNA聚合酶,5 μL 5h PCR Buffer,5 μL 5h High GC Buffer,2 μL dNTP(2.5 mmol/L),2 μL DNA模板,1 μL上下游引物(10 μmol/L),8.75 μL双蒸水。PCR扩增程序:98 ℃预变性2 min;25 个循环扩增:98 ℃变性20 s,55 ℃退火30 s,72 ℃延伸15 s;72 ℃完全延伸5 min。PCR扩增产物经纯化后,Quant-iT PicoGreen dsDNA Assay Kit荧光定量,构建克隆文库(TruSeq Nano DNA LT Library Prep Kit,Illumina),经Agilent 2100 Bioanlyzer检验DNA文库合格后,Illumina MiSeq双向测序(MiSeq Reagent Kit V3)。
1.3.4 测序数据处理与统计学分析
首先将原始序列优化得到用于后续分析的优质序列。即:去掉长度小于150 bp或者大于300 bp、模糊碱基数大于1、同聚碱基数目大于8、引物错配大于1 bp的序列(QIIME,v1.8.0);双向拼接(FLASH软件v1.2.7)序列,剔除嵌合体(USEARCH,v5.2.236)序列。UCLUST聚类(97%相似度)优质序列得到各可操作分类单元(operational taxonomic units,OTU),认定各OTU中丰度最高的序列为其代表序列。在80%可信度水平,使用Silva数据库(Release132)注释各代表序列即为代表OTU的注释结果,并形成OTU列表。去除OTU列表中序列数目少于总测序量0.001%的OTU。然后将OTU列表进行100 次抽平,取平均,对取平均后的序列数进行四舍五入取整,得到新的OTU列表。对抽平取 后的OTU列表,使用Qiime软件(v1.8.0)计
后的OTU列表,使用Qiime软件(v1.8.0)计 其Shannon指数、Chao 1指数等微生物群落多
其Shannon指数、Chao 1指数等微生物群落多 性指数。使用Qiime软件,对Weighted UniFrac距离矩阵分别进行UPGMA聚类分析,并使用R软件(R3.3.2)进行可视化。黄水
性指数。使用Qiime软件,对Weighted UniFrac距离矩阵分别进行UPGMA聚类分析,并使用R软件(R3.3.2)进行可视化。黄水 本理化因子之间的差异显著性分析通过SPSS(24.0)方差分析(ANOVA)实现。黄水理化因子与其菌群组成之间的冗余分析(redundancy analysis,RDA)通过Canoco 5实现。
本理化因子之间的差异显著性分析通过SPSS(24.0)方差分析(ANOVA)实现。黄水理化因子与其菌群组成之间的冗余分析(redundancy analysis,RDA)通过Canoco 5实现。
2 结果与分析
2.1 黄水 本的理化性质
本的理化性质
新老窖池的新鲜黄水相比较,两者的淀粉、还原糖、丙酸、乳酸、乙醇含量不具有显著性差异,说明新老窖池发酵粮食(淀粉)产生乙醇的主体过程无差异。如表1所示,与新窖池的新鲜黄水相比,老窖池的新鲜黄水中,丁酸、己酸、戊酸、乙酸、铵态氮的值偏高,而酸度略低。说明:1)与新窖池相比,老窖池发酵过程中代谢形成的各种酸等风味物质较丰富,可能与老窖池发酵过程中己酸菌与甲烷菌之间存在良性的氢传递,更容易促进己酸和丁酸等风味物质的合成有关[15]; 2)老窖池发酵过程中,铵态氮含量比较高,可能与老窖池中降解氨基酸的菌含量比较高有关,比如胺杆菌属(Aminobacterium);3)老窖池的新鲜黄水酸度略低,一方面与其中铵态氮含量较高有关,另一方面与乳酸含量略低(尽管两者不具有显著性差异)有关,因为几种有机酸中,乳酸的含量最大,且其pKa值最小,其对酸度的贡献最大。
表 1 4 组黄水样本的理化性质
Table 1 Physicochemical properties of 4 groups of HS samples
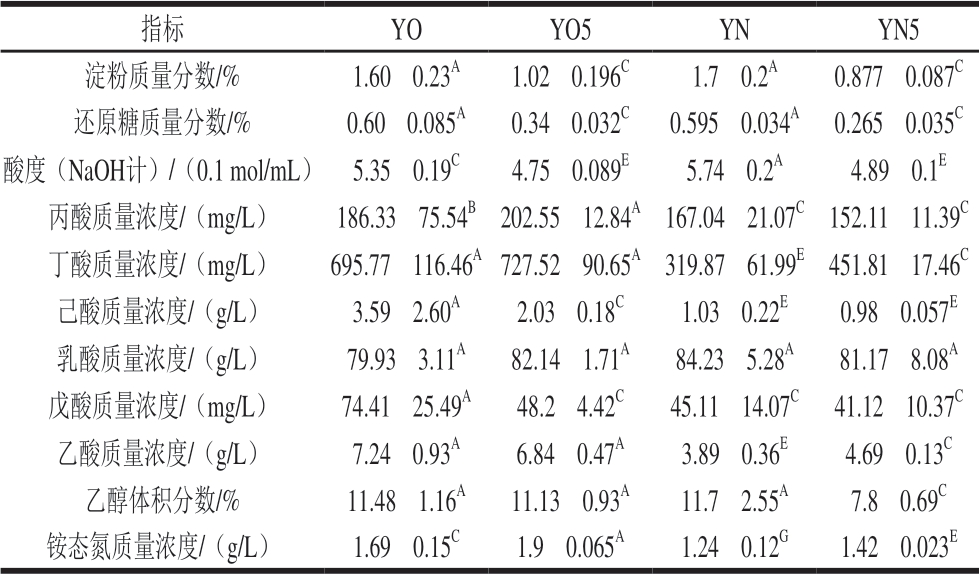
注:同行肩标不连续字母表示差异显著,P<0.05。表2同。
指标 YO YO5 YN YN5淀粉质量分数/% 1.60f 0.23A 1.02f 0.196C 1.7f 0.2A 0.877f 0.087C还原糖质量分数/% 0.60f 0.085A 0.34f 0.032C 0.595f 0.034A 0.265f 0.035C酸度(NaOH计)/(0.1 mol/mL) 5.35f 0.19C 4.75f 0.089E 5.74f 0.2A 4.89f 0.1E丙酸质量浓度/(mg/L) 186.33f 75.54B 202.55f 12.84A 167.04f 21.07C 152.11f 11.39C丁酸质量浓度/(mg/L) 695.77f 116.46A 727.52f 90.65A 319.87f 61.99E 451.81f 17.46C己酸质量浓度/(g/L) 3.59f 2.60A 2.03f 0.18C 1.03f 0.22E 0.98f 0.057E乳酸质量浓度/(g/L) 79.93f 3.11A 82.14f 1.71A 84.23f 5.28A 81.17f 8.08A戊酸质量浓度/(mg/L) 74.41f 25.49A 48.2f 4.42C 45.11f 14.07C 41.12f 10.37C乙酸质量浓度/(g/L) 7.24f 0.93A 6.84f 0.47A 3.89f 0.36E 4.69f 0.13C乙醇体积分数/% 11.48f 1.16A 11.13f 0.93A 11.7f 2.55A 7.8f 0.69C铵态氮质量浓度/(g/L) 1.69f 0.15C 1.9f 0.065A 1.24f 0.12G 1.42f 0.023E
新老窖池黄水经过5 个月的封闭静置培养后,丙酸、乳酸值无显著变化,淀粉、还原糖、酸度值不同程度地降低,而铵态氮有所增加。说明静置培养过程黄水中的菌群生长消耗了其中的淀粉、还原糖,同时生成了铵态氮(降解氨基酸的菌),如Aminobacterium[16-18]。最终黄水酸度有所下降。新老窖池黄水培养后的不同之处在于:老窖池黄水经培养后,己酸和戊酸的值显著降低;新窖池黄水培养后乙醇含量显著降低,丁酸和乙酸的值显著增加。目前已知,在窖泥中存在以乙醇[19-20]和乳酸[21]为前体生成丁酸/己酸的菌种。新窖池黄水经过封闭静置培养后,乙醇减少,同时丁酸和乙酸增加,很可能与其中存在以乙醇为前体的丁酸/己酸菌的代谢功能有关。相比较而言,老窖池黄水中的丁酸/己酸菌在封闭静置培养期间似乎并不活跃。
2.2 黄水原核微生物群落的α多 性
性
通过Illumina MiSeq高通量测序,得到673 738 条平均长度为207 bp的优质序列,平均30 182~53 152 条/ 本。对所有
本。对所有 本10 次抽平(subsample)取平均四舍五入后,得到序列26 931~26 981 条/
本10 次抽平(subsample)取平均四舍五入后,得到序列26 931~26 981 条/ 本,进行后续分析。OTU聚类(97%相似度)得到4 886 个OTU,平均77~580 个/
本,进行后续分析。OTU聚类(97%相似度)得到4 886 个OTU,平均77~580 个/ 本。每个
本。每个 本的测序覆盖率大于99%,说明测序数目足够,测序序列可以代表其菌群组成。得到注释(门、纲、目、科、属)的序列大于99.9%,无法得到注释的序列仅12 条序列,说明对窖泥中大量的未培养菌也充分实现了系统分类。如表2所示,新老窖池的新鲜黄水相比较,两者微生物群落的OTU数目、Shannon指数和Chao 1指数都不具有显著性差异,经过封闭静置培养5 个月后,3 个微生物群落参数值均显著升高,说明静置培养后黄水中的菌群丰度和多
本的测序覆盖率大于99%,说明测序数目足够,测序序列可以代表其菌群组成。得到注释(门、纲、目、科、属)的序列大于99.9%,无法得到注释的序列仅12 条序列,说明对窖泥中大量的未培养菌也充分实现了系统分类。如表2所示,新老窖池的新鲜黄水相比较,两者微生物群落的OTU数目、Shannon指数和Chao 1指数都不具有显著性差异,经过封闭静置培养5 个月后,3 个微生物群落参数值均显著升高,说明静置培养后黄水中的菌群丰度和多 性增加。
性增加。
表 2 4 组黄水样本的细菌群落丰度和多样性参数
Table 2 Bacterial community richness and diversity indices of 4 groups of HS samples

指标 YO YO5 YN YN5优质序列数目 39 212f 9 689A 35 996f 1 421A 37 807f 6 452A 34 546f 2 429A覆盖率/% 99.2f 0.5A 99.2f 0.2A 99.6f 0.1A 99.2f 0.06A OTU数目 200f 110.8A 398f 40.3C 165.3f 47.9A 500f 86.6C Shannon指数 1.86f 0.86A 4.02f 0.50C 2.15f 0.26A 5.47f 0.54E Chao 1指数 208.7f 117.3A 400.5f 43.3C 178.0f 45.5A 503.3f 91.3C
2.3 黄水原核微生物群落的β多 性
性
对OTU注释,总共得到35 个门,其中32 个细菌门,3 个古菌门。在门的水平上,在新老窖池新鲜黄水中,厚壁菌门(Firmicutes)为绝对优势菌门,分别占新老窖池新鲜黄水 本的98.46%和95.72%。将相对丰度超过0.1%的门定义为优势菌门(图1)。除Firmicutes外,其余4 个优势菌门在新老窖池新鲜黄水中的相对丰度依次为:变形菌门(Proteobacteria,1.0%和2.0%)、放线菌(Actinobacteria,0.11%和1.0%)、拟杆菌门(Bacteroidetes,0.1%和0.36%)和绿弯菌门(Chloroflexi,0.03%和0.45%)。Firmicutes在黄水中的绝对优势情况也存在于窖泥中[1-2],但在黄水中占的比例更大。
本的98.46%和95.72%。将相对丰度超过0.1%的门定义为优势菌门(图1)。除Firmicutes外,其余4 个优势菌门在新老窖池新鲜黄水中的相对丰度依次为:变形菌门(Proteobacteria,1.0%和2.0%)、放线菌(Actinobacteria,0.11%和1.0%)、拟杆菌门(Bacteroidetes,0.1%和0.36%)和绿弯菌门(Chloroflexi,0.03%和0.45%)。Firmicutes在黄水中的绝对优势情况也存在于窖泥中[1-2],但在黄水中占的比例更大。
经过封闭静置培养5 个月后,新老窖池的黄水中的菌群组成发生变化。新老窖池黄水中Firmicutes的相对丰度分别下降为63.14%和79.59%;Proteobacteria在两者中的丰度分别大幅上升至20.86%和12.88%;Bacteroidetes则分别上升至6.21%和1.74%;Actinobacteria分别上升至0.63%和2.79%;Chloroflexi分别上升至1.32%和0.47%。 外,经过静置培养后,互养菌门(Synergistetes)在老窖池黄水中的相对丰度上升幅度很大(由0.06%变为2.11%),而在新窖池黄水中变化幅度相对较小(由0.02%变为0.46%)。通过静置培养,黄水菌群与窖泥菌群中的组成更接近了,比如Firmicutes与窖泥中的菌群组成更接近。
外,经过静置培养后,互养菌门(Synergistetes)在老窖池黄水中的相对丰度上升幅度很大(由0.06%变为2.11%),而在新窖池黄水中变化幅度相对较小(由0.02%变为0.46%)。通过静置培养,黄水菌群与窖泥菌群中的组成更接近了,比如Firmicutes与窖泥中的菌群组成更接近。
对O T U 注释,共得到6 6 4 个属,注释度为97.81%,其余序列只能不同程度地注释到门、纲、目、科等级别。注释度之所以如 高,因为黄水
高,因为黄水 本中的属种非常集中,Lactobacillus占绝对优势。除Lactobacillus,黄水
本中的属种非常集中,Lactobacillus占绝对优势。除Lactobacillus,黄水 本中相对丰度超过1%的优势菌属还有:不动杆菌属(Acinetobacter)、双歧黄色高温菌属(Thermoflavimicrobium)、芽孢杆菌属(Bacillus)、苍白杆菌属(Ochrobactrum)、寡养单胞菌属(Stenotrophomonas)、产己酸菌属(Caproiciproducens)和Aminobacterium(图2)。
本中相对丰度超过1%的优势菌属还有:不动杆菌属(Acinetobacter)、双歧黄色高温菌属(Thermoflavimicrobium)、芽孢杆菌属(Bacillus)、苍白杆菌属(Ochrobactrum)、寡养单胞菌属(Stenotrophomonas)、产己酸菌属(Caproiciproducens)和Aminobacterium(图2)。
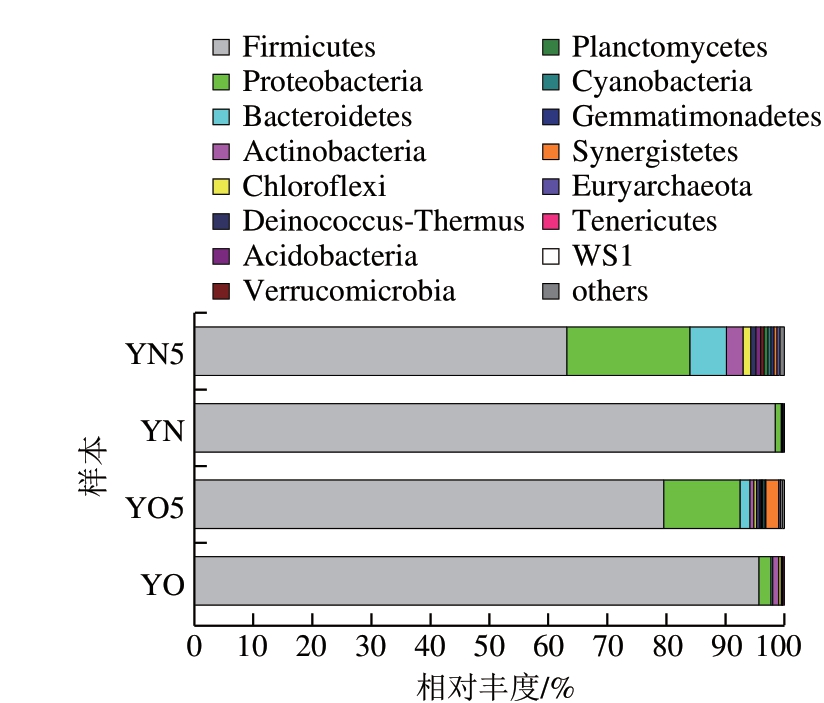
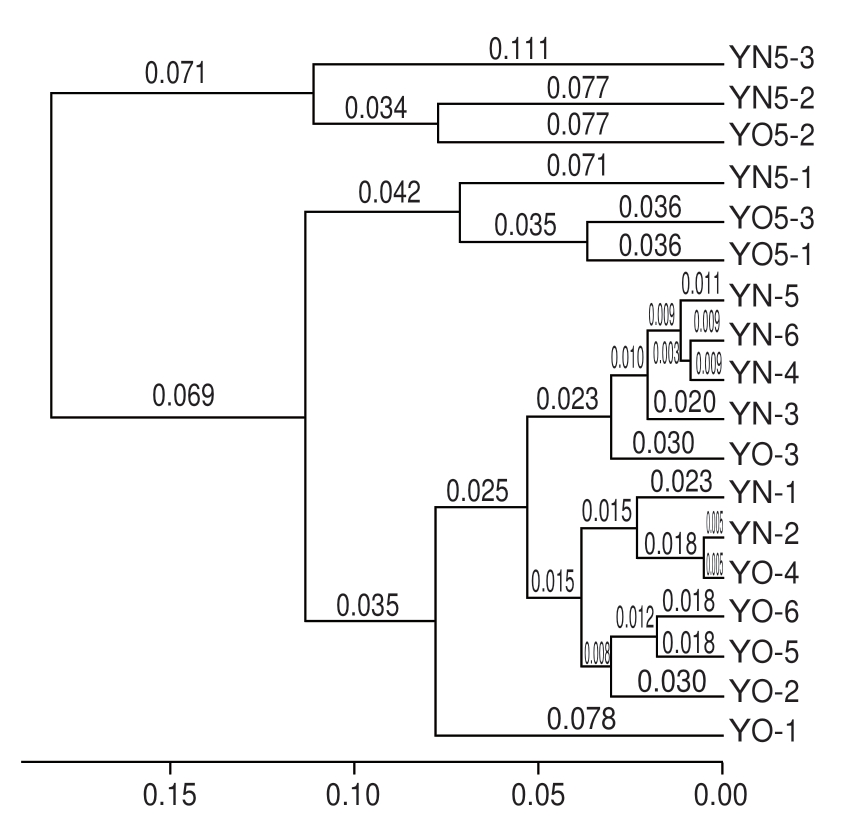
对18 个黄水 本菌群组成进行Weighted Unifrac Distance聚类(图3)发现,所有黄水
本菌群组成进行Weighted Unifrac Distance聚类(图3)发现,所有黄水 本分为两大组:新鲜黄水
本分为两大组:新鲜黄水 本组和封闭静置培养后的黄水
本组和封闭静置培养后的黄水 本组。而2 个组的组内
本组。而2 个组的组内 本,老窖池黄水与新窖池黄水差异很不明显,
本,老窖池黄水与新窖池黄水差异很不明显, 本交叉存在。由
本交叉存在。由 可知,与窖池的窖龄相比,是否静置培养对黄水
可知,与窖池的窖龄相比,是否静置培养对黄水 本的菌群组成影响更大。
本的菌群组成影响更大。
深入分析黄水中优势菌属在封闭静置培养前后的变化(图4)可知,经过封闭静置培养后,新老窖池黄水 本中的绝对优势菌属Lactobacillus的相对丰度分别降低至52.5%和68.55%。推测很可能与封闭静置培养条件下的缺氧环境不利于兼性厌氧菌Lactobacillus的增殖有一定关系。
本中的绝对优势菌属Lactobacillus的相对丰度分别降低至52.5%和68.55%。推测很可能与封闭静置培养条件下的缺氧环境不利于兼性厌氧菌Lactobacillus的增殖有一定关系。 外,黄水中的其余7 个优势菌属的相对丰度都显著性增加。
外,黄水中的其余7 个优势菌属的相对丰度都显著性增加。
Acinetobacter 为革兰氏 性绝对好氧菌,在土壤中常见[2 2],存在于池壁泥中却不存在于池底泥中[23],说明黄水中的Acinetobacter来自于池壁泥。Thermoflavimicrobium[24]、Ochrobactrum[25]和Stenotrophomonas[26]均为好氧菌,土壤中常见菌,鉴于池底泥的厌氧环境,其有可能也来自于池壁泥中的土壤。Bacillus既可以是绝对好氧菌,也可以是兼性厌氧菌,其在自然界广泛存在,在窖泥和酿酒大曲中都有[27-28]。Caproiciproducens是革兰氏阳性菌,绝对厌氧菌,产生己酸,其在窖泥中大量存在,对产生浓香型白酒中的风味成分己酸的产生具有重要作用[3,29]。Aminobacterium为革兰氏
性绝对好氧菌,在土壤中常见[2 2],存在于池壁泥中却不存在于池底泥中[23],说明黄水中的Acinetobacter来自于池壁泥。Thermoflavimicrobium[24]、Ochrobactrum[25]和Stenotrophomonas[26]均为好氧菌,土壤中常见菌,鉴于池底泥的厌氧环境,其有可能也来自于池壁泥中的土壤。Bacillus既可以是绝对好氧菌,也可以是兼性厌氧菌,其在自然界广泛存在,在窖泥和酿酒大曲中都有[27-28]。Caproiciproducens是革兰氏阳性菌,绝对厌氧菌,产生己酸,其在窖泥中大量存在,对产生浓香型白酒中的风味成分己酸的产生具有重要作用[3,29]。Aminobacterium为革兰氏 性菌,绝对厌氧菌,其在老窖泥中的相对丰度更大,具有降解氨基酸的功能[16-18]。分析在黄水封闭静置培养前期,环境中有一定的氧气存在,促进了好氧菌的生长繁殖。随着封闭环境中的氧气耗尽,也促进了来自窖泥的厌氧菌,如Caproiciproducens和Aminobacterium的生长繁殖。其中Aminobacterium在老窖泥中的含量远高于新窖泥[30],而在经过静置培养的黄水中,其在老窖池黄水中的菌群相对丰度大于新窖池,一方面有可能与老窖泥中Aminobacterium的含量更多有关,另一方面,也可能与老窖池黄水更有利于Aminobacterium的生长繁殖有关。
性菌,绝对厌氧菌,其在老窖泥中的相对丰度更大,具有降解氨基酸的功能[16-18]。分析在黄水封闭静置培养前期,环境中有一定的氧气存在,促进了好氧菌的生长繁殖。随着封闭环境中的氧气耗尽,也促进了来自窖泥的厌氧菌,如Caproiciproducens和Aminobacterium的生长繁殖。其中Aminobacterium在老窖泥中的含量远高于新窖泥[30],而在经过静置培养的黄水中,其在老窖池黄水中的菌群相对丰度大于新窖池,一方面有可能与老窖泥中Aminobacterium的含量更多有关,另一方面,也可能与老窖池黄水更有利于Aminobacterium的生长繁殖有关。
除上述提到的Caproiciproducens和Aminobacterium,窖泥中还存在很多功能菌[ 1 , 3 ], 如棒状杆菌(Caldicoprobacter)[31]、贪铜菌属(Cupriavidus)[32]、 甲烷囊菌属(M e t h a n o c u l l e u s)[2]、瘤梭菌(Ruminiclostridium)[33]、Sedimentibacter[2]和互营单胞菌属(Syntrophomonas)[2],其对窖泥的老熟具有很重要的作用。图5为这些菌属在4 组黄水中的相对丰度。经过封闭静置培养后,6 株菌在新老窖池黄水中的相对丰度都有不同程度的升高。与新窖池黄水相比,老窖池黄水经过封闭静置培养Methanoculleus、Sedimentibacter、Syntrophomonas的相对丰度增加更多。说明黄水中含有大量促进窖泥老熟的菌种,且黄水可以提供这些菌种在厌氧条件下生长所需要的营养物质。
2.4 黄水 本理化性质与菌群之间的RDA
本理化性质与菌群之间的RDA
如图6所示,2 个主成分的总解释度为87.49%,但是两个坐标轴上的解释度相差悬殊,主要集中在RDA1(86.16%)。以横轴为分界点,封闭静置培养前的新鲜黄水 本集中在左侧,静置培养后的黄水
本集中在左侧,静置培养后的黄水 本散布在右侧。由
本散布在右侧。由 也可得知,与窖池的窖龄相比,是否静置培养对黄水
也可得知,与窖池的窖龄相比,是否静置培养对黄水 本的菌群组成影响更大,与图3结论一致。图6中还原糖、淀粉、酸度和乙醇与新鲜黄水
本的菌群组成影响更大,与图3结论一致。图6中还原糖、淀粉、酸度和乙醇与新鲜黄水 本菌群呈强烈正相关,铵态氮与静置培养黄水呈正相关,表明新鲜黄水中还原糖、淀粉、酸度和乙醇的值偏高,静置培养后的黄水铵态氮升高。使用互动向前选择程序验收11 个理化因子,发现参数还原糖的解释度最高65%(P<0.01)。
本菌群呈强烈正相关,铵态氮与静置培养黄水呈正相关,表明新鲜黄水中还原糖、淀粉、酸度和乙醇的值偏高,静置培养后的黄水铵态氮升高。使用互动向前选择程序验收11 个理化因子,发现参数还原糖的解释度最高65%(P<0.01)。 外,其余理化指标的贡献率都不具有显著性,指标(解释度)分别为:己酸(6.2%)、乳酸(5.9%)、铵态氮(2.7%)、乙酸(2.2%)、丁酸(1.7%)、酸度(1.4%)、淀粉(1.2%)、乙醇(0.9%)、戊酸(0.3%)、丙酸(0.2%)。
外,其余理化指标的贡献率都不具有显著性,指标(解释度)分别为:己酸(6.2%)、乳酸(5.9%)、铵态氮(2.7%)、乙酸(2.2%)、丁酸(1.7%)、酸度(1.4%)、淀粉(1.2%)、乙醇(0.9%)、戊酸(0.3%)、丙酸(0.2%)。
3 讨 论
新老窖池新鲜黄水中淀粉、还原糖、丙酸、乳酸、乙醇的含量不具有显著性差异。与新窖池相比,老窖池新鲜黄水中,即老窖池酒醅发酵过程中产生的丁酸、己酸、戊酸、乙酸等风味物质含量较丰富,同时产生的铵态氮的含量较高。己酸是生成浓香型白酒特色风味物质己酸乙酯的前体物质,与“窖池越老,酒质越好”的结论一致。铵态氮是菌群生长的氮源,老窖池黄水中铵态氮含量高与老窖池中菌群含量更丰富有关系。
新老窖池的黄水 本,经过5 个月的封闭静置培养,黄水中的淀粉、还原糖被消耗,同时酸度也略有下降,而铵态氮略有增加。该过程展示了窖泥老熟过程中其理化性质的变化。从一定程度上来说,窖泥的老熟过程其实是黄水浸入窖泥(窖池池壁和池底土壤)后,静置生长的同时促使窖泥理化性质和菌群结构变化的过程。根据已有研究[1],新老窖泥相比,一方面,老窖泥的pH值略有上升(与静置培养黄水酸度下降相一致),达到更多菌属的pH值适宜生长范围;另一方面,铵态氮含量增加,提供了窖泥中菌群繁殖生长所需要的氮源。老窖泥的理化性质是长年累月的黄水周期性浸入和静置生长累加效应的表现。不过,新老窖池黄水由于菌群组成差异,其代谢也有所差异,比如新窖池黄水中的乙醇被大量消耗,同时产生了丁酸和乙酸;而老窖池黄水中的乙醇基本没有变化。
本,经过5 个月的封闭静置培养,黄水中的淀粉、还原糖被消耗,同时酸度也略有下降,而铵态氮略有增加。该过程展示了窖泥老熟过程中其理化性质的变化。从一定程度上来说,窖泥的老熟过程其实是黄水浸入窖泥(窖池池壁和池底土壤)后,静置生长的同时促使窖泥理化性质和菌群结构变化的过程。根据已有研究[1],新老窖泥相比,一方面,老窖泥的pH值略有上升(与静置培养黄水酸度下降相一致),达到更多菌属的pH值适宜生长范围;另一方面,铵态氮含量增加,提供了窖泥中菌群繁殖生长所需要的氮源。老窖泥的理化性质是长年累月的黄水周期性浸入和静置生长累加效应的表现。不过,新老窖池黄水由于菌群组成差异,其代谢也有所差异,比如新窖池黄水中的乙醇被大量消耗,同时产生了丁酸和乙酸;而老窖池黄水中的乙醇基本没有变化。 外,新老窖池黄水经过静置培养后,其中乳酸没有显著变化,而提高pH值降解乳酸是关键,现已知窖泥中存在以乳酸为前体生成己酸的菌种[18]。因
外,新老窖池黄水经过静置培养后,其中乳酸没有显著变化,而提高pH值降解乳酸是关键,现已知窖泥中存在以乳酸为前体生成己酸的菌种[18]。因 将来有必要寻找适宜的黄水培养条件,加强乳酸降解菌株的降解作用,提高黄水pH值,促进黄水菌群的老熟。
将来有必要寻找适宜的黄水培养条件,加强乳酸降解菌株的降解作用,提高黄水pH值,促进黄水菌群的老熟。
在新老窖池的新鲜黄水 本中,其菌群组成的差异不大,其中相对丰度超过95%的绝对优势菌种是Lactobacillus。经过5 个月的封闭静置培养,新老窖池黄水中的菌群组成发生变化,其中Lactobacillus的相对丰度显著降低,而其余一些好氧菌和厌氧菌的相对丰度提高,其中包括一些老熟窖泥中相对丰度很高的菌属。这种黄水菌群的变化过程是窖泥菌群老熟过程中其菌群结构变化的表现。在窖泥老熟过程中,周期性来自于黄水的菌群,受各种理化性质和厌氧情况的影响,菌群结构逐渐趋于稳定,即窖泥的老熟状态。与窖泥相类似,新老窖池黄水的理化性质与其菌群组成是相互影响的。黄水理化因子与菌群之间的RDA结果表明,与窖龄比较,封闭静置培养对黄水菌群的影响更大。理化因子中还原糖对菌群解释度最高,达65%,说明菌群生长前期,对还原糖的需求度最高。
本中,其菌群组成的差异不大,其中相对丰度超过95%的绝对优势菌种是Lactobacillus。经过5 个月的封闭静置培养,新老窖池黄水中的菌群组成发生变化,其中Lactobacillus的相对丰度显著降低,而其余一些好氧菌和厌氧菌的相对丰度提高,其中包括一些老熟窖泥中相对丰度很高的菌属。这种黄水菌群的变化过程是窖泥菌群老熟过程中其菌群结构变化的表现。在窖泥老熟过程中,周期性来自于黄水的菌群,受各种理化性质和厌氧情况的影响,菌群结构逐渐趋于稳定,即窖泥的老熟状态。与窖泥相类似,新老窖池黄水的理化性质与其菌群组成是相互影响的。黄水理化因子与菌群之间的RDA结果表明,与窖龄比较,封闭静置培养对黄水菌群的影响更大。理化因子中还原糖对菌群解释度最高,达65%,说明菌群生长前期,对还原糖的需求度最高。
本研究通过高通量测序分析黄水中的原核菌群组成,证明静置培养有利于窖泥老熟菌属的增加,尤其是老黄水中,窖泥老熟菌属的增加更明显,比如Aminobacterium相对丰度从0.47%升到1.97%,已知优质老窖泥中Aminobacterium相对丰度显著高于新窖泥[4]。Methanoculleus相对丰度从接近于0%上升到0.24%,已知新窖泥中的Methanoculleus相对丰度为0.16%,25 a窖龄窖泥中的相对丰度上升到1.56%[2]。静置培养后的老黄水中Methanoculleus的相对丰度尽管没有达到老窖泥中的丰度,但说明黄水中天然有促进窖泥老熟的菌种存在,为将来通过自然培养黄水改良窖泥提供了一种思路。而考虑到黄水环境与窖泥环境的差异,需要进一步摸索适宜黄水中窖泥老熟菌种生存繁殖的条件。实现对黄水的自然培养并应用于促进窖泥老熟的养护,不但有利于促进窖泥老熟,对黄水的处理也有重要意义。因为黄水的化学需氧量值很高,排放会远超过国家允许的废水排放指标[34]。目前,有研究直接将黄水蒸馏制成低度黄 水酒[35],但只是将黄水中的乙醇进行回收利用;有研究通过超临界CO2萃取技术从黄水中提取风味物质[36],但成本太高。 外,柴玉强等[37]提出将黄水进行
外,柴玉强等[37]提出将黄水进行 次发酵再蒸馏酒的方法。本研究尝试了直接静置厌氧培养黄水的方法,可能解决黄水的处理问题,将黄水变废为宝,用于窖泥改良,将来还需要对黄水作为“液体窖泥”的培养条件进行进一步研究。
次发酵再蒸馏酒的方法。本研究尝试了直接静置厌氧培养黄水的方法,可能解决黄水的处理问题,将黄水变废为宝,用于窖泥改良,将来还需要对黄水作为“液体窖泥”的培养条件进行进一步研究。
参考文献:
[1] DENG B, SHEN C H, SHAN X H, et al. PCR-DGGE analysis on microbial communities in pit mud of cellars used for different periods of time[J]. Journal of the Institute of Brewing, 2012, 118(1): 120-126. DOI:10.1002/jib.2.
[2] TAO Y, LI J, RUI J, et al. Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strongflavored liquor[J]. Applied and Environmental Microbiology, 2014, 80(7): 2254-2260. DOI:10.1128/AEM.04070-13.
[3] LIU M K, TANG Y M, GUO X J, et al. Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J]. Food Research International, 2017, 102(9): 68-76. DOI:10.1016/j.foodres.2017.09.075.
[4] HU X, DU H, REN C, et al. Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J]. Applied and Environmental Microbiology, 2016, 82(8): 2506-2515. DOI:10.1128/AEM.03409-15.
[5] WANG X S, DU H, XU Y. Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J]. International Journal of Food Microbiol, 2017, 244(6): 27-35. DOI:10.1016/j.ijfoodmicro.2016.12.018.
[6] ZOU W, ZHAO C, LUO H. Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem: a review[J]. Frontiers in Microbiology, 2018, 9: 671. DOI:10.3389/fmicb.2018.00671.
[7] 李可, 范志刚, 王俊芳, 等. 浓香型白酒发酵黄水中微生物群落结构解析[J]. 食品与生物技术学报, 2015, 34(11): 1155-1161.
[8] LI H, HUANG J, LIU X, et al. Characterization of interphase microbial community in Luzhou-flavored liquor manufacturing pits of various ages by polyphasic detection methods[J]. Journal of Microbiology and Biotechnology, 2017, 27(1): 130-140. DOI:10.4014/jmb.1605.05036.
[9] DING X, WU C, HUANG J, et al. Interphase microbial community characteristics in the fermentation cellar of Chinese Luzhou-flavor liquor determined by PLFA and DGGE profiles[J]. Food Research International, 2015, 72: 16-24. DOI:10.1016/j.foodres.2015.03.018.
[10] 韩永胜, 刘兴平, 敖宗华, 等. 不同窖龄黄水的差异性及其对酒质影响的研究[J]. 酿酒, 2014, 41(1): 36-39.
[11] 王传荣, 沈洪涛. 黄水在新型白酒生产中的应用[J]. 中国酿造, 2005, 24(2): 26-28.
[12] RAPPE M S, GIOVANNI S J. The uncultured microbial majority[J]. Annual Reviews in Microbiology, 2003, 57(1): 369-394. DOI:10.1146/annurev.micro.57.030502.090759.
[13] 吴衍庸, 刘光烨. 窖泥甲烷细菌与浓香型曲酒[J]. 酿酒, 1988, 1(2): 29-32.
[14] 沈怡芳. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 2017: 642-650.
[15] TAO Y, WANG X, LI X, et al. The functional potential and active populations of the pit mud microbiome for the production of Chinese strong-flavour liquor[J]. Microbial Biotechnology, 2017, 10(6): 1603-1615. DOI:10.1111/1751-7915.12729.
[16] HAMDI O, HANIA W B, POSTEC A, et al. Aminobacterium thunnarium sp. nov., a mesophilic, amino acid-degrading bacterium isolated from an anaerobic sludge digester, pertaining to the phylum Synergistetes[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(Pt 2): 609-614. DOI:10.1099/ijs.0.068965-0.
[17] BAENA S, FARDEAU M L, LABAT M, et al. Aminobacterium mobile sp. nov., a new anaerobic amino-acid-degrading bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 259-264. DOI:10.1099/00207713-50-1-259.
[18] BAENA S, FARDEAU M L, LABAT M, et al. Aminobacterium colombiensegen. nov. sp. nov., an amino acid-degrading anaerobe isolated from anaerobic sludge[J]. Anaerobe, 1998, 4(5): 241-250. DOI:10.1006/anae.1998.0170.
[19] BARKER H, KAMEN M, BORNSTEIN B. The synthesis of butyric and caproic acids from ethanol and acetic acid by Clostridium kluyveri[J]. Proceedings of the National Academy of Sciences of the United States of America, 1945, 31(12): 373-381. DOI:10.1073/pnas.31.12.373.
[20] CAVALCANTE W D A, LEITÃO R C, GEHRING T A, et al. Anaerobic fermentation for n-caproic acid production: a review[J]. Process Biochemistry, 2017, 54: 106-119. DOI:10.1016/j.procbio.2016.12.024.
[21] ZHU X, TAO Y, LIANG C, et al. The synthesis of n-caproate from lactate: a new efficient process for medium-chain carboxylates production[J]. Scientific Reports, 2015, 5(1): 14360. DOI:10.1038/srep14360.
[22] BAUMANN P. Isolation of Acinetobacter from soil and water[J]. Journal of Bacteriology, 1968, 96(1): 39-42.
[23] DING X F, WU C D, ZHANG L Q, et al. Characterization of eubacterial and archaeal community diversity in the pit mud of Chinese Luzhou-flavor liquor by nested PCR-DGGE[J]. World Journal of Microbiology and Biotechnology, 2014, 30(2): 605-612. DOI:10.1007/S11274-013-1472-4.
[24] STOTT M B, CROWE M A, MOUNTAIN B W, et al. Isolation of novel bacteria, including a candidate division, from geothermal soils in New Zealand[J]. Environmental Microbiology, 2008, 10(8): 2030-2041. DOI:10.1111/j.1462-2920.2008.0621.x.
[25] SVIRIDOV A V, SHUSHKOVA T V, ZELENKOVA N F, et al. Distribution of glyphosate and methylphosphonate catabolism systems in soil bacteria Ochrobactrum anthropi and Achromobacter sp.[J]. Applied Microbiology and Biotechnology, 2012, 93(2): 787-796. DOI:10.1007/S00253-011-3485-y.
[26] HEYLEN K, VANPARYS B, PEIRSEGAELE F, et al. Stenotrophomonas terrae sp. nov. and Stenotrophomonas humi sp. nov., two nitrate-reducing bacteria isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(9): 2056-2061. DOI:10.1099/ijs.0.65044-0.
[27] 张会敏, 束莹, 周庆伍, 等. 利用非培养技术研究古井贡酒大曲中的细菌群落结构[J]. 现代食品科技, 2014, 30(4): 44-49. DOI:10.13982/j.mfst.1673-9078.2014.04.025.
[28] 刘森, 李林光, 李可, 等. 中国浓香型白酒窖池窖泥中原核微生物群落的空间异质性[J]. 食品科学, 2013, 34(21): 221-226. DOI:10.7506/spkx1002-6630-201321045.
[29] 朱晓军. 浓香型白酒窖泥产酸菌群培养及新型己酸合成菌的鉴定与特性分析[D]. 无锡: 江南大学 2018.
[30] 张会敏. 古井贡酒微生物群落结构及其与主要风味物质的关联研究[D]. 哈尔滨: 哈尔滨工业大学, 2017.
[31] ZENG T, HU X L, MA Z, et al. Analysis of prokaryotic mirobial community diversity with the capability of caproic acid-producing and lactic acid-utilizing in the pit muds of Luzhou-flavor liquor[J]. Journal of Light Industry, 2017, 32(6): 12-19.
[32] WANG M Y, YANG J G, ZHAO Q S, et al. Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J]. Journal of Food Science, 2019, 84: 6-18. DOI:10.1111/1750-3841.14409.
[33] LIU Z L, HAN Y, LI J W, et al. Analysis of microbial community structure of pit mud for Chinese strong-flavor liquor fermentation using next generation DNA sequencing of full-length 16S rRNA[J]. bioRxiv, 2018: 380949. DOI:10.1101/380949.
[34] 张宿义, 许德富. 泸型酒技艺大全[M]. 北京: 中国轻工业出版社, 2011.
[35] 谭光迅, 李净. 黄水的组分分析及应用研究进展[J]. 酿酒科技, 2010(10): 90-92. DOI:10.13746/j.njkj.2010.10.023.
[36] 朱开宪, 赵金松, 张晗. 酿酒黄水萃取液的应用[J]. 酿酒科技, 2016(7): 78-80. DOI:10.13746/j.njkj.2016049.
[37] 柴玉强, 张宿义, 霍丹群, 等. 利用黄水发酵生产生物发酵液的工艺研究[J]. 食品与发酵科技, 2015, 51(3): 81-86.
 外,老窖池黄水己酸和戊酸值降低;新窖池黄水的乙醇值显著降低,同时丁酸和乙酸的值显著增加。新老窖池新鲜黄水中乳酸杆菌(Lactobacillus)均占绝对优势(>95%),封闭静置培养后,Lactobacillus分别降低至68.55%和52.5%,同时其他菌属的丰度增加,其中包括很多对窖泥老熟有益的厌氧菌。聚类分析表明:与窖龄相比,是否静置培养对黄水菌群的影响更大。冗余分析表明:还原糖与菌群结构的相关性最强,其解释度高达65%。本研究证明了封闭静置培养对黄水菌群的老熟作用,为将来定向培养黄水以促进新窖泥的老熟提供了可能性。
外,老窖池黄水己酸和戊酸值降低;新窖池黄水的乙醇值显著降低,同时丁酸和乙酸的值显著增加。新老窖池新鲜黄水中乳酸杆菌(Lactobacillus)均占绝对优势(>95%),封闭静置培养后,Lactobacillus分别降低至68.55%和52.5%,同时其他菌属的丰度增加,其中包括很多对窖泥老熟有益的厌氧菌。聚类分析表明:与窖龄相比,是否静置培养对黄水菌群的影响更大。冗余分析表明:还原糖与菌群结构的相关性最强,其解释度高达65%。本研究证明了封闭静置培养对黄水菌群的老熟作用,为将来定向培养黄水以促进新窖泥的老熟提供了可能性。 菌等。因
菌等。因 黄水又被称为“液体窖泥”,是“万年糟”作用的执行者。
黄水又被称为“液体窖泥”,是“万年糟”作用的执行者。 外,醋酸杆菌属(A c e t o b a c t e r)、蛋白杆菌属(Proteiniphilum)、喜热菌属(Caloramator)和甲烷菌也在黄水中检测到
外,醋酸杆菌属(A c e t o b a c t e r)、蛋白杆菌属(Proteiniphilum)、喜热菌属(Caloramator)和甲烷菌也在黄水中检测到 ,黄水菌群中的厌氧菌有可能对窖泥菌群的老熟起重要作用。
,黄水菌群中的厌氧菌有可能对窖泥菌群的老熟起重要作用。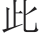 ,有必要全面了解新老窖池新鲜黄水中的菌群组成差异及封闭静置培养对黄水菌群,尤其是对厌氧菌群的影响。窖池发酵25 a,窖泥基本达到老熟
,有必要全面了解新老窖池新鲜黄水中的菌群组成差异及封闭静置培养对黄水菌群,尤其是对厌氧菌群的影响。窖池发酵25 a,窖泥基本达到老熟 本采自安徽北部某知名浓香型白酒企业。
本采自安徽北部某知名浓香型白酒企业。 仪(配C P-W A X 5 7 C B色
仪(配C P-W A X 5 7 C B色 柱(50 mh 0.25 mm,0.2 μm)) 美国Agilent公司;Acquity超高效液相色
柱(50 mh 0.25 mm,0.2 μm)) 美国Agilent公司;Acquity超高效液相色 (配
(配 极管阵列检测器和Waters HSS T3色
极管阵列检测器和Waters HSS T3色 柱(100 mmh 2.1 mm,1.8 μm)) 美国Waters公司;TU-1810S紫外-可见分光光度计 北京普析通用分析仪器有限公司。
柱(100 mmh 2.1 mm,1.8 μm)) 美国Waters公司;TU-1810S紫外-可见分光光度计 北京普析通用分析仪器有限公司。 本采集
本采集 本。取6 个新窖池(窖龄6 a)新鲜黄水
本。取6 个新窖池(窖龄6 a)新鲜黄水 本,标记为YN-1~YN-6;6 个老窖池(窖龄≥50 a)新鲜黄水
本,标记为YN-1~YN-6;6 个老窖池(窖龄≥50 a)新鲜黄水 本,标记为YO-1~YO-6。另外取3 个老窖池黄水
本,标记为YO-1~YO-6。另外取3 个老窖池黄水 本用于提取基因组后高通量测序。
本用于提取基因组后高通量测序。 本与15%甲醇溶液按照1∶9体积比混匀,0.22 μm滤膜过滤得到浸提液,用于检测其中有机酸醇含量。通过气相色
本与15%甲醇溶液按照1∶9体积比混匀,0.22 μm滤膜过滤得到浸提液,用于检测其中有机酸醇含量。通过气相色 仪检测黄水中挥发性有机酸和乙醇的含量:进
仪检测黄水中挥发性有机酸和乙醇的含量:进 仪检测乳酸含量:进
仪检测乳酸含量:进 本DNA。由上海派森诺生物科技股份有限公司进行Illumina MiSeq高通量测序16S V4可变区。引物:520F(5’-7 bp barcode
本DNA。由上海派森诺生物科技股份有限公司进行Illumina MiSeq高通量测序16S V4可变区。引物:520F(5’-7 bp barcode GCA CCT AAY TGG GYD TAA AGNG-3’)和802R(5’-TAC NVG GGT ATC TAA TCC-3’)。25 μL PCR扩增体系:0.25 μL Q5高保真DNA聚合酶,5 μL 5h PCR Buffer,5 μL 5h High GC Buffer,2 μL dNTP(2.5 mmol/L),2 μL DNA模板,1 μL上下游引物(10 μmol/L),8.75 μL双蒸水。PCR扩增程序:98 ℃预变性2 min;25 个循环扩增:98 ℃变性20 s,55 ℃退火30 s,72 ℃延伸15 s;72 ℃完全延伸5 min。PCR扩增产物经纯化后,Quant-iT PicoGreen dsDNA Assay Kit荧光定量,构建克隆文库(TruSeq Nano DNA LT Library Prep Kit,Illumina),经Agilent 2100 Bioanlyzer检验DNA文库合格后,Illumina MiSeq双向测序(MiSeq Reagent Kit V3)。
GCA CCT AAY TGG GYD TAA AGNG-3’)和802R(5’-TAC NVG GGT ATC TAA TCC-3’)。25 μL PCR扩增体系:0.25 μL Q5高保真DNA聚合酶,5 μL 5h PCR Buffer,5 μL 5h High GC Buffer,2 μL dNTP(2.5 mmol/L),2 μL DNA模板,1 μL上下游引物(10 μmol/L),8.75 μL双蒸水。PCR扩增程序:98 ℃预变性2 min;25 个循环扩增:98 ℃变性20 s,55 ℃退火30 s,72 ℃延伸15 s;72 ℃完全延伸5 min。PCR扩增产物经纯化后,Quant-iT PicoGreen dsDNA Assay Kit荧光定量,构建克隆文库(TruSeq Nano DNA LT Library Prep Kit,Illumina),经Agilent 2100 Bioanlyzer检验DNA文库合格后,Illumina MiSeq双向测序(MiSeq Reagent Kit V3)。 后的OTU列表,使用Qiime软件(v1.8.0)计
后的OTU列表,使用Qiime软件(v1.8.0)计 其Shannon指数、Chao 1指数等微生物群落多
其Shannon指数、Chao 1指数等微生物群落多 性指数。使用Qiime软件,对Weighted UniFrac距离矩阵分别进行UPGMA聚类分析,并使用R软件(R3.3.2)进行可视化。黄水
性指数。使用Qiime软件,对Weighted UniFrac距离矩阵分别进行UPGMA聚类分析,并使用R软件(R3.3.2)进行可视化。黄水 本的理化性质
本的理化性质
 本。对所有
本。对所有 本。每个
本。每个 本的测序覆盖率大于99%,说明测序数目足够,测序序列可以代表其菌群组成。得到注释(门、纲、目、科、属)的序列大于99.9%,无法得到注释的序列仅12 条序列,说明对窖泥中大量的未培养菌也充分实现了系统分类。如表2所示,新老窖池的新鲜黄水相比较,两者微生物群落的OTU数目、Shannon指数和Chao 1指数都不具有显著性差异,经过封闭静置培养5 个月后,3 个微生物群落参数值均显著升高,说明静置培养后黄水中的菌群丰度和多
本的测序覆盖率大于99%,说明测序数目足够,测序序列可以代表其菌群组成。得到注释(门、纲、目、科、属)的序列大于99.9%,无法得到注释的序列仅12 条序列,说明对窖泥中大量的未培养菌也充分实现了系统分类。如表2所示,新老窖池的新鲜黄水相比较,两者微生物群落的OTU数目、Shannon指数和Chao 1指数都不具有显著性差异,经过封闭静置培养5 个月后,3 个微生物群落参数值均显著升高,说明静置培养后黄水中的菌群丰度和多
 本的98.46%和95.72%。将相对丰度超过0.1%的门定义为优势菌门(图1)。除Firmicutes外,其余4 个优势菌门在新老窖池新鲜黄水中的相对丰度依次为:变形菌门(Proteobacteria,1.0%和2.0%)、放线菌(Actinobacteria,0.11%和1.0%)、拟杆菌门(Bacteroidetes,0.1%和0.36%)和绿弯菌门(Chloroflexi,0.03%和0.45%)。Firmicutes在黄水中的绝对优势情况也存在于窖泥中
本的98.46%和95.72%。将相对丰度超过0.1%的门定义为优势菌门(图1)。除Firmicutes外,其余4 个优势菌门在新老窖池新鲜黄水中的相对丰度依次为:变形菌门(Proteobacteria,1.0%和2.0%)、放线菌(Actinobacteria,0.11%和1.0%)、拟杆菌门(Bacteroidetes,0.1%和0.36%)和绿弯菌门(Chloroflexi,0.03%和0.45%)。Firmicutes在黄水中的绝对优势情况也存在于窖泥中 外,经过静置培养后,互养菌门(Synergistetes)在老窖池黄水中的相对丰度上升幅度很大(由0.06%变为2.11%),而在新窖池黄水中变化幅度相对较小(由0.02%变为0.46%)。通过静置培养,黄水菌群与窖泥菌群中的组成更接近了,比如Firmicutes与窖泥中的菌群组成更接近。
外,经过静置培养后,互养菌门(Synergistetes)在老窖池黄水中的相对丰度上升幅度很大(由0.06%变为2.11%),而在新窖池黄水中变化幅度相对较小(由0.02%变为0.46%)。通过静置培养,黄水菌群与窖泥菌群中的组成更接近了,比如Firmicutes与窖泥中的菌群组成更接近。
 高,因为黄水
高,因为黄水 本菌群组成进行Weighted Unifrac Distance聚类(图3)发现,所有黄水
本菌群组成进行Weighted Unifrac Distance聚类(图3)发现,所有黄水 可知,与窖池的窖龄相比,是否静置培养对黄水
可知,与窖池的窖龄相比,是否静置培养对黄水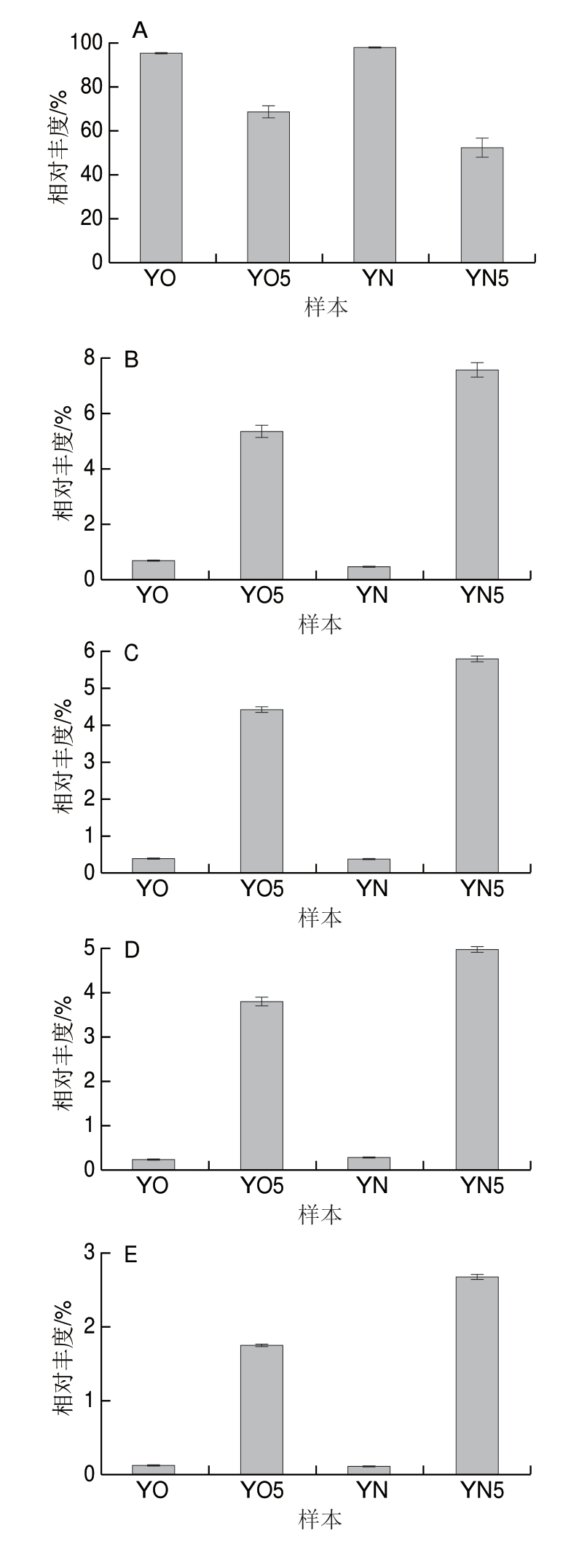

 外,黄水中的其余7 个优势菌属的相对丰度都显著性增加。
外,黄水中的其余7 个优势菌属的相对丰度都显著性增加。 性绝对好氧菌,在土壤中常见
性绝对好氧菌,在土壤中常见 性菌,绝对厌氧菌,其在老窖泥中的相对丰度更大,具有降解氨基酸的功能
性菌,绝对厌氧菌,其在老窖泥中的相对丰度更大,具有降解氨基酸的功能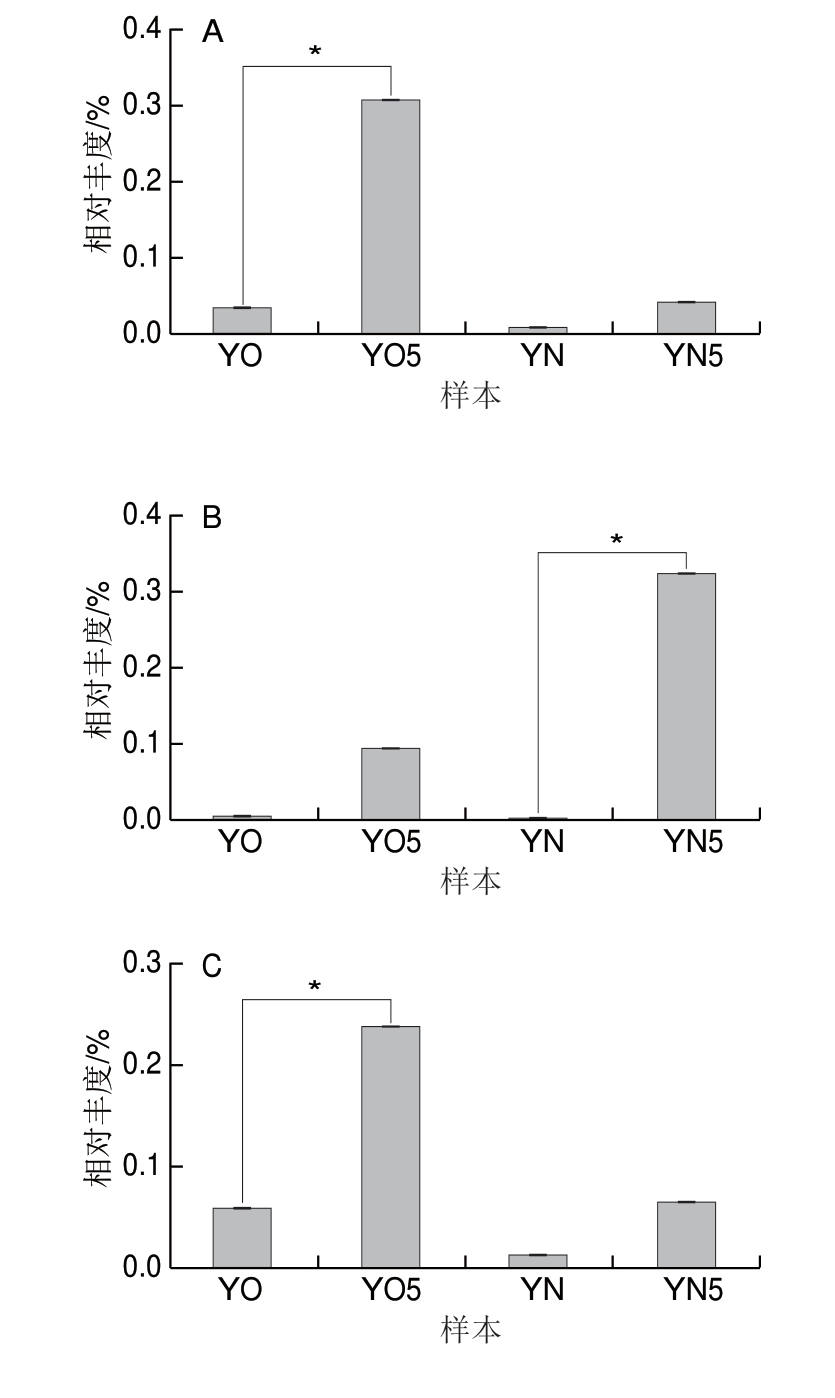

 本差异极显著,P<0.01。
本差异极显著,P<0.01。 本理化性质与菌群之间的RDA
本理化性质与菌群之间的RDA
 ,锐
,锐 表示负相关。
表示负相关。 本集中在左侧,静置培养后的黄水
本集中在左侧,静置培养后的黄水 也可得知,与窖池的窖龄相比,是否静置培养对黄水
也可得知,与窖池的窖龄相比,是否静置培养对黄水 本的菌群组成影响更大,与图3结论一致。图6中还原糖、淀粉、酸度和乙醇与新鲜黄水
本的菌群组成影响更大,与图3结论一致。图6中还原糖、淀粉、酸度和乙醇与新鲜黄水 本菌群呈强烈正相关,铵态氮与静置培养黄水呈正相关,表明新鲜黄水中还原糖、淀粉、酸度和乙醇的值偏高,静置培养后的黄水铵态氮升高。使用互动向前选择程序验收11 个理化因子,发现参数还原糖的解释度最高65%(P<0.01)。
本菌群呈强烈正相关,铵态氮与静置培养黄水呈正相关,表明新鲜黄水中还原糖、淀粉、酸度和乙醇的值偏高,静置培养后的黄水铵态氮升高。使用互动向前选择程序验收11 个理化因子,发现参数还原糖的解释度最高65%(P<0.01)。 外,其余理化指标的贡献率都不具有显著性,指标(解释度)分别为:己酸(6.2%)、乳酸(5.9%)、铵态氮(2.7%)、乙酸(2.2%)、丁酸(1.7%)、酸度(1.4%)、淀粉(1.2%)、乙醇(0.9%)、戊酸(0.3%)、丙酸(0.2%)。
外,其余理化指标的贡献率都不具有显著性,指标(解释度)分别为:己酸(6.2%)、乳酸(5.9%)、铵态氮(2.7%)、乙酸(2.2%)、丁酸(1.7%)、酸度(1.4%)、淀粉(1.2%)、乙醇(0.9%)、戊酸(0.3%)、丙酸(0.2%)。 本,经过5 个月的封闭静置培养,黄水中的淀粉、还原糖被消耗,同时酸度也略有下降,而铵态氮略有增加。该过程展示了窖泥老熟过程中其理化性质的变化。从一定程度上来说,窖泥的老熟过程其实是黄水浸入窖泥(窖池池壁和池底土壤)后,静置生长的同时促使窖泥理化性质和菌群结构变化的过程。根据已有研究
本,经过5 个月的封闭静置培养,黄水中的淀粉、还原糖被消耗,同时酸度也略有下降,而铵态氮略有增加。该过程展示了窖泥老熟过程中其理化性质的变化。从一定程度上来说,窖泥的老熟过程其实是黄水浸入窖泥(窖池池壁和池底土壤)后,静置生长的同时促使窖泥理化性质和菌群结构变化的过程。根据已有研究 外,新老窖池黄水经过静置培养后,其中乳酸没有显著变化,而提高pH值降解乳酸是关键,现已知窖泥中存在以乳酸为前体生成己酸的菌种
外,新老窖池黄水经过静置培养后,其中乳酸没有显著变化,而提高pH值降解乳酸是关键,现已知窖泥中存在以乳酸为前体生成己酸的菌种 将来有必要寻找适宜的黄水培养条件,加强乳酸降解菌株的降解作用,提高黄水pH值,促进黄水菌群的老熟。
将来有必要寻找适宜的黄水培养条件,加强乳酸降解菌株的降解作用,提高黄水pH值,促进黄水菌群的老熟。 外,柴玉强等
外,柴玉强等 次发酵再蒸馏酒的方法。本研究尝试了直接静置厌氧培养黄水的方法,可能解决黄水的处理问题,将黄水变废为宝,用于窖泥改良,将来还需要对黄水作为“液体窖泥”的培养条件进行进一步研究。
次发酵再蒸馏酒的方法。本研究尝试了直接静置厌氧培养黄水的方法,可能解决黄水的处理问题,将黄水变废为宝,用于窖泥改良,将来还需要对黄水作为“液体窖泥”的培养条件进行进一步研究。