花色苷是一类水溶性天然着色剂,具有一定的抗氧化、抗炎症等多种生物活性[1],在食品等领域有巨大的应用潜力[2],但易受温度、光照等因 影响导致其稳定性较差,因
影响导致其稳定性较差,因 采用胶囊化技术提高花色苷的稳定性,扩展适用范围[3]。目前花色苷的微胶囊化常用方法有喷雾干燥法、脂质体法和凝聚法等,其中喷雾干燥在食品工业中是最常用的封装技术。喷雾干燥过程中,溶剂快速蒸发,活性成分瞬间被保留[4]从而形成非晶态的固体分散体[5],
采用胶囊化技术提高花色苷的稳定性,扩展适用范围[3]。目前花色苷的微胶囊化常用方法有喷雾干燥法、脂质体法和凝聚法等,其中喷雾干燥在食品工业中是最常用的封装技术。喷雾干燥过程中,溶剂快速蒸发,活性成分瞬间被保留[4]从而形成非晶态的固体分散体[5], 法工艺简单、成本较低,适用于对温度敏感的活性物质[6]。喷雾干燥法已被证实能有效保护多酚化合物[7],但其高温条件在一定程度上可能会降解热敏性的花色苷。
法工艺简单、成本较低,适用于对温度敏感的活性物质[6]。喷雾干燥法已被证实能有效保护多酚化合物[7],但其高温条件在一定程度上可能会降解热敏性的花色苷。
内源乳化法是近年来兴起的新型海藻酸盐微胶囊制备方法,是将海藻酸钠溶液、水不溶性钙盐及包埋物共混后分散到油相中形成W/O型乳化液,加入酸引发钙盐中Ca2 的解离,促使Ca2
的解离,促使Ca2 在乳液液滴内部与海藻酸钠作用生成海藻酸钙凝胶珠。内源乳化法采用无毒试剂,因而可应用于生物、食品、医药等行业中包埋生物 活性物质[8-9]。
在乳液液滴内部与海藻酸钠作用生成海藻酸钙凝胶珠。内源乳化法采用无毒试剂,因而可应用于生物、食品、医药等行业中包埋生物 活性物质[8-9]。
本实验以葡萄皮提取物中的花色苷为芯材,以海藻酸钠为壁材[10],采用内源乳化法制备湿态花色苷微胶囊,再考察喷雾干燥工艺对微胶囊化湿态花色苷的影响,比较分析花色苷微胶囊化前后对其光照、温度、 肠消化稳定性的影响,旨在为提高花色苷类功能性食品的稳定性研究开发提供理论依据。
肠消化稳定性的影响,旨在为提高花色苷类功能性食品的稳定性研究开发提供理论依据。
1 材料与方法
1.1 材料与试剂
葡萄皮红色 提取物(色价32.27) 云南通海杨氏天然产物有限公司;海藻酸钠 青岛明月海藻集团有限公司;纳米级碳酸钠(分析纯) 哈尔冰萨默斯生物科技有限公司;无水乙醇、Span80、冰醋酸、柠檬酸等试剂(均为分析纯)、
提取物(色价32.27) 云南通海杨氏天然产物有限公司;海藻酸钠 青岛明月海藻集团有限公司;纳米级碳酸钠(分析纯) 哈尔冰萨默斯生物科技有限公司;无水乙醇、Span80、冰醋酸、柠檬酸等试剂(均为分析纯)、 蛋白酶、胰蛋白酶、猪胆盐(均为生化级) 国药集团化学试剂有限公司;DPPH(分析级) Sigma中国有限公司。
蛋白酶、胰蛋白酶、猪胆盐(均为生化级) 国药集团化学试剂有限公司;DPPH(分析级) Sigma中国有限公司。
1.2 仪器与设备
YC-3000喷雾干燥机 上海雅程仪器设备有限 公司;Evolution220紫外-可见分光光度计 美国Thermo Fisher公司;MS3000 LV
LV Aeros激光粒度仪 上海思百吉仪器系统有限公司武汉分公司;CM-24圆形水浴氮吹仪 瑞士万通中国有限公司;S-3000N扫描式电子显微镜(scanning electron microscope,SEM) 日本 日立公司;XD30倒置显微镜 宁波舜宇仪器有限公司; UV-4802紫外全扫描分光光度计 武汉利天科技仪器有限公司。
Aeros激光粒度仪 上海思百吉仪器系统有限公司武汉分公司;CM-24圆形水浴氮吹仪 瑞士万通中国有限公司;S-3000N扫描式电子显微镜(scanning electron microscope,SEM) 日本 日立公司;XD30倒置显微镜 宁波舜宇仪器有限公司; UV-4802紫外全扫描分光光度计 武汉利天科技仪器有限公司。
1.3 方法
1.3.1 葡萄皮花色苷的制备及含量测定[11-12]
将3.0 g葡萄皮红色 溶于1 L纯水,过滤除杂,AB-8柱对花色苷纯化,并用酸性乙醇洗脱后浓缩冻干备用,测定花色苷的含量。其中上
溶于1 L纯水,过滤除杂,AB-8柱对花色苷纯化,并用酸性乙醇洗脱后浓缩冻干备用,测定花色苷的含量。其中上 流速为1.5 mL/min,上
流速为1.5 mL/min,上 液质量浓度为3.0 mg/mL,洗脱流速为1.0 mL/min,洗脱液为体积分数80%酸性乙醇。
液质量浓度为3.0 mg/mL,洗脱流速为1.0 mL/min,洗脱液为体积分数80%酸性乙醇。
pH示差法测定葡萄皮色 中总花色苷的含量。将1 mg冻干后的花色苷纯化物溶于蒸馏水,配制成1 mg/mL的花色苷溶液,分别用氯化钾-盐酸缓冲液(0.025 mol/L, pH 1.0)和醋酸钠缓冲液(0.4 mol/L,pH 4.5)稀释10 倍,稀释液室温避光平衡15 min后,以蒸馏水做空白对照,分别测定两种
中总花色苷的含量。将1 mg冻干后的花色苷纯化物溶于蒸馏水,配制成1 mg/mL的花色苷溶液,分别用氯化钾-盐酸缓冲液(0.025 mol/L, pH 1.0)和醋酸钠缓冲液(0.4 mol/L,pH 4.5)稀释10 倍,稀释液室温避光平衡15 min后,以蒸馏水做空白对照,分别测定两种 品稀释液在λmax和700 nm波长处的吸光度A,按下式计
品稀释液在λmax和700 nm波长处的吸光度A,按下式计 :
:
总花色苷含量(C)按矢车菊色 -3-葡萄糖苷(cyanidin-3-glucoside,cy-3-glu)表示,按下式计
-3-葡萄糖苷(cyanidin-3-glucoside,cy-3-glu)表示,按下式计 :
:
式中:A为pH 1.0、4.5时花色苷在λmax波长处的吸光度差值;V为提取液总体积;n为稀释倍数;M为cy-3-glu的摩尔质量(449.4 g/mol);ε为cy-3-glu的消光系数(26 900 L/(molg cm));m为花色苷纯化物质量。
根据pH 示差法测得的葡萄皮花色苷含量为 102.99 g/mg。
1.3.2 花色苷微胶囊的制备
根据内源乳化法的原理,以海藻酸钠为壁材[13-15]:海藻酸钠、碳酸钙溶于20 mL水中,溶胀1~2 h后与10 mL花色苷溶液充分混匀待用;Span80与大豆油按一定比例混匀后加入制备好的水相,磁力搅拌进行乳化得到W/O乳浊液,再加20 mL含有乙酸的大豆油(降低体系pH值),最后加入200 mL含有NaCl的磷酸盐缓冲液(0.1 mol/L,pH 7.0),静置1~2 h,采用分液漏斗分离油水相得到湿态花色苷微胶囊,在一定条件下喷雾 干燥[16-17]制备花色苷微胶囊。
通过Plackett-Burman试验设计、最陡爬坡试验及Box-Behnken设计试验得出内源乳化法制备花色苷微胶囊的最佳工艺条件为:海藻酸钠与CaCO3质量比为3∶1,壁材与芯材质量比为15∶1,酸钙质量比为3∶1,NaCl质量浓度为900 mg/mL。经验证,该条件下的微胶囊包埋率为75.12%,平均粒径为120 μm。
考察加热器温度、进料速率和真空压力3 个单因 对微胶囊化的影响,根据单因
对微胶囊化的影响,根据单因 试验结果,进行正交试验设计L9(33)确定最佳制备工艺参数。
试验结果,进行正交试验设计L9(33)确定最佳制备工艺参数。
式中:A1为包埋前花色苷的吸光度;A2为包埋后花色苷的吸光度。
1.3.4 微胶囊形态观察及粒径的测定
SEM观察干燥的花色苷微胶囊形态:将花色苷微胶囊 品固定于载玻片上,用离子溅射仪镀一层金膜后在SEM下观察微胶囊的微观形态。
品固定于载玻片上,用离子溅射仪镀一层金膜后在SEM下观察微胶囊的微观形态。
马尔文激光粒度仪测定花色苷微胶囊的平均粒径和粒径分布:取少量干燥的花色苷微胶囊用纯水溶解,按一定比例稀释,用激光粒度仪测定花色苷微胶囊的平均粒径和粒径分布。
1.3.5 花色苷微胶囊的紫外-可见光 分析
分析
称取一定质量的花色苷微胶囊溶于无水乙醇,采用超声波振荡破碎释放花色苷,微孔滤膜过滤后在300~800 nm波长范围内进行紫外全扫描,对照组仅将花色苷微胶囊溶解在无水乙醇中后进行紫外全扫描。
1.3.6 花色苷微胶囊的光照稳定性
对照组:以pH 2.0柠檬酸-磷酸氢 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
实验组:微胶囊预先采用1% DMSO充分溶解,再以pH 2.0柠檬酸-磷酸氢 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
将两组溶液密封静置于50 W日光灯下考察0、1、2、3、4、5 h花色苷的光照稳定性。采用紫外分光光度计测定吸光度,由下式计
 品花色苷保存率:
品花色苷保存率:
1.3.3 包埋率的测定
根据内源乳化法的原理和花色苷紫外-可见光 吸收特性可以分别测定包埋前后分离液的吸光度,按下式计
吸收特性可以分别测定包埋前后分离液的吸光度,按下式计 包埋率:
包埋率:
对花色苷微胶囊和花色苷光降解动力学分析,符合一级反应动力学方程:
式中:C0为花色苷溶液初始吸光度;Ct为受光照t小时后的溶液吸光度;t1/2为花色苷受光降解半衰期;k为降解反应速率常数/h 1。
1。
1.3.7 花色苷微胶囊的热稳定性
对照组:以pH 2.0柠檬酸-磷酸氢 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
实验组:微胶囊预先采用1% DMSO充分溶解,再以pH 2.0柠檬酸-磷酸氢 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
将两组溶液密封置于试管架,于50、60、70、80、90 ℃条件下避光水浴,每半小时取 测定其在2.5 h内吸光度变化。按式(4)计
测定其在2.5 h内吸光度变化。按式(4)计 花色苷保存率;对花色苷微胶囊和花色苷光降解动力学分析,符合一级反应动力学方 程(5),并按方程(6)计
花色苷保存率;对花色苷微胶囊和花色苷光降解动力学分析,符合一级反应动力学方 程(5),并按方程(6)计 花色苷温度降解半衰期。
花色苷温度降解半衰期。
1.3.8 花色苷微胶囊在模拟人 肠消化环境中的稳定性
肠消化环境中的稳定性
1.3.8.1 人工模拟 消化
消化
取1.0 g 蛋白酶溶于8 mL 0.1 mol/L HCl溶液,配制成
蛋白酶溶于8 mL 0.1 mol/L HCl溶液,配制成 蛋白酶溶液[18];称取花色苷微胶囊与花色苷粉末,分别加入微量无水乙醇涡旋充分溶解后加入50 mL超纯水,通过氮吹仪挥发溶液乙醇,最后高速分散混匀得到花色苷
蛋白酶溶液[18];称取花色苷微胶囊与花色苷粉末,分别加入微量无水乙醇涡旋充分溶解后加入50 mL超纯水,通过氮吹仪挥发溶液乙醇,最后高速分散混匀得到花色苷 液。取25 mL花色苷
液。取25 mL花色苷 液并调节pH值至2.0,加入0.5 mL
液并调节pH值至2.0,加入0.5 mL 蛋白酶溶液,置于37 ℃水浴振荡,转速为100 r/min,测定0、0.5、1、1.5、2 h模拟
蛋白酶溶液,置于37 ℃水浴振荡,转速为100 r/min,测定0、0.5、1、1.5、2 h模拟 液中
液中 品吸光度的变化。反应期间,密封避光保存防止花色苷降解。
品吸光度的变化。反应期间,密封避光保存防止花色苷降解。
1.3.8.2 人工模拟肠消化
取0.3 1 3 g 胰蛋白酶和1.8 8 g 猪胆盐混合溶于50 mL 0.1 mol/L NaHCO3缓冲液,配制成模拟肠溶液。将经过2 h 消化
消化 品于
品于 4 ℃放置2 h,于3 000 r/min离心15 min去除
4 ℃放置2 h,于3 000 r/min离心15 min去除 蛋白酶,取上清液加入2 mL胰蛋白酶和猪胆盐混合溶液,用0.1 mol/L NaHCO3缓冲溶液调至pH 6.8,置于37 ℃水浴振荡,转速为100 r/min,测定0、0.5、1、1.5、2 h模拟肠液中
蛋白酶,取上清液加入2 mL胰蛋白酶和猪胆盐混合溶液,用0.1 mol/L NaHCO3缓冲溶液调至pH 6.8,置于37 ℃水浴振荡,转速为100 r/min,测定0、0.5、1、1.5、2 h模拟肠液中 品吸光度的变化。在反应期间,密封避光保存防止花色苷降解。
品吸光度的变化。在反应期间,密封避光保存防止花色苷降解。
1.4 数据处理
利用数据处理软件SPSS 19和Origin 85进行数据统计及图表绘制。
2 结果与分析
2.1 喷雾干燥单因 试验结果
试验结果
2.1.1 加热器温度对花色苷微胶囊粒径及包埋率的影响
低温喷雾干燥参数设置中,在进料速率12 r/min、真空压力0.03 MPa的条件下,加热器温度对花色苷微胶囊平均粒径及包埋率的影响结果见图1。
由图1可知,花色苷微胶囊平均粒径随温度的升高而先减后增,包埋率呈下降趋势,包埋率随温度变化波动较小则主要考虑粒径变化。加热器温度为120 ℃时微胶囊平均粒径达到最小值552.3 nm,包埋率为75.4%, 时进出料口温度分别为70.2、64.8 ℃,
时进出料口温度分别为70.2、64.8 ℃, 后平均粒径随加热器温度的上升而增大,可能是加热器温度过低时进出料口温度过低,微胶囊化时间长,溶剂蒸发速度慢,流动性差,且易回潮,导致微胶囊颗粒聚集大小不均一,粒径分布较为广泛,加热器温度过高时溶剂蒸发速度太快,囊壁破碎从而影响花色苷微胶囊的稳定性及生物活性[19]。因
后平均粒径随加热器温度的上升而增大,可能是加热器温度过低时进出料口温度过低,微胶囊化时间长,溶剂蒸发速度慢,流动性差,且易回潮,导致微胶囊颗粒聚集大小不均一,粒径分布较为广泛,加热器温度过高时溶剂蒸发速度太快,囊壁破碎从而影响花色苷微胶囊的稳定性及生物活性[19]。因 确定喷雾干燥法制备花色苷微胶囊的最佳加热器温度为120 ℃。
确定喷雾干燥法制备花色苷微胶囊的最佳加热器温度为120 ℃。
2.1.2 进料速率对花色苷微胶囊粒径及包埋率的影响
低温喷雾干燥参数设置中,在真空压力0.03 MPa、加热器温度120 ℃的条件下,进料速率对花色苷微胶囊平均粒径及包埋率的影响结果见图2。
由图2可知,花色苷微胶囊的平均粒径随进料速率的增加而先减后增,包埋率呈下降趋势,综合粒径和包埋率的变化趋势及波动性,选择主要参考平均粒径。进料速率达到12 r/min时,平均粒径达到最小值571.5 nm,包埋率为77.3%,之后平均粒径随着进料速率的增加而增大,可能是在喷雾干燥过程中,进料速率过快, 品流量过大,较多
品流量过大,较多 品进入雾化器降低
品进入雾化器降低 品与热空气的传热传质效率[20],
品与热空气的传热传质效率[20], 品未能充分干燥导致微胶囊颗粒发生聚集,从而影响花色苷微胶囊的粒径大小。因
品未能充分干燥导致微胶囊颗粒发生聚集,从而影响花色苷微胶囊的粒径大小。因 确定喷雾干燥法制备花色苷微胶囊的最佳进料速率为12 r/min。
确定喷雾干燥法制备花色苷微胶囊的最佳进料速率为12 r/min。
2.1.3 真空压力对花色苷微胶囊粒径及包埋率的影响
低温喷雾干燥参数设置中,在加热器温度120 ℃、进料速率12 r/min的条件下,真空压力对花色苷微胶囊平均粒径及包埋率的影响见图3。
由图3可知,花色苷微胶囊的平均粒径及包埋率均随真空压力的增加而先减后增,综合粒径和包埋率的变化趋势及波动性,选择主要参考平均粒径。在0.03 MPa时,其平均粒径仅为560.1 nm,包埋率为74.3%,之后平均粒径随真空压力的升高而变大,可能是较小真空压力影响溶剂蒸发速度及颗粒成型速度,进出料口间隔距离较短, 品未能及时干燥成型;真空压力太大则超出囊壁承压范围致使囊壁破碎,芯材流出。因
品未能及时干燥成型;真空压力太大则超出囊壁承压范围致使囊壁破碎,芯材流出。因 确定喷雾干燥法制备花色苷微胶囊的最佳真空压力为0.03 MPa。
确定喷雾干燥法制备花色苷微胶囊的最佳真空压力为0.03 MPa。
2.2 喷雾干燥正交试验结果
由表1可知,影响因 的主次顺序为加热器温度>进料速率>真空压力。最优方案为A2B2C2,即加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa。经实验验证,以最优条件进行喷雾干燥时,花色苷微胶囊的平均粒径仅为558.2 nm,包埋率为75.12%,优于表中其他方案组。
的主次顺序为加热器温度>进料速率>真空压力。最优方案为A2B2C2,即加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa。经实验验证,以最优条件进行喷雾干燥时,花色苷微胶囊的平均粒径仅为558.2 nm,包埋率为75.12%,优于表中其他方案组。
表 1 正交试验设计与结果
Table 1 Orthogonal array design and results
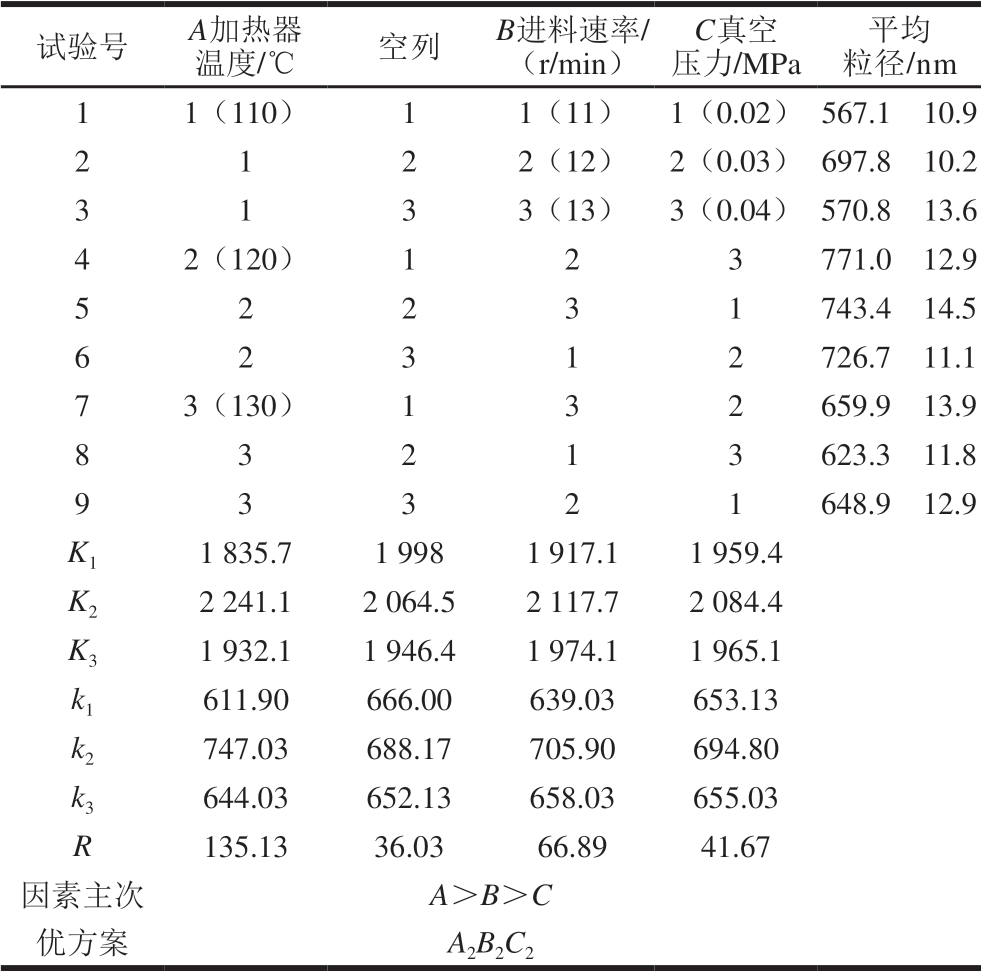
试验号 A加热器 温度/℃ 空列 B进料速率/ (r/min)C真空 压力/MPa平均 粒径/nm 1 1(110) 1 1(11) 1(0.02) 567.1f 10.9 2 1 2 2(12) 2(0.03) 697.8f 10.2 3 1 3 3(13) 3(0.04) 570.8f 13.6 4 2(120) 1 2 3 771.0f 12.9 5 2 2 3 1 743.4f 14.5 6 2 3 1 2 726.7f 11.1 7 3(130) 1 3 2 659.9f 13.9 8 3 2 1 3 623.3f 11.8 9 3 3 2 1 648.9f 12.9 K1 1 835.7 1 998 1 917.1 1 959.4 K2 2 241.1 2 064.5 2 117.7 2 084.4 K3 1 932.1 1 946.4 1 974.1 1 965.1 k1 611.90 666.00 639.03 653.13 k2 747.03 688.17 705.90 694.80 k3 644.03 652.13 658.03 655.03 R 135.13 36.03 66.89 41.67因images/BZ_291_310_1349_341_1381.png主次 A>B>C优方案 A2B2C2
2.3 花色苷微胶囊的形态及粒径大小
2.3.1 花色苷微胶囊的形态
由图4可知,喷雾干燥的花色苷微胶囊分布均匀、颗粒完整,呈现圆形外部结构并且有不同尺寸的附聚物,具有喷雾干燥粉末的特征[21]。部分微胶囊会存在表面开裂、凹痕或形状不规则的情况,可能与 品的水分含量、操作温度、进料速率有关[22-23]。
品的水分含量、操作温度、进料速率有关[22-23]。
2.3.2 花色苷微胶囊的粒径
喷雾干燥的花色苷微胶囊呈粉末状,圆球度好,大小均一,粒径分布均匀,平均粒径可达到558.2 nm(图5)。综上可知,喷雾干燥法有利于制备胶囊化产品,制备所需时间较短能避免 品受热时间过长,并且可有效降低微胶囊的粒径大小,使粒径分布更为集中[24]。
品受热时间过长,并且可有效降低微胶囊的粒径大小,使粒径分布更为集中[24]。
2.4 花色苷微胶囊的紫外-可见光 特征
特征
由图6可知,超声波破碎处理的花色苷微胶囊及花色苷 品在542 nm波长处有最大的光
品在542 nm波长处有最大的光 吸收
吸收 ,在花色苷最大吸收区域465~550 nm波长范围内符合花色苷的可见光吸收特性,
,在花色苷最大吸收区域465~550 nm波长范围内符合花色苷的可见光吸收特性, 时花色苷微胶囊包埋率为75.12%,表明花色苷很好地包裹于微胶囊内,基本无损失。未破碎处理的花色苷微胶囊在可见光吸收区有较小的特征
时花色苷微胶囊包埋率为75.12%,表明花色苷很好地包裹于微胶囊内,基本无损失。未破碎处理的花色苷微胶囊在可见光吸收区有较小的特征 ,可能是在制备微胶囊过程中花色苷残留在胶囊表面。结合花色苷微胶囊的形态观察及粒径结果表明,基于内源乳化法的微胶囊化包埋花色苷是一种技术可行且有效的方法。
,可能是在制备微胶囊过程中花色苷残留在胶囊表面。结合花色苷微胶囊的形态观察及粒径结果表明,基于内源乳化法的微胶囊化包埋花色苷是一种技术可行且有效的方法。
2.5 光照对花色苷微胶囊稳定性影响
由图7可知,光照3 h和5 h,花色苷微胶囊的保存率分别为93.8%和82.1%,花色苷的保存率分别为80.0%和63.7%,可见花色苷微胶囊的光稳定性要明显高于花色苷,表明以海藻酸钠为壁材的内源乳化法制备微胶囊可有效保护花色苷芯材;避光保存5 h,花色苷和花色苷微胶囊的保存率分别为78.6%和91.4%,结果表明微胶囊化可提高花色苷的保存率[3,25]。分别比较花色苷和花色苷微胶囊在光照和避光条件下的保存率,发现光照能加速花色苷的降解,而微胶囊化可增强花色苷对光照的耐受力,提高其稳定性[26]。
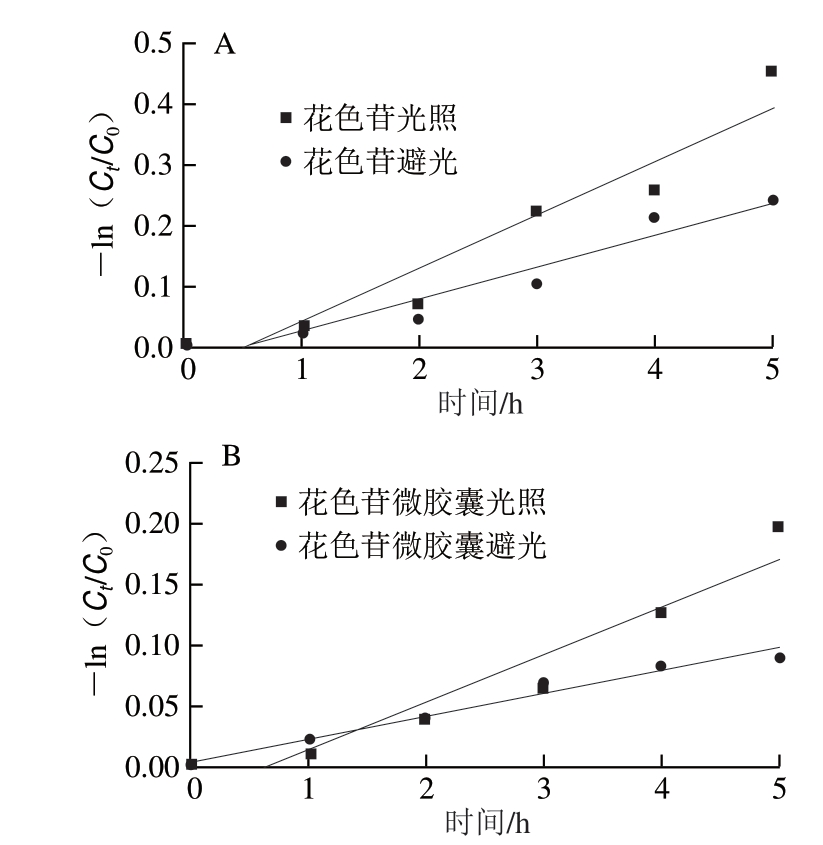
以光照时间为横坐标, ln(Ct/C0)为纵坐标回归拟合直线,光照对花色苷和花色苷微胶囊的降解如图8所示,通过线性回归分析可知
ln(Ct/C0)为纵坐标回归拟合直线,光照对花色苷和花色苷微胶囊的降解如图8所示,通过线性回归分析可知 ln(Ct/C0)与时间呈良好的线性关系,花色苷和花色苷微胶囊的光照降解动力学均符合一级动力学反应,其降解动力学参数如表2所示。
ln(Ct/C0)与时间呈良好的线性关系,花色苷和花色苷微胶囊的光照降解动力学均符合一级动力学反应,其降解动力学参数如表2所示。
表 2 花色苷、花色苷微胶囊的光降解动力学参数
Table 2 Photo-degradation kinetics parameters of free anthocyanins and anthocyanin microcapsules
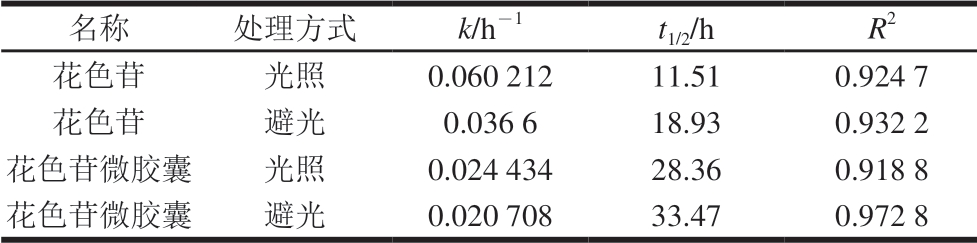
名称 处理方式 k/h-1 t1/2/h R2花色苷 光照 0.060 212 11.51 0.924 7花色苷 避光 0.036 6 18.93 0.932 2花色苷微胶囊 光照 0.024 434 28.36 0.918 8花色苷微胶囊 避光 0.020 708 33.47 0.972 8
由表2可知,相较于避光状态,在光照条件下花色苷和花色苷微胶囊的一级反应速率常数k均增大,且半衰期均减小,表明花色苷在光照条件下不稳定,避光状态更利于保存。在光照和避光条件下,花色苷微胶囊的半衰期比花色苷的半衰期长,说明微胶囊化的花色苷由于壁材的保护作用未直接暴露于光照而更加稳定, 进一步表明基于内源乳化法的微胶囊化包埋花色苷具有可行性。
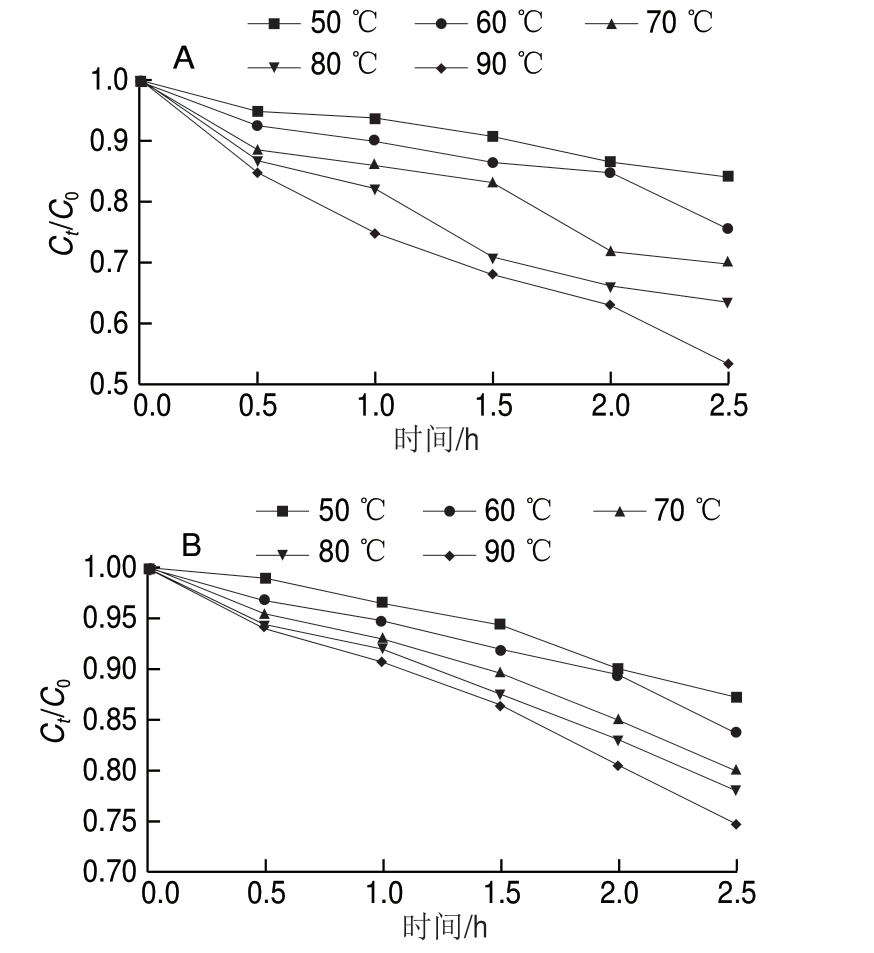
2.6 温度对花色苷微胶囊稳定性影响
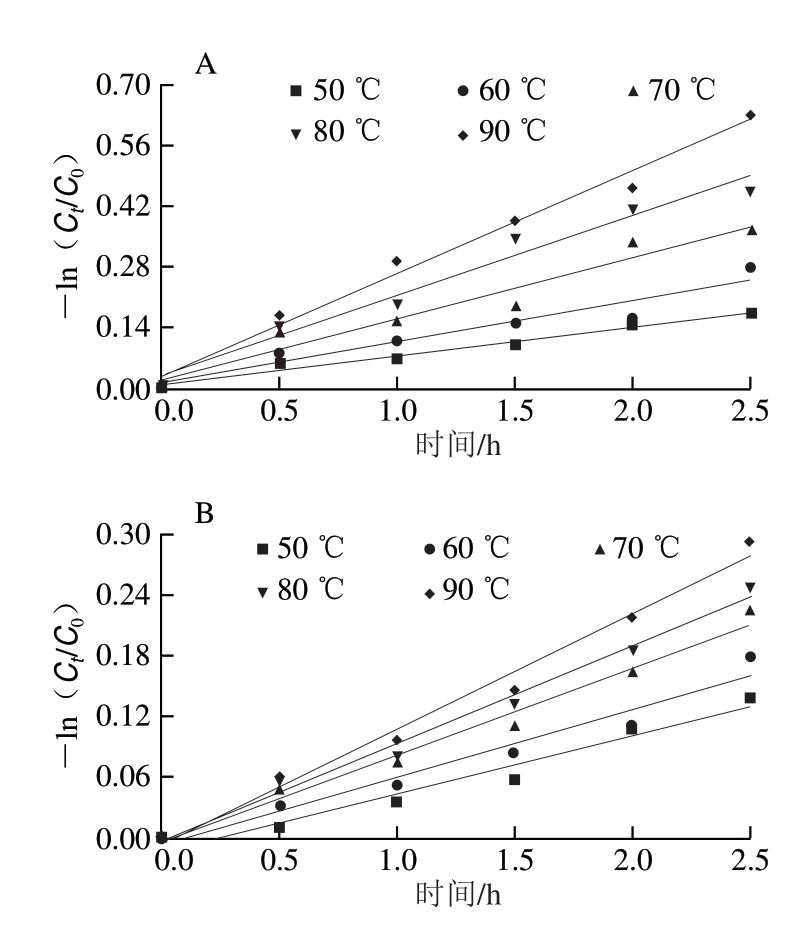
由图9可知,花色苷和花色苷微胶囊在高温下均发生了不同程度的热降解。由图9A可知,高温加热1 h,花色苷保存率急速降低;90 ℃加热2.5 h,其保存率仅为53.3%。由图9B可知,高温加热1.5 h花色苷微胶囊保存率逐渐降低;90 ℃加热2.5 h,其保存率为74.7%。由 可知,随着加热时间和温度的增加,相较于微胶囊化花色苷,花色苷的热降解更加显著,即高温状态微胶囊化的花色苷的热稳定性更高[3],可能是微胶囊化的花色苷受海藻酸钠壁材的保护其结构未被直接破坏。现有研究表明,升高温度能加快降解花色苷[27-28],因
可知,随着加热时间和温度的增加,相较于微胶囊化花色苷,花色苷的热降解更加显著,即高温状态微胶囊化的花色苷的热稳定性更高[3],可能是微胶囊化的花色苷受海藻酸钠壁材的保护其结构未被直接破坏。现有研究表明,升高温度能加快降解花色苷[27-28],因 在贮存花色苷及其微胶囊化
在贮存花色苷及其微胶囊化 品时应避免高温。
品时应避免高温。
以加热时间为横坐标, ln(Ct/C0)为纵坐标回归拟合直线如图10所示,通过线性回归分析,可以得知
ln(Ct/C0)为纵坐标回归拟合直线如图10所示,通过线性回归分析,可以得知  ln(Ct/C0)与时间呈良好的线性关系,花色苷和花色苷微胶囊的光照降解动力学均符合一级动力学反应,其降解动力学参数如表3所示。
ln(Ct/C0)与时间呈良好的线性关系,花色苷和花色苷微胶囊的光照降解动力学均符合一级动力学反应,其降解动力学参数如表3所示。
表 3 花色苷、花色苷微胶囊的热降解动力学参数
Table 3 Thermal degradation kinetic parameters of free anthocyanins amd anthocyanin microcapsules
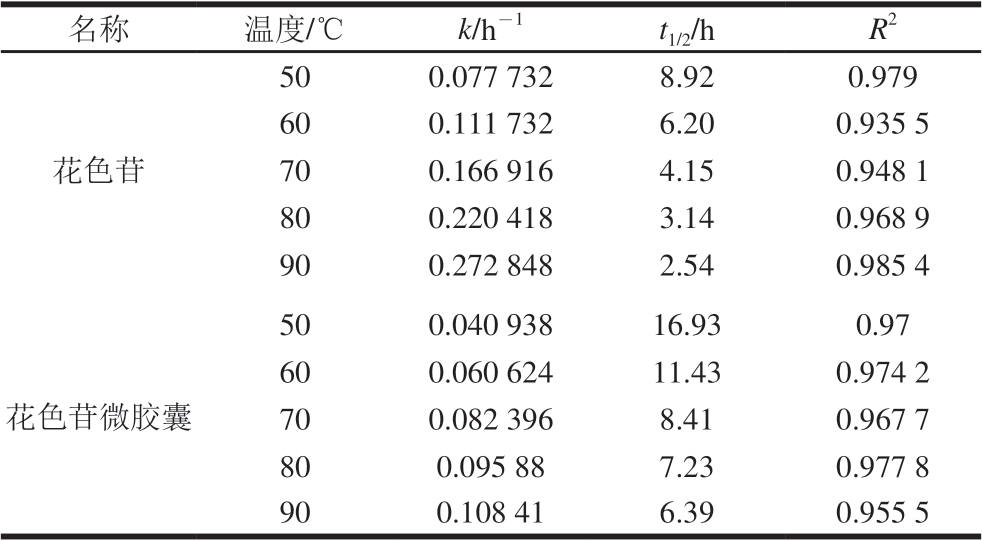
名称 温度/℃ k/h-1 t1/2/h R2花色苷50 0.077 732 8.92 0.979 60 0.111 732 6.20 0.935 5 70 0.166 916 4.15 0.948 1 80 0.220 418 3.14 0.968 9 90 0.272 848 2.54 0.985 4花色苷微胶囊50 0.040 938 16.93 0.97 60 0.060 624 11.43 0.974 2 70 0.082 396 8.41 0.967 7 80 0.095 88 7.23 0.977 8 90 0.108 41 6.39 0.955 5
随温度的升高,花色苷和花色苷微胶囊的一级反应速率常数k均增大,而半衰期均减小,表明花色苷及花色苷微胶囊在高温状态下热稳定性下降且热降解速率快;在相同温度条件下,花色苷微胶囊的热降解速率常数k(0.040 938)比花色苷k(0.077 732)小,而半衰期(16.93 h)比花色苷的半衰期(8.92 h)大,说明微胶囊化的花色苷在高温状态下比花色苷更稳定,同时体现出基于内源乳化法的微胶囊化包埋花色苷的有效性。
2.7 花色苷微胶囊在模拟人 肠消化环境中的稳定性
肠消化环境中的稳定性
由图11可知,花色苷、花色苷微胶囊经过人工模拟 液的消化后,均发生了不同程度的降解。经过2 h
液的消化后,均发生了不同程度的降解。经过2 h 液消化后,花色苷和花色苷微胶囊的保存率分别为45.3%、83.7%,在人工模拟
液消化后,花色苷和花色苷微胶囊的保存率分别为45.3%、83.7%,在人工模拟 液的酸性条件下,壁材结构稳定能更好的保护芯材,故微胶囊化的花色苷稳定性更高,有更好的缓释效果[29]。有文献记载,微胶囊可以修饰
液的酸性条件下,壁材结构稳定能更好的保护芯材,故微胶囊化的花色苷稳定性更高,有更好的缓释效果[29]。有文献记载,微胶囊可以修饰 品结构从而改变释放速率,所以花色苷微胶囊对酸性环境更具抗性,其保存率高于花色苷,并且有一半以上的花色苷能进入肠道环境[30-31]。同时有研究表明,可能没有任何结构能抑制花色苷在模拟
品结构从而改变释放速率,所以花色苷微胶囊对酸性环境更具抗性,其保存率高于花色苷,并且有一半以上的花色苷能进入肠道环境[30-31]。同时有研究表明,可能没有任何结构能抑制花色苷在模拟 环境下的早期释放,大概有23%~32%的花色苷能通过
环境下的早期释放,大概有23%~32%的花色苷能通过 腔吸收[32]。
腔吸收[32]。
表 4 经过人工模拟消化后花色苷、花色苷微胶囊的保存率
Table 4 Retention rates of free anthocyanins and anthocyanin microcapsules after artificial digestion

处理方式 保存率/%模拟images/BZ_293_1430_978_1455_1006.png消化pH 2.0 花色苷images/BZ_293_1848_978_1873_1006.png模拟images/BZ_293_1923_978_1948_1006.png液 45.3f 0.6 37 ℃、2 h 花色苷微胶囊images/BZ_293_1886_1024_1911_1052.png模拟images/BZ_293_1961_1024_1986_1052.png液 83.7f 2.7模拟肠消化pH 6.8 花色苷images/BZ_293_1773_1072_1798_1100.png消化上清液images/BZ_293_1923_1072_1948_1100.png模拟肠液 0.9f 0.1 37 ℃、4 h 花色苷微胶囊images/BZ_293_1811_1117_1836_1145.png消化上清液images/BZ_293_1961_1117_1986_1145.png模拟肠液 24.4f 1.3
根据现有文献可知,模拟 消化时间一般采取2 h,也可进行0.5~1 h或长达5 h[33]。由表4可知,当
消化时间一般采取2 h,也可进行0.5~1 h或长达5 h[33]。由表4可知,当 品经过
品经过 消化2 h后,
消化2 h后, 品的保存率趋于稳定,因
品的保存率趋于稳定,因 以
以 消化2 h后的去酶
消化2 h后的去酶 品作为模拟肠消化的初始
品作为模拟肠消化的初始 品,经过4 h人工模拟肠道消化,
品,经过4 h人工模拟肠道消化, 时人工模拟肠液pH 6.8。由图12可知,花色苷和花色苷微胶囊在人工模拟肠道环境中发生显著降解,2 h
时人工模拟肠液pH 6.8。由图12可知,花色苷和花色苷微胶囊在人工模拟肠道环境中发生显著降解,2 h 消化和4 h肠消化后,花色苷和花色苷微胶囊的保存率分别为0.9%、24.4%,说明微胶囊化对花色苷有较好的控释性能,可抑制花色苷的降解[33],随着消化时间的延长,花色苷的释放率明显增加,这是由于海藻酸钠中—OH的成膜受pH值影响,导致壁材变薄保护性涂层被破坏,微粒被降解最终芯材从受肠道环境刺激的壁材中不断流出[25]。
消化和4 h肠消化后,花色苷和花色苷微胶囊的保存率分别为0.9%、24.4%,说明微胶囊化对花色苷有较好的控释性能,可抑制花色苷的降解[33],随着消化时间的延长,花色苷的释放率明显增加,这是由于海藻酸钠中—OH的成膜受pH值影响,导致壁材变薄保护性涂层被破坏,微粒被降解最终芯材从受肠道环境刺激的壁材中不断流出[25]。
通过分析上述实验可知,花色苷及微胶囊化的花色苷在 环境(pH 2.0)中稳定性较强,保存率较高;由于肠液呈弱酸偏碱性(pH 6.8),花色苷及微胶囊化的花色苷的结构发生变化,而
环境(pH 2.0)中稳定性较强,保存率较高;由于肠液呈弱酸偏碱性(pH 6.8),花色苷及微胶囊化的花色苷的结构发生变化,而 液和肠液中的其他物质如
液和肠液中的其他物质如 蛋白酶和胰蛋白酶等对花色苷的稳定性影响不大。实验结果表明,在人工模拟
蛋白酶和胰蛋白酶等对花色苷的稳定性影响不大。实验结果表明,在人工模拟 、肠液中花色苷微胶囊的稳定性均高于花色苷。
、肠液中花色苷微胶囊的稳定性均高于花色苷。
通过比较花色苷微胶囊化前后的光照、温度和人工模拟 肠液的稳定性,微胶囊化的花色苷的稳定性明显优于花色苷。基于内源乳化法,以海藻酸钠为壁材的保护作用,再结合喷雾干燥微胶囊呈粉末状、质地细腻、流动性好、结构致密的优良特性,在一定程度上隔绝了花色苷与外界环境的接触,延缓了花色苷的释放时 间[34-35]。在实际生产过程中,喷雾干燥可以连续进料、生产效率高且节约成本,适合大规模的连续化生产[36]。
肠液的稳定性,微胶囊化的花色苷的稳定性明显优于花色苷。基于内源乳化法,以海藻酸钠为壁材的保护作用,再结合喷雾干燥微胶囊呈粉末状、质地细腻、流动性好、结构致密的优良特性,在一定程度上隔绝了花色苷与外界环境的接触,延缓了花色苷的释放时 间[34-35]。在实际生产过程中,喷雾干燥可以连续进料、生产效率高且节约成本,适合大规模的连续化生产[36]。
3 结 论
本实验以海藻酸钠为壁材,采用内源乳化法制备湿态花色苷微胶囊,再考察喷雾干燥工艺对微胶囊化湿态花色苷的影响,通过单因 、正交试验获得喷雾干燥花色苷微胶囊的最佳工艺参数为加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa,花色苷微胶囊的平均粒径为558.2 nm,包埋率为75.12%。
、正交试验获得喷雾干燥花色苷微胶囊的最佳工艺参数为加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa,花色苷微胶囊的平均粒径为558.2 nm,包埋率为75.12%。
研究结果表明,微胶囊化前后花色苷的光降解稳定性均符合一级反应动力学方程,在避光条件下较光照条件下的保存率更高;且花色苷微胶囊稳定性在光照和避光贮藏条件下均高于花色苷。微胶囊化前后花色苷的热降解稳定性也符合一级反应动力学方程,其保存率均随温度升高而降低,但花色苷微胶囊的温度稳定性高于花色苷。在人工模拟 肠液中花色苷微胶囊的稳定性均高于花色苷。综上可知,内源乳化法结合喷雾干燥法制备花色苷微胶囊可有效提高花色苷的光照、温度、
肠液中花色苷微胶囊的稳定性均高于花色苷。综上可知,内源乳化法结合喷雾干燥法制备花色苷微胶囊可有效提高花色苷的光照、温度、 肠消化稳定性。
肠消化稳定性。
参考文献:
[1] DI MAJO D, LA GUARDIA M, GIAMMANCO S, et al. The antioxidant capacity of red wine in relationship with its polyphenolic constituents[J]. Food Chemistry, 2008, 111(1): 45-49. DOI:10.1016/j.foodchem.2008.03.037.
[2] FAN G J, HAN Y B, GU Z X, et al. Composition and colour stability of anthocyanins extracted from fermented purple sweet potato culture[J]. LWT-Food Science and Technology, 2008, 41(8): 1412-1416. DOI:10.1016/j.lwt.2007.09.003.
[3] 韩爱芝, 蒋卉, 贾清华, 等. 响应面试验优化黑果枸杞花色苷微胶囊制备工艺及其稳定性分析[J]. 食品科学, 2016, 37(10): 82-87. DOI:10.7506/spkx1002-6630-201610014.
[4] GHARSALLAOUI A, ROUDAUT G, CHAMBIN O, et al. Applications of spray-drying in microencapsulation of food ingredients: an overview[J]. Food Research International, 2007, 40(9): 1107-1121. DOI:10.1016/j.foodres.2007.07.004.
[5] PAUDEL A, WORKU Z A, MEEUS J, et al. Manufacturing of solid dispersions of poorly water soluble drugs by spray drying: formulation and process considerations[J]. International Journal of Pharmaceutics, 2013, 453(1): 253-284. DOI:10.1016/j.ijpharm.2012.07.015.
[6] TONON R V, CRF G, HUBINGER M D. Influence of emulsion composition and inlet air temperature on the microencapsulation of flaxseed oil by spray drying[J]. Food Research International, 2011, 44(1): 282-289. DOI:10.1016/j.foodres.2010.10.018.
[7] MEDINA-TORRES L, SANTIAGO-ADAME R, CALDERAS F, et al. Microencapsulation by spray drying of laurel infusions (Litsea glaucescens) with maltodextrin[J]. Industrial Crops & Products, 2016, 90: 1-8. DOI:10.1016/j.indcrop.2016.06.009.
[8] 赵萌, 蔡沙, 屈方宁, 等. 内源乳化法制备海藻酸盐微胶囊的研究进展[J]. 食品工业科技, 2013, 34(22): 392-396.
[9] 王艳. 内源乳化凝胶法制备嗜热链球菌微胶囊及其性质的研究[D]. 青岛: 中国海洋大学, 2008: 10-11. DOI:10.7666/d.y1337175.
[10] 梁新晓, 贠婷婷, 田科雄, 等. 内源乳化凝胶化法制备海藻酸钙微胶珠的工艺优化[J]. 食品科学, 2014, 35(12): 35-40. DOI:10.7506/spkx1002-6630-201412007.
[11] 侯召华, 翟虎渠, 万建民, 等. 黑米花色苷的提取及纯化[J]. 食品 科学, 2010, 31(10): 53-59. DOI:10.7506/spkx1002-6630-201010011.
[12] 周永, 阿嘎, 赵国建, 等. 大孔树脂对红心萝卜花色苷的纯化[J]. 食品科学, 2011, 32(4): 21-24. DOI:10.7506/spkx1002-6630-201104005.
[13] LUPO B, MAESTRO A, PORRAS M, et al. Preparation of alginate microspheres by emulsification/internal gelation to encapsulate cocoa polyphenols[J]. Food Hydrocolloids, 2014, 38: 56-65. DOI:10.1016/j.foodhyd.2013.11.003.
[14] AHMED M M, ELRASOUL S A, AUDA S H, et al. Emulsification/internal gelation as a method for preparation of diclofenac sodiumsodium alginate microparticles[J]. Saudi Pharmaceutical Journal, 2013, 21(1): 61-69. DOI:10.1016/j.jsps.2011.08.004.
[15] 邹强, 梁华忠, 龚春雪, 等. 海藻酸钠和乳清蛋白作为益生菌包埋壁材的比较[J]. 食品科学, 2014, 35(15): 207-211. DOI:10.7506/spkx1002-6630-201415042.
[16] LEBRUNAD P, MANTANUS J, GROHGANZ H, et al. Design space approach in the optimization of the spray-drying process[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2012, 80(1): 226-234. DOI:10.1016/j.ejpb.2011.09.014.
[17] LOH S K, MAN Y, TAN C P, et al. Process optimisation of encapsulated pandan (Pandanus amaryllifolius) powder using spraydrying method[J]. Journal of the Science of Food & Agriculture, 2010, 85(12): 1999-2004. DOI:10.1002/jsfa.2169.
[18] TENORE G C, CAMPIGLIA P, GIANNETTI D, et al. Simulated gastrointestinal digestion, intestinal permeation and plasma protein interaction of white, green, and black tea polyphenols[J]. Food Chemistry, 2015, 169: 320-326. DOI:10.1016/j.foodchem.2014.08.006.
[19] 罗程印, 程远渡, 易有金, 等. 植物甾醇酯和葛根 复合微胶囊的制备工艺优化[J]. 食品科学, 2016, 37(6): 26-33. DOI:10.7506/spkx1002-6630-201606005.
复合微胶囊的制备工艺优化[J]. 食品科学, 2016, 37(6): 26-33. DOI:10.7506/spkx1002-6630-201606005.
[20] 涂宗财, 张璎, 王辉, 等. 不同干燥方式对玫瑰茄水提物成分及活性的影响[J]. 食品科学, 2013, 34(21): 47-50. DOI:10.7506/spkx1002-6630-201321010.
[21] RIGON R, CACIANO Z N. Microencapsulation by spray-drying of bioactive compounds extracted from blackberry (Rubus fruticosus)[J]. Journal of Food Science & Technology, 2016, 53(3): 1515-1524. DOI:10.1007/s13197-015-2111-x.
[22] SHEN Q, QUEK S Y. Microencapsulation of astaxanthin with blends of milk protein and fiber by spray drying[J]. Journal of Food Engineering, 2014, 123(2): 165-171. DOI:10.1016/j.jfoodeng.2013.09.002.
[23] ALAMILLA-BELTRAN L, CHANONA-PEREZ J J, JIMENEZAPARICIO A R, et al. Description of morphological changes of particles along spray drying[J]. Journal of Food Engineering, 2005, 67(1): 179-184. DOI:10.1016/j.jfoodeng.2004.05.063.
[24] 王宇滨, 张超, 马越, 等. 紫玉米花色苷微胶囊化工艺和性能 研究[J]. 食品科学, 2011, 32(8): 61-64. DOI:10.7506/spkx1002-6630-201108014.
[25] 孟宪军, 赵婧, 李斌. 正交试验优化树莓花色苷的微胶囊化 工艺[J]. 食品科学, 2013, 34(14): 173-177. DOI:10.7506/spkx1002-6630-201314035.
[26] 李颖畅, 吕春茂, 孟宪军, 等. 蓝莓花色苷的微胶囊化[J]. 食品与发酵工业, 2010(6): 71-75. DOI:10.13995/j.cnki.11-1802/ts.2010.06.004.
[27] JANNA O A, KHAIRUL A K, MAZIAH M. Anthocyanin stability studies in Tibouchina semidecandra L.[J]. Food Chemistry, 2007, 101(4): 1640-1646. DOI:10.1016/j.foodchem.2006.04.034.
[28] SANTOSA S S, RODRIGUESA L, COSTAB S C, et al. Microcapsules of blackberry pomace (Rubus fruticosus): light and temperature stability[J]. Chemical Engineering Transactions, 2017, 57: 1837-1842. DOI:10.3303/CET1757307.
[29] 邵信儒, 孙海涛, 姜瑞平, 等. 短梗五加果花色苷微球的制备及其缓释效果评价[J]. 食品科学, 2015, 36(22): 40-45. DOI:10.7506/spkx1002-6630-201522007.
[30] FLORES F P, SINGH R K, KERR W L, et al. In vitro release properties of encapsulated blueberry (Vaccinium ashei) extracts[J]. Food Chemistry, 2015, 168: 225-232. DOI:10.1016/j.foodchem.2014.07.059.
[31] RYU D, KOH E. Stability of anthocyanins in bokbunja (Rubus occidentalis L.) under in vitro gastrointestinal digestion[J]. Food Chemistry, 2018, 267(30): 157-162. DOI:10.1016/j.foodchem.2018.02.109.
[32] FLORES F P, SINGH R K, KONG F. Anthocyanin extraction, microencapsulation, and release properties during in vitro digestion[J]. Food Reviews International, 2016, 32(1): 46-67. DOI:10.1080/875591 29.2015.1041185.
[33] GHOTBI M, ZENOOZIAN M S, ROOZBEHNASIRAII L. Survival of free and microencapsulated Lb. rhamnosus LC705 in simulated gastric and intestinal juice[J]. International Journal of Biosciences, 2015, 6(3): 330-337. DOI:10.12692/ijb/6.3.330-337.
[34] 陈琳, 李荣, 姜子涛, 等. 微胶囊化方法对紫苏油包埋性能的比较 研究[J]. 食品工业科技, 2013, 34(20): 176-180.
[35] 宋宏新, 李宏, 刘晓阳. 番茄喷雾干燥及真空冷冻干燥制粉工艺研究[J]. 食品科学, 2007, 28(5): 100-103. DOI:10.3321/j.issn:1002-6630.2007.05.021.
[36] 文连奎, 冯永巍, 郭平, 等. 喷雾干燥与冷冻干燥玉米肽工艺的比较研究[J]. 食品科学, 2009, 30(20): 231-233. DOI:10.7506/spkx1002-6300-200920048.
 肠消化稳定性。花色苷微胶囊喷雾干燥的最佳工艺条件为加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa,包埋率为75.12%,平均粒径为558.2 nm。光照5 h,花色苷和花色苷微胶囊保存率分别为63.7%、82.1%;避光5 h,花色苷和花色苷微胶囊保存率分别为78.6%、91.4%;90 ℃条件下,花色苷和花色苷微胶囊半衰期分别为2.54、6.39 h;2 h
肠消化稳定性。花色苷微胶囊喷雾干燥的最佳工艺条件为加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa,包埋率为75.12%,平均粒径为558.2 nm。光照5 h,花色苷和花色苷微胶囊保存率分别为63.7%、82.1%;避光5 h,花色苷和花色苷微胶囊保存率分别为78.6%、91.4%;90 ℃条件下,花色苷和花色苷微胶囊半衰期分别为2.54、6.39 h;2 h 消化,花色苷和花色苷微胶囊保存率分别为45.3%、83.7%;4 h肠消化,花色苷和花色苷微胶囊保存率分别为0.9%、24.4%。研究结果表明内源乳化法结合喷雾干燥制备的花色苷微胶囊的光照、温度以及
消化,花色苷和花色苷微胶囊保存率分别为45.3%、83.7%;4 h肠消化,花色苷和花色苷微胶囊保存率分别为0.9%、24.4%。研究结果表明内源乳化法结合喷雾干燥制备的花色苷微胶囊的光照、温度以及 肠消化稳定性均高于花色苷。
肠消化稳定性均高于花色苷。  影响导致其稳定性较差,因
影响导致其稳定性较差,因 采用胶囊化技术提高花色苷的稳定性,扩展适用范围
采用胶囊化技术提高花色苷的稳定性,扩展适用范围 法工艺简单、成本较低,适用于对温度敏感的活性物质
法工艺简单、成本较低,适用于对温度敏感的活性物质 的解离,促使Ca
的解离,促使Ca 在乳液液滴内部与海藻酸钠作用生成海藻酸钙凝胶珠。内源乳化法采用无毒试剂,因而可应用于生物、食品、医药等行业中包埋生物 活性物质
在乳液液滴内部与海藻酸钠作用生成海藻酸钙凝胶珠。内源乳化法采用无毒试剂,因而可应用于生物、食品、医药等行业中包埋生物 活性物质 肠消化稳定性的影响,旨在为提高花色苷类功能性食品的稳定性研究开发提供理论依据。
肠消化稳定性的影响,旨在为提高花色苷类功能性食品的稳定性研究开发提供理论依据。 提取物(色价32.27) 云南通海杨氏天然产物有限公司;海藻酸钠 青岛明月海藻集团有限公司;纳米级碳酸钠(分析纯) 哈尔冰萨默斯生物科技有限公司;无水乙醇、Span80、冰醋酸、柠檬酸等试剂(均为分析纯)、
提取物(色价32.27) 云南通海杨氏天然产物有限公司;海藻酸钠 青岛明月海藻集团有限公司;纳米级碳酸钠(分析纯) 哈尔冰萨默斯生物科技有限公司;无水乙醇、Span80、冰醋酸、柠檬酸等试剂(均为分析纯)、 蛋白酶、胰蛋白酶、猪胆盐(均为生化级) 国药集团化学试剂有限公司;DPPH(分析级) Sigma中国有限公司。
蛋白酶、胰蛋白酶、猪胆盐(均为生化级) 国药集团化学试剂有限公司;DPPH(分析级) Sigma中国有限公司。 LV
LV 溶于1 L纯水,过滤除杂,AB-8柱对花色苷纯化,并用酸性乙醇洗脱后浓缩冻干备用,测定花色苷的含量。其中上
溶于1 L纯水,过滤除杂,AB-8柱对花色苷纯化,并用酸性乙醇洗脱后浓缩冻干备用,测定花色苷的含量。其中上 流速为1.5 mL/min,上
流速为1.5 mL/min,上 液质量浓度为3.0 mg/mL,洗脱流速为1.0 mL/min,洗脱液为体积分数80%酸性乙醇。
液质量浓度为3.0 mg/mL,洗脱流速为1.0 mL/min,洗脱液为体积分数80%酸性乙醇。 中总花色苷的含量。将1 mg冻干后的花色苷纯化物溶于蒸馏水,配制成1 mg/mL的花色苷溶液,分别用氯化钾-盐酸缓冲液(0.025 mol/L, pH 1.0)和醋酸钠缓冲液(0.4 mol/L,pH 4.5)稀释10 倍,稀释液室温避光平衡15 min后,以蒸馏水做空白对照,分别测定两种
中总花色苷的含量。将1 mg冻干后的花色苷纯化物溶于蒸馏水,配制成1 mg/mL的花色苷溶液,分别用氯化钾-盐酸缓冲液(0.025 mol/L, pH 1.0)和醋酸钠缓冲液(0.4 mol/L,pH 4.5)稀释10 倍,稀释液室温避光平衡15 min后,以蒸馏水做空白对照,分别测定两种 品稀释液在λ
品稀释液在λ :
: -3-葡萄糖苷(cyanidin-3-glucoside,cy-3-glu)表示,按下式计
-3-葡萄糖苷(cyanidin-3-glucoside,cy-3-glu)表示,按下式计 :
: 对微胶囊化的影响,根据单因
对微胶囊化的影响,根据单因 品固定于载玻片上,用离子溅射仪镀一层金膜后在SEM下观察微胶囊的微观形态。
品固定于载玻片上,用离子溅射仪镀一层金膜后在SEM下观察微胶囊的微观形态。 分析
分析 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
 吸收特性可以分别测定包埋前后分离液的吸光度,按下式计
吸收特性可以分别测定包埋前后分离液的吸光度,按下式计 包埋率:
包埋率:

 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。 钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。 测定其在2.5 h内吸光度变化。按式(4)计
测定其在2.5 h内吸光度变化。按式(4)计 花色苷温度降解半衰期。
花色苷温度降解半衰期。 肠消化环境中的稳定性
肠消化环境中的稳定性 消化
消化 蛋白酶溶于8 mL 0.1 mol/L HCl溶液,配制成
蛋白酶溶于8 mL 0.1 mol/L HCl溶液,配制成 蛋白酶溶液
蛋白酶溶液 液。取25 mL花色苷
液。取25 mL花色苷 液并调节pH值至2.0,加入0.5 mL
液并调节pH值至2.0,加入0.5 mL 蛋白酶溶液,置于37 ℃水浴振荡,转速为100 r/min,测定0、0.5、1、1.5、2 h模拟
蛋白酶溶液,置于37 ℃水浴振荡,转速为100 r/min,测定0、0.5、1、1.5、2 h模拟 品吸光度的变化。反应期间,密封避光保存防止花色苷降解。
品吸光度的变化。反应期间,密封避光保存防止花色苷降解。 消化
消化 品于
品于 4 ℃放置2 h,于3 000 r/min离心15 min去除
4 ℃放置2 h,于3 000 r/min离心15 min去除 试验结果
试验结果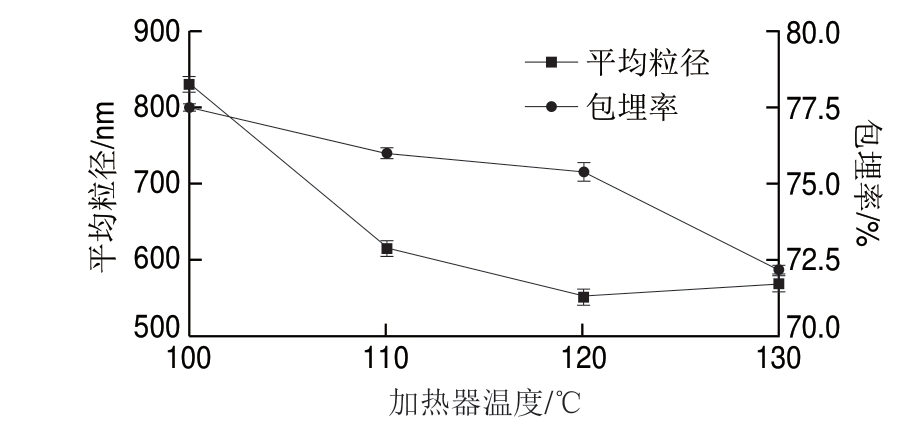
 时进出料口温度分别为70.2、64.8 ℃,
时进出料口温度分别为70.2、64.8 ℃, 后平均粒径随加热器温度的上升而增大,可能是加热器温度过低时进出料口温度过低,微胶囊化时间长,溶剂蒸发速度慢,流动性差,且易回潮,导致微胶囊颗粒聚集大小不均一,粒径分布较为广泛,加热器温度过高时溶剂蒸发速度太快,囊壁破碎从而影响花色苷微胶囊的稳定性及生物活性
后平均粒径随加热器温度的上升而增大,可能是加热器温度过低时进出料口温度过低,微胶囊化时间长,溶剂蒸发速度慢,流动性差,且易回潮,导致微胶囊颗粒聚集大小不均一,粒径分布较为广泛,加热器温度过高时溶剂蒸发速度太快,囊壁破碎从而影响花色苷微胶囊的稳定性及生物活性 确定喷雾干燥法制备花色苷微胶囊的最佳加热器温度为120 ℃。
确定喷雾干燥法制备花色苷微胶囊的最佳加热器温度为120 ℃。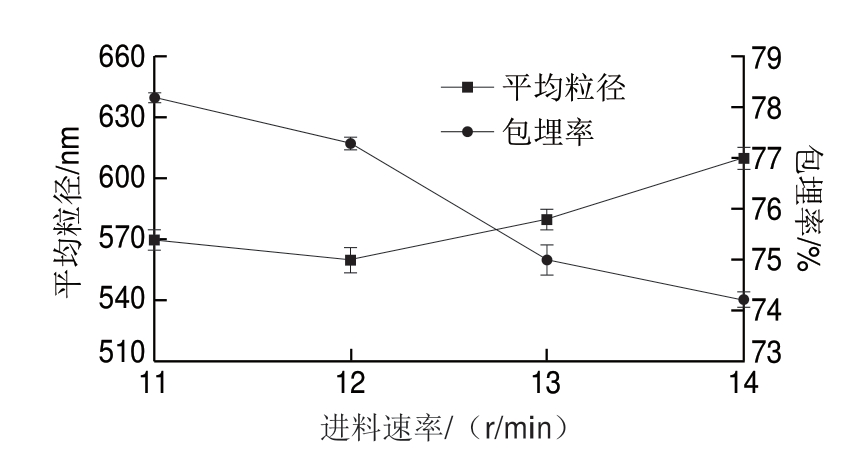
 品流量过大,较多
品流量过大,较多 品未能充分干燥导致微胶囊颗粒发生聚集,从而影响花色苷微胶囊的粒径大小。因
品未能充分干燥导致微胶囊颗粒发生聚集,从而影响花色苷微胶囊的粒径大小。因 确定喷雾干燥法制备花色苷微胶囊的最佳进料速率为12 r/min。
确定喷雾干燥法制备花色苷微胶囊的最佳进料速率为12 r/min。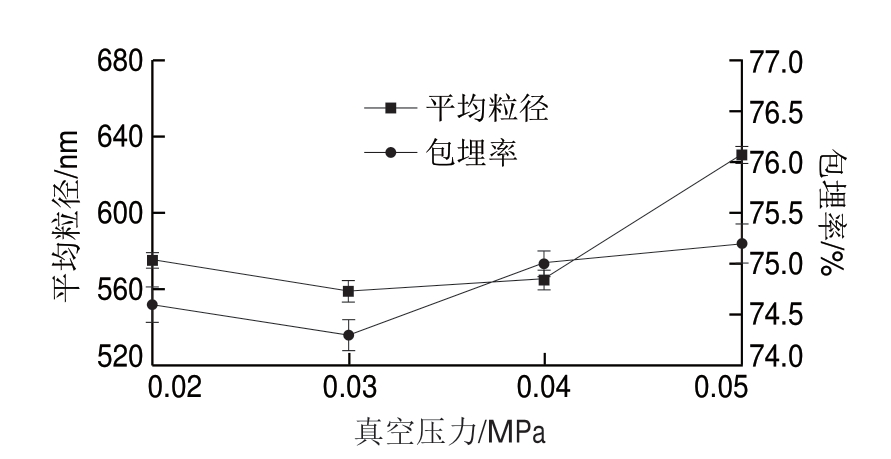
 确定喷雾干燥法制备花色苷微胶囊的最佳真空压力为0.03 MPa。
确定喷雾干燥法制备花色苷微胶囊的最佳真空压力为0.03 MPa。 的主次顺序为加热器温度>进料速率>真空压力。最优方案为A
的主次顺序为加热器温度>进料速率>真空压力。最优方案为A

 品的水分含量、操作温度、进料速率有关
品的水分含量、操作温度、进料速率有关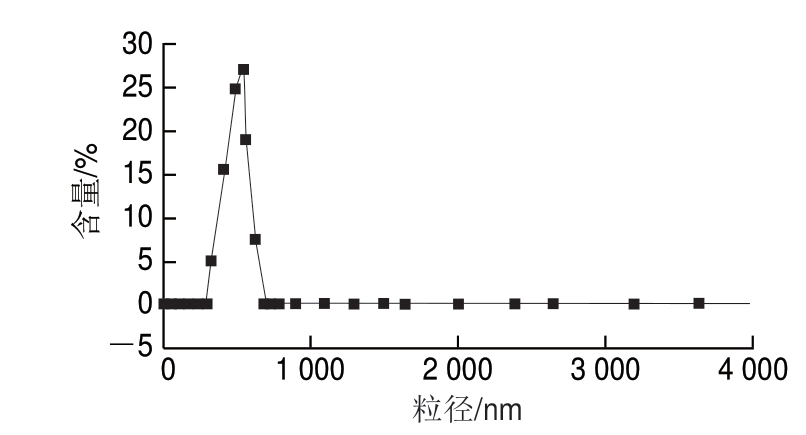
 特征
特征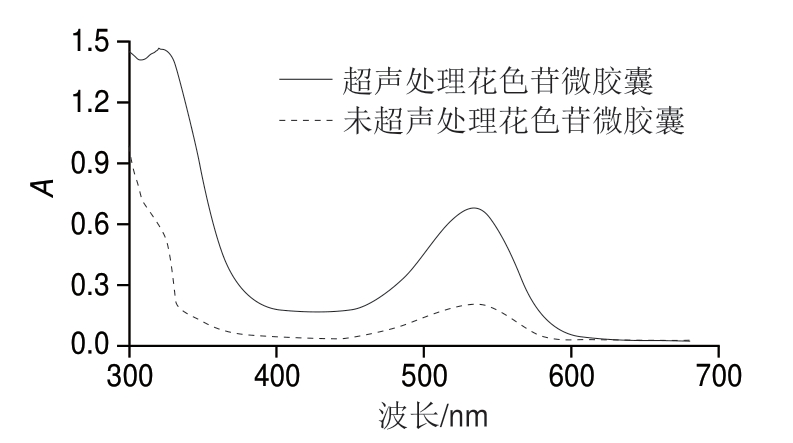
 品在542 nm波长处有最大的光
品在542 nm波长处有最大的光 吸收
吸收 ,在花色苷最大吸收区域465~550 nm波长范围内符合花色苷的可见光吸收特性,
,在花色苷最大吸收区域465~550 nm波长范围内符合花色苷的可见光吸收特性, ,可能是在制备微胶囊过程中花色苷残留在胶囊表面。结合花色苷微胶囊的形态观察及粒径结果表明,基于内源乳化法的微胶囊化包埋花色苷是一种技术可行且有效的方法。
,可能是在制备微胶囊过程中花色苷残留在胶囊表面。结合花色苷微胶囊的形态观察及粒径结果表明,基于内源乳化法的微胶囊化包埋花色苷是一种技术可行且有效的方法。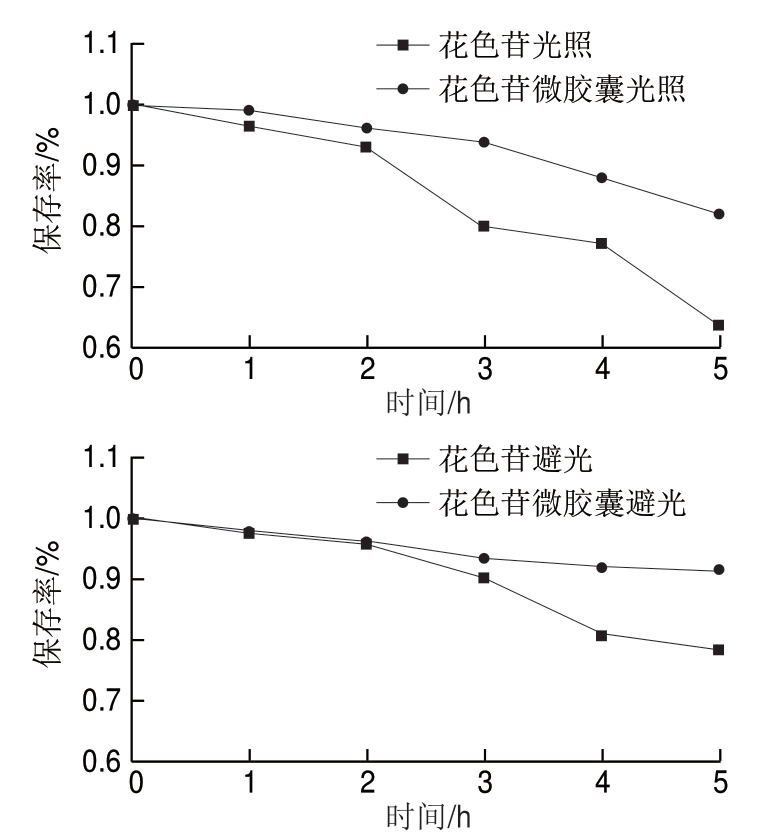
 ln(C
ln(C ln(C
ln(C
 可知,随着加热时间和温度的增加,相较于微胶囊化花色苷,花色苷的热降解更加显著,即高温状态微胶囊化的花色苷的热稳定性更高
可知,随着加热时间和温度的增加,相较于微胶囊化花色苷,花色苷的热降解更加显著,即高温状态微胶囊化的花色苷的热稳定性更高 在贮存花色苷及其微胶囊化
在贮存花色苷及其微胶囊化 品时应避免高温。
品时应避免高温。 ln(C
ln(C
 肠消化环境中的稳定性
肠消化环境中的稳定性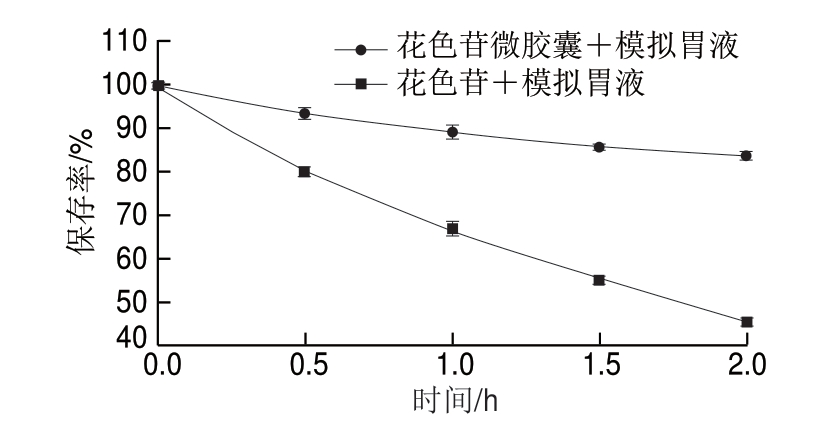
 液的酸性条件下,壁材结构稳定能更好的保护芯材,故微胶囊化的花色苷稳定性更高,有更好的缓释效果
液的酸性条件下,壁材结构稳定能更好的保护芯材,故微胶囊化的花色苷稳定性更高,有更好的缓释效果 环境下的早期释放,大概有23%~32%的花色苷能通过
环境下的早期释放,大概有23%~32%的花色苷能通过 腔吸收
腔吸收

 消化时间一般采取2 h,也可进行0.5~1 h或长达5 h
消化时间一般采取2 h,也可进行0.5~1 h或长达5 h 品经过
品经过 品作为模拟肠消化的初始
品作为模拟肠消化的初始 消化和4 h肠消化后,花色苷和花色苷微胶囊的保存率分别为0.9%、24.4%,说明微胶囊化对花色苷有较好的控释性能,可抑制花色苷的降解
消化和4 h肠消化后,花色苷和花色苷微胶囊的保存率分别为0.9%、24.4%,说明微胶囊化对花色苷有较好的控释性能,可抑制花色苷的降解 、正交试验获得喷雾干燥花色苷微胶囊的最佳工艺参数为加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa,花色苷微胶囊的平均粒径为558.2 nm,包埋率为75.12%。
、正交试验获得喷雾干燥花色苷微胶囊的最佳工艺参数为加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa,花色苷微胶囊的平均粒径为558.2 nm,包埋率为75.12%。 肠液中花色苷微胶囊的稳定性均高于花色苷。综上可知,内源乳化法结合喷雾干燥法制备花色苷微胶囊可有效提高花色苷的光照、温度、
肠液中花色苷微胶囊的稳定性均高于花色苷。综上可知,内源乳化法结合喷雾干燥法制备花色苷微胶囊可有效提高花色苷的光照、温度、 复合微胶囊的制备工艺优化[J]. 食品科学, 2016, 37(6): 26-33. DOI:10.7506/spkx1002-6630-201606005.
复合微胶囊的制备工艺优化[J]. 食品科学, 2016, 37(6): 26-33. DOI:10.7506/spkx1002-6630-201606005.