 制对玉米粉中玉米黄
制对玉米粉中玉米黄 含量的影响展开实验,以玉米粉为原料进行不同
含量的影响展开实验,以玉米粉为原料进行不同 制条件的热处理,以玉米黄
制条件的热处理,以玉米黄 含量为指标,通过单因
含量为指标,通过单因 试验,探究
试验,探究 制温度、
制温度、 制时间、加水量在
制时间、加水量在 制过程中对玉米黄
制过程中对玉米黄 含量的影响,利用响应面法对影响玉米黄
含量的影响,利用响应面法对影响玉米黄 含量的3 个因
含量的3 个因 进行优化。
进行优化。 制优化条件为
制优化条件为 制温度190 ℃、
制温度190 ℃、 制时间30 min、加水量75%。在
制时间30 min、加水量75%。在 条件下,做3 次平行实验进行验证,
条件下,做3 次平行实验进行验证, 时玉米粉中玉米黄
时玉米粉中玉米黄 含量为306.79 μg/100 g。
含量为306.79 μg/100 g。玉米黄 又名玉米黄质,分子式为C4 0H5 6O2,相对分子质量为568.88,其分子结构如图1所示。玉米黄
又名玉米黄质,分子式为C4 0H5 6O2,相对分子质量为568.88,其分子结构如图1所示。玉米黄 是
是 羟基化的类胡萝卜
羟基化的类胡萝卜 ,玉米黄
,玉米黄 与叶黄
与叶黄 为同分异构体,两者的区别是紫罗酮环的类型不一
为同分异构体,两者的区别是紫罗酮环的类型不一 ;玉米黄
;玉米黄 有两个β-紫罗酮环,而叶黄
有两个β-紫罗酮环,而叶黄 含有一个β-紫罗酮环和一个ε-紫罗酮环[1]。玉米黄
含有一个β-紫罗酮环和一个ε-紫罗酮环[1]。玉米黄 是存在于植物、藻类、光和细菌代谢产物中的天然色
是存在于植物、藻类、光和细菌代谢产物中的天然色 。
。

图 1 玉米黄素的化学结构
Fig. 1 Chemical structure of zeaxanthin
玉米黄 分子中的共轭多烯官能团和尾端有羟基官能团决定了光吸收、光捕获性质及抗氧化能力,可以保护生物系统免受一些因过量氧化或反应所产生的潜在危害。研究表明[2-9]玉米黄
分子中的共轭多烯官能团和尾端有羟基官能团决定了光吸收、光捕获性质及抗氧化能力,可以保护生物系统免受一些因过量氧化或反应所产生的潜在危害。研究表明[2-9]玉米黄 具有保护视力、预防老年黄斑变性和白内障、预防癌症发生、增强机体免疫力、预防潜在心脑血管疾病、对炎性反应和氧化应激反应具有保护作用、对糖尿病大鼠的视网膜氧化损伤和生长具有保护作用;一项离体研究中证明叶黄
具有保护视力、预防老年黄斑变性和白内障、预防癌症发生、增强机体免疫力、预防潜在心脑血管疾病、对炎性反应和氧化应激反应具有保护作用、对糖尿病大鼠的视网膜氧化损伤和生长具有保护作用;一项离体研究中证明叶黄 能够对冠心病患者产生抗炎作用[10]。玉米黄
能够对冠心病患者产生抗炎作用[10]。玉米黄 在食品领域主要应用作天然食品着色剂和保健食品添加剂等[11],研究玉米黄
在食品领域主要应用作天然食品着色剂和保健食品添加剂等[11],研究玉米黄 开发[12]与提取工艺优化[13]、不同热加工方式对食物中玉米黄
开发[12]与提取工艺优化[13]、不同热加工方式对食物中玉米黄 的影响[14]、生物利用率[15]、食品中玉米黄
的影响[14]、生物利用率[15]、食品中玉米黄 的营养强化[16]以及生物活性研究等成为研究热点及焦点。国内外研究发现[17-26]不同热处理方式或者光诱导均会不同程度使食物中玉米黄
的营养强化[16]以及生物活性研究等成为研究热点及焦点。国内外研究发现[17-26]不同热处理方式或者光诱导均会不同程度使食物中玉米黄 、叶黄
、叶黄 、β-胡萝卜
、β-胡萝卜 含量降低或者发生异构化和降解,而国内外还未见有关单一热处理方式不同条件下玉米黄
含量降低或者发生异构化和降解,而国内外还未见有关单一热处理方式不同条件下玉米黄 含量变化的研究。因
含量变化的研究。因 探讨
探讨 制热处理不同条件对玉米黄
制热处理不同条件对玉米黄 含量的影响,可为玉米粉工业化及日常烹调提供数据依据。
含量的影响,可为玉米粉工业化及日常烹调提供数据依据。
玉米粉 吉林省金米粒米业有限公司;无水乙醇 天津市富宇精细化工有限公司;甲醇(色 级)、玉米黄
级)、玉米黄 标准品 美国Sigma-Aldrich公司;甲基叔丁基醚 天津市光复精细化工研究所。
标准品 美国Sigma-Aldrich公司;甲基叔丁基醚 天津市光复精细化工研究所。
圆形模具4.5 cmh 4.5 cmh 1.7 cm 沃尔玛超市;CP214型电子天平 奥豪斯仪器(上海)有限公司;ATO-36A8型电 箱 北美电器(珠海)有限公司;GZX-9070MBE数显鼓风干燥箱 上海博讯实业有限公司医疗设备厂;FW-100型高速万能粉碎机 北京 市永光明医疗仪器有限公司;VCX800超声波细胞 破碎机 美国Sonics & Materials公司;超声波细胞破碎机隔音箱 宁波新芝生物科技股份有限公司;LD5-28离心机 北京雷勃尔离心机有限公司;5585氮吹仪 美国Organomation公司;ULTS5490低温冰箱 赛默飞世尔仪器有限公司;JK-3200B型超声波清洗器 合肥金尼克机械制造有限公司;Phenom Pro扫描电子显微镜 复纳科学仪器有限公司;1200型高效液相色
箱 北美电器(珠海)有限公司;GZX-9070MBE数显鼓风干燥箱 上海博讯实业有限公司医疗设备厂;FW-100型高速万能粉碎机 北京 市永光明医疗仪器有限公司;VCX800超声波细胞 破碎机 美国Sonics & Materials公司;超声波细胞破碎机隔音箱 宁波新芝生物科技股份有限公司;LD5-28离心机 北京雷勃尔离心机有限公司;5585氮吹仪 美国Organomation公司;ULTS5490低温冰箱 赛默飞世尔仪器有限公司;JK-3200B型超声波清洗器 合肥金尼克机械制造有限公司;Phenom Pro扫描电子显微镜 复纳科学仪器有限公司;1200型高效液相色 (high performance liquid chromatography,HPLC)仪、SB-C18保护柱(4.6 mmh 12.5 mm) 美国Agilent Technologies 公司;CT99S05-2546WT C30柱 YMC(台湾)股份有限公司。
(high performance liquid chromatography,HPLC)仪、SB-C18保护柱(4.6 mmh 12.5 mm) 美国Agilent Technologies 公司;CT99S05-2546WT C30柱 YMC(台湾)股份有限公司。
1.3.1 实验流程
玉米粉→加水和制成玉米面团→用模具压成均一的玉米饼→ 制热处理→干燥至质量恒定→无水乙醇玉米黄
制热处理→干燥至质量恒定→无水乙醇玉米黄 提取→氮吹仪→用色
提取→氮吹仪→用色 级甲醇溶出→过膜(0.22 μm)→HPLC检测分析。
级甲醇溶出→过膜(0.22 μm)→HPLC检测分析。
1.3.2 超声波辅助提取玉米黄
用电子天平精确称取4.00 g玉米粉,加入40 mL(料液比1∶10(g/mL))无水乙醇。在超声波功率12%(144 W)、作用温度45 ℃、作用时间3 s、间隔时间5 s、总时间50 min的条件下对玉米粉中的玉米黄 进行超声波辅助提取。
进行超声波辅助提取。
1.3.3 离心和氮吹仪除乙醇
将完成超声波辅助提取的 品倒入离心管内,3 000 r/min离心5 min,取澄清上清液用氮吹仪低温除乙醇。
品倒入离心管内,3 000 r/min离心5 min,取澄清上清液用氮吹仪低温除乙醇。
1.3.4 HPLC检测
加4 mL色 级甲醇于低温除乙醇的离心管中,反复摇晃使玉米黄
级甲醇于低温除乙醇的离心管中,反复摇晃使玉米黄 能够充分溶解于甲醇,放置于
能够充分溶解于甲醇,放置于 80 ℃冰箱避光保存待到检测时取出,过0.22 μm孔径滤膜,过膜注入色
80 ℃冰箱避光保存待到检测时取出,过0.22 μm孔径滤膜,过膜注入色 进
进 瓶中并将进
瓶中并将进 瓶放置于自动进
瓶放置于自动进 器内。
器内。
检测玉米黄 采用C30 HPLC法。色
采用C30 HPLC法。色 条件为流动相A为甲醇,流动相B为甲基叔丁基醚(methyl tertbutyl ether,MTBE),流动相甲醇-MTBE(86∶14, V/V),洗脱时间为20 min,流速为0.9 mL/min,进
条件为流动相A为甲醇,流动相B为甲基叔丁基醚(methyl tertbutyl ether,MTBE),流动相甲醇-MTBE(86∶14, V/V),洗脱时间为20 min,流速为0.9 mL/min,进 量为20 μL,柱温为30 ℃,检测波长为450 nm。以玉米黄
量为20 μL,柱温为30 ℃,检测波长为450 nm。以玉米黄 的质量浓度(μg/mL)为X,HPLC检测出的玉米黄
的质量浓度(μg/mL)为X,HPLC检测出的玉米黄 的
的 面积为Y绘制标准曲线:X=(Y-15.112)/195.18。
面积为Y绘制标准曲线:X=(Y-15.112)/195.18。
1.3.5 玉米粉 制的单因
制的单因 试验
试验
1.3.5.1  制温度的考察
制温度的考察
用电子天平精确称取100.00 g玉米粉,设定 制时间30 min、加水量75%,避光条件下分别在130、150、170、190、210 ℃对玉米饼进行
制时间30 min、加水量75%,避光条件下分别在130、150、170、190、210 ℃对玉米饼进行 制,进行3 次平行实验。
制,进行3 次平行实验。
1.3.5.2  制时间的考察
制时间的考察
用电子天平精确称取100.00 g玉米粉,设定 制温度190 ℃、加水量75%,避光条件下分别将玉米饼
制温度190 ℃、加水量75%,避光条件下分别将玉米饼 制20、25、30、35、40 min,进行3 次平行实验。
制20、25、30、35、40 min,进行3 次平行实验。
1.3.5.3 加水量的考察
用电子天平精确称取100.00 g玉米粉,设定 制温度190 ℃、
制温度190 ℃、 制时间30 min,避光条件下分别在加水量65%、70%、75%、80%、85%、90%时对玉米饼进行
制时间30 min,避光条件下分别在加水量65%、70%、75%、80%、85%、90%时对玉米饼进行 制,进行3 次平行实验。
制,进行3 次平行实验。
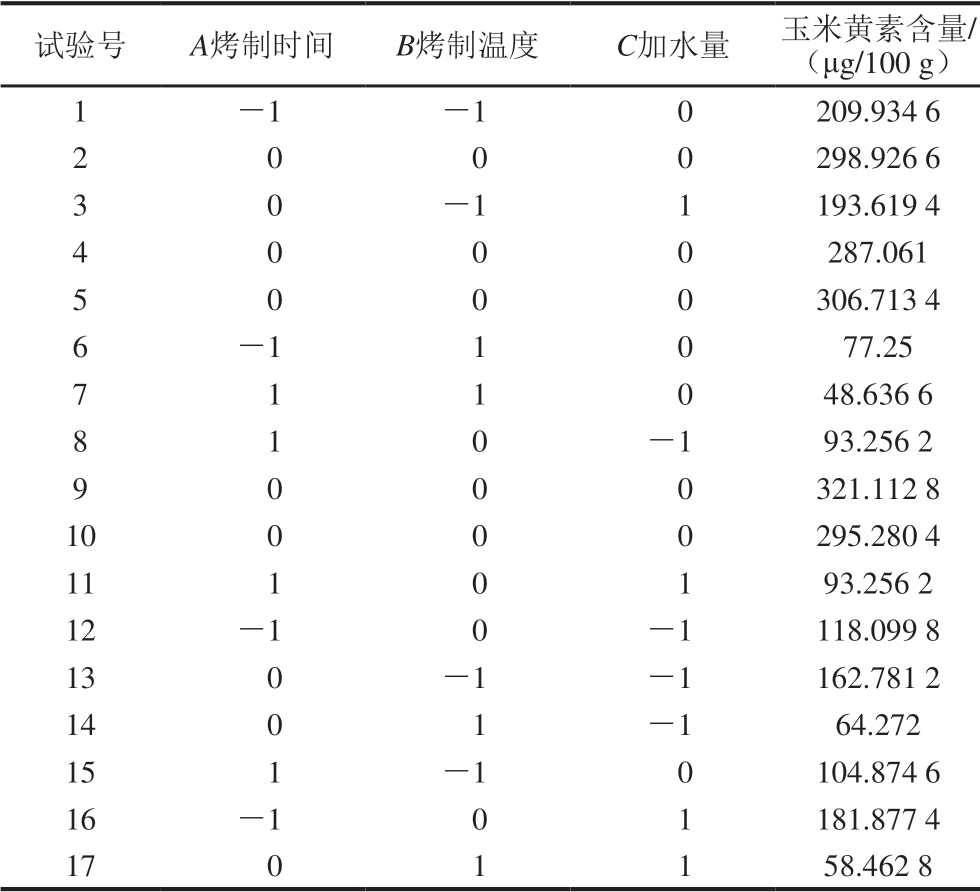
1.3.6 正交试验设计
在单因 试验的基础上,以
试验的基础上,以 制温度、
制温度、 制时间、料液比为因
制时间、料液比为因 设计响应面试验。因
设计响应面试验。因 与水平见表1。
与水平见表1。
表 1 响应面试验因素与水平
Table 1 Levels and codes of independent variables used for Box-Behnken design
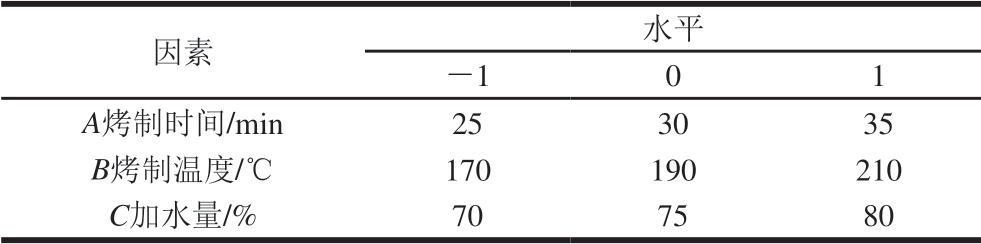
因images/BZ_306_418_773_449_804.png 水平images/BZ_306_679_796_711_827.png1 0 1 Aimages/BZ_306_336_844_368_875.png制时间/min 25 30 35 Bimages/BZ_306_345_890_376_921.png制温度/℃ 170 190 210 C加水量/% 70 75 80
 标准品及玉米粉
标准品及玉米粉 品提取液HPLC测定结果
品提取液HPLC测定结果
图 2 玉米黄素标准品(A)、玉米原粉提取液(B)、烤制后 玉米粉提取液(C)的HPLC图
Fig. 2 HPLC chromatograms of zeaxanthin standard (A), corn flour extract (B) and roasted corn flour extract (C)
由图2可以得出,玉米粉提取液中可检测物质种类较多,但各物质与玉米黄 可以清晰有效分离且
可以清晰有效分离且 形较好。说明该HPLC方法可以用于玉米黄
形较好。说明该HPLC方法可以用于玉米黄 检测并计
检测并计 其含量。
其含量。
 试验结果
试验结果2.2.1  制温度的单因
制温度的单因 试验结果
试验结果

图 3 烤制温度对玉米黄素含量的影响
Fig. 3 Effect of baking temperature on the content of zeaxanthin
由图3可知,当 制时间为30 min,加水量为75%时,玉米饼中玉米黄
制时间为30 min,加水量为75%时,玉米饼中玉米黄 的含量随着
的含量随着 制温度在一定范围内的升高而逐渐增加当温度达到190 ℃,玉米黄
制温度在一定范围内的升高而逐渐增加当温度达到190 ℃,玉米黄 的含量为306.38 μg/100 g,当
的含量为306.38 μg/100 g,当 制温度高于190 ℃时,玉米黄
制温度高于190 ℃时,玉米黄 的含量呈极具下降趋势。已有研究发现热处理可有效促进植物组织基质软化,促进类胡萝卜
的含量呈极具下降趋势。已有研究发现热处理可有效促进植物组织基质软化,促进类胡萝卜 -蛋白质复合物的变性,促进类胡萝卜
-蛋白质复合物的变性,促进类胡萝卜 从食物基质中释放,增加植物活性物质溶出并提高其提取量[27-30]。在一定范围内随着
从食物基质中释放,增加植物活性物质溶出并提高其提取量[27-30]。在一定范围内随着 制温度升高使玉米黄
制温度升高使玉米黄 -蛋白质复合物变性,破坏了其大分子结构,使得玉米黄
-蛋白质复合物变性,破坏了其大分子结构,使得玉米黄 被释放出来从而引起玉米黄
被释放出来从而引起玉米黄 含量升高;当
含量升高;当 制温度过高时,玉米黄
制温度过高时,玉米黄 的热稳定性差,会将溶出的玉米黄
的热稳定性差,会将溶出的玉米黄 降解或者转换为其他异构体。研究发现热处理会使水果和蔬菜中的β-胡萝卜
降解或者转换为其他异构体。研究发现热处理会使水果和蔬菜中的β-胡萝卜 、玉米黄
、玉米黄 的发生降解以及产生顺式异构体4%~40%[22];热处理会导致类胡萝ト
的发生降解以及产生顺式异构体4%~40%[22];热处理会导致类胡萝ト 发生异构体反应,且研究发现β-胡萝卜
发生异构体反应,且研究发现β-胡萝卜 、玉米黄
、玉米黄 更容易发生异构化[23]。
更容易发生异构化[23]。
2.2.2  制时间的单因
制时间的单因 试验结果
试验结果
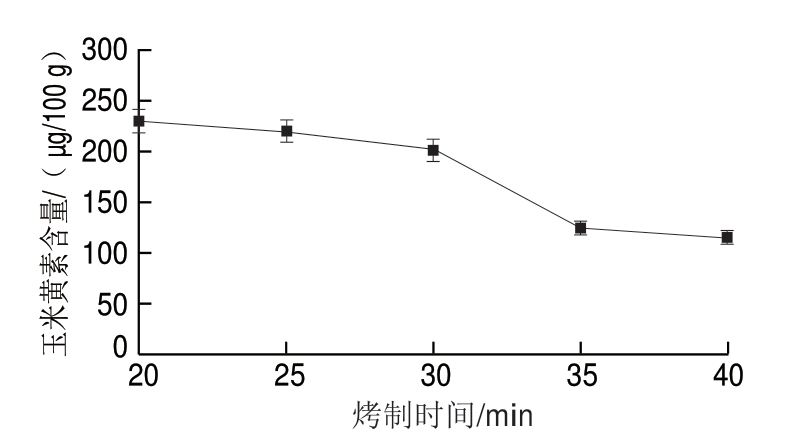
图 4 烤制时间对玉米黄素含量的影响
Fig. 4 Effect of baking time on the content of zeaxanthin
由图4可知,当 制温度为190 ℃,加水量为75%时,当
制温度为190 ℃,加水量为75%时,当 制时间在20~30 min之间玉米黄
制时间在20~30 min之间玉米黄 的含量随着
的含量随着 制时间的增加呈平稳下降趋势,当
制时间的增加呈平稳下降趋势,当 制大于30 min时玉米黄
制大于30 min时玉米黄 的含量下降幅度明显提高。研究发现菠菜长时间热处理时叶黄
的含量下降幅度明显提高。研究发现菠菜长时间热处理时叶黄 的含量下降明显[23],朱倩等[31]研究发现延长加热时间可促进番茄红
的含量下降明显[23],朱倩等[31]研究发现延长加热时间可促进番茄红 异构化甚至使其发生降解。玉米黄
异构化甚至使其发生降解。玉米黄 具有高温瞬时处理稳定,长时间处理不稳定的特点。
具有高温瞬时处理稳定,长时间处理不稳定的特点。
2.2.3 加水量的单因 试验结果
试验结果
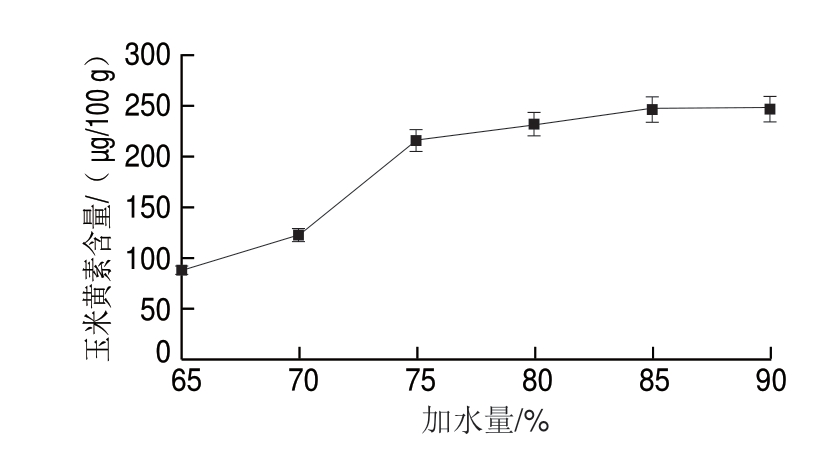
图 5 加水量对玉米黄素含量的影响
Fig. 5 Effect of water addition on the content of zeaxanthin
由图5可知,当 制温度和
制温度和 制时间分别为190 ℃、30 min时,随着加水量的增加玉米黄
制时间分别为190 ℃、30 min时,随着加水量的增加玉米黄 的含量呈上升趋势,当加水量为65%~75%之间时曲线的增长幅度较高,后随着加水量的增加玉米黄
的含量呈上升趋势,当加水量为65%~75%之间时曲线的增长幅度较高,后随着加水量的增加玉米黄 含量增加趋势趋于平稳。其主要的原因是水的比热容比较大,当
含量增加趋势趋于平稳。其主要的原因是水的比热容比较大,当 制温度和
制温度和 制时间一定时,随着加水量的增加玉米黄
制时间一定时,随着加水量的增加玉米黄 真正受热时间和受热温度并没有达到设定的值;另一方面是玉米粉中淀粉含量较高,当淀粉与水处在受热加温的条件下,水分子开始逐渐进入淀粉颗粒内的结晶区域,淀粉分子内的一些化学键变得很不稳定、易断裂,淀粉颗粒内结晶区域则由原来排列紧密的状态变为疏松状态,使得淀粉的吸水量迅速增加,出现了不可逆吸水的现象,当淀粉颗粒仍在继续吸水膨胀,其体积膨胀到一定限度后,颗粒便出现破裂现象,有利于玉米黄
真正受热时间和受热温度并没有达到设定的值;另一方面是玉米粉中淀粉含量较高,当淀粉与水处在受热加温的条件下,水分子开始逐渐进入淀粉颗粒内的结晶区域,淀粉分子内的一些化学键变得很不稳定、易断裂,淀粉颗粒内结晶区域则由原来排列紧密的状态变为疏松状态,使得淀粉的吸水量迅速增加,出现了不可逆吸水的现象,当淀粉颗粒仍在继续吸水膨胀,其体积膨胀到一定限度后,颗粒便出现破裂现象,有利于玉米黄 溶出。
溶出。
在单因 试验基础上,综合考虑各因
试验基础上,综合考虑各因 对玉米黄
对玉米黄 含量的影响,根据Box-Behnken试验原理,选择
含量的影响,根据Box-Behnken试验原理,选择 制时间、
制时间、 制温度、加水量,设计3因
制温度、加水量,设计3因 3水平的响应面分析方法,确定玉米粉最佳
3水平的响应面分析方法,确定玉米粉最佳 制条件,结果见表2。将所得的试验数据采用Design-Expert 7.1软件进行多元回归拟合,得到玉米黄
制条件,结果见表2。将所得的试验数据采用Design-Expert 7.1软件进行多元回归拟合,得到玉米黄 含量对
含量对 制温度(A)、
制温度(A)、 制时间 (B)、加水量(C)的
制时间 (B)、加水量(C)的 次多项回归方程:
次多项回归方程:
Y=48.84 5.00A
5.00A 8.55B
8.55B 1.80C
1.80C 3.09AB
3.09AB 2.58AC
2.58AC 1.48BC
1.48BC 15.36A2
15.36A2 15.36B2
15.36B2 13.80C2
13.80C2
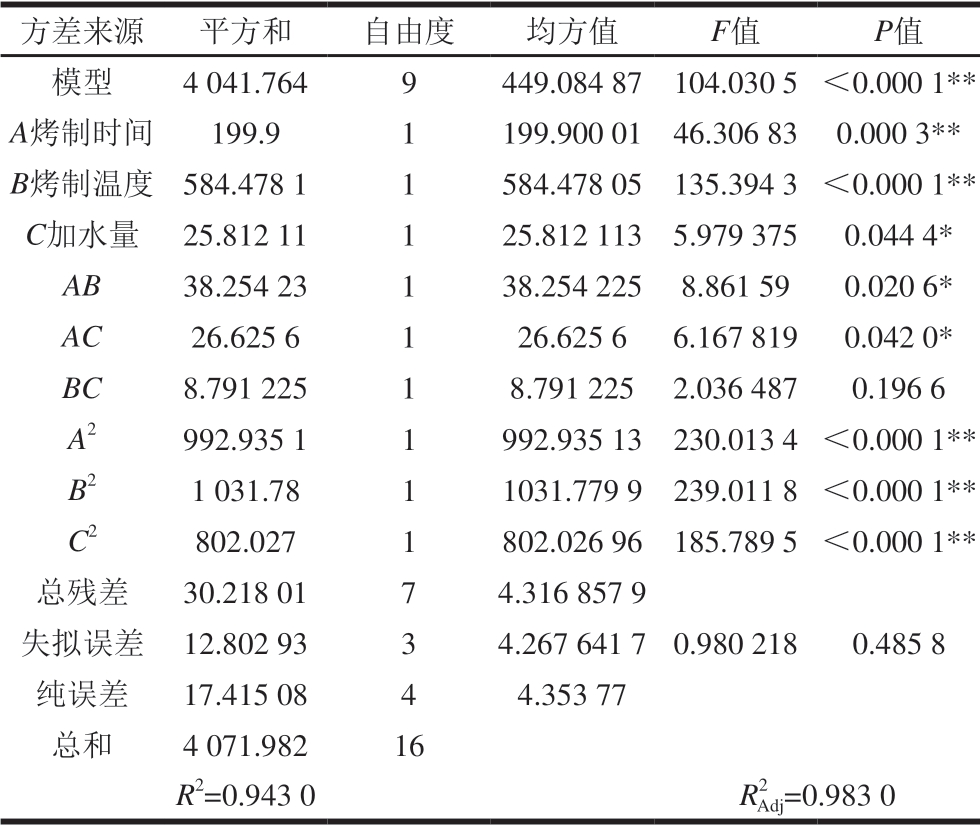
由表3可知,模型F值为104.030 5,P<0.000 1,表明响应回归模型达到了极显著水平。失拟项P>0.05,表示失拟不显著,模型的确定系数R2为0.943 0,说明该模型能解释94.30%响应值的变化,因而该模型拟合程度比较好,可以用 模型对玉米粉
模型对玉米粉 制条件进行分析和预测。由回归模型和方差分析可知,方程一次项A、B、A2、B2、C2对玉米黄
制条件进行分析和预测。由回归模型和方差分析可知,方程一次项A、B、A2、B2、C2对玉米黄 含量的影响达到极显著水平 (P<0.01);方程一次项C,交互项AB、AC对玉米黄
含量的影响达到极显著水平 (P<0.01);方程一次项C,交互项AB、AC对玉米黄 含量的影响达到显著水平(P<0.05)。根据F值可知,各个因
含量的影响达到显著水平(P<0.05)。根据F值可知,各个因 对玉米黄
对玉米黄 含量影响的大小顺序为:
含量影响的大小顺序为: 制温度(B)>
制温度(B)> 制时间(A)>加水量(C)。
制时间(A)>加水量(C)。
表 2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis
试验号 Aimages/BZ_307_1544_777_1575_808.png制时间 Bimages/BZ_307_1749_777_1780_808.png制温度 C加水量 玉米黄images/BZ_307_2208_760_2239_791.png含量/(μg/100 g)1 images/BZ_307_1570_842_1601_873.png1 images/BZ_307_1775_842_1806_873.png1 0 209.934 6 2 0 0 0 298.926 6 3 0 images/BZ_307_1775_936_1806_967.png1 1 193.619 4 4 0 0 0 287.061 5 0 0 0 306.713 4 6 images/BZ_307_1570_1078_1601_1109.png1 1 0 77.25 7 1 1 0 48.636 6 8 1 0 images/BZ_307_1980_1172_2011_1203.png1 93.256 2 9 0 0 0 321.112 8 10 0 0 0 295.280 4 11 1 0 1 93.256 2 12 images/BZ_307_1570_1361_1601_1392.png1 0 images/BZ_307_1980_1361_2011_1392.png1 118.099 8 13 0 images/BZ_307_1775_1408_1806_1440.png1 images/BZ_307_1980_1408_2011_1440.png1 162.781 2 14 0 1 images/BZ_307_1980_1456_2011_1487.png1 64.272 15 1 images/BZ_307_1775_1503_1806_1534.png1 0 104.874 6 16 images/BZ_307_1570_1550_1601_1581.png1 0 1 181.877 4 17 0 1 1 58.462 8
表 3 回归模型和方差分析
Table 3 Analysis of variance for the regression model
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
方差来源 平方和 自由度 均方值 F值 P值模型 4 041.764 9 449.084 87 104.030 5 <0.000 1**Aimages/BZ_307_1363_1891_1395_1922.png制时间 199.9 1 199.900 01 46.306 83 0.000 3**Bimages/BZ_307_1363_1942_1395_1973.png制温度 584.478 1 1 584.478 05 135.394 3 <0.000 1**C加水量 25.812 11 1 25.812 113 5.979 375 0.044 4*AB 38.254 23 1 38.254 225 8.861 59 0.020 6*AC 26.625 6 1 26.625 6 6.167 819 0.042 0*BC 8.791 225 1 8.791 225 2.036 487 0.196 6 A2 992.935 1 1 992.935 13 230.013 4 <0.000 1**B2 1 031.78 1 1031.779 9 239.011 8 <0.000 1**C2 802.027 1 802.026 96 185.789 5 <0.000 1**总残差 30.218 01 7 4.316 857 9失拟误差 12.802 93 3 4.267 641 7 0.980 218 0.485 8纯误差 17.415 08 4 4.353 77总和 4 071.982 16 R2=0.943 0 R2Adj=0.983 0
 制对玉米粉中玉米黄
制对玉米粉中玉米黄 影响的等高线和响应面见图6,等高线图可直观地反映各因
影响的等高线和响应面见图6,等高线图可直观地反映各因 对玉米黄
对玉米黄 含量的交互作用程度。等高线呈圆形表示两因
含量的交互作用程度。等高线呈圆形表示两因 交互作用不显著,而呈椭圆形或马鞍形则表示两因
交互作用不显著,而呈椭圆形或马鞍形则表示两因 交互作用显著。由图可知,
交互作用显著。由图可知, 制时间(A)和
制时间(A)和 制温度(B)、
制温度(B)、 制时间(A)和加水量(C)等高线图呈明显的椭圆形,表明两因
制时间(A)和加水量(C)等高线图呈明显的椭圆形,表明两因 间交互作用显著。相比之下,
间交互作用显著。相比之下, 制温度(B)和加水量(C)交互作用较小。比较3 组图可知,
制温度(B)和加水量(C)交互作用较小。比较3 组图可知, 制温度对玉米黄
制温度对玉米黄 含量影响最为显著,其曲线较陡,
含量影响最为显著,其曲线较陡, 制时间、加水量次之,其曲线较平滑。
制时间、加水量次之,其曲线较平滑。

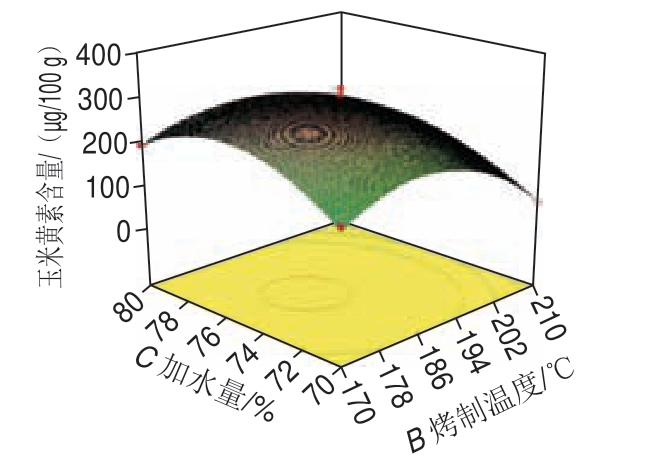
图 6 各因素交互作用对玉米黄素含量影响的等高线和响应面图
Fig. 6 Response surface and contour plots showing the interactive effects of any of baking temperature and water addition on the
content of zeaxanthin
c.  制温度和加水量
制温度和加水量
 制热处理对玉米粉表面形态的影响
制热处理对玉米粉表面形态的影响
图 7 烤制热处理前后玉米粉扫描电子显微镜图
Fig. 7 Scanning electron micrographs of corn flour before and after baking heat treatment
a.未经热处理玉米粉(×500);b.未经热处理玉米粉(×1 000);c. 制热处理后玉米粉(×500);d.
制热处理后玉米粉(×500);d. 制热处理后玉米粉(×1 000)。
制热处理后玉米粉(×1 000)。
图7a、b为玉米原粉扫描电子显微镜图,可以看到玉米淀粉颗粒分散均匀且玉米原粉中有少量纤维和蛋白质;当经过 制热处理后通过扫描电子显微镜得图7c、d, 可以明显观察到有大块联结状出现,且纤维和蛋白质含量比未经热处理时含量有所降低,这是因为玉米粉中含有大量淀粉,在
制热处理后通过扫描电子显微镜得图7c、d, 可以明显观察到有大块联结状出现,且纤维和蛋白质含量比未经热处理时含量有所降低,这是因为玉米粉中含有大量淀粉,在 制热处理过程中使得淀粉糊化老化形成淀粉凝胶,淀粉凝胶将部分玉米黄
制热处理过程中使得淀粉糊化老化形成淀粉凝胶,淀粉凝胶将部分玉米黄 和玉米黄
和玉米黄 ——蛋 白质复合体包裹起来,使得玉米黄
——蛋 白质复合体包裹起来,使得玉米黄 含减少。通过扫描电子显微镜可以更加直观了解到
含减少。通过扫描电子显微镜可以更加直观了解到 制热处理对玉米粉表面形态变化,从而影响玉米黄
制热处理对玉米粉表面形态变化,从而影响玉米黄 含量变化。
含量变化。
根据回归模型分析可知, 制玉米粉工艺最优条件为
制玉米粉工艺最优条件为 制时间27.00 min、
制时间27.00 min、 制温度189.65 ℃、加水量78%。根据实际情况稍做调整,即
制温度189.65 ℃、加水量78%。根据实际情况稍做调整,即 制时间30 min、
制时间30 min、 制温度190 ℃、加水量75%,进行3 次平行实验,
制温度190 ℃、加水量75%,进行3 次平行实验, 时玉米黄
时玉米黄 的平均提取量为理论值接近。
的平均提取量为理论值接近。
本实验研究日常热加工 制对玉米粉中玉米黄
制对玉米粉中玉米黄 含量的影响,通过实验优化
含量的影响,通过实验优化 制热加工工艺,根据Box-Benhnken试验设计,建立
制热加工工艺,根据Box-Benhnken试验设计,建立 制时间、
制时间、 制温度、加水量对玉米黄
制温度、加水量对玉米黄 含量的回归模型,并对模型进行失拟,经过实验验证了该方法的可靠性,能较好地预测出玉米黄
含量的回归模型,并对模型进行失拟,经过实验验证了该方法的可靠性,能较好地预测出玉米黄 的含量。
的含量。 制热加工最优条件为
制热加工最优条件为 制时间30 min、
制时间30 min、 制温度190 ℃、加水量75%,在
制温度190 ℃、加水量75%,在 条件下玉米黄
条件下玉米黄 含量为306.79 μg/100 g,原粉中玉米黄
含量为306.79 μg/100 g,原粉中玉米黄 含量为755.14 μg/100 g,
含量为755.14 μg/100 g, 制热处理后玉米黄
制热处理后玉米黄 的含量降低55%。玉米黄
的含量降低55%。玉米黄 作为天然安全的植物色
作为天然安全的植物色 具多种生物学活性,随着膳食营养健康意识的日益增强,在食物热加工过程中探究玉米黄
具多种生物学活性,随着膳食营养健康意识的日益增强,在食物热加工过程中探究玉米黄 含量变化、保护玉米黄
含量变化、保护玉米黄 免受降解且提高其生物利用率成为科研人员关注的问题。本实验深入研究玉米黄
免受降解且提高其生物利用率成为科研人员关注的问题。本实验深入研究玉米黄 的热变规律,对指导玉米及其他杂粮精深加工、提高玉米及其他杂粮产品营养品质具有十分重要的科学意义。通过本实验的研究,可以优化
的热变规律,对指导玉米及其他杂粮精深加工、提高玉米及其他杂粮产品营养品质具有十分重要的科学意义。通过本实验的研究,可以优化 制玉米粉加工工艺,指导人们日常烹调方式从而达到玉米黄
制玉米粉加工工艺,指导人们日常烹调方式从而达到玉米黄 含量最大化。
含量最大化。
[1] ABDEL-AAL E S M, YOUNG J C, AKHTAR H, et al. Stability of lutein in wholegrain bakery products naturally high in lutein or fortified with free lutein[J]. Journal of Agricultural and Food Chemistry, 2010, 58(18): 10109-10117. DOI:10.1021/jf102400t.
[2] RIBAYA-MERCADO J D, BLUMBERG J B. Lutein and zeaxanthin and their potential roles in disease prevention[J]. Journal of the American College of Nutrition, 2004, 23(6): 567-587. DOI:10.1080/07 315724.2004.10719427.
[3] BONE R A, LANDURM J T, MAYNE S T, et al. Macular pigment in donor eyes with and without AMD: a case-control study[J]. Investigative Opthalmology & Visual Science, 2001, 42: 235-240. DOI:10.1007/PL00007900.
[4] MA L, LIN X M. Effects of lutein and zeaxanthin on aspects of eye health[J]. Journal of Science of Food & Agriculture, 2010, 90(1): 2-12. DOI:10.1002/jsfa.3785.
[5] OLMEDILLA B, GRANADO F, BLANCO I, et al. Lutein in patients with cataracts and age-related macular degeneration: a longterm supplementation study[J]. Journal of the Science of Food and Agriculture, 2001, 81(9): 904-909. DOI:10.1002/jsfa.905.
[6] MICHAUD D S, FESKANICH D, RIMM E B, et al. Intake of specific carotenoids and risk of lung cancer in 2 prospective US cohorts[J]. The American Journal of Clinical Nutrition, 2000, 72(4): 990-997. DOI:10.1093/ajcn/72.4.990.
[7] OSGANIAN S K, STAMPFER M J, RIMM E, et al. Dietary carotenoids and risk of coronary disease in women[J]. The American Journal of Clinical Nutrition, 2003, 77: 1390-1399. DOI:10.1378/chest.66.5.541.
[8] GAO Y Y, XIE Q M, JIN L, et al. Supplementation of xanthophylls decreased proinflammatory and increased antiinflammatory cytokines in hens and chicks[J]. The British Journal of Nutrition, 2012, 108(10): 1746-1755. DOI:10.1017/S0007114512000025.
[9] RENU A K, BINDU M, DENNIS L. et al. Beneficial effect of zeaxanthin on retinal metabolic abnormalities in diabetic rats[J]. Investigative Opthalmology & Visual Science, 2008, 49(4): 1645. DOI:10.1167/iovs.07-0764.
[10] CHUNG R W S, LEANDERSON P, LUNDBERG A, et al. Lutein exerts anti-inflammatory effects in patients with coronary artery disease[J]. Atherosclerosis, 2017, 262: 87-93. DOI:10.1016/j.atherosclerosis.2017.05.
[11] DELIA B RODRIGUEZ-AMAYA. Natural food pigments and colorants[J]. Current Opinion in Food Science, 2016, 7: 20-26. DOI:10.1016/j.cofs.2015.08.004.
[12] GRANADO-LORENCIO F, HERRERO-BARBUDO C, ACIÉNFERNÁNDEZ G, et al. In vitro bioaccesibility of lutein and zeaxanthin from the microalgae Scenedesmus almeriensis[J]. Food Chemistry, 2009, 114(2): 747-752. DOI:10.1016/j.foodchem.2008.10.058.
[13] SINGH D, BARROW C J, MATHUR A S, et al. Optimization of zeaxanthin and β-carotene extraction from Chlorella saccharophila isolated from New Zealand marine waters[J]. Biocatalysis and Agricultural Biotechnology, 2015, 4(2): 166-173. DOI:10.1016/j.bcab.2015.02.001.
[14] BAEK J J, KIM Y, LEE S. Functional characterization of extruded rice noodles with corn bran: xanthophyll content and rheology[J]. Journal of Cereal Science, 2014, 60(2): 311-316. DOI:10.1016/j.jcs.2014.06.004.
[15] FERNÁNDEZ-GARCÍA E, CARVAJAL-LÉRIDA I, JARÉNGALÁN M, et al. Carotenoids bioavailability from foods: from plant pigments to efficient biological activities[J]. Food Research International, 2012, 46(2): 438-450. DOI:10.1016/j.foodres.2011.06.007.
[16] O’HARE T J, FANNING K J, MARTIN I F. Zeaxanthin biofortification of sweet-corn and factors affecting zeaxanthin accumulation and colour change[J]. Archives of Biochemistry and Biophysics, 2015, 572: 184-187. DOI:10.1016/j.abb.2015.01.015.
[17] 刘春菊, 肖亚东, 李大靖, 等. 玉米黄质及其异构体的测定方法 研究[J]. 现代食品科技, 2015, 31(11): 313-318. DOI:10.13982/j.mfst.1673- 9078 .2015.11.047.
[18] WELLER P, BREITHHAUPT D E. Identification and quantification of zeaxanthin esters in plants using liquid chromatography mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2003, 51(24): 7044-7049. DOI:10.1021/jf034803s.
[19] SAINI R K, SHETTY N P, PRAKASH M, et al. Effect of dehydration methods on retention of carotenoids, tocopherols, ascorbic acid and antioxidant activity in Moringa oleifera leaves and preparation of a RTE product[J]. Journal of Food Science and Technology, 2014, 51(9): 2176-2182. DOI :10.1007/s13197-014-1264-3.
[20] COLLE I J P, LEMMENS L, KNOCKAERT G, et al. Carotene degradation and isomerization duringthermal processing: a review on the kinetic aspects[J]. Critical Reviews in Food Science and Nutrition, 2015, 56(11): 1844-1855. DOI:10.1080/10408398.2013.790779.
[21] MORTENSEN A. Analysis of a complex mixture of carotenes from oil palm (Elaeis guineensis) fruit extract[J]. Food Research International, 2005, 38(8/9): 847-853. DOI:10.1016/j.foodres.
[22] AMAN R, SCHIEBER A, CARLE R. Effects of heating and illumination on trans-cis isomerization and degradation of β-carotene and lutein in isolated spinach chloroplasts[J]. Journal of Agricultural and Food Chemistry, 2005, 53(24): 9512-9518. DOI:10.1021/jf050926w.
[23] CHUNG R W S, LEANDERSON P, GUSTAFASSON N, et al. Liberation of lutein from spinach: effects of heating time, microwavereheating and liquefaction[J]. Food Chemistry, 2019, 277: 573-578. DOI:10.1016/j.foodchem.2018.11.023.
[24] ERIKSEN J N, LUU A Y, DRAGSTED L O, et al. Adaption of an in vitro digestion method to screen carotenoid liberation and in vitro accessibility from differently processed spinach preparations[J]. Food Chemistry, 2017, 224: 407-413. DOI:10.1016/j.foodchem.20116.11.146.
[25] ERIKSEN J N, LUU A Y, DRAGSTED L O, et al. In vitro liberation of carotenoids from spinach and Asia salads after different domestic kitchen procedures[J]. Food Chemistry, 2016, 203: 23-27. DOI:10.1016/j.foodchem.2016.02.033.
[26] VELÁZQUEZ-ESTRADA R M, HERNÁNDEZ-HERRERO M M, RÜFER C E, et al. Influence of ultra high pressure homogenization processing on bioactive compounds and antioxidant activity of orange juice[J]. Innovative Food Science & Emerging Technologies, 2013, 18: 89-94. DOI:10.1016/j.ifset.2013.02.005.
[27] PALERMO M, PELLEGRINI N, FOGLIANO V. The effect of cooking on the phytochemical content of vegetables[J] Journal of the Science of Food and Agriculture, 2013, 94(6): 1057-1070. DOI:10.1002/jsfa.6478.
[28] PARK Y S, IM M H, HAM K S, et al. Nutritional and pharmaceutical properties of bioactive compounds in organic and conventional growing kiwifruit[J]. Plant Foods for Human Nutrition, 2013, 68(1): 57-64. DOI:10.1007/s11130-013-0339-z.
[29] DELCHEIR N, REICH M, RENARD C M G C. Impact of cooking methods on folates, ascorbic acid and lutein in green beans (Phaseolus vulgaris) and spinach (Spinacea oleracea)[J]. LWT- Food Science and Technology, 2012, 49(2): 197-201. DOI:10.1016/j.lwt.2012.06.017.
[30] BOHN T, MCDOUGALL G J, ALEGRÍA A, et al. Mind the gapdeficits in our knowledge of aspects impacting the bioavailability of phytochemicals and their metabolites-a position paper focusing on carotenoids and polyphenols[J]. Molecular Nutrition & Food Research, 2015, 59(7): 1307-1323. DOI:10.1002/mnfr.201400745.
[31] 朱倩, 高瑞萍, 雷琳, 等. 番茄红 热异构化机制及其影响因
热异构化机制及其影响因 研究进展[J]. 食品科学, 2018, 39(15): 310-315. DOI:10.7506/spkx1002-6630-201815045.
研究进展[J]. 食品科学, 2018, 39(15): 310-315. DOI:10.7506/spkx1002-6630-201815045.
Effect of Baking on Zeaxanthin Content in Corn Flour
刘回民(1984ü )(ORCID: 0000-0002-2265-2961),男,讲师, 博士,研究方向为食品生物技术与长白山特色植物资源开发利用。E-mail: liuhuimin@jlau.edu.cn
刘景圣(1964ü )(ORCID: 0000-0002-6591-1759),男,教授,博士,研究方向为粮食深加工、发酵工程、食品资源综合利用与功能性食品。E-mail: liujs1007@vip.sina.com.cn
WANG Jiaojiao, ZHENG Mingzhu, LIU Meihong, et al. Effect of baking on zeaxanthin content in corn flour[J]. Food Science, 2020, 41(2): 284-290. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181227-321. http://www.spkx.net.cn