近年来,随着乳品消费量的大幅增加,乳品安全已经引起全社会的高度关注。其中,乳粉作为大众食品原料,在全球经济贸易中占有重要地位。受经济利益驱使的乳粉掺假行为具有一定的普遍性,严重地损害了人民的利益,甚至危及婴幼儿的生命健康[1-3]。我国目前的食品安全检测标准方法仅仅针对已知危害物质制定其限量标准。然而,由于新型化学性有害物质层出不穷,不法商贩为逃避监管,有可能使用其他可替代化学品,不可能逐一建立检测标准。因此,针对可能存在未知掺杂物的乳粉,发展新型、高效的非定向筛查技术,成为食品安全领域的一大紧迫需求。
目前常用的乳粉检测手段主要基于色谱、质谱技术,如高效液相色谱法、气相色谱-质谱联用法等[4-7],通常是通过尽可能多的搜集化学品的信息,构建大数据库,以覆盖乳粉中未知化合物的检测。基于色谱和质谱的分析方法,虽然灵敏度高,但其需要繁琐的前处理工序,对检测人员要求高,对仪器成本要求高,不适宜用作大规模的快速筛查[8-10],而更适合作为筛查后的确证方法使用。
在各类检测技术中,基于光谱的检测技术,具有检测速度快、无损、操作简单、高通量等优点[3,11-13]。其中,拉曼光谱谱峰指纹特异性好,富含丰富的光谱信息,为后续化学计量学分析奠定了良好的基础,十分适用于乳粉的非定向筛查。然而,乳粉掺杂行为大部分是通过添加含氮化合物提升其表观蛋白质含量[13-14],通常掺杂浓度很低,且因不需要特殊设备和培训,其混合方式通常是干法混合[15],因此存在混合不均匀的现象。传统的拉曼光谱技术,仅采集样品单点数据或多点数据取平均值,而忽略了乳粉样本的非均匀异质性[16],因此极易错过低浓度掺杂物质,从而降低其检测灵敏度。
针对掺杂乳粉上述特点,引入拉曼高光谱成像技术用于乳粉安全性的检测,该技术有效结合微区分析和大面积扫描的特性,可同时获取包括位置信息和光谱信息的三维数据立方体[17]。目前,一些文献报道了拉曼近红外光谱成像技术在药品和食品的掺假诊断中的应用,然而这些方法往往只能实现特定掺杂物的定向筛查,即针对某种已知掺杂物建立其定性、定量的化学计量学方法,而并未将这些光谱成像技术应用于非定向筛查领域,因此难以全面覆盖食品中的未知掺杂物。如Chao Kuanglin等[18]使用掺杂物标准谱出峰位置的强度值结合最优阈值画出二值成像图。Fu Xiaping等[19]通过光谱角测量(spectral angle mapping,SAM)、光谱相关性度测量和欧式距离测量等光谱相似性分析方法,比较被测物的每个像素点的光谱与纯掺杂物光谱的相似度,从而证明高光谱技术结合光谱相似性分析可以有效地检测食品中的掺杂物。Lohumi等[20]使用单变量、多变量和光谱角制图等方法,针对掺杂物作出成像图,并根据掺杂像素点的数量进行辣椒粉的定量分析。Qin Jianwei等[10,21-22]在拉曼成像技术领域发表了很多的工作成果,其中,常使用被测物特征单波长信息画出拉曼强度图,并结合强度阈值法画出被测掺杂物的二值图,再通过掺杂像素点的个数定量分析掺杂质量。然而,在真实的乳粉掺杂鉴别应用中,各类掺杂物质种类繁多,定向筛查方法难以通过穷举法实现全面检查。因此,急需发展一种通用的非定向筛查方法,用于弥补传统拉曼高光谱成像技术在乳粉质量安全检测中的不足。
本研究发展了一种基于移动窗口光谱角制图的拉曼高光谱成像方法(moving spectral angle mapping Raman hyperspectral imaging method,MWSAM-RHIM),以实现乳粉安全的非定向筛查。在MWSAM-RHIM中,利用改进的移动窗口光谱角制图算法,借助高光谱位置信息与光谱信息合一的特性,将乳粉中未知掺杂物的识别问题转化为奇异像素点的识别问题,设置合理阈值,构建二值图像,进而可视化、非定向的识别掺杂乳粉。实验中,首先采集正常乳粉高光谱数据,确定了MWSAMRHIM中正常乳粉判定阈值,并进一步使用验证样本验证此方法的准确性和有效性。
1 材料与方法
1.1 材料与试剂
脱脂乳粉(25 种) 雀巢(中国)研发公司;尿素(99%,生物技术级)、三聚氰酸(98%)、硫脲(分析纯,99%) 上海麦克林生化科技有限公司;滑石粉 商丘市亮峰卫生用品有限公司;小麦粉(特级,金 龙鱼) 益海嘉里食品营销有限公司。
1.2 仪器与设备
本实验使用实验室自行搭建的拉曼高光谱成像装置,并为此装置开发了操作软件,将BIOS-105T-304GS型(日本Sigma Koki公司)二维位移平台控制器与便携式拉曼光谱仪一同控制,实现了拉曼光谱仪与位移平台的联用。此装置所用便携式拉曼光谱仪的激光器功率为100 mW,波长785 nm,CCD波数范围为200~2 200 cm-1, 采集的每条拉曼光谱数据为1h 1 024波长点阵列。在实验中,设置单点采集积分时间为600 ms,激光功率为100 mW,将高光谱采集区域设置为30 mmh 30 mm,将二维位移平台步长设置为0.3 mm,则可以采集100h 100共10 000 个像素点的拉曼光谱数据,其空间分辨率为0.3 mm(30 mm范围内100 个像素点)。最终可以得到每个乳粉样品的100h 100h 1 024的拉曼高光谱三维数据立方体,其中100h 100表示在采集平面X-Y轴方向的采样点数,而1 024是每个像素点的拉曼光谱数据点数(Z轴)。
在光谱数据处理中,使用Matlab R2016a软件进行计算。移动窗口光谱角制图算法,根据算法原理自行编写。
1.3 方法
1.3.1 样品分组
实验设置6 组验证样品,用来验证MWSAM-RH的有效性。其中,第1组为阴性样本,第2~6组为人为配制的掺杂阳性样本。具体分别为:第1组为雀巢中国研发公司提供的15 个按照国标生产的脱脂乳粉;第2~4组分别采用尿素、三聚氰酸、硫脲掺杂样品15 个,按照质量分数梯度0.1%~5%混合入脱脂乳粉中;第5~6组分别采用滑石粉、小麦粉掺杂样品15 个,按照质量分数梯度0.1%~15%混合入脱脂乳粉中。具体掺杂样品掺杂浓度见表1。
1.3.2 掺杂样品制备
按照表1配制验证样品中的5 组阳性掺杂样品,每个样品20 g。具体制样步骤:1)将掺杂化学品采用研钵进行研磨;2)研磨后过200 目的筛子,使其2 种混合体系的颗粒度尽可能一致;3)将掺杂物质倒入乳粉中,用玻璃棒搅拌至肉眼观察已均匀后,使用XW-80A涡流混合仪混合5 min,之后再用玻璃棒辅助移入样品杯,以确保奶粉中掺假颗粒的均匀性。
表 1 掺杂样品的配制
Table 1 Preparation of adulterated samples at different concentrations

样品编号第2~4组 第5~6组掺杂物质量分数/%脱脂乳粉质量分数/%掺杂物质量分数/%脱脂乳粉质量分数/%1 0.1 99.9 0.1 99.9 2 0.2 99.8 0.3 99.7 3 0.3 99.7 0.5 99.5 4 0.4 99.6 1.0 99.0 5 0.5 99.5 2.0 98.0 6 0.7 99.3 3.0 97.0 7 1.0 99.0 4.0 96.0 8 1.5 98.5 5.0 95.0 9 2.0 98.0 6.0 94.0 10 2.5 97.5 7.0 93.0 11 3.0 97.0 8.0 92.0 12 3.5 96.5 9.0 91.0 13 4.0 96.0 11.0 89.0 14 4.5 95.5 13.0 87.0 15 5.0 95.0 15.0 85.0
1.3.3 MWSAM-RHIM原理
乳粉是复杂的有机物体系,其拉曼光谱具有强烈的荧光背景[24]。掺杂的乳粉,其掺杂物位点的拉曼光谱会含有掺杂物的光谱信息,因此,掺杂乳粉的拉曼光谱相较于纯乳粉光谱存在畸变。本研究基于此现象,将被测物质光谱与纯脱脂乳粉光谱进行对比,计算其相似度,通过设置合理阈值,达到非定向筛查的目的。
光谱角制图算法,最早由Kruse等[25]在1993年提出,是一种常用的计算光谱相似性的方法,在高光谱和成像领域应用广泛[26-31]。通过计算参考光谱与分析光谱的矢量夹角大小度量光谱间的相似性,夹角越小,两光谱越相似[25]。之前常被用于定向筛查方法,通过计算被测物质与已知某掺杂物的纯物质光谱的光谱相似性,检测是否含有此种掺杂物[19]。而本实验用其作为非定向筛查的手段,将被测物光谱与纯乳粉光谱进行比较。传统的光谱角制图算法如式(1)所示[28]:
式中:xr为参考光谱;X为分析光谱;DSAM(X)为求得的夹角。其值越小,代表与参考光谱的匹配越紧密,相似性越高。
传统的SAM,使用整条光谱进行对比,而通常乳粉掺杂物的含量偏低,且拉曼光谱指纹特异性较好,掺杂物可能仅在几个波数范围内出现很小的尖峰,因此用单条光谱比对,容易出现掺杂物信息淹没在大部分相似的脱脂乳粉信息中的情况,从而产生假阳性的问题。针对此问题,本研究提出了移动窗口光谱角制图方法,通过添加移动窗口,将整条光谱切分为很多段进行对比,从而可以提取更多细节光谱信息,提升其检测灵敏度。
利用计算光谱相似性原理进行检测,其阈值设置的合理性尤为重要。如果设置过于严格的阈值,则可能出现假阳性的误判,而设置过于宽松的阈值,则会出现假阴性的误判。在本方法中,利用正常奶粉数据自行比对计算,得到乳粉的光谱相似性信息。将正常乳粉比对后矢量角最大,即最不相似的值设置为阈值,大于此阈值则认作异常光谱。
将上述算法与拉曼高光谱相结合,建立MWSAMRHIM,可以利用高光谱特性,大面积获取乳粉信息的同时,获取到微区的精细信息,再通过移动窗口光谱角制图算法,计算每个像素点与正常奶粉光谱的相似性,从而判断该像素点是否掺杂,最终得知此样品是否为掺杂样品。MWSAM-RHIM计算了两个向量间的余弦角[28],使用角度表示两个向量在方向上的差异,这一特点十分适用于分析乳粉这一含有强烈荧光背景的物质的拉曼光谱,此方法省略了有机物拉曼光谱常规的去除荧光背景的预处理步骤,大大提升了计算速度。
1.3.4 MWSAM-RHIM参数设置
在实践中,MWSAM-RHIM首先需要设置窗口。由于本研究使用的便携式拉曼光谱仪提供200~2 200 cm-1 共1 024 个变量。使用半窗宽为100,步长为50的移动窗口,可以得到17 个窗口。其次,需要为每个窗口设置判定阈值。由于不同批次、不同品牌的脱脂乳粉具有不同的基质特性,为保证此方法可以覆盖绝大多数脱脂乳粉,选用10 种正常乳粉计算阈值。具体为,使用MWSAM-RHIM计算10 种正常乳粉同一窗口光谱两两之间的相似度。每个样品因为含有10 000 个像素点的光谱数据,所以最终得到10 000h 10 000的相似度数据。为避免个别奇异点对阈值的影响,将全部数据排序,找到前10 个最大值取平均,作为此两种奶粉光谱的最大夹角,即最不相似值。用此方法对全部10 种乳粉进行计算,可以得到共计55 组相似度数据,再选择此55 组中的前10 个最大值的平均值,即为正常乳粉间差异的最大范围,将此范围作为正常脱脂乳粉的判定阈值。17 个窗口全部使用上述方法计算,最终产生17 个判定阈值。
1.3.5 MWSAM-RHIM检测未知样品
采集未知待测样品的高光谱数据,计算每个像素点的每个窗口待测样品与正常奶粉的光谱角大小,并与先前建立的判定阈值作对比。如果有任一窗口的光谱角超出阈值,则判定该像素点为掺杂像素,标记为1;如果在阈值范围内,则判定该像素点为正常像素,标记为0。待测样品只要存在掺杂的像素点,则认为其为掺杂样品。在此基础上,结合像素点的位置和标记,画出包含定位信息的二值图,得到待测样品的掺杂二值图像。MWSAM-RHIM的具体流程如图1所示。
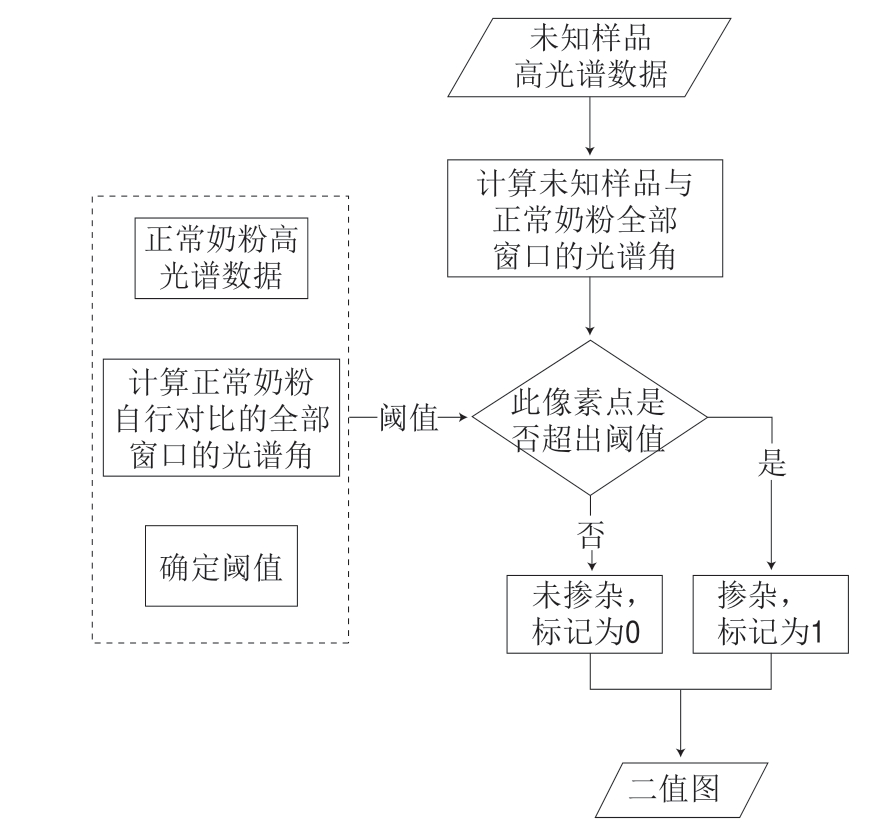
图 1 基于移动窗口光谱角制图的拉曼高光谱成像方法流程图Fig. 1 Flowchart of MWSAM-RHIM
1.3.6 方法评价指标
作为一种定性方法,采用识别率作为此方法的评价指标[3,32]。计算公式为:

式中:TP为阳性样本被正确识别为阳性的数量;TN为阴性样本被正确识别为阴性的数量;FN为阳性样本被错误识别为阴性样本的数量;FP为阴性样本被错误识别为阳性样本的数量。TP+FN即为全部阳性样本的数量,而TN+FP为全部阴性样品的数量。
2 结果与分析
2.1 确定正常乳粉判定阈值
使用1.3.2节方法计算得到的17 个窗口的阈值分别为:0.192、0.152、0.112、0.127、0.164、0.187、0.183、0.130、0.158、0.181、0.190、0.195、0.155、0.137、0.135、0.158、0.172。
2.2 基于MWSAM-RHIM的可视化非定向筛查

图 2 MWSAM-RHIM的掺杂脱脂乳粉二值成像图
Fig. 2 MWSAM-RHIM binary images of adulterated skim milk samples
A~D.分别为含有质量分数0.1%的尿素、三聚氰酸、硫脲和滑石粉的乳粉样品;图中白色点代表正常像素,深红色点表示掺杂像素。
在计算出阈值之后,将未知样品与正常乳粉进行对比,将超出阈值的像素点设置为1,没有超出的设置为0。在一共17 个窗口中,只要有其中某一窗口有超出阈值的像素点,则认为此为掺杂像素点。使用此方法画出可视化的掺杂二值成像图(空间分辨率0.3 mm),如图2和图3所示。图2表示了此方法可以在0.1%掺杂的条件下,检测出尿素、三聚氰酸、硫脲和滑石粉的掺杂情况,并可视化的标注出掺杂像素点的位置。图3则以滑石粉为例,显示了随着掺杂质量分数的升高,掺杂像素点数量也同时升高,在掺杂15%时,所有像素点都含有掺杂物质信号。


图 3 掺杂不同质量分数滑石粉的脱脂乳粉MWSAM-RHIM二值成像图
Fig. 3 MWSAM-RHIM binary images of talcum powder adulterated skim milk powders
A~F.添加滑石粉质量分数分别为0.1%、0.5%、1%、5%、8%、15%。
2.3 MWSAM-RHIM效果评价
表 2 基于MWSAM-RHIM非定向筛查模型识别率预测结果评价
Table 2 Classification rates of MWSAM-RHIM predicted results

样品 验证组 样品数量 正确分类数量 识别率/%阴性 组1 15 14 93.3阳性 组2~6 75 70 93.3
本实验使用含有15 个正常脱脂乳粉(阴性样本)和含有共计75 个掺杂样品(阳性样本)计算此方法的识别率,从而验证此方法的有效性,并将结果见表2。结果表明,MWSAM-RHIM其阴性和阳性样本识别率(特异性)均达到了93.3%,证明其非定向筛查的准确识别率可满足实际乳粉工业检测需求。另外,5 组掺杂不同质量分数梯度的掺杂物的样品被用来验证此方法的最低可检出质量分数,结果如表3所示。结果证明,其针对尿素、三聚氰酸、硫脲和滑石粉的最低可检出质量分数为0.1%,完全可以满足乳粉质量安全真实性鉴别的需求;但其对小麦粉的最低可检出质量分数仅达到3%,其原因是纯小麦粉的拉曼光谱,其荧光信号很强,且不具有特征峰。证明此方法对某些不具备特征峰的掺杂物,在其低质量分数下,存在灵敏度不足的问题,应在以后针对此问题继续发展新型的非定向筛查方法。
表 3 基于MWSAM-RHIM非定向筛查最低可检出 质量分数模型预测结果评价
Table 3 MWSAM-RHIM predicted results of lowest detectable concentrations

掺杂物质名称 验证组 添加质量分数/%可检出质量分数/%尿素 组2 0.1~5.0 0.1三聚氰酸 组3 0.1~5.0 0.1硫脲 组4 0.1~5.0 0.1滑石粉 组5 0.1~15.0 0.1小麦粉 组6 0.1~15.0 3.0
3 结 论
本研究提出了一种基于移动窗口光谱角制图的拉曼高光谱成像方法,该方法借助拉曼高光谱成像技术,将乳粉中未知掺杂物的识别问题转化为拉曼高光谱奇异像素点的识别问题;借助移动窗口光谱角制图算法,找出与正常脱脂乳粉相似度差距大于阈值的像素点,有效的弥补了传统的定向筛查方法中无法遍历所有掺杂物的问题。实验结果表明,MWSAM-RHIM能较准确地识别乳粉的阴性样品和阳性样本,以可视化的方式实现乳粉真伪的非定向筛查,并为其他食品体系的非定向筛查提供了一种新思路。
[1] KHAN K M, KRISHNA H, MAJUMDER S K, et al. Detection of urea adulteration in milk using near-infrared Raman spectroscopy[J]. Food Analytical Methods, 2014, 8(1): 93-102. DOI:10.1007/s12161-014-9873-z.
[2] GOSSNER C M, SCHLUNDT J, BEN EMBAREK P, et al. The melamine incident: implications for international food and feed safety[J]. Environmental Health Perspectives, 2009, 117(12): 1803-1808. DOI:10.1289/ehp.0900949.
[3] LIMM W, KARUNATHILAKA S R, YAKES B J, et al. A portable mid-infrared spectrometer and a non-targeted chemometric approach for the rapid screening of economically motivated adulteration of milk powder[J]. International Dairy Journal, 2018, 85: 177-183. DOI:10.1016/j.idairyj.2018.06.005.
[4] ABERNETHY G, HIGGS K. Rapid detection of economic adulterants in fresh milk by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2013, 1288: 10-20. DOI:10.1016/j.chroma.2013.02.022.
[5] HE D, ZHANG X, GAO B, et al. Preparation of magnetic molecularly imprinted polymer for the extraction of melamine from milk followed by liquid chromatography-tandem mass spectrometry[J]. Food Control, 2014, 36(1): 36-41. DOI:10.1016/j.foodcont.2013.07.044.
[6] SU X, ZHOU H Y, CHEN F C, et al. Modified SBA-15 matrices for high-throughput screening of melamine in milk samples by MALDITOF MS[J]. International Journal of Mass Spectrometry, 2013, 338: 39-44. DOI:10.1016/j.ijms.2012.11.006.
[7] 国家质量监督检验检疫总局. 原料乳与乳制品中三聚氰胺检测 方法: GB/T 22388ü 2008[S]. 北京: 中国标准出版社, 2008.
[8] BILGE G, SEZER B, ESELLER K E, et al. Determination of whey adulteration in milk powder by using laser induced breakdown spectroscopy[J]. Food Chemistry, 2016, 212 (Suppl C): 183-188. DOI:10.1016/j.foodchem.2016.05.169.
[9] CHAO K L, QIN J W, KIM M S, et al. Raman spectroscopy and imaging to detect contaminants for food safety applications[C]// Sensing for Agriculture and Food Quality and Safety V. International Society for Optics and Photonics, 2013. DOI:10.1117/12.2018616.
[10] QIN J W, CHAO K L, KIM M S, et al. Development of a Raman chemical imaging detection method for authenticating skim milk powder[J]. Journal of Food Measurement and Characterization, 2014, 8(2): 122-131. DOI:10.1007/s11694-014-9172-9.
[11] KARUNATHILAKA S R, YAKES B J, HE K, et al. First use of handheld Raman spectroscopic devices and on-board chemometric analysis for the detection of milk powder adulteration[J]. Food Control, 2018, 92: 137-146. DOI:10.1016/j.foodcont.2018.04.046.
[12] KARUNATHILAKA S R, FARRIS S, MOSSOBA M M, et al. Characterising variances of milk powder and instrumentation for the development of a non-targeted, Raman spectroscopy and chemometrics detection method for the evaluation of authenticity[J]. Food Additives & Contaminants-Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2016, 33(6): 921-932. DOI:10.1080/19440049.2016.1188437.
[13] KARUNATHILAKA S R, FARRIS S, MOSSOBA M M, et al. Non-targeted detection of milk powder adulteration using Raman spectroscopy and chemometrics: melamine case study[J]. Food Additives & Contaminants-Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2017, 34(2): 170-182. DOI:10.1080/194 40049.2016.1260168.
[14] QIN J W, CHAO K L, KIM M S. Simultaneous detection of multiple adulterants in dry milk using macro-scale Raman chemical imaging[J]. Food Chemistry, 2013, 138(2): 998-1007. DOI:10.1016/j.foodchem.2012.10.115.
[15] SCHOLL P F, BERGANA M M, YAKES B J, et al. Effects of the adulteration technique on the near-infrared detection of melamine in milk powder[J]. Journal of Agricultural and Food Chemistry, 2017, 65(28): 5799-5809. DOI:10.1021/acs.jafc.7b02083.
[16] SU W H, SUN D W. Fourier transform infrared and Raman and hyperspectral imaging techniques for quality determinations of powdery foods: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2018, 17(1): 104-122. DOI:10.1111/1541-4337.12314.
[17] QIN J W, CHAO K L, KIM M S. Raman chemical imaging system for food safety and quality inspection[J]. Transactions of the ASABE, 2010, 53(6): 1873. DOI:10.13031/2013.35796.
[18] CHAO K L, DHAKAL S, QIN J W, et al. A 1 064 nm dispersive Raman spectral imaging system for food safety and quality evaluation[J]. Applied Sciences, 2018, 8(3): 431. DOI:10.3390/app8030431.
[19] FU X P, KIM M S, CHAO K L, et al. Detection of melamine in milk powders based on NIR hyperspectral imaging and spectral similarity analyses[J]. Journal of Food Engineering, 2014, 124: 97-104. DOI:10.1016/j.jfoodeng.2013.09.023.
[20] LOHUMI S, LEE H, KIM M, et al. Raman imaging for the detection of adulterants in paprika powder: acomparison of data analysis methods[J]. Applied Sciences, 2018, 8(4): 485. DOI:10.3390/app8040485.
[21] QIN J W, KIM M S, CHAO K L, et al. Detection and quantification of adulterants in milk powder using a high-throughput Raman chemical imaging technique[J]. Food Additives & Contaminants-Part A: Chemistry, Analysis, Control, Exposure & Risk Assessment, 2017, 34(2): 152-161. DOI:10.1080/19440049.2016.1263880.
[22] QIN J W, CHAO K L, KIM M S, et al. Line-scan macro-scale Raman chemical imaging for authentication of powdered foods and ingredients[J]. Food and Bioprocess Technology, 2015, 9(1): 113-123. DOI:10.1007/s11947-015-1605-x.
[23] 卫生部. 乳粉: GB 19644ü 2010[S]. 北京: 中国标准出版社, 2010.
[24] DAS R S, AGRAWAL Y K. Raman spectroscopy: recent advancements, techniques and applications[J]. Vibrational Spectroscopy, 2011, 57(2): 163-176. DOI:10.1016/j.vibspec.2011.08.003.
[25] KRUSE F A, LEFKOFF A, BOARDMAN J, et al. The spectral image processing system (SIPS): interactive visualization and analysis of imaging spectrometer data[J]. Remote Sensing of Environment, 1993, 44(2/3): 145-163. DOI:10.1016/0034-4257(93)90013-N.
[26] 孙娅琴, 田淑芳, 王兴振, 等. 基于光谱匹配的热红外高光谱数据岩性分类研究[J]. 现代地质, 2016, 30(1): 239-246.
[27] 甘茜. 红外成像光谱仪的数据处理算法研究 [D]. 武汉: 华中科技 大学, 2017: 11-12.
[28] CHENG W, SUN D W, PU H, et al. Characterization of myofibrils cold structural deformation degrees of frozen pork using hyperspectral imaging coupled with spectral angle mapping algorithm[J]. Food Chemistry, 2018, 239: 1001-1008. DOI:10.1016/j.foodchem.2017.07.011.
[29] CALIN M A, PARASCA S V, MANEA D. Comparison of spectral angle mapper and support vector machine classification methods for mapping skin burn using hyperspectral imaging[C]//Unconventional Optical Imaging, International Society for Optics and Photonics, 2018.DOI:10.1117/12.2319267.
[30] FARKAS A, NAGY B, DÉMUTH B, et al. Variable clustering and spectral angle mapper-orthogonal projection method for Raman mapping of compound detection in tablets: variable clustering for Raman mapping of compound detection in tablet[J]. Journal of Chemometrics, 2017, 31(1): e2861. DOI:10.1002/cem.2861.
[31] LOHUMI S, LEE S, LEE H, et al. Application of hyperspectral imaging for characterization of intramuscular fat distribution in beef[J]. Infrared Physics & Technology, 2016, 74: 1-10. DOI:10.1016/j.infrared.2015.11.004.
[32] 禇小立. 化学计量学方法与分子光谱分析技术[M]. 北京: 化学工业出版社, 2011: 106-108.