油脂在高温下会发生氧化[1]、水解[2]、聚合[3]等热质变反应,产生比甘油三酯极性大的极性部分(polar components,PC)[4],包括甘油三酯氧化寡聚物(oxidized oligomeric triacylglycerols,TGO)、甘油三酯氧化二聚物(oxidized dimeric triacylglycerols,TGD)、甘油三酯氧化单体(oxidized monomeric triacylglycerols,ox-TGM)[5]、甘油二酯(diacylglycerols,DG)以及游离脂肪酸(free fatty acids,FFA)等组分。其中TGO和TGD是甘油三酯热氧化聚合产物[6],ox-TGM是热氧化产物,DG、单甘酯(monoacylglycerols,MG)以及FFA为热水解产物。高温条件下,甘油三酯也发生热聚合反应产生仅通过Cü C键聚合的非极性(nonpolar components,Non-PC)甘油三酯聚合物[7]。油脂中PC组分含量的高低是目前评价煎炸油氧化程度的最佳指标,其中甘油三酯氧化聚合物(oxidized triacylglycerol polymers,TGP)的含量在油脂精炼过程中“只增不减”[8-9],是一类难以去除的、反映热处理程度与存放时间长短的特征性内源性热氧化聚合产物,因此利用TGP含量高低甄别煎炸油脂[10]、劣质油脂、过期油脂、新鲜油脂等,有助于鉴伪食用油脂[11]、评价油脂氧化程 度[12-13]、油脂质量控制[14-15]等方面。
目前检测油脂中TGP含量的标准方法包括ISO方法[16] 和AOCS方法[17],但这2 种方法不能把油脂中极性的热氧化聚合产物和非极性的热聚合产物分开,且只适用于TGP含量高于3%的油脂。为解决这些问题,又出现不少改进方法,包括硅胶柱层析(silica columns,SC)-体积排阻色谱(high-performance size-exclusion chromatography,HPSEC)法[18-19]、小型硅胶柱层析(silica minicolumns,SMC)-HPSEC法[20-21]、固相萃取(solid-phase extraction,SPE)-HPSEC法[22]、制备型快速柱层析(preparative flash chromatography,PFC)-HPSEC法[23]等,其共同点是采用硅胶等吸附材料预先吸附PC、洗脱(即吸附色谱)分离Non-PC后,再通过体积排阻色谱柱,依据分子质量大小分离PC中的TGO、TGD、ox-TGM、DG、FFA。但在使用硅胶柱、小型硅胶柱、固相萃取预分离PC时,必然会有一定程度的样品丢失、增加氧化反应、增加操作误差等而影响测定结果的准确性。另外,这些预分离措施需要相应的仪器、试剂,也存在增加操作时间等弊端[24]。为此,本实验拟采用“双柱法”直接测定TGP,即将正向硅胶柱与凝胶柱先后串联,高效液相色谱(high performance liquid chromatography,HPLC)测定时直接进样,再经梯度洗脱准确、快速、方便地测定TGO、TGD、ox-TGM、DG、FFA等PC组分。此方法无需预分离步骤且能够快速、简便、准确测定油脂中TGP的含量,有益于控制、评价油脂的质量与安全。
1 材料与方法
1.1 材料、试剂与仪器
自制废弃食用植物油样品:橄榄油、花生油、澳洲坚果油。
PC、Non-PC标准样品 自制;四氢呋喃(色谱纯)、石油醚(沸程60~90 ℃,色谱纯) 克鲁德化工股份有限公司;DL-1,2-二棕榈精(标准品) 西格玛奥德里奇上海贸易有限公司;三油酸甘油酯(标准品) Alfa Aesar化学有限公司。
LC-20A nence HPLC仪(配有蒸发光散射检测器) 日本岛津公司;Luna Silica(2)色谱柱(250 mmh 4.6 mm,5 μm)、PhenogelTM体积排阻凝胶色谱柱(300 mmh 7.8 mm,5 μm,100 Å) 美国Phenomenex公司;薄层色谱(thin layer chromatography,TLC)板 德国Merck公司;X500 QTOF高分辨质谱系统 美国Sciex公司。
1.2 方法
1.2.1 配制聚合物混合标准溶液
按照GB 5009.202ü 2016《食用植物油煎炸过程中的极性组分(PC)的测定》[25]中第二法分离制备PC部分和Non-PC部分[26]。为考察线性范围、检出限以及定量限,准确称取200 mg PC样品,用10 mL四氢呋喃溶成20 000 mg/L的PC标准母液,连续稀释配成PC质量浓度分别为5 000、4 000、3 333、2 500、2 000、1 666、1 250、625、312、267、234、208、187、156、78、39、20、10 mg/L的系列标准样品上样液,HPLC测定后,外标法绘制标准曲线。
1.2.2 外标法样品配制以及加标DG样品制备
制备一系列质量浓度分别为4 320、3 600、2 700、1 350、675、338、169 mg/L的DG标准溶液,每个质量浓度连续进样3 次,制作外标标准曲线。
测定10 000 mg/L的PC标准溶液中DG的含量作为本底值,用微量移液器分别移取60 μL质量浓度分别为675、1 350、2 700 mg/L的DG标准品溶液,加入60 μL PC标准溶液(已知其中DG的质量浓度)中作为加标样品,平行制备3 份,用于考察双柱法的回收率。
1.2.3 TLC分离油脂中的PC和Non-PC部分测定
依照GB 5009.202ü 2016附录C中PC和Non-PC分离效果的TLC验证法,将其中TLC展开剂改为石油醚、四氢呋喃,改变石油醚和四氢呋喃的比例分别为0∶100、5∶95、10∶90、15∶85、20∶80、30∶70、40∶60、70∶30、80∶20、100∶0,验证PC和Non-PC的分离效果,大致确定HPLC测定程序,TLC展开剂的比例如表1所示。
表 1 双柱法测试程序方法
Table 1 Elution program for HPLC with two tandem columns
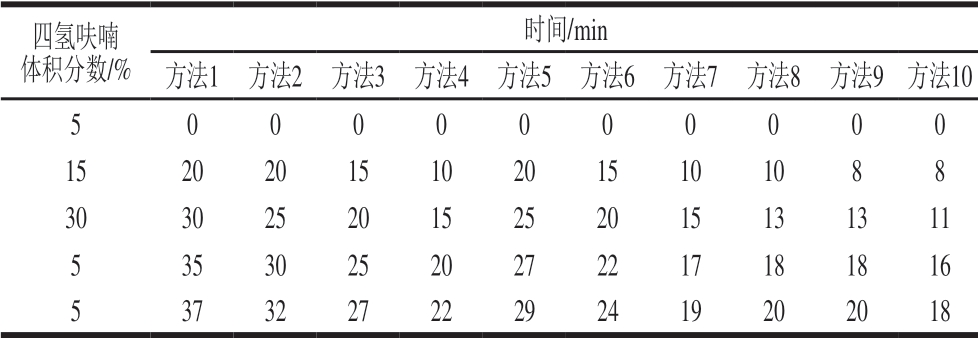
四氢呋喃体积分数/%时间/min方法1 方法2 方法3 方法4 方法5 方法6 方法7 方法8 方法9 方法10 5 0 0 0 0 0 0 0 0 0 0 15 20 20 15 10 20 15 10 10 8 8 30 30 25 20 15 25 20 15 13 13 11 5 35 30 25 20 27 22 17 18 18 16 5 37 32 27 22 29 24 19 20 20 18
1.2.4 HPLC梯度洗脱方法设计
根据TLC分离结果,设计HPLC洗脱方法1,并进行HPLC测试,然后根据方法1的测试结果进行方法调整,得到表1中的一系列洗脱方法。测试样品PC质量浓度为5 000 mg/L,Non-PC质量浓度为22 000 mg/L。
1.2.5 HPLC分析条件
将Phenomenex Luna Silica(2)色谱柱(250 mmh 4.6 mm,5 μm)和PhenogelTM体积排阻凝胶色谱柱(300 mmh 7.8 mm,5 μm,100 Å)先后串联,进样量7 μL,流速0.7 mL/min,流动相为四氢呋喃和石油醚,检测器为蒸发光散射检测器,检测器以干燥洁净的压缩空气为雾化气体,压力0.5 MPa,气体流速2.4 L/min,漂移管温度90 ℃,增益值1。
梯度洗脱条件:流动相分别为石油醚(A)和四氢呋喃(B);梯度洗脱程序为0 min、5% B,20 min、15% B,30 min、30% B,35 min、5% B;流速 0.7 mL/min;测定时间50 min。
1.2.6 质谱定性检测TGP条件
按1.2.5节方法对自制PC标准样品进行HPLC测定,记录每个峰的出峰时间,收集每个流出峰进行质谱测定(由于35 min后第1个峰的起止时间太短,将第1个峰和第2个峰一起接出)。
质谱条件:电喷雾离子源,正离子模式;气帘气压力30 psi;离子化电压5 500 V;离子源温度550 ℃;电喷雾气压力50 psi;辅助加热气压力60 psi;质量扫描范围m/z 50~5 000。
1.3 数据统计与分析
油脂各组分的HPLC色谱图以及多组色谱叠加图由岛津的Labsoluton软件处理生成,双柱法的回收率、重复性、误差、工作曲线,以及相关表格的数据处理,均采用Excel 2016软件进行处理。
2 结果与分析
2.1 双柱法测定条件的确定
2.1.1 TLC确定适宜展开剂

从左到右四氢呋喃与石油醚-乙酸体积比分别为0∶100∶2、5∶95∶2、10∶90∶2、15∶85∶2、20∶80∶2、30∶70∶2、40∶60∶2、60∶40∶2、70∶30∶2、80∶20∶2、100∶0∶2。1. PC;2. Non-PC;3.样品油。
从图1可看出,当四氢呋喃体积分数高于30%时,PC与前沿的Non-PC未分开,其Rf值约为1;当四氢呋喃体积分数低于30%时,PC能与Non-PC分开,但PC和Non-PC部分连在一起,但若在HPLC仪分析时采用选择梯度洗脱,两者分离效果应该能够改善。根据TLC分离效果最好在Rf约为0.3的原则[27],故将洗脱程序从5%的四氢呋喃开始,在20 min内,四氢呋喃的体积分数逐渐升到15%,使PC和Non-PC快速分开,但为了防止PC出峰时间太晚,快速将四氢呋喃的体积分数在5 min内提升到30%,最后在5 min内把四氢呋喃的体积分数降回5%(表1方法1)。
2.1.2 洗脱方法的选择

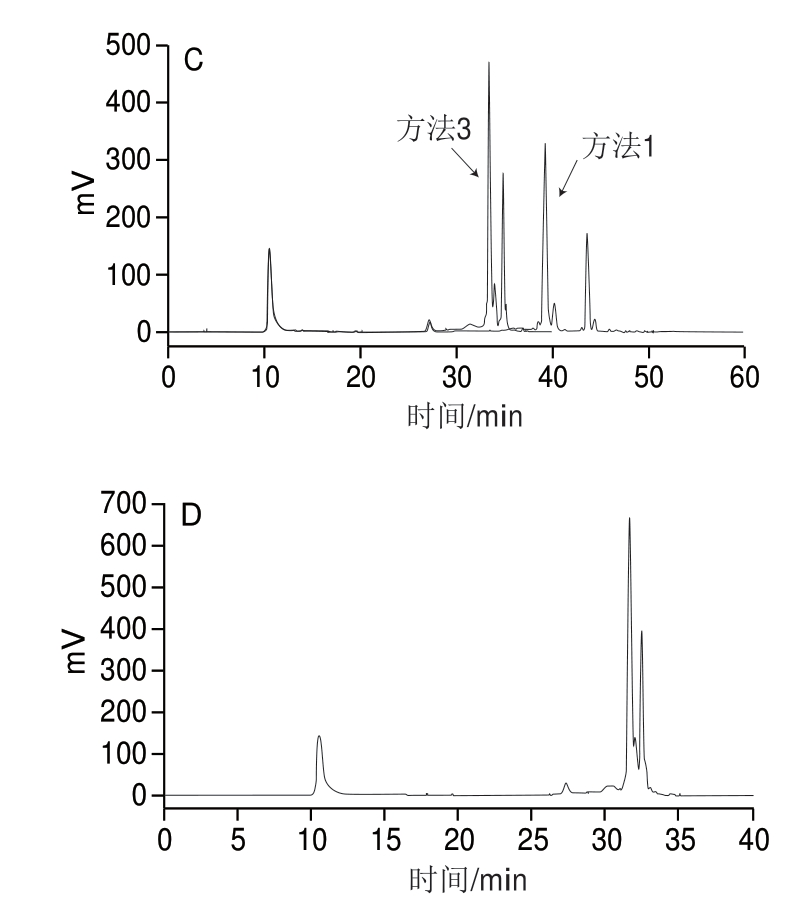
图 2 洗脱方法对比色谱图
Fig. 2 Comparison of several elution methods
A. Non-PC按方法1洗脱色谱图;B. PC按方法1洗脱色谱图;C.方法1和方法3的分离效果对比;D.方法9色谱图。
如图2A、B所示,洗脱的总时间达到50 min,但PC和Non-PC之间的时间间隔接近20 min,由此考虑有可能总的检测时间可以达到更短,所以优化得到其他方法。如图2C所示,方法3的时间有所缩短,但对比分离度方 法1更高。其余方法没有有效的分离效果,如图2D所示。因此最终采用方法1作为最终的方法;但从实际效果看,最优条件仍有待进一步优化。
2.2 PC各组分的定性
虽然检测油脂中TGP含量的标准方法包括ISO方法[5]和AOCS方法[6],都对PC各组分的定性有具体规定,但由于双柱法受柱子吸附、分子筛双因素的影响,其定性规律应当与这些方法有所不同。因此,有必要对双柱法的各峰进行定性。
2.2.1 DG的确定
如图3A所示,外标物DG保留时间为42.719 min,对比PC样品(图3B)中第4个峰,两峰的保留时间一致,根据保留时间一致、物质性质一致的定性原则[28],确定图3B中第4个峰为DG。


图 3 PC组分定性色谱图
Fig. 3 Qualitative chromatograms of polar components
A.甘二酯的定性色谱图;B. TGO、TGD、ox-TGM、DG定性色谱图。
2.2.2 TGO与TGD的确定
35 min后第1峰与第2个峰分子质量分布在900~2 200 Da之间,由于TGO、TGD分别比ox-TGM单体平均相对分子质量的3 倍小180~225 Da、2 倍小80~105 Da[29],且TGO的分子质量(其分子质量约为2 300~2 500 Da)比较大,在凝胶柱上应该早于TGD出现(其分子质量约为1 500~1 800 Da),由此两点判断出图3B中35 min后的第1个峰为TGO,保留时间为39.355 min,第2个峰为TGD,保留时间为40.043 min。
2.2.3 ox-TGM的确定
35 min后出现的第3个峰分子质量在700~1 300 Da之间,其中分子质量在800~1 000 Da的比较多,与ox-TGM的分子质量(其分子质量约为800~1 000 Da)范围一致。此外,ox-TGM的极性比DG小,所以其出峰时间应早于DG(在正相柱上,极性强的出峰迟),且ox-TGM的分子质量也比TGP小,所以应在TGP后出峰。根据这两点可以推断出图3B中第3个峰为ox-TGM,保留时间为41.004 min。
由上述分析可知,本双柱法PC出峰的顺序依次为TGO、TGD、ox-TGM、DG,本实验条件下,其保留时间依次为39.355、40.403、41.004、42.719 min,与标准方法(ISO方法、AOCS方法、IUPAC方法)的出峰顺序一致。
2.3 PC各组分的定量
2.3.1 外标法标准曲线经双柱法得到的标准曲线方程为y=0.29x2+2 046x-204 904,相关系数R2为0.998 4(P<0.01,显著相关)。
2.3.2 双柱法的标准曲线范围、检出限和定量限结果
以TGP的峰面积为纵坐标,PC组分标准溶液的质量浓度为横坐标,得到标准曲线方程为y=0.484 4x2+848.95x-352 438,相关系数R2为0.999 5。逐级稀释标准PC组分溶液,信噪比为3时所对应的质量浓度即为检出限,信噪比为10时对应的质量浓度为定量限。本方法TGD的检出限为156 mg/L,定量限为267 mg/L。
2.3.3 双柱法的精确度与回收率结果
表 2 双柱法分离油脂DG的加标回收率
Table 2 Recoveries and RSDs of DG spiked samples

理论DG质量浓度/(mg/L)回收率/% 平均回收率/% RSD/%1 2 3 479 96.89 97.54 99.30 97.22 1.24 817 96.20 95.83 99.04 97.44 1.75 1 492 95.41 98.70 96.23 95.82 1.71
对3 个质量浓度水平的加标DG样品(理论质量浓度分别为479、817 mg/L和1 492 mg/L)进行回收实验,如表2所示,DG的回收率在95%~99%之间,3 个平行样品之间的相对标准偏差(relative standard deviation,RSD)均小于2%。
2.3.4 双柱法测定TGP的重复性结果
选用橄榄油、澳洲坚果油、花生油3 种废弃植物油样品,采用双柱法测试,每个样品分别连续进样5 次。如表3所示,橄榄油、澳洲坚果油、花生油的RSD分别为2.266 5%、2.711 3%、2.344 1%,3 种废弃油的RSD均小于3%,表明此方法的重复性良好。
表 3 双柱法测定TGP的重复性
Table 3 Repeatability of the developed method

样品 TGP相对含量/% 平均值/% RSD/%1 2 3 4 5橄榄油 2.718 2 2.879 7 2.823 5 2.771 1 2.845 3 2.807 56 2.266 5澳洲坚果油 1.564 6 1.648 2 1.661 8 1.695 8 1.671 6 1.648 4 2.711 3花生油 0.420 4 0.435 7 0.430 5 0.450 1 0.425 9 0.432 52 2.344 1
2.4 双柱法与标准方法的比较
双柱法定量油脂中TGP含量的方法,与标准方法(ISO方法、AOCS方法[30]、IUPAC方法)相比,无与分离过程、用样量少、节省时间、操作简便,具有多方面的优点。由表4可以看出,双柱法除具有前述的准确、快速、高效特点外,还具有节省时间、试材、设备等多方面的优点。
表 4 各类分离方法对比
Table 4 Comparison of advantages and disadvantages of various separation methods
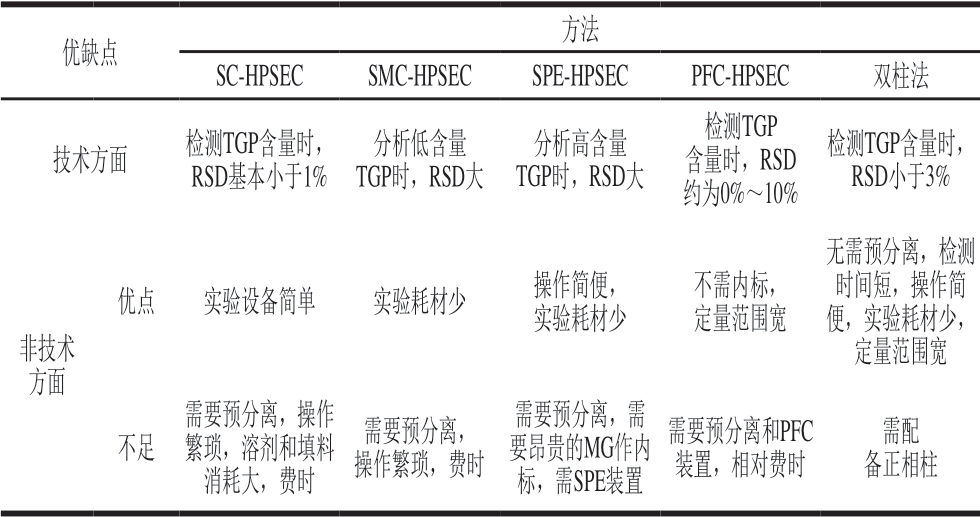
优缺点 方法SC-HPSEC SMC-HPSEC SPE-HPSEC PFC-HPSEC 双柱法技术方面 检测TGP含量时,RSD基本小于1%分析低含量TGP时,RSD大分析高含量TGP时,RSD大检测TGP含量时,RSD约为0%~10%检测TGP含量时,RSD小于3%非技术方面优点 实验设备简单 实验耗材少 操作简便,实验耗材少不需内标,定量范围宽无需预分离,检测时间短,操作简便,实验耗材少,定量范围宽不足需要预分离,操作繁琐,溶剂和填料消耗大,费时需要预分离,操作繁琐,费时需要预分离,需要昂贵的MG作内标,需SPE装置需要预分离和PFC装置,相对费时需配备正相柱
3 结 论
建立双柱法定量检测油脂中TGP含量的方法,本方法无需预分离油脂中的PC,直接进样即可,总测定时间为50 min,缩短了检测时间,方法的精密度、重复性、线性关系均满足定性定量要求,适用于油脂中TGP的定量检测。
[1] 刘海兰, 刘玉兰, 陈刚, 等. 油脂煎炸过程质量安全风险研究进展[J]. 中国油脂, 2017, 42(11): 110-114. DOI:10.3969/j.issn.1003-7969.2017.11.023.
[2] 王进英, 钟海雁, 周波. 油脂在深度煎炸过程中发生的化学反应及其主要产物[J]. 中国油脂, 2015, 40(11): 37-43. DOI:10.3969/j.issn.1003-7969.2015.11.008.
[3] 冯红霞. 大豆油煎炸过程中极性化合物的衍变规律及结构特性 解析[D]. 哈尔滨: 东北农业大学, 2016: 91-92.
[4] TAKEOKA G R, FULL G H, DAO L T. Effect of heating on the characteristics and chemical composition of selected frying oils and fats[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 3244-3249. DOI:10.1021/jf970111q.
[5] 耿曼璐, 赵贝贝, 兰韬, 等. 食用油甘油三酯及其氧化聚合物分析方法研究进展[J]. 中国油脂, 2017, 42(1): 134-138. DOI:10.3969/j.issn.1003-7969.2017.01.032.
[6] 柳明, 李晶, 张彬, 等. 食用油中甘油三酯聚合物含量测定[J]. 食品研究与开发, 2015(1): 85-88. DOI:10.3969/j.issn.1005-6521.2015.01.022.
[7] 曹文明, 薛斌, 曹洁, 等. 氧化甘油三酯聚合物与油脂氧化程度关联性[J]. 粮食与油脂, 2011, 24(4): 1-5. DOI:10.3969/j.issn.1008-9578.2011.04.001.
[8] 吴颖. 沪初步建立地沟油两分钟筛查法[N]. 粮油场报, 2011-10-21(002).
[9] 曹文明, 薛斌, 王文高, 等. 高效体积排阻色谱测定油脂中氧化甘油三酯聚合物[J]. 中国油脂, 2011, 36(10): 57-58.
[10] 仇兆倩, 曹文明, 吴莹, 等. TGP在煎炸油质量评价中的应用研究[J]. 粮食与油脂, 2017, 30(6): 91-92.
[11] 陈凤香, 曹文明, 吴莹, 等. 氧化甘油三酯聚合物含量在冷榨油鉴别中的应用研究[J]. 粮食与油脂, 2018, 31(3): 34-36. DOI:10.3969/j.issn.1008-9578.2018.03.009.
[12] GOMES T, DELCURATOLO D, PARADISO V M, et al. Pro-oxidant activity of oxidized triacylglycerols in olive oil and comparison with pro-oxidant action of polar triacylglycerol oligopolymers[J]. LWTFood Science and Technology, 2011, 44(4): 1236-1239. DOI:10.1016/j.lwt.2010.12.004.
[13] MARMESAT S, RODRIGUES E, VELASCO J, et al. Quality of used frying fats and oils: comparison of rapid tests based on chemical and physical oil properties[J]. International Journal of Food Science & Technology, 2010, 42(5): 601-608. DOI:10.1111/j.1365-2621.2006.01284.x.
[14] RUIZ-MÉNDEZ M V, MÁRQUEZ-RUIZ G, DOBARGANES M C. Relationships between quality of crude and refined edible oils based on quantitation of minor glyceridic compounds[J]. Food Chemistry, 1997, 60(4): 549-554. DOI:10.1016/s0308-8146(97)00029-0.
[15] 安柯静, 刘玉兰, 马宇翔, 等. 3 种油脂煎炸过程极性组分与甘油三酯聚合物及多环芳烃相关性研究[J]. 中国油脂, 2018, 43(1): 70-75. DOI:10.3969/j.issn.1003-7969.2018.01.019.
[16] Animal and vegetable fats and oils. Determination of polymerized triacylglycerols by high-performance size-exclusion chromatography (HPSEC)[S]. ISO International Standard, 2009.
[17] AOCS Official Method Cd 22-91. Determination of polymerized triglycerides by gel-permeation HPLC[S]. AOCS Press, 2009.
[18] International Union of Pure and Applied Chemistry, Blackwell, Oxford. Determination of polar compounds in frying fats. Standard methods for the analysis of oils, fats and derivatives[J]. Pure and Applied Chemistry, 1979, 51(12): 2503-2526. DOI:10.1351/pac197951122503.
[19] DOBARGANES M C, VELASCO J, DIEFFENBACHER A. Determination of polar compounds, polymerized and oxidized triacylglycerols, and diacylglycerols in oils and fats: results of collaborative studies and the standardized method (technical report)[J]. Pure and Applied Chemistry, 2000, 72(8): 1563-1575. DOI:10.1351/pac200072081563.
[20] DOBARGANES M C, VELASCO J, DIEFFENBACHER A. Determination of polar compounds, polymerized and oxidized triacylglycerols and diacylglycerols in oils and fats[J]. Pure and Applied Chemistry, 2000, 72(8): 1563-1575.
[21] GERTZ C. Determination of polymerized (dimeric and oligomeric) triglycerides content at low level[J]. European Journal of Lipid Science and Technology, 2001, 103(3): 181-184. DOI:10.1002/1438-9312(200103)103:3<181::aid-ejlt181>3.0.co;2-h.
[22] MÁRQUEZ-RUIZ G, JORGE N, MARTÍN-POLVILLO M, et al. Rapid, quantitative determination of polar compounds in fats and oils by solid-phase extraction and size-exclusion chromatography using monostearin as internal standard[J]. Journal of Chromatography A, 1996, 749(1/2): 55-60. DOI:10.1016/0021-9673(96)00429-3.
[23] 曹文明, 薛斌, 陈凤香, 等. 三酰甘油氧化聚合物的制备型快速柱层析-体积排阻色谱测定法[J]. 分析测试学报, 2012, 31(8): 933-939. DOI:10.3969/j.issn.1004-4957.2012.08.008.
[24] 曹文明. 三酰甘油氧化聚合物的检测、评价及应用[D]. 无锡: 江南大学, 2013: 17-18.
[25] 卫生部. 食用植物油煎炸过程中的极性组分(PC)的测定: GB/T 5009.202ü 2003[S]. 北京: 中国标准出版社, 2003: 1-3.
[26] 印瑜洁, 薛斌. 硅胶柱层析分离煎炸油中极性和非极性组分的研究[J]. 粮食与油脂, 2016, 29(6): 72-74. DOI:10.3969/j.issn.1008-9578.2016.06.019.
[27] 刘宝月. 自动化真空液相色谱装置设计及其在中药组分分离纯化中的应用[D]. 大连: 大连工业大学, 2015: 22-23.
[28] 陈家华. 现代食品分析新技术[M]. 北京: 化学工业出版社, 2005: 109.
[29] 薛斌, 曹文明. 高效体积排阻色谱测定氧化甘油三酯聚合物相对分子质量[J]. 中国油脂, 2013, 38(10): 87-90. DOI:10.3969/j.issn.1003-7969.2013.10.023
[30] CALDWELL J D, COOKE B S, GREER M K. High performance liquid chromatography-size exclusion chromatography for rapid analysis of total polar compounds in used frying oils[J]. Journal of the American Oil Chemists’ Society, 2011, 88(11): 1669-1674. DOI:10.1007/s11746-011-1845-5.