葛氏鲈塘鳢(Perccottus glenii),塘鳢科,鲈塘鳢属,俗名老头鱼、沙姑鲈子,是我国北方地区一种小型底栖肉食性土著鱼类,主要分布于黑龙江、图门以及辽河水系。与一般淡水鱼相比,葛氏鲈塘鳢生命力强、极耐缺氧、肉质细嫩、无肌间刺,是最受消费者青睐的淡水鱼类品种之一[1]。但其头部大,肉质少,经常被丢弃。
糖类的研究重点已经从单纯的结构研究转向构效关系。研究表明多糖具有抗氧化[2]、抗疲劳[3]、抑制肿瘤[4]、抑菌[5]、提高人体免疫力[6]、降血压[7]、降血糖[8]等生物活性。在动物多糖方面,仅集中于部分水产品,如鲍鱼内脏[9]、牡蛎肉[10]、池沼公鱼多糖[11-12]等方面的研究,而对于葛氏鲈塘鳢鱼头多糖(polysaccharide from Perccottus glenii head,PGP)的研究鲜见报道。
目前,已有研究表明淡水鱼鱼头中含有较高含量的多糖[13]。因此,本实验研究PGP的制备工艺、结构表征及生物活性,为副产物资源的综合利用提供数据支持。
1 材料与方法
1.1 材料与试剂
新鲜的葛氏鲈塘鳢购于长春市同鑫水产批发市场,取鱼头洗净分装于真空包装袋中,-20 ℃保存。
牛血清白蛋白(bovine serum albumin,BSA)、阿卡波糖、血管紧张素I转换酶(angiotensin converting enzyme,ACE)、α-葡萄糖苷酶、对硝基苯-α-D-半乳糖吡喃葡萄糖苷(p-nitrobenzene-α-D-galactose glucopyranoside,PNPG)、马尿酰-组氨酰-亮氨酸(horseuria-histamine-leucine,HHL) 美国Sigma公司;胃蛋白酶、木瓜蛋白酶 上海源叶生物有限公司;有机溶剂均为分析纯。
1.2 仪器与设备
H-2050R离心机 湖南湘仪离心机仪器有限公司;FD-80型真空冷冻干燥机 北京博医康实验仪器有限公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限公司;IR RESTIGE-21傅里叶变换红外光谱仪 日本岛津公司;XL-30 ESEM FEG扫描电子显微镜 美国FEI公司;6890-5975型气相色谱-质谱联用仪美国Agilent公司。
1.3 方法
1.3.1 多糖提取
取葛氏鲈塘鳢鱼头(100 g)洗净沥干,破碎机破碎;按料液比1∶3(g/mL)加入石油醚浸泡(30 ℃、 2 h);按料液比1∶2(g/mL)加入生理盐水匀浆10 min;4 ℃离心(3 800×g、15 min)后,获得沉淀物和上清液1;沉淀物中加入5 倍体积0.1 mol/L的NaOH溶液进行碱解(30 ℃、8 h),随后4 ℃离心(3 800×g、15 min),获得上清液2;合并上清液1和上清液2,旋转蒸发,抽滤去杂,获得浓缩液;浓缩液中加入4 倍体积的95%乙醇溶液(4 ℃、12 h);醇沉后离心(3 800×g、15 min),将沉淀冷冻干燥,获得PGP。
1.3.2 多糖得率与含量测定
1.3.2.1 多糖得率的测定
按式(1)计算多糖得率[14]:
1.3.2.2 总糖含量的测定
采用苯酚-硫酸法[15]。在波长490 nm处测定吸光度,以葡萄糖为对照品绘制标准曲线,回归方程为Y=0.011 08X+0.000 4,R2=0.999 6。式中:X为质量浓度(mg/mL),Y为吸光度。根据回归方程计算样品总糖的质量浓度,按式(2)计算总糖质量分数:
1.3.2.3 蛋白含量的测定
采用考马斯亮蓝法[16]。在波长595 nm处测定吸光度,以BSA为标准品绘制标准曲线,回归方程为Y=0.006 6X+0.009 6,R2=0.999。式中:X为质量浓度(mg/mL);Y为吸光度。根据回归方程计算样品蛋白质的质量浓度,按式(3)计算蛋白质量分数:
1.3.2.4 脂肪含量及脱除率的测定
分别制备葛氏鲈塘鳢鱼头未脱脂和经石油醚脱脂的粗多糖,对2 种多糖采用索氏抽提法[16]按式(4)、(5)计算脂肪质量分数和脱除率:

1.3.3 PGP脱蛋白工艺筛选
采用Sevag法、胃蛋白酶法、胃蛋白酶法与Sevag法联用、木瓜蛋白酶法以及木瓜蛋白酶法与Sevag法联用脱除蛋白质。按式(6)~(8)计算蛋白脱除率、多糖损失率及羟自由基半清除率,以衡量脱蛋白效果。

式中:A0为蒸馏水代替样品的吸光度;Ax为样品组的吸光度;Ax0为蒸馏水代替H2O2的吸光度。
1.3.3.1 Sevag法
参照伍善广等[17]的方法,采用Sevag试剂(氯仿-正丁醇(4∶1,V/V))对PGP样品进行脱蛋白处理,重复操作6 次,每次均取出一定量的上层水溶液测定并按式(6)~(8)计算蛋白脱除率、多糖损失率及羟自由基半清除率。
1.3.3.2 胃蛋白酶法
参照李冬梅[18]的方法,加入2%胃蛋白酶对PGP样品进行酶解脱蛋白处理,离心取上清液测定并按式(6)~(8)计算蛋白脱除率、多糖损失率及羟自由基半清除率。
1.3.3.3 胃蛋白酶与Sevag法联用
根据1.3.3.2节获得胃蛋白酶脱蛋白多糖溶液,再根据1.3.3.1节Sevag法进行一次脱蛋白处理,测定并按式(6)~(8)计算蛋白脱除率、多糖损失率及羟自由基半清除率。
1.3.3.4 木瓜蛋白酶法
参照于晓红等[19]的方法,加入2%木瓜蛋白酶对PGP样品进行酶解处理。离心取上清液测定并按式(6)~(8)计算蛋白脱除率、多糖损失率及羟自由基半清除率。
1.3.3.5 木瓜蛋白酶与Sevag法联用
根据1.3.3.4节获得木瓜蛋白酶脱蛋白多糖溶液,再根据1.3.3.1节的Sevag法进行一次脱蛋白处理。测定并按式(6)~(8)计算蛋白脱除率、多糖损失率及羟自由基半清除率。
将5 种脱蛋白方法建组对比,分析最优脱蛋白工艺。将PGP脱蛋白溶液进行醇沉、离心、透析、冷冻干燥,获得脱蛋白多糖(deproteinized polysaccharides from Perccottus glenii head,PGP-D)。
1.3.4 单糖组成测定
1.3.4.1 多糖的水解
精确称取10 mg PGP-D于反应釜中,加入2 mL的4 mol/L三氟乙酸溶液,置于烘箱内110 ℃水解3 h,冷却至室温,放入真空干燥箱70 ℃减压干燥。
1.3.4.2 多糖的衍生
向经水解干燥的PGP-D中加入1 mL吡啶后,立即加入1 mL硅烷化试剂,防止空气中的水分进入。振荡充分溶解后,于50 ℃恒温干燥箱中反应40 min,冷却至室温,取上清液进行气相色谱-质谱联用测定其单糖组成。
1.3.4.3 气相色谱-质谱检测条件
气相色谱条件:DB-5MS色谱柱(30 m×0.25 mm,0.25 μm);进样口温度280 ℃;接口温度280 ℃;载气为氦气;柱压73.0 kPa;柱流量1 mL/min;分流比10∶1;程序升温:80 ℃保持3 min,以10 ℃/min升至280 ℃,保持5 min,进样量1 μL。
质谱条件:离子源温度200 ℃,质量扫描范围m/z 20~800。
1.3.5 紫外光谱测定
用蒸馏水配制质量浓度为0.050 mg/mL的PGP-D溶液,注入石英比色皿中,使用紫外-可见分光光度计,以蒸馏水校准基线,在190~400 nm内进行全波长扫描[20]。
1.3.6 傅里叶变换红外光谱测定
将PGP-D与KBr按质量比1∶100充分研磨混匀后压片。以KBr为空白,置于傅里叶变换红外光谱仪,在4 000~400 cm-1区间内进行红外光谱扫描[21]。
1.3.7 扫描电镜观察
样品进行镀金后,采用扫描电子显微镜观察PGP和PGP-D表面的微观形态[22]。
1.3.8 体外生物活性测定
1.3.8.1 羟自由基清除能力测定
参照Fan Jing等[23]的方法,以VC为阳性对照,采用Fenton反应体系测定不同质量浓度(0、2、4、6、8、10 mg/mL)多糖样品溶液对羟自由基的清除能力,按式(8)计算。
1.3.8.2 总还原能力测定
参照Hu Haobin等[24]的方法,以VC为阳性对照,测定不同质量浓度(0、2、4、6、8、10 mg/mL)的多糖样品溶液的总还原能力。在波长700 nm处测定溶液的吸光度,吸光度越大代表还原能力越强。
1.3.8.3 α-葡萄糖苷酶抑制活性测定
参照Zhang Ziling[25]、徐静珠[26]等的方法,采用PNPG比色法测定不同质量浓度(0、2、4、6、8、10 mg/mL)的多糖样品溶液对α-葡萄糖苷酶的抑制能力。在波长400 nm处测定酶作用下释放出硝基酚含量的吸光度。样品对α-葡萄糖苷酶抑制率按式(9)计算。
式中:Aa为对照组的吸光度;Ab为对照空白组的吸光度;Ac为样品组的吸光度;Ad为样品空白组的吸光度。
1.3.8.4 ACE抑制活性测定
参照Tan[27]、张梦娟[28]等的方法,测定不同质量浓度(0、2、4、6、8、10 mg/mL)多糖样品溶液对ACE的抑制能力。在波长228 nm处测定吸光度,ACE抑制率按式(10)计算:
式中:Aa为ACE和ACE抑制剂同时存在的吸光度;Ab为不加抑制剂的吸光度;Ac为ACE和HHL空白反应的吸光度。
1.4 数据分析与处理
实验重复3 次,结果以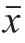 ±s表示,采用Excel软件对数据进行处理、Origin 8.0软件作图。
±s表示,采用Excel软件对数据进行处理、Origin 8.0软件作图。
2 结果与分析
2.1 PGP理化性质
PGP得率为8.2%,总糖质量分数为11.5%,蛋白质量分数为69.9%,未脱脂脂肪质量分数为0.6%,脱脂脂肪质量分数为0.1%,脱脂率为83.3%。
2.2 PGP脱蛋白工艺筛选
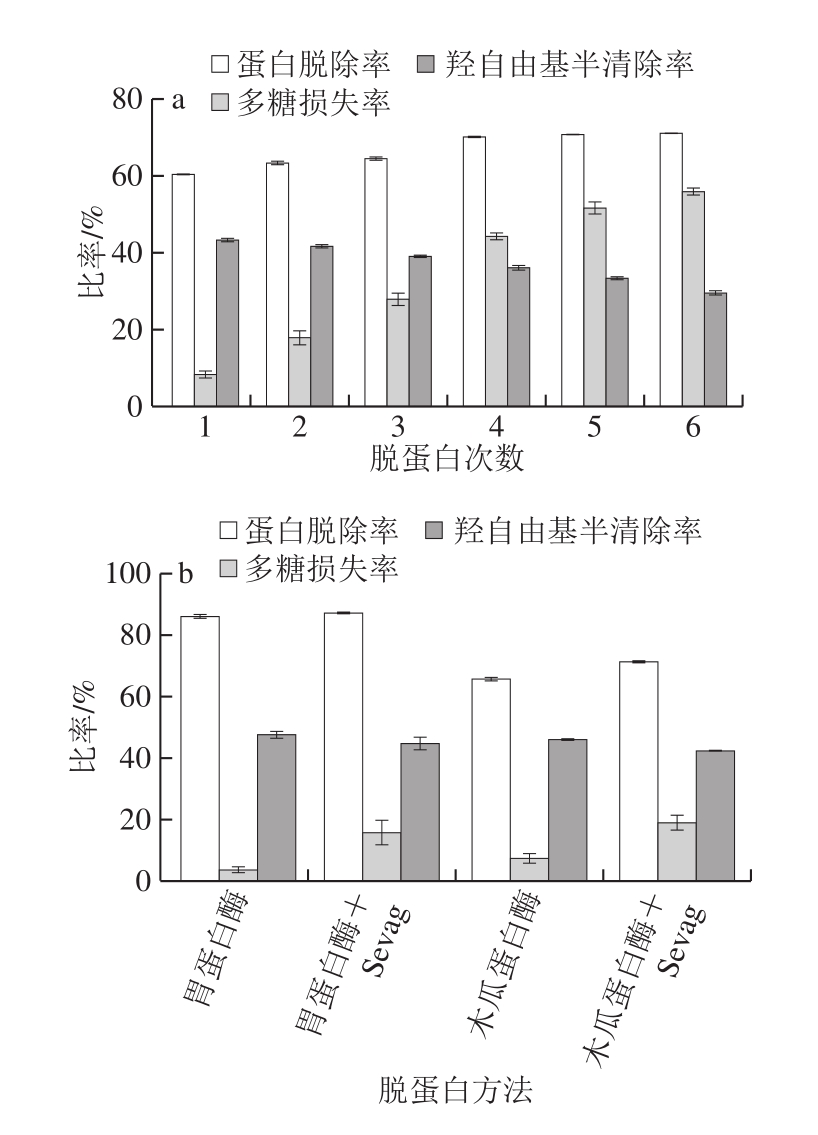
图1 Sevag法(a)、酶法及酶联合Sevag法(b)的蛋白脱除率
Fig.1 Protein removal rates of Sevag method (a) and single enzymes and enzyme combined with Sevag deproteinization (b)
如图1a所示,随脱蛋白次数的增加,蛋白脱除率和多糖损失率均呈现上升趋势,羟自由基的半清除率呈现下降趋势。用Sevag法处理6 次后,蛋白脱除率为71.1%,多糖损失率为55.9%,羟自由基的半清除率为29.5%。表明在脱蛋白过程中,会损失部分多糖。
如图1b所示,采用胃蛋白酶-Sevag法联用脱蛋白,蛋白脱除率最高,达87.2%,但多糖损失率为15.9%,羟自由基半清除率为44.7%。酶法脱蛋白时,胃蛋白酶比木瓜蛋白酶脱蛋白效果好,采用胃蛋白酶脱蛋白的蛋白脱除率为86.0%,多糖损失率为3.7%,羟自由基半清除率为47.6%。虽然胃蛋白酶-Sevag法联用的蛋白脱除率有小幅度的提高,但多糖损失率增大,并且Sevag试剂会对多糖的结构造成破坏,使多糖失去活性。胃蛋白酶法反应条件温和,可将蛋白酶解成相对分子质量较小的多肽或氨基酸,醇沉后多肽及氨基酸保留在溶液中,大分子多糖得到沉淀,降低多糖的损失率。但由于少部分蛋白与多糖紧密结合形成糖肽或糖蛋白,导致任何一种脱蛋白工艺都不能将蛋白完全除去[29]。因此,为了更好地测定多糖的活性和结构,选择胃蛋白酶脱除蛋白。此外,本实验结果与葛炳艳[30]和陈桂冰[31]等的研究结果基本一致。
2.3 扫描电镜分析

图2 PGP和PGP-D的扫描电镜形貌图
Fig.2 SEM images of PGP and PGP-D
如图2所示,PGP(图2a、b)和PGP-D(图2c、d)的表面微观形貌有较大差异。PGP具有颗粒感、整体呈球状、表面粗糙凹凸不平、沟壑明显,可能是由于PGP成分复杂,与蛋白结合紧密,相互包裹导致。经脱蛋白处理后,PGP-D呈现片状、棱角分明、厚度均一、表面光滑紧密,说明成分相对均一,分子间相互作用力较强,放大至5 000 倍可见表面有轻微凹凸点。高倍下看到的仅是多糖的表面形貌,进一步的形态连接特征需借助更精密的仪器和设备。
2.4 单糖组成分析
如图3a所示,混合标准品中各单糖的出峰顺序依次为阿拉伯糖、鼠李糖、核糖、岩藻糖、木糖、甘露糖、果糖、半乳糖、葡萄糖、半乳糖醛酸和葡萄糖醛酸,其出峰时间依次为13.794、13.935、14.201、14.370、14.858、15.963、16.096、16.510、16.848、17.701 min和18.119 min。根据单糖标准品衍生化的保留时间鉴定PGP-D的单糖组成,如图3b所示,PGP-D的单糖组成主要为阿拉伯糖、鼠李糖、甘露糖、半乳糖、半乳糖醛酸和葡萄糖醛酸,相对含量依次为8.0%、3.3%、7.3%、3.6%、4.5%和45.6%,表明PGP-D为酸性杂多糖。
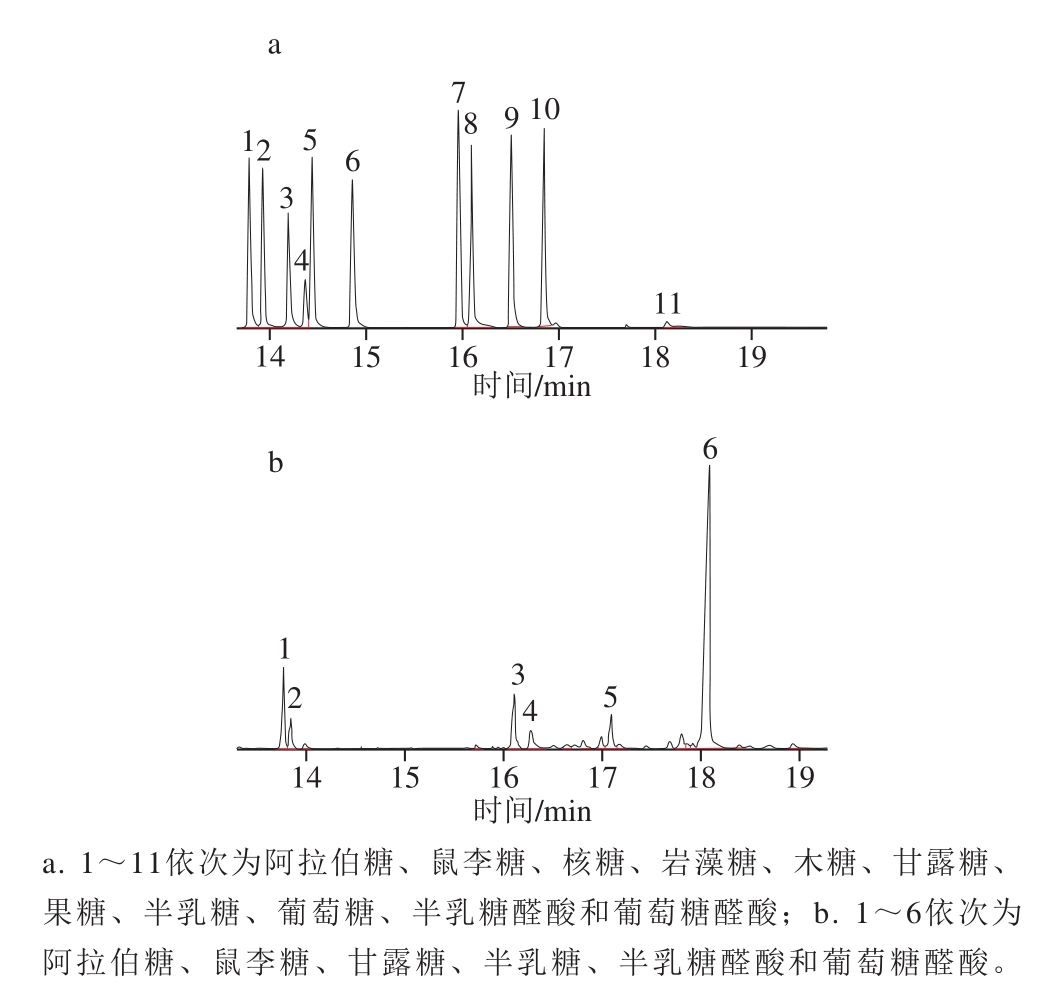
图3 单糖标准品(a)和PGP-D(b)的气相色谱-质谱图
Fig.3 GC-MS profiles of mixed monosaccharide standard (a) and PGP-D (b)
2.5 紫外光谱分析
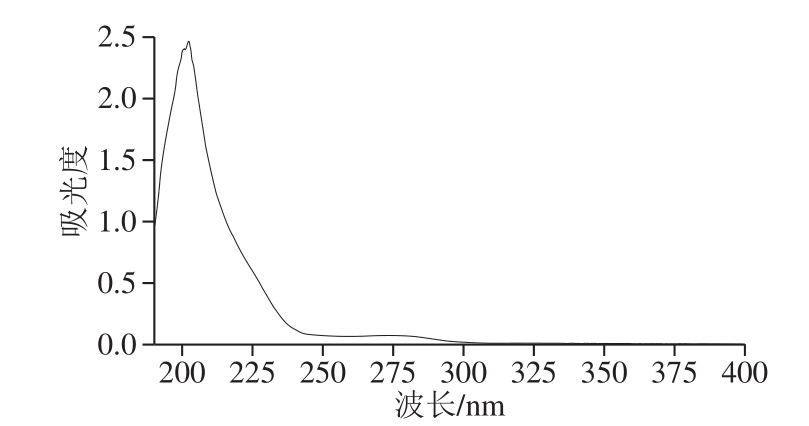
图4 PGP-D的紫外-可见吸收光谱图
Fig.4 UV-visible absorption spectrum of PGP-D
如图4所示,在波长190~400 nm内,PGP-D在波长200 nm处具有特征吸收峰,表明该样品属于多糖类物质;在波长260 nm处无吸收峰,表明不含核酸;在波长280 nm处有微弱吸收峰,表明经脱蛋白处理后,仍有少量蛋白与多糖紧密结合[32-33],与脱蛋白工艺处理结果一致。
2.6 傅里叶变换红外光谱分析
如图5所示,样品在3 300.20 cm-1处为O—H的伸缩振动峰[34];在2 960.73、2 931.80、2 873.94 cm-1处为CH3、CH2的CH伸缩振动峰[34];在1 392.61、1 309.67 cm-1为—COOH的C—O伸缩振动,证明存在糖醛酸结构[35];1 109.07 cm-1处为C—O键伸缩振动峰[36];在1 109.07~1 026.13 cm-1之间存在3 个拉伸峰,证明存在C—O键和吡喃糖环[37];在904.61 cm-1处为β-糖苷键的特征吸收峰,表明该物质符合糖类结构[35],是一种含有β-糖苷键的吡喃酸性杂多糖;在665.44 cm-1处为鼠李糖的特征吸收峰[35]。上述结果与气相色谱-质谱、紫外光谱结果一致。
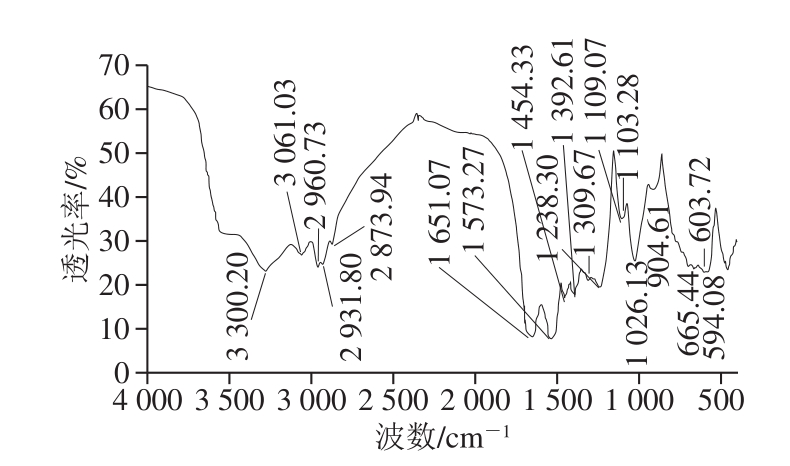
图5 PGP-D的傅里叶变换红外光谱图
Fig.5 FTIR spectrum of PGP-D
2.7 体外抗氧化活性分析
2.7.1 羟自由基清除能力分析
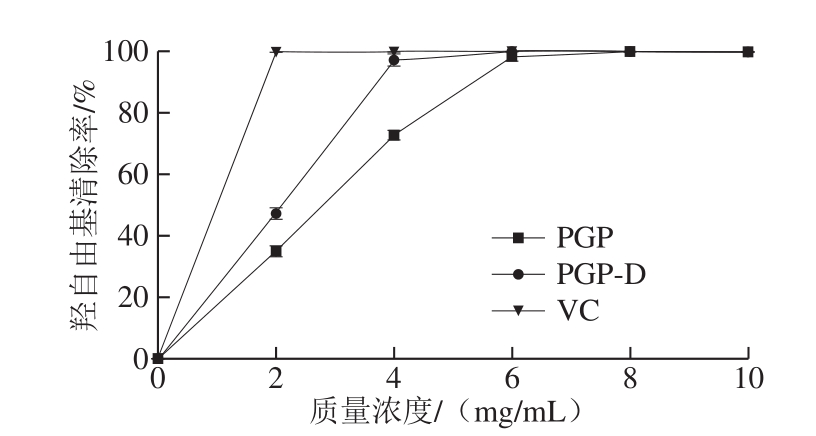
图6 PGP和PGP-D羟自由基清除能力
Fig.6 Scavenging capacities of PGP and PGP-D on hydroxyl radicals
由于羟自由基很容易穿过细胞膜导致组织损伤或细胞死亡,因此,除去羟自由基对保护生命系统非常重要[38]。如图6所示,多糖质量浓度与羟自由基清除率呈正相关,PGP对羟自由基的IC50值为2.8 mg/mL,PGP-D对羟自由基的IC50值为2.1 mg/mL,经脱蛋白处理后,多糖纯度得到提高,使PGP-D清除羟自由基的能力优于PGP。与罗敬文等[39]从玉木耳中提取的多糖对羟自由基的IC50值为2.4 mg/mL,王姣等[9]从鲍内脏中获得的多糖对羟自由基的IC50值为7.1 mg/mL,孙玉林等[40]发现拟目乌贼肌肉多糖对羟自由基的IC50值为12.4 mg/mL,相比活性较强。
2.7.2 总还原能力分析
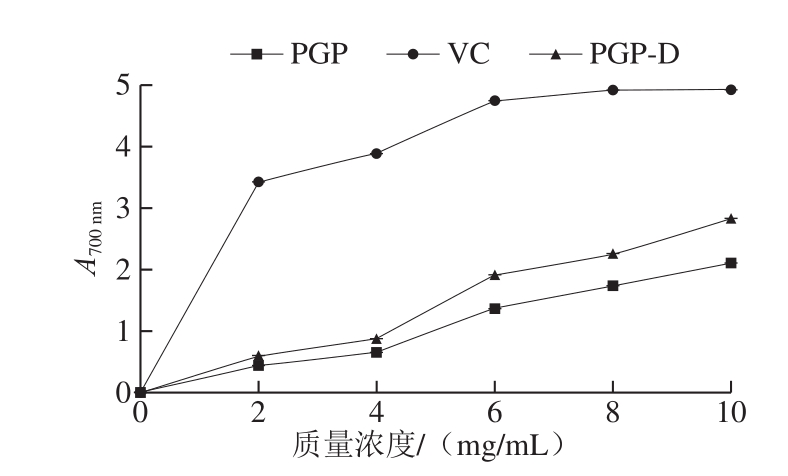
图7 PGP和PGP-D总还原能力
Fig.7 Total reducing power of PGP and PGP-D
如图7所示,随质量浓度增加,PGP和PGP-D的还原能力均呈现上升趋势。在质量浓度为10 mg/mL时,PGP的吸光度为2.100,PGP-D的吸光度为2.811,其中PGP-D是VC总还原能力的57.1%。经胃蛋白酶脱蛋白后,PGP-D表现出更强的还原能力。与宋荪阳等[41]从扇贝性腺中提取的多糖,在质量浓度为10 mg/mL时吸光度为0.255,许女等[42]从鸡腿菇子实体中提取的多糖,在质量浓度为8 mg/mL时吸光度为0.730,相比活性较强。
上述结果表明PGP-D可以作为抗氧化剂。研究认为,多糖的生物活性受其结构特征的影响,如原料、提取过程、单糖组成及糖苷键类型等方面的差异将导致抗氧化活性的不同[43-45]。首先,糖醛酸被认为是反映多糖抗氧化活性的重要指标。据报道,许多含有一定量糖醛酸的酸性多糖可作为优良的抗氧化剂[46-47],这可能是因为在酸性多糖中存在亲电基团,例如酮或醛,有助于从O—H键中释放出氢[48],由单糖组成分析可知,PGP-D中含有50.1%的糖醛酸(葡萄糖醛酸45.6%、半乳糖醛酸4.5%)。其次,揭示了单糖的组成和比例与抗氧化活性大小明显相关。Meng Lei等[49]认为抗氧化活性与甘露糖和葡萄糖的含量相关,在PGP-D中,甘露糖相对含量为7.3%。有关葛氏鲈塘鳢多糖抗氧化活性机理鲜见报道,有待于进一步探讨。
2.8 α-葡萄糖苷酶抑制活性分析
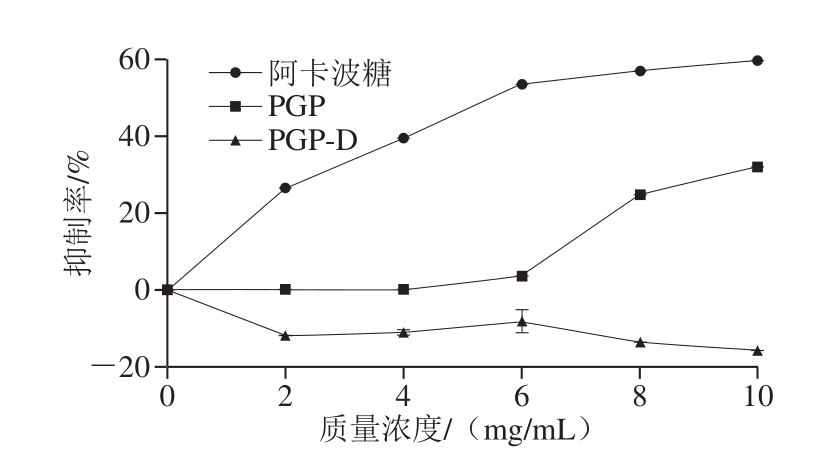
图8 PGP和PGP-D对α-葡萄糖苷酶的抑制率
Fig.8 Inhibition rates of α-glucosidase by PGP and PGP-D
餐后高血糖是II型糖尿病最早发生的代谢异常现象[50]。α-葡萄糖苷酶是寡糖降解为葡萄糖的关键酶,该酶是治疗餐后高血糖的靶点。如图8所示,多糖质量浓度与α-葡萄糖苷酶抑制效果呈正相关。当质量浓度为10 mg/mL时,阳性对照组阿卡波糖的抑制率为59.8%,PGP的抑制率为32.1%,是阿卡波糖抑制α-葡萄糖苷酶能力的53.7%。而PGP-D对α-葡萄糖苷酶活性具有较弱的促进作用,这与黄霞[51]采用碱提法从杭白菊中提取的CMP-A多糖对α-葡萄糖苷酶的效果相似。
据Xu Ping等[50]报道,当蛋白质结合酸性杂多糖时,会对α-葡萄糖苷酶产生抑制作用,随蛋白质含量的增加,抑制能力会得到改善,但其潜在的机制尚不清楚。
2.9 ACE活性抑制分析
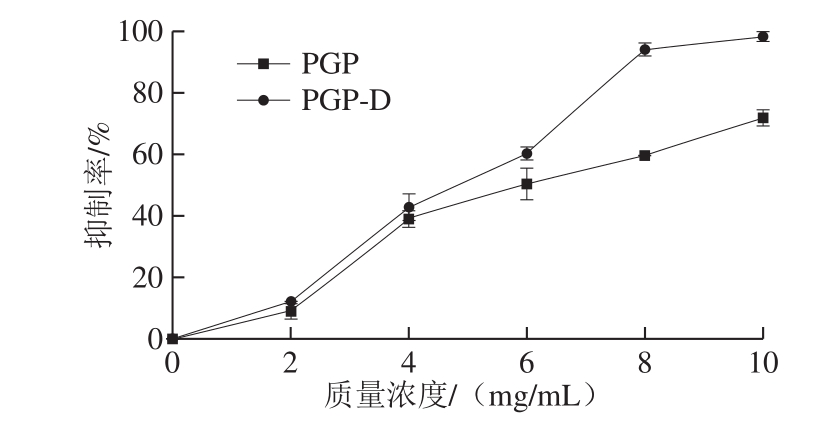
图9 PGP和PGP-D对ACE的抑制率
Fig.9 Inhibition rates of ACE by PGP and PGP-D
ACE通过转换肾素-血管紧张素系统中的血管紧张素I催化产生血管紧张素II,而血管紧张素II是一种导致高血压的血管收缩因子。如图9所示,多糖质量浓度与ACE抑制效果呈正相关性。在质量浓度为10 mg/mL时,PGP的抑制率为71.7%,PGP-D的抑制率为98.2%。与张梦娟[28]从天麻中获得多糖的87.2%,Tan等[27]从苦瓜中提取多糖的94.1%相比,PGP-D表现出更强的ACE抑制能力。
3 结 论
本实验优化的PGP脱蛋白方法为胃蛋白酶水解法,脱除率为86.0%,多糖损失率为3.7%,羟自由基半清除率为47.6%。PGP-D是一种含有β-糖苷键的酸性杂多糖,组成的单糖为阿拉伯糖、鼠李糖、甘露糖、半乳糖、半乳糖醛酸和葡萄糖醛酸,相对含量分别为8.0%、3.3%、7.3%、3.6%、4.5%和45.6%。PGP-D的总还原能力、对羟自由基清除能力及ACE的抑制能力优于PGP,且均呈量效正相关,PGP对α-葡萄糖苷酶具有抑制活性。
[1]曲丽华, 管红梅, 巩丽娟.北方地区养殖葛氏鲈塘鳢前景展望[J].黑龙江水产, 2018(3): 12-14.DOI:10.3969/j.issn.1674-2419.2018.03.007.
[2]LIANG X, GAO Y, FEI W, et al.Chemical characterization and antioxidant activities of polysaccharides isolated from the stems of, Parthenocissus tricuspidata[J].International Journal of Biological Macromolecules, 2018, 119: 70-78.DOI:10.1016/j.ijbiomac.2018.07.131.
[3]付爱叶, 王俏娜, 吴雨龙, 等.菊苣多糖体外抗氧化能力及抗疲劳作用[J].食品工业科技, 2018, 39(9): 7-11; 16.DOI:10.13386/j.issn1002-0306.2018.09.001.
[4]王军玲, 魏配晓, 邱绪建, 等.鲍鱼肌肉多糖的性质及抗肿瘤活性[J].食品科学, 2018, 39(12): 26-32.DOI:10.7506/spkx1002-6630-20181200.
[5]PÂMELA T K, CORREA V G, RÚBIA C C, et al.Antioxidant and antimicrobial activities of a purified polysaccharide from yerba mate (Ilex paraguariensis)[J].International Journal of Biological Macromolecules, 2018, 114: 1161-1167.DOI:10.1016/j.ijbiomac.2018.04.020.
[6]李卓悦, 冯玉祥, 张洪影, 等.国槐花活性多糖抗氧化和免疫增强作用的研究[J].山东畜牧兽医, 2018(6): 1-3.
[7]SILA A, BAYAR N, GHAZALA I, et al.Water-soluble polysaccharides from agro-industrial by-products: functional and biological properties[J].International Journal of Biological Macromolecules,2014, 69: 236-243.DOI:10.1016/j.ijbiomac.2014.05.052.
[8]REN B B, CHEN C.Optimization of microwave-assisted extraction of Sargassum thunbergii polysaccharides and its antioxidant and hypoglycemic activities[J].Carbohydrate Polymers, 2017, 173: 192-201.DOI:10.1016/j.carbpol.2017.05.094.
[9]王姣, 魏好程, 何传波, 等.鲍内脏多糖的抗氧化活性[J].食品科学,2017, 38(15): 127-133.DOI:10.7506/spkx1002-6630-201715019.
[10]石璇, 郭国丽, 马慧慧, 等.水溶性牡蛎多糖的降血压活性[J].河北渔业, 2015(2): 1-2.DOI:10.3969/j.issn.1004-6755.2015.02.001.
[11]马欣彤, 刘学军.池沼公鱼多糖微波辅助提取工艺[J].肉类工业,2016(2): 22-26.DOI:10.3969/j.issn.1008-5467.2016.02.007.
[12]刘学军, 王冬娇.池沼公鱼抗凝血作用的试验研究[J].食品与机械,2012, 28(3): 21-23.DOI:10.3969/j.issn.1003-5788.2012.03.006.
[13]管修媛.池沼公鱼多糖分离纯化及抗凝血活性的初步研究[D].长春: 吉林农业大学, 2015: 1.
[14]ZHANG D Y, WAN Y, XU J Y, et al.Ultrasound extraction of polysaccharides from mulberry leaves and their effect on enhancing antioxidant activity[J].Carbohydrate Polymers, 2015, 137: 473-479.DOI:10.1016/j.carbpol.2015.11.016.
[15]张惟杰.糖复合物生化研究技术[M].杭州: 浙江大学出版社, 1999: 11-12.
[16]徐玮, 汪东风.食品化学实验和习题[M].北京: 化学工业出版社,2008: 21-22; 31-32.
[17]伍善广, 赖泰君, 孙建华, 等.蚕蛹多糖脱蛋白方法研究[J].食品科学, 2011, 32(14): 21-24.
[18]李冬梅.鲍鱼脏器多糖的提取、分离纯化以及结构的研究[D].大连: 大连轻工业学院, 2007: 18.
[19]于晓红, 吴宪玲, 付薇, 等.西洋参多糖脱色脱蛋白方法研究[J].中国食品学报, 2017, 17(11): 150-154.DOI:10.16429/j.1009-7848.2017.11.019.
[20]郑捷, 孙凯华, 胡爱军, 等.海参斑软骨多糖的纯化、结构及性质分析[J].精细化工, 2019, 36(1): 66-73.DOI:10.13550/j.jxhg.20180410.
[21]王艺, 杨晓华, 张华峰, 等.滇黄精多糖的结构及对葡萄糖苷酶的抑制作用[J].精细化工, 2019, 36(4): 715-720.DOI:10.13550/j.jxhg.20180645.
[22]于晓红.西洋参多糖结构表征及免疫活性研究[D].哈尔滨: 哈尔滨商业大学, 2016: 26.
[23]FAN J, FENG H, YU Y, et al.Antioxidant activities of the polysaccharides of Chuanminshen violaceum[J].Carbohydrate Polymers, 2017, 157: 629-636.DOI:10.1016/j.carbpol.2016.10.040.
[24]HU H B, LIANG H P, LI H M, et al.Isolation, purification,characterization and antioxidant activity of polysaccharides from the stem barks of, Acanthopanax leucorrhizus[J].Carbohydrate Polymers,2018, 196: 359-367.DOI:10.1016/j.carbpol.2018.05.028.
[25]ZHANG Z L, KONG F, NI H, et al.Structural characterization,α-glucosidase inhibitory and DPPH scavenging activities of polysaccharides from guava[J].Carbohydrate Polymers, 2016, 144:106-114.DOI:10.1016/j.carbpol.2016.02.030.
[26]徐静珠, 吴彩娥, 应瑞峰, 等.青钱柳叶多糖不同组分体外降血糖及抗氧化活性研究[J].南京林业大学学报(自然科学版), 2017(4): 6-12.DOI:10.3969/j.issn.1000-2006.201610064.
[27]TAN H F, GAN C Y.Polysaccharide with antioxidant, α-amylase inhibitory and ACE inhibitory activities from Momordica charantia[J].International Journal of Biological Macromolecules, 2016, 85: 487-496.DOI:10.1016/j.ijbiomac.2016.01.023.
[28]张梦娟.天麻多糖的提取、纯化及活性研究[D].杨凌: 西北农林科技大学, 2007: 55-56.
[29]刘佳维, 周君, 高亚杰, 等.红参多糖脱蛋白的研究[J].食品科技,2018, 43(7): 188-192.
[30]葛炳艳, 杨波.裙带菜多糖3 种脱蛋白质方法的比较研究[J].食品与药品, 2010, 12(3): 96-98.DOI:10.3969/j.issn.1672-979X.2010.02.006.
[31]陈桂冰, 孙培冬, 季晓彤, 等.茶籽多糖的提取及脱蛋白工艺研究[J].中国油脂, 2016, 41(8): 74-77.DOI:10.3969/j.issn.1003-7969.2016.08.018.
[32]徐雅琴, 王跃鹏, 牛小杰, 等.黑穗醋栗果实多糖的制备、结构鉴定及生物活性研究[J].食品科学, 2017, 38(15): 19-25.DOI:10.7506/spkx1002-6630-201715002.
[33]马欣彤.池沼公鱼抗凝血多糖理化性质及其作用机理的研究[D].长春: 吉林农业大学, 2016: 29-57.DOI:CNKI:CDMD:2.1016.732681.
[34]LIU Y, HUANG G L, HU J C.Extraction, characterisation and antioxidant activity of polysaccharides from Chinese watermelon[J].International Journal of Biological Macromolecules, 2018, 111: 1304-1307.DOI:10.1016/j.ijbiomac.2018.01.088.
[35]陈树俊, 李佳益, 王翠连, 等.黄梨渣多糖的提取、分离纯化和结构鉴定[J].食品科学, 2018, 39(20): 278-286.DOI:10.7506/spkx1002-6630-201820040.
[36]谢东雪, 陆娟, 王月, 等.长白山区核桃青皮多糖分离纯化、鉴定及抗氧化活性分析[J].食品科学, 2019, 40(18): 281-286.DOI:10.7506/spkx1002-6630-20181017-177.
[37]LIU W, WANG H, PANG X, et al.Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodies of Ganoderma lucidum[J].International Journal of Biological Macromolecules, 2010, 46(4): 451-457.DOI:10.1016/j.ijbiomac.2010.02.006.
[38]LIU J L, ZHENG S L, FAN Q J, et al.Optimisation of highpressure ultrasonic-assisted extraction and antioxidant capacity of polysaccharides from the rhizome of Ligusticum chuanxiong[J].International Journal of Biological Macromolecules, 2015, 76: 80-85.DOI:10.1016/j.ijbiomac.2015.02.031.
[39]罗敬文, 司风玲, 顾子玄, 等.3 种木耳多糖的抗氧化活性与抑菌能力比较分析[J].食品科学, 2018, 39(19): 64-69.DOI:10.7506/spkx1002-6630-201819011.
[40]孙玉林, 戴宏杰, 文菁, 等.拟目乌贼肌肉多糖酶法脱蛋白工艺优化及体外清除自由基能力[J].食品科学, 2017, 38(18): 258-265.DOI:10.7506/spkx1002-6630-201718039.
[41]宋荪阳, 孙黎明, 等.扇贝性腺多糖提取物的抗氧化及免疫调节活性[J].食品科学, 2012, 33(5): 248-251.
[42]许女, 贾瑞娟, 陈旭峰, 等.鸡腿菇子实体多糖的体内、体外抗氧化活性[J].中国食品学报, 2019, 19(1): 40-46.DOI:10.16429/j.1009-7848.2019.01.005.
[43]MA L S, CHEN H X, ZHU W C, et al.Effect of different drying methods on physicochemical properties and antioxidant activities of polysaccharides extracted from mushroom Inonotus obliquus[J].Food Research International, 2013, 50(2): 633-640.DOI:10.1016/j.foodres.2011.05.005.
[44]CHEN H X, QU Z S, FU L L, et al.Physicochemical properties and antioxidant capacity of 3 polysaccharides from green tea, oolong tea,and black tea[J].Journal of Food Science, 2009, 74(6): C469-C474.DOI:10.1111/j.1750-3841.2009.01231.x.
[45]SHEN S, CHENG H, LI X, et al.Effects of extraction methods on antioxidant activities of polysaccharides from camellia seed cake[J].European Food Research and Technology, 2014, 238(6): 1015-1021.DOI:10.1007/s00217-014-2183-2.
[46]WU H, MIN T, LI X F, et al.Physicochemical properties and antioxidant activities of acidic polysaccharides from wampee seeds[J].International Journal of Biological Macromolecules, 2013, 59: 90-95.DOI:10.1016/j.ijbiomac.2013.04.020.
[47]AL-SHERAJI S H, ISMAIL A, MANAP M Y, et al.Purification,characterization and antioxidant activity of polysaccharides extracted from the fibrous pulp of Mangifera pajang fruits[J].LWT-Food Science and Technology, 2012, 48(2): 291-296.DOI:10.1016/j.lwt.2012.04.002.
[48]RAO R S P, MURALIKRISHNA G.Water soluble feruloyl arabinoxylans from rice and ragi: changes upon malting and their consequence on antioxidant activity[J].Phytochemistry (Amsterdam),2006, 67(1): 91-99.DOI:10.1016/j.phytochem.2005.09.036.
[49]MENG L, SUN S S, LI R, et al.Antioxidant activity of polysaccharides produced by Hirsutella sp.and relation with their chemical characteristics[J].Carbohydrate Polymers, 2015, 117: 452-457.DOI:10.1016/j.carbpol.2014.09.076.
[50]XU P, WU J, ZHANG Y, et al.Physicochemical characterization of puerh tea polysaccharides and their antioxidant and α-glycosidase inhibition[J].Journal of Functional Foods, 2014, 6: 545-554.DOI:10.1016/j.jff.2013.11.021.
[51]黄霞.杭白菊多糖三种提取方法及体外生理活性的比较研究[D].成都: 四川农业大学, 2016: 49-51.