中国传统食醋[1-2],即谷物醋,是由大米、小麦、高粱、小米、麸皮等通过微生物发酵酿得[3],是佐餐和烹饪中常用的一种液体酸味调味料[4]。镇江香醋、山西陈醋、福建永春老醋和四川保宁醋等[5-6]是中国著名的具有独特口感特征及感官品质的地理标志保护品牌的食醋。
有机酸是食醋中的一组重要化合物,它们不仅是具有特殊抑菌作用的功能性物质[7-9],也是能够影响食醋感官特性的风味物质。有机酸的种类和含量最终影响食醋产品的稳定性、色泽和风味,也可以提供有关其来源以及加工和陈化工艺的信息[1]。因此,对食醋中有机酸构成和含量的准确了解可以为研究食醋生产工艺对其质量的影响提供理论依据,能够为食醋工业化生产和制造工艺标准化的推进提供参考。
食醋中低分子质量的有机酸分子极性强,虽然用滴定法定量总酸度相当容易,但由于食醋基质复杂,代谢产物种类繁多,大量的氨基酸、糖类和酚类化合物以及色素、鞣质、无机盐等的存在干扰分离和定量步骤,使对食醋中的单酸进行提取和测定有一定的难度。值得注意的是,我国在食醋中有机酸的含量测定方面缺乏官方统一的分析方法。GB 2719—2018《食醋》仅规定总酸(以乙酸计)质量浓度应不小于3.5 g/100 mL,而GB 5009.157—2016《食品中有机酸的测定》的适用范围不包括食醋。目前,关于食醋中有机酸的分析方法有很多文献报道,包括液相色谱(liquid chromatography,LC)法[10-19]、毛细管电泳(capillary electrophoresis,CE)法[19]、气相色谱和气相色谱-质谱法[20-22]、离子色谱(ion chromatography,IC)法[23]和光谱法[24]。其中以分析速度快、灵敏度高、稳定性好、应用范围广的LC法对食醋中有机酸分离分析的研究报道最多。文献报道的LC法[10-16]对有机酸的分析均采用C18色谱分离柱结合紫外检测的方法。样品预处理方法可分为2 种,第1种只对样品进行稀释和过滤,第2种是样品用离子交换树脂或固相萃取柱萃取(如SAX阴离子交换萃取柱)以避免糖或色素与有机酸共溶的干扰,研究证实经稀释过滤后直接进样比固相萃取法具有更好的精密度和回收率[25];余永健等[12-13]对采用C18色谱柱分离固态发酵食醋中9 种有机酸的LC分析法进行了优化;王洁等[17]采用Grace以树脂聚合物为填料的有机酸专用分析柱对醋粉中的12 种有机酸进行分离;Lin等[18]使用Rezex ROA苯乙烯和二乙烯基苯聚合树脂(苯环有8%被磺化)填料的分析柱成功分离了20 种有机酸;Castro等[19]采用Ion 300离子排阻色谱柱对5 种有机酸进行了分析。这些研究证明色谱柱的性能对分离复杂基质中的多种有机酸至关重要。
本研究建立离子色谱法测定镇江香醋及其相关产品中乳酸、乙酸、丙酸、甲酸、丁酸、丙酮酸、异戊酸、戊酸、己二酸、丁二酸、酒石酸、酮戊二酸、草酸和柠檬酸的分析方法。采用Dionex Ion Pac AS11-HC分析柱(4 mm×250 mm)和KOH溶液梯度洗脱对上述14 种有机酸进行分离,电导检测器进行检测,方法准确性好、灵敏度高,适用于食醋及其相关衍生产品中14 种有机酸的测定。该方法为监控食醋生产过程和相关产品中的有机酸含量提供技术手段,有益于食醋产品的质量控制。
1 材料与方法
1.1 材料与试剂
镇江香醋及制品由江苏恒顺醋业股份有限公司提供。超纯水为美国Milli-Q Advantage A10超纯水系统制备。
L-乳酸(≥98%) 大连美仑生物技术有限公司;甲酸钠(≥99.0%) 美国Alfa Aesar公司;乙酸钠(≥99.0%)、己二酸(≥99.5%)、丁二酸钠(≥98%)、丙酮酸钠(≥99.0%)和酮戊二酸(≥99.0%) 美国Sigma-Aldrich公司;戊酸(≥99.3%)、草酸(≥99.8%) 德国Dr.Ehrenstorfer GmbH公司;丁酸(≥99.0%)、丙酸(≥99.0%)上海麦克林生化科技有限公司;异戊酸(≥99.6%)北京世纪奥科生物技术有限公司;L-酒石酸(≥98.0%)北京索莱宝科技有限公司;柠檬酸(≥97.0%) 中国食品药品检定研究院。
1.2 仪器与设备
Dionex ICS-5000+离子色谱仪(配有AS-AP智能样品处理系统、自动淋洗液发生器和抑制电导检测器,抑制器型号AERS 500_4mm)和Chromeleon 7.1色谱数据处理系统、Dionex OnGuardTM II RP Cartridges(1 mL)固相萃取柱、Dionex Ion Pac AS11-HC分析柱(4 mm×250 mm)、Dionex Ion Pac AS11-HC保护柱(4 mm×50 mm) 美国赛默飞世尔科技(中国)有限公司;CF16RX高速冷冻离心机 日本Hitachi公司;KQ5200DE型数控超声波清洗仪 昆山市超声仪器有限公司;MX-F涡旋混合器 北京联合科仪科技有限公司。
1.3 方法
1.3.1 样品预处理及标准溶液配制
准确称取混合均匀的食醋样品0.5 g至50 mL容量瓶中,加水40 mL左右,于35 ℃超声10 min,充分溶解后冷却至室温,加水定容至刻度,混匀;样品在8 000 r/min离心10 min后,取一定体积的上清液,过0.22 μm水相滤膜,滤液备用(根据含量确定样品稀释倍数);对于颜色较深的样品,滤液可以采用Dionex OnGuardTM II RP Cartridges(1 mL)固相萃取柱进行净化处理(净化柱使用前依次用4 mL甲醇,6 mL水进行活化,放置30 min后使用)。将上述滤液通过净化柱,弃去前面3 倍柱体积洗脱液,收集后面的洗脱液待上机测定。
分别准确称取乳酸、乙酸钠、丙酸、甲酸钠、丁酸、丙酮酸钠、异戊酸、戊酸、己二酸、丁二酸钠、酒石酸、酮戊二酸、草酸和柠檬酸标准品约0.01 g(精确至0.01 mg)于10 mL容量瓶中,用水溶解并定容,混匀。储备液质量浓度均为1 000 μg/mL。分别吸取一定体积的上述14 种有机酸储备溶液于容量瓶中,用水配制成100 μg/mL的标准混合溶液。
1.3.2 色谱条件
Dionex Ion Pac AS11-HC分析柱(4 mm×250 mm)和Dionex Ion Pac AS11-HC保护柱(4 mm×50 mm);流动相:KOH梯度洗脱,流动相梯度见表1;流速1.5 mL/min;进样量25 μL;检测器:电导检测器;抑制器:AERS500(4 mm);抑制器电流167 mA。根据保留时间定性化合物,使用外标法根据峰面积定量。
表1 流动相梯度
Table 1 Elution gradient of mobile phase
时间/min 0 9 17 27 29 32 32.1 35 KOH溶液浓度/(mmol/L) 1 1 13 13 45 45 1 1
1.3.3 标准曲线的绘制
分别吸取一定体积的100 μg/mL标准混合溶液于容量瓶中,用水配制成0、0.2、0.5、1、2、3、4、5、6、7、8、9、10.0 μg/mL的混合标准系列工作溶液。按照1.3.2节的色谱条件进行分析,以有机酸的质量浓度为横坐标(X),峰面积为纵坐标(Y)作图,进行线性回归分析和样品定量分析。
1.3.4 样品加标回收率的测定
准确称取0.5 g白醋样品18 份,1~6号样品加入2 500 μg的有机酸,7~12号样品加入5 000 μg的有机酸,13~18号样品加入25 000 μg的有机酸,按照1.3.1节方法进行样品的预处理,再按照1.3.2节色谱条件测定,计算回收率。
1.4 数据处理
运用Origin 8.6软件进行图形绘制,采用Chromeleon 7.1色谱数据处理系统进行数据分析。
2 结果与分析
2.1 流动相梯度的优化
离子色谱是基于离子色谱柱(离子交换树脂)上可离解的离子与流动相中具有相同电荷的溶质离子之间进行的可逆交换和分析物溶质对交换剂亲和力的差别而被分离的。由于在溶液中大多数电离物质都会电离,因此可以通过测定电导值检测被测物质的含量。本研究采用低选择性的KOH淋洗液[26]和AS11-HC阴离子分离柱,样品测试溶液进样之后,有机酸阴离子首先与分离柱的离子交换位点之间直接进行离子交换(即被保留在柱上),然后被淋洗液中的OH-置换并从柱上被洗脱,对树脂亲和力弱的分析物离子先于对树脂亲和力强的分析物离子依次被洗脱。乳酸、乙酸、丙酸、甲酸、丁酸、丙酮酸、异戊酸、戊酸、己二酸、丁二酸、酒石酸、酮戊二酸、草酸、柠檬酸在稀溶液中会完全电离,产生电导,采用电导检测器可以分析其含量。
考察KOH淋洗液质量浓度变化对14 种有机酸分离的影响。经过淋洗液质量浓度、分离时间的优化和分离效果的比较,确定的淋洗液梯度见表1。在优化后的色谱条件下,35 min内可以实现14 种有机酸的完全分离,如图1所示。14 种有机酸完全达到基线分离。
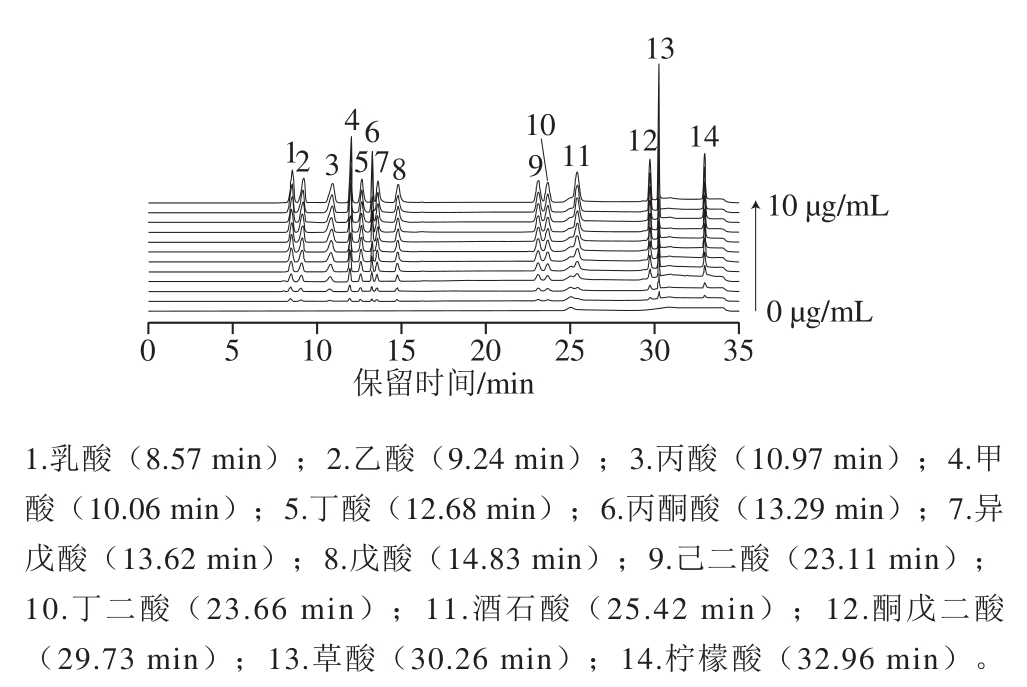
图1 有机酸标准溶液色谱图
Fig.1 Chromatograms of mixed standard solution of organic acids
2.2 样品处理方法的选择
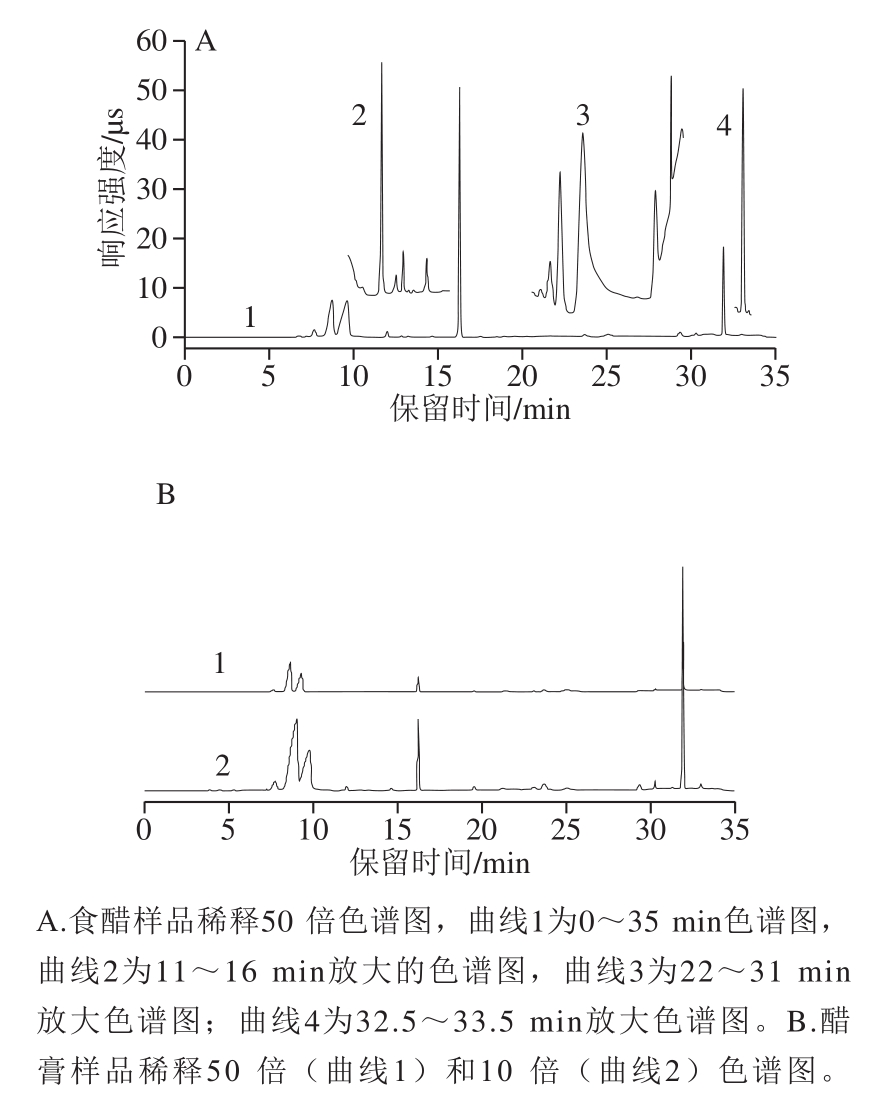
图2 样品测试液色谱图
Fig.2 Chromatograms of tested samples
采用样品直接稀释的方法对食醋样品进行处理。食醋发酵过程中微生物的代谢不仅产生多种低分子质量的有机酸,还产生了一些其他的大分子化合物,如肽类和多糖类化合物[27-28]。因此,在处理过程中采用高速离心的方式去除一些高分子质量化合物可以避免它们对测定过程的干扰。另外,样品所含的有机酸中,乳酸和乙酸的含量远高于其他的有机酸(如丁二酸和柠檬酸等),为了能够准确定量,根据样品中乙酸的含量将其稀释不同的倍数测定,用稀释倍数大的测试样品对乳酸和乙酸进行定量(如稀释50 倍或100 倍等),用稀释倍数小(如稀释50 倍或10 倍等)的测试样品对其他有机酸进行定量。对稀释后颜色仍然较深的样品,可以采用Dionex OnGuardTM II RP Cartridges(1 mL)固相萃取柱去除其中的色素。
如图2A所示,16.543 min为Cl-的色谱峰,31.921 min为PO43-的色谱峰。如图2B所示,样品稀释倍数为10 倍时,乳酸和乙酸色谱峰分离度差,峰形变差,定量准确性差,而稀释倍数为50 倍的测试样品乳酸和乙酸色谱峰分离度好,定量准确性高。
2.3 标准曲线的线性范围和精密度结果
分别将不同质量浓度的有机酸标准溶液进行测定,得到标准溶液色谱图(图1)。以有机酸质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标作图,线性回归方程见表2。有机酸的质量浓度与峰面积具有良好的相关性。以10 μg/mL有机酸标准溶液连续重复进样8 次进行精密度实验,14 种有机酸测定结果的相对标准偏差(relative standard deviation,RSD)结果在0.015%~0.032%范围内,表明精密度满足方法学定量的要求。根据GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》对检出限和定量限的规定,以3 倍的信噪比确定检出限(0.001~0.09 μg/mL),以10 倍的信噪比确定定量限(0.005~0.3 μg/mL),结果见表2。
表2 有机酸标准曲线、线性范围、检出限和定量限
Table 2 Calibration curves, linear ranges, correlation coefficients,detection limits, and quantification limits of 14 organic acids
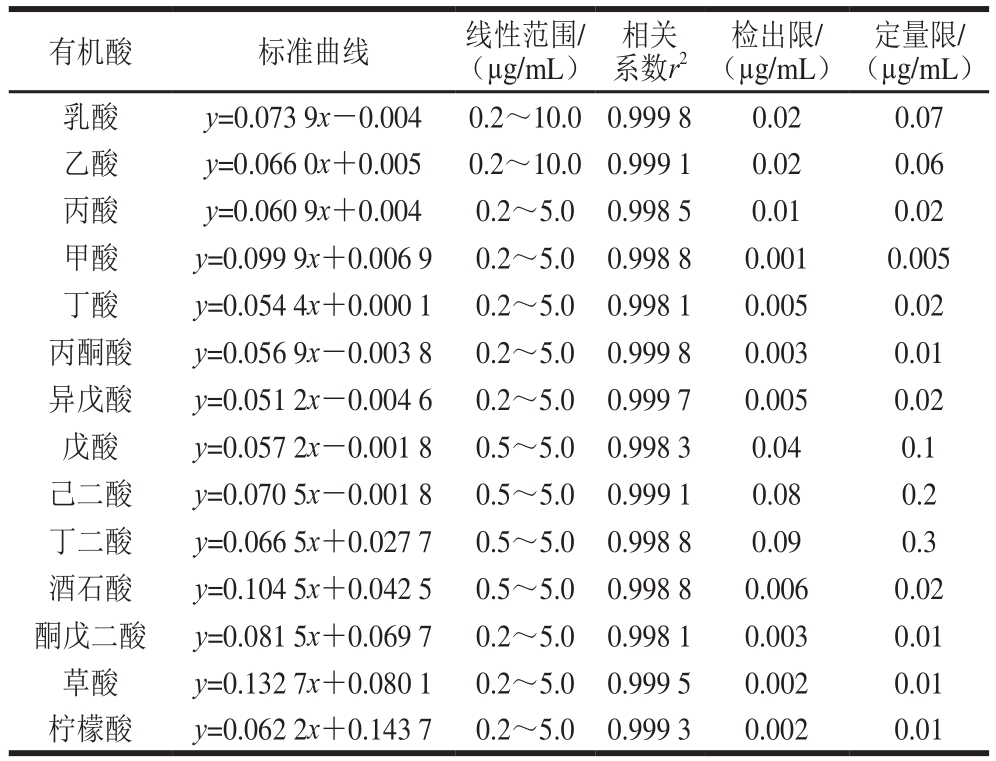
有机酸 标准曲线 线性范围/(μg/mL)相关系数r2检出限/(μg/mL)定量限/(μg/mL)乳酸 y=0.073 9x-0.004 0.2~10.0 0.999 8 0.02 0.07乙酸 y=0.066 0x+0.005 0.2~10.0 0.999 1 0.02 0.06丙酸 y=0.060 9x+0.004 0.2~5.0 0.998 5 0.01 0.02甲酸 y=0.099 9x+0.006 9 0.2~5.0 0.998 8 0.001 0.005丁酸 y=0.054 4x+0.000 1 0.2~5.0 0.998 1 0.005 0.02丙酮酸 y=0.056 9x-0.003 8 0.2~5.0 0.999 8 0.003 0.01异戊酸 y=0.051 2x-0.004 6 0.2~5.0 0.999 7 0.005 0.02戊酸 y=0.057 2x-0.001 8 0.5~5.0 0.998 3 0.04 0.1己二酸 y=0.070 5x-0.001 8 0.5~5.0 0.999 1 0.08 0.2丁二酸 y=0.066 5x+0.027 7 0.5~5.0 0.998 8 0.09 0.3酒石酸 y=0.104 5x+0.042 5 0.5~5.0 0.998 8 0.006 0.02酮戊二酸 y=0.081 5x+0.069 7 0.2~5.0 0.998 1 0.003 0.01草酸 y=0.132 7x+0.080 1 0.2~5.0 0.999 5 0.002 0.01柠檬酸 y=0.062 2x+0.143 7 0.2~5.0 0.999 3 0.002 0.01
2.4 方法的准确度和重复性结果
对方法的准确性进行考察,选择白醋样品进行加标回收实验,白醋样品中仅含有乙酸4.7%。在优化后的实验条件下,分别对有机酸添加量为2 500、5 000 μg和25 000 μg的样品进行测定,样品前处理方式采用直接稀释的方式,见表3,将有机酸添加量为25 000 μg的样品稀释后采用固相萃取柱净化,见表4。图3为白醋样品本底和加标样品的色谱图。不使用固相萃取柱净化时,14 种有机酸的平均回收率为94.7%~105%;使用萃取柱净化时,丙酸的回收率为72.6%,丁酸的回收率只有1.1%,异戊酸和戊酸的回收率为0%,即短链脂肪酸的回收率随碳原子数的增加而降低。
表3 直接稀释的预处理方式回收率实验结果
Table 3 Recoveries with direct dilution pretreatment
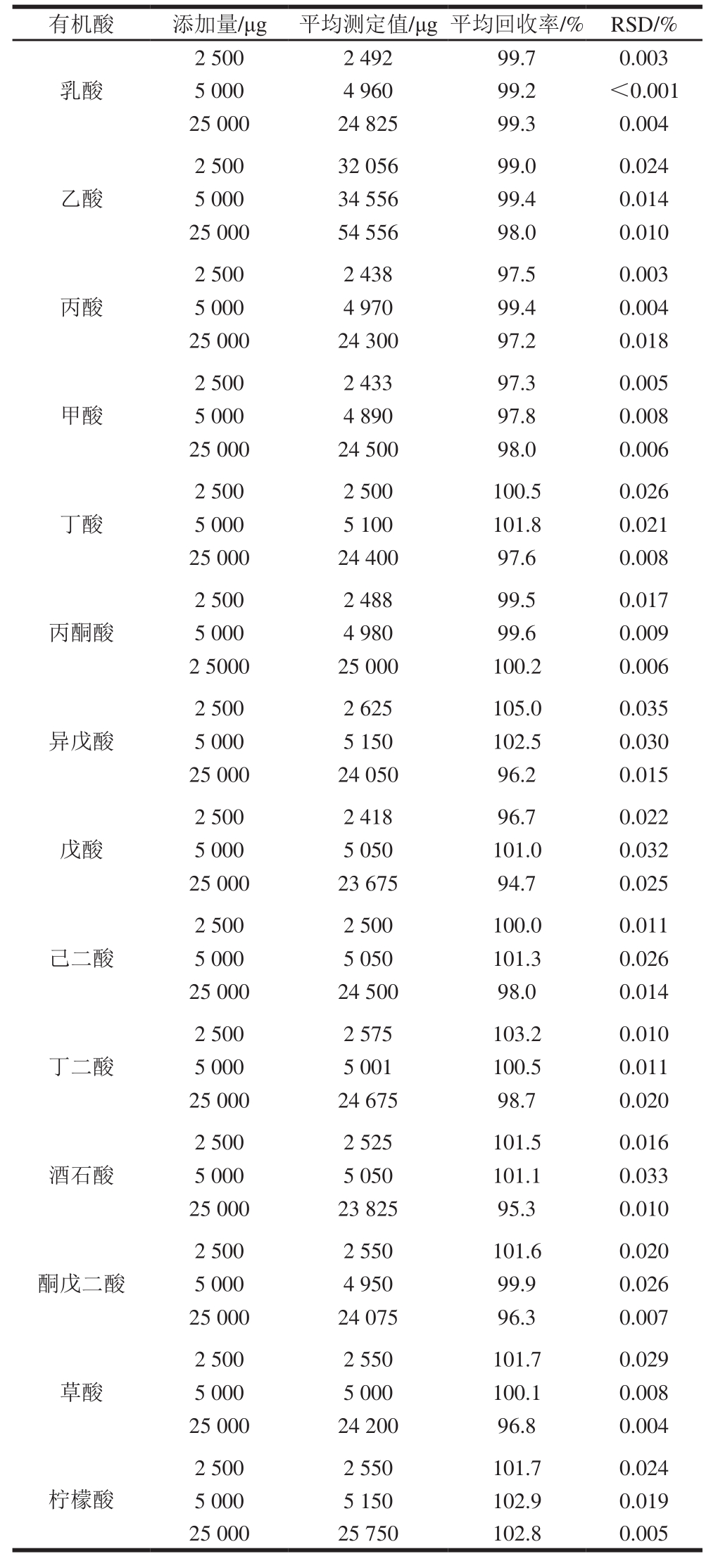
有机酸 添加量/μg 平均测定值/μg平均回收率/% RSD/%2 500 2 492 99.7 0.003 5 000 4 960 99.2 <0.001 25 000 24 825 99.3 0.004乳酸乙酸2 500 32 056 99.0 0.024 5 000 34 556 99.4 0.014 25 000 54 556 98.0 0.010丙酸2 500 2 438 97.5 0.003 5 000 4 970 99.4 0.004 25 000 24 300 97.2 0.018甲酸2 500 2 433 97.3 0.005 5 000 4 890 97.8 0.008 25 000 24 500 98.0 0.006丁酸2 500 2 500 100.5 0.026 5 000 5 100 101.8 0.021 25 000 24 400 97.6 0.008丙酮酸2 500 2 488 99.5 0.017 5 000 4 980 99.6 0.009 2 5000 25 000 100.2 0.006异戊酸2 500 2 625 105.0 0.035 5 000 5 150 102.5 0.030 25 000 24 050 96.2 0.015戊酸2 500 2 418 96.7 0.022 5 000 5 050 101.0 0.032 25 000 23 675 94.7 0.025己二酸2 500 2 500 100.0 0.011 5 000 5 050 101.3 0.026 25 000 24 500 98.0 0.014丁二酸2 500 2 575 103.2 0.010 5 000 5 001 100.5 0.011 25 000 24 675 98.7 0.020酒石酸2 500 2 525 101.5 0.016 5 000 5 050 101.1 0.033 25 000 23 825 95.3 0.010酮戊二酸2 500 2 550 101.6 0.020 5 000 4 950 99.9 0.026 25 000 24 075 96.3 0.007草酸2 500 2 550 101.7 0.029 5 000 5 000 100.1 0.008 25 000 24 200 96.8 0.004柠檬酸2 500 2 550 101.7 0.024 5 000 5 150 102.9 0.019 25 000 25 750 102.8 0.005
表4 样品稀释后采用固相萃取柱净化回收率实验结果
Table 4 Recoveries with sample dilution followed by solid phase extraction cleanup
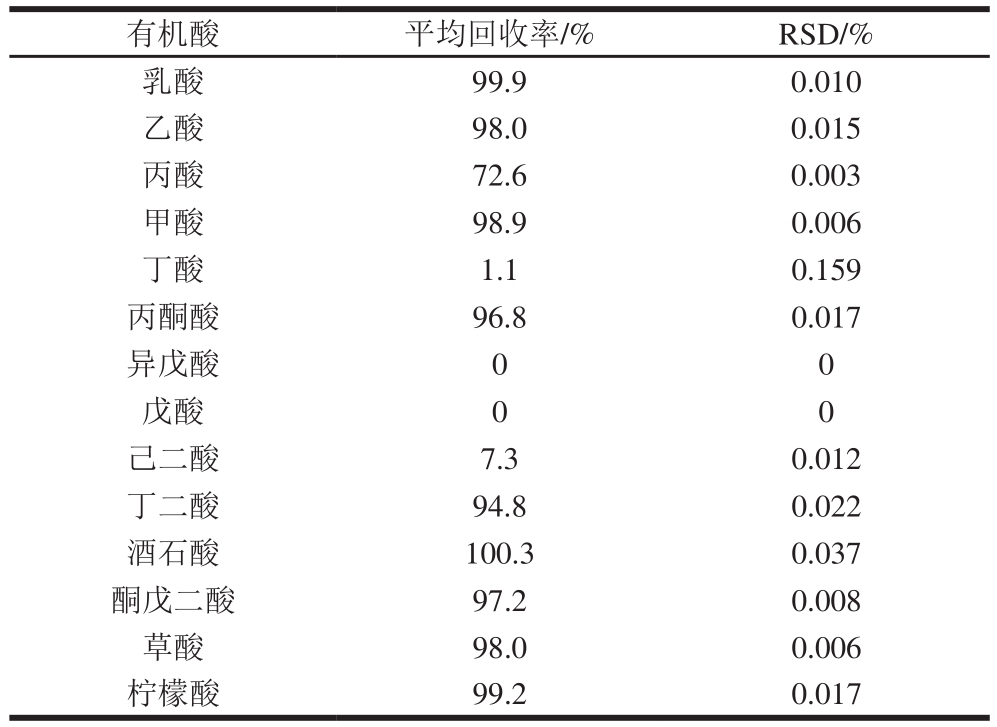
有机酸 平均回收率/% RSD/%乳酸 99.9 0.010乙酸 98.0 0.015丙酸 72.6 0.003甲酸 98.9 0.006丁酸 1.1 0.159丙酮酸 96.8 0.017异戊酸 0 0戊酸 0 0己二酸 7.3 0.012丁二酸 94.8 0.022酒石酸 100.3 0.037酮戊二酸 97.2 0.008草酸 98.0 0.006柠檬酸 99.2 0.017
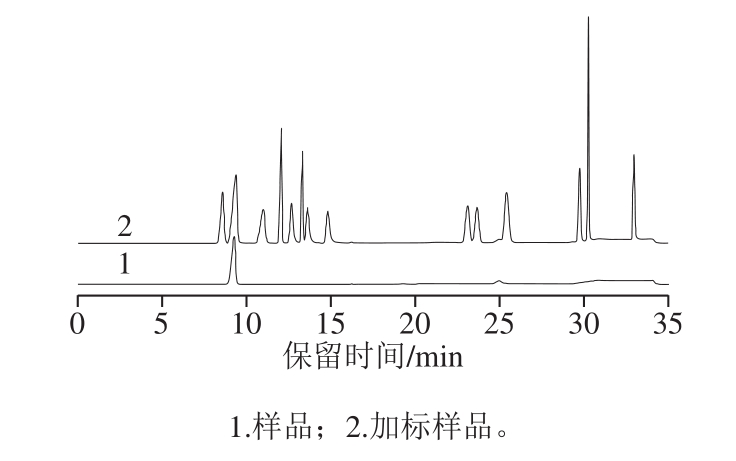
图3 样品和加标样品色谱图
Fig.3 Chromatograms of samples and spiked samples
2.5 样品中有机酸含量
表5 样品中有机酸含量
Table 5 Contents of organic acids in real samples%
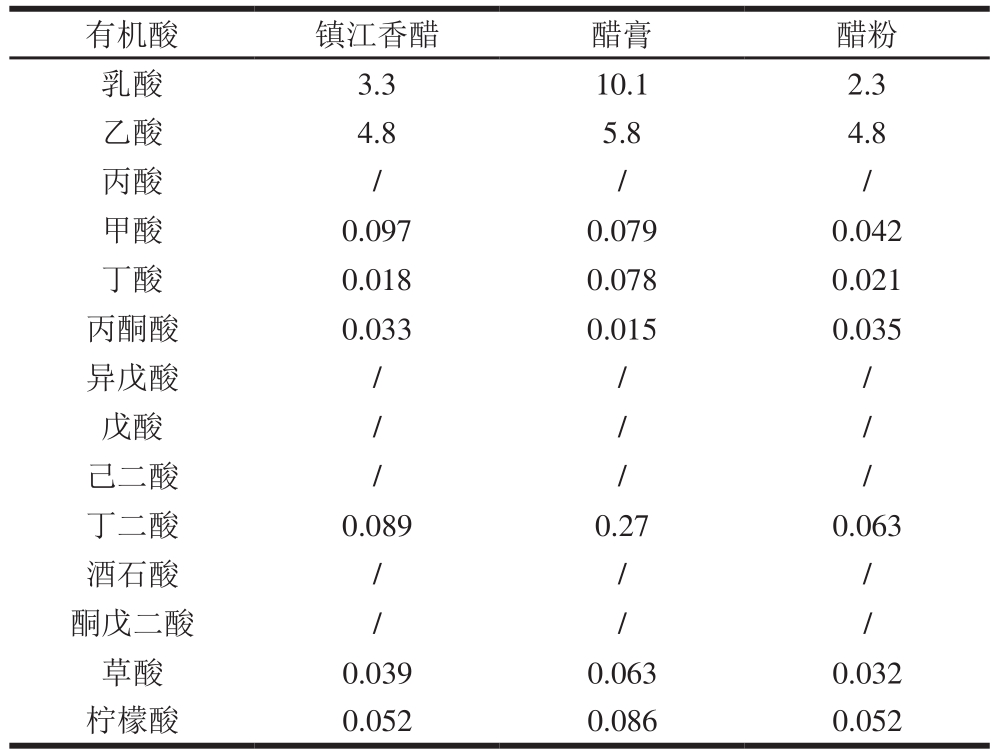
注:/.未检出。
有机酸 镇江香醋 醋膏 醋粉乳酸 3.3 10.1 2.3乙酸 4.8 5.8 4.8丙酸 / / /甲酸 0.097 0.079 0.042丁酸 0.018 0.078 0.021丙酮酸 0.033 0.015 0.035异戊酸 / / /戊酸 / / /己二酸 / / /丁二酸 0.089 0.27 0.063酒石酸 / / /酮戊二酸 / / /草酸 0.039 0.063 0.032柠檬酸 0.052 0.086 0.052
醋膏及醋粉均为镇江香醋的加工制品,其中醋膏由镇江香醋采用真空浓缩而成,醋粉则是由镇江香醋添加麦芽糊精等辅料后,经过喷雾干燥而得的产品。由表5可知,镇江香醋、醋膏及醋粉中检出的有机酸种类一致,醋膏中乳酸质量分数高达10.1%,说明乳酸作为醋中含量比较稳定的有机酸,经过浓缩后,含量显著升高。本方法适用于食醋及其加工衍生品中有机酸的测定。
3 结 论
分析影响食醋风味品质的有机酸构成和含量对产品品质评价和质量提升意义重大。本研究建立测定食醋及其相关产品中有机酸的离子色谱法。采用AS11-HC阴离子色谱柱分离,以KOH溶液梯度淋洗的方式对食醋中包括乳酸、乙酸、丙酸、甲酸、丁酸、丙酮酸、异戊酸、戊酸、己二酸、丁二酸、酒石酸、酮戊二酸、草酸和柠檬酸的14 种有机酸进行分离,流动相流速1.5 mL/min,电导检测器进行检测。方法重复测定结果的相对标准偏差均小于3%,直接稀释法回收率在94.7%~105%范围内,检出限为0.001~0.09 μg/mL,定量限为0.005~0.3 μg/mL。方法学验证结果表明,该分析方法具有特异性强、灵敏度高、准确性好等优点,样品处理也比较简便,适用于食醋及其相关制品中14 种有机酸的含量测定,可以作为有效控制食醋及相关产品质量的依据,为相关产品的品质评价、标准的完善和提升提供了技术支撑。
[1]XIA T, YAO J H, ZHANG J, et al.Evaluation of nutritional compositions, bioactive compounds, and antioxidant activities of Shanxi aged vinegars during the aging process[J].Journal of Food Science, 2018, 83(10): 2638-2644.DOI:10.1111/1750-3841.14356.
[2]ZHAO C Y, XIA T, DU P, et al.Chemical composition and antioxidant characteristic of traditional and industrial Zhenjiang aromatic vinegars during the aging process[J].Molecules, 2018,23(11): 2949-2966.DOI:10.3390/molecules23112949.
[3]NIE Z Q, ZHENG Y, DU H F, et al.Dynamics and diversity of microbial community succession intraditional fermentation of Shanxi aged vinegar[J].Food Microbiology, 2015, 47: 62-68.DOI:10.1016/j.fm.2014.11.006.
[4]GIUDICI P, CORRADINI G, BONCIANI T, et al.The flavor and taste of cereal Chinese vinegars[J].Acetic Acid Bacteria, 2017, 6(1):6370.DOI:10.4081/aab.2017.6370.
[5]BUDAK N H, AYKIN E, SEYDIM A C, et al.Functional properties of vinegar[J].Journal of Food Science, 2014, 79: 757-764.DOI:10.1111/1750-3841.12434.
[6]CHEN H, CHEN T, GIUDICI P, et al.Vinegar functions on health:constituents, sources, and formation mechanisms[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15: 1124-1138.DOI:10.1111/1541-4337.12228.
[7]ZHU Y P, ZHANG F F, ZHANG C N, et al.Dynamic microbial succession of Shanxi aged vinegar and its correlation with flavor metabolites during different stages of acetic acid fermentation[J].Scientific Reports, 2018,8(1): 8612-8622.DOI:10.1038/s41598-018-26787-6.
[8]庞锦伟, 姚欣, 雷超, 等.气相色谱-质谱法测定酵素产品中短链脂肪酸[J].中国酿造, 2017, 36(8): 165-167.DOI:10.11882/j.issn.0254-5071.2017.08.036.
[9]张军, 田子罡, 王建华, 等.有机酸抑菌分子机理研究进展[J].畜牧兽医学报, 2011, 42(3): 323-328.
[10]KONG Y, ZHANG L L, SUN Y, et al.Determination of the free amino acid, organic acid, and nucleotide in commercial vinegars[J].Journal of Food Science, 2017, 82(5): 1116-1123.DOI:10.1111/1750-3841.13696.
[11]ZONG Y Y, LIN J, XU H, et al.Optimization and validation of an HPLC-photodiode array detector method for determination of organic acids in vinegar[J].Journal of AOAC International, 2015, 98(2):422-430.DOI:10.5740/jaoacint.14-164.
[12]余永建, 邓晓阳, 陆震鸣, 等.高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化[J].食品科学, 2014, 35(4): 55-59.DOI:10.7506/spkx1002-6630-201404012.
[13]余永建, 邓晓阳, 陆震鸣, 等.固态发酵食醋有机酸组成分析中样品预处理方法的研究[J].食品工业科技, 2013, 34(4): 198-200.
[14]SAIZ-ABAJO M J, GONZALEZ-SAIZ J M, PIZARRO C.Multiobjective optimization strategy based on desirability functions used for chromatographic separation and quantification of L-proline and organic acids in vinegar[J].Analytica Chimica Acta, 2005, 528(1): 63-76.DOI:10.1016/j.aca.2004.06.027.
[15]SANARICO D, MOTTA S, BERTOLINI L, et al.HPLC determination of organic acids in traditional balsamic vinegar of Reggio Emilia[J].Journal of Liquid Chromatography & Related Technology, 2003,26(13): 2177-2187.DOI:10.1081/jlc-120022402.
[16]COCCHI M, LAMBERTINI P, MANZINI D, et al.Determination of carboxylic acids in vinegars and in Aceto Balsamico Tradizionale di Modena by HPLC and GC methods[J].Journal of Agricultural and Food Chemistry, 2002, 50(19): 5255-5261.DOI:10.1021/jf020155l.
[17]王洁, 李艳杰, 陈继承, 等.醋粉中12 种有机酸快速同时检测[J].中国食品学报, 2015, 15(4): 241-246.DOI:10.16429/j.1009-7848.2015.04.032.
[18]LIN J T, LIU S C, SHEN Y C, et al.Comparison of various preparation methods for determination of organic acids in fruit vinegars with a simple ion-exclusion liquid chromatography[J].Food Analytical Methods, 2011, 4(4): 531-539.DOI:10.1007/s12161-011-9204-6.
[19]CASTRO R, MORENO M V G, NATERA R, et al.Comparative analysis of the organic acid content of vinegar by capillary electrophoresis and ion-exclusion chromatography with conductimetric detection[J].Chromatographia, 2002, 56(1/2): 57-61.DOI:10.1007/bf02490247.
[20]DURAN G E, CHINNICI F, NATALI N, et al.Solid-phase extraction method for determination of volatile compounds in traditional balsamic vinegar[J].Journal of Separation Science, 2008, 31(16/17):3030-3036.DOI:10.1002/jssc.200800307.
[21]COCCHI M, DURANTE C, GRANDI M, et al.Simultaneous determination of sugars and organic acids in aged vinegars and chemometric data analysis[J].Talanta, 2006, 69(5): 1166-1175.DOI:10.1016/j.talanta.2005.12.032.
[22]YANG M H, CHOONG Y M.A rapid gas chromatographic method for direct determination of short-chain (C2-C12) volatile organic acids in foods[J].Food Chemistry, 2001, 75(1): 101-108.DOI:10.1016/s0308-8146(01)00211-4.
[23]SAKURSGAWA A, NAKANE M.Ion chromatographic determination of organic acids in vinegar samples using cetyltrimethylammonium ion coated graphite carbon column[J].Bunseki Kagaku, 2004, 53(8): 851-856.DOI:10.2116/bunsekikagaku.53.851.
[24]LIU F, HE Y, WANG L, et al.Detection of organic acids and pH of fruit vinegars using near-infrared spectroscopy and multivariate calibration[J].Food and Bioprocess Technology, 2011, 4(8): 1331-1340.DOI:10.1007/s11947-009-0240-9.
[25]MATO I, SUÁREZ-LUQUE S, HUIDOBRO J F.A review of the analytical methods to determine organic acids in grape juices and wines[J].Food Research International, 2005, 38: 1175-1188.DOI:10.1016/j.foodres.2005.04.007.
[26]美国Dionex公司中国服务中心.离子色谱家族的新成员: ASll-HC阴离子分离柱[J].环境化学, 1998, 17(3): 306-307.
[27]LIU J Y, GAN J, SATORU N, et al.Cellular uptake and transenterocyte transport of phenolics bound to vinegar melanoidins[J].Journal of Functional Foods, 2017, 37: 632-640.DOI:10.1016/j.jff.2017.08.009.
[28]LIU J Y, GAN J, YU Y, et al.Effect of laboratory-scale decoction on the antioxidative activity of Zhenjiang aromatic vinegar: the contribution of melanoidins[J].Journal of Functional Foods, 2016, 21:75-86.DOI:10.1016/j.jff.2015.11.041.