特定腐败菌(specific spoilage organism,SSO)是海产品中的一类重要微生物,具有调节鱼体代谢产生一系列化合物与生物活性物质的能力[1]。SSO还可能通过其初级或次级代谢,产生具有异味的挥发性有机化合物,直接影响鱼肉的感官特性、质地与新鲜度[2-3]。因此,其作为评价化学腐败指数的重要部分,在货架期预测中起到关键作用[4]。目前,已有研究发现假单胞菌属、希瓦氏菌属与葡萄球菌属是鱼类冷藏期间的优势腐败菌[5]。
近年来,天然植物及提取物以其优良的生物活性、经济适用性与低毒性等特点逐渐在各类食品的贮藏保鲜上受到关注[6-8]。植物源提取物包括单一化合物、复合化合物与植物精油等。其中,植物精油是一种具有特殊芳香气味的油性液体,具有易挥发、澄清、易溶于有机溶剂等特点。可通过蒸馏法、超临界CO2法、冷压法等从植株的多个部位提取获得植物精油,其密度通常低于水[9-10]。植物精油作为芳香植物的次级代谢产物,是一种性质复杂的天然混合物,一般含有约20~60 种不同浓度的组分。其中酚、醇、酮、醚与烃类常被认为是香料植物中的主要抗菌成分[11]。因此,精油可作为降低细菌耐药性的潜在替代品,为医药、食品等行业带来便利。目前,部分学者开展植物精油的抑菌机理研究。如Shan Bin等[12]分析了46 种草本植物提取物对蜡样芽孢杆菌、单增李斯特菌、金黄色葡萄球菌、大肠杆菌与沙门氏菌的抗菌活性,研究发现革兰氏阳性菌比阴性菌敏感;Chan等[13]研究表明,植物精油中的香芹酚、香豆酸、反式肉桂醛、丁香酚、没食子酸与迷迭香酸的抗菌性能良好;Dorman等[14]研究发现从牛至、黑胡椒、丁香与肉豆蔻中提取的植物精油对嗜水气单胞菌的抗菌活性相近,而肉豆蔻与丁香精油则具更显著的抑制作用。
本实验在对10 种植物精油对腐生葡萄球菌作用性能分析的基础上,筛选出效果最佳的植物精油——肉桂精油;以其为研究对象,通过分析其对腐生葡萄球菌的微生物生长曲线、碱性磷酸酶(alkaline phosphatase,AKP)活力、紫外吸收物质与扫描电子显微镜等综合评价,并结合其对菌体生物膜的抑制率分析,研究肉桂精油对腐生葡萄球菌的作用机制与生物被膜形成的影响,以期为植物精油等植物源生物保鲜剂在水产品保鲜中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
腐生葡萄球菌(Staphylococcus saprophyticus)由上海海洋大学水产品加工与贮藏工程技术研究中心分离纯化,鉴定后于-80 ℃超低温下甘油管冻存。
罗勒精油、黑胡椒精油、甜茴香精油、芫荽籽精油、肉桂精油、姜精油、玫瑰草精油、茶树精油、绿橘精油、白兰叶精油(均为食品级) 雅琪实业(上海)有限公司;AKP测试盒 南京建成生物工程研究所;胰蛋白胨大豆肉汤(trypticase soy broth,TSB) 、胰蛋白胨大豆琼脂(tryptic soy agar,TSA) 青岛海博生物技术有限公司;50%戊二醛溶液、无水乙醇、二甲基亚砜(dimethyl sulfoxide,DMSO)、聚四氟乙烯(poly tetra fluoroethylene,PTFE)膜过滤器 生工生物工程(上海)股份有限公司;羟乙基哌嗪乙硫磺酸(N-2-hydroxyethylpiperazine-N-ethane-sulphonic acid,HEPES)缓冲液、结晶紫 国药集团化学试剂有限公司。
1.2 仪器与设备
Synergy 2多功能酶标仪 美国BioTek仪器有限公司;Q-150T ES plus高真空离子溅射镀膜仪 英国QUORUM有限公司;MIRA FE-SEMs分析型高分辨扫描电子显微镜 捷克TESCAN公司;TGL-16M台式高速冷冻离心机 湖南湘仪离心机仪器有限公司;UV-2450型紫外-可见分光光度计 日本岛津公司;LDZM-40KCS-Ⅲ型立式压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-1D型单人净化工作台 苏州净化设备有限公司;QYC-200型全温培养摇床、DNP-9162BS-Ⅲ型电热恒温培养箱上海新苗医疗器械制造有限公司;CP4202C型电子分析天平 奥豪斯国际贸易(上海)有限公司。
1.3 方法
1.3.1 菌悬液与植物精油溶液制备
菌悬液制备:将Staphylococcus saprophyticus菌株从-80 ℃冰箱中取出,在TSA平板上划线,30 ℃培养24 h。挑单菌落于10 mL TSB中,37 ℃、150 r/min恒温摇床活化培养18 h;再以体积分数1%的接种量接入10 mL的TSB中,37 ℃、200 r/min振荡培养18 h,5 000 r/min、4 ℃离心10 min,收集菌体后弃去上清液,用质量分数0.85%生理盐水重悬,调节菌悬液浓度为1×106 CFU/mL,4 ℃保存备用。
植物精油溶液制备:参考Blažeković等[15]的方法,并略作修改。将精油分别溶于DMSO至不同质量浓度,通过0.22 μm PTFE膜过滤器过滤灭菌待用。
1.3.2 10 种植物精油对腐生葡萄球菌的抑菌圈直径测定
吸取制备好的1×106 CFU/mL菌悬液100 μL,将其均匀涂布在TSA培养基表面上。在超净工作台中使用6 mm×10 mm无菌不锈钢圆管于琼脂上打孔,用琼脂密封孔底。将100 μL不同质量浓度精油溶液用移液枪移至每个孔中。平板置于4 ℃下2 h进行预扩散,然后在30 ℃下孵育24 h,以DMSO为阴性对照。使用游标卡尺十字交叉法测量抑菌圈直径,评估抑菌活性。其中,抑菌圈直径小于8.0 mm被认为是“无抑制区”[16]。
1.3.3 最小抑菌浓度与最小杀菌浓度测定
采用Amini等[17]的微量肉汤稀释法测定肉桂精油对腐生葡萄球菌的最小抑菌浓度(minimum inhibitory concentration,MIC)与最小杀菌浓度(minimum bactericidal concentration,MBC),略作修改。将不同植物精油分别通过0.22 μm微孔滤膜过滤除菌,随后在DMSO中稀释至64 mg/mL并移至96 孔板中,采用二倍稀释法将植物精油分别稀释至32、16、8、4、2、1、0.5、0.25 mg/mL与0.125 mg/mL。吸取制备好的1×106 CFU/mL菌悬液100 μL依次加入到96 孔板中,30 ℃温育24 h后测定OD600 nm值,以仅添加DMSO的TSB培养基作为对照。其中,MIC为明显抑制腐生葡萄球菌生长的最低质量浓度。MBC为细菌两次培养中均不能生长的最低质量浓度[14]。所有操作重复6 次。
1.3.4 肉桂精油处理后腐生葡萄球菌生长曲线测定
参考Chimnoi等[18]的方法测定腐生葡萄球菌的微生物生长曲线,研究肉桂精油对其正常生长的影响。将过滤除菌后的肉桂精油溶解于DMSO中至终质量浓度分别为1/2 MIC、MIC与2 MIC,加入制备好的菌悬液100 μL到相应试管中。以仅含DMSO的TSB为空白对照(CK)组。将接种后的各管置于摇床中37 ℃、150 r/min振荡培养24 h。每隔2 h离心收集菌体。在每个时间段结束时,用无菌生理盐水制备10 倍系列稀释液备用。随后,将100 μL样品涂布于TSA培养基,在培养箱37 ℃培养24 h后进行平板计数。
1.3.5 肉桂精油处理的腐生葡萄球菌细胞膜完整性测定
参考Liu Guorong等[19]的方法,通过紫外线吸收测定细菌细胞膜完整性。将过滤除菌后的肉桂精油溶解于DMSO中至终质量浓度分别为1/2 MIC、MIC与2 MIC,将菌液加入其中。以仅含DMSO的TSB为对照组。将接种后的各管置于摇床中37 ℃、150 r/min振荡培养24 h。取2 mL菌液,4 ℃、4 000 r/min离心收集菌体并将之重悬于2.5 mmol/L的HEPES缓冲液(pH 7.0)中,再分别加入1/2 MIC、MIC与2 MIC肉桂精油溶液,以不含肉桂精油的TSB培养基为空白对照(CK)组。每30 min取样2 mL,4 ℃、5 000 r/min离心10 min后用0.22 μm微孔滤膜过滤上清液,使用紫外-可见分光光度计分别在260 nm和280 nm波长处测其吸光度,吸光度越大,表明细胞膜破坏程度越严重。
1.3.6 肉桂精油处理的腐生葡萄球菌胞外AKP活力测定
将过滤除菌后的肉桂精油溶解于DMSO中至终质量浓度分别为1/2 MIC、MIC与2 MIC,将100 μL菌液加入其中。以仅含DMSO的TSB为对照(CK)组。将接种后的各管置于摇床中37 ℃、150 r/min振荡培养5 h。分别在0 h与5 h时,取2 mL菌液于4 ℃、4 000 r/min离心收集菌体,根据AKP测试盒说明书测定胞外AKP活力。
1.3.7 肉桂精油处理的腐生葡萄球菌微观结构的观察
参考蓝蔚青等[20]的方法,取对数期菌种按体积分数1%接种量分别接种至1/2 MIC、MIC与2 MIC的肉桂精油溶液中,以DMSO作为空白对照(CK)组,37 ℃、150 r/min摇床培养5 h后,取1.5 mL菌液8 000 r/min、4 ℃离心5 min,收集沉淀,用体积分数2.5%戊二醛溶液对菌体重悬浮后于4 ℃固定10 h。然后用磷酸盐缓冲液(pH 7.4)洗涤3 次后弃上清液,然后分别用体积分数30%、50%、70%、90%与无水乙醇梯度脱水,冻干后均匀涂在金属箔片上并固定喷金,置于扫描电子显微镜下观察菌体形态结构。
1.3.8 肉桂精油处理的腐生葡萄球菌生物膜形成能力测定
参考Mizdal等[21]的方法,并略有修改。分别向96 孔板中加入1/2 MIC、MIC、2 MIC的肉桂精油溶液后,加入106 CFU/mL菌液,在37 ℃条件下培养24 h。孵育后,用0.1 mol/L磷酸盐缓冲液(pH 5.8)洗涤除去弱黏附于生物膜的细胞,将形成的生物膜在室温下干燥15 min后,用0.1%结晶紫染色液将黏附在壁上的生物膜染色15 min,再用磷酸盐缓冲液洗涤3 次,随即用体积分数33%冰醋酸进行细胞脱色,在570 nm波长处测定洗脱液吸光度。以DMSO溶剂为阴性对照[22],无菌水处理菌液为阳性对照,分析肉桂精油对细菌生物膜形成的影响。
1.4 数据统计与分析
采用SPSS 25软件进行数据统计与分析,实验结果表示为平均值±标准差,多组间数据差异性比较使用单因素方差分析,Duncan’s检验与LSD法进行均值多重比较;P<0.05表示存在统计学显著差异;使用Origin 2018软件作图。
2 结果与分析
2.1 10 种植物精油处理对腐生葡萄球菌的MIC与MBC
表1 10 种植物精油对腐生葡萄球菌的抑菌效果
Table 1 Inhibitory effects of 10 plant essential oils on Staphylococcus saprophyticus
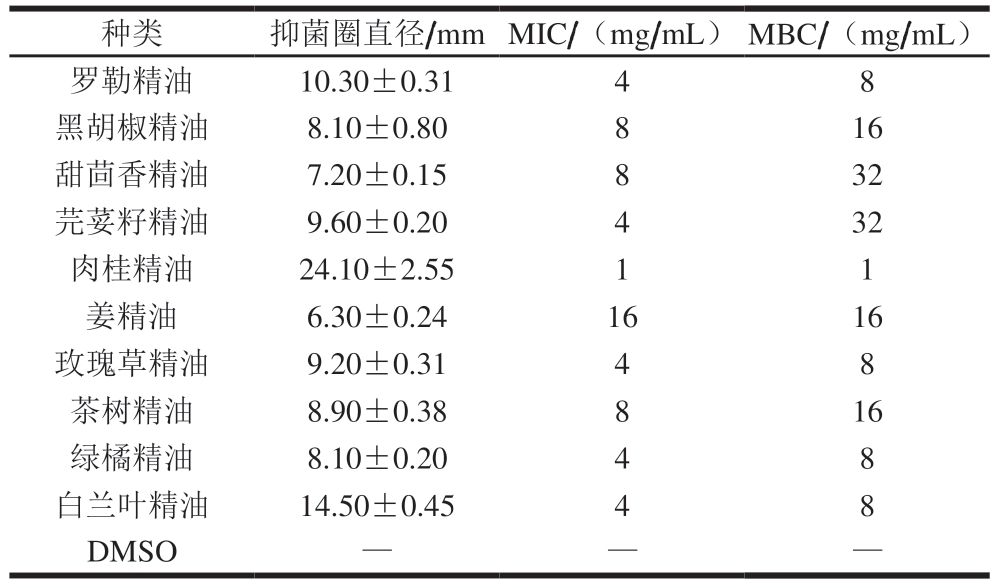
注:—.无抑菌性。
种类 抑菌圈直径/mm MIC/(mg/mL) MBC/(mg/mL)罗勒精油 10.30±0.31 4 8黑胡椒精油 8.10±0.80 8 16甜茴香精油 7.20±0.15 8 32芫荽籽精油 9.60±0.20 4 32肉桂精油 24.10±2.55 1 1姜精油 6.30±0.24 16 16玫瑰草精油 9.20±0.31 4 8茶树精油 8.90±0.38 8 16绿橘精油 8.10±0.20 4 8白兰叶精油 14.50±0.45 4 8 DMSO— —
从表1中可以看出,不同植物精油在抑菌活性上表现出较大差异,在10 种受试植物精油中,以肉桂精油的作用效果最佳,其对腐生葡萄球菌的抑菌圈直径为(24.10±2.55)mm,MIC和MBC均为1 mg/mL。姜精油与甜茴香精油的抑菌性较弱,可能由于其中活性物质易挥发,使部分有效成分在培养基表面重新分配[23]。植物精油大多含有酚类物质,如百里香酚、丁香酚与香芹酚等,并以此发挥抗菌作用[24]。在肉桂精油中,肉桂醛为发挥其抑菌作用的主要成分[25]。
由MIC结果可知,肉桂精油在10 种精油中的抑菌性最强,因此后期将以DMSO为对照组,1/2 MIC、MIC、2 MIC肉桂精油为处理组,进一步研究肉桂精油对腐生葡萄球菌的作用效果。
2.2 肉桂精油处理对腐生葡萄球菌生长曲线的影响
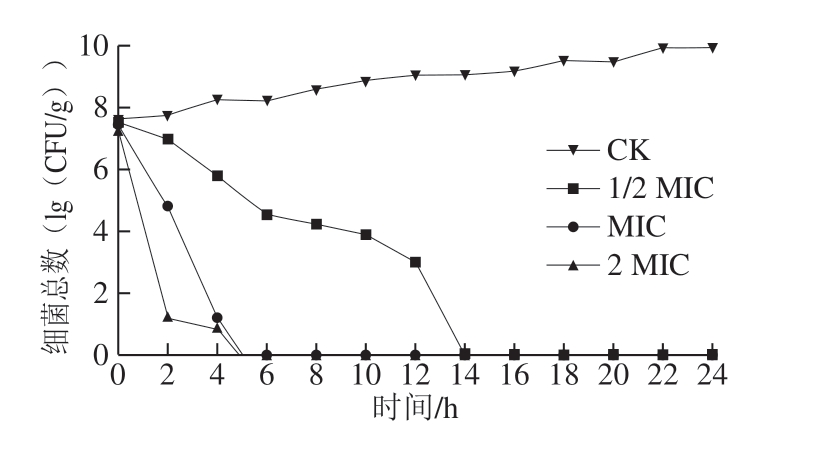
图1 肉桂精油对腐生葡萄球菌生长的影响
Fig. 1 Effect of cinnamon essential oil on growth of Staphylococcus saprophyticus
正常情况下,微生物数量会随培养时间的延长而增加,当受到外界不良因素影响,其生长速率与生长能力就会受到抑制,菌落总数相应减少。因此,可通过菌落总数的变化来判定抑菌剂的作用效果。由图1可知,CK组菌体生长正常,随着时间延长,其菌落总数呈上升趋势,而不同质量浓度肉桂精油处理组作用效果明显,在2 h内菌体数明显降低。其中,1/2 MIC肉桂精油组菌体生长在14 h时被完全抑制;MIC肉桂精油组与2 MIC肉桂精油组在5 h时被完全抑制,未有活菌检出。结果表明,肉桂精油对抑制腐生葡萄球菌生长有明显效果。
2.3 肉桂精油处理对腐生葡萄球菌细胞膜完整性的影响
若在胞外介质环境中检测到细菌胞内在260 nm波长处具有强吸收作用的物质(如嘌呤、嘧啶、戊糖以及无机磷酸盐等)以及在280 nm波长处有最大吸收波长的蛋白质,可表示细菌的细胞膜遭到一定程度破坏[26-27]。同时,细胞质中重要组分的泄漏也表明菌体细胞质膜发生不可逆损伤[28]。
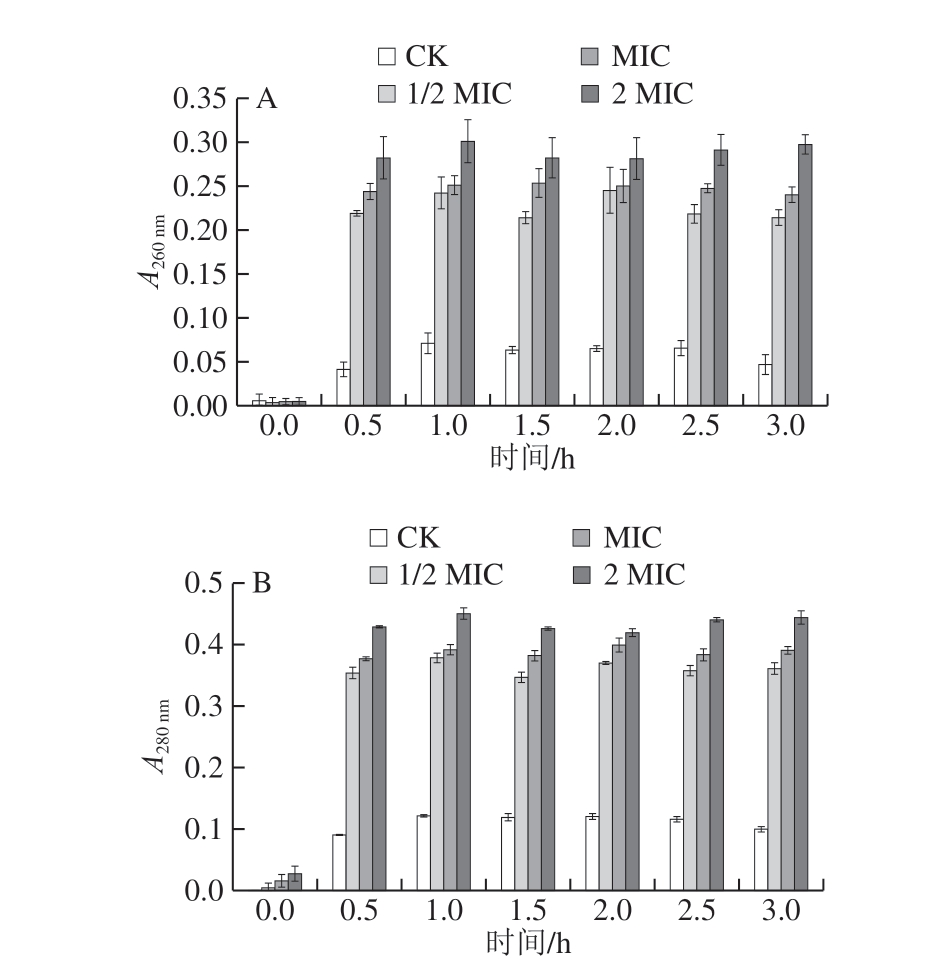
图2 肉桂精油对腐生葡萄球菌在260 nm(A)和280 nm(B)波长处紫外吸收的影响
Fig. 2 Effect of cinnamon essential oil on absorbance of Staphylococcus
saprophyticus suspension at 260 (A) and 280 nm (B)
由图2可知,随着处理时间的延长,不同质量浓度处理组在260 nm和280 nm波长处的吸光度总体呈上升趋势,表明肉桂精油对腐生葡萄球菌的作用效果具有一定的时间依赖性。其中,MIC组与2 MIC肉桂精油处理组的吸光度相比于CK组上升迅速;其均在0.5 h时升高,处理1 h后,吸光度达到最大,2 MIC处理组的吸光度上升速度明显快于MIC处理组,由此表明肉桂精油对腐生葡萄球菌的细胞膜完整性有较强破坏性,其能使菌体胞内物质大量渗出,作用强度与质量浓度正相关。
部分学者通过对植物精油进行化学气相分析,结果表明植物精油中的主要抗菌组分是酚、萜烯、醛与酮类,认为其可作用于细菌细胞膜[29]。同时,植物精油及其组分的疏水性在破坏菌体细胞膜过程中同样有着关键作用,这一特征使精油的有效成分能透过细胞膜或在细胞膜中积累、破坏细胞膜结构,使细胞膜通透性增加、胞内物质溶出,造成位于细胞膜上的微生物能量代谢系统及其关键酶类的损伤与破坏,关键生理活性物质的大量流失,最终导致细菌死亡[30-31]。植物精油及组分在对细菌细胞膜造成破坏的同时,还会作用于细胞内部的多种关键酶类,使其能量及代谢系统被破坏,导致菌体细胞对抗菌药物的耐受性大大降低[32]。
2.4 肉桂精油处理对腐生葡萄球菌胞外AKP活力的影响
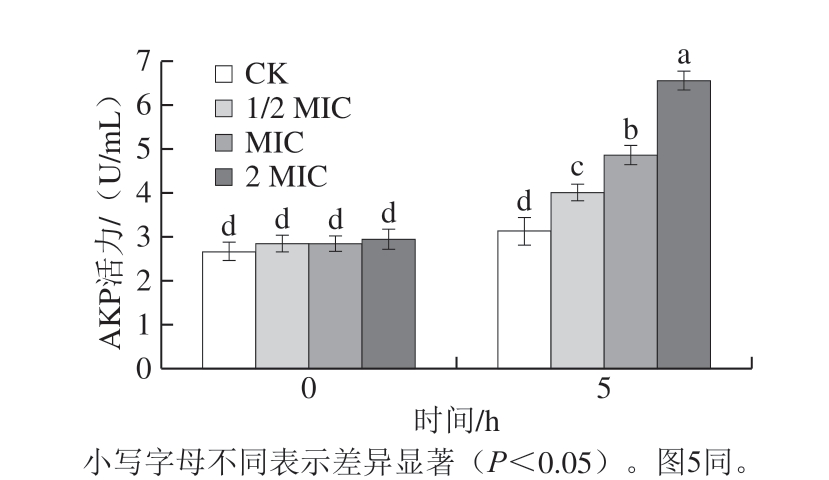
图3 肉桂精油处理后腐生葡萄球菌胞外AKP活力变化
Fig. 3 Effect of cinnamon essential oil on extracellular AKP activity of Staphylococcus saprophyticus
AKP与细菌细胞膜上的能量产生密切相关,通常存在于细菌的细胞壁与细胞膜间隙中[33]。因此,正常情况下在胞外无法检出;然而,当菌体细胞壁受到损伤时,AKP则会泄漏到胞外的环境介质中[34]。如图3所示,经过不同质量浓度的肉桂精油处理5 h后,CK组AKP活力无显著变化,各处理组的AKP活力均有所上升,AKP活力与肉桂精油质量浓度呈正相关,其中2 MIC肉桂精油组增长最为明显,在培养5 h时达6.52 U/mL。表明肉桂精油对腐生葡萄球菌的细胞壁有破坏作用,同时还可能使细胞膜遭到破坏,胞内重要生理物质泄漏,最终导致细菌死亡。陈梦玲等[30]研究得出牛至精油可使腐生葡萄球菌菌体细胞壁完整性遭到破坏,与本研究结果相似。
2.5 肉桂精油处理对腐生葡萄球菌微观结构的影响
图4中显示了肉桂精油处理5 h后,其对腐生葡萄球菌的微观形貌影响。在CK组中,菌体保持原有完整的球状结构,菌体表面致密、光滑而饱满;而经不同质量浓度的肉桂精油处理后,菌体表面出现明显皱缩,部分菌体表面不再致密,出现溶解与黏聚现象。同时,经MIC与2 MIC肉桂精油处理后,部分菌体已破裂并有内容物流出,表明肉桂精油对腐生葡萄球菌的菌体细胞壁与细胞膜结构破坏作用明显,使细胞膜受到不同程度的损伤,胞内物质泄漏,最终导致菌体死亡。陈梦玲等[30]研究得出,牛至精油能使菌体变形,导致其表面破裂,外膜脱落。

图4 肉桂精油对腐生葡萄球菌微观结构影响
Fig. 4 Effect of cinnamon essential oil on microstructure of Staphylococcus saprophyticus
经不同质量浓度肉桂精油处理后,菌体细胞发生变化同A260 nm和A280 nm紫外吸收物质测定的结果相符,表明细菌细胞膜受到不同程度损伤,得出肉桂精油对菌体细胞完整性存在破坏作用。该实验结果与AKP分析结果相符,表明肉桂精油对菌体的破坏作用可能先引起细胞壁损伤,随后导致菌体细胞膜受损,使AKP发生泄漏。
2.6 肉桂精油处理对腐生葡萄球菌生物膜形成的影响
细菌生物膜是指细菌黏附于接触表面,分泌多糖基质、纤维蛋白、脂质蛋白等,将其自身包绕其中而形成的大量细菌聚集膜样物[35-36]。生物膜的形成是细菌的一种保护机制,可通过观察细菌生物膜的形成来观察其是否受到抑制[37]。菌体经结晶紫染色后,一般情况下,其生物膜密度越高,在570 nm波长处的吸光度越大[38]。因此,可通过酶标仪检测其吸光度来判定菌体生物膜的形成能力。
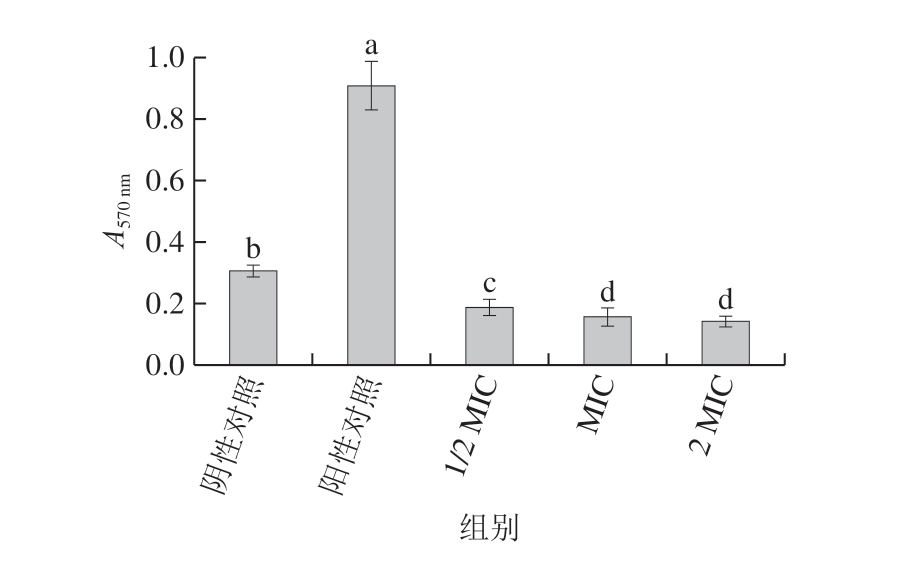
图5 肉桂精油处理对腐生葡萄球菌生物膜形成的影响
Fig. 5 Effect of cinnamon essential oil on biofilm formation of Staphylococcus saprophyticus
如图5所示,不同质量浓度的肉桂精油对腐生葡萄球菌生物膜的生长有明显抑制作用,表明其对腐生葡萄球菌生物膜具有良好的清除效果,且抑制效果随着肉桂精油质量浓度的升高而增强。生物膜的形成机制较复杂,通常认为受到胞间通讯系统在不同菌种间差异的影响,其常见的信号调节分子有脂肪酰基高丝氨酸内酯(acyl homoserine lactones,AHLs)、自诱导肽(autoinducter peptide,AIP)与自诱导分子-2(autoinducter-2,AI-2)等[39];Kang Jiamu等[40]研究表明,没食子酸在降低破坏福氏志贺氏菌细胞活力、破坏细胞膜微结构及细胞膜完整性的基础上,还能通过调节葡聚糖葡糖基转移酶(mdoH)基因与骨桥蛋白(OpgH)来抑制生物膜形成。据报道,抗菌分子能与细菌细胞膜上羧基转移酶的某些位点结合,导致乙酰辅酶A羧化酶活性降低或失效,阻断脂肪酸和脂质的生物合成过程,导致细胞膜的破损[41];同时,也使菌体细胞膜结构受到破坏。
3 讨 论
通过比较10 种植物精油对腐生葡萄球菌的抗菌作用,并以抗菌作用最明显的肉桂精油为研究对象,初步探究其对腐生葡萄球菌的作用机制。结果表明,肉桂精油对腐生葡萄球菌的MIC与MBC均为1 mg/mL;经肉桂精油处理后,腐生葡萄球菌生长明显延缓,细胞膜通透性增加,其菌体完整性受到破坏,并对其生物膜的生成有明显的抑制作用。
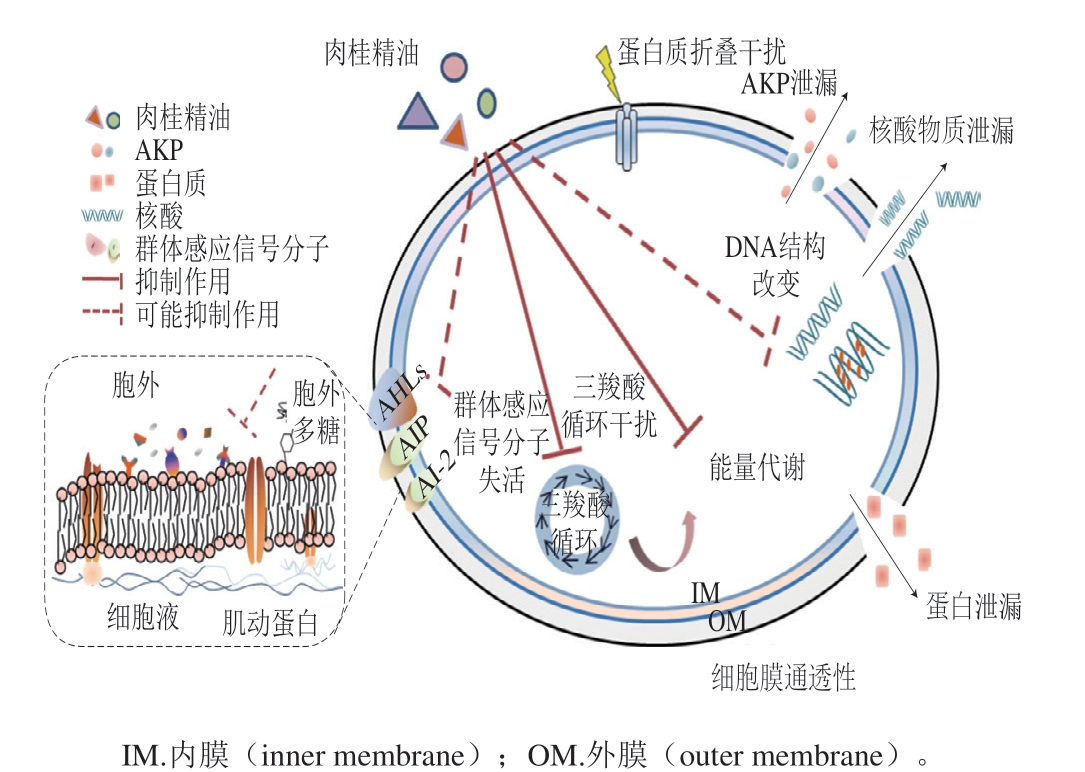
图6 肉桂精油对腐生葡萄球菌的抑菌机制示意图[42]
Fig. 6 Antimicrobial mechanism of cinnamon essential oil on Staphylococcus saprophyticus[42]
如图6所示,植物精油的作用位点多样,机制复杂,其对于细胞膜、信号分子的分泌与接收、能量代谢与物质循环、增殖与传代等研究还需要进一步深入。同时,在菌体外部普遍存在的胞外基质中,作为群体感应系统中关键因素的AHLs等信号分子及胞外多糖在不同菌种的差异性可能也对不同菌株对植物精油的耐受力有一定影响[43]。
随着相关技术进步和研究不断深入,植物精油及其主要成分作为一种天然、低毒、经济适用性高的生物活性物质在抑制水产品特定腐败菌生长、延缓水产品氧化变质、保持其品质与延长货架期等方面具有较好潜力。后期课题组拟开展对细菌细胞水平的能量代谢与物质运输研究,从分子角度对胞间信息交流的各种特征信号分子影响进行探讨,以期为拓展植物精油的应用范围提供理论参考。
[1] BOZIARIS I S, PARLAPANI F F. Chapter 3: specific spoilage organisms (SSOs) in fish [M]//BEVILACQUA A, CORBO M R,SINIGAGLIA M. The microbiological quality of food. Cambridge:Woodhead Publishing, 2017: 61-98. DOI:10.1016/B978-0-08-100502-6.00006-6.
[2] ODEYEMI O A, BURKE C M, BOLCH C C J, et al. Seafood spoilage microbiota and associated volatile organic compounds at different storage temperatures and packaging conditions[J]. International Journal of Food Microbiology, 2018, 280: 87-99. DOI:10.1016/j.ijfoodmicro.2017.12.029.
[3] MIKŠ-KRAJNIK M, YOON Y J, UKUKU D O, et al. Volatile chemical spoilage indexes of raw Atlantic salmon (Salmo salar)stored under aerobic condition in relation to microbiological and sensory shelf lives[J]. Food Microbiology, 2016, 53(Pt B): 182-191.DOI:10.1016/j.fm.2015.10.001.
[4] 王桂英, 王艳娟. 基于玫瑰茄色素的鱼肉新鲜度指示标签[J]. 包装工程, 2017, 38(23): 50-54. DOI:10.19554/j.cnki.1001-3563.2017.23.012.
[5] NOSEDA B, TARIQUL I M, ERIKSSON M, et al. Microbiological spoilage of vacuum and modified atmosphere packaged Vietnamese Pangasius hypophthalmus fillets[J]. Food Microbiology, 2012, 30(2):408-419. DOI:10.1016/j.fm.2011.12.025.
[6] PRAKASH B, KEDIA A, MISHRA P K, et al. Plant essential oils as food preservatives to control moulds, mycotoxin contamination and oxidative deterioration of agri-food commodities: potentials and challenges[J]. Food Control, 2015, 47: 381-391. DOI:10.1016/j.foodcont.2014.07.023.
[7] 王硕, 谢晶, 刘爱芳. 生物保鲜技术在海产品中的应用及展望[J]. 包装工程, 2017, 38(1): 137-142. DOI:10.19554/j.cnki.1001-3563.2017.01.026.
[8] 常晶, 李晨辉, 刘尊英, 等. 明胶-壳聚糖-迷迭香提取物复合膜对冷藏鲟鱼品质的影响[J]. 包装工程, 2019, 40(13): 52-57.DOI:10.19554/j.cnki.1001-3563.2019.13.008.
[9] 邵兴锋, 曹保英, 王鸿飞, 等. 茶树精油的生物活性及其在对虾保鲜中的应用[J]. 江苏农业学报, 2013, 29(1): 172-177. DOI:10.3969/j.issn.1000-4440.2013.01.030.
[10] 李冬娜, 马晓军. 天然植物抑菌成分提取及在食品保鲜中的应用进展[J]. 包装工程, 2018, 39(13): 71-77. DOI:10.19554/j.cnki.1001-3563.2018.13.013.
[11] STANBOROUGH T, FEGAN N, POWELL S M, et al. Genomic and metabolic characterization of spoilage-associated Pseudomonas species[J]. International Journal of Food Microbiology, 2018, 268: 61-72. DOI:10.1016/j.ijfoodmicro.2018.01.005.
[12] SHAN Bin, CAI Yizhong, BROOKS J D, et al. Antibacterial properties and major bioactive components of cinnamon stick(Cinnamomum burmannii): activity against foodborne pathogenic bacteria[J]. Journal of Agricultural and Food Chemistry, 2007, 55(14):5484-5490. DOI:10.1021/jf070424d.
[13] CHAN C L, GAN R, SHAH N P, et al. Polyphenols from selected dietary spices and medicinal herbs differentially affect common foodborne pathogenic bacteria and lactic acid bacteria[J]. Food Control,2018, 92: 437-443. DOI:10.1016/j.foodcont.2018.05.032.
[14] DORMAN H J, DEANS S G. Antimicrobial agents from plants:antibacterial activity of plant volatile oils[J]. Journal of Applied Microbiology, 2000, 88(2): 308-316. DOI:10.1046/j.1365-2672.2000.00969.x.
[15] BLAŽEKOVIĆ B, YANG W F, WANG Y, et al. Chemical composition, antimicrobial and antioxidant activities of essential oils of Lavandula × intermedia ‘Budrovka’ and L. angustifolia cultivated in Croatia[J]. Industrial Crops and Products, 2018, 123: 173-182.DOI:10.1016/j.indcrop.2018.06.041.
[16] 周本宏, 松长青, 姜姗, 等. 地榆鞣质提取物的抗菌活性及对金黄色葡萄球菌的抑菌机制研究[J]. 中国药师, 2016, 19(3): 464-469.DOI:10.3969/j.issn.1008-049X.2016.03.015.
[17] AMINI L, SOUDI M R, SABOORA A, et al. Effect of essential oil from Zataria multiflora on local strains of Xanthomonas campestris: an efficient antimicrobial agent for decontamination of seeds of Brassica oleracea var. capitata[J]. Scientia Horticulturae, 2018, 236: 256-264.DOI:10.1016/j.scienta.2018.03.046.
[18] CHIMNOI N, REUK-NGAM N, CHUYSINUAN P, et al.Characterization of essential oil from Ocimum gratissimum leaves:antibacterial and mode of action against selected gastroenteritis pathogens[J]. Microbial Pathogenesis, 2018, 118: 290-300.DOI:10.1016/j.micpath.2018.03.041.
[19] LIU Guorong, SONG Zhenqin, YANG Xuelian, et al. Antibacterial mechanism of bifidocin A, a novel broad-spectrum bacteriocin produced by Bifidobacterium animalis BB04[J]. Food Control, 2016,62: 309-316. DOI:10.1016/j.foodcont.2015.10.033.
[20] 蓝蔚青, 谢晶, 毛锋, 等. 复合生物保鲜剂对金黄色葡萄球菌的抑菌作用研究[J]. 食品与生物技术学报, 2014, 33(8): 814-820.DOI:10.3969/j.issn.1673-1689.2014.08.005.
[21] MIZDAL C R, STEFANELLO S T, DA COSTA FLORES V, et al.The antibacterial and anti-biofilm activity of gold-complexed sulfonamides against methicillin-resistant Staphylococcus aureus[J].Microbial Pathogenesis, 2018, 123: 440-448. DOI:10.1016/j.micpath.2018.08.002.
[22] DOS REIS C M, DA ROSA B V, DA ROSA G P, et al. Antifungal and antibacterial activity of extracts produced from Diaporthe schini[J]. Journal of Biotechnology, 2019, 294: 30-37. DOI:10.1016/j.jbiotec.2019.01.022.
[23] GHOSH S, INDUKURI K, BONDALAPATI S, et al. Unveiling the mode of action of antibacterial labdane diterpenes from Alpinia nigra (Gaertn.) B. L. Burtt seeds[J]. European Journal of Medicinal Chemistry, 2013, 66: 101-105. DOI:10.1002/chin.201401215.
[24] RAUT J S, KARUPPAYIL S M. A status review on the medicinal properties of essential oils[J]. Industrial Crops and Products, 2014, 62:250-264. DOI:10.1016/j.indcrop.2014.05.055.
[25] ARANCIBIA M, GIMÉNEZ B, LÓPEZ-CABALLERO M E, et al.Release of cinnamon essential oil from polysaccharide bilayer films and its use for microbial growth inhibition in chilled shrimps[J]. LWTFood Science and Technology, 2014, 59(2): 989-995. DOI:10.1016/j.lwt.2014.06.031.
[26] BURT S. Essential oils: their antibacterial properties and potential applications in foods: a review[J]. International Journal of Food Microbiology, 2004, 94(3): 223-253. DOI:10.1016/j.ijfoodmicro.2004.03.022.
[27] 王倩, 蓝蔚青, 侯旻, 等. 银杏叶提取液对腐生葡萄球菌的作用机理研究[J]. 食品与生物技术学报, 2018, 37(9): 971-976. DOI:10.3969/j.issn.1673-1689.2018.09.011.
[28] CARSON C F, MEE B J, RILEY T V. Mechanism of action of Melaleuca alternifolia (tea tree) oil on Staphylococcus aureus determined by time-kill, lysis, leakage, and salt tolerance assays and electron microscopy[J]. Antimicrob Agents Chemother, 2002, 46(6):1914-1920. DOI:10.1128/AAC.46.6.1914-1920.2002.
[29] CEYLAN E, FUNG D Y C. Antimicrobial activity of spices[J].Journal of Rapid Methods & Automation in Microbiology, 2010,12(1): 1-55. DOI:10.1111/j.1745-4581.2004.tb00046.x.
[30] 陈梦玲, 蓝蔚青, 李函笑, 等. 牛至精油对腐生葡萄球菌抑制作用机制[J]. 食品科学, 2020, 41(7): 46-51. DOI:10.7506/spkx1002-6630-20190311-131.
[31] MOREIRA M R, PONCE A G, DAL VALLE C E, et al. Inhibitory parameters of essential oils to reduce a foodborne pathogen[J]. LWTFood Science and Technology, 2005, 38(5): 565-570. DOI:10.1016/j.lwt.2004.07.012.
[32] GOÑI P, LÓPEZ P, SÁNCHEZ C, et al. Antimicrobial activity in the vapour phase of a combination of cinnamon and clove essential oils[J]. Food Chemistry, 2010, 116(4): 982-989. DOI:10.1016/j.foodchem.2009.03.058.
[33] SALAZAR G J T, DE SOUSA J P, LIMA C N F, et al.Phytochemical characterization of the Baccharis dracunculifolia DC(Asteraceae) essential oil and antibacterial activity evaluation[J].Industrial Crops and Products, 2018, 122: 591-595. DOI:10.1016/j.indcrop.2018.06.052.
[34] DIAO M M, QI D P, XU M M, et al. Antibacterial activity and mechanism of monolauroyl-galactosylglycerol against Bacillus cereus[J]. Food Control, 2018, 85: 339-344. DOI:10.1016/j.foodcont.2017.10.019.
[35] CHICUREL M. Bacterial biofilms and infections. slimebusters[J].Nature, 2000, 408: 284-286. DOI:10.1038/35042737.
[36] 邓开野, 邢盼盼, 李南薇, 等. 响应面法优化金黄色葡萄球菌生物被膜的培养条件[J]. 中国食品学报, 2013, 13(11): 48-54.DOI:10.16429/j.1009-7848.2013.11.014.
[37] 戴雨芸, 李超, 袁中伟, 等. 香芹酚抑制金黄色葡萄球菌生物被膜的形成[J]. 微生物学通报, 2020, 47(3): 813-820. DOI:10.13344/j.microbiol.china.190539.
[38] 何年安, 鲁怀伟, 储新民, 等. 超声靶向微泡破坏增强万古霉素活性治疗生物膜感染的实验研究[J]. 中国超声影像学杂志, 2013,22(12): 1080-1084. DOI:10.3760/cma.j.issn.1004-4477.2013.12.022.
[39] XAVIER K B, BASSLER B L. LuxS quorum sensing: more than just a numbers game[J]. Current Opinion in Microbiology, 2003, 6(2): 191-197. DOI:10.1016/S1369-5274(03)00028-6.
[40] KANG Jiamu, LIU Liu, LIU Meihui, et al. Antibacterial activity of gallic acid against Shigella flexneri and its effect on biofilm formation by repressing mdoH gene expression[J]. Food Control, 2018, 94: 147-154. DOI:10.1016/j.foodcont.2018.07.011.
[41] ZHANG W J, WEI S P, WU W J. Preliminary studies on the antibacterial mechanism of Yanglingmycin[J]. Pesticide Biochemistry and Physiology, 2018, 147: 27-31. DOI:10.1016/j.pestbp.2017.05.011.
[42] RAI M, PARALIKAR P, JOGEE P, et al. Synergistic antimicrobial potential of essential oils in combination with nanoparticles:emerging trends and future perspectives[J]. International Journal of Pharmaceutics, 2017, 519(1/2): 67-78. DOI:10.1016/j.ijpharm.2017.01.013.
[43] RAŠKOVIĆ A, MILANOVIĆ I, PAVLOVIĆ N, et al. Antioxidant activity of rosemary (Rosmarinus officinalis L.) essential oil and its hepatoprotective potential[J]. BMC Complementary and Alternative Medicine, 2014, 14(1): 225-233. DOI:10.1186/1472-6882-14-22.