核桃营养保健价值极高[1-2],其脂肪组成中不饱和脂肪酸相对含量高达90%以上,因此也极易发生氧化酸败而影响其产品的品质和货架期,故有效控制氧化就成为核桃生产中亟待突破的瓶颈。
核桃仁油脂氧化产生一系列的氧化产物,从感官上不仅能闻到氧化的油脂哈败味,还能观察到核桃仁表面出现渗油现象,核桃仁氧化过程中细胞组织结构也发生变化,但有关核桃果仁氧化酸败细胞结构的变化鲜有研究报道。已有研究主要集中在核桃果仁从胚发育到成熟时细胞组织微观结构的变化[3],以及观察核桃果实细胞结构微观领域的研究[4-5],如李永涛[6]、陈虹[7]和王蓓[8]等通过石蜡切片技术、超薄切片技术、组织化学技术和显微观察法相结合,观察了核桃果实发育过程中种仁的细胞组织结构、脂肪的转化形成和油体的形态,而对于核桃果仁从鲜果到干果及干果贮藏加工过程中细胞组织结构,特别是氧化过程中细胞结构变化的研究尚少。核桃果仁氧化出现渗油现象表明核桃氧化过程中细胞结构发生了明显的变化,渗油将加速核桃果仁的氧化,因此,研究核桃坚果仁氧化过程中细胞组织结构的变化规律,揭示渗油的机制,对进一步从细胞结构层面深入了解油脂氧化酸败机理,并在此基础上开发新的抗氧化技术具有重要的理论意义和实践价值。
拉曼光谱技术是近年来发展应用的一种测定食品品质的新技术,与传统的油脂氧化分析方法相比,具有简单、直接、快捷,样品无需复杂预处理、受中间氧化产物影响小等优势。拉曼光谱可以提供不同官能团的分子结构信息,源于分子中极化率的改变[9]。非极性的化学键(如C=C双键)具有较强的拉曼散射[10]。因此,通过拉曼光谱技术可以获得在传统方法检测中难以获得的分子基团信息,更清晰地展现油脂氧化时发生的结构变化,确定其氧化程度。本研究运用光学显微镜和透射电子显微镜技术,观察了核桃仁的细胞组织结构,并比较分析了常温氧化和60 ℃加速氧化过程中核桃仁细胞结构的变化规律,结合核桃油脂的过氧化值测定和拉曼光谱分析,探究不同氧化程度核桃仁细胞显微结构的变化规律,旨在揭示核桃仁氧化酸败的细胞结构变化规律及其关键点,为开发控制核桃氧化酸败的新技术提供科学依据,从而保持核桃的营养健康价值,延长核桃果仁货架期。
1 材料与方法
1.1 材料与试剂
成熟的核桃仁(河北绿岭核桃)于2018年9月采收,采后干制至水分质量分数5%,塑料袋包装,室温下存放,2019年4月制作切片用于实验研究。
冰乙酸、三氯甲烷、碘化钾、硫代硫酸钠、石油醚(沸程30~60 ℃)、重铬酸钾、淀粉、无水乙醇、磷酸缓冲液、盐酸溶液、焦亚硫酸钠(均为分析纯)北京化工厂;高碘酸(纯度99%)、二甲苯 上海麦克林生化科技有限公司;席夫试剂、考马斯亮蓝R250、苏木精、伊红、苏丹III、甘油 北京索莱宝公司;中性树胶、OCT(optimal cutting temperature compound)包埋剂北京中杉金桥生物公司;标准固定液(FAA)、戊二醛固定液 上海源叶生物公司;锇酸、环氧树脂包埋剂、醋酸双氧铀 加拿大SPI-Chem公司。
1.2 仪器与设备
RM2245型半自动轮转式切片机、CM1850型冷冻切片机 德国徕卡仪器有限公司;CX41型光学显微镜上海光学仪器一厂;H-7500型透射电子显微镜 日本日立公司;R-201型旋转蒸发器 上海申生科技有限公司;LabRAM HR Evolution型新一代高分辨拉曼光谱仪法国HORIBA Jobin Yvon公司。
1.3 方法
1.3.1 不同温度条件加速氧化核桃仁处理
为更好地观察研究日常条件存放核桃的氧化情况,设置了常温氧化组,但常温条件存放周期长,有可能无法观察到氧化后期的结果,故设置一组60 ℃加速氧化组,以实验开始时期的核桃仁放入冰箱冷冻作为对照组。每组处理5 份核桃仁,每份100 g,密封包装,每隔7 d随机选取5 个完整的核桃仁(子叶部分),分别进行制片、细胞结构观察和氧化程度测定。
1.3.2 核桃仁细胞组织结构观察
1.3.2.1 石蜡切片制作与细胞结构观察
核桃仁切片处理:选取完整的核桃仁进行处理,普通刀片切取核桃仁同一部位(子叶),切成厚度为5 mm左右的薄片,切面保持光滑、平整,然后参考李永涛[6]的方法进行下述石蜡切片制作。
石蜡切片制作:实验材料→标准固定液(FAA)固定24 h→梯度乙醇(50%、70%、85%、95%、100%,每个梯度2 h)脱水→二甲苯透明(体积分数50%二甲苯+体积分数50%乙醇、纯二甲苯2 次,每个梯度2 h)→浸蜡和包埋→半自动轮转式切片机进行连续切片(4 μm)→展片、粘片、晾片。
组织化学染色观察细胞结构。鉴定细胞组织多糖的高碘酸-席夫反应参照王蓓[8]的方法:0.5%(体积分数,后同)的高碘酸溶液浸泡处理30 min→水洗2 min→席夫试剂处理30 min→焦亚硫酸钠洗涤液洗涤4 min→水洗5 min→干燥。鉴定细胞组织蛋白质的考马斯亮蓝R250染色参照李永涛[6]的方法:7%冰乙酸溶液处理2 min→考马斯亮蓝R250 60 ℃下染色10 min→0.1%冰乙酸溶液处理1 min→水洗5 min→干燥。细胞中除核之外其他成分的苏木精-伊红染色参照李红芬等[11]的方法:苏木精染液染色5~15 min→水洗多余染液→0.5%~1%盐酸-乙醇溶液浸泡2~3 min→蒸馏水洗涤10 s→0.1%~0.5%伊红染液染色1~5 min→70%、85%、95%、100%乙醇脱水(每个梯度2~3 min)→二甲苯透明→中性树胶封片。
光学显微镜观察切片并拍照。
1.3.2.2 冷冻切片制作与细胞结构观察
参考Li Jianxia等[12]方法进行冷冻切片制作与细胞结构观察。核桃仁的前处理同1.3.2.1节石蜡切片,样品→OCT包埋剂中浸没20 min→-20 ℃下冷冻30 min→调节冷冻切片机切片(5 μm)。细胞结构观察:切片→苏丹III试剂染色30 min→蒸馏水洗3 次→50%甘油封片→光学显微镜观察并拍照。
1.3.2.3 超薄切片制作和细胞结构观察
参考陈虹[7]和王蓓[8]等方法进行超薄切片制作和细胞结构观察。将核桃仁修整为小块长方体材料→2.5%戊二醛固定液固定3 h→磷酸缓冲液洗涤3 次→4 ℃、1%锇酸溶液固定16 h→脱水→渗透→环氧树脂包埋→切片(80 nm)→1%柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液染色5~10 min→透射电子显微镜观察。
1.3.3 核桃仁氧化程度的测定
1.3.3.1 核桃油的制备
取混合均匀的样品30 g,每组样品取5 份,粉碎后置于250 mL广口瓶中,按照体积比1∶10加入适量石油醚(沸程30~60 ℃)进行溶解[13-14],摇匀,待完全混合后进行密封处理,静置浸提12 h以上,根据石油醚沸程不同,使用旋转蒸发仪减压蒸干石油醚,剩余样品为待测油样。
1.3.3.2 过氧化值的测定
参考GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》测定核桃仁过氧化值。
1.3.3.3 拉曼光谱分析
采用LabRAM HR Evolution型新一代高分辨拉曼光谱仪进行拉曼光谱分析,选用532 nm的激光光源,物镜使用5 倍焦距镜头。用毛细管吸取2 μL核桃油,将其置于LabRAM HR Evolution型新一代高分辨拉曼光谱仪载物台的物镜视野下并找到合适的位置,调整焦距至清晰可见。设置扫描参数为光栅600 mm-1、功率100%、积分时间30 s、扫描次数1 次、扫描范围600~2 000 cm-1,在视野中取点检测。
1.4 数据统计与分析
数据以平均值±标准差表示,采用SPSS软件中单因素方差分析法进行显著性分析,以P<0.05表示差异显著,采用Pearson法对数据进行相关性分析。采用Labspec 5软件进行拉曼光谱基线的调平。采用Origin 8.0软件作图。
2 结果与分析
2.1 核桃仁细胞组织结构观察结果
核桃仁属种仁结构,其最外层为内种皮,一层黄色膜衣,包裹着核桃仁,核桃仁中间存在间隙(图1)。核桃仁中各组分相对含量以脂肪最多,约60%以上,蛋白质约15%,碳水化合物约15%[15-16]。核桃仁的细胞组织结构采用石蜡制片、光学显微镜观察,即可清晰看到,为更清晰地观察核桃仁细胞组织中结构及组成成分分布,分别采用多糖染色的席夫试剂(呈紫红色)、蛋白质染色的考马斯亮蓝R250(呈蓝色)和细胞中除细胞核之外其他所有物质染色的苏木精-伊红(呈红色)切片。细胞内的脂肪采用苏丹III染色(橘黄色)。因石蜡切片制作过程用到的二甲苯溶剂能将脂肪溶解去除,导致制片后的细胞中无脂肪存在,因此,核桃脂肪的观察不使用二甲苯溶剂制片的冷冻切片。
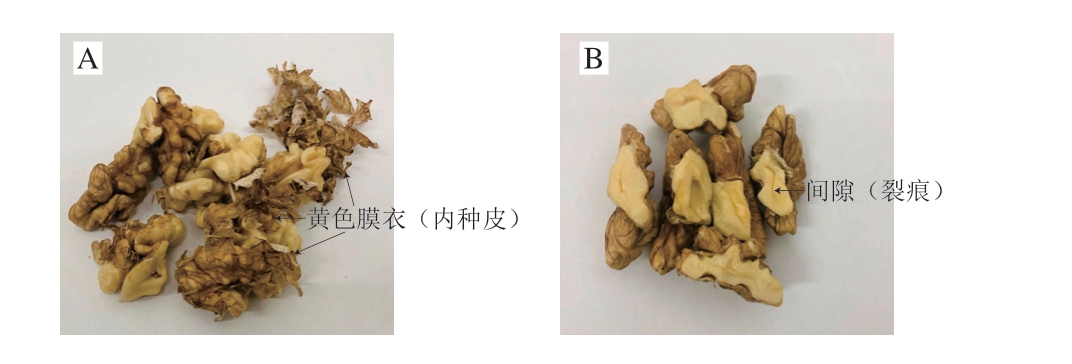
图1 核桃仁的黄色膜衣和间隙
Fig. 1 Endotesta and crack of walnut kernels
2.1.1 核桃仁内种皮及表层结构
经过石蜡切片处理和席夫试剂、考马斯亮蓝R250、苏木精-伊红染色后,在光学显微镜下观察可见,内种皮结构由6~7 层细胞组织构成(图2),内种皮细胞组织是由输送营养物质的类似维管束结构和不规则形状的细胞组成,细胞内未见任何物质,由于它由几层疏松的细胞层组成,具有缓冲外力的作用,因而对核桃仁起到了良好的保护作用。
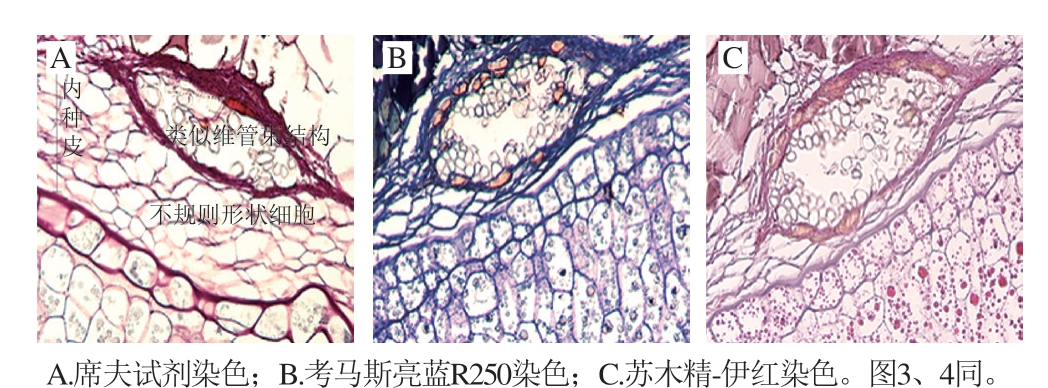
图2 不同染色制片的核桃仁内种皮及其皮层细胞组织结构(×40)
Fig. 2 Microscopic structure of walnut seed coat and its cortex with different staining preparation (× 40)
2.1.2 皮层细胞组织
紧邻核桃内种皮内侧的是一层排列紧密的、中等大小的矩形厚壁细胞组织(图3),细胞壁比其他层细胞的细胞壁明显增厚,其将内种皮和核桃仁内部组织分开,此层细胞的上下细胞壁很厚,约2~3 μm,比其左右侧细胞壁厚,细胞内可见大量直径约为0.2~1.0 μm的颗粒状物质,经考马斯亮蓝R250染色后呈现蓝色,为蛋白质颗粒(图3B)。紧贴表皮层内侧的是一层体积变小、排列紧密的方圆形细胞,细胞壁未增厚。皮层细胞组织这种特殊结构具有致密、抗挤压等特点,对核桃仁内层细胞起到了很重要的阻隔和抗挤压保护作用。
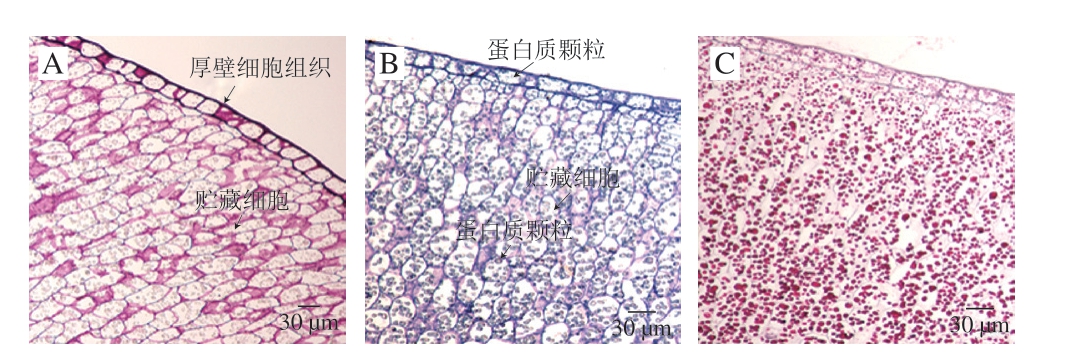
图3 不同染色制片的核桃仁皮层内侧细胞组织结构(×20)
Fig. 3 Microscopic structure of medial cells in walnut kernel cortex with different dyeing preparation (× 20)
2.1.3 内层贮藏细胞组织
贮藏细胞是构成核桃仁主体的细胞组织。观察图3、4可知,贮藏细胞的形状由靠近皮层细胞的类椭圆形到中心部位后逐渐变为直径约25~30 μm的圆形,每瓣(即核桃仁中1/4小瓣)核桃仁中间有一条裂痕,形为条带状的结构为核桃仁中间裂痕处细胞层,由中心部位到接近裂痕部位细胞呈圆形,直径与中心部位一致,裂痕边缘处细胞变小,直径约为9~10 μm,与类椭圆形相比,绝大多数贮藏细胞为圆形。从核桃仁表皮细胞至中心部位最后到裂痕部位细胞变化明显,直径由小变大,再变小,层次分明。分析可知凡核桃仁边缘处,紧邻外界空气层细胞体积都较小且致密,由此表明核桃仁外层细胞都具有一定的坚硬结构和致密性,以保护内层细胞。内含物蛋白质颗粒直径由外层细胞(图3)向内层细胞(图4)变化规律与细胞直径的变化规律一致,直径变化为2 μm→5 μm→1~2 μm,较为均匀地分散于贮藏细胞中,不同部位每个贮藏细胞内蛋白体数量基本一致,约为10~13 个,偶尔出现个别贮藏细胞中蛋白体数量较少的情况。
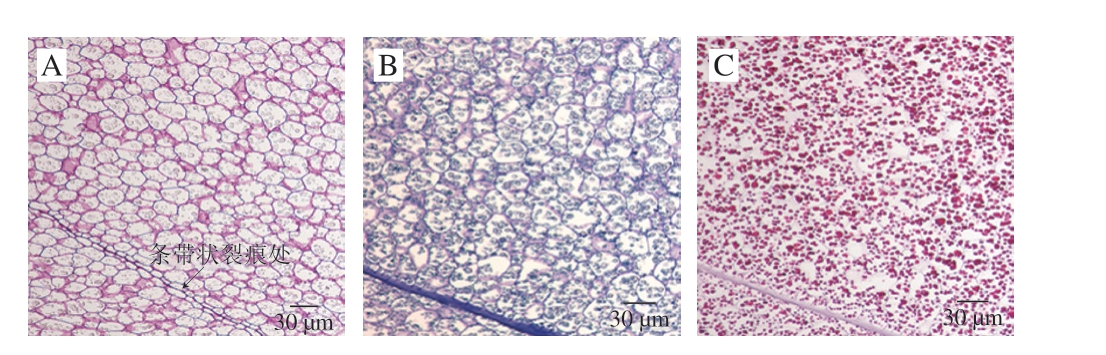
图4 不同染色制片的核桃仁中心层细胞组织结构(×20)
Fig. 4 Microscopic structure of central layer cells in walnut kernels with different staining preparation (× 20)

图5 苏丹III染色后细胞组织中脂肪的分布(×40)
Fig. 5 Distribution of fat in cells with Sudan III staining (× 40)

图6 核桃仁细胞中脂肪与蛋白质的分布(×3 500)
Fig. 6 Distribution of fat and protein in walnut kernel cells (× 3 500)
由于核桃脂肪含量过高,制片切片时会破坏细胞及油体结构,造成脂肪外溢扩散,呈现为光亮的小油滴(图5)。因光学显微镜对核桃细胞组织结构的观察分辨率有限,无法清晰观察到细胞的微观结构,需采用透射电子显微镜来观察。如图6所示,经透射电子显微镜观察,成熟干制后的核桃仁贮藏细胞中无细胞器,仅有脂肪和蛋白质颗粒(蛋白体)[17]存在。脂肪以大小较均匀的油滴(又称油体,油料细胞中油脂的主要储存结构)形式充满细胞内,蛋白体分散在脂肪中。油体大小相对均匀,平均直径约为3~4 μm。研究表明,细胞内油体分布在一个蛋白网络中[18]。油体中有一种称为Oleosins的蛋白质在维持油体的稳定方面发挥重要作用[19-20],称其为油体膜,能够防止油体破裂,维持油体的完整和细胞内脂肪的稳定。
2.2 核桃仁氧化过程中细胞超微结构的变化
由图7、8透射电子显微镜观察图可知,不同温度下存放核桃仁氧化过程中,其细胞结构发生一系列有规律的变化,60 ℃加速氧化组细胞结构变化较大。
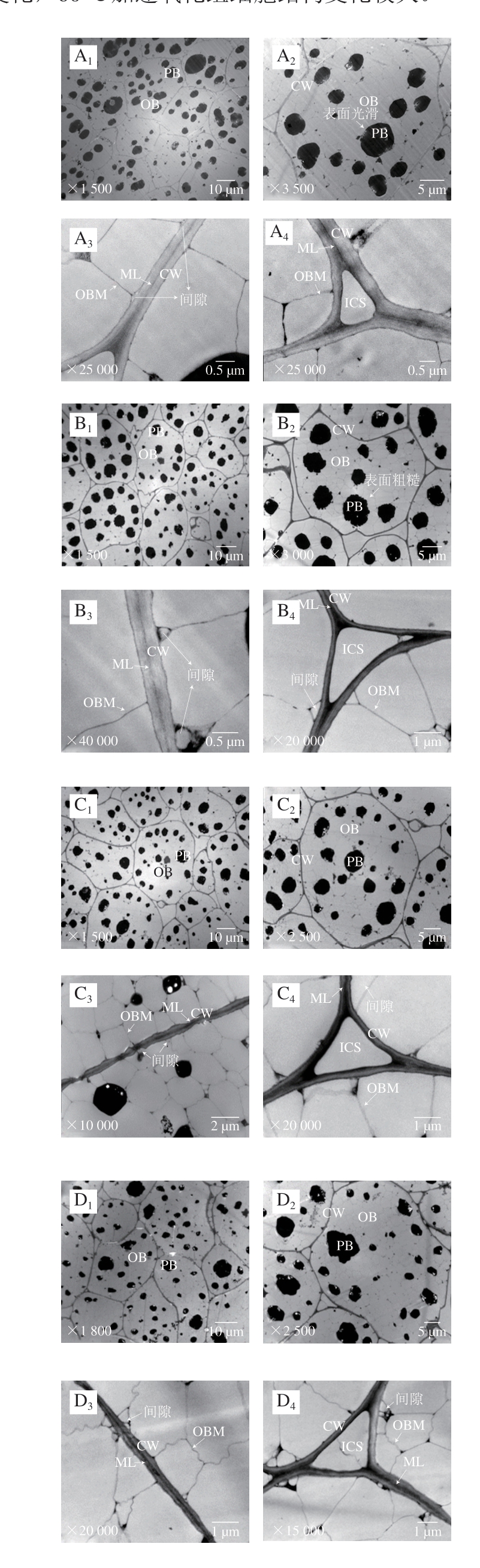
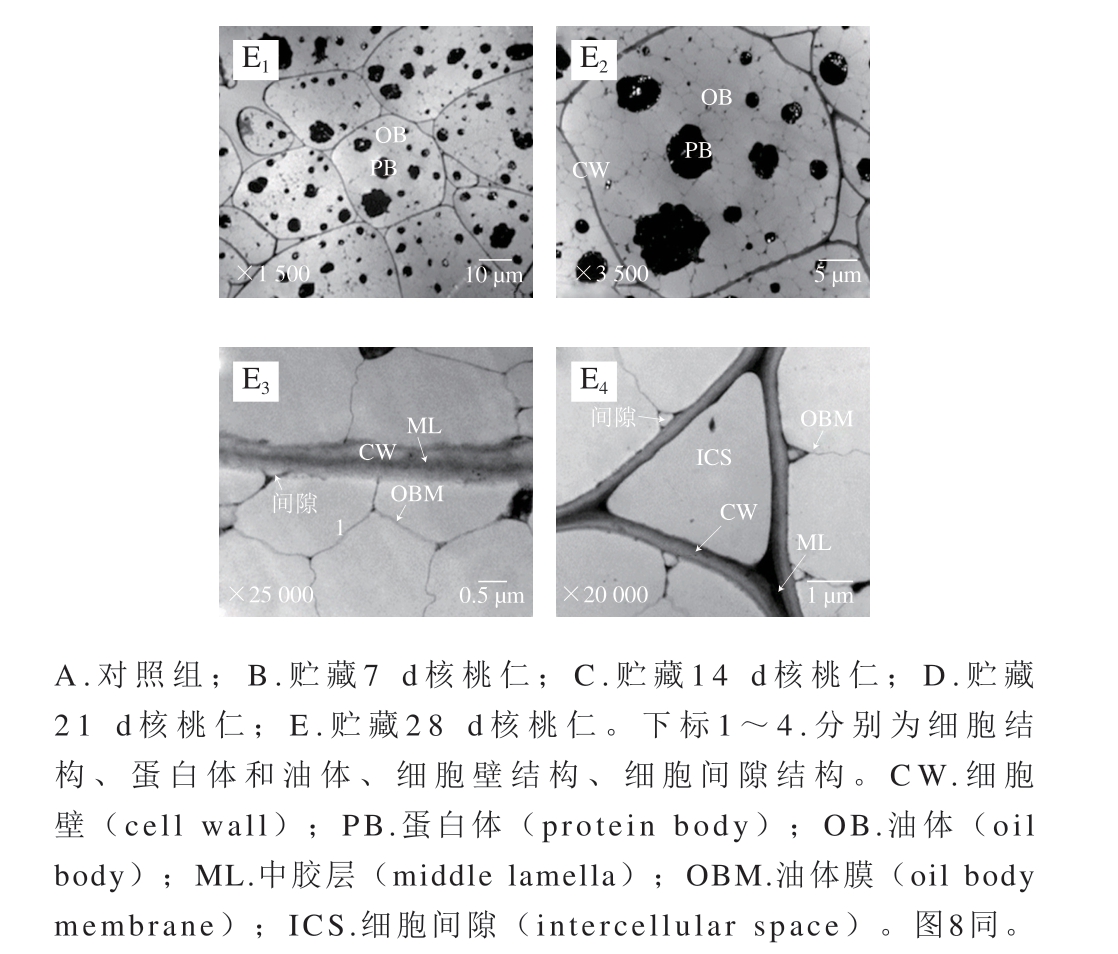
图7 常温下不同氧化时间核桃仁细胞超微结构的变化
Fig. 7 Ultrastructural changes of walnut kernel cells during oxidation at normal temperature
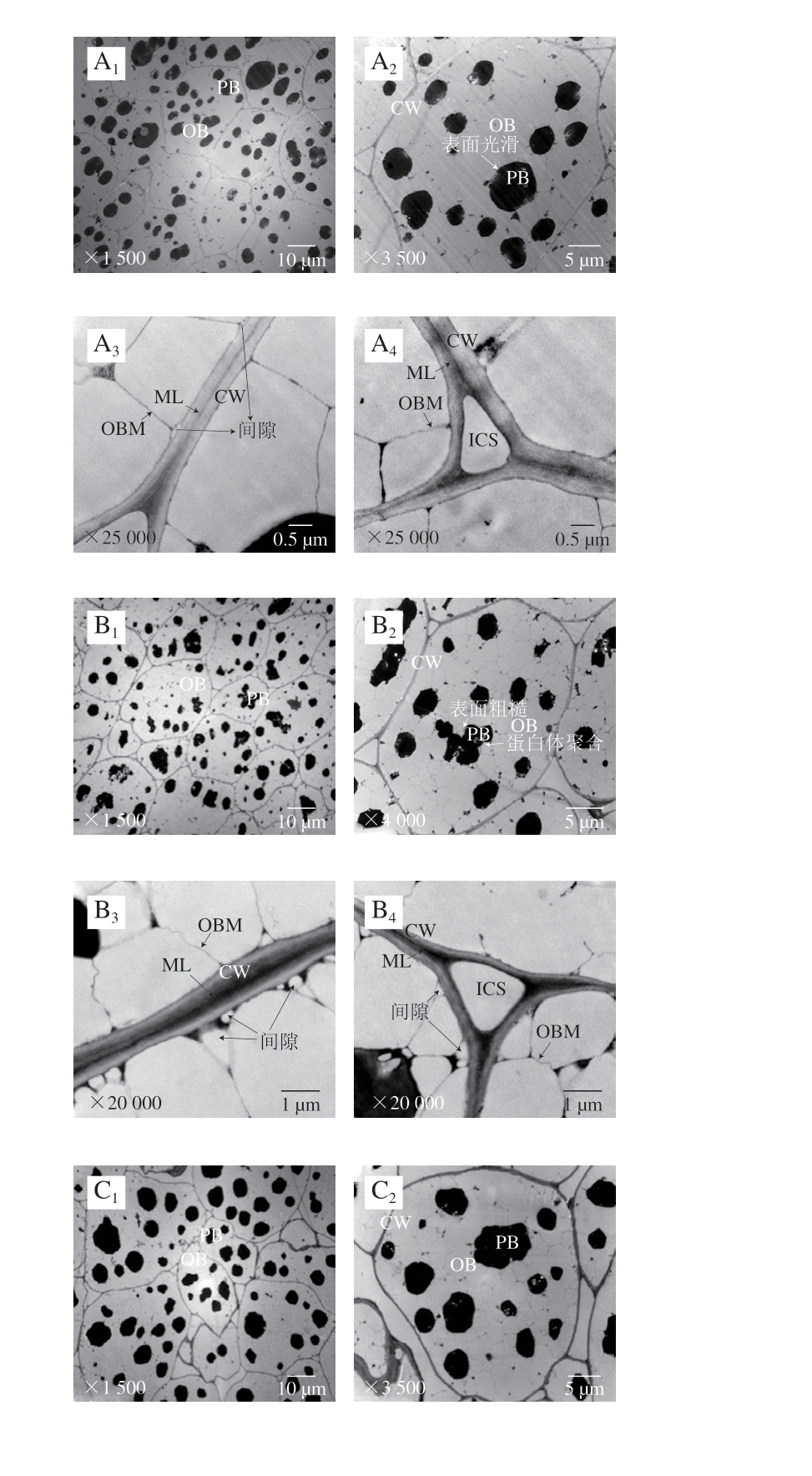
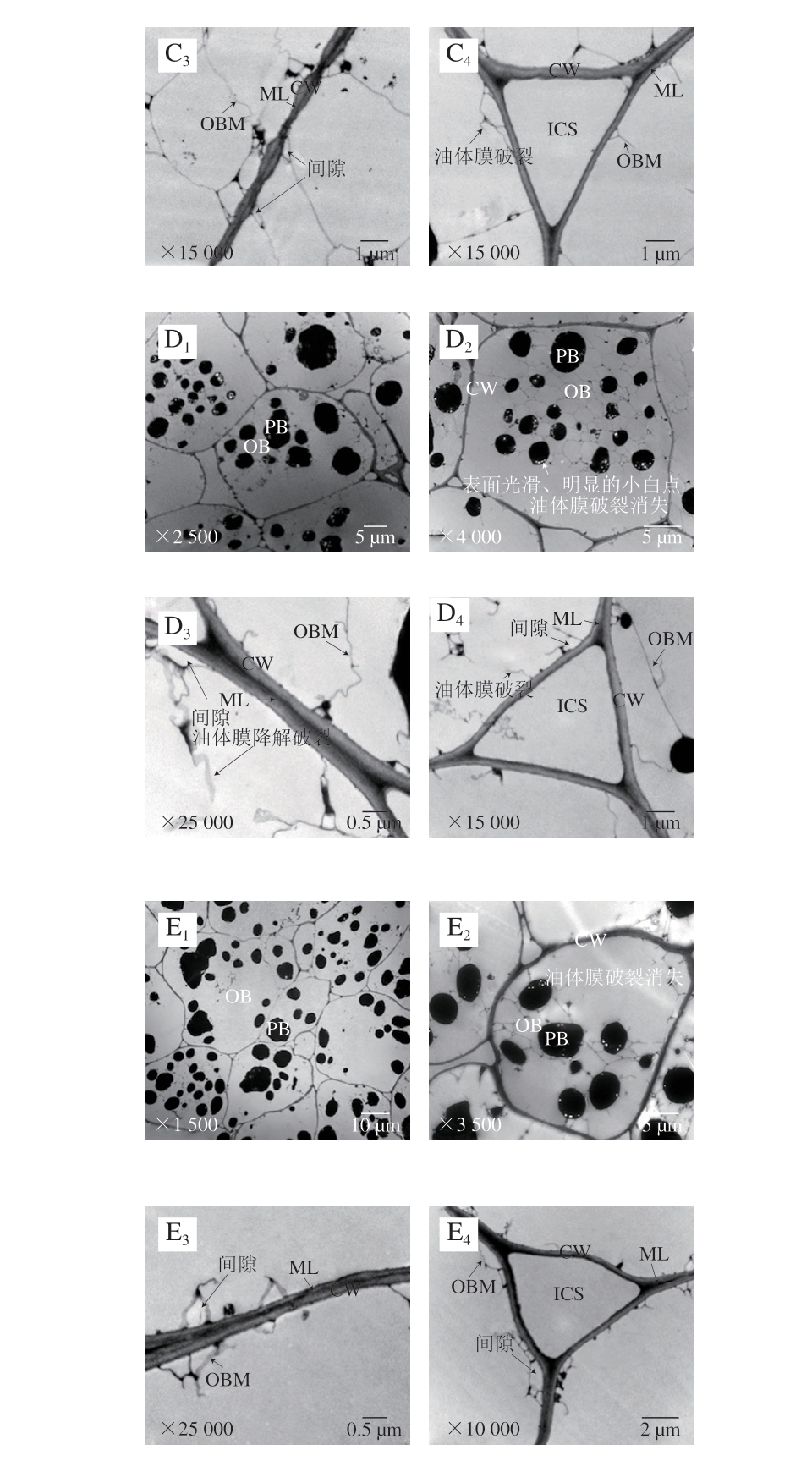
图8 60 ℃条件下不同氧化时间核桃仁细胞超微结构的变化
Fig. 8 Ultrastructural changes of walnut kernel cells during oxidation at 60 ℃
2.2.1 蛋白体的变化
通过透射电子显微镜观察,对照组的蛋白体形状呈圆形或椭圆形,大小相对均匀,直径约为4~5 μm,均匀分散在细胞中,周围是大量的脂肪体(图7A1、A2)。常温氧化组随着氧化时间的延长,从第14天开始,部分蛋白体直径减小为1~2.5 μm(图7C1、D1、E1),并且表面不光滑(图7B2、C2、D2、E2)。60 ℃加速氧化组在第0~7天时,蛋白体出现与常温条件下第14~21天较一致的变化趋势(图8B1),表明加速氧化的同时加速了核桃仁细胞结构的破坏,加速氧化后期均观察到蛋白体向细胞一侧移动聚集的现象,蛋白体上出现了小白点。但蛋白体表面没有出现明显的不光滑现象(图8D1、D2、E1、E2)。蛋白体上出现的小白点结构尚不知其具体成分、功能及形成原因,有待后续研究。
2.2.2 油体及油体膜的变化
对照组的油体呈不规则五边形,直径约为3~4 μm,占细胞体积的大部分,油体膜呈线性致密结构,随着氧化时间的延长,常温氧化组和60 ℃加速氧化组的油体膜逐渐皱缩(图7D3、D4、E3、E4),后者油体膜更大量地发生破裂消失(图8D2、E2),表明高温加剧了油体膜的破坏。
2.2.3 细胞壁和细胞间隙的变化
贴近细胞壁处的油体与细胞壁之间有一定的空隙,但不明显(图7A2、A3、A4);随着氧化时间的延长,常温氧化组细胞壁与油体膜间隙明显增大,在第21天时油体膜出现明显的皱缩(图7D3、D4),60 ℃加速氧化组第7天时,细胞壁与油体膜间隙和油体膜发生与常温组同样的变化,但程度加剧(图8B3、B4),表明高温条件加速了核桃仁细胞结构的破坏,加速氧化后期观察到油体膜皱缩程度逐渐加深,第14天时,靠近三细胞间隙细胞壁周围的油体膜降解破裂(图8C4)。第21天时靠近细胞壁的油体膜开始大量破裂(图8D2、D3、D4、E2、E3、E4),靠近三细胞与双细胞间隙的细胞壁周围油体膜出现同等程度的破坏。
对照组的细胞壁平滑,结构致密且完整,厚薄均匀,胞壁边缘整齐,紧贴细胞壁的中胶层电子密度高,呈“明-暗-明”区域结构(图7A3、A4)。不同处理组的细胞壁随着氧化时间的延长逐渐皱缩,厚薄变得不均一,但未破裂,中胶层由“明-暗-明”区域结构逐渐变得模糊,60 ℃氧化组的变化较常温氧化组明显,第28天中胶层甚至有产生间隙的趋势(图8E3)表明细胞壁发生了一定程度的分解变化。
2.3 核桃仁氧化过程中过氧化值的变化
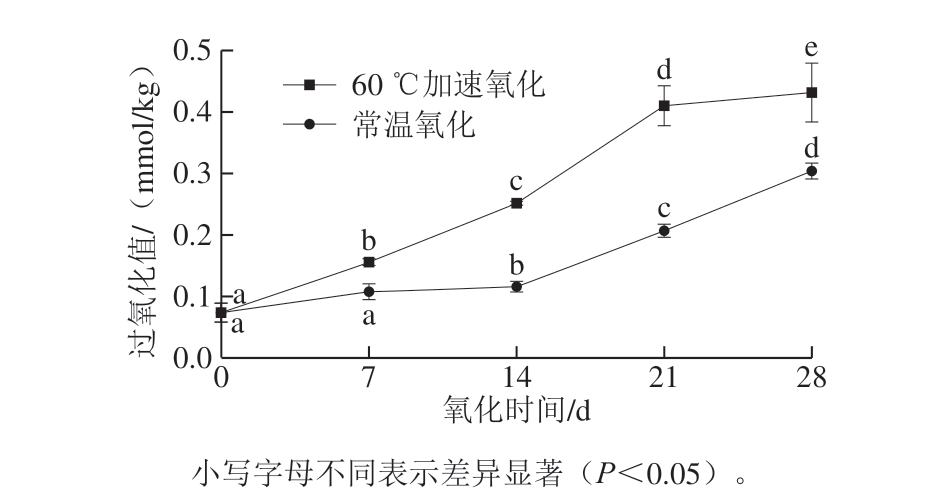
图9 不同氧化条件和时间核桃油脂过氧化值的变化
Fig. 9 Changes in peroxide value of walnut oil under different storage conditions
图9显示,随着氧化时间延长,常温和60 ℃氧化处理核桃的油脂过氧化值都呈逐渐上升趋势,60 ℃氧化组过氧化值显著高于常温组(P<0.05),两组处理的核桃油脂在第14~21天氧化进程突然加剧,常温氧化和加速氧化的过氧化值分别增大约75%、64%,与同时期核桃仁细胞结构中油体膜明显皱缩和大量发生破裂的情况一致,油体膜的结构遭到较大程度的破坏后,造成油脂外溢,进一步加剧氧化反应,导致出现过氧化值增大的结果。
2.4 核桃仁氧化过程中油脂的拉曼光谱分析结果
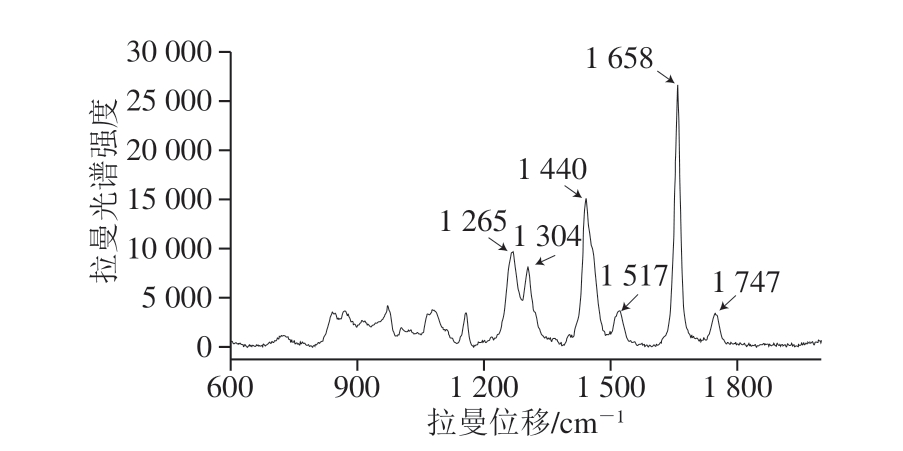
图10 核桃油脂的拉曼光谱图
Fig. 10 Raman spectrum of walnut oil
如图10所示,各特征峰代表其组分的分子基团结构信息,核桃油脂的拉曼峰主要集中于600~1 800 cm-1的拉曼位移范围内,其中1 658 cm-1处的峰是核桃油脂的主要峰,其强度(峰高)与不饱和烯烃键的含量成正比关系。油脂酸败的本质是其中不饱和脂肪酸双键发生氧化[21],因此,拉曼光谱强度峰值可反映核桃油脂的不同氧化程度[22]。
拉曼光谱强度表示拉曼散射光强弱的信号值,一般以光子计数值表示[23]。拉曼光谱强度IR可以如下式表示。
式中:I0为激光强度;n为待测物分子密度;dσ/dΩ为拉曼截面积;Ω为光收集角度;Le为路径长度;υR和υ0分别为拉曼频率和入射光频率。
如图11、12所示,随着氧化时间的延长,可以很清晰地观察到不同氧化温度组1 658 cm-1特征峰的拉曼光谱强度总体呈下降趋势,第7天到第14天,特征峰强度有小幅度的衰减,无明显变化,但是在第14天到第21天,特征峰的强度较大幅度下降,常温和加速氧化组分别下降了5.24%、10.92%。常温和加速氧化组在第28天时特征峰的强度分别较对照组下降了12.22%、31.07%。由此可知,60 ℃加速氧化下核桃油脂拉曼光谱强度的衰减速率比常温氧化更快,表明拉曼光谱分析能较准确地反映出核桃油脂的氧化特性。
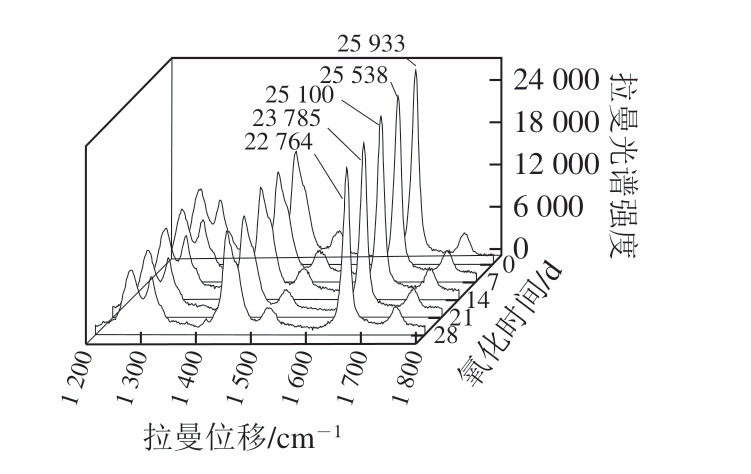
图11 常温氧化核桃油脂拉曼光谱图
Fig. 11 Raman spectrum of oxidized walnut oil stored at normal temperature
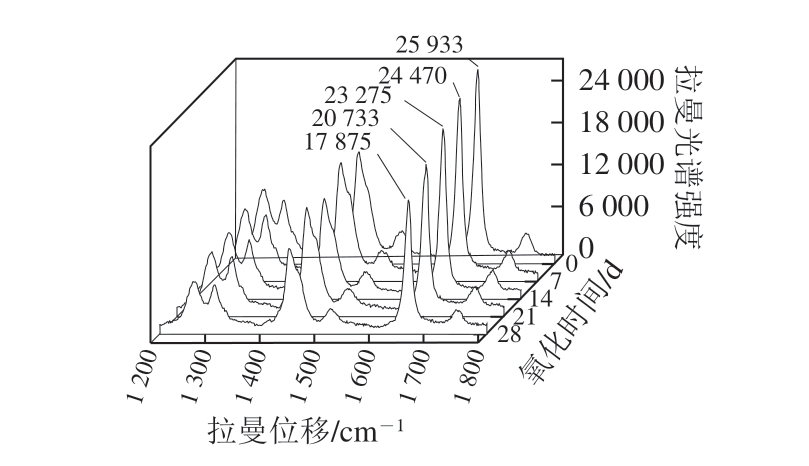
图12 60 ℃氧化核桃油脂拉曼光谱图
Fig. 12 Raman spectrum of oxidized walnut oil stored at 60 ℃
2.5 核桃仁氧化过程中细胞结构变化与拉曼光谱强度、过氧化值的相关性分析结果
表1 核桃仁氧化过程中细胞结构变化与拉曼光谱强度、过氧化值的对应
Table 1 Changes in cell structure corresponding to Raman intensity and peroxide value during oxidation of walnut kernels
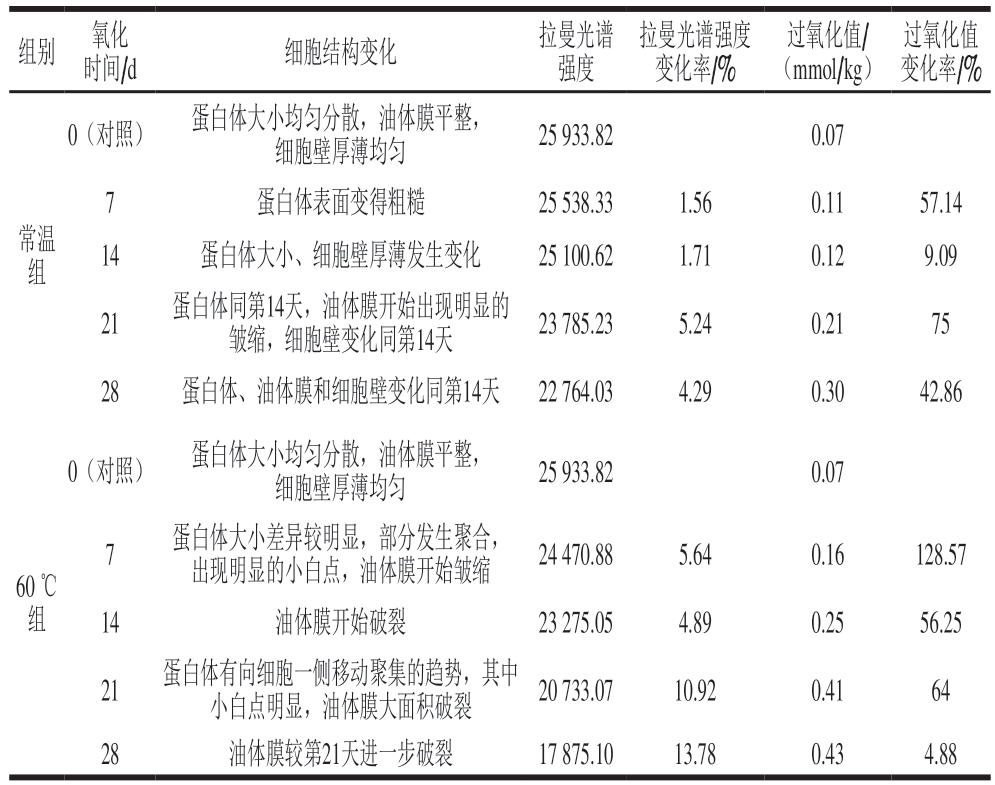
组别 氧化时间/d 细胞结构变化 拉曼光谱强度拉曼光谱强度变化率/%过氧化值/(mmol/kg)过氧化值变化率/%0(对照) 蛋白体大小均匀分散,油体膜平整,细胞壁厚薄均匀 25 933.82 0.07蛋白体表面变得粗糙 25 538.33 1.56 0.11 57.14 14 蛋白体大小、细胞壁厚薄发生变化 25 100.62 1.71 0.12 9.09 7常温组21 蛋白体同第14天,油体膜开始出现明显的皱缩,细胞壁变化同第14天 23 785.23 5.24 0.21 75 28 蛋白体、油体膜和细胞壁变化同第14天 22 764.03 4.29 0.30 42.86 0(对照) 蛋白体大小均匀分散,油体膜平整,细胞壁厚薄均匀 25 933.82 0.07 60 ℃组7 蛋白体大小差异较明显,部分发生聚合,出现明显的小白点,油体膜开始皱缩 24 470.88 5.64 0.16 128.57 14 油体膜开始破裂 23 275.05 4.89 0.25 56.25 21 蛋白体有向细胞一侧移动聚集的趋势,其中小白点明显,油体膜大面积破裂 20 733.07 10.92 0.41 64 28 油体膜较第21天进一步破裂 17 875.10 13.78 0.43 4.88
由表1可知,常温条件下,随着氧化进展到第7天,细胞结构上蛋白体先发生变化,表面变得粗糙;第14天时蛋白体变得大小不等,可能发生了蛋白体的破碎和聚合,同时细胞壁也变得厚薄不均;第21天时,油体膜出现明显的皱缩,此时,拉曼光谱强度较第14天降低5.24%,过氧化值升高了75%。而60 ℃加速氧化7天时蛋白体就发生明显变化,拉曼光谱强度较对照组降低5.64%,过氧化值升高128.57%。之后每个周期的测定值都较前一个周期发生明显变化,表明60 ℃的高温条件下,核桃仁氧化速度明显加快。细胞结构上,第14~21天油体膜开始发生破裂直至大面积破裂且蛋白体向细胞一侧移动聚集,第28天时,油体膜进一步破裂,拉曼光谱强度变化剧烈,较第21天降低了13.78%,而过氧化值的上升幅度趋缓,较第21天上升了4.88%,这可能与油脂的氧化反应进入二级氧化有关。上述结果表明,核桃仁的氧化伴随着细胞结构发生渐进深入的结构破坏性变化,蛋白体的变化先于油体膜的变化,油体膜明显皱缩直到破裂时,核桃仁氧化加剧,细胞结构的变化与过氧化值和拉曼光谱强度有标志性的对应关系。
2.6 核桃油脂氧化过程中过氧化值与拉曼光谱相关性分析结果
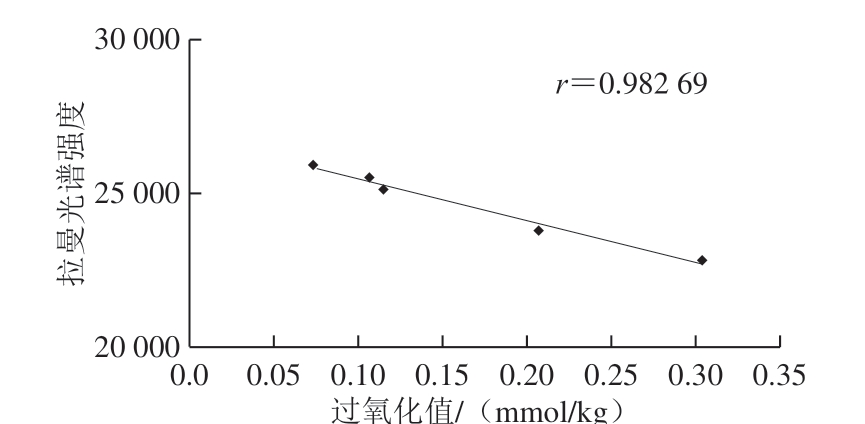
图13 常温氧化核桃油脂拉曼光谱强度与过氧化值的相关性
Fig. 13 Relationship between Raman intensity and peroxide value of walnut oil under ambient oxidation at 60 ℃
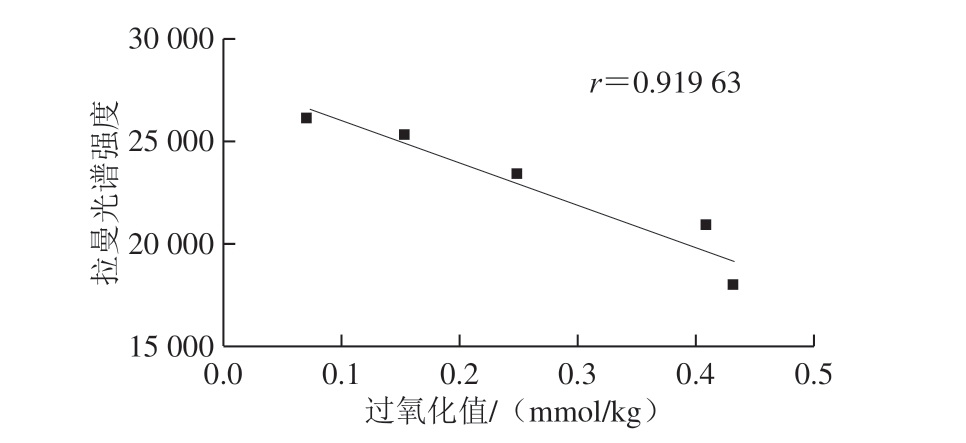
图14 60 ℃氧化核桃油脂拉曼光谱强度与过氧化值的相关性
Fig. 14 Relationship between Raman intensity and peroxide value of walnut oil under accelerated oxidation at 60 ℃
如图13、14所示,常温和60 ℃条件下氧化第28天,核桃仁油脂的拉曼光谱强度与过氧化值均呈线性相关性,相关系数分别为0.982 69和0.919 63,常温下的相关关系达到0.98以上,优于60 ℃条件的相关系数,表明常温条件下拉曼光谱分析能较准确地反映出核桃油脂氧化前期的氧化特性。而加速氧化条件下,核桃油脂氧化进程加快,氧化反应进入二级氧化有关,过氧化值已不能准确反映油脂的氧化程度,因而,相关系数线性关系较低。由于拉曼光谱分析操作简单快速,在生产实践中,用拉曼光谱分析核桃和核桃油脂货架期前期的品质和氧化特性具有重要的实践意义。
3 讨 论
核桃油脂以油体的形式被油体膜包裹,与蛋白体均匀分散分布在细胞内,从结构上看,核桃仁贮藏细胞中油体外层有油体膜、细胞壁、皮层厚壁细胞组织、内种皮层细胞组织,以及最外层的核桃壳包裹,5 层结构组织将外界空气阻隔,形成层层防护,且核桃仁化合物组成中含有相当丰富的多酚[24]、黄酮[25]和VE[26]等抗氧化成分。但核桃坚果仁存放过程中仍然会发生严重的氧化。尽管核桃油脂不饱和脂肪酸含量高,但其结构上的层层防护对阻隔空气的进入应该具有一定的效果,且核桃壳避光,故光敏氧化的影响可以不考虑,那么,核桃的氧化机制就只能是自动氧化和酶促氧化,但上述结构组织能够阻隔空气,意味着氧气的影响较小,无论是自动氧化和酶促氧化的作用都受到抑制,由此表明核桃仁的氧化机制很复杂。
本实验对核桃仁氧化过程中细胞结构变化的初步研究表明,核桃仁细胞中的蛋白体表面变得粗糙、出现小白点,油体膜发生皱缩、裂解等剧烈变化,与核桃油脂的氧化进程相关性大,氧化影响了蛋白体和油体膜的结构,二者结构变化与氧化的相互关系以及在氧化过程中的作用尚不清楚,有待进一步深入研究。
蛋白体结构变化中,表面出现小白点,此现象在胡杨种子细胞蛋白体中也得到证实[27],Tully等[28]的研究表明,蛋白体由拟晶体和蛋白质基质组成,由单层膜包被,蛋白质基质中可含有酶[29]和一个至多个大小不同的植酸钙镁球状体[28],后者易与蛋白质结合,抑制酶活性,使其降解蛋白质的效率降低[30]。所以,随着氧化进程的加剧,细胞结构发生明显变化时,可能为植酸钙镁球状体的小白点增多,可认为其对蛋白质具有保护作用,该变化过程需进一步深入探讨研究。
前人的研究表明,蛋白质出现一侧移动聚集的趋势,可能与油脂和蛋白质之间维持平衡体系相关[31]。因此,在核桃仁细胞结构层面积极探索脂质与蛋白的相互作用、蛋白体和油体膜的分子结构是今后研究的重点。
油脂氧化产生的氢过氧化物、小分子醛类和自由基等氧化产物,对油体膜产生氧化损伤,导致油体膜皱缩破裂,证实了油脂氧化以及氧化产物对生物膜具有损伤作用[32-33],氧化后期细胞壁出现的厚薄不均现象促进了核桃仁出油。结合本研究结果,推测核桃油脂氧化出油的过程为:加速氧化后期,油体膜的破坏从细胞壁周围开始,油体膜破裂,细胞壁皱缩,中胶层离散,使细胞中溃散的油脂得以穿过细胞壁与遭到破坏的细胞膜,最后沿着细胞间隙渗出核桃仁表面,造成出油现象。
4 结 论
核桃仁细胞组织基本结构包括6~7 层细胞组成的内种皮组织,2 层厚壁细胞组成的皮层组织和大量的贮藏细胞组成的中心贮藏组织。贮藏细胞中充满形状不规则圆形、直径约为3~4 μm的油体,均匀分散着10~15 个直径约为4~5 μm的蛋白体。
核桃仁氧化过程中细胞结构变化规律:细胞中蛋白体表面由光滑变为粗糙,发生聚合和破碎,并向细胞一侧移动;细胞壁周围油体膜首先开始皱缩、逐渐皱缩加剧,直至破裂,并向细胞中心蔓延;细胞壁与油体膜间隙增大,细胞壁皱缩并出现厚薄不均匀,中胶层逐渐模糊不清晰。
核桃仁氧化与拉曼光谱的相关性:核桃氧化过程中,细胞内蛋白体和油体膜结构变化与过氧化值与拉曼光谱强度具有较好的相关性;常温条件下拉曼光谱强度与过氧化值之间线性关系良好,拉曼光谱分析可准确地反映出核桃油脂的氧化特性。
[1] CHOI Y, ABDELMEGEED M, AKBAR M, et al. Dietary walnut reduces hepatic triglyceride content in high-fat-fed mice via modulation of hepatic fatty acid metabolism and adipose tissue inflammation[J]. Journal of Nutritional Biochemistry, 2016, 30: 116-125. DOI:10.1016/j.jnutbio.2015.12.005.
[2] 吴素萍. 亚麻籽中α-亚麻酸的保健功能及提取技术[J]. 中国酿造,2010, 29(2): 7-11. DOI:10.3969/j.issn.0254-5071.2010.02.003.
[3] 兖攀, 彭方仁, 张瑞, 等. 美国山核桃嫁接愈合过程的组织细胞学观察[J]. 南京林业大学学报(自然科学版), 2018, 42(2): 202-206.DOI:10.3969/j.issn.1000-2006.201703067.
[4] 梁少茵, 林亮, 魏敏. 脂肪鉴定实验的改进[J]. 中学生物教学,2019(7): 44-46.
[5] 马艳萍, 王国梁, 刘兴华, 等. 60Coγ射线辐照对鲜食核桃贮藏期间胚细胞超微结构的影响[J]. 西北植物学报, 2010(7): 100-105.
[6] 李永涛. 核桃(Juglans regia)胚发育及其营养代谢动态研究[D]. 泰安: 山东农业大学, 2011: 18-22.
[7] 陈虹, 潘存德, 王蓓, 等. 核桃种子油体发育及不同品种种子子叶油体特征差异分析[J]. 中国农业科学, 2015, 48(19): 126-136.DOI:10.3864/j.issn.0578-1752.2015.19.012.
[8] 王蓓. 两个早实核桃品种果实生长发育与油体积累[D]. 乌鲁木齐:新疆农业大学, 2015: 11-13.
[9] SAMYN P, VAN NIEUWKERKE D, SCHOUKENS G, et al. Quality and statistical classification of Brazilian vegetable oils using midinfrared and Raman spectroscopy[J]. Applied Spectroscopy, 2012,66(5): 552-565. DOI:10.1366/11-06484.
[10] 赵薇, 刘翠玲, 孙晓荣, 等. 应用拉曼光谱技术识别食用油的种类[J].食品科技, 2015, 40(3): 274-278. DOI:10.13684/j.cnki.spkj.2015.03.065.
[11] 李红芬, 郑肇巽, 马品耀, 等. HE染色原理和试剂配制及染色过程中的若干问题的探讨[J]. 医学信息, 2011(4): 136-137.
[12] LI Jianxia, ZHANG Xiaofei, ZHAO Liangcheng, et al. Cryosectioning conditions and histochemistry comparison with paraffin sectioning[J]. Chinese Bulletin of Botany, 2014, 48(6): 643-650.DOI:10.3724/SP.J.1259.2013.00643.
[13] 宋士连, 王畅, 何泽超. 核桃油的提取及其稳定性的研究[J]. 种子科技, 2017, 35(12): 149-151.
[14] 李慧丽, 何欢, 俞琴, 等. 不同加热方式对薄皮核桃仁品质的影响[J].食品科技, 2016, 41(4): 97-102.
[15] 乔雪, 吴舒同, 刘零怡, 等. 不同山核桃及其油脂品质对比分析[J]. 中国油脂, 2017, 42(1): 139-143. DOI:10.3969/j.issn.1003-7969.2017.01.033.
[16] MAO Xiaoying, HUA Yufei. Chemical composition, molecular weight distribution, secondary structure and effect of NaCl on functional properties of walnut (Juglans regia L.) protein isolates and concentrates[J]. Journal of Food Science and Technology, 2014, 51(8):1473-1482. DOI:10.1007/s13197-012-0674-3.
[17] 陈虹. 新疆早实核桃果实生长发育影响因素[D]. 乌鲁木齐: 新疆农业大学, 2016: 30-31.
[18] BAIR C, SNYDER H. Electron microscopy of soybean lipid bodies[J].Journal of the American Oil Chemists’ Society, 1980, 57(9): 279-282.DOI:10.1007/BF02662207.
[19] HUANG A C H. Structure of plant seed oil bodies[J]. Current Opinion in Structural Biology, 1994, 4(4): 493-498. DOI:10.1016/S0959-440X(94)90210-0.
[20] NAPIER J A, STOBART A K, SHEWRY P R. The structure and biogenesis of plant oil bodies: the role of the ER membrane and the oleosin class of proteins[J]. Plant Molecular Biology, 1996, 31(5):945-956. DOI:10.1007/bf00040714.
[21] ZHOU Xiaofang, YAN Fang, ZHANG P X. Experimental and theoretical analysis for identifying Sudan red molecules based on Raman spectroscopy[J]. Trends in Applied Sciences Research, 2003,1(2): 155-161. DOI:10.3923/tasr.2006.155.161.
[22] 杨坤, 褚昆昆, 朱祥, 等. 几种典型食用油脂拉曼光谱分析研究[J].粮食与油脂, 2015(11): 56-58.
[23] 王品一, 万福, 王建新, 等. 注入锁定腔增强拉曼光谱微量气体检测技术[J]. 光学精密工程, 2018, 26(8): 87-94. DOI:10.3788/OPE.20182608.1917.
[24] ZHANG Zijia, LIAO Lingping, MOORE J, et al. Antioxidant phenolic compounds from walnut kernels (Juglans regia L.)[J]. Food Chemistry,2009, 113(1): 160-165. DOI:10.1016/j.foodchem.2008.07.061.
[25] 余旭亚, 陈朝银, 王洪钟, 等. 核桃仁与核桃油总黄酮含量比较研究[J]. 食品研究与开发, 2002, 23(6): 25-26. DOI:10.3969/j.issn.1005-6521.2002.06.010.
[26] MARTÍNEZ M, BARRIONUEVO G, NEPOTE V, et al. Sensory characterisation and oxidative stability of walnut oil[J]. International Journal of Food Science & Technology, 2011, 46(6): 1276-1281.DOI:10.1111/j.1365-2621.2011.02618.x.
[27] 刘亚萍. 胡杨种子萌发特性及其活力骤变原因的探究[D]. 乌鲁木齐: 新疆大学, 2006: 36-40.
[28] TULLY R E, BEEVERS H. Protein bodies of castor bean endosperm:isolation, fractionation, and the characterization of protein components[J].Plant Physiology, 1976, 58(6): 710-716. DOI:10.1104/pp.58.6.710.
[29] VIGIL E L, RUDDAT M. Development and enzyme activity of protein bodies in proteinoplasts of tobacco root cells[J]. Histochemistry, 1985,83(1): 17-27. DOI:10.1007/BF00495295.
[30] SHI Yu, COWIESON A, GILBERT C, et al. Interactions of phytate and myo-inositol phosphate esters (IP1-5) including IP5 isomers with dietary protein and iron and inhibition of pepsin[J]. Journal of Animal Science, 2012, 90(6): 1824-1832. DOI:10.2527/jas.2011-3866.
[31] 郑煜焱, 曾洁, 李晶, 等. 米糠蛋白的组成及功能性[J]. 食品科学,2012, 33(23): 156-162.
[32] 蒋明义, 郭绍川. 水分亏缺诱导的氧化胁迫和植物的抗氧化作用[J].植物生理学通讯, 1996(2): 144-150.
[33] SINGAL P K, TONG J G. Vitamin E deficiency accentuates adriamycin-induced cardiomyopathy and cell surface changes[J].Molecular and Cellular Biochemistry, 1989, 84(2): 163-171.DOI:10.1007/BF00421051.