近年来,随着人们生活水平的提高和生活方式的改变,我国的糖尿病(尤其是2型糖尿病)患病率呈明显的上升趋势,糖尿病已成为肿瘤、心血管疾病之外的又一大慢性非传染性疾病[1]。糖尿病一般表现为高血糖症状,其病因是胰岛β细胞分泌功能发生障碍,从而造成患者体内脂肪、蛋白质和碳水化合物代谢紊乱,加大了患者心血管疾病等并发症的发病概率[2]。古典医书记载了对糖尿病“养阴生津,平衡阴阳”的主要医治方法[3]。现代西医主要是通过服用降糖药物(二甲双胍、阿卡波糖等)或注射胰岛素来降低血糖治疗糖尿病。
随着人们生活质量以及对医疗水平要求的提高,降低糖尿病治疗过程的痛苦已经成为广大糖尿病患者的迫切诉求。因此,从中草药中寻找高效、安全的预防和治疗糖尿病天然产物,具有很高的实际应用价值。现在已经有大量的研究发现,许多中草药都有降低血糖水平的作用,其中包括生芪[4]、地黄[5]、黄连[6]、当归[7]、葛根[8]、铁皮石斛等。铁皮石斛具有的药用价值,是一种珍贵的药材[9],其最主要的药用成分是石斛多糖,除此之外还含有石斛碱、黄酮和一些微量元素[10-13]。诸多研究证明铁皮石斛多糖具有抗氧化、抗衰老和提高免疫力等药理作用[14-16]。汤志远等证明从铁皮石斛茎提取物中分离得到的多糖具有降血糖的作用[17]。宓文佳等证明铁皮石斛根提取物中分离得到的多糖也具有良好的降血糖的疗效[18],铁皮石斛膏、铁皮石斛当归复方提取液在2型糖尿病小鼠降糖方面也具有显著效果[19-20]。本实验以铁皮石斛多糖(Dendrobium officinale polysaccharide,DOP)为单味药,研究其对糖尿病小鼠降糖降脂的作用,为铁皮石斛多糖及其制剂用于治疗糖尿病提供药理学依据。
1 材料与方法
1.1 动物、材料与试剂
4 周龄ICR小鼠,雄性,体质量(20±3)g,购于山西医科大学实验动物中心,生产许可证号:SCXK(晋)2015-0001;使用正常小鼠饲料饲喂小鼠,饲料购买于山西医科大学实验动物中心;所有实验动物均饲养于(24±2)℃的恒温恒湿室内。
铁皮石斛由山西省农业科学院温室实验房种植,取其茎用于多糖提取。
盐酸二甲双胍片 天津太平洋制药有限公司;胰岛素 南京建成生物工程研究所;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒 北京索莱宝公司;四氧嘧啶、戊巴比妥钠 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BXM-50VE型立式压力蒸汽灭菌锅 上海博迅医疗生物仪器股份有限公司;3K15型高速冷冻离心机 美国Sigma公司;GA-3型血糖仪 深圳三诺生物传感股份有限公司;AR124CN型电子天平 上海奥豪斯仪器有限公司;LGJ-1ON型超低温冰箱 北京亚星仪器公司。
1.3 方法
1.3.1 糖尿病小鼠模型的建立及分组
选取体质量(25±3)g的健康纯系ICR小鼠100 只,适应性饲养1 周,然后全部禁食不禁水24 h后,从中随机选取10 只腹腔注射生理盐水作为正常组,其余90 只小鼠按100 mg/kg mb的剂量腹腔注射四氧嘧啶溶液,每隔1 d注射一次,共注射3 次。之后正常饲喂3 d后,禁食12 h后用血糖仪进行尾部采血统计血糖浓度,以空腹血糖浓度不低于11.1 mmol/L为2型糖尿病模型成功标准。
从成模小鼠中随机选出50 只小鼠,然后随机分成5 组,每组10 只,腹腔注射生理盐水的作为正常对照组,苦味酸进行标记,分组及灌胃给药情况如下:高剂量给药组(DOP-H)(造模成功的糖尿病小鼠灌胃450 mg/kg mb DOP)、中剂量给药组(DOP-M)(造模成功的糖尿病小鼠灌胃300 mg/kg mb DOP)、低剂量给药组(DOP-L)(造模成功的糖尿病小鼠灌胃150 mg/kg mb DOP)、模型对照组(造模成功的糖尿病小鼠灌胃等量生理盐水)、阳性对照组(造模成功的糖尿病小鼠灌胃250 mg/kg mb盐酸二甲双胍溶液)、正常对照组(正常饲养未进行造模的小鼠灌胃等量生理盐水)。每日早上8∶30定时给药,灌胃时以0.1 mL/10 g mb为标准进行灌胃,每天一次,连续灌胃给药4 周。
1.3.2 铁皮石斛多糖提取率及含量测定
1.3.2.1 铁皮石斛多糖的制备
铁皮石斛多糖的制备按照邱现创等[21]的工艺流程制备。
1.3.2.2 标准曲线的绘制
准确称取400.0 mg干燥至恒质量的葡萄糖,加入适量去离子水溶解后,转移至100 mL容量瓶定容。取1 mL于50 mL的容量瓶中稀释并定容,配成质量浓度为0.08 mg/mL的葡萄糖标准溶液。依次吸取质量浓度为0.08 mg/mL的葡萄糖标准溶液0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL和1.8 mL于干燥试管中,分别用去离子水补至2.0 mL,然后再加入体积分数5%的苯酚溶液(现配现用)1.0 mL和5.0 mL浓硫酸。摇匀振荡,置于室温下20 min后于490 nm波长处测定其吸光度。以2.0 mL去离子水按同样量加入苯酚和浓硫酸为空白。以葡萄糖质量浓度ρ/(mg/mL)为横坐标,吸光度A为纵坐标,绘制标准曲线。标准曲线方程为A=13.952ρ-0.043 2(R2=0.999 1)。
1.3.2.3 铁皮石斛多糖提取率测定
铁皮石斛多糖提取率按式(1)计算。
1.3.2.4 铁皮石斛多糖质量分数测定
本实验采用苯酚-硫酸法测定铁皮石斛多糖质量分数,并按式(2)计算。
式中:0.91表示多糖的校正系数。
1.3.3 铁皮石斛多糖的分离纯化及紫外光谱分析
1.3.3.1 铁皮石斛多糖溶液蛋白质的去除
利用Sevag法进行铁皮石斛多糖脱蛋白。向铁皮石斛多糖溶液中加入Sevag试剂(氯仿和正丁醇的体积比为4∶1,多糖溶液和Sevag试剂的体积比为5∶1,磁力搅拌器搅拌40 min,4 000 r/min离心20 min除去蛋白层,重复上述操作,直到蛋白质除尽为止。
1.3.3.2 铁皮石斛多糖溶液脱色素
按照0.2 g/100 mL的量加入活性炭,60 ℃脱色1.5 h,除去铁皮石斛多糖溶液中的色素。
1.3.3.3 铁皮石斛多糖进行纤维素凝胶树脂DEAE-52洗脱纯化
称取经除蛋白、脱色后的粗多糖300 mg,然后加入10 mL的蒸馏水溶解,待溶解完全后经0.45 μm的微孔滤膜过滤以备上样。上样量为300 mg/10 mL,流速为1 mL/min,先以去离子水洗脱,然后以0.1、0.2、0.3、0.5 mol/L的氯化钠溶液作为洗脱剂进行梯度洗脱,等量接收(5.0 mL/管)。用苯酚硫酸显色法,并在490 nm波长处测定吸光度。可按吸光度将洗脱液分别收集为5 个部分(分别记为铁皮石斛多糖洗脱l~5),并分别对其进行减压浓缩、冻干。对氯化钠溶液洗脱下来的铁皮石斛多糖洗脱1~5进行脱盐处理。去离子水将其分别溶解后,用透析袋以流水进行透析48 h,再将其减压冷冻干燥得到无盐的铁皮石斛多糖洗脱1~5。
1.3.4 小鼠体质量记录与空腹血糖浓度测定
实验期间每7 d记录小鼠体质量,统计小鼠体质量变化趋势。分别于给药第1、2、3、4周,各组小鼠禁食不禁水12 h后尾部取血,用血糖仪测定血糖浓度。
1.3.5 小鼠血脂指标检测
实验结束后采用摘除眼球法取小鼠血清,送至武汉塞维尔生物科技公司检测胰岛素、尿素氮、肌酐、糖化血清蛋白、血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(highdensity liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density liptein cholesterol,LDL-C)水平及T-AOC。
1.3.6 血糖-时间曲线下面积和胰岛素敏感指数计算
整个实验结束前1 d进行小鼠糖耐量实验,小鼠禁食不禁水12 h后,尾静脉采血测空腹血糖浓度,给药15 min后,按照2 g/kg mb剂量腹腔注射质量分数10%的葡萄糖溶液,然后分别于30、60、120 min后尾静脉采血测定血糖浓度。
1.3.6.1 血糖-时间曲线下面积计算
血糖-时间曲线下面积(area under curve,AUC)计算参照文献[18]进行,AUC按式(3)计算。
式中:BG0为0 h的血糖浓度/(mmol/L);BG1为1 h的血糖浓度/(mmol/L);BG2为2 h的血糖浓度/(mmol/L)。
1.3.6.2 胰岛素抵抗指数计算
根据测定的空腹血糖和空腹胰岛素含量,按式(4)计算胰岛素抵抗指数(homeostasis model assessment was applied to assess the status of insulin resistance,HOMA-IR)。
1.4 数据统计分析
采用SPASS 17.0软件处理数据,结果以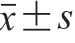 表示,以单因素方差分析和t检验进行组间差异显著性比较,P<0.05表示差异显著,P<0.01表示差异极显著。
表示,以单因素方差分析和t检验进行组间差异显著性比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 2型糖尿病小鼠建模结果
在90 只小鼠建模过程中,惊厥死亡3 只,11 只小鼠空腹血糖浓度未达到成模水平,最后建模成功率为84.4%。
2.2 铁皮石斛多糖提取率和质量分数测定结果
精确称取10 g铁皮石斛粉,按照1.3.2.1节的方法进行铁皮石斛多糖的提取,最后得到铁皮石斛粗多糖2.123 g,铁皮石斛多糖的提取率为21.23%。
苯酚-硫酸法显色后,在490 nm波长处测定分离纯化后铁皮石斛多糖溶液的吸光度,代入标准曲线回归方程A=13.952ρ-0.043 2(R2=0.999 1)计算铁皮石斛多糖样品的多糖质量分数,所得到的铁皮石斛粗多糖质量分数为46.75%。
2.3 铁皮石斛多糖紫外光谱分析结果
紫外光谱分析结果如图1所示,经分离纯化后的铁皮石斛多糖在210 nm波长附近出现多糖具有的特征吸收峰(最大吸收峰),且在260 nm和280 nm波长处无明显吸收峰,表明分离纯化铁皮石斛多糖中几乎不含有核酸和蛋白质等杂质。
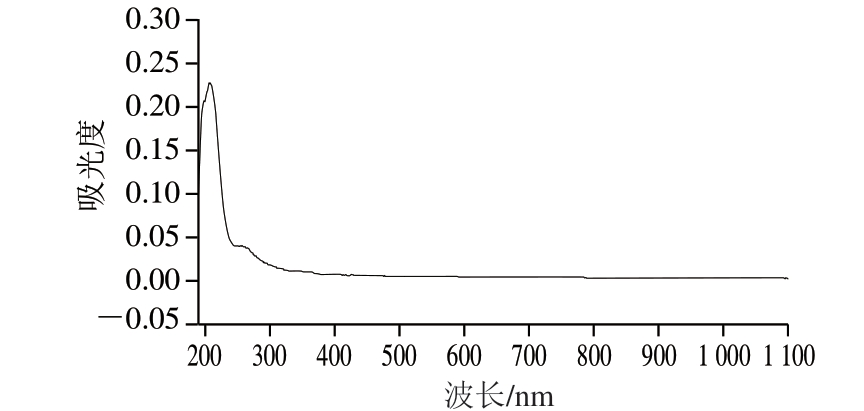
图1 铁皮石斛多糖紫外光谱分析结果
Fig. 1 Ultraviolet spectroscopic analysis of Dendrobium candidum polysaccharides
2.4 铁皮石斛多糖对小鼠体质量的影响
表1 铁皮石斛多糖对糖尿病小鼠体质量的影响(n= 10)
Table 1 Effect of Dendrobium officinale polysaccharide on body mass of diabetic mice (n= 10)
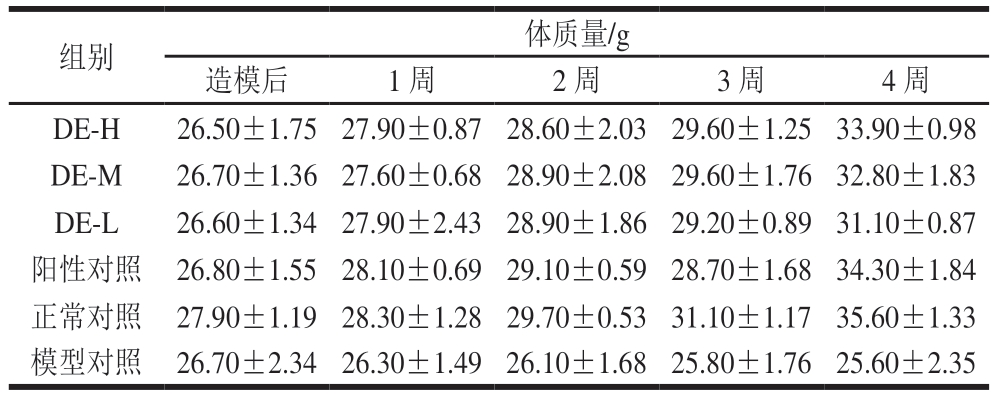
组别 体质量/g造模后 1 周 2 周 3 周 4 周DE-H 26.50±1.75 27.90±0.87 28.60±2.03 29.60±1.25 33.90±0.98 DE-M 26.70±1.36 27.60±0.68 28.90±2.08 29.60±1.76 32.80±1.83 DE-L 26.60±1.34 27.90±2.43 28.90±1.86 29.20±0.89 31.10±0.87阳性对照 26.80±1.55 28.10±0.69 29.10±0.59 28.70±1.68 34.30±1.84正常对照 27.90±1.19 28.30±1.28 29.70±0.53 31.10±1.17 35.60±1.33模型对照 26.70±2.34 26.30±1.49 26.10±1.68 25.80±1.76 25.60±2.35
由表1可知,造模成功后小鼠体质量与正常组小鼠相比体质量减轻,经盐酸二甲双胍和铁皮石斛灌胃治疗的2型糖尿病小鼠体质量呈现增长趋势,而无治疗的2型糖尿病小鼠体质量一直呈现下降趋势。在整个实验结束时,未治疗的2型糖尿病小鼠的体质量明显低于正常组小鼠以及经盐酸二甲双胍和铁皮石斛灌胃治疗的2型糖尿病小鼠体质量。
2.5 铁皮石斛多糖对小鼠空腹血糖和糖化血清蛋白浓度的影响
糖化血清蛋白因受环境作用较小,所以能够稳定地反映机体过去1~2 周内的血糖水平[22],而空腹血糖浓度则能实时反映机体血糖水平,但易受外界环境干扰。
表2 铁皮石斛多糖对糖尿病小鼠空腹血糖浓度和糖化血清蛋白浓度的影响(n= 10)
Table 2 Effect of Dendrobium officinale polysaccharide on fasting blood glucose and glycated serum protein in diabetic mice (n = 10)
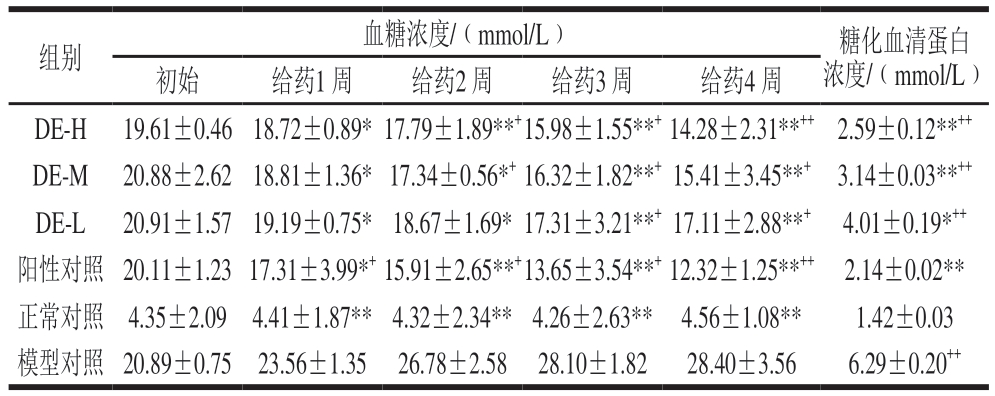
注:与模型对照组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01);与正常对照组相比,+.差异显著(P<0.05),++.差异极显著(P<0.01)。下同。
组别 血糖浓度/(mmol/L) 糖化血清蛋白浓度/(mmol/L)初始 给药1 周 给药2 周 给药3 周 给药4 周DE-H 19.61±0.46 18.72±0.89* 17.79±1.89**+15.98±1.55**+14.28±2.31**++ 2.59±0.12**++DE-M 20.88±2.62 18.81±1.36* 17.34±0.56*+16.32±1.82**+ 15.41±3.45**+ 3.14±0.03**++DE-L 20.91±1.57 19.19±0.75* 18.67±1.69* 17.31±3.21**+ 17.11±2.88**+ 4.01±0.19*++阳性对照 20.11±1.23 17.31±3.99*+15.91±2.65**+13.65±3.54**+12.32±1.25**++ 2.14±0.02**正常对照 4.35±2.09 4.41±1.87** 4.32±2.34** 4.26±2.63** 4.56±1.08** 1.42±0.03模型对照 20.89±0.75 23.56±1.35 26.78±2.58 28.10±1.82 28.40±3.56 6.29±0.20++
由表2可知,与模型组小鼠相比,铁皮石斛多糖灌胃组小鼠空腹血糖浓度和糖化血清蛋白浓度均显著降低(P<0.05)。由表2中也可看出,铁皮石斛多糖高剂量组与盐酸二甲双胍组的降糖效果基本一致。以上结果表明铁皮石斛多糖具有明显的降糖效果。
2.6 铁皮石斛多糖对小鼠血清肌酐和尿素氮浓度的影响
作为糖尿病中常见的并发症——糖尿病肾病严重损伤了患者的肾脏,给患者带来了极大病痛,且极易造成糖尿病患者的病亡[23-24]。已有研究证明,因糖尿病引起的早期肾脏病变可用机体的血清尿素氮和肌酐来进行辅助诊断[25-26]。
表3 铁皮石斛多糖对糖尿病小鼠血清尿素氮、肌酐浓度的影响(n= 10)Table 3 Effect of Dendrobium officinale polysaccharide on serum urea
nitrogen and creatinine levels in diabetic mice (n= 10)

组别 血尿素氮浓度/(mmol/L) 肌酐浓度/(mmol/L)DE-H 16.01±0.91**+ 51.04±0.71**+DE-M 22.58±1.57*++ 62.26±4.79**++DE-L 34.04±1.14++ 84.36±2.07++阳性对照 9.93±0.53** 46.26±0.97**正常对照 7.41±1.09 40.07±0.46模型对照 39.72±0.47++ 88.74±1.86++
由表3可知,模型组小鼠的血清肌酐、尿素氮极显著高于正常组小鼠(P<0.01)。铁皮石斛多糖灌胃组小鼠血清肌酐、尿素氮浓度与模型组小鼠相比均显著降低(P<0.05),且呈现剂量效应。铁皮石斛多糖高剂量组对2型糖尿病小鼠血清肌酐和尿素氮浓度的降低效果与盐酸二甲双胍效果基本一致,表明铁皮石斛多糖能够改善糖尿病小鼠的肾脏损伤。
2.7 铁皮石斛多糖对小鼠血脂代谢的影响
表4 铁皮石斛多糖糖尿病小鼠血脂代谢的影响(n= 10)
Table 4 Effect of Dendrobium officinale polysaccharide on lipid metabolism in diabetic mice (n= 10)
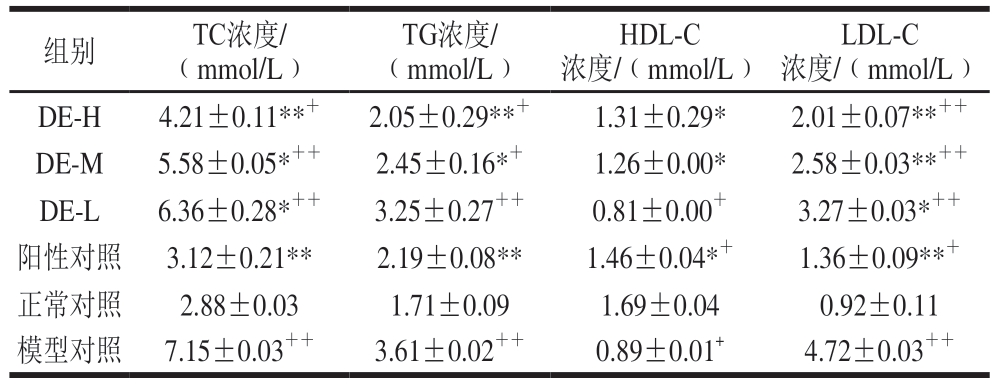
组别 TC浓度/(mmol/L)TG浓度/(mmol/L)HDL-C浓度/(mmol/L)LDL-C浓度/(mmol/L)DE-H 4.21±0.11**+ 2.05±0.29**+ 1.31±0.29* 2.01±0.07**++DE-M 5.58±0.05*++ 2.45±0.16*+ 1.26±0.00* 2.58±0.03**++DE-L 6.36±0.28*++ 3.25±0.27++ 0.81±0.00+ 3.27±0.03*++阳性对照 3.12±0.21** 2.19±0.08** 1.46±0.04*+ 1.36±0.09**+正常对照 2.88±0.03 1.71±0.09 1.69±0.04 0.92±0.11模型对照 7.15±0.03++ 3.61±0.02++ 0.89±0.01+ 4.72±0.03++
糖尿病患者一般都患有严重的脂质代谢紊乱症状,长期严重的脂质代谢紊乱极大地增加了冠心病并发症的几率,从而给患者带来了极大的健康威胁。由表4可知,与正常组小鼠相比,模型组小鼠TC、TG、LDL-C浓度极显著增高(P<0.01),HDL-C浓度极显著降低(P<0.01)。铁皮石斛多糖高剂量组对2型糖尿病小鼠血脂代谢紊乱的改善效果与盐酸二甲双胍的效果基本一致。以上结果表明铁皮石斛多糖可以改善糖尿病小鼠血脂代谢异常。
2.8 铁皮石斛多糖对小鼠糖耐量、胰岛素水平、胰岛素抵抗性的影响
表5 铁皮石斛多糖对糖尿病小鼠糖耐量、胰岛素水平和胰岛素抵抗性的影响(n= 10)
Table 5 Effect of Dendrobium officinale polysaccharide on glucose tolerance, insulin content and insulin resistance in diabetic mice (n= 10)
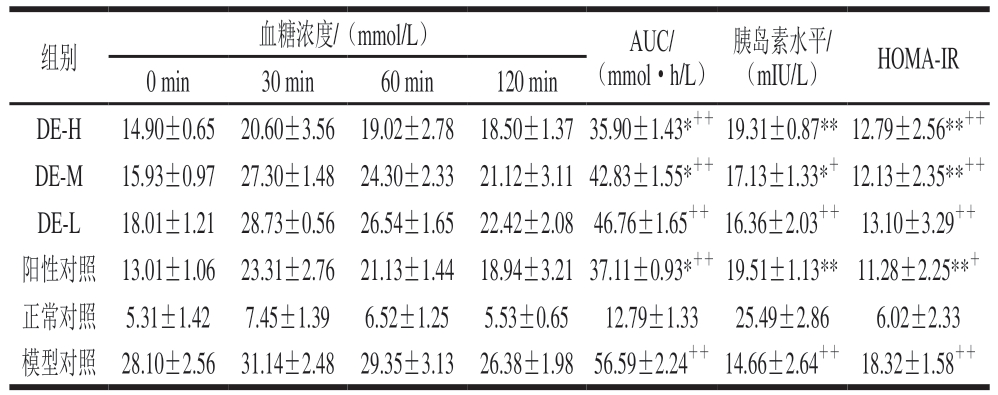
组别 血糖浓度/(mmol/L) AUC/(mmol·h/L)胰岛素水平/(mIU/L) HOMA-IR 0 min 30 min 60 min 120 min DE-H 14.90±0.65 20.60±3.56 19.02±2.78 18.50±1.37 35.90±1.43*++ 19.31±0.87** 12.79±2.56**++DE-M 15.93±0.97 27.30±1.48 24.30±2.33 21.12±3.11 42.83±1.55*++ 17.13±1.33*+ 12.13±2.35**++DE-L 18.01±1.21 28.73±0.56 26.54±1.65 22.42±2.08 46.76±1.65++ 16.36±2.03++ 13.10±3.29++阳性对照 13.01±1.06 23.31±2.76 21.13±1.44 18.94±3.21 37.11±0.93*++ 19.51±1.13** 11.28±2.25**+正常对照 5.31±1.42 7.45±1.39 6.52±1.25 5.53±0.65 12.79±1.33 25.49±2.86 6.02±2.33模型对照 28.10±2.56 31.14±2.48 29.35±3.13 26.38±1.98 56.59±2.24++ 14.66±2.64++ 18.32±1.58++
由表5可知,模型组给予葡萄糖前后各时间点的血糖浓度及AUC均极显著高于正常组,糖耐量异常(P<0.01)。与模型组比较,灌胃4 周后,铁皮石斛多糖高、中剂量组给予葡萄糖前后各时间点的血糖浓度及AUC均显著降低(P<0.05)。表明铁皮石斛多糖能够改善糖尿病小鼠的糖耐量异常状况。与正常组相比,模型组小鼠胰岛素水平极显著降低(P<0.01),而模型组小鼠胰岛素抵抗性极显著增高(P<0.01)。与模型组小鼠相比,铁皮石斛多糖高、中剂量组小鼠的胰岛素水平均显著提高(P<0.05),而胰岛素抵抗性均显著降低(P<0.05)。铁皮石斛多糖高剂量组对2型糖尿病小鼠胰岛素含量和胰岛素抵抗性的改善与盐酸二甲双胍的效果基本一致。以上结果表明铁皮石斛多糖可以提高2型糖尿病小鼠胰岛素水平和降低糖尿病小鼠胰岛素抵抗性。
2.9 铁皮石斛多糖对小鼠肝脏、胰腺抗氧化酶活性及T-AOC的影响
表6 铁皮石斛多糖对糖尿病小鼠SOD、CAT活力和T-AOC的影响(n= 10)
Table 6 Effect of Dendrobium officinale polysaccharide on SOD and CAT activity and T-AOC in diabetic mice (n= 10)
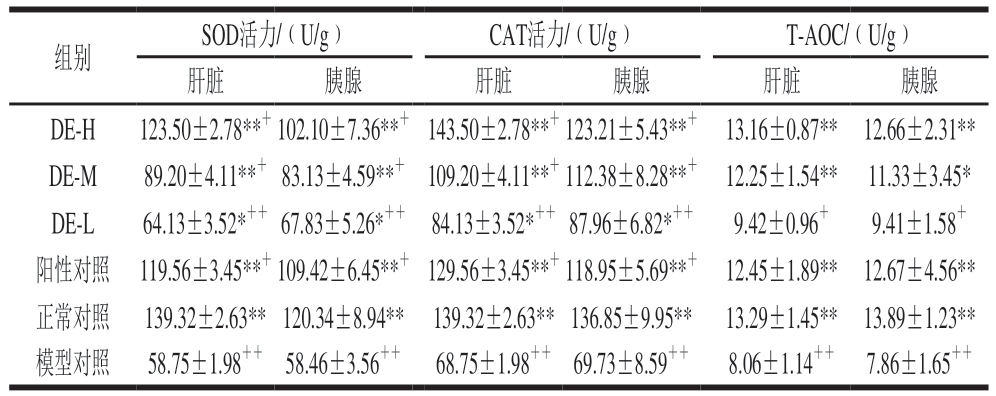
组别SOD活力/(U/g) CAT活力/(U/g) T-AOC/(U/g)肝脏 胰腺 肝脏 胰腺 肝脏 胰腺DE-H 123.50±2.78**+102.10±7.36**+ 143.50±2.78**+123.21±5.43**+ 13.16±0.87** 12.66±2.31**DE-M 89.20±4.11**+ 83.13±4.59**+ 109.20±4.11**+112.38±8.28**+ 12.25±1.54** 11.33±3.45*DE-L 64.13±3.52*++ 67.83±5.26*++ 84.13±3.52*++ 87.96±6.82*++ 9.42±0.96+ 9.41±1.58+阳性对照 119.56±3.45**+109.42±6.45**+ 129.56±3.45**+118.95±5.69**+ 12.45±1.89** 12.67±4.56**正常对照 139.32±2.63** 120.34±8.94** 139.32±2.63** 136.85±9.95** 13.29±1.45** 13.89±1.23**模型对照 58.75±1.98++ 58.46±3.56++ 68.75±1.98++ 69.73±8.59++ 8.06±1.14++ 7.86±1.65++
由表6可知,与正常组小鼠相比,模型组小鼠肝脏和胰腺的SOD、CAT活力和T-AOC极显著降低(P<0.01)。与模型组小鼠相比,铁皮石斛多糖灌胃小鼠肝脏和胰腺的SOD、CAT活力T-AOC均得到极显著提高(P<0.01),呈现出一定的剂量依赖效应。以上结果表明铁皮石斛多糖可以提高糖尿病小鼠肝脏和胰腺的抗氧化水平。
3 讨 论
当今一些不良的饮食、作息习惯导致糖尿病发病率愈发大众化和年轻化,其中2型糖尿病占到90%以上[27]。目前,对于糖尿病的治疗主要是采用西药降糖和注射胰岛素的方法,长期注射胰岛素给患者带来了很大的痛苦,因此开发具有降糖降脂作用的功能型保健品,对于糖尿病的辅助治疗具有重要的实践意义。
本实验结果表明:1)铁皮石斛多糖对2型糖尿病小鼠具有良好的降糖效果,其中铁皮石斛多糖高剂量的降糖效果与盐酸二甲双胍降糖效果基本一致。这一研究结果与汤志远[17]、李秀芳[28]等研究结果一致。2)铁皮石斛多糖对2型糖尿病小鼠的血脂代谢紊乱也具有良好的改善效果,与模型组小鼠相比,铁皮石斛多糖高剂量组小鼠的LDL-C、TC、TG水平明显降低,而HDL-C水平增加。张文等[29]利用猴头菌粉多糖和李新萍等[30]利用山药多糖灌胃糖尿病小鼠,也发现相应多糖具有明显的降脂作用。3)糖耐量实验和胰岛素抵抗指数评价结果表明铁皮石斛多糖能够提高糖尿病小鼠对葡萄糖的耐受力,增加糖尿病小鼠血清胰岛素水平和降低胰岛素抵抗指数。肾功能检测结果表明高剂量的铁皮石斛多糖能够极显著地降低糖尿病小鼠血清肌酐和尿素氮浓度(P<0.01),从而改善糖尿病小鼠的肾脏的损伤情况,这与穿心莲、姜黄素对2糖尿病引起的肾脏病变具有一定的治疗作用的结果基本一致[31-32]。
研究表明,氧化应激是导致胰岛β细胞功能衰退的重要因素,氧化应激导致活性氧和活性氮产生过多,其中活性氧可直接损伤β细胞[33-34]。CAT能够降低生物体内过氧化氢的水平,从而减少自由基和过氧化脂质的形成。SOD能够把有害的超氧阴离子自由基转化为过氧化氢,进而在CAT的作用下转化为对生物体无危害作用的水[35-36]。小鼠肝脏和胰腺抗氧化性酶活力测定结果表明,铁皮石斛多糖能够极显著提高糖尿病小鼠肝脏和胰腺的SOD、CAT活力和T-AOC(P<0.01),从而增强清除自由基的能力和降低活性氧的产生,发挥抗氧化应激,修复肝脏和胰腺氧化损伤的作用。这说明抗氧化应激是铁皮石斛多糖提高胰岛素含量和缓解胰岛素抵抗,从而抗糖尿病的原因。常惠礼等[37]研究表明,铁皮石斛多糖能够抑制氧化应激状态导致的JNK信号通路激活,从而保护胰岛细胞免受氧化应激损伤。
综上所述,本实验以四氧嘧啶诱导的ICR2型糖尿病小鼠为材料,研究了铁皮石斛降糖降脂作用。结果表明:铁皮石斛多糖提高糖尿病小鼠肝脏和胰腺的抗氧化能力的作用、具有良好的降糖降脂作用、增加糖尿病小鼠血清胰岛素水平和降低胰岛素抵抗指数、改善糖尿病小鼠的症状,这为铁皮石斛多糖用于辅助治疗糖尿病提供了一定的药理学依据。
[1] 牟严艳, 叶中慧, 林梅珍, 等. 糖尿病流行病学研究进展[J].糖尿病新世界, 2 0 1 9, 2 2(4): 1 9 6-1 9 8. D O I:1 0.1 6 6 5 8/j.cnki.1672-4062.2019.04.196.
[2] 于雷, 刘纳文, 张莉, 等. 天津市成人体检者糖尿病及糖尿病前期的流行病学调查[J]. 中国慢性病预防与控制, 2017, 25(7): 511-513.DOI:10.16386/j.cjpccd.issn.1004-6194.2017.07.008.
[3] 吕圭源, 颜美秋, 陈素红. 铁皮石斛功效相关药理作用研究进展[J].中国中药杂志, 2013, 38(4): 489-493. DOI:10.4268/cjcmm20130405.
[4] 宋晓琪, 李招霞, 牛风秀, 等. 生芪降糖颗粒治疗2型糖尿病效果观察[J]. 青岛大学医学院学报, 2017, 53(4): 427-430. DOI:10.13361/j.qdyxy.201704016.
[5] 周桂芬, 庞敏霞, 陈素红, 等. 铁皮石斛茎、叶多糖含量及多糖部位柱前衍生化-高效液相色谱指纹图谱比较研究[J]. 中国中药杂志,2014, 39(5): 795-802.
[6] 林燕飞, 曾苏, 林小香, 等. 铁皮石斛水溶性多糖含量的动态研究[J].现代中药研究与实践, 2009, 23(2): 19-21. DOI:10.13728/j.1673-6427.2009.02.011.
[7] 高建平, 金若敏, 吴耀平, 等. 铁皮石斛原球茎与原药材免疫调节作用的比较研究[J]. 中药材, 2002, 25(7): 487-489. DOI:10.3321/j.issn:1001-4454.2002.07.016.
[8] 陈晓梅, 王春兰, 杨峻山, 等. 铁皮石斛化学成分及其分析的研究进展[J]. 中国药学杂志, 2013, 48(19): 1634-1640. DOI:10.11669/cpj.2013.19.008.
[9] 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2015: 282.
[10] WEI W, FEN L, BAO W R, et al. Structure characterization and immunomodulating effects of polysaccharides isolated from Dendrobium officinale[J]. Journal of Agricultural and Food Chemistry,2016, 64(4): 881-889. DOI:10.1021/acs.jafc.5b05180.
[11] 吴昊姝, 徐建华, 陈立钻, 等. 铁皮石斛降血糖作用及其机制的研究[J].中国中药杂志, 2 0 0 4, 2 9(2): 1 6 0-1 6 3. D O I:1 0.3 3 2 1/j.issn:1001-5302.2004.02.020.
[12] 郑珊娇, 吕圭源, 陈素红, 等. 铁皮石斛与市场上常见的几种伪品含糖量的测定[J]. 中华中医药学刊, 2012, 30(1): 346-348.DOI:10.13193/j.archtcm.2012.01.148.zhengshj.060.
[13] 周桂芬, 陈素红, 吕圭源. 浙江省铁皮石斛黄酮类成分高效液相色谱指纹图谱的建立[J]. 中国药学杂志, 2013, 48(15): 1261-1265.DOI:10.11669/cpj.2013.15.007.
[14] SHAO H, ZHANG L Q, LEE J M, et al. Advances in research of Dendrobium officinale[J]. Chinese Traditional and Herbal Drugs,2004, 35(1): 109-111. DOI:10.13313/jissn16734890.2014.05.020.
[15] HOU S Z, LI H B, GUO J R, et a1. Study on the analgesic and anti-inflammatory effects of Dendrobium officinale[J]. Progress in Viterinary Medicine, 2012, 33(10): 49-52. DOI:10.16437/j.cnki.1007-5038.2012.10.017.
[16] 宋燕华, 蔡德雷, 傅剑云, 等. 铁皮石斛叶对二代繁殖雌性大鼠免疫水平影响的研究[J]. 浙江预防医学, 2016, 28(2): 109-112.DOI:10.19485/j.cnki.issn1007-0931.2016.02.001.
[17] 汤志远, 周晓宇, 冯健, 等. 铁皮石斛多糖降血糖作用研究[J].南京中医药大学学报, 2016, 32(6): 566-570. DOI:10.14148/j.issn.1672-0482.2016.0566.
[18] 宓文佳, 陈素红, 吕圭源, 等. 铁皮石斛根提取物对2型糖尿病模型小鼠的降糖作用研究[J]. 中药药理与临床, 2015, 31(1): 125-129.DOI:10.13412/j.cnki.zyyl.2015.01.040.
[19] 陈爱君, 李钦, 张信岳, 等. 铁皮石斛膏降糖作用的研究[J].中国中医药科技, 2009, 6(16): 457-458. DOI:10.3969/j.issn.1005-7072.2009.06.016.
[20] 戴明珠, 王楠楠, 徐俞悦, 等. 铁皮石斛当归复方提取液对2型糖尿病小鼠降糖作用研究术[J]. 浙江中医杂志, 2017, 52(5): 371-372.DOI:10.3969/j.issn.0411-8421.2017.05.051.
[21] 邱现创, 赵宁, 李晨, 等. 铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响[J]. 食品科学, 2018, 39(2): 273-280. DOI:10.7506/spkx1002-6630-201802043.
[22] 陈瑛波, 宋丹, 吴晋, 等. 铁皮石斛对小鼠和胰岛瘤细胞胰岛素抵抗的改善作用[J]. 吉林大学学报, 2018, 44(4): 709-717.
[23] ZHANG P P, ZHANG J F, XIE H L, et al. Evaluation of glomerular filtration rate using cystatin C in diabetic patients analysed by multiple factors including tubular function[J]. Journal of International Medical Research, 2010, 38(2): 473-483. DOI:10.1177/147323001003800211.
[24] SUZUKI Y, MATSUSHIT K, SEIMIY M, et al. Serum cystatin C as a marker for early detection of chronic kidney disease and grade 2 nephropathy in Japanese patients with type 2 diabetes[J].Cling Chemical Laboratory Medical, 2012, 50(10): 1833-1839.DOI:10.1515/cclm-2011-0777.
[25] 姚建, 陈名道. 糖尿病肾病及其早期防治[J]. 中华内分泌代谢杂志,2002, 8(4): 330-332. DOI:10.3760/j.issn:1000-6699.2002.04.033.
[26] 周新, 府伟灵. 临床生物化学与检验[M]. 北京: 人民卫生出版社,2007: 213-216.
[27] 王卫庆, 陆洁莉. 中国人群2型糖尿病的分子机制[J]. 中国科学,2018, 48(8): 840-846. DOI:10.1360/N05201800043.
[28] 李秀芳. 霍山石斛和四种药典石斛多糖降血糖活性比较研究[D].合肥: 合肥工业大学, 2012: 4-15.
[29] 张文, 陈建伟, 李洋, 等. 猴头菌粉对糖尿病小鼠血糖血脂的影响[J]. 药学研究, 2012, 20(1): 24-28. DOI:10.3969/j.issn.1673-7806.2012.01.007.
[30] 李新萍, 周书琦, 徐丽丽, 等. 山药多糖的提取及其对糖尿病小鼠的影响研究[J]. 黑龙江医药, 2018, 31(1): 20-22. DOI:10.14035/j.cnki.hljyy.2018.01.007.
[31] 李梦诗, 吴腾, 曹静桦, 等. 穿心莲内酯对糖尿病肾病小鼠的治疗作用及机制[J]. 中国药科大学学报, 2018, 49(1): 97-101.DOI:10.11665/j.issn.1000 -5048.20180114.
[32] 柏合, 刘勇, 李洪志, 等. 姜黄素对2型糖尿病肾病大鼠肾脏的保护作用探究[J]. 光明中医, 2017, 32(11): 1575-1577. DOI:10.3969/j.issn.1000-7369.2015.01.055.
[33] 任春久, 张瑶, 崔为正, 等. 氧化应激在2型糖尿病发病机制中的作用研究进展[J]. 生理学报, 2013, 65(6): 664-673. DOI:10.13294/j.aps.2013.06.00.
[34] WANG J, ZHAO Y, LI W, et al. Optimization of polysaccharides extraction from Tricholoma mongolicum Imai and their antioxidant and antiproliferative activities[J]. Carbohydrate Polymer, 2015, 131:322-330. DOI:10.1016/j.carbpol.2015.06.009.
[35] 郭福团, 许雄伟, 潘建峰, 等. 桑植多糖对糖尿病肾病大鼠肾脏组织抗氧化能力作用的影响[J]. 中国医学院杂志, 2016, 36(23): 2058-2062. DOI:10.13286/j.cnki.chinhosppharmacyj.2016.23.05.
[36] 林福新, 邹奕恒, 张连妹, 等. 铁皮石斛对免疫抑制模型小鼠血清抗氧化酶活性及细胞因子含量的影响[J]. 黑龙江畜牧兽医, 2017(5):39-42. DOI:10.13881/j.cnki.hljxmsy.2017.0763.
[37] 常惠礼. 铁皮石斛对2型糖尿病大鼠胰岛组织JNK、AKT蛋白磷酸化表达的影响[J]. 中国药事, 2015, 29(1): 54-57. DOI:10.3321/j.issn1002-7777(2015)01-0054-0.