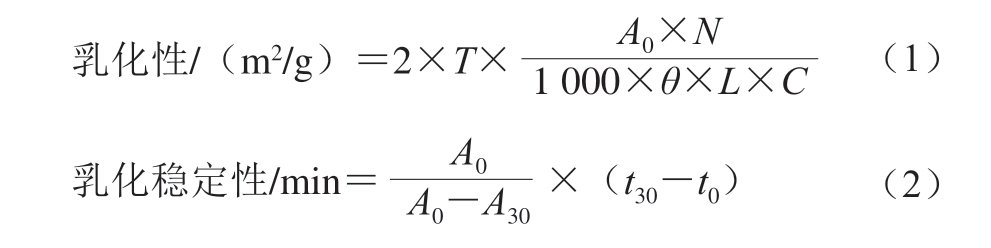
Effect of pH Treatment on Structure, Rheological Properties and Emulsifying Properties of Black Bean Protein Isolate
黑豆是豆科植物大豆的干燥成熟种子[1],亦称为马豆、冬豆子、黑大豆,与普通大豆相比,黑豆蛋白的含量更高,常常被人们称为“植物蛋白之王”、“豆中之王”。作为一种植物蛋白资源,黑豆分离蛋白(black bean protein isolate,BBPI)来源广泛,氨基酸构成比例合适,较大豆蛋白更为优越,是优质蛋白资源之一。
随着社会的发展,人们对食品营养和安全越发重视,对蛋白质的需求量日益增加。蛋白质的乳化性和流变性是食品加工制造过程中需要考虑的重要性质[2],许多研究发现,pH值处理可以使氨基酸带电,通过蛋白质与水分子间的离子-偶极相互作用进而改变蛋白质的溶解性,带同种电荷的蛋白质之间相互排斥导致亚基的解离和结构的展开[3],蛋白质的溶解性和表面疏水性显著影响着蛋白质其他功能性质的发挥[4]。目前,关于黑豆的研究主要集中在抗氧化机理及品种之间的营养成分、功能性质差异[5]及产品的研发[6],有关黑豆蛋白的研究集中于热处理及超声处理对黑豆蛋白结构和功能性质的影响[7-8]。较多学者研究pH值处理改变蛋白质性质,主要集中在极端酸碱处理对大豆蛋白、7S、11S的疏水性、溶解性等理化性质及结构的影响[9]或极端pH结合热处理对大豆分离蛋白结构特性的影响[10],关于pH值处理对BBPI的表面性质、流变性质及其稳定乳液的相互关系的研究较少,植物蛋白的相互关系的研究可用于乳剂制备、长期稳定性预测和食品质量控制。
本研究采用不同pH值条件处理BBPI后调节回中性条件,研究pH值对蛋白质的功能性质、流变性、乳化性的影响以及与稳定乳液的相互关系,使黑豆的资源能够得到更好的发掘。
黑豆 北大荒绿野食品有限公司;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonicacid,TNBS)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)北京索莱宝科技有限公司;二喹啉甲酸法蛋白含量测定试剂盒 上海荔达生物科技有限公司;8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司。
磷酸二氢钠、磷酸氢二钠 天津博迪化工股份有限公司;正己烷 天津北科化学品有限责任公司;其他试剂均为国产分析纯。
CR22G高速冷冻离心机、F-4500型荧光分光光度计日本日立公司;PHS-3D pH计 上海雷磁仪器厂;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;XW-80A旋涡混合器 上海青浦沪西仪器厂;VIC-212电子天平 美国艾科勒公司;Discovery系列HR-1型流变仪 美国TA公司;傅里叶红外光谱仪美国Nicoler公司。
1.3.1 制备BBPI
黑豆去皮、烘干、磨粉、过60 目筛,1∶3(g/mL)料液比加入正己烷脱脂,25 ℃搅拌1 h后4 500 r/min离心20 min,重复3 次,沉淀物室温放置24 h干燥得到脱脂豆粉;参照蒋将等[3]的方法并加以改进,干燥后的脱脂豆粕按1∶10(g/mL)的料液比加入去离子水混合,常温搅拌30 min,用2 mol/L NaOH溶液调节pH值至8.0,搅拌1 h后,4 ℃、9 000 r/min离心20 min取上清液,上清液用2 mol/L HCl溶液调节pH值至4.0,搅拌1 h后,4 ℃,9 000 r/min离心20 min取沉淀物,沉淀物水洗2 次,取沉淀分散于水中,用2 mol/L NaOH溶液调节pH 7.0,冷冻干燥后备用。
1.3.2 pH值处理BBPI
取10 份等量的冷冻干燥后的BBPI粉末溶解于去离子水(1∶5 g/mL)中,25 ℃搅拌1 h,分别用2 mol/L HCl溶液调节pH值至2.0、3.0、4.0、5.0、6.0,或用2 mol/L NaOH溶液调节pH值至7.0、8.0、9.0、10.0、11.0,25 ℃搅拌2 h,随即用2 mol/L NaOH或HCl溶液调节pH 7.0,保持中性条件诱导重折叠1 h,冷冻干燥后置于4 ℃备用。
1.3.3 溶解度
参考Morr等[11]的方法研究BBPI的溶解度随pH值的变化。将质量分数2.0%的蛋白溶液转移到15 mL离心管中,4 ℃、9 100 r/min离心10 min,去除不溶性残渣。上清液梯度稀释,采用二喹啉甲酸法测定上清液蛋白质含量,溶解度表示为上清液中蛋白质含量与样品中总蛋白质含量的百分比。
1.3.4 乳化性及乳化稳定性
取质量分数为1%的蛋白溶液15 mL与5 mL葵花籽油混匀,以12 000 r/min高速匀化2 min,形成均一的乳液,第0分钟时从底部吸取50 μL加入5 mL 0.1%的SDS溶液,用旋涡混合器混匀,静置30 min后从乳液底部再吸取50 μL加入5 mL 0.1%的SDS溶液,用旋涡混合器混匀,500 nm波长处测其吸光度。乳化性和乳化稳定性分别按式(1)和(2)计算。
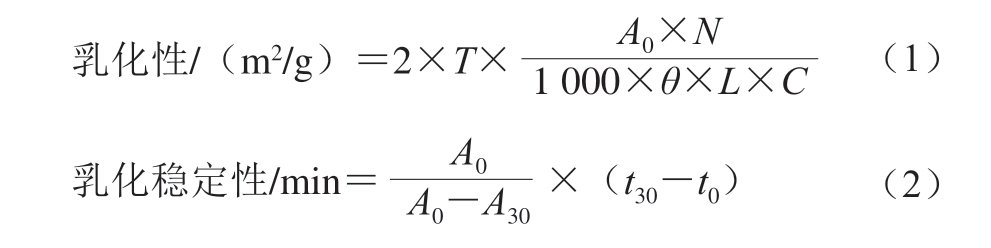
式中:T为2.303;N为稀释倍数;C为形成乳化液之前的蛋白质质量浓度/(g/mL);θ为乳化液的油相体积分数/%;A0为乳化液均质后第0分钟时测得的吸光度;A30为乳化液均质后静置30 min后测得的吸光度;t30-t0为2 次测定的时间差。
1.3.5 傅里叶红外光谱测定
参照朱明华等[12]的方法,分别取不同pH值处理后冻干的蛋白粉末1 mg,以1∶100的比例加入溴化钾,研磨均匀,压片,纯溴化钾为参照,扫描波段400~4 000 cm-1,分辨率4 cm-1,扫描次数32;傅里叶红外光谱测定的酰胺I带可以计算BBPI的二级结构含量,使用peakfit软件拟合出在酰胺-I 区域(1 7 0 0 ~1 6 0 0 c m-1)的峰位,酰胺-I区域对蛋白质的二级结构最为敏感[13],根据峰的中心位置将其分配到相应的结构中,1 600~1 639 cm-1谱带归属于β-折叠;1 640~1 650 cm-1谱带归属于无规卷曲;1 651~1 660 cm-1谱带归属于α-螺旋;1 661~1 700 cm-1谱带归属于β-转角[14]。
1.3.6 表面疏水性
参照Kato等[15]的方法称取一定量蛋白样品溶于去离子水,稀释至蛋白质浓度为0.005~0.500 mol/mL,取4 mL不同浓度蛋白样品加入20 μL 8.0 mmol/L ANS,混匀器混匀,避光静置15 min测荧光强度,激发波长390 nm,发射波长470 nm,狭缝宽度5 nm。以荧光强度对蛋白浓度作图,斜率即为该蛋白样品的表面疏水性。
1.3.7 内源荧光光谱分析
取不同pH值处理后的BBPI样品溶于去离子水中,蛋白质的最终质量浓度为0.1 mg/mL,采用F-4500型荧光分光光度计测定BBPI的内源性荧光光谱,激发波长为290 nm,发射光的扫描范围为280~350 nm,狭缝为5 nm,每个样品溶液扫描3 次。
1.3.8 流变学特性的测定
1.3.8.1 表观黏度的测定
不同pH值处理后的BBPI样品的表观黏度利用马尔文流变仪进行测定,将各个样品分别溶解于去离子水中制成质量浓度为200 mg/mL的蛋白溶液,60 mm、0.5°的锥板,实验在室温下进行,测定样品在0.1~100 s-1频率范围内的表观黏度。
1.3.8.2 弹性模量(G’)和黏性模量(G’’)的测定
用流变仪测定蛋白质的振荡界面膨胀流变特性随pH值的变化。将蛋白溶液(200 mg/mL)缓慢注入充满夹具(60 mm,0.5°的锥板)中,室温保温5 min,测试参数:振幅值0.3%,剪切频率0.1~10 Hz,温度25 ℃,分析样品分散液的G’、G’’及损耗角正切值(tanδ)随角频率的变化。
利用SPSS 18.0对数据进行显著性及相关性分析,采用Origin 8.0软件作图。红外图谱数据处理采用Peakfit 4.21软件进行拟合分析。
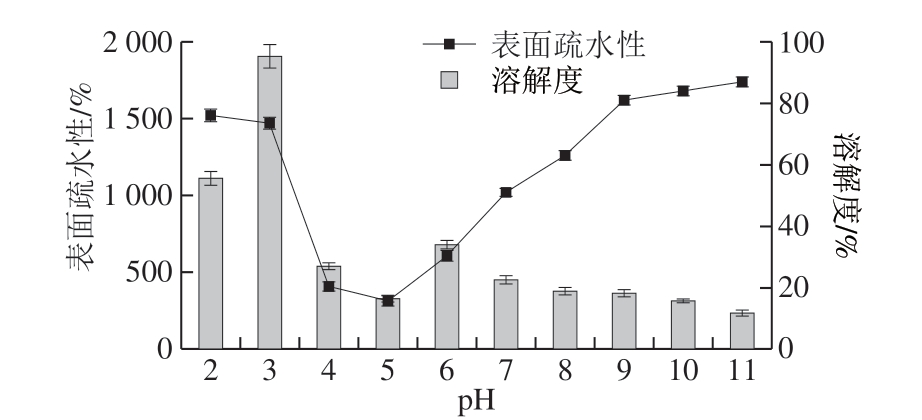
图1 pH值对BBPI的溶解性与表面疏水性的影响
Fig. 1 Effect of pH on solubility and surface hydrophobicity of BBPI
由图1可知,BBPI的等电点在pH 4.0~5.0之间,表面疏水性在远离等电点的两侧均呈现下降趋势且在等电点附近出现最大值,溶解性在pH 5.0时最低,远离pH 5.0的两侧时随酸碱度的增加而增加,这表明在远离等电点时溶解性与表面疏水性呈负相关,本实验研究结果与Kato等[15]的研究一致,即溶解性高的蛋白质分子表面存在的疏水性残基较少。
pH值处理通过改变蛋白质的电离情况进而改变BBPI的溶解度;蛋白质的疏水性残基大部分位于蛋白质内部,pH值处理后BBPI发生不同程度的变性,蛋白质之间的相互作用改变导致蛋白质的表面疏水性发生改变,随酸碱度增加,疏水基团暴露增多,当疏水基团增加到一定程度时,蛋白质分子间会通过疏水键相互聚集[9],发生疏水坍塌,从而引起表面疏水性下降。等电点附近表面疏水性出现最高值(pH 3.0)可能是因为蛋白质亚基解离后经过重折叠呈现舒展的状态,位于α-螺旋内部的疏水氨基酸残基暴露,导致疏水性增高。
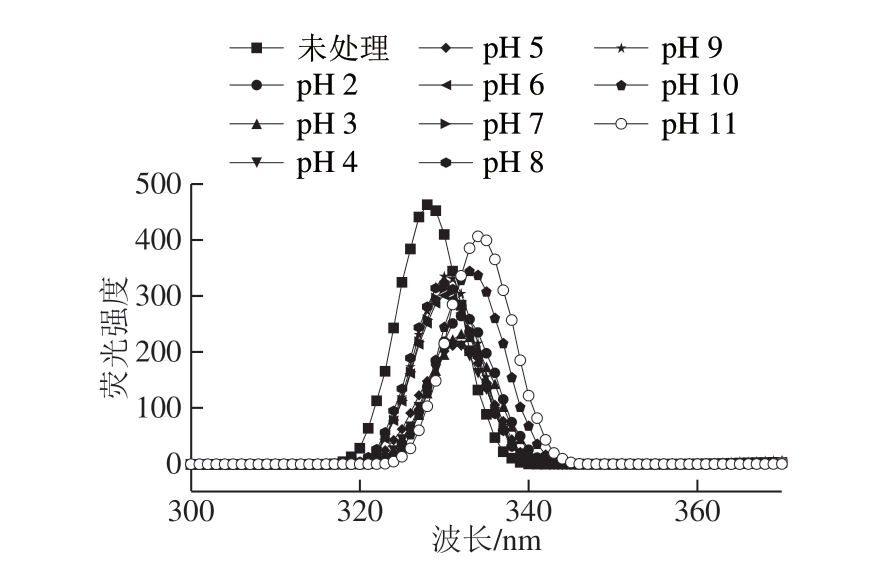
图2 不同pH值处理下BBPI的荧光光谱
Fig. 2 Fluorescence spectra of black bean protein isolate under pH treatments
由图2可以看出,相比于未经pH值处理的BBPI,pH值处理后,BBPI的荧光强度均有所下降且最大吸收波长发生不同程度的红移,说明pH值处理改变了蛋白质色氨酸残基的微环境,BBPI色氨酸残基暴露;由表1可知,BBPI的最大吸收波长(λmax)分布在325~340 nm之间;pH值处理条件下,随酸处理程度加深,荧光强度从202.6增长到265.4,最大吸收波长从330 nm红移到332 nm;随碱处理程度加深,荧光强度从324.6增长到408.2,蛋白质的最大吸收波长从330 nm红移到333 nm,由此可见,经pH值处理后的蛋白质的色氨酸残基所处的微环境极性有所提高且碱处理对BBPI影响较大。
表1 不同pH值处理下BBPI的荧光强度和最大吸收波长
Table 1Fluoresceine intensity and maximum absorption wavelength of black bean protein isolate under pH treatments
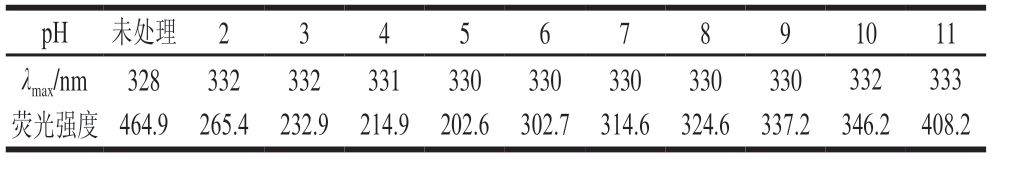
pH 未处理 2 3 4 5 6 7 8 9 10 11 λmax/nm 328 332 332 331 330 330 330 330 330 332 333荧光强度 464.9 265.4 232.9 214.9 202.6 302.7 314.6 324.6 337.2 346.2 408.2
λmax与色氨酸残基所处的环境有关,λmax<330 nm表示色氨酸残基位于非极性环境,相反λmax>330 nm则表示色氨酸残基位于极性环境,由表1可知,未经pH值处理的BBPI的最大吸收波长为328 nm,表明蛋白质色氨酸残基仍位于蛋白质内部非极性环境中,而荧光强度为464.9 nm,明显大于pH值处理后的样品荧光强度,可能是因为BBPI自身外部的疏水基团较多,所以BBPI的溶解性较差;经pH值处理后蛋白质的色氨酸残基不同程度的暴露在外部的极性环境中[16]且BBPI的荧光强度随着pH值处理程度加深而增加,反映了这种结构变化属于一种动态过程,pH值处理后的蛋白样品荧光强度低于未处理组,可能是因为BBPI在pH值处理后再调整回pH 7的过程中可能会产生一种处于变性与未变现之间的“熔球态”的蛋白,这种情况下的蛋白质部分折叠,虽然不能恢复到之前的状态,但蛋白质分子的再聚集会导致更多色氨酸残基被包裹于更加疏水的分子内部,从而引起内源荧光强度的下降[17];也可能是因为酸碱环境下蛋白质分子展开,使内部色氨酸残基暴露,蛋白质分子间相互作用使色氨酸微环境变化,导致内源荧光强度下降[18]。
表2 酰胺I带拟合pH值处理下BBPI二级结构含量
Table 2Contents of secondary structures of black bean protein isolate under pH treatments measured by curve-fitting of amide Іband %
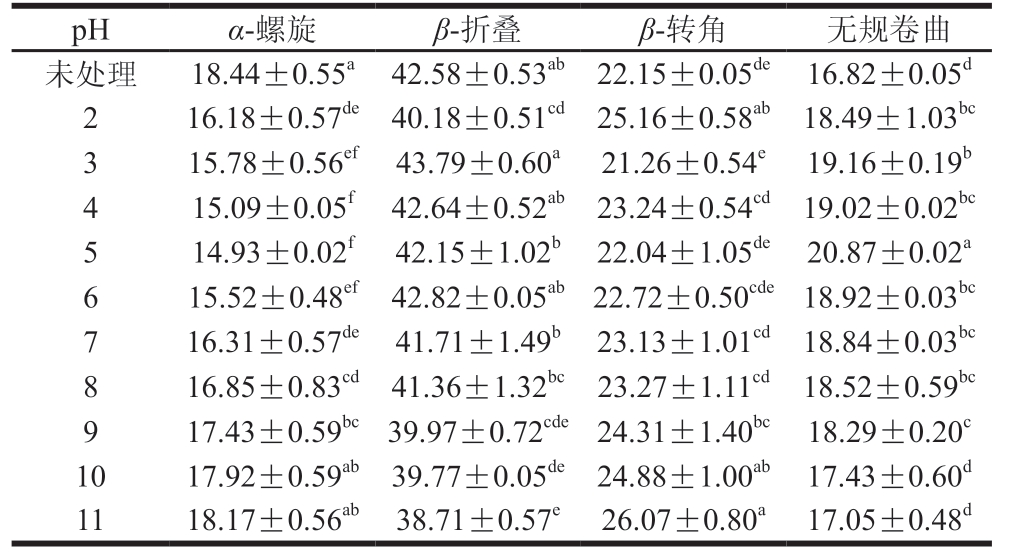
注:同列小写字母不同表示差异显著(P<0.05)。
pH α-螺旋 β-折叠 β-转角 无规卷曲未处理 18.44±0.55a 42.58±0.53ab 22.15±0.05de 16.82±0.05d 2 16.18±0.57de 40.18±0.51cd 25.16±0.58ab 18.49±1.03bc 3 15.78±0.56ef 43.79±0.60a 21.26±0.54e 19.16±0.19b 4 15.09±0.05f 42.64±0.52ab 23.24±0.54cd 19.02±0.02bc 5 14.93±0.02f 42.15±1.02b 22.04±1.05de 20.87±0.02a 6 15.52±0.48ef 42.82±0.05ab 22.72±0.50cde 18.92±0.03bc 7 16.31±0.57de 41.71±1.49b 23.13±1.01cd 18.84±0.03bc 8 16.85±0.83cd 41.36±1.32bc 23.27±1.11cd 18.52±0.59bc 9 17.43±0.59bc 39.97±0.72cde 24.31±1.40bc 18.29±0.20c 10 17.92±0.59ab 39.77±0.05de 24.88±1.00ab 17.43±0.60d 11 18.17±0.56ab 38.71±0.57e 26.07±0.80a 17.05±0.48d
由表2可知,BBPI含有4 种二级结构组分:α-螺旋、β-折叠、β-转角和无规卷曲,其中α-螺旋和β-折叠为BBPI的有序结构,β-转角和无规卷曲为无序结构;与未处理BBPI样品对比,pH值处理条件下BBPI的α-螺旋结构含量减少,无规卷曲含量增加,可能是因为pH值处理使得BBPI发生部分变性,变性过程与α-螺旋结构数量的减少和无序结构的数量增加有关[19];在远离等电点的pH值处理下,α-螺旋含量显著增加,β-折叠含量显著下降,且随着酸碱度的增加,这些变化更加明显;靠近等电点时,α-螺旋含量减小、β-折叠含量增多,可能是因为蛋白质表面电荷量少,静电斥力减小、疏水相互作用增大、分子间氢键增大导致的[20],无规卷曲含量的增加可能是受蛋白质聚集的影响。β-折叠比例增加的同时α-螺旋结构的比例减小,可能是因为pH值的变化影响了α-螺旋和β-折叠结构之间的平衡,使其发生了结构转化[21]。通过与表面疏水性变化规律相关性分析表明,表面疏水性与β-转角含量负相关(r=-0.423,P<0.05),表面疏水性与β-折叠含量正相关(r=0.502,P<0.05),说明蛋白质的二级结构变化影响了其功能性质的表达,王中江等[22]采用圆二色谱研究pH值对大豆分离蛋白二级结构的影响,得到的结果与本研究结果一致。
如图3所示,在pH值处理下,BBPI的乳化性及乳化稳定性呈现先下降后上升的趋势,等电点附近乳化性及乳化稳定性最低,可能是因为等电点时,蛋白质表面电荷量少,缺乏静电排斥的相互作用会使得乳液中蛋白质絮凝、聚集导致乳化性降低,偏离等电点时,蛋白质表面静电荷含量增加,增加了蛋白质的溶解性进而提高蛋白质的乳化活性及乳化稳定性,随酸碱度增加,蛋白质逐渐变性,变性蛋白所含氨基酸残基的疏水基团指向油相,而亲水性基团指向水,越偏离等电点乳化活性越好,可能是因为蛋白质发生了改性,增强了与油相之间的作用,乳化活性更好[23]。
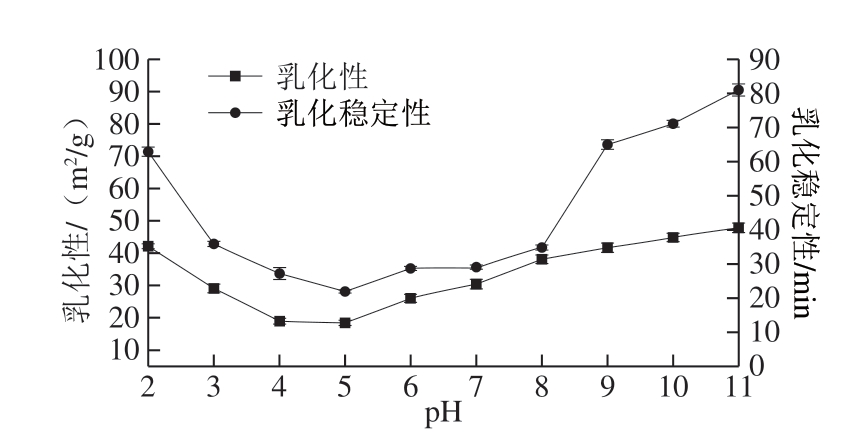
图3 pH值对BBPI乳化性及乳化稳定性的影响
Fig. 3 Effect of pH on EAI and ESI of BBPI
pH值处理可能会使得BBPI部分形成“熔融态”的蛋白质[24],这部分蛋白的二级结构相对稳定,但三级结构会有所变化,结构展开会导致蛋白内部疏水氨基酸暴露,表面疏水性增强,蛋白质三级结构的改变显著提高了蛋白质的乳化性能[24],结构展开使得蛋白质具有相对柔软的构象,多肽链松散,乳化性能提高[25]。
2.5.1 表观黏度
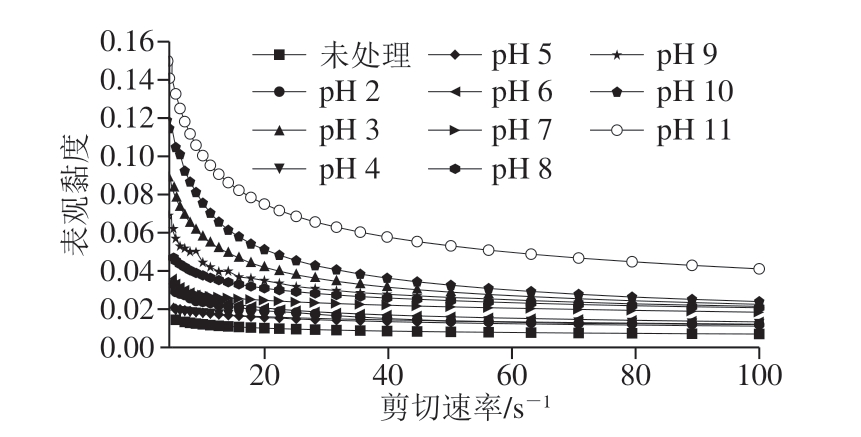
图4 pH值对BBPI表观黏度的影响
Fig. 4 Effect of pH on apparent viscosity of BBPI
由图4可知,在同一剪切速率下,不同pH条件处理后BBPI溶液的表观黏度不同,pH值处理后的蛋白质溶液的表观黏度大于未处理组,说明处理后的蛋白体系趋于稳定[26];不同pH条件处理的蛋白溶液样品间表观黏度值和变化趋势差异较大,等电点时的表观黏度最低,所有样品的表观黏度随剪切速率的增加均呈现降低的趋势,即表现出剪切稀释的现象,符合非牛顿流体特性,这与Karaman等[27]报道的乳液剪切稀化一致。
表观黏度的变化规律与乳化活性及乳化稳定性大体一致,即远离等电点均呈现上升趋势。在pH 3时表观黏度大于pH 2条件下的蛋白溶液,可能是因为该条件处理BBPI导致疏水基团暴露较多,蛋白间形成了三维网状结构,降低了流动性,即蛋白质分子之间的连接更加紧密,表观黏度增大[28-29]。表观黏度呈现上升的趋势且在等电点时最小,这与孙少敏等[30]报道的小麦醇溶蛋白溶液的研究一致,这是因为临近等电点,水合度小,溶液流动时受到的阻力小,故在pH 4、5时黏度较小;远离等电点时溶解性高,水化程度比较高,能固定更多的水分子,体积变大,根据托克斯定律[31],蛋白溶液体积越大,溶液在流动的过程中受到的内部阻力越大,阻碍了介质的自由移动从而表现出较高的表观黏度,所以表观黏度呈上升趋势[32];尤其当pH值过于偏酸偏碱时,蛋白质发生部分变性,削弱了表面水合层蛋白质分子间发生聚集形成较大的聚合物,很大程度上提高了蛋白质溶液的黏度[33]。也可能是因为远离等电点,蛋白质表面带同种电荷量增加,静电斥力增加导致黏度增加[33]。
2.5.2 BBPI黏弹性
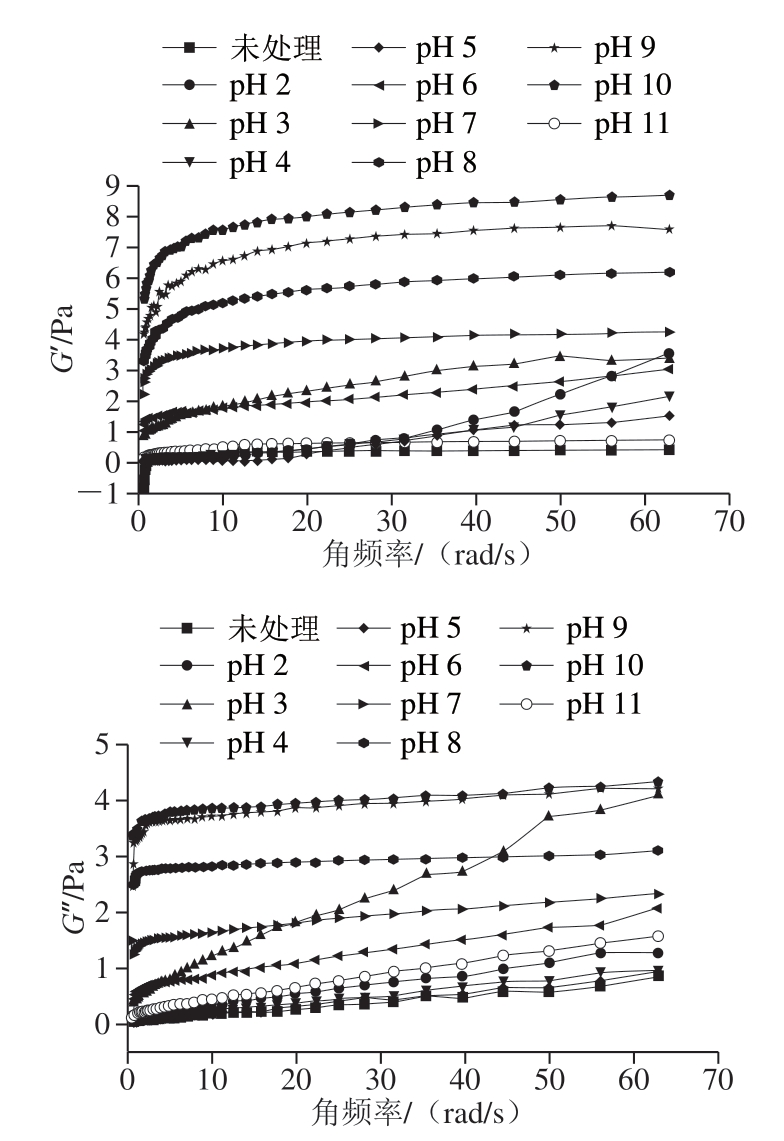
图5 pH值对BBPI的G’、G’’的影响
Fig. 5 Effect of pH on G’ and G’’ of BBPI
由于蛋白质发生凝胶的能力与聚集状态有很大的关系,所以蛋白质在不同的pH值处理条件发生的不同聚集模式可能对蛋白质的凝胶能力有很大的影响,小幅振荡变形流变测试已经被广泛用于研究蛋白凝胶过程中的黏弹性和分子间相互作用。由图5可以看出,储能模量对扫描频率具有一定的依赖性,pH值处理后的样品G’值高于未处理组,说明pH值处理BBPI可以在一定程度上促进形成均一、致密、高强度的蛋白质凝胶状网络结构[34],pH值处理后的样品的G’增大,原因可能是pH值处理后蛋白质中的亚基发生变性,巯基氧化形成二硫键,新的二硫键进一步加强了蛋白质分子间的共价作用,加固了蛋白的凝胶网络结构,G’增强[35];pH 4.0、5.0时G’、G’’增长缓慢可能是因为临近等电点时,蛋白质水合能力差,蛋白质重排变得困难,降低了G’增长的速度,蛋白质发生聚集生成沉淀不能产生凝胶,黏弹性较差。pH 11.0样品的G’和G’’低,可能是因为蛋白质变性结构展开,有序结构向无序结构转变导致流动性增加,这有可能破坏已经形成的网络结构,所以G’下降[35];也可能是极端pH值条件下破坏了疏水相互作用力和范德华力,使蛋白亚基之间的二硫键发生断裂,蛋白质的三级结构部分展开,从而改变了蛋白质紧密的三维结构,黏弹性减弱。不同pH值处理后样品的G’增幅差异较大,说明pH值对蛋白形成凝胶网络状结构有很大的影响。
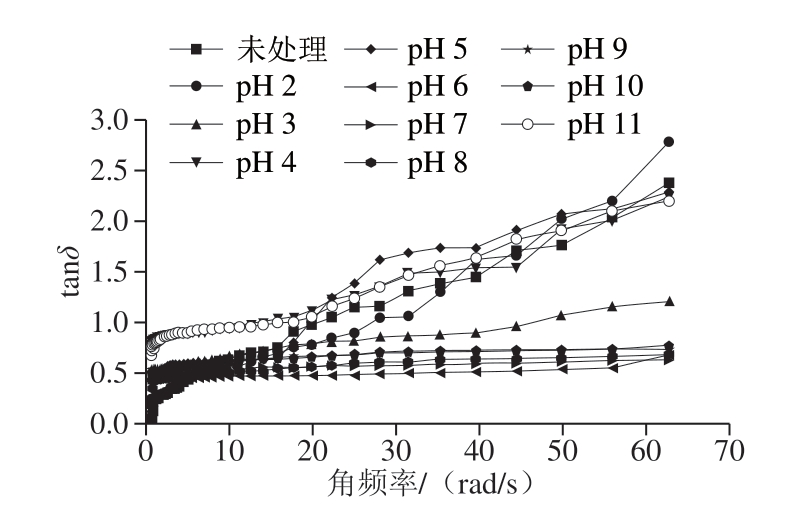
图6 pH值对BBPI的tanδ的影响
Fig. 6 Effect of pH on tanδ of BBPI
tanδ值可以作为衡量蛋白质在凝胶三维网状结构中的动态性质。由图6可知,未处理组、pH 2.0、4.0、5.0、11.0的BBPI溶液tanδ>1且呈上升趋势,说明蛋白溶液体系的聚合度变小,形成的凝胶状的网络结构不够稳定,可能在高剪切频率下,破坏了已经形成的三维结构。pH值处于等电点时tanδ值大,说明蛋白质的G’’性强,流动性大,不利于形成凝胶状网络结构[36]。pH 3.0时tanδ<1且随频率增加有所上升,表明pH 3的条件显著提高BBPI的黏弹性[37]。pH 6.0、7.0、8.0、9.0、10.0的蛋白溶液的tanδ<1且从低剪切频率到高剪切频率几乎不变,表明在这个范围内蛋白质的凝胶网络结构黏性越低,弹性越高,tanδ值越低表明形成的三维网状结构更好[38],说明在6<pH<10范围内pH值处理使得蛋白在溶液中的弹性更强,结构更稳定,可能是疏水相互作用在稳定蛋白质-蛋白质聚集物方面发挥重要作用。对比表面疏水性数据发现,表面疏水性强的BBPI样品溶液形成的三维网状结构更好。
pH值处理对BBPI的理化性质及流变性质产生了一定的影响,远离等电点随pH值升高,蛋白质间的疏水作用降低,减少了静电粒子的相互作用,溶解性得到改善,具有高溶解性蛋白质的表面疏水性较低;三级结构展开,亚基解离,巯基氧化成二硫键可以进一步加强蛋白质的凝胶网络结构,疏水氨基酸暴露影响蛋白质分子空间结构,表面活性增强,溶解性和乳化性随之增强,蛋白质的二级结构发生了由β-折叠向α-螺旋的转变,表面疏水性与β-折叠含量正相关(r=0.502,P<0.05),溶解度与乳化性变化趋势一致,与表面疏水性变化趋势相反。
随pH值处理条件变化,表观黏度先减少后增大,pH值处理后BBPI乳液的黏弹性均高于未处理组,表面疏水性对形成凝胶状的网络结构发挥重要作用;研究发现制备乳液时具有高溶解性和低疏水性(pH 11.0)的蛋白质能更好的与油水界面结合,乳化活性与稳定性最好;具有高溶解性和高疏水性(pH 3.0)的蛋白质能形成强黏弹性界面膜,且表面疏水性越高,形成的三维网状结构更好。
[1] 商国懋, 卢文可. 益精明目的黑豆[J]. 首都食品与医药, 2017, 24(5):55.
[2] 李杨, 刘宝华, 姜楠, 等. 超声处理对黑豆蛋白凝胶性能的影响[J].中国食品学报, 2017, 17(1): 161-169. DOI:10.16429/j.1009-7848.2017.01.021.
[3] 蒋将. pH偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善[D]. 无锡: 江南大学, 2011.
[4] 王辰, 江连洲, 魏冬旭, 等. 不同品种大豆分离蛋白结构与表面疏水性的关系[J]. 食品科学, 2012, 33(9): 54-57.
[5] 周凯琳, 陶莎, 薛文通. 黑豆蛋白及其抗氧化肽研究进展[J]. 食品工业, 2015, 36(5): 204-207.
[6] 任彩霞. 黑豆饼干及桃酥配方与工艺研究及其工厂设计[D]. 西安:陕西师范大学, 2016.
[7] 毕爽, 齐宝坤, 隋晓楠, 等. 超声处理对黑豆蛋白结构和功能性质的影响[J]. 中国食品学报, 2016, 16(6): 153-160. DOI:10.16429/j.1009-7848.2016.06.021.
[8] 王小庆, 任健. 不同预热处理温度对黑豆分离蛋白乳液凝胶性质的影响[J]. 中国油脂, 2016, 41(8): 28-30. DOI:10.3969/j.issn.1003-7969.2016.08.007.
[9] KONG X Z, LI X H, WANG H J, et al. Effect of lipoxygenase activity in defatted soybean flour on the gelling properties of soybean protein isolate[J]. Food Chemistry, 2008, 106(3): 1093-1099. DOI:10.1016/j.foodchem.2007.07.050.
[10] 耿蕊, 刘骞, 卢岩, 等. pH偏移结合加热处理对大豆分离蛋白结构特性的影响[J]. 中国食品学报, 2015, 15(11): 219-226.
[11] MORR C V, GERMAN B, KINSELLA J E, et al. A collaborative study to develop a standardized food protein solubility procedure[J]. Journal of Food Science, 1985, 50(6): 1715-1718. DOI:10.1111/j.1365-2621.1985.tb10572.x.
[12] 朱明华, 胡坪. 仪器分析[M]. 4版. 北京: 高等教育出版社, 2009.
[13] BARTH A. Infrared spectroscopy of proteins[J]. Biochimica et Biophysica Acta, 2007, 1767(9): 1073-1101. DOI:10.1016/j.bbabio.2007.06.004.
[14] 何建川, 邵阳, 张波. 蛋白质和变性蛋白质二级结构的FTIR分析进展[J]. 化学研究与应用, 2012, 24(8): 1176-1180.
[15] KATO A, NAKAI S. Hydrophobicity determination by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta, 1980, 624(1): 13-20.DOI:10.1016/0005-2795(80)90220-2.
[16] TRAVERSO N N. Malondialdehyde, a lipoperoxidation-derived aldehyde, can bring about secondary oxidative damage to proteins[J].Journals of Gerontology, 2004, 59(9): B890-B895. DOI:10.1093/gerona/59.9.B890.
[17] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014.
[18] 余娱乐. pH调节法制备兔肉分离蛋白及其性质研究[D]. 重庆: 西南大学, 2018.
[19] TOMCZYNSKA-MLEKO M, KAMYSZ E, SIKORSKA E, et al.Study on changes of secondary structure and surface tension of whey protein isolate dispersions upon pH and temperature[J]. Czech Journal of Food Sciences, 2014, 32(1): 82-89. DOI:10.17221/326/2012-CJFS.
[20] 张兴, 杨玉玲, 马云, 等. pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J]. 中国农业科学, 2017, 50(3): 564-573.DOI:10.3864/j.issn.0578-1752.2017.03.015
[21] QI P X, ONWULATA C I. Physical properties, molecular structures,and protein quality of texturized whey protein isolate: effect of extrusion moisture content[J]. Journal of Dairy Science, 2011, 94(5):2231-2244. DOI:10.3168/jds.2010-3942.
[22] 王中江, 江连洲, 魏冬旭, 等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.
[23] LAWAL O S, ADEBOWALE K O, OGUNSANWO B M, et al. On the fuctional properties of globulin and albumin protein fractions and flours of African locust bean (Parkia biglobossa)[J]. Food Chemistry,2005, 92(4): 681-691. DOI:10.1016/j.foodchem.2004.08.043.
[25] 周向军, 董瑞红, 高义霞. pH偏移结合温和热处理对蚕豆分离蛋白结构和功能的影响[J]. 食品与发酵工业, 2019, 45(1): 100-108.DOI:10.13995/j.cnki.11-1802/ts.016995.
[25] JIANG J, CHEN J, XIONG Y L. Structural and emulsifying properties of soy protein isolate subjected to acid and alka line pH-shifting processes[J]. Journal of Agriculture and Food Chemistry, 2009, 57(16):7576-7583. DOI:10.1021/jf901585n.
[26] 周爱琴, 葛胜菊, 常然然, 等. 淀粉纳米颗粒对大豆分离蛋白流变特性、乳化性的影响[J]. 粮食与油脂, 2016, 29(12): 56-59.DOI:10.3969/j.issn.1008-9578.2016.12.016.
[27] KARAMAN S, YILMAZ M T, DOGAN M, et al. Dynamic oscillatory shear properties of O/W model system meat emulsions: linear viscoelastic analysis for effect of temperature and oil concentration on protein network formation[J]. Journal of Food Engineering, 2014,107(2): 241-252. DOI:10.1016/j.jfoodeng.2011.06.016.
[28] 张会, 任健. pH对玉米胚芽蛋白Pickering乳液稳定性及流变学性质的影响[J]. 中国油脂, 2019, 44(3): 48-51; 57.
[29] 朱连昌. 大豆蛋白自组装纤维的乳化性质研究[D]. 广州: 华南理工大学, 2016.
[30] 孙少敏, 宋义虎, 陈瑶, 等. 小麦醇溶蛋白溶液的流变特性研究[J].食品科学, 2007, 28(3): 34-37. DOI:10.3321/j.issn:1002-6630.2007.03.003.
[31] MALHOTRA A, COUPLAND J N. The effect of surfactants on the solubility, zeta potential, and viscosity of soy protein isolates[J].Food Hydrocolloids, 2004, 18(1): 101-108. DOI:10.1016/s0268-005x(03)00047-x.
[32] 冯凌凌, 熊犍. 大豆浓缩蛋白粘度与动态粘弹性研究[J]. 食品与发酵工业, 2007(12): 36-39. DOI:10.13995/j.cnki.11-1802/ts.2007.12.015.
[34] 田少君, 雷继鹏, 孙阿鑫. 温度对大豆蛋白流变特性的影响[J]. 中国油脂, 2004(10): 47-49. DOI:10.3321/j.issn:1003-7969.2004.10.012.
[34] 包中宇. 超声波技术对大豆分离蛋白功能性质、结构及凝胶特性的影响[D]. 南昌: 南昌大学, 2015.
[35] 简华君. 大豆蛋白对肌纤维复合蛋白凝胶性质的影响[D]. 无锡:江南大学, 2014.
[36] 张雅媛, 洪雁, 顾正彪, 等. 玉米淀粉与黄原胶复配体系流变和凝胶特性分析[J]. 农业工程学报, 2011, 27(9): 357-362.
[37] 马福敏, 王璋, 许时婴, 等. 离子强度对水溶性戊聚糖-面筋蛋白混合体系粘弹性的影响[J]. 食品工业科技, 2009, 30(3): 140-142.
[38] SUN X D, ARNTFIELD S D, BASSETT C, et al. Gelation properties of salt-extracted pea protein induced by heat treatment[J]. Food Research International, 2010, 43(2): 509-515. DOI:10.1016/j.foodres.2009.09.039.