图1 取样位点示意图
Fig. 1 Schematic of sampling sites
Correlation Analysis of Microbial Community Succession in Fermented Grains of Xifeng-Flavor Chinese Liquor with Its Physicochemical Indexes
中国白酒可分为清香型、酱香型、浓香型、凤香型等12 种香型[1]。凤香型白酒以乙酸乙酯为主,己酸乙酯和高级醇为辅,具有醇香秀雅、诸味谐调的特点,凤香型白酒的独特性与其生产工艺和微生物群落息息相关。
自2005年以来,随着科学的发展,以罗氏公司454测序技术、Illumina公司Solexa测序技术和ABI公司的Solid测序技术为代表的高通量测序技术相继诞生,并广泛应用于传统发酵食品的微生物群落的宏基因组研究中[2],包括食醋[3]、鱼露[4]、牛奶[5]、酸肉[6]、米酒[7]、浓香[8]和清香白酒[9-10]等。在白酒领域利用高通量测序对酿酒微生物群落的研究也逐渐增加,已有研究[11-13]关于洋河浓香白酒发酵过程中微生物群落结构及其与有机酸合成的相关性,找到与有机酸合成相关的7 个菌属,分别为乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、酵母属(Saccharomyces)、Naumovozyma、伊萨酵母属(Issatchenkia)、嗜冷芽孢杆菌属(Psychrobacillus)和根霉属(Rhizopus)。黄蕴利等[14]研究了酱香型白酒第2轮次发酵过程中微生物多样性,检测堆积和窖池发酵中的细菌和真菌,酒醅中主要优势菌属为Lactobacillus、Saccharomyces、假丝酵母属(Candida)、青霉菌属(Penicillium)、镰孢霉属(Fusarium)。王雪山[15]分析不同环境清香类型白酒发酵微生物种群结构比较及溯源解析,采用高通量测序得到酒醅中主要的细菌种群包含Lactobacillus、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、Kroppenstedtia、魏斯氏菌属(Weissella)和不动杆菌属(Acinetobacter),真菌种群主要包含毕赤酵母属(Pichia)、Candida、Kazachstania、复膜孢酵母属(Saccharomycopsis)、Saccharomyces、维克汉姆酵母属(Wickerhamomyces)和曲霉属(Aspergillus)。但凤香型白酒酿造微生物群落的研究尚鲜有报道,对微生物结构的复杂性、多样性以及动态变化情况等方面认识仍然不足。
本研究以凤香型白酒发酵过程中酒醅为对象,通过高通量测序技术解析不同发酵时间的酒醅微生物群落组成,评价微生物群落多样性与理化指标的相关性。以期为更好了解研究凤香型白酒的酿造机理提供理论依据,对凤香型白酒的提质发展具有重要意义。
酒醅样:西凤酒9 0 3 制酒车间,圆窖期间3月份的重点窖酒醅。分别按入池0、4、7、1 0、14、18、22 d和30 d(出窖)时间跟踪取样8 次,记为J 0 d、J 4 d…J 3 0 d。用取样器依次取上层、中层和下层酒醅(每层取3 个区域的点样混合,见图1),将3 层的样品进行混合,放于-20 ℃冰箱保存。
0.1 mol/L NaOH溶液、1%酚酞溶液、0.2%葡萄糖溶液、斐林氏甲液、斐林氏乙液、10 g/L次甲基蓝指示剂美国Sigma公司。

图1 取样位点示意图
Fig. 1 Schematic of sampling sites
DH-2000R高速台式冷冻离心机 上海德洋意邦仪器有限公司;D-78224超声水浴清洗仪 德国Elma公司;AB204-E分析天平 瑞士Mettler Toledo公司。
1.3.1 酒醅理化指标的检测
酸度、淀粉、还原糖测定:参照DB 34/T 2264—2014《固态发酵酒醅分析方法》;温度测定:用测温计测量取样点附近的温度。
1.3.2 酒醅微生物多样性检测
将酒醅样品送北京奥维森基因科技有限公司,利用ITS2 MiSeq PE300平台进行高通量测序分析。提取酒醅微生物总基因组后,分别对基因组的16S V3-V4区和ITS2(ITS3-ITS4)区扩增子测序分析。
2.1.1 真菌
2.1.1.1 真菌菌群测序数据统计
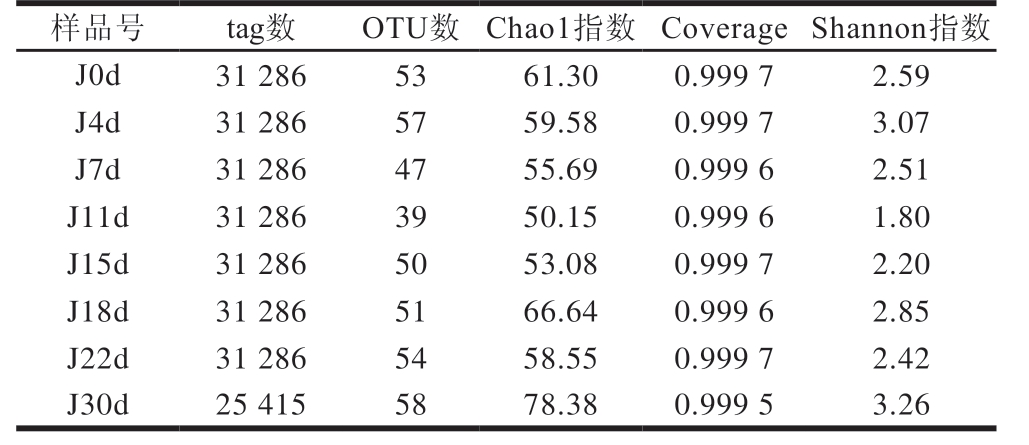
表1 酒醅真菌菌群测序数据统计分析
Table 1Statistical analysis of fungal community sequencing data of fermented grains
样品号 tag数 OTU数 Chao1指数 Coverage Shannon指数J0d 31 286 53 61.30 0.999 7 2.59 J4d 31 286 57 59.58 0.999 7 3.07 J7d 31 286 47 55.69 0.999 6 2.51 J11d 31 286 39 50.15 0.999 6 1.80 J15d 31 286 50 53.08 0.999 7 2.20 J18d 31 286 51 66.64 0.999 6 2.85 J22d 31 286 54 58.55 0.999 7 2.42 J30d 25 415 58 78.38 0.999 5 3.26
如表1所示,得到每个样品所对应的分类序列条数(tag数),通过归类操作,将每个样品序列按照彼此的相似性分归为许多可操作分类单元(operational taxonomic unit,OTU)。其中发酵30 d真菌的OTU数最高为58,所有样品共有的真菌OTU数为27。发酵过程中酒醅样本的Chao1指数在50.15~78.38之间,Shannon指数在1.80~3.26之间。发酵30 d的Shannon指数最高,达到3.26(Shannon指数越高,多样性越高),说明出池酒醅的微生物多样性远高于发酵期酒醅。发酵过程中氧逐渐被消耗,产生酸和乙醇,对有些微生物起到抑制作用,所以发酵中期多样性指数较低。所有样本的覆盖率(Coverage)在0.999 5~0.999 7之间,测序结果能完整反映西凤酒酒醅真菌菌群组成信息。
2.1.1.2 发酵过程中真菌群落的演替规律
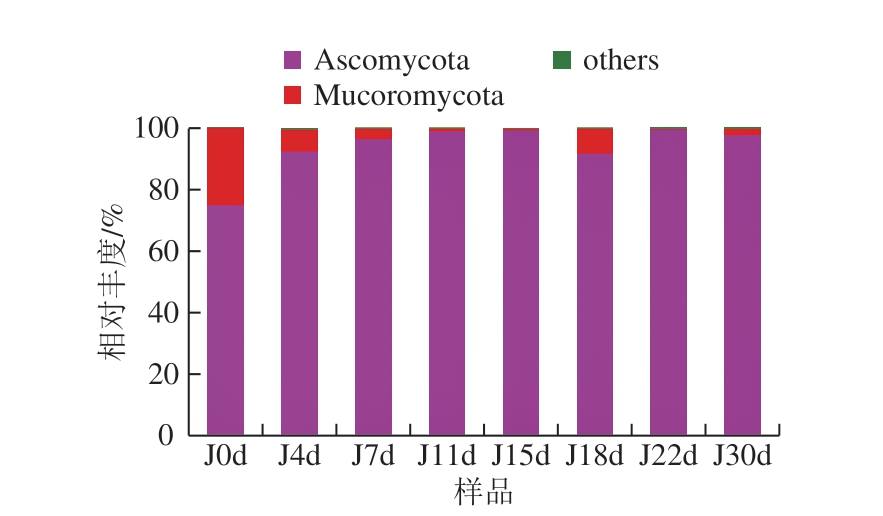
图2 门水平下真菌群落结构组成分布
Fig. 2 Distribution of fungal community structure at phylum level
如图2 所示, 整个发酵过程中有子囊菌门(Ascomycota)、毛霉亚门(Mucoromycota),其中Ascomycota占绝对优势。已有研究表明,Ascomycota不仅是凤香型酒醅中优势真菌种群,同样也是酱香型白酒及食醋等多种发酵食品中的主要真菌种群。
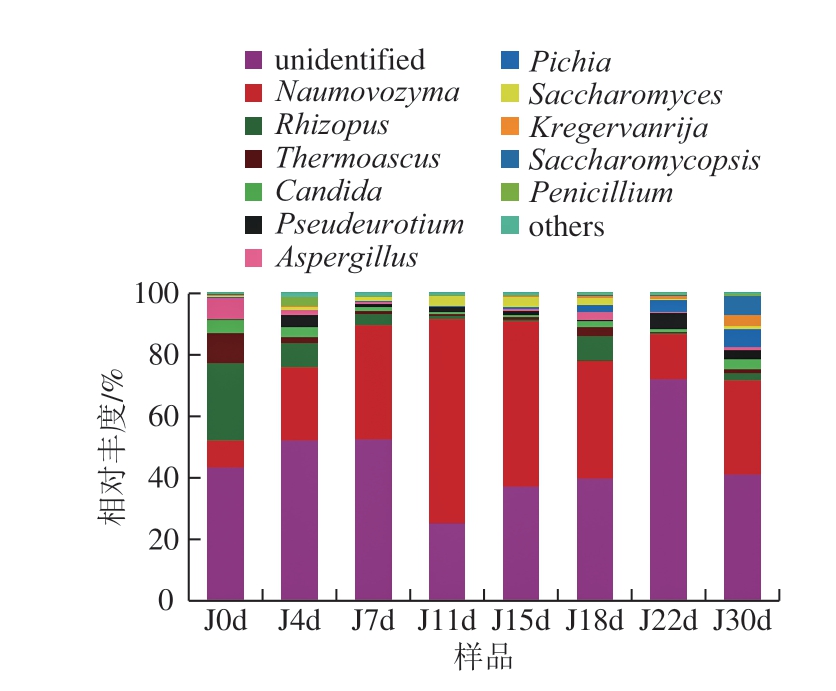
图3 属水平下真菌群落结构分布
Fig. 3 Distribution of fungal community structure at genus level
西凤酒酒醅发酵过程中共检测出3 3 个属的真菌微生物,真菌群落属水平的演替规律如图3 所示,其中主要存在11 个真菌类群:Naumovozyma、Rhizopus、热子囊菌属(Thermoascus)、Aspergillus、Candida、Pseudeurotium、Saccharomycopsis、Pichia和Saccharomyces、Kregervanrija、Penicillium。发酵过程中主要优势菌为Rhizopus、Naumovozyma、Thermoascus、Candida、Pichia、Pseudeurotium和Saccharomyces。其中Naumovozyma占绝对优势,相对丰度为8.77%~66.69%,发酵前期增殖迅速,成为优势菌株,在11 d相对丰度达到峰值,发酵后期逐渐降低。Rhizopus相对丰度为0.39%~24.87%;Rhizopus、Aspergillus在发酵前期占据优势地位,随着氧气的耗尽、温度的升高呈下降趋势,在18 d短暂回升,发酵后期再次下降至发酵结束。Saccharomyces相对丰度为0.24%~3.30%,发酵前期繁殖迅速,在动态稳定期成为第二优势菌株,主要完成乙醇发酵;在发酵后期(22 d)急剧降低并保持在很低水平。Thermoascus相对丰度为0.27%~9.65%;从初始9.65%(0 d)下降至0.43%(11 d),后处于较低水平。Candida相对丰度为0.62%~4.57%,在发酵初始和发酵结束时相对丰度为3.5%~4.5%,发酵过程中较低。Pichia相对丰度为0.05%~6.18%,在发酵中后期波动增加。Pseudeurotium相对丰度为0.33%~6.75%,发酵中波动增加,增幅较小。
2.1.2 细菌
2.1.2.1 细菌菌群测序数据统计
表2 酒醅细菌菌群测序数据统计分析
Table 2Statistical analysis of bacterial community sequencing data of fermented grains
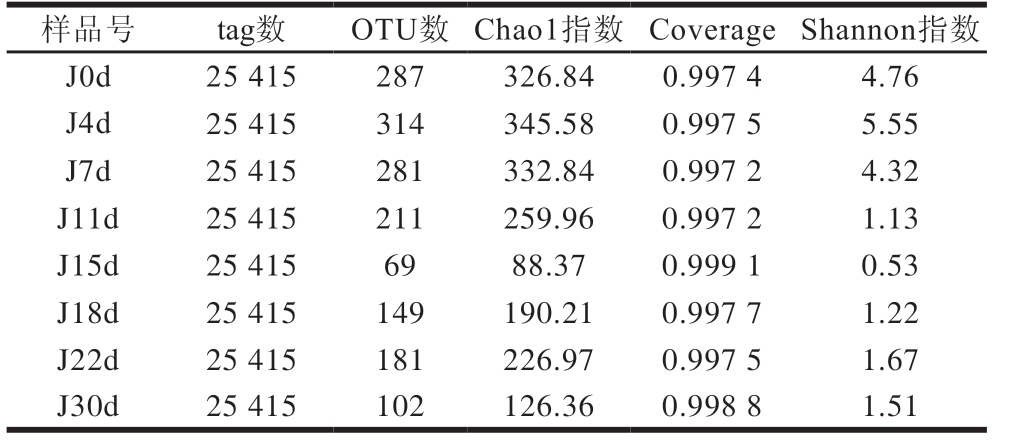
样品号 tag数 OTU数 Chao1指数 Coverage Shannon指数J0d 25 415 287 326.84 0.997 4 4.76 J4d 25 415 314 345.58 0.997 5 5.55 J7d 25 415 281 332.84 0.997 2 4.32 J11d 25 415 211 259.96 0.997 2 1.13 J15d 25 415 69 88.37 0.999 1 0.53 J18d 25 415 149 190.21 0.997 7 1.22 J22d 25 415 181 226.97 0.997 5 1.67 J30d 25 415 102 126.36 0.998 8 1.51
酒醅细菌菌群测序数据统计分析见表2,每个样品所对应的分类序列条数(tag数)最终为25 415,发酵4 d的OTU数最高为314,所有样品共有的OTU数为43。发酵过程中酒醅样本的Chao1指数在88.37~345.58之间,Shannon指数在0.53~5.55之间,随着发酵的进行,Shannon指数降低,说明发酵过程中低氧、低pH值以及高乙醇的不利条件,使得许多细菌受到抑制。所有样本的Coverage在0.997 2~0.999 1之间,测序结果能完整反映西凤酒酒醅细菌菌群组成信息。
2.1.2.2 酵过程中细菌群落的演替规律
如图4 所示,西凤酒发酵酒醅中细菌分属5 个门类,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和Saccharibacteria。其中Firmicutes占绝对优势。
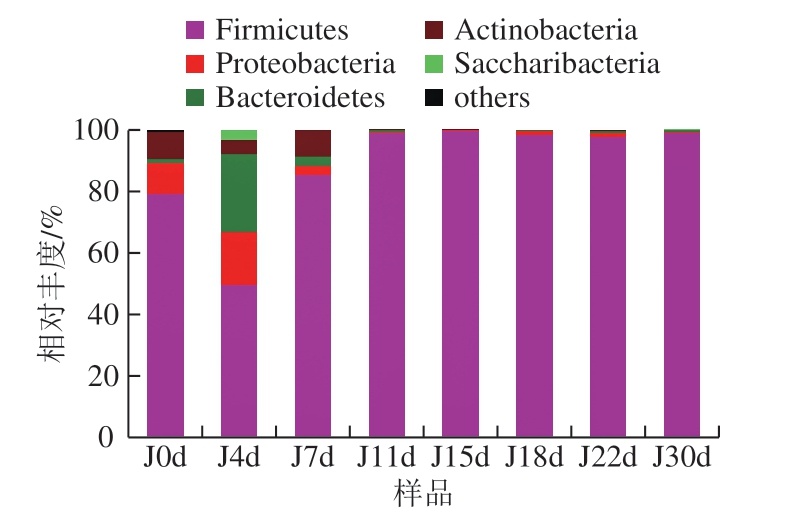
图4 门水平下细菌群落结构组成分布
Fig. 4 Distribution of bacterial community structure at phylum level
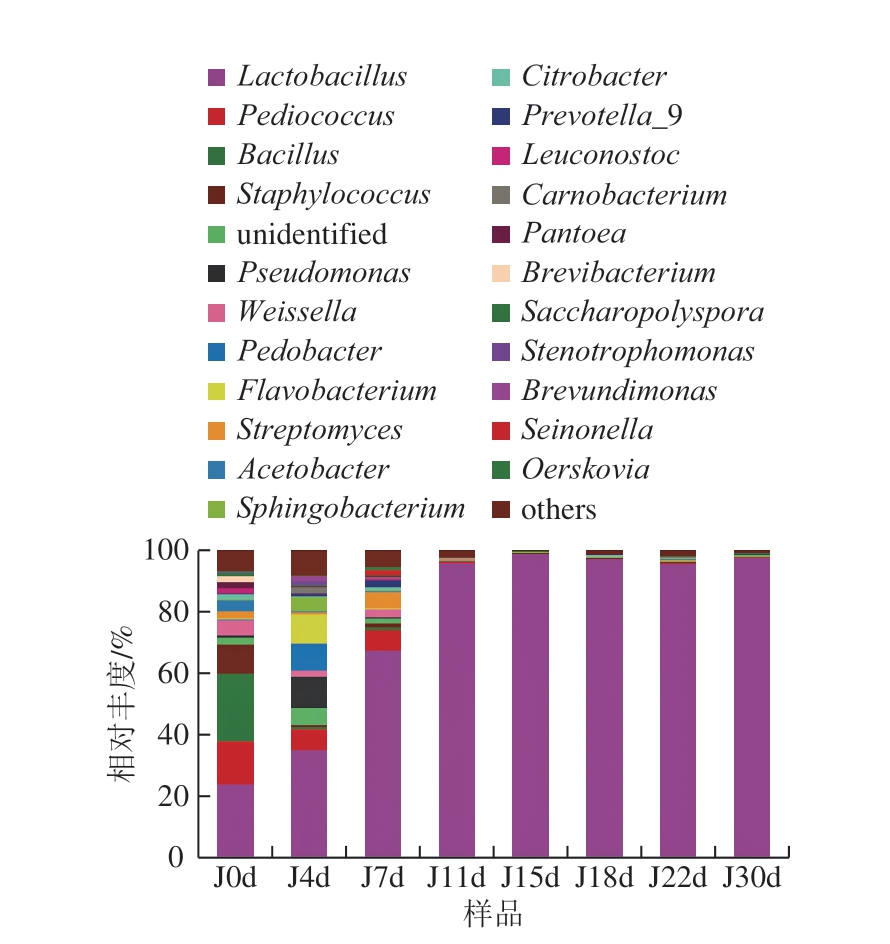
图5 属水平下细菌群落结构分布
Fig. 5 Distribution of bacterial community structure at genus level
西凤酒发酵酒醅中共检测出183 个属的细菌微生物,如图5所示,西凤酒发酵酒醅中主要存在22 个细菌类群,分别为Lactobacillus、片球菌属(Pediococcus)、Bacillus、Staphylococcus、Pseudomonas、Weissella、地杆菌属(Pedobacter)、黄杆菌属(Flavobacterium)、链霉菌属(Streptomyces)和醋酸杆菌属(Acetobacter)等。入池酒醅的细菌群落以Lactobacillus、Bacillus、Pediococcus、Staphylococcus、Weissella、Acetobacter等为主。
发酵过程中主要优势菌为Lactobacillus、Weissella、Streptomyces、Pediococcus,其中Lactobacillus占绝对优势,相对丰度为23.98%~98.9%,发酵前期逐渐增多占据绝对优势,在发酵后期相对丰度保持在90%以上。Weissella相对丰度为0.13%~6.29%,从初始的6.29%下降至0.17%(11 d),后期保持在一个较低的水平。Streptomyces相对丰度为0.05%~5.53%,在发酵7 d升高随后降低并在11 d后保持在0.9%以下。Pediococcus相对丰度为0.15%~13.82%,从初始的13.82%下降至0.75%(11 d),并在发酵后期保持在较低水平,这可能与发酵过程中环境因素的变化有关,随着发酵进行窖池逐渐进入厌氧和高渗环境,不利于片球菌的生长繁殖。
综合以上,西凤酒酒醅真菌以Naumovozyma、Rhizopus、Thermoascus、Saccharomyces、Candida、Pichia、Pseudeurotium等为主;细菌以Lactobacillus、Bacillus、Pediococcus、Weissella、Streptomyces等为主,其中Naumovozyma和Lactobacillus占绝对优势。
Rhizopus产糖化酶和液化酶能力强,有产生脂肪酶和乙醇的能力,能快速催化有机酸和乙醇生成酯类物质[16];Naumovozyma产生的乙醇可与乙酸、乳酸反应产生己酸和丁酸,在一定程度上抑制窖内发酵中乳酸及乙酸的合成[17];Pichia产乙酸酯能力较强,多数产糖苷酶[18]。乳酸菌也是酸肉、香肠发酵中的优势细菌[4,6],具有生成乙酸、乳酸和其他风味物质的能力[19];Weissella可促进乳杆菌生长;Streptomyces各个种都能利用葡萄糖,有较强的淀粉和蛋白质水解能力。
表3 凤香型白酒与其他香型白酒微生物菌群高通量测序结果比较
Table 3Comparison of microbial communities in fermented grains of different Chinese liquors by next-generation sequencing

微生物 本研究(凤香型) 酱香型白酒[14,20-22] 浓香型白酒[13,23-25] 清香型白酒[26-29] 特香型白酒[30]真菌Naumovozyma、Rhizopus、Thermoascus、Aspergillus、Candida、Pseudeurotium、Saccharomycopsis、Pichia、Saccharomyces、Kregervanrija Penicillium、Pichia、Aspergillus、Thermoascus、Candida、Fusarium、Saccharomyces Aspergillus、散囊菌属(Eurotium)、Saccharomyces、Issatchenkia、Candida、Naumovozyma、汉逊酵母属(Hansenula)Pichia、Candida、Aspergillus、Saccharomycopsis、Kazachstania Saccharomyces、耐碱酵母、Galactomyces、Pichia细菌Lactobacillus、Bacillus、Pediococcus、Weissella、Streptomyces、Lactobacillus、Acetobacter Lactobacillus、Bacillus、Weissella、Lactobacillus、Weissella、Kroppenstedtia、Pseudomonas、明串珠菌属(Leuconostoc)、Bacillus、Pediococcus
如表3所示,凤香型酒醅中优势真菌的组成及比例与其他香型均不同;细菌均多以Lactobacillus为主,但低丰度细菌在种类上也有差异。不同香型白酒采用不同的曲种和酿造工艺,均会导致发酵过程中微生物组成及演替的差异,最终蒸馏得到的酒中微量组分不同,影响酒的品质与风格。凤香型白酒微生物群落结构有别于以上4 种香型,具有独特性,是其白酒风格形成的重要因素之一。
如图6所示,发酵前期温度缓慢上升,发酵12 d达到30 ℃,维持30 ℃以上8 d,后期温度略微下降。发酵前期酒醅中淀粉浓度高,微生物繁殖快,短时间内生成大量发酵热量,导致酒醅温度升高;随后糖化作用生成的还原糖量与窖池内酵母菌维持生长代谢所需还原糖量达到动态平衡,发酵作用基本停止,酒醅温度在32 ℃保持5 d左右;后期的酯化阶段细菌等微生物代谢产生较多的酶和酸,对前期生成的醇和酸起到催化酯化反应的作用,酒醅温度缓慢下降。
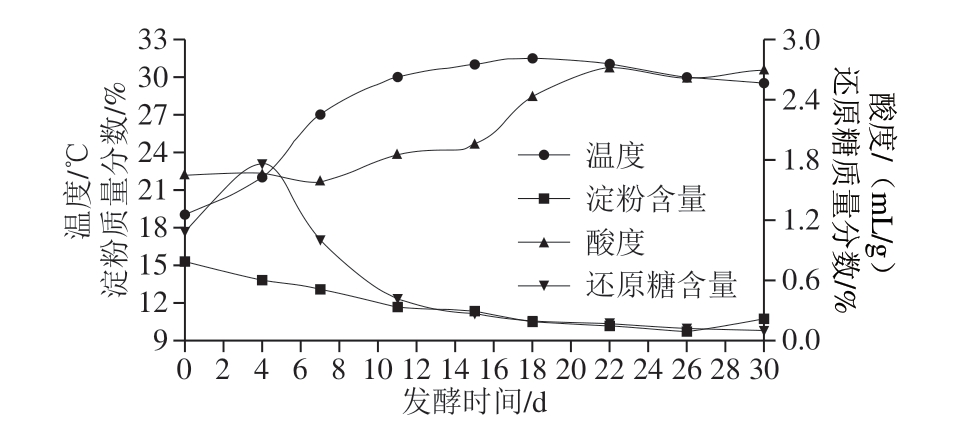
图6 发酵过程中酒醅理化指标的变化情况
Fig. 6 Changes in physiochemical indexes in fermented grains during fermentation
凤型酒醅的酸度前期缓慢上升,中后期上升迅速,说明霉菌、酵母菌及好氧细菌不是产酸的主体,厌氧及兼性厌氧细菌的大量增殖生成了多种有机酸,导致酒醅酸度迅速增加,适量的酸能增加白酒的后味,使酒体更加丰满。因此,酿造过程的酸度必须控制在合适的范围内。
酒醅中淀粉和还原糖含量的变化反映了发酵进度和完全度,对工艺操作具有一定的指导作用。发酵后淀粉含量约下降30%,前期下降显著,中后期由于霉菌逐渐消亡,淀粉分解利用的速率明显降低;发酵前后还原糖降低约90%,呈先升高后波动平衡的趋势。发酵初期霉菌快速生长繁殖,淀粉质原料快速分解,而此时酵母菌消耗还原糖比较少,所以还原糖不断积累。发酵中期酵母菌数量增多,发酵作用加快,还原糖被代谢旺盛的酵母菌快速消耗,含量迅速下降,直至发酵期结束。
表4 酒醅样品中理化指标与微生物多样性的相关性
Table 4Correlation coefficents between physicochemical indicators and microbial diversity in fermented grain samples
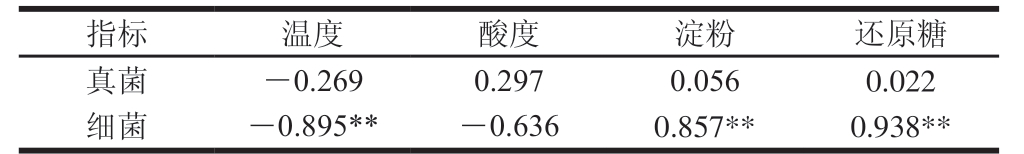
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
利用SPSS软件对酒醅样品的理化指标(温度、酸度、还原糖和淀粉)和酒醅微生物多样性进行Pearson相关性分析,结果见表4。发酵温度与细菌多样性呈极显著负相关,相关系数为-0.895(P<0.01),淀粉含量与细菌多样性呈极显著正相关,相关系数为0.857(P<0.01),还原糖与细菌多样性呈极显著正相关,相关系数为0.938(P<0.01),理化指标与真菌多样性之间相关性不显著。
本研究利用高通量测序法检测分析凤香型白酒不同发酵时期的酒醅样品的微生物组成,达到深度测序的效果,共检测出216 个属和一些未被归类的微生物,其中细菌检测出183 个属,真菌检测出33 个属。发酵过程中真菌以Naumovozyma、Rhizopus、Thermoascus、Saccharomyces、Candida、Pichia、Pseudeurotium等为主;细菌以Lactobacillus、Bacillus、Pediococcus、Weissella、Streptomyces等为主,其中Naumovozyma和乳酸菌属占绝对优势。凤香型白酒微生物群落结构具有独特性,是其白酒风格形成的主要因素。发酵温度与细菌多样性呈极显著负相关,淀粉含量和还原糖与细菌多样性呈极显著正相关,理化指标与真菌多样性之间相关性不显著。
[1] 赵爽, 杨春霞, 窦岫. 白酒生产中酿酒微生物研究进展[J]. 中国酿造,2012, 31(4): 5-10. DOI:10.3969/j.issn.0254-5071.2012.04.002.
[2] 王宗敏. 镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D]. 无锡: 江南大学, 2016.
[3] NIE Z, ZHENG Y, WANG M, et al. Exploring microbial succession and diversity during solid-state fermentation of Tianjin duliu mature vinegar[J]. Bioresource Technology, 2013, 148(8): 325-333.DOI:10.1016/j.biortech.2013.08.152.
[4] 李春生, 王悦齐, 李来好, 等. 传统鱼露发酵过程中细菌群落演替及对其挥发性风味形成的影响分析[J]. 食品科学, 2018, 39(24): 85-92.DOI:10.7506/spkx1002-6630-201824014.
[5] BOKULICH N A, AMIRANASHVILI L, CHITCHYAN K, et al.Microbial biogeography of the transnational fermented milk matsoni[J]. Food Microbiology, 2015, 50(1): 12-19. DOI:10.1016/j.fm.2015.01.018.
[6] 米瑞芳, 陈曦, 熊苏玥, 等. 传统自然发酵酸肉中细菌群落多样性与风味品质分析[J]. 食品科学, 2019, 40(2): 85-92. DOI:10.7506/spkx1002-6630-20180521-282.
[7] 宁亚丽, 吴跃, 何嫱, 等. 基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J]. 食品科学, 2019, 40(16): 107-114.DOI:10.7506/spkx1002-6630-20180917-173.
[8] 程伟, 吴丽华, 徐亚磊, 等. 浓香型白酒酿造微生物研究进展[J]. 中国酿造, 2014, 33(3): 1-4. DOI:10.3969/j.issn.0254-5071.2014.03.001.
[9] 张双燕, 廖永红, 纪南, 等. 基于高通量测序技术分析北京清香型大曲微生物多样性[J]. 中国酿造, 2016, 35(11): 49-53. DOI:10.11882/j.issn.0254-5071.2016.11.010.
[10] 雷振河. 采用高通量测序技术分析清香型白酒酿造微生物[J]. 食品与发酵工业, 2015, 41(9): 164-167. DOI:10.13995/j.cnki.11-1802/ts.201509032.
[11] ZHENG Q, LIN B, WANG Y, et al. Proteomic and high-throughput analysis of protein expression and microbial diversity of microbes from 30- and 300-year pit muds of Chinese Luzhou-flavor liquor[J].Food Research International, 2015, 75: 305-314. DOI:10.1016/j.foodres.2015.06.029.
[12] 黄治国, 刘燕梅, 卫春会, 等. 浓香型酒醅微生物群落与理化指标的相关分析[J]. 现代食品科技, 2014, 30(11): 38-42. DOI:10.13982/j.mfst.1673-9078.2014.11.008.
[13] 刘凡, 周新虎, 陈翔, 等. 洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J]. 微生物学报, 2018, 58(12):2087-2099. DOI:10.13343/j.cnki.wsxb.20170616.
[14] 黄蕴利, 黄永光, 胡建峰, 等. 酱香型白酒第二轮次酒发酵过程微生物多样性研究[J]. 中国酿造, 2017, 36(9): 30-35. DOI:10.11882/j.issn.0254-5071.2017.09.007.
[15] 王雪山. 不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D]. 无锡: 江南大学, 2018.
[16] ADAK S, BANERJEE R. A green approach for starch modification:esterification by lipase and novel imidazolium surfactant[J].Carbohydrate Polymers, 2016, 150: 359-368. DOI:10.1016/j.carbpol.2016.05.038.
[17] 张方, 张宿义, 苏占元, 等. 有机酸对浓香型白酒品质及其酿造过程影响的研究进展[J]. 酿酒科技, 2016(1): 94-97; 102. DOI:10.13746/j.njkj.2015381.
[18] VIANA F, GIL J V, GENOVÉS S, et al. Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation andenological traits[J]. Food Microbiology, 2008, 25(6): 778-785.DOI:10.1016/j.fm.2008.04.015.
[19] DE ANGELIS M, CALASSO M, CAVALLO N, et al. Functional proteomics within the genus Lactobacillus[J]. Proteomics, 2016, 16(6):946-962. DOI:10.1002/pmic.201500117.
[20] 李欣, 王彦华, 林静怡, 等. 高通量测序技术分析酱香型白酒酒醅的微生物多样性[J]. 福建师范大学学报(自然科学版), 2017, 33(1):51-59. DOI:10.12046/j.issn.1000-5277.2017.01.009.
[21] 孙利林, 李立郎, 胡萍, 等. 酱香型白酒第四轮次酒酿造过程中真菌多样性分析[J]. 中国酿造, 2019, 38(11): 24-30. DOI:10.11882/j.issn.0254-5071.2019.11.006.
[22] 胡小霞, 黄永光, 涂华彬, 等. 酱香型白酒1轮次酿造细菌的菌群结构[J]. 食品科学, 2020, 41(14): 175-182. DOI:10.7506/spkx1002-6630-20190618-195.
[23] 王海燕, 张晓君, 徐岩, 等. 浓香型和芝麻型白酒酒醅中微生物菌群的研究[J]. 酿酒科技, 2008(2): 86-91.
[24] 高江婧, 任聪, 刘国英, 等. 浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J]. 食品与发酵工业, 2019, 45(20): 1-6.DOI:10.13995/j.cnki.11-1802/ts.021271.
[25] 翟磊, 于学健, 冯慧军, 等. 宜宾产区浓香型白酒酿造生境中细菌群落结构的研究[J]. 食品与发酵工业, 2020, 46(2): 18-24.DOI:10.13995/j.cnki.11-1802/ts.022600.
[26] 王雪山, 杜海, 徐岩. 清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业, 2018, 44(9): 1-8. DOI:10.13995/j.cnki.11-1802/ts.017334.
[27] 雷振河. 采用高通量测序技术分析清香型白酒酿造微生物[J]. 食品与发酵工业, 2015, 41(9): 164-167. DOI:10.13995/j.cnki.11-1802/ts.201509032.
[28] 陈申习, 唐洁, 张龙, 等. 清香型小曲白酒机械化生产中微生物动态变化研究[J]. 中国酿造, 2018, 37(6): 68-72. DOI:10.11882/j.issn.0254-5071.2018.06.014.
[29] 王薇, 吴群, 徐岩. 清香型白酒固态酿造过程中酵母种群结构和多样性分析[J]. 微生物学通报, 2012, 39(9): 1272-1279. DOI:10.13344/j.microbiol.china.2012.09.005.
[30] 李凯敏, 付桂明, 吴酬飞, 等. 特香型白酒酿造过程中真核微生物菌群演替[J]. 食品科学, 2017, 38(22): 1131-1136. DOI:10.7506/spkx1002-6630-201722020.