木瓜蛋白酶(EC 3.4.22.2)存在于番木瓜乳胶中,是由212 个氨基酸残基组成的含巯基的肽链内切酶。木瓜蛋白酶的肽链之间形成3 个二硫键,肽链折叠成两个结构域,一个结构域主要由α-螺旋结构在空间内卷曲折叠而成,另一个则由β-折叠和部分α-螺旋构成。木瓜蛋白酶的活性中心位于两个结构域间的第25位半胱氨酸残基和第158位组氨酸残基所在的凹槽内[1],分子质量为21 kDa,具有凝结牛奶、水解脂肪、溶解细菌,以及其他作用[2]。因此,木瓜蛋白酶可用于许多领域,例如食品、医药、皮革、饲料、化妆品、纺织和制药工业[3-5]。离子液体作为非常规溶剂已广泛用于各种液相萃取模式中,因其固有的离子特性和显著的性质(例如可忽略不计的蒸气压、无效可燃性、高离子传导性、以及高热和电化学稳定性),所以成为“绿色溶剂”的重要一类[6-7]。
双水相体系指一些具有亲水性质的高分子聚合物与聚合物,或聚合物与无机盐溶解在水中,当浓度超过一定界限时,能自然地分成互不相溶的两相或多相体系,其原理主要是聚合物的不相容性,双水相体系主要是在水环境中产生的[8]。离子液体双水相基于离子液体的各种优点,将离子液体应用到体系的某一水相中,运用离子液体与无机盐竞争水分子使目标物质有选择性地富集在离子液体相或盐相[9]。离子液体双水相溶液酸度范围较宽、不易乳化、界面更清晰、黏度小、不需要挥发性有机溶剂、生物相容性好、离子液体经简单处理可重复再利用[10],因此该技术在木瓜蛋白酶的制备中占有一席之地。
本课题组长期致力于离子液体双水相体系萃取木瓜蛋白酶的研究。曾颖等[11]运用1-辛基-3-甲基咪唑醋酸盐([C8mim]Ac)与磷酸氢二钾(K2HPO4)双水相体系萃取木瓜蛋白酶,得到酶分配系数高达11.52,酶活力回收率为86.81%。蔡涛等[12]运用1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)与磷酸氢钠(NaH2PO4)双水相萃取木瓜蛋白酶,得到酶分配系数为4.77,酶活力回收率达97.45%。Zhu Xinyun等[13]运用1-丁基氯化吡啶([C4Py]Cl)与磷酸氢二钾(K2HPO4)双水相萃取木瓜蛋白酶,酶活力回收率达96.03%,分配系数为4.57。离子液体双水相体系萃取木瓜蛋白酶取得了较好的成果,但相关的理论研究较少,本研究利用荧光光谱与分子对接分析[C4mim]BF4、[C4Py]Cl与木瓜蛋白酶之间的相互作用,以期为离子液体双水相萃取木瓜蛋白酶提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
木瓜蛋白酶、牛血清白蛋白(均为生物纯) 生工生物工程(上海)股份有限公司;K2HPO4(分析纯)西陇科学(广东)股份有限公司;[C4Py]Cl、[C4mim]BF4(均为分析纯) 美国ALFA试剂公司;实验用水为超纯水。
1.2 仪器与设备
TU1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;F-7000分子荧光光谱仪 日本日立公司;DK-98-1型恒温水浴锅 天津泰斯特仪器有限公司;FA2104电子天平 上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 荧光光谱法分析相互作用
根据Li Xiangrong[14]和Xiao Huizhi[15]等探究分子间相互作用的方法,于一系列10 mL比色管中添加1 mL 6×10-5 mol/L的木瓜蛋白酶储备液,分别加入0.08、0.4、0.8、1.6、2、4 mL 5×10-4 mol/L [C4Py]Cl和[C4mim]BF4储备液,用水定容至10 mL,分别在25、30、35 ℃下恒温水浴10 min后放入1.0 cm石英池中。
发射荧光光谱条件:激发波长280 nm、扫描波长范围280~450 nm、激发和发射狭缝宽度2.5 nm。
1.3.2 荧光猝灭计算
采用Stern-Volmer方程(公式(1))计算猝灭常数(Kq),判断荧光猝灭类型;使用双对数方程(公式(2))计算相互作用过程的结合常数(Ka)和结合位点数(n);使用Van’t Hoff方程(公式(3))计算反应的焓变(ΔH)和熵变(ΔS);使用吉布斯自由能方程(公式(4))计算各温度下反应的吉布斯自由能(ΔG)[16]。
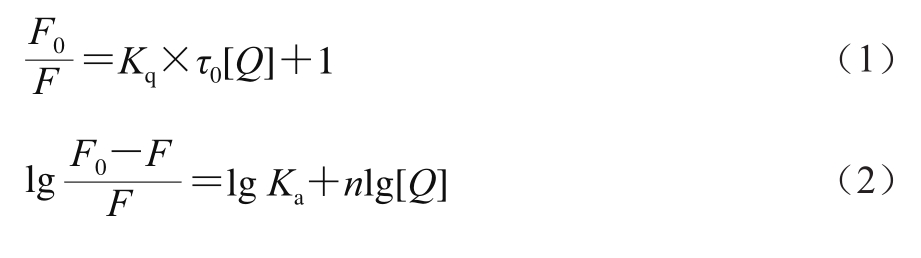
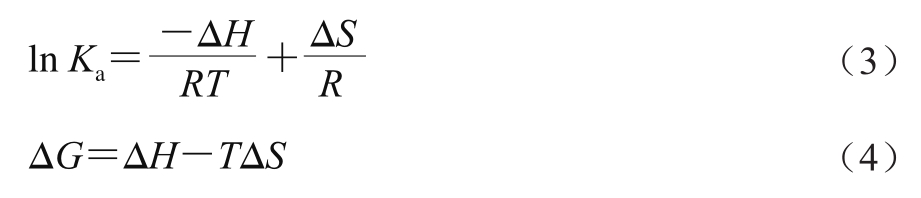
式中:F0为无猝灭剂时反应体系的荧光强度/au;F为有猝灭剂时反应体系的荧光强度/au;τ0为无猝灭剂时荧光分子寿命/s:Kq为猝灭常数/(mol·s);[Q]为猝灭剂浓度/(mol/L)。n为结合位点数;Ka为反应的结合常数/(L/mol);ΔH为反应的焓变/(kJ/mol);ΔS为反应的熵变/(J/(mol·K));R为气体摩尔常数(8.314 J/(mol·K));ΔG为反应的吉布斯自由能/(kJ/mol);T为热力学温度/K。
1.3.3 分子对接探究对接结构
运用AutoDock软件研究离子液体与木瓜蛋白酶的结合模式。离子液体的mol文件预先下载自Chemical Book数据库(www.chemicalbook.com,CAS号为1124-64-7,174501-65-6)用Discovery Studio 软件转变为PDB格式,并只保留阳离子部分。木瓜蛋白酶的晶体结构下载自RCSB PDB数据库(http://www.rcsb.org/,PDB编号1PPD),删除水分子和非必需子结构,通过末端处理、加氢、加电荷等步骤完成受体结构的准备,采用半柔性对接法,其余参数默认。对接后,选取打分函数最高的结果作为研究对象[17]。
1.3.4 相同条件下不同离子液体双水相体系分配系数的测定
构建[C4mim]BF4-K2HPO4、[C4Py]Cl-K2HPO4双水相体系:固定K2HPO4添加量为0.35 g/mL、酶添加量为2.17 mg/mL、温度30 ℃,离子液体质量浓度分别为0.20、0.24、0.28、0.32、0.36 g/mL,用水定容至10 mL。振荡混匀后以5 000 r/min离心10 min,读取上下相的体积,测定上下相的蛋白酶质量浓度,分配系数(K)的计算公式如(5)所示。
式中:ρT和ρB分别为双水相体系中上、下相的蛋白酶的质量浓度/(mg/mL)。
1.3.5 木瓜蛋白酶蛋白质量浓度的测定
用Bradford法来测定蛋白质的质量浓度[18]。以牛血清白蛋白为标准品配制系列质量浓度的标准溶液1.0 mL,取考马斯亮蓝G-250染色液5.0 mL,反应10 min左右,在595 nm波长处测定吸光度。以蛋白质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。标准曲线的回归方程为y=0.013 6+0.004 5x,R2=0.998 1。
1.4 数据处理与分析
对每个添加不同体积离子液体溶液的样本测定3 次,使用SPSS软件的Duncan’s法对结果的方差显著性进行分析[19],采用不同小写英文字母表示不同数据之间差异的显著性(P<0.05)。
2 结果与分析
2.1 荧光光谱分析结果
荧光光谱法是在接近实际萃取环境下研究活性小分子与酶间相互作用应用最广泛的方法,其基于小分子引起的酶蛋白内源荧光光谱变化来获得二者的结合常数、结合位点数及热力学参数等信息[20-21]。由图1可知,随着离子液体溶液添加量的增加,木瓜蛋白酶的荧光强度呈规律性降低,表明二者发生了相互作用。采用Stern-Volmer方程(公式(1))分析不同温度下的荧光光谱最大吸收波长(表1),获得相应的猝灭常数(表2)。不同温度下的猝灭常数(Kq)均大于生物大分子动态荧光猝灭的最大常数2×1010 L/(mol·s),表明离子液体通过与木瓜蛋白酶结合成复合物,引发了酶蛋白的静态荧光猝灭[22]。
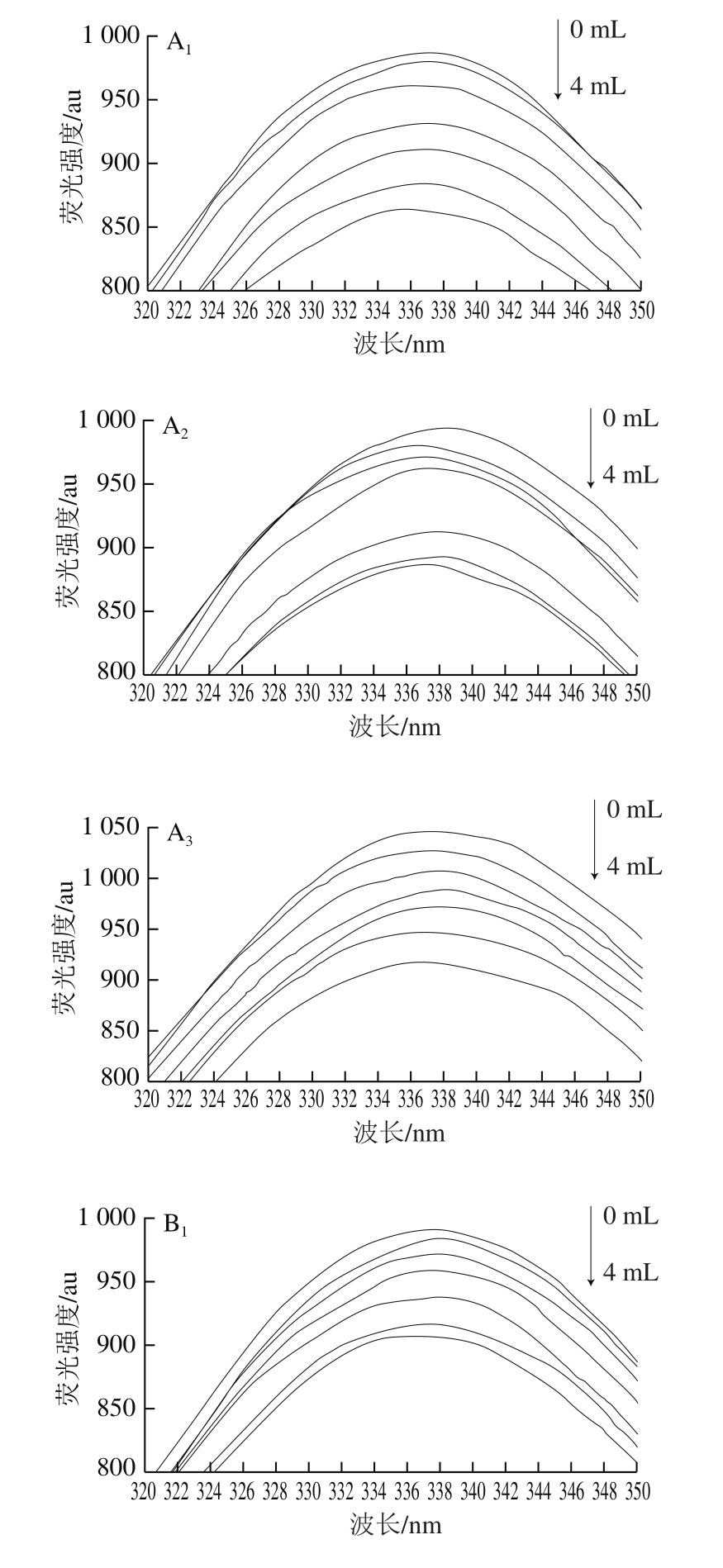
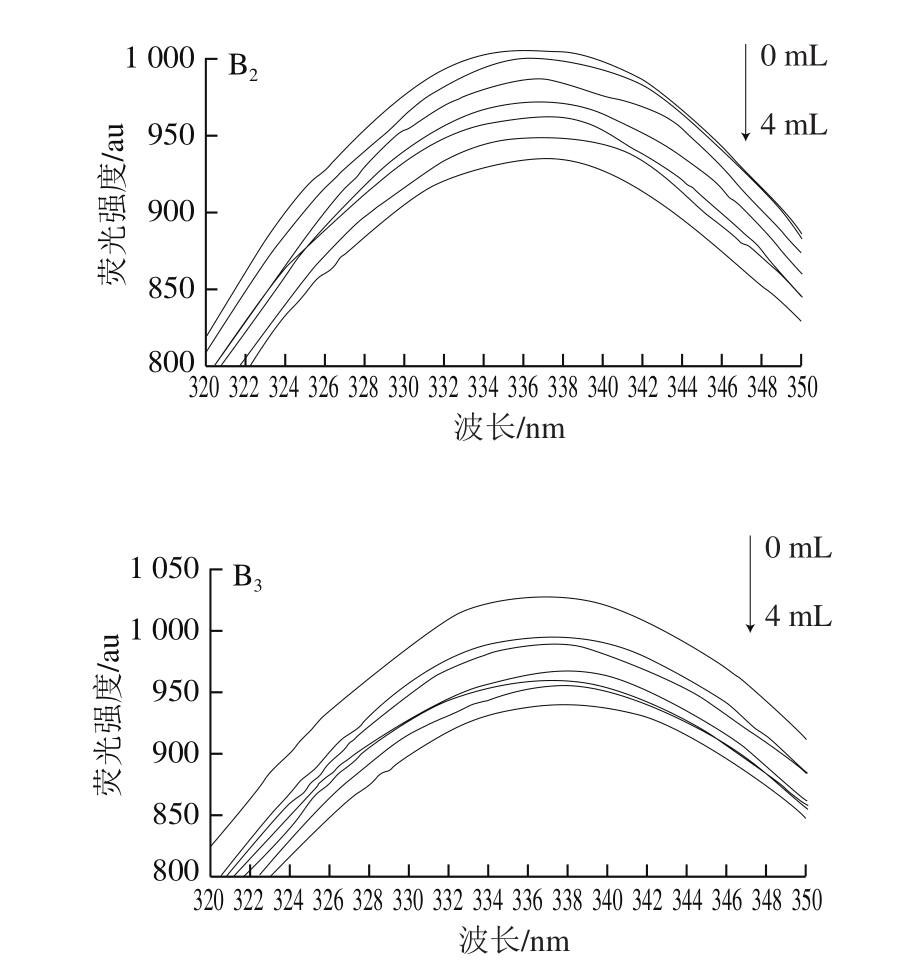
图1 离子液体在不同温度下对木瓜蛋白酶荧光光谱的影响
Fig.1 Effect of ionic liquids on the fluorescence spectra of papain at different temperatures
A.[C4mim]BF4;B.[C4Py]Cl。下标1~3.温度分别为25、30、35 ℃。
表1 离子液体在不同温度下木瓜蛋白酶荧光光谱最大吸收波长处荧光强度
Table 1 Fluorescence intensity at maximum absorption wavelength of papain fluorescence spectrum of ionic liquid at different temperatures
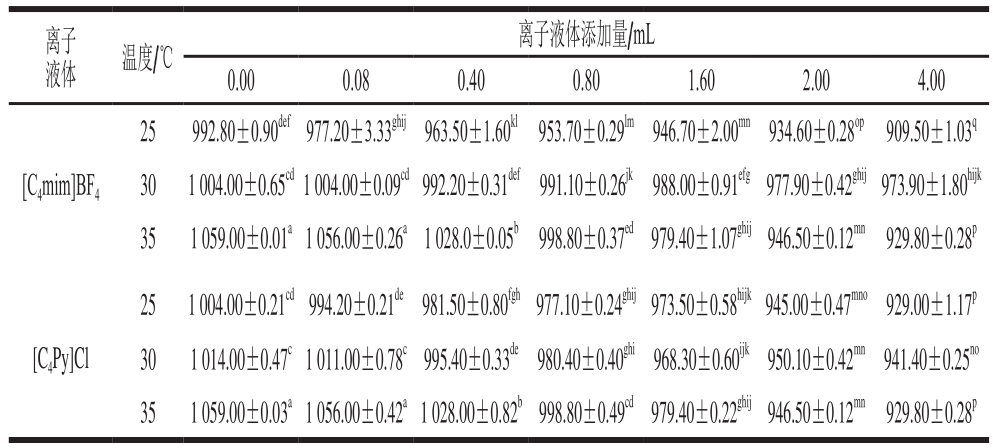
注:肩标小写字母不同表示差异显著(P<0.05)。
离子液体 温度/℃离子液体添加量/mL 0.00 0.08 0.40 0.80 1.60 2.00 4.00[C4mim]BF4 25 992.80±0.90def977.20±3.33ghij963.50±1.60kl953.70±0.29lm 946.70±2.00mn934.60±0.28op 909.50±1.03q 30 1 004.00±0.65cd1 004.00±0.09cd992.20±0.31def991.10±0.26jk988.00±0.91efg977.90±0.42ghij973.90±1.80hijk 35 1 059.00±0.01a1 056.00±0.26a1 028.0±0.05b998.80±0.37ed979.40±1.07ghij946.50±0.12mn929.80±0.28p[C4Py]Cl 25 1 004.00±0.21cd994.20±0.21de981.50±0.80fgh977.10±0.24ghij973.50±0.58hijk945.00±0.47mno929.00±1.17p 30 1 014.00±0.47c1 011.00±0.78c995.40±0.33de980.40±0.40ghi968.30±0.60ijk950.10±0.42mn941.40±0.25no 35 1 059.00±0.03a1 056.00±0.42a1 028.00±0.82b998.80±0.49cd979.40±0.22ghij946.50±0.12mn929.80±0.28p
表2 离子液体与木瓜蛋白酶间的荧光猝灭常数
Table 2 Fluorescence quenching constants between ionic liquids and papain
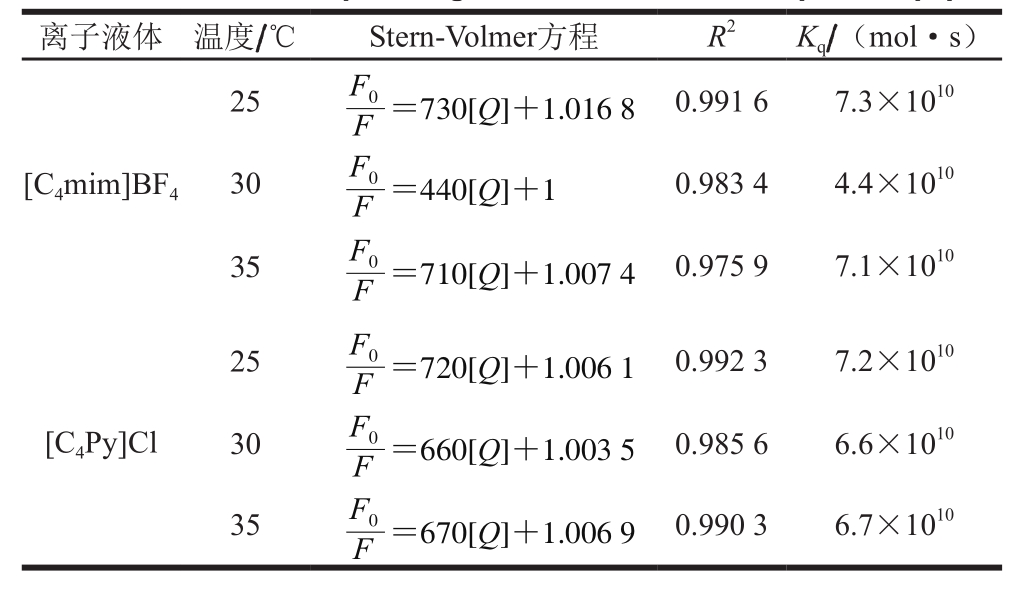
离子液体 温度/℃ Stern-Volmer方程 R2 Kq/(mol·s)[C4mim]BF4 25=730[Q]+1.016 8 F0 F 0.991 6 7.3×1010 30=440[Q]+1 F0 F 0.983 4 4.4×1010 35=710[Q]+1.007 4 F0 F 0.975 9 7.1×1010[C4Py]Cl 25=720[Q]+1.006 1 F0 F 0.992 3 7.2×1010 30=660[Q]+1.003 5 F0 F 0.985 6 6.6×1010 35=670[Q]+1.006 9 F0 F 0.990 3 6.7×1010
对于静态荧光猝灭过程,可以使用双对数方程(公式(2))计算离子液体与木瓜蛋白酶相互作用过程的结合常数(Ka)和结合位点数(n),相关结果见表3。
表3 离子液体与木瓜蛋白酶间的结合参数
Table 3 Binding parameters between ionic liquids and papain
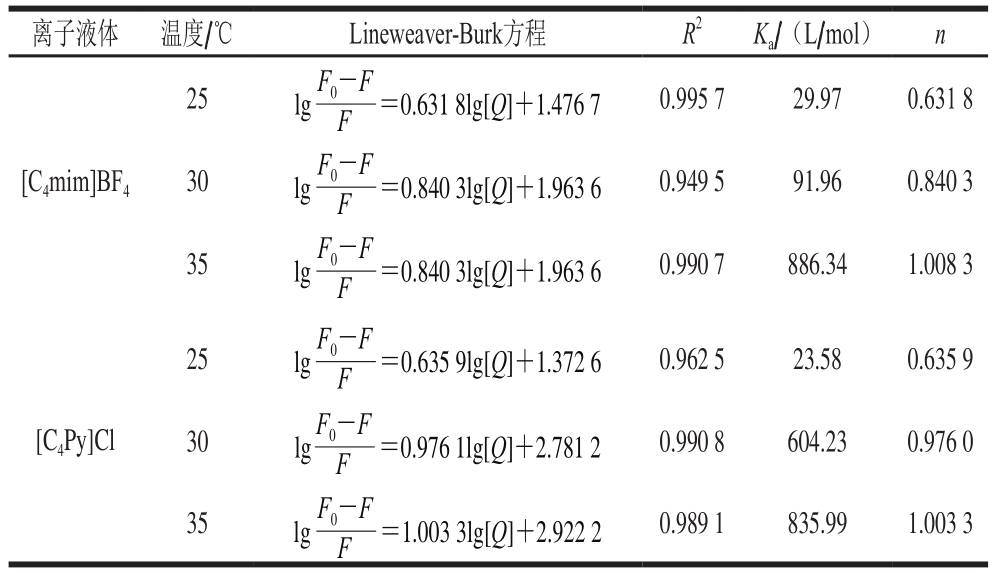
离子液体 温度/℃ Lineweaver-Burk方程 R2 Ka/(L/mol) n[C4mim]BF4 25=0.631 8lg[Q]+1.476 7 F0-F F lg 0.995 7 29.97 0.631 8 30=0.840 3lg[Q]+1.963 6 F0-F F lg 0.949 5 91.96 0.840 3 35=0.840 3lg[Q]+1.963 6 F0-F F lg 0.990 7 886.34 1.008 3[C4Py]Cl 25=0.635 9lg[Q]+1.372 6 F0-F F lg 0.962 5 23.58 0.635 9 30=0.976 1lg[Q]+2.781 2 F0-F F lg 0.990 8 604.23 0.976 0 35=1.003 3lg[Q]+2.922 2 F0-F F lg 0.989 1 835.99 1.003 3
由表3可知,随着温度的升高,离子液体与木瓜蛋白酶的结合常数明显上升,而其结合位点数则略有增加,都趋近于1附近,因为两种离子液体的猝灭常数并未远大于动态猝灭常数,所以推测猝灭过程含有部分动态猝灭的特性,适当升温不仅可以加速二者在溶液中的运动速率,提高结合效果,还可令木瓜蛋白酶结构更加伸展,暴露更多的结合位点[19]。为了理解离子液体与木瓜蛋白酶的结合过程,利用van’t Hoff方程(公式(3))和吉布斯自由能方程(公式(4))获得了二者互作的热力学参数(表4)。
表4 离子液体与木瓜蛋白酶间的热力学参数
Table 4 Thermodynamic parameters for interaction between ionic liquids and papain
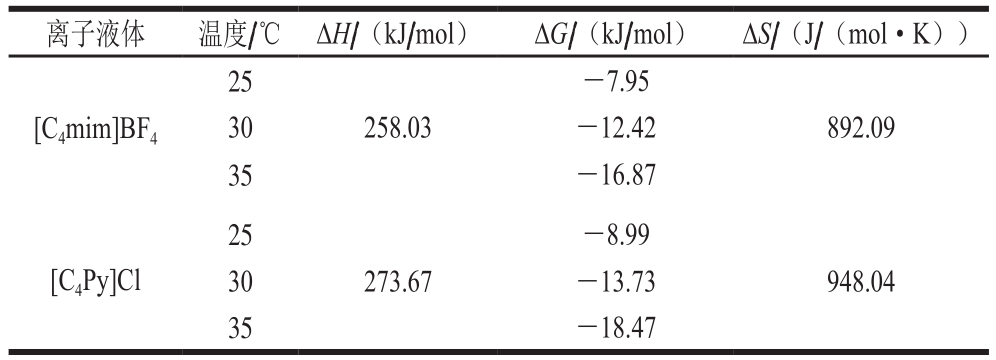
离子液体 温度/℃ ΔH/(kJ/mol) ΔG/(kJ/mol) ΔS/(J/(mol·K))[C4mim]BF4 25 -7.95 30 258.03 -12.42 892.09 35 -16.87[C4Py]Cl 25 -8.99 30 273.67 -13.73 948.04 35 -18.47
离子液体与木瓜蛋白酶相互作用的ΔG为负值,表明离子液体与木瓜蛋白酶的结合是一个自发的过程,而ΔH和ΔS为正值,根据Ross等总结的药物小分子与蛋白质大分子之间结合反应的热力学参数数值正负性与作用力类型的关系[23],二者的结合过程是一个以熵驱动为主的自发进行的过程,受疏水作用力驱动,这可能由于[C4mim]BF4和[C4Py]Cl在结构上具有一个疏水性的五元环和六元环[24],因而在与酶的疏水口袋结合过程中,疏水力发挥了主要作用。
2.2 木瓜蛋白酶与离子液体的分子对接分析结果
离子液体与酶的互作涉及复杂的结构改变,目前多种实验手段可用于此类研究,如光谱法(包括紫外光谱、荧光光谱、红外光谱、拉曼光谱、圆二色光谱等)、平衡透析、电泳及色谱等方法,还有新出现的等温滴定量热、核磁共振、表面等离子共振等方法[25]。但上述方法复杂的条件参数给研究带来了极大困难,近年来,分子模拟方法成为互作研究的重要工具。分子对接已被用于研究多种小分子与酶蛋白的结合机制[26]。由于离子液体本身极化程度非常高,能被很清晰地分成阳离子部分和阴离子部分,因此无法在AutoDock软件中将其设置为单一小分子进行对接[27]。考虑到离子液体与蛋白酶结合主要为阳离子在蛋白质表面聚集来影响蛋白酶的结构与活性的[28],所以在对接过程中使用离子液体的阳离子部分进行对接研究。
表5 离子液体与木瓜蛋白酶分子对接的对接参数
Table 5 Molecular docking parameters for interaction between ionic liquid and papain
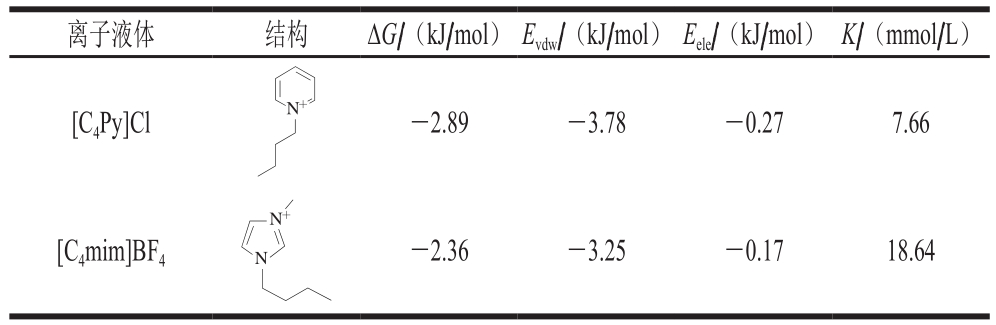
注:Evdw.分子的对接内能;Eele.分子内部结构转动所消耗的动能;K.抑制常数。
离子液体 结构 ΔG/(kJ/mol) Evdw/(kJ/mol) Eele/(kJ/mol) K/(mmol/L)[C4Py]Cl N+-2.89 -3.78 -0.27 7.66[C4mim]BF4 N+N -2.36 -3.25 -0.17 18.64
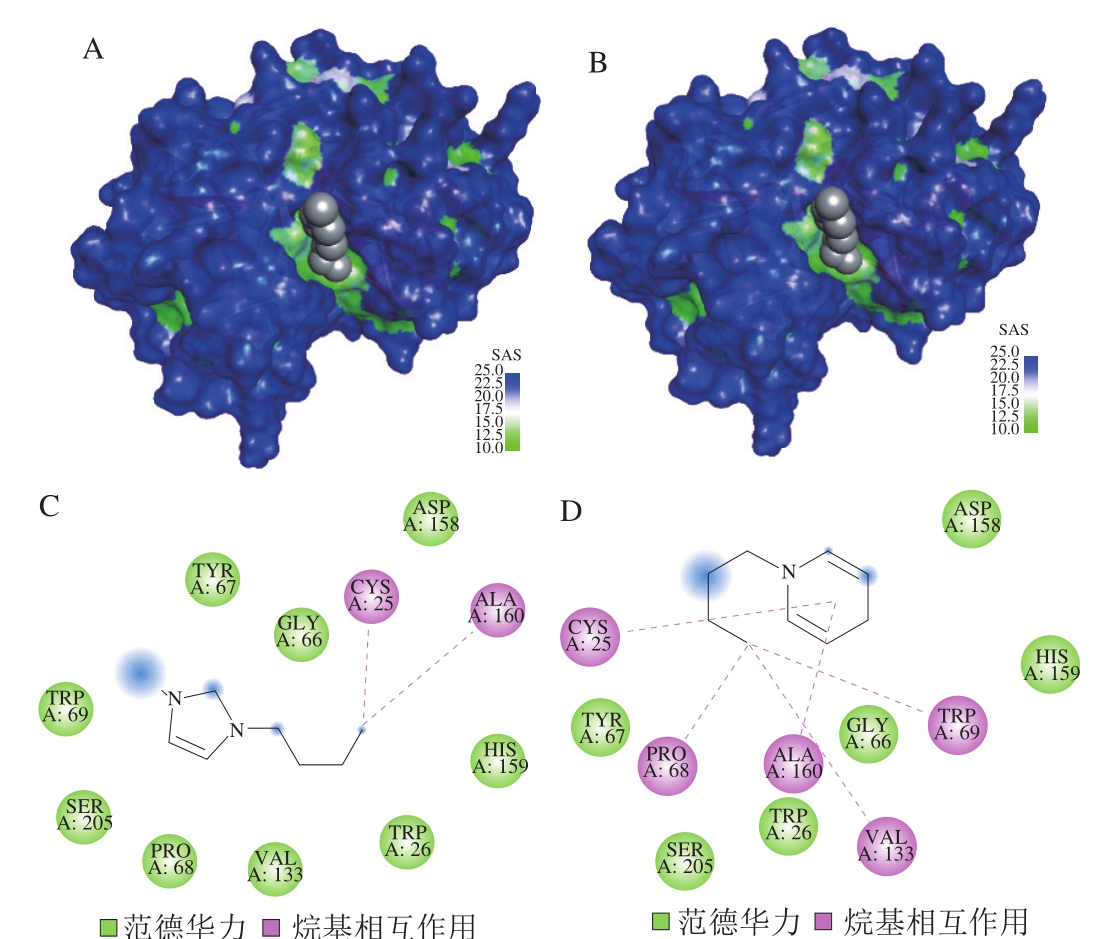
图2 离子液体与木瓜蛋白酶分子对接结果
Fig.2 Molecular docking results of ionic liquid and papain
离子液体与木瓜蛋白酶的分子对接,选取结合能最低的对接构像为最优构像,从软件AutoDock Tools中获取离子液体与酶作用的模拟对接参数(表5)。由表5可知,离子液体的阳离子与木瓜蛋白酶的结合ΔG均小于0,且[C4Py]Cl的ΔG小于[C4mim]BF4,由此说明离子液体小分子与木瓜蛋白酶的结合是自发进行的,[C4Py]Cl与木瓜蛋白酶的结合优于[C4mim]BF4。通过软件分析可知,离子液体与木瓜蛋白酶的结合结构如图2所示,只存在一个结合位点,其位于木瓜蛋白酶结构域中间活性部位的凹槽内,通过对木瓜蛋白酶表面作疏水性分析,离子液体完全处于木瓜蛋白酶的疏水性凹槽内,由此可以得出离子液体与木瓜蛋白酶之间存在较强的疏水相互作用,同时通过软件分析发现还存在范德华力和π-π相互作用。分子对接的结果与荧光光谱的结果相一致,同时也证明荧光光谱结果的正确性。
2.3 相同条件下不同离子液体双水相体系分配系数的测定分析结果
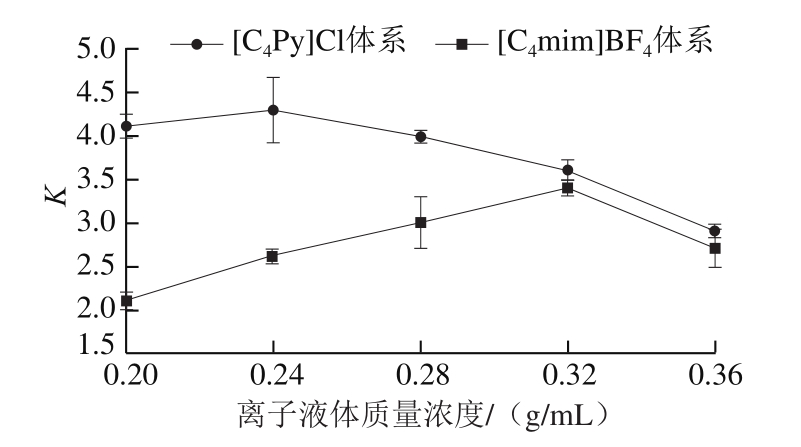
图3 不同离子液体双水相萃取木瓜蛋白酶的分配系数
Fig.3 Partition coefficients of papain in aqueous two-phase extraction systems with different ionic liquids
为了验证荧光光谱与分子对接结果在实际提取中的正确性,分别用两种离子液体构建双水相萃取体系,两个体系均在相同的条件下进行且构成体系的其他成分均相同,离子液体相均在双水相的上相,所以离子液体与木瓜蛋白酶的相互作用强度不同是木瓜蛋白酶分配系数不同的主要因素。如图3所示,所有的分配系数均为正值,表明木瓜蛋白酶主要富集于离子液体相,随着离子液体浓度的增加,两个体系的分配系数K均呈现先增大后减小的趋势,原因是适当加大离子液体质量浓度可以使相比例增大,因此K增大;继续增大离子液体质量浓度,使得体系黏度增加,阻止了两相分子间的转移,在两相之间形成乳化层,使下相的酶滞留在两相之间,酶的分配系数反而降低[29]。另一方面离子液体质量浓度过高使离子液体产生拥挤,对蛋白质的折叠和稳定性有很大影响,拥挤会使不稳定的蛋白构象更不稳定,并有助于形成致密结构使蛋白的活性降低甚至失活[28],所以离子液体质量浓度过高时分配系数K反而会降低。但是在相同离子液体质量浓度下,[C4mim]BF4-K2HPO4体系的分配系数K均小于[C4Py]Cl-K2HPO4体系,从结果可以直接得出[C4Py]Cl与木瓜蛋白酶的结合能力优于[C4mim]BF4,由此证明荧光光谱和分子对接的结果是可以预测离子液体实际的萃取效果。
3 结 论
本实验通过荧光光谱法得到两种离子液体的猝灭机制均为静态荧光猝灭且都有轻微动态荧光猝灭的特性,与木瓜蛋白酶结合生成复合物,结合位点数为1,通过ΔG的计算得出[C4Py]Cl的ΔG低于[C4mim]BF4,说明[C4Py]Cl与木瓜蛋白酶的结合能力优于[C4mim]BF4。分子对接分析结果表明,离子液体位于木瓜蛋白酶中间活性区域的疏水口袋中,只有1 个结合位点,并与周围众多的氨基酸残基存在疏水作用、范德华力和π-π相互作用等非共价键力,从模拟的角度验证了荧光光谱结果的正确性。离子液体双水相体系分配系数测定结果表明,离子液体与木瓜蛋白酶结合力的强弱会影响离子液体双水相实际萃取木瓜蛋白酶的效果,且与荧光猝灭所得的结果相同。本研究补充了[C4Py]Cl和[C4mim]BF4离子液体双水相体系萃取木瓜蛋白酶的理论依据,为构建新离子液体萃取体系提供了参考。
[1]李明亮.木瓜蛋白酶的双水相分离纯化、原位固定化及其应用研究[D].上海: 华东理工大学, 2011: 6-13.
[2]DE LOURDES MEZA-JIMÉNEZ M, POKHREL P R, DE LA TORRE R R R, et al.Effect of pulsed electric fields on the activity of food-grade papain in a continuous system[J].LWT-Food Science and Technology, 2019, 109: 336-341.DOI:10.1016/j.lwt.2019.04.037.
[3]FERNÁNDEZ-LUCAS J, CASTAÑEDA D, HORMIGO D.New trends for a classical enzyme: Papain, a biotechnological success story in the food industry[J].Trends in Food Science & Technology, 2017,68: 91-101.DOI:10.1016/j.tifs.2017.08.017.
[4]CHEN Y Y, LU Y H, MA C H, et al.A novel elastic liposome for skin delivery of papain and its application on hypertrophic scar[J].Biomedicine & Pharmacotherapy, 2017, 87: 82-91.DOI:10.1016/j.biopha.2016.12.076.
[5]ROCHA M V, DI GIACOMO M, BELTRAMINO S, et al.A sustainable affinity partitioning process to recover papain from Carica papaya latex using alginate as macro-ligand[J].Separation and Purification Technology, 2016, 168: 168-176.DOI:10.1016/j.seppur.2016.05.025.
[6]MALEKGHASEMI S, MOKHTARANI B, HAMZEHZADEH S,et al.Liquid-liquid equilibria of aqueous biphasic systems of ionic liquids and dipotassium hydrogen phosphate at different temperatures: Experimental study and thermodynamic modeling[J].Journal of Molecular Liquids, 2016, 219: 95-103.DOI:10.1016/j.molliq.2016.03.026.
[7]OLKIEWICZ M, PLECHKOVA N V, FABREGAT A, et al.Efficient extraction of lipids from primary sewage sludge using ionic liquids for biodiesel production[J].Separation and Purification Technology, 2015,153(16): 118-125.DOI:10.1016/j.seppur.2015.08.038.
[8]CORDERÍ S, GÓMEZ E, DOMÍNGUEZ Á, et al.(Liquid +liquid) equilibrium of ternary and quaternary systems containing heptane, cyclohexane, toluene and the ionic liquid [EMim][N(CN)2].Experimental data and correlation[J].The Journal of Chemical Thermodynamics, 2016, 94: 16-23 DOI:10.1016/j.jct.2015.10.018.
[9]JIANG X M, LU Y M, TAN C P, et al.Combination of aqueous twophase extraction and cation-exchange chromatography: New strategies for separation and purification of alliin from garlic powder[J].Journal of Chromatography B, 2014, 957(15): 60-67.DOI:10.1016/j.jchromb.2014.02.037.
[10]范晓伟, 冉露, 郭箐, 等.离子液体结合超声辅助和双水相萃取提取分离柑橘果皮中黄酮类化合物[J].食品科学, 2020, 41(10): 265-271.DOI:10.7506/spkx1002-6630-20190403-048.
[11]曾颖, 朱新儒, 余垒, 等.响应面法优化离子液体双水相萃取木瓜蛋白酶[J].食品研究与开发, 2018, 39(20): 29-34.DOI:10.3969/j.issn.1005-6521.2018.20.006.
[12]蔡涛, 张海德, 董安华, 等.木瓜蛋白酶在[Cnmim]BF4-NaH2PO4双水相体系中的分配行为[J].化工学报, 2015, 66(6): 17-22.DOI:10.11949/j.issn.0438-1157.20141927.
[13]ZHU Xinyun, ZHANG Haide.Optimization of [CnPy]Cl (n = 2, 4, 6)ionic liquid aqueous two-phase system extraction of papain using response surface methodology with box-behnken design[J].Process Biochemistry, 2019, 77: 113-121.DOI:10.1016/j.procbio.2018.11.016.
[14]LI Xiangrong, YANG Zhenhua, BAI Yulin.Fluorescence spectroscopic analysis of the interaction of papain and bromelain with l-ascorbic acid, α-tocopherol, β-carotene and astaxanthin[J].International Journal of Biological Macromolecules, 2018, 107: 144-156.DOI:10.1016/j.ijbiomac.2017.08.150.
[15]XIAO Huizhi, LIU Benguo, MO Haizhen, et al.Comparative evaluation of tannic acid inhibiting α-glucosidase and trypsin[J].Food Research International, 2015, 76: 605-610.DOI:10.1016/j.foodres.2015.07.029.
[16]陈丽.四种头孢类药物与木瓜蛋白酶间相互作用的荧光光谱法研究[D].保定: 河北大学, 2018: 6-12.
[17]杨继, 杨柳, 汤建国, 等.两种烟碱对映体与胃蛋白酶作用机理的研究[J].工程科学与技术, 2020, 52(1): 175-183.DOI:10.15961/j.jsuese.201801047.
[18]曾颖, 余垒, 朱新儒, 等.盐析法联合离子液体双水相纯化木瓜蛋白酶[J].食品科学, 2018, 39(24): 261-267.DOI:10.7506/spkx1002-6630-201824039.
[19]韩芬霞, 范新景, 耿升, 等.异甘草素抑制α-葡萄糖苷酶的分子机制[J].食品科学, 2019, 40(15): 37-42.DOI:10.7506/spkx1002-6630-20180830-337.
[20]TOPRAK M.Fluorescence study on the interaction of human serum albumin with Butein in liposomes[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2016, 154(5): 108-113.DOI:10.1016/j.saa.2015.10.023.
[21]倪志华, 张玉明, 邓传怀, 等.荧光光谱法研究杆菌肽与溶菌酶的相互作用[J].食品科学, 2016, 37(9): 139-143.DOI:10.7506/spkx1002-6630-201609026.
[22]赵焕焦, 吕晓玲, 王梦姝, 等.β-乳球蛋白与黑米花色苷的相互作用[J].食品科学, 2017, 38(9): 85-90.DOI:10.7506/spkx1002-6630-201709014.
[23]ROSS P D, SUBRAMANIAN S.Thermodynamics of protein association reactions: forces contributing to stability[J].Biochemistry,1981, 20(11): 3096-3102.DOI:10.1021/bi00514a017.
[24]白银鸽.离子液体结构设计及萃取分离含羧酸及含酯体系[D].北京: 中国科学院大学(中国科学院过程工程研究所), 2018: 7-21.
[25]OJHA H, MISHRA K, HASSAN M I, et al.Spectroscopic and isothermal titration calorimetry studies of binding interaction of ferulic acid with bovine serum albumin[J].Thermochimica Acta, 2012,548(20): 56-64.DOI:10.1016/j.tca.2012.08.016.
[26]杨淑玲, 廖先萍, 范星, 等.光谱法及分子对接技术研究黄体酮与牛血清白蛋白的结合机制[J].发光学报, 2019, 40(11): 1439-1445.DOI:10.3788/fgxb20194011.1439.
[27]陈鹏飞, 杨畅, 刘璇, 等.离子液体萃取天然活性物质的分子对接研究[C]//中国药学大会暨中国药师周.石家庄: 中国药学会, 2014:12-21.
[28]SATISH L, MILLAN S, SAHOO H.Sustained activity and stability of lysozyme in aqueous ionic liquid solutions containing carboxymethylcellulose and polyethylene glycol[J].Journal of Molecular Liquids, 2019, 278(15): 329-334.DOI:10.1016/j.molliq.2019.01.052.
[29]SATTARI M, KAMARI A, MOHAMMADI A H, et al.On the prediction of critical temperatures of ionic liquids: Model development and evaluation[J].Fluid Phase Equilibria, 2016, 411(15): 24-32.DOI:10.1016/j.fluid.2015.11.025.