肥胖已经成为一种全球性的流行病,它不仅严重威胁着人们的健康,缩短人们的寿命,而且给各国政府和公共医疗支出带来了严重的社会经济压力。为了应对肥胖问题,现代医学一直在努力开发有效的治疗方案,但目前找到的应对方法有限,主要包括改变生活方式和饮食、加强体育锻炼、药物治疗以及外科手术治疗等。但有些方法的作用机制还不明确,所以常常导致一些副作用,给人们的健康造成了威胁。为了应对这个挑战,大量的科研经费和大批的科研人员投入到这场战役当中,其中比较前沿的研究热点就是以肠道菌群为组成的微生物-肠-脑轴(microbiome -gut-brain axis,MGBA)调控途径。本文就MGBA的组成以及对肥胖的调控进行阐述。
1 肥胖的严峻现状
从20世纪至今,肥胖已经成为全球健康关注的焦点,随着人们生活水平的提高,高热量和高脂肪食物的饮食结构、身体锻炼不足和久坐不动的生活方式,导致全球肥胖的发病率呈逐年上升趋势[1]。截至2010年,全球近三分之一的成年人超重[2]。2014年,超过39%的18 岁以上的成年人超重,13%的人肥胖。2016年,超过19亿18 岁以上的成年人超重,其中6.5亿 人患有肥胖症[3]。虽然儿童肥胖症的患病率低于成年人,但在许多国家,儿童肥胖症的增长率已经超过了成人肥胖症的增长率。根据世界卫生组织的统计,2016年,至少有4 100万5 岁以下的儿童超重或肥胖[4]。在过去40 年里,全球5~19 岁的肥胖儿童和青少年数量增加了10 倍以上,从1975年的1 100万增至2016年的3.4亿,几乎每五人中就有一人(18.4%)超重或肥胖[5]。中国正处于经济转型期,随着经济的迅速发展,人民生活质量的提高,饮食习惯由传统的植物型食物逐渐向高脂肪、高能量的膳食结构转变,导致肥胖人数也在逐年增高。据统计,1992—2015年,我国肥胖人数比例由3%上升到12%,超重人数比例从13%上升到30%。同时中国儿童和青少年的肥胖率也在快速增加[6],据统计,2017年我国儿童青少年肥胖率为7.1%,超重率为12.2%[7]。
肥胖是非传染性疾病,由其引起的心血管疾病、2型糖尿病、高血压、冠心病以及各种类型的癌症严重危害人体健康,它还会导致各种心理问题或各种身体残疾。据世界卫生组织统计,44%糖尿病患者、23%缺血性心脏病患者以及7%~41%癌症患者超重或肥胖[8-9]。在这些疾病中,2型糖尿病与肥胖的关系最为密切,到2025年,与肥胖相关的糖尿病患病率预计将翻一番,患病人数将达到3亿。这种密切的关系意味着大多数糖尿病患者超重或肥胖。肥胖和这些疾病一起将人们的死亡风险提高了近7 倍[10]。据世界卫生组织统计,肥胖已经成为第五大致死疾病,每年因肥胖和其相关并发症死亡的人数高达280万。此外,严重肥胖患者(身体质量指数(body mass index,BMI)≥35)已出现全球化趋势,且增长迅速,它所导致的死亡风险比低BMI肥胖患者(34.9≥BMI≥30)高很多[11]。
肥胖在国内外的发病率都如此之高,如果按此趋势继续发展,到2030年,世界上60%的人口将超重或肥胖[12-13]。肥胖已然成为当今全球最大健康问题,其严重程度超过营养不良。肥胖及其引起的各种慢性疾病不但对人们的健康造成了极大的威胁,而且也造成了沉重的经济负担和巨大的医疗投入。我国每年在超重、肥胖及其并发症上花费240亿 元,占每年全国卫生保健支出的2.46%[14]。因此预防和治疗肥胖已经成为21世纪世界各国面临的重大公共卫生挑战之一。
2 MGBA的组成以及对肥胖的调控
MGBA是由肠道菌群、短链脂肪酸(short-chain fatty acids,SCFAs)、肠道内分泌细胞(enteroendocrine cells,EECs)、神经系统(包括中枢神经系统(central nervous system,CNS)、肠道神经系统(enteric nervous system,ENS)、自主神经系统以及相关的交感神经和副交感神经分支)、肠激素以及神经体液通路组成的一个复杂的神经体液交互网络[15]。轴内肠道和大脑的沟通是通过肠道内的神经元将感受信号转换成神经信号、激素信号和免疫信号,然后这些信号在CNS和肠道之间来回传递[16]。而神经信号和激素信号的传递是肠道和大脑维持机体代谢平衡采取的主要方式,因为胃肠道(gastrointestinal tract,GIT)内拥有超过5亿 个神经元,能调节产生一系列的激素[17],这些介质可作为肠-脑轴的大脑和肠道传递信息的信号。由于GIT中的神经分布很广,遍布肠道的独特营养成分识别传感器将预吸收的营养物总量和热量等信息发送给中枢系统(图1)[18];这些信号随后被传送到大脑的不同区域,如脑干和下丘脑;这些信息中心的高阶处理会引发一系列反应,导致急性或慢性的能量消耗和积累的差异,从而维持机体的能量平衡[3-5,19]。因此MGBA对肥胖的调节作用受到越来越多的关注。
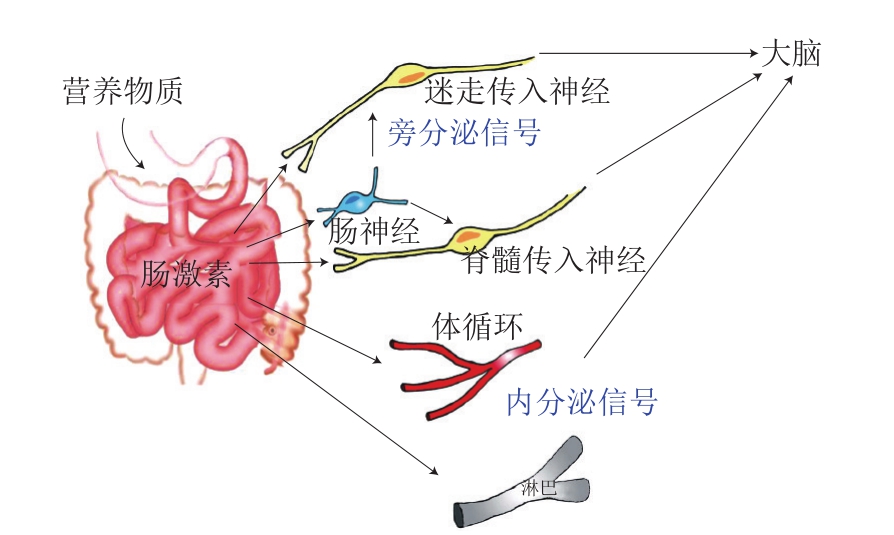
图1 肠道通过肠肽与大脑交流途径[18]
Fig.1 Gut-brain communication through gut peptides[18]
2.1 肠道菌群
人的身体里面大约有3.8×1013~3.9×1013 个细菌,大部分定植于肠道中,组成了人体中最复杂的生态系统,即肠道菌群[20-21]。这些细菌与宿主形成了一种复杂的共生关系,宿主为细菌提供营养丰富的生存环境,而细菌参与宿主的代谢、防护。细菌的这些功能都是宿主基因组不能编码的[22-23]。由1 000多种微生物组成的肠道菌群,在人的一生中随着饮食、抗生素、疾病、分娩方式以及现代生活方式等因素的变化而不停地变化[22]。因此,肠道菌群的组成不是静态的。
肠道菌群对宿主的新陈代谢有着巨大的影响,很多相关的研究不断证实了肠道菌群直接参与或者调节机体的各种代谢过程[24-26]。近些年的研究表明肠道菌群与肥胖的发生发展直接相关[27]。主要机理有以下几个方面:1)肠道菌群可分解难消化的碳水化合物,导致肠道吸收的单糖和SCFAs量增加,从而促进肝脂肪的生成[28-31]。2)肠道菌群的变化可以引起肥胖,研究表明肠道菌群改变可以增加肠的通透性[32-33],从而促进细菌脂多糖进入血液,导致内毒素血症,引起机体低水平的慢性炎症反应,最终发生肥胖等代谢综合征[34-35]。3)肠道菌群抑制肠道上皮细胞分泌血管生成素样蛋白4,而血管生成素样蛋白4是一种脂蛋白脂肪酶抑制剂,可导致三磷酸甘油酯在脂肪组织中的存储[36]。4)肠道菌群还可以调控宿主基因表达,影响脂肪的消耗和储存[37]。5)一些肠道菌群发酵碳水化合物的产物(例如SCFAs)有利于机体代谢[38-39]。6)肠道菌群的结构变化与减肥息息相关[40-41],菌群中某类细菌直接具有降脂减肥的保健功效[42-47]。7)肠道菌群通过肠-脑轴影响机体的能量代谢过程。脂多糖对卡哈尔间质细胞(一种可以产生慢波电位的间质细胞,可以导致肠道平滑肌收缩/蠕动,并参与ENS的调节)的增殖有抑制作用[18,48],可改变ENS内神经元释放神经递质的频率从而导致胃肠道运动紊乱,进而影响肠道激素的释放48]。Schéle等[49-50]比较了无菌和正常饲养小鼠的食物摄入调节激素、下丘脑和脑干进食回路的基因表达,发现在无菌小鼠的脑干和下丘脑中编码胰高血糖素样肽(glucagon-like peptide,GLP)-1和胃泌调节素的前体肽的mRNA表达减少,肠道菌群可以直接影响食欲减退相关激素的表达,从而通过肠-脑轴影响机体能量平衡。肠道菌群和肠-脑轴又组成了MGBA,近些年关于肠道菌群对肠-脑轴影响的研究越来越多。因此,鉴于肠道菌群与肥胖等代谢疾病的联系,可以通过改变肠道菌群的组成或者干预肠道菌群参与机体的代谢功能,也可以通过干预肠道菌群进而影响肠-脑轴调控机体代谢的功能,为治疗肥胖等代谢疾病提供了思路。
2.2 短链脂肪酸
人们每天摄入的食物中大约有60 g的碳水化合物难以消化,而肠道菌群的细菌可以分泌特殊的糖苷水解酶,可将这些难消化的碳水化合水解生成SCFAs[51],这些SCFAs提供了人体每天大约10%的能量[52],其中SCFAs中丁酸、丙酸和乙酸的相对含量接近95%[18]。丁酸是各类细胞的主要能量来源,丙酸进入门静脉循环后,被肝脏作为糖异生作用的主要原料,乙酸则通过循环系统到达各个外周组织而被利用[18,53]。口服或直接向肠道中灌注SCFAs可减少糖尿病和健康啮齿动物及人类的食物摄入和体质量[28,54-56]。还可以通过在食物中添加难消化碳水化合物,比如水溶性膳食纤维、低聚果糖、抗性糊精、果胶等,来控制SCFAs的产生,促进体质量减轻,改善代谢[57]。丁酸通常是厚壁菌门的细菌通过发酵产生,而乙酸和丙酸的合成通常与拟杆菌门有关[51]。所以肠道菌群的变化可以影响SCFAs的产生,可以通过调节肠道菌群的种类和活性来控制SCFAs的产生,从而达到降脂减肥的作用[58-59]。
很多研究表明SCFAs具有调节机体能量代谢的能力,这其中的机制主要有以下几个方面(图2)。SCFAs通过激活肠上皮的信号通路,促进人和啮齿动物的肠激素的释放[28,60],这是其通过MGBA发挥调节能量代谢的主要途径。G蛋白偶联受体(G-protein coupled receptor,GPR)43和GPR41是SCFAs受体,后被分别改名为游离脂肪酸受体(free fatty acid receptor,FFAR)2和FFAR3[61-62]。FFAR2和FFAR3虽然在许多其他组织中都有表达[63],但这两种受体均分布于EECs上,在分离的L细胞中有很高的表达[64-66],当SCFAs与FFAR2和FFAR3结合,L细胞可以合成和释放肠激素[28]。这些结论在体内和体外研究中得到了证实,SCFAs可以刺激小鼠原代肠上皮细胞释放GLP-1,但在ffar2-/-和ffar3-/-两种受体基因敲除的小鼠原代肠上皮细胞中,这种作用消失了[31]。此外,在ffar2-/-小鼠中,在肠道末端注射丙酸后,L细胞释放GLP-1和酪酪肽(peptide YY,PYY)的情况也消失了[67]。所以,SCFAs是通过与EECs上的受体结合,刺激EECs产生并释放肠激素,而肠激素可以诱导体质量减轻和减少食物摄入[68-70]。
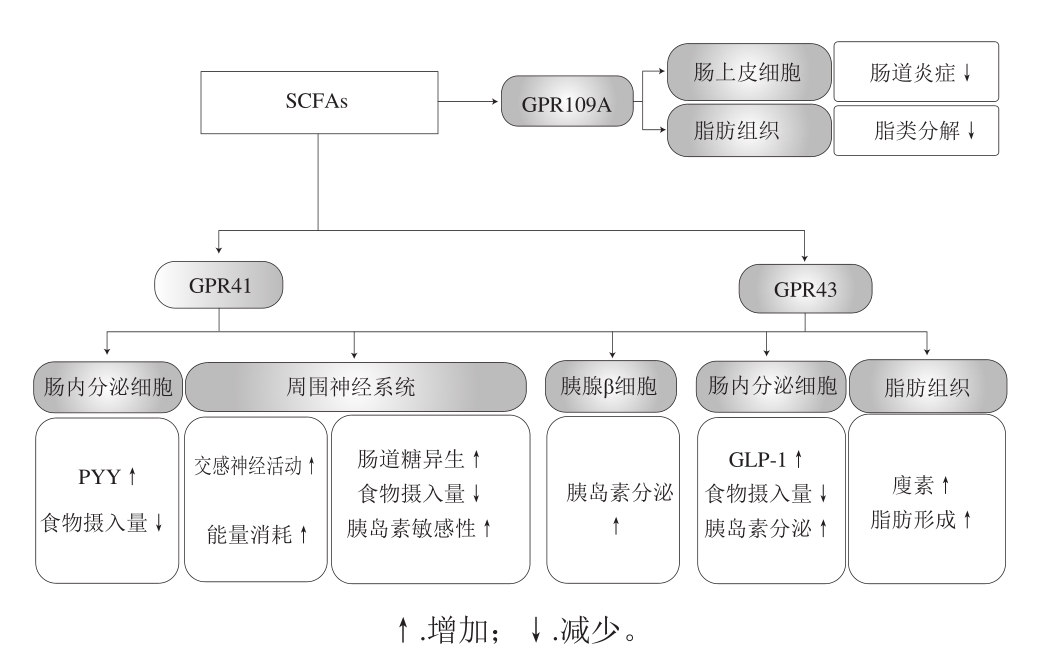
图2 SCFAs通过其受体与机体多个器官组织作用影响机体能量代谢[70]
Fig.2 SCFAs exert multiple effects on host metabolism and physiology via complementary receptors that differentially occur in host tissues[70]
如图2所示,肠道菌群产生的SCFAs与诸如神经、内分泌和免疫系统以组织特异性的方式发生盘根错节的联系。尽管这其中涉及到的确切机制尚未阐明,仍需更多的研究才能明确,但肠道菌群通过SCFAs受体参与到MGBA对机体的能量代谢途径已被证实,为我们提供了治疗肥胖及其相关疾病的新思路,即通过激活或抑制SCFAs信号通路调节MGBA。
2.3 肠道内分泌细胞
MGBA中肠道内的大部分信号都是通过释放肠激素来传递的。具体来说,位于肠上皮内、向肠腔内开放的EECs,通过其顶端表面化学感受器对吸收的营养物质和其他物质做出反应。这些物质与G蛋白偶联受体、电解质转运体以及细胞内间质发生反应,随后导致钙内流和肠激素释放到肠腔中[71-72]。各种类型的EECs通过它们在GIT中的位置和分泌的肠激素类型区分。小肠近端的I细胞和K细胞分别产生胆囊收缩素(cholecystokinin,CCK)和葡萄糖依赖性促胰岛素激素;小肠末端的L细胞分泌GLP-1、GLP-2、胃泌酸调节素(oxyntomodulin,OXM)和PYY。然而,最近的研究认为,肠激素实际上是由一类肠上皮细胞根据环境的不同分泌产生的种类不同的激素[71]。尽管如此,上述所有肠激素的合成和分泌都是由肠内营养物质的流入引起的,并通过在EECs顶膜上表达的营养物特异性的化学感受机制介导。除了营养物质的流入可以刺激EECs产生相应的肠激素之外,肠道菌群的变化以及引起的SCFAs的变化也可以刺激EECs产生肠激素,Song Junxian等[73]研究发现辣椒素通过长时间作用改变肠道菌群结构,进而通过调控SCFAs和FFAR2的产生来诱导GLP-1和PYY的分泌。
2.4 肠激素
EECs分泌的肠激素有很多种,其中参与MGBA调控的有CCK、GLP-1、PYY、OXM、血清素以及内源性大麻素,以下分别介绍它们的特点以及参与MGBA调控机体能量代谢的作用。
2.4.1 胆囊收缩素
CCK是最早被认识到具有食欲控制作用的肠道激素,主要是由十二指肠和空肠内的I细胞在脂肪和蛋白质的作用下释放出来的,餐后15 min内浓度显著增加[19]。CCK的半衰期很短,只有几分钟,因此在很短时间内通过作用于GIT和中枢神经系统组织(包括迷走神经、孤束核(nucleus tractus solitarius,NTS)和下丘脑等)中分布的CCK-1和CCK-2受体来诱导其作用[19,74]。作为饱足信号,CCK具有通过激活肠-脑轴发挥控制肠道运动、食物摄入、能量消耗和稳定血糖等重要生理功能[75]。CCK-1的受体在肠的迷走传入神经中表达,当将脂肪和蛋白质与CCK-1受体拮抗剂一同灌入十二指肠,迷走神经的兴奋和降低食物摄取的功能都被显著抑制[76],这表明CCK是脂肪和蛋白质诱导人体产生饱腹感的中介。外源性CCK-8的注射可激活脑干NTS中向下丘脑室旁核(paraventricular nucleus of hypothalamus,PVN)投射的特定神经元群,发挥显著降低食物摄入功能,如果这些神经元受损,则外源性CCK-8的抑制进食作用消失[77]。PVN中特定的神经元是厌氧性促甲状腺素激素释放神经元,直接参与进食行为[78]。除了作用于局部迷走神经元上受体外,CCK还被释放进入循环系统到达大脑发挥作用。餐后血浆中CCK的浓度显著升高[79],CCK可能通过血液循环直接到达大脑中枢,直接作用于NTS中的CCK-1受体,以及下丘脑的6 个不同区域来抑制进食。但是大多数研究表明,化学和手术切除迷走神经,会影响肠-脑轴的神经信号的传输,从而消除外源性CCK的进食抑制作用[80]。此外,与全身注射相比,将CCK注入近端小肠的外周动脉能更有效地降低食物摄入量。这些证据都表明摄食后的CCK主要是通过旁分泌的方式作用临近的迷走传入神经元上的CCK-1受体发挥作用。这也与脂类诱导的CCK的糖调节作用相一致,它与迷走传入神经上的CCK-1受体结合,通过肠-脑-肝轴的神经信号传导来降低肝脏葡萄糖的合成[81]。
2.4.2 胰高血糖素样肽-1
GLP-1主要是由小肠末端和结肠内的L细胞产生,碳水化合物、脂类和蛋白质都是GLP-1的强效促分泌物。越来越多的证据表明GLP-1是一个重要的饱足信号激素[82]。GLP-1在食物摄取后15 min内就被释放[34],是在营养物质到达小肠末端刺激L细胞之前,考虑到十二指肠的迷走神经参与对营养物质的感知,推测营养物质是通过神经激素反射刺激结肠L细胞释放GLP-1。此推测可通过以下研究证实:当营养物质被注入十二指肠而不能流入小肠末端时,GLP-1分泌量显著升高,而当小肠末端被移除时,这一升高的反应消失[83]。新的研究证实GLP-1在小肠近端EECs中表达[84],表明营养物质直接刺激EECs释放GLP-1和十二指肠迷走神经参与的神经激素反射刺激释放GLP-1这两种方式共同存在[85]。
GLP-1是在肠道营养物质的作用下分泌的,多项研究表明,内源性GLP-1也是通过旁分泌系统发挥抑制食物摄入的生理作用[86]。肠道分泌的GLP-1在运输中迅速降解,导致仅有25%的GLP-1进入肝门静脉循环,不到10%的GLP-1进入体循环[87]。因此,GLP-1可能是通过肠道的旁分泌系统发挥作用。迷走传入神经元上可以表达GLP-1受体[88],GLP-1可以直接诱导培养的迷走传入神经元放电也证实了这个结论[89]。在啮齿类动物中,膈下迷走神经切断术或辣椒素处理完全阻断了腹腔内注射的GLP-1所引起的抑制食物摄入作用[90]。血管内注射外源性GLP-1也可抑制食物摄入,而不能被迷走神经切开术或辣椒素处理所抑制[91],这暗示了GLP-1可以通过血液循环将信号直接传入脑内。另一种可能性是,GLP-1不是进入门静脉循环,而是释放到淋巴液中。在肠内输注葡萄糖或脂肪后,随着剂量增大,淋巴中促进GLP-1降解的肽酶-4浓度显著下降,所以淋巴中GLP-1的浓度升高,且高于血浆中的GLP-1浓度[92]。此外,胃内营养物质灌注使淋巴中GLP-1的浓度升高,且高于肝门静脉中的浓度[93]。
GLP-1受体在NTS、包括弓状核(arcuate nucleus,ARC)在内的下丘脑核以及脑室内都有表达。GLP-1具有抑制食物摄入的作用,在下丘脑中预先注入GLP-1受体拮抗剂艾塞那肽(exendin 9-39,Ex9)可以解除GLP-1对食物摄入的抑制作用。然而,脑室内注入Ex9并不影响腹腔注射GLP-1抑制食物摄入的效果,而腹腔同时注射GLP-1和Ex9后,抑制食物摄入的效果消失,这表明在生理条件下GLP-1从肠道释放激活迷走传入神经元中GLP-1受体可能更重要[94]。同时在GLP-1给药后,进行幽门成形术和躯干迷走神经切开术的患者未出现食物摄入量减少的现象,提示迷走传入神经信号传递对于GLP-1的作用是至关重要的[95]。许多研究分析了GLP-1的作用,其中使用长效GLP-1受体激动剂促进GLP-1分泌来模拟内源性GLP-1的分泌量增加的研究较多。利用GLP-1受体激动剂的研究有助于确定外科治疗的作用模式,从而保证更有针对性和更完善的药物选择。GLP-1受体激动剂肠促胰岛素类似物exendin-4和利拉鲁肽的半衰期较长,可以穿过血脑屏障,但它们与营养物质引起的GLP-1分泌量增加不同,这些药物的早期引起饱腹感的作用可能类似于内源性GLP-1,但长期刺激会使CNS产生对GLP-1受体激动剂的拮抗作用,从而减弱抑制食物摄入的作用[96]。所以可以尝试使用某些物质刺激内源性GLP-1的分泌,如SCFAs通过FFAR2和FFAR3途径刺激L细胞释放GLP-1,这也是SCFAs具有降脂减肥的机制之一。
2.4.3 酪酪肽
PYY是一种由36 个氨基酸组成的多肽,属于胰多肽家族,和GLP-1一样也是L细胞对肠道营养物质的反应而释放的肠激素。内源性PYY通常以PYY1-36和PYY3-36两种形式存在,餐后PYY主要以PYY3-36的形式存在。PYY基因敲除的小鼠贪吃,且对餐食没有饱足感[97],推测PYY在能量代谢平衡中可能发挥重要作用。营养物质直接作用于小肠末端的L细胞是促进PYY的分泌主要途径[98],但PYY在进食后15 min内被释放,说明PYY的释放和GLP-1一样是通过小肠近端神经或化学传递的反射弧刺激末端小肠L细胞释放。血液中PYY在进食1~2 h后达到峰值[99],且可以在进食数小时后仍维持高水平,这表明PYY通过内分泌信号控制长期的饱腹感,而CCK和GLP-1在控制短期的饱腹感更重要。PYY3-36是PYY受体(Y2 receptor,Y2R)的激活剂,外源性PYY3-36可以降低啮齿动物和人类的食物摄入量,这个作用在Y2R基因敲除小鼠[100]和与Y2R拮抗剂[101]同时注射的小鼠中都不存在。Y2R主要由ARC内促饮食的酪神经肽Y(neuropeptide Y,NPY)的神经元表达,外源性PYY3-36通过对Y2R的作用导致NPY mRNA表达量减少[100],而Y2R拮抗剂使NPY表达量增加[102]。因此,PYY可能通过激素途径激活前阿片黑素细胞皮质激素(pro-opiomelanocortin,POMC)神经元和抑制NPY神经元调节食物摄入,在能量稳态中发挥关键作用[18]。
PYY会引起饱腹感,减少食物的摄入,参与能量消耗。所以可以通过一些操作或者物质刺激内源性PYY的分泌,从而达到降脂的预期。Steinert[103]和Dischinger[104]等通过对高脂饲料诱导的肥胖小鼠进行胃旁路手术(Roux-en-Y,RYGB),发现升高的PYY等肠激素有效地降低了小鼠的体质量。Christiansen等[105]发现在结肠内灌注SCFAs可以显著增加结肠中GLP-1/PYY分泌。但是RYGB有一定的副作用,人工添加的SCFAs又可能很快被消耗掉,所以有研究通过直接补充PYY,发挥其抑制饮食的作用,从而达到调节能量平衡的目的。Tan等[106]通过注射与RYGB后相匹配的餐后GLP-1(4 pmol/(kg·min))、OXM(4 pmol/(kg·min))和PYY(0.4 pmol/(kg·min))浓度水平,成功使食物摄入量平均减少了32%。同时使用Y2R激动剂和PYY衍生物用于肥胖的治疗有一定前景。但一些研究表明,PYY浓度升高与胃肠道疾病相关,如炎症性肠病和慢性破坏性胰腺炎以及长期食欲减退[107]。PYY和CCK在老年人体内的浓度较高,但这些老年人常常出现胃排空延迟和胆囊收缩力下降的现象[19],这种长期饱腹感引起食物摄入量减少可能与老年人营养不良有关[19]。因此,在使用Y2R激动剂和PYY衍生物治疗肥胖或超重前要明确持续高浓度的PYY对于机体的长期影响。
2.4.4 胃泌酸调节素
OXM也是一种由肠道营养物质刺激L细胞而释放的肠激素。它与GLP-1一样,是由肠道EECs和中枢神经系统中的原胰高血糖素肽翻译后加工合成的[71]。它的分泌与GLP-1和PYY同时发生,并在餐后30 min内浓度达到峰值,随后被二肽基肽酶IV迅速降解[108]。OXM与GIT、胰腺和ARC内的GLP-1受体结合,导致胃酸分泌和食物摄入的减少[109]。中央和外周给药能增强饱腹感,从而减少啮齿动物和人类的食物摄入,并增加能量消耗[110]。此外,OXM与胰腺内的胰高血糖素受体结合,能降低血糖浓度,提高葡萄糖利用率[111]。但OXM如何通过与胰高血糖素受体结合形成肠促胰岛素的确切机制仍不是很清楚[112]。OXM可能对胰高血糖素起拮抗作用,并通过局部的旁分泌作用或通过下丘脑激活大脑的高级中枢而产生促胰岛素作用。有研究表明OXM可以增加能量消耗是通过激活儿茶酚胺和POMC神经元,并增加褐色脂肪部位的迷走神经活动,导致产热增加[112]。以上研究结果表明,可以通过OXM类似物来治疗肥胖,但仍需要进一步的研究来阐明其成为肠促胰岛素和具有产热能力的机制。
2.4.5 血清素
肠嗜铬细胞是一种特化的EECs,在食物摄入的反应中产生并分泌肠道源血清素[113]。血清素通过激活迷走传入神经纤维、中枢神经系统内的其他神经元以及GIT、心脏和肾上腺内的细胞上的各种血清素受体(如5-羟色胺2受体和5-羟色胺4受体家族)发挥其作用[114-115]。血清素类似物,如氯卡色林,能抑制食欲,减轻体质量,而血清素受体拮抗剂则能诱导相反的作用,增加食欲,从而增加体质量[116]。血清素通过对中枢神经系统的影响降低食欲,有助于减肥。但有报道却发现相反的作用,饲喂高脂饲料的小鼠体内的血清素的浓度升高与体质量增加的程度成正比[117]。Crane等[117]研究表明,抑制血清素的合成可以减少肥胖和代谢功能障碍,因为血清素可以抑制β肾上腺素的神经元向褐色脂肪组织传递信息,从而减少产热。此外,由于会产生严重的副作用,如精神疾病、心脏毒性、药物成瘾和死亡,血清素类似物最近已经退出市场[118]。因此,血清素对能量平衡和采食行为的影响是复杂的,有待进一步研究。
2.4.6 内源性大麻素
内源性大麻素是一类具有生物活性的脂类,已被证明在肠-脑轴中发挥重要作用。内源性大麻素在GIT中合成和分泌,通过作用于内源性大麻素受体发挥作用。内源性大麻素受体主要是内源性大麻素受体1(cannabinoid receptor 1,CB1)和内源性大麻素受体2(cannabinoid receptor 2,CB2),它们是内源性大麻素系统中的G蛋白偶联受体[18,51]。CB1大量分布于中枢神经系统和周围神经系统,在肝脏、胰腺和脂肪组织中也表达,CB2除在大脑、胰腺和脂肪组织中表达外,主要在免疫细胞中表达[119]。内源性大麻素调节参与各种与代谢相关的生理功能,如调节肠道运动和增加食欲[119]。这些作用被越来越多的研究所支持,CB1拮抗剂(如利莫那班),被用于肥胖人群减肥,证明了内源性大麻素在增加食欲方面的作用[120-121]。同时肥胖个体常常伴随着体内血浆和脂肪组织中内源性大麻素活性、CB1表达量和内源性大麻素浓度升高[51]。CB1基因敲除的小鼠对高脂饮食诱导的肥胖具有抵抗力,对抑制饥饿和增加饱腹感的瘦素的敏感性增强[121]。在缺少食物的情况下,大麻素的分泌量增加,通过促进CB1表达抑制迷走传入神经而诱导饥饿感,从而阻断迷走神经向中枢神经系统的传递信息,可能导致其他肠道激素传递的效应减弱[122],但是这个作用还需要进一步的实验验证。内源性大麻素还与压力、记忆、免疫功能和情绪有着错综复杂的联系[119],因此,影响这些生理和心理功能的因素可能与进食行为有关,而这些因素可能在肥胖者体内被放大。
2.5 神经体液回路及神经中枢
肠激素从EECs释放后,可通过两种回路将信号传递到中枢神经。第1条回路是神经回路。肠激素可以通过迷走传入神经将信号传入大脑或者其他器官,肠道中的迷走传入神经纤维延伸至肠绒毛固有层,终止于EECs的基底外侧表面表达肠激素受体的位置,如胃饥饿素、瘦素、CCK、GLP-1和PYY的受体,这些受体激活导致迷走传入神经元的激活[123],然后将信号通过迷走传入神经传导到中枢系统。此外,肠激素也可能通过激活表达肠激素受体的ENS神经元上的肠激素受体,间接激活迷走传入神经元和脊髓传入神经[124-125]。迷走传入神经元终止于脑干背侧迷走神经复合体的NTS,而脊髓传入神经元则延伸至脊髓背角第1板层的神经元上并投射至NTS。NTS整合迷走神经和脊髓传入神经接收到的肠道信号,这些信号随后被传递到下丘脑[126],终止于参与能量平衡控制的PVN和ARC。肠内营养物质可导致NTS中c-Fos基因的激活,而通过用神经毒素辣椒素处理肠内迷走传入神经,阻断肠-脑迷走神经沟通,可减弱这一反应。但辣椒素的这种效应可以被释放的肠激素终止,例如,CCK通过迷走传入神经末端的受体激活NTS神经元[127]。CCK激活传入神经元末端的N-甲基-D-天冬氨酸受体导致细胞外调节蛋白激酶1/2(extracellular signalregulatedkinase1/2,ERK1/2)和突出蛋白I磷酸化,从而激活迷走传入神经元,进而刺激NTS神经元释放神经递质[128]。肠激素-迷走神经传入信号可激活NTS内的各种神经元脉冲,包括POMC和儿茶酚胺能神经元[129],而NTS黑皮质素受体信号则需要肠道肽诱导的ERK1/2的磷酸化来激活进而抑制食物摄取[130]。另一方面,关于ENS或脊髓传入神经元在调节肠-脑轴中的作用的研究较少,它们可能是肠-脑信号的一个附加或冗余通路。所有激活的神经元将神经元信号传入到中枢系统进而调节维持能量的平衡。第2个回路是体液回路。肠激素从EECs释放后进入体液循环,作用于包括大脑在内的外周靶器官,以内分泌方式发挥作用。餐后血浆中肠激素水平增加,通过体循环扩散到大脑并直接作用于脑干和下丘脑神经元。例如,与PYY结合的PYY受体已经被定位在ARC内,而注射外源性PYY增加了ARC中c-Fos的免疫反应活性[18]。
下丘脑除了整合周围体液信号之外还接受NTS和大脑其他高级区域投射来的信号[19]。激素和神经信号通过肠-脑轴激活ARC神经元对能量平衡尤为重要,这主要是通过ARC内的POMC和刺鼠相关蛋白神经元(agouti gene-related protein,AgRP)控制的黑素皮质素系统进行调节。POMC神经元释放POMC神经递质,然后刺激α-黑素细胞刺激素的释放,直接激活下游神经元黑素皮质素受体,抑制食物摄入,增加能量消耗。AgRP神经元释放AgRP神经递质,抑制黑素皮质素受体和NPY,可刺激食物摄入并抑制能量消耗。许多肠激素通过调节ARC中POMC和AgRP神经元及其相关神经肽来控制能量平衡。Bauer等[18]证明肠内灌注葡萄糖可激活肠黏膜上的分泌细胞分泌肠激素,肠激素通过ENS和迷走传入神经使NTS和ARC中的神经元兴奋。由此可见,营养物质通过刺激肠激素的释放来触发肠-脑轴,肠激素通过多种神经或体液途径,激活后脑和下丘脑的重要代谢部位,改变能量摄入和能量消耗来恢复能量平衡。
3 结 语
肠道菌群和其代谢物SCFAs刺激肠道分泌细胞释放的肠激素,通过MGBA调控中枢系统进而调节机体能量代谢平衡,其降糖、降脂、减肥以及改善胰岛素敏感性等益生作用已经被很多研究[18-19,131-132]所证实。Breton等[133]研究了肠道输注大肠杆菌蛋白对小鼠血浆中GLP-1和PYY水平的影响,发现肠道菌群的变化导致了血液中GLP-1和PYY含量的变化,进而通过影响下丘脑ARC来控制食欲。Song Junxian等[73]研究发现辣椒素通过增加肠道中SCFAs浓度,从而刺激GLP-1的分泌量增多,进而维持肥胖小鼠的血糖稳定。Neyrinck等[134]研究发现益生元能调节EECs分泌的胃泌素抑制肽、GLP-1以及PYY的浓度,增加中枢神经的饱腹感,降低食欲,减少进食,从而发挥降脂作用。Wang Yuanwei等[135]研究发现辣椒素可以提高艾克曼菌属、普雷沃菌属、Allobaculum、Odoribacter、S24-7科、拟杆菌属和粪球菌属发酵产生乙酸或丙酸细菌的能力,发挥降脂减肥作用,并发现可能是通过改变PYY和GLP-1的浓度,影响下丘脑ARC中控制采食的神经元,从而发挥降脂减肥作用。因此可以通过MGBA调控中枢系统控制的饮食行为从而达到降脂作用,MGBA调控为治疗肥胖等代谢疾病提供了思路。同时,一些具有降脂作用的物质,例如益生元、膳食纤维、低聚果糖、抗性糊精、果胶、辣椒素以及魔芋等,均可以影响肠道菌群的结构,MGBA调控也为这些物质降脂机理的研究提供了参考方向。
[1]YUMUK V, TSIGOS C, FRIED M, et al.European guidelines for obesity management in adults[J].Obesity Facts, 2015, 8(6): 402-424.DOI:10.1159/000442721.
[2]NG M, FLEMING T, ROBINSON M.Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the global burden of disease study 2013[J].The Lancet, 2014, 384: 766-781.DOI:10.1016/S0140-6736(14)60460-8.
[3]World Health Organization.Obesity and overweight fact sheet[EB/OL].(2018-04-01)[2020-04-21].https://www.who.int/news-room/factsheets/detail/obesity-and-overweight.
[4]World Health Organization.Obesity and overweight[EB/OL].(2011-04-01)[2020-04-21].http://www.who.int/mediacentre/factsheets/fs311/en/.
[5]ABARCA-GÓMEZ L, ABDEEN Z A, HAMID Z A, et al.Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128.9 million children, adolescents, and adults[J].The Lancet, 2017, 390: 2627-2642.DOI:10.1016/S0140-6736(17)32129-3.
[6]LOBSTEIN T, JACKSON-LEACH R.Planning for the worst: estimates of obesity and comorbidities in school-age children in 2025[J].Pediatric Obesity, 2016, 11(5): 321-325.DOI:10.1111/ijpo.12185.
[7]陈贻珊, 张一民, 孔振兴, 等.我国儿童青少年超重、肥胖流行现状调查[J].中华疾病控制杂志, 2017, 21(9): 866-869; 878.DOI:10.16462/j.cnki.zhjbkz.2017.09.002.
[8]FRIED M, YUMUK V, OPPERT J M, et al.Interdisciplinary European guidelines on metabolic and bariatric surgery[J].Obesity Facts, 2013,6(5): 449-468.DOI:10.1159/000355480.
[9]FRÜHBECK G, TOPLAK H, WOODWARD E, et al.Obesity: the gateway to ill health: an EASO position statement on a rising public health, clinical and scientific challenge in Europe[J].Obesity Facts,2013, 6(2): 117-120.DOI:10.1159/000350627.
[10]OLDRIDGE N B, STUMP T E, NOTHWEHR F K, et al.Prevalence and outcomes of comorbid metabolic and cardiovascular conditions in middle- and older-age adults[J].Journal of Clinical Epidemiology,2001, 54(9): 928-934.DOI:10.1016/S0895-4356(01)00350-X.
[11]Prospective Studies Collaboration.Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies[J].The Lancet, 2009, 373: 1083-1096.DOI:10.1016/S0140-6736(09)60318-4.
[12]KELLY T, YANG W, CHEN C S, et al.Global burden of obesity in 2005 and projections to 2030[J].International Journal of Obesity,2008, 32(9): 1431-1437.DOI:10.1038/ijo.2008.102.
[13]KAPLAN S A.Re: national, regional, and global trends in bodymass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants[J].Journal of Urology, 2011, 186(5): 1982-1983.DOI:10.1016/j.juro.2011.07.061.
[14]QIN X Z, PAN J.The medical cost attributable to obesity and overweight in China: estimation based on longitudinal surveys[J].Health Economics, 2016, 25(10): 1291-1311.DOI:10.1002/hec.3217.
[15]GRENHAM S, CLARKE G, CRYAN J F, et al.Brain-gut-microbe communication in health and disease[J].Frontiers in Physiology, 2011,2: 94.DOI:10.3389/fphys.2011.00094.
[16]MAYER E A, TILLISCH K, GUPTA A.Gut/brain axis and the microbiota[J].Journal of Clinical Investigation, 2015, 125(3): 926-938.DOI:10.1172/JCI76304.
[17]MONJE M.Settling a nervous stomach: the neural regulation of enteric cancer[J].Cancer Cell, 2017, 31(1): 1-2.DOI:10.1016/j.ccell.2016.12.008.
[18]BAUER P V, HAMR S C, DUCA F A.Regulation of energy balance by a gut-brain axis and involvement of the gut microbiota[J].Cellular and Molecular Life Sciences, 2016, 73(4): 737-755.DOI:10.1007/s00018-015-2083-z.
[19]BUHMANN H, LE ROUX C W, BUETER M.The gut-brain axis in obesity[J].Best Practice & Research Clinical Gastroenterology, 2014,28(4): 559-571.DOI:10.1016/j.bpg.2014.07.003.
[20]SENDER R, FUCHS S, MILO R.Are we really vastly outnumbered?Revisiting the ratio of bacterial to host cells in humans[J].Cell, 2016,164(3): 337-340.DOI:10.1016/j.cell.2016.01.013.
[21]SENDER R, FUCHS S, MILO R.Revised estimates for the number of human and bacteria cells in the body[J].PLoS Biology, 2016, 14(8):e1002533.DOI:10.1371/journal.pbio.1002533.
[22]QIN J J, LI R Q, RAES J, et al.A human gut microbial gene catalogue established by metagenomics sequencing[J].Nature, 2010, 464: 59-65.DOI:10.1038/nature08821.
[23]WANG H X, WANG Y P.Gut microbiota-brain axis[J].Chinese Medical Journal, 2016, 129(19): 2373-2380.DOI:10.4103/0366-6999.190667.
[24]HEIJTZ R D, WANG S G, ANUAR F, et al.Normal gut microbiota modulates brain development and behavior[J].Proceedings of the National Academy of Sciences, 2011, 108(7): 3047-3052.DOI:10.1073/pnas.1010529108.
[25]CHO I, YAMANISHI S, COX L, et al.Antibiotics in early life alter the murine colonic microbiome and adiposity[J].Nature, 2012, 488: 621-626.DOI:10.1038/nature11400.
[26]AL-ASMAKH M, ZADJALI F.Use of germ-free animal models in microbiota-related research[J].Journal of Microbiology and Biotechnology, 2015, 25(10): 1583-1588.DOI:10.4014/jmb.1501.01039.
[27]DELZENNE N M, NEYRINCK A, CANI P D, et al.Modulation of the gut microbiota by nutrients with prebiotic properties: consequences for host health in the context of obesity and metabolic syndrome[J].Microbial Cell Factories, 2011, 10(Suppl 1): S10.DOI:10.1186/1475-2859-10-S1-S10.
[28]LIN H V, FRASSETTO A, KOWALIK E J Jr, et al.Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms[J].PLoS ONE, 2012, 7(4): e35240.DOI:10.1371/journal.pone.0035240.
[29]WICHMANN A, ALLAHYAR A, GREINER T U, et al.Microbial modulation of energy availability in the colon regulates intestinal transit[J].Cell Host & Microbe, 2013, 14(5): 582-590.DOI:10.1016/j.chom.2013.09.012.
[30]BRAHE L K, ASTRUP A, LARSEN L H.Is butyrate the link between diet, intestinal microbiota and obesity-related metabolic diseases?[J].Obesity Reviews, 2013, 14(12): 950-959.DOI:10.1111/obr.12068.
[31]TOLHURST G, HEFFRON H, LAM Y S, et al.Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein-coupled receptor FFAR2[J].Diabetes, 2012, 61(2): 364-371.DOI:10.2337/db11-1019.
[32]HARTE A L, VARMA M C, TRIPATHI G, et al.High fat intake leads to acute postprandial exposure to circulating endotoxin in type 2 diabetic subjects[J].Diabetes Care, 2012, 35(2): 375-382.DOI:10.2337/dc11-1593.
[33]KIM K A, GU W, LEE I A, et al.High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4 signaling pathway[J].PLoS ONE, 2012, 7(10): e47713.DOI:10.1371/journal.pone.0047713.
[34]EVERARD A, CANI P D.Diabetes, obesity and gut microbiota[J].Best Practice & Research Clinical Gastroenterology, 2013, 27(1): 73-83.DOI:10.1016/j.bpg.2013.03.007.
[35]OUCHI N, PARKER J L, LUGUS J J, et al.Adipokines in inflammation and metabolic disease[J].Nature Reviews Immunology,2011, 11(2): 85-97.DOI:10.1038/nri2921.
[36]BLAUT M.Gut microbiota and energy balance: role in obesity[J].Proceedings of the Nutrition Society, 2015, 74(3): 227-234.DOI:10.1017/S0029665114001700.
[37]吴小平, 贺杰.重视肠道菌群失调与肠外疾病关系的研究[J].国际消化病杂志, 2012, 32(1): 1-3.DOI:10.3969/j.issn.1673-534X.2012.01.001.
[38]HAMR S C, WANG B N, SWARTZ T D, et al.Does nutrient sensing determine how we “see” food?[J].Current Diabetes Reports, 2015,15(6): 38.DOI:10.1007/s11892-015-0604-7.
[39]TIMS S, DEROM C, JONKERS D M, et al.Microbiota conservation and BMI signatures in adult monozygotic twins[J].ISME Journal,2013, 7(4): 707-717.DOI:10.1038/ismej.2012.146.
[40]WANG J, JIA H J.Metagenome-wide association studies: fine-mining the microbiome[J].Nature Reviews Microbiology, 2016, 14(8): 508-522.DOI:10.1038/nrmicro.2016.83.
[41]王洋, 周礼红.肥胖人群肠道菌群多样性研究[J].贵州大学学报(自然科学版), 2018, 35(4): 47-53.DOI:10.15958/j.cnki.gdxbzrb.2018.04.10.
[42]LI X F, GUO J, JI K L, et al.Bamboo shoot fiber prevents obesity in mice by modulating the gut microbiota[J].Scientific Reports, 2016, 6:32953.DOI:10.1038/srep32953.
[43]BABOOTA R K, MURTAZA N, JAGTAP S, et al.Capsaicininduced transcriptional changes in hypothalamus and alterations in gut microbial count in high fat diet fed mice[J].The Journal of Nutritional Biochemistry, 2014, 25(9): 893-902.DOI:10.1016/j.jnutbio.2014.04.004.
[44]ANHÊ F F, ROY D, PILON G, et al.A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp.population in the gut microbiota of mice[J].Gut, 2015, 64(6): 872-883.DOI:10.1136/gutjnl-2014-307142.
[45]ROOPCHAND D E, CARMODY R N, KUHN P, et al.Dietary polyphenols promote growth of the gut bacterium Akkermansia muciniphila and attenuate high-fat diet-induced metabolic syndrome[J].Diabetes, 2015, 64(8): 2847-2858.DOI:10.2337/db14-1916.
[46]VAN DORSTEN F A, PETERS S, GROSS G, et al.Gut microbial metabolism of polyphenols from black tea and red wine/grape juice is source-specific and colon-region dependent[J].Journal of Agricultural and Food Chemistry, 2012, 60(45): 11331-11342.DOI:10.1021/jf303165w.
[47]HERRMANN E, YOUNG W, ROSENDALE D, et al.RNA-based stable isotope probing suggests Allobaculum spp.as particularly active glucose assimilators in a complex murine microbiota cultured in vitro[J].BioMed Research International, 2017, 2017: 1829685.DOI:10.1155/2017/1829685.
[48]ZUO D C, CHOI S, SHAHI P K, et al.Inhibition of pacemaker activity in interstitial cells of Cajal by LPS via NF-κB and MAP kinase[J].World Journal of Gastroenterology, 2013, 19(8): 1210-1218.DOI:10.3748/wjg.v19.i8.1210.
[49]SCHÉLE E, GRAHNEMO L, ANESTEN F, et al.The gut microbiota reduces leptin sensitivity and the expression of the obesity-suppressing neuropeptides proglucagon (Gcg) and brain-derived neurotrophic factor (Bdnf) in the central nervous system[J].Endocrinology, 2013,154(10): 3643-3651.DOI:10.1210/en.2012-2151.
[50]SCHÉLE E, GRAHNEMO L, ANESTEN F, et al.Regulation of body fat mass by the gut microbiota: possible mediation by the brain[J].Peptides, 2016, 77: 54-59.DOI:10.1016/j.peptides.2015.03.027.
[51]MORAN C P, SHANAHAN F.Gut microbiota and obesity: role in aetiology and potential therapeutic target[J].Best Practice & Research Clinical Gastroenterology, 2014, 28(4): 585-597.DOI:10.1016/j.bpg.2014.07.005.
[52]SCHWIERTZ A, TARAS D, SCHÄFER K, et al.Microbiota and SCFA in lean and overweight healthy subjects[J].Obesity, 2010, 18(1):190-195.DOI:10.1038/oby.2009.167.
[53]GAO Z G, YIN J, ZHANG J, et al.Butyrate improves insulin sensitivity and increases energy expenditure in mice[J].Diabetes,2009, 58(7): 1509-1517.DOI:10.2337/db08-1637.
[54]CHAMBERS E S, VIARDOT A, PSICHAS A, et al.Effects of targeted delivery of propionate to the human colon on appetite regulation, bodyweight maintenance and adiposity in overweight adults[J].Gut, 2015,64(11): 1744-1754.DOI:10.1136/gutjnl-2014-307913.
[55]DEN BESTEN G, VAN EUNEN K, GROEN A K, et al.The role of short-chain fatty acids in the interplay between diet, gut microbiota,and host energy meta-bolism[J].Journal of Lipid Research, 2013,54(9): 2325-2340.DOI:10.1194/jlr.R036012.
[56]CANFORA E E, BAN DER BEEK C M, JOCKEN J W E, et al.Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial[J].Scientific Reports, 2017, 7(1): 2206-2217.DOI:10.1038/s41598-017-02546-x.
[57]LIOU A P, PAZIUK M, LUEVANO J M, et al.Conserved shifts in the gut microbiota due to gastric bypass reduce host weight and adiposity[J].Science Translational Medicine, 2013, 5: 178ra41.DOI:10.1126/scitranslmed.3005687.
[58]LU Y Y, FAN C N, LI P, et al.Short chain fatty acids prevent highfat-diet-induced obesity in mice by regulating G protein-coupled receptors and gut microbiota[J].Scientific Reports, 2016, 6: 37589.DOI:10.1038/srep37589.
[59]MURUGESAN S, NIRMALKAR K, HOYO-VADILLO C, et al.Gut microbiome production of short-chain fatty acids and obesity in children[J].European Journal of Clinical Microbiology & Infectious Diseases, 2017, 37(4): 621-625.DOI:10.1007/s10096-017-3143-0.
[60]FREELAND K R, WOLEVER T M S.Acute effects of intravenous and rectal acetate on glucagon-like peptide-1, peptide YY, ghrelin,adiponectin and tumour necrosis factor-alpha[J].Journal British Journal of Nutrition, 2010, 103(3): 460-466.DOI:10.1017/S0007114509991863.
[61]LE POUL E, LOISON C, STRUYF S, et al.Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation[J].Journal of Biological Chemistry,2003, 278(28): 25481-25489.DOI:10.1074/jbc.M301403200.
[62]BROWN A J, GOLDSWORTHY S M, BARNES A A, et al.The orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain car-boxylic acids[J].Journal of Biological Chemistry,2003, 278(13): 11312-11319.DOI:10.1074/jbc.M211609200.
[63]KASUBUCHI M, HASEGAWA S, HIRAMATSU T, et al.Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation[J].Nutrients, 2015, 7(4): 2839-2849.DOI:10.3390/nu7042839.
[64]TAZOE H, OTOMO Y, KARAKI S I, et al.Expression of shortchain fatty acid receptor GPR41 in the human colon[J].Biomedical Research, 2009, 30(3): 149-156.DOI:10.2220/biomedres.30.149.
[65]KARAKI S I, TAZOE H, HAYASHI H, et al.Expression of the shortchain fatty acid receptor, GPR43, in the human colon[J].Journal of Molecular Histology, 2008, 39(2): 135-142.DOI:10.1007/s10735-007-9145-y.
[66]KARAKI S I, MITSUI R, HAYASHI H, et al.Short-chain fatty acid receptor, GPR43, is expressed by enteroendocrine cells and mucosal mast cells in rat intestine[J].Cell and Tissue Research, 2006, 324(3):353-360.DOI:10.1007/s00441-005-0140-x.
[67]PSICHAS A, SLEETH M L, MURPHY K G, et al.The short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents[J].International Journal of Obesity,2015, 39(3): 424-429.DOI:10.1038/ijo.2014.153.
[68]NAMKOONG C, KIM M S, JANG B T, et al.Central administration of GLP-1 and GIP decreases feeding in mice[J].Biochemical and Biophysical Research Communications, 2017, 490(2): 247-252.DOI:10.1016/j.bbrc.2017.06.031.
[69]REINER D J, MIETLICKI-BAASE E G, MCGRATH LE, et al.Astrocytes regulate GLP-1 receptor-mediated effects on energy balance[J].The Journal of Neuroscience, 2016, 36(12): 3531-3540.DOI:10.1523/JNEUROSCI.3579-15.2016.
[70]LI X, SHIMIZU Y, KIMURA I.Gut microbial metabolite short-chain fatty acids and obesity[J].Bioscience of Microbiota Food and Health,2017, 36(4):135-140.DOI:10.12938/bmfh.17-010.
[71]HABIB A M, RICHARDS P, CAIRNS L S, et al.Overlap of endocrine hormone expression in the mouse intestine revealed by transcriptional profiling and flow cytometry[J].Endocrinology, 2012, 153(7): 3054-3065.DOI:10.1210/en.2011-2170.
[72]PSICHAS A, REIMANN F, GRIBBLE F M.Gut chemosensing mechanisms[J].Journal of Clinical Investigation, 2015, 125(3): 908-917.DOI:10.1172/JCI76309.
[73]SONG Junxian, REN Hui, GAO Yuanfeng, et al.Dietary capsaicin improves glucose homeostasis and alters the gut microbiota in obese diabetic ob/ob mice[J].Frontiers in Physiology, 2017, 8: 602.DOI:10.3389/fphys.2017.00602.
[74]LO C C, DAVIDSON W S, HIBBARD S K, et al.Intraperitoneal CCK and fourth-intraventricular Apo AIV require both peripheral and NTS CCK1R to reduce food intake in male rats[J].Endocrinology, 2014,155(5): 1700-1707.DOI:10.1210/en.2013-1846.
[75]CÔTÉ C D, ZADEH-TAHMASEBI M, RASMUSSEN B A, et al.Hormonal signaling in the gut[J].Journal of Biological Chemistry,2014, 289(17): 11642-11649.DOI:10.1074/jbc.O114.556068.
[76]BRENNER L, RITTER R C.Peptide cholesystokinin receptor antagonist increases food intake in rats[J].Appetite, 1995, 24(1): 1-9.DOI:10.1016/S0195-6663(95)80001-8.
[77]RINAMAN L.Hind brain noradrenergic lesions attenuate anorexia and alter central cFos expression in rats after gastricviscerosensory stimulation[J].Journal of Neuroscience, 2003, 23(31): 10084-10092.DOI:10.1523/JNEUROSCI.23-31-10084.2003.
[78]LECHAN R M, FEKETE C.The TRH neuron: a hypothalamic integrator of energy metabolism[J].Progress in Brain Research, 2006,153: 209-235.DOI:10.1016/S0079-6123(06)53012-2.
[79]BRENNER L, YOX D P, RITTER R C.Suppression of sham feeding by intraintestinal nutrients is not correlated with plasma cholecystokinin elevation[J].American Journal of Physiology, 1993,264(5): R972-R976.DOI:10.1152/ajpregu.1993.264.5.R972.
[80]SAYEGH A I.The role of cholecystokinin receptors in the shortterm control of food intake[J].Progress in Molecular Biology and Translational Science, 2013, 114: 277-316.DOI:10.1016/B978-0-12-386933-3.00008-X.
[81]DUCA F A, YUE J T Y.Fatty acid sensing in the gut and the hypothalamus: in vivo and in vitro perspectives[J].Molecular and Cellular Endocrinology, 2014, 397(1/2): 23-33.DOI:10.1016/j.mce.2014.09.022.
[82]STEINERT R E, BEGLINGER C, LANGHANS W.Intestinal GLP-1 and satiation-from man to rodents and back[J].International Journal of Obesity, 2015, 40(2): 198-205.DOI:10.1038/ijo.2015.172.
[83]ROBERGE J N, GRONAU K A, BRUBAKER P L.Gastrin-releasing peptide is a novel mediator of proximal nutrient-induced proglucagonderived peptide secretion from the distal gut[J].Endocrinology, 1996,137(6): 2383-2388.DOI:10.1210/endo.137.6.8641190.
[84]THEODORAKIS M J, CARLSON O, MICHOPOULOS S, et al.Human duodenal enteroendocrine cells: source of both incretin peptides, GLP-1 and GIP[J].American Journal of Physiology-Endocrinology and Metabolism, 2006, 290(3): 550-559.DOI:10.1152/ajpendo.00326.2004.
[85]SVENDSEN B, PEDERSEN J, ALBRECHTSEN N J W, et al.An analysis of cosecretion and coexpression of gut hormones from male rat proximal and distal small intestine[J].Endocrinology, 2015, 156(3):847-857.DOI:10.1210/en.2014-1710.
[86]HAYES M R, DE JONGHE B C, KANOSKI S E.Role of the glucagon-like-peptide-1 receptor in the control of energy balance[J].Physiology & Behavior, 2010, 100(5): 503-510.DOI:10.1016/j.physbeh.2010.02.029.
[87]HOLST J J.The physiology of glucagon-like peptide 1[J].Physiological Reviews, 2007, 87(4): 1409-1439.DOI:10.1152/physrev.00034.2006.
[88]NAKAGAWA A, SATAKE H, NAKABAYASHI H, et al.Receptor gene expression of glucagon-like peptide-1, but not glucose-dependent insulinotropic polypeptide, in rat nodose ganglion cells[J].Autonomic Neuroscience-Basic & Clinical, 2004, 110(1): 36-43.DOI:10.1016/j.autneu.2003.11.001.
[89]KAKEI M, YADA T, NAKAGAWA A, et al.Glucagon- like peptide-1 evokes action potentials and increases cytosolic Ca2+ in rat nodose ganglion neurons[J].Autonomic Neuroscience-Basic & Clinical, 2002,102(1/2): 39-44.DOI:10.1016/s1566-0702(02)00182-0.
[90]HAYES M R, KANOSKI S E, DE JONGHE B C, et al.The common hepatic branch of the vagus is not required to mediate the glycemic and food intake suppressive effects of glucagonlike peptide-1[J].American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2011, 301(5): 1479-1485.DOI:10.1152/ajpregu.00356.2011.
[91]ZHANG J C, RITTER R C.Circulating GLP-1 and CCK-8 reduce food intake by capsaicin-insensitive, nonvagal mechanisms[J].American Journal of Physiology, 2012, 302(2): 264-273.DOI:10.1152/ajpregu.00114.2011.
[92]OHLSSON L, KOHAN A B, TSO P, et al.GLP-1 released to the mesenteric lymph duct in mice: effects of glucose and fat[J].Regulatory Peptides, 2014, 189: 40-45.DOI:10.1016/j.regpep.2014.02.001.
[93]KOHAN A, YODER S, TSO P.Lymphatics in intestinal transport of nutrients and gastrointestinal hormones[J].Annals of The New York Academy of Sciences, 2010, 1207(Suppl 1): 44-51.DOI:10.1111/j.1749-6632.2010.05753.x.
[94]WILLIAMS D L, BASKIN D G, SCHWARTZ M W.Evidence that intestinal glucagon-like peptide-1 plays a physiological role in satiety[J].Endocrinology, 2009, 150(4): 1680-1687.DOI:10.1210/en.2008-1045.
[95]PLAMBOECK A, VEEDFALD S, DEACON CF, et al.The effect of exogenous GLP-1 on food intake is lost in male truncally vagotomized subjects with pyloroplasty[J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2013, 304(12): 1117-1127.DOI:10.1152/ajpgi.00035.2013.
[96]KANOSKI S E, FORTIN S M, ARNOLD M, et al.Peripheral and central GLP-1 receptor populations mediate the anorectic effects of peripherally administered GLP-1 receptor agonists, liraglutide and exendin-4[J].Endocrinology, 2011, 152(8): 3103-3112.DOI:10.1210/en.2011-0174.
[97]BATTERHAM R L, HEFFRON H, KAPOOR S, et al.Critical role for peptide YY in protein-mediated satiation and body-weight regulation[J].Cell Metabolism, 2006, 4(3): 223-233.DOI:10.1016/j.cmet.2006.08.001.
[98]ROZENGURT N, WU S V, CHEN M C, et al.Colocalization of the alpha-subunit of gustducin with PYY and GLP-1 in L cells of human colon[J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2006, 291(5): 792-802.DOI:10.1152/ajpgi.00074.2006.
[99]BATTERHAM R L, COHEN M A, ELLIS S M, et al.Inhibition of food intake in obese subjects by peptide YY3-36[J].New England Journal of Medicine, 2003, 349(10): 941-948.DOI:10.1056/NEJMoa030204.
[100]TALSANIA T, ANINI Y, SIU S, et al.Peripheral exendin-4 and peptide YY3-36 synergistically reduce food intake through different mechanisms in mice[J].Endocrinology, 2005, 146(9): 3748-3756.DOI:10.1210/en.2005-0473.
[101]BATTERHAM R L, COWLEY M, SMALL C J, et al.Gut hormone PYY3-36 physiologically inhibits food intake[J].Nature, 2002, 418:650-654.DOI:10.1038/nature00887.
[102]KING P J, WILLIAMS G, DOODS H, et al.Effect of a selective neuropeptide YY2 receptor antagonist, BIIE0246 on neuropeptide Y release[J].European Journal of Pharmacology, 2000, 396(1): 1-3.DOI:10.1016/s0014-2999(00)00230-2.
[103]STEINERT R E, FEINLE-BISSET C, ASARIAN L, et al.Ghrelin,CCK, GLP-1, and PYY3-36: secretory controls and physiological roles in eating and glycemia in health, obesity, and after RYGB[J].Physiological Reviews, 2017, 97(1): 411-463.DOI:10.1152/physrev.00031.2014.
[104]DISCHINGER U, CORTEVILLE C, OTTO C, et al.GLP-1 and PYY3-36 reduce high-fat food preference additively after Roux-en-Y gastric bypass in diet-induced obese rats[J].Surgery for Obesity and Related Diseases, 2019, 15(9): 1483-1492.DOI:10.1016/j.soard.2019.04.008.
[105]CHRISTIANSEN C B, GABE M B N, SVENDSEN B, et al.The impact of short-chain fatty acids on GLP-1 and PYY secretion from the isolated perfused rat colon[J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2018, 315(1): 53-65.DOI:10.1152/ajpgi.00346.2017.
[106]TAN T, BEHARY P, THARAKAN G, et al.The effect of a subcutaneous infusion of GLP-1, OXM, and PYY on energy intake and expenditure in obese volunteers[J].Journal of Clinical Endocrinology& Metabolism, 2017, 102(7): 2364-2372.DOI:10.1210/jc.2017-00469.
[107]EL-SALHY M, MAZZAWI T, GUNDERSEN D, et al.The role of peptide YY in gastrointestinal diseases and disorders (review)[J].International Journal of Molecular Medicine, 2013, 31(2): 275-282.DOI:10.3892/ijmm.2012.1222.
[108]DRUCE M R, MINNION J S, FIELD B C T, et al.Investigation of structure-activity relationships of oxyntomodulin (OXM) using OXM analogs[J].Endocrinology, 2009, 150(4): 1712-1722.DOI:10.1210/en.2008-0828.
[109]POCAI A, CARRINGTON P E, ADAMS J R, et al.Glucagon-like peptide 1/glucagon receptor dual agonism reverses obesity in mice[J].Diabetes, 2009, 58(10): 2258-2266.DOI:10.2337/db09-0278.
[110]WYNNE K, PARK A J, SMALL C J, et al.Subcutaneous oxyntomodulin reduces body weight in overweight and obese subjects:a double-blind, randomized, controlled trial[J].Diabetes, 2005, 54(8):2390-2395.DOI:10.2337/diabetes.54.8.2390.
[111]MAIDA A, LOVSHIN J A, BAGGIO L L, et al.The glucagon like peptide-1 receptor agonist oxyntomodulin enhances β-cell function but does not inhibit gastric emptying in mice[J].Endocrinology, 2008,149(11): 5670-5678.DOI:10.1210/en.2008-0336.
[112]POCAI A.Action and therapeutic potential of oxyntomodulin[J].Molecular Metabolism, 2014, 3(3): 241-251.DOI:10.1016/j.molmet.2013.12.001.
[113]BERTRAND P P, BERTRAND R L.Serotonin release and uptake in the gastrointestinal tract[J].Autonomic Neuroscience-Basic &Clinical, 2010, 153(1/2): 47-57.DOI:10.1016/j.autneu.2009.08.002.
[114]LI B J, SHAO D Y, LUO Y G, et al.Role of 5- HT3 receptor on food intake in fed and fasted mice[J].PLoS ONE, 2015, 10(3): e0121473.DOI:10.1371/journal.pone.0121473.
[115]STIEDL O, PAPPA E, KONRADSSON-GEUKEN Å, et al.The role of the serotonin receptor subtypes 5-HT1A and 5-HT7 and its interaction in emotional learning and memory[J].Frontiers in Pharmacology, 2015, 6:162.DOI:10.3389/fphar.2015.00162.
[116]SMITH S R, WEISSMAN N J, ANDERSON C M, et al.Multicenter,placebo-controlled trial of lorcaserin for weight management[J].New England Journal of Medicine, 2010, 363(3): 2468-2470.DOI:10.1056/NEJMoa0909809.
[117]CRANE J D, PALANIVEL R, MOTTILLO E P, et al.Inhibiting peripheral serotonin synthesis reduces obesity and metabolic dysfunction by promoting brown adipose tissue thermogenesis[J].Nature Medicine, 2015, 21(2): 166-172.DOI:10.1038/nm.3766.
[118]ONAKPOYA I J, HENEGHAN C J, ARONSON J K.Postmarketing withdrawal of anti-obesity medicinal products because of adverse drug reactions: a systematic review[J].BMC Medicine, 2016, 14(1): 191.DOI:10.1186/s12916-016-0735-y.
[119]MACKIE K.Cannabinoid receptors: where they are and what they do[J].Journal of Neuroendocrinology, 2008, 20(Suppl 1): 10-14.DOI:10.1111/j.1365-2826.2008.01671.x.
[120]ARONNE L J, TONSTAD S, MORENO M, et al.A clinical trial assessing the safety and efficacy of taranabant, a CB1R inverse agonist,in obese and overweight patients: a high-dose study[J].International Journal of Obesity, 2010, 34: 919-935.DOI:10.1038/ijo.2010.21.
[121]CLUNY N L, CHAMBERS A P, VEMURI V K, et al.The neutral cannabinoid CB1 receptor antagonist AM4113 regulates body weight through changes in energy intake in the rat[J].Pharmacology Biochemistry and Behavior, 2011, 97(3): 537-543.DOI:10.1016/j.pbb.2010.10.013.
[122]KENTISH S J, PAGE A J.The role of gastrointestinal vagal afferent fibres in obesity[J].Journal of Physiology, 2015, 593(4): 775-786.DOI:10.1113/jphysiol.2014.278226.
[123]DOCKRAY G J.Enteroendocrine cell signalling via the vagus nerve[J].Current Opinion in Pharmacology, 2013, 13(6): 954-958.DOI:10.1016/j.coph.2013.09.007.
[124]AMATO A, CINCI L, ROTONDO A, et al.Peripheral motor action of glucagon-like peptide-1 through enteric neuronal receptors[J].Neurogastroenterol and Motility, 2010, 22(6): 664-671; e203.DOI:10.1111/j.1365-2982.2010.01476.x.
[125]RICHARDS P, PARKER H E, ADRIAENSSENS A E, et al.Identification and characterization of GLP-1 receptor-expressing cells using a new transgenic mouse model[J].Diabetes, 2014, 63(4):1224-1233.DOI:10.2337/db13-1440.
[126]SCHWARTZ M W, WOODS S C, PORTE D J R, et al.Central nervous system control of food intake[J].Nature, 2000, 404: 661-671.DOI:10.1038/35007534.
[127]CAMPOS C A, SHIINA H, SILVAS M, et al.Vagal afferent NMDA receptors modulate CCK-induced reduction of food intake through synapsin I phosphorylation in adult male rats[J].Endocrinology, 2013,154(8): 2613-2625.DOI:10.1210/en.2013-1062.
[128]BABIC T, TOWNSEND R L, PATTERSON L M, et al.Phenotype of neurons in the nucleus of the solitary tract that express CCK-induced activation of the ERK signaling pathway[J].American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2009,296(4): 845-854.DOI:10.1152/ajpregu.90531.2008.
[129]SUTTON G M, DUOS B, PATTERSON L M, et al.Melanocortinergic modulation of cholecystokinin-induced suppression of feeding through extracellular signal-regulated kinase signaling in rat solitary nucleus[J].Endocrinology, 2005, 146(9): 3739-3747.DOI:10.1210/en.2005-0562.
[130]SEELEY R J, GRILL H J, KAPLAN J M.Neurological dissociation of gastrointestinal and metabolic contributions to meal size control[J].Behavioral Neuroscience, 1994, 108(2): 347-352.DOI:10.1037/0735-7044.108.2.347.
[131]BLISS E S, WHITESIDE E.The gut-brain axis, the human gut microbiota and their integration in the development of obesity[J].Frontiers in Physiology, 2018, 9: 900.DOI:10.3389/fphys.2018.00900.
[132]DE VADDER F, KOVATCHEVA-DATCHARY P, GONCALVES D,et al.Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J].Cell, 2014, 156(1/2): 84-96.DOI:10.1016/j.cell.2013.12.016.
[133]BRETON J, TENNOUNE N, LUCAS N, et al.Gut commensal E.coli proteins activate host satiety pathways following nutrientinduced bacterial growth[J].Cell Metabolism, 2016, 23(2): 324-334.DOI:10.1016/j.cmet.2015.10.017.
[134]NEYRINCK A M, VAN HEE V F, PIRONT N, et al.Wheatderived arabinoxylan oligosaccharides with prebiotic effect increase satietogenic gut peptides and reduce metabolic endotoxemia in diet-induced obese mice[J].Nutrition & Diabetes, 2012, 2(1): e28.DOI:10.1038/nutd.2011.24.
[135]WANG Yuanwei, TANG Cheng, TANG Yong, et al.Capsaicin has an anti-obesity effect through alterations in gut microbiota populations and short-chain fatty acid concentrations[J].Food & Nutrition Research, 2020, 64: 3525.DOI:10.29219/fnr.v64.3525.