香气是衡量酿酒葡萄和葡萄酒品质的重要指标之一,优质葡萄酒的香气通常有丰富、平衡、典型性突出的特点。目前已在葡萄酒中发现了800多种香气成分[1-2],其中直接来自酿酒葡萄果实的香气物质(品种香)是决定葡萄酒典型性和产地风格的重要组分,主要有萜烯类、C13降异戊二烯类、甲氧基吡嗪等,分别贡献花香和柑橘、热带水果和紫罗兰、青椒等气味,这些物质共同构成了优质葡萄酒复杂、优雅的香气。在酿酒葡萄果实中,萜烯类物质从葡萄转色开始大量积累,在接近成熟时含量达到峰值,随后略有下降,萜烯类物质的积累通常与果实中糖分积累同步。因此,在实际采收时通常通过糖酸比来确定是否达到适宜采收的程度。果实中的萜烯类物质以游离态和糖苷结合态两种形式存在于内果皮中,极少量存在于果肉中,且糖苷结合态萜烯的含量远高于游离态[3]。据报道,果实中糖苷结合态萜烯含量可达到游离态的2~8 倍[4]。由于糖苷结合态香气物质不具备挥发性,对葡萄酒香气的贡献是间接的、潜在的,因此又被称为香气前体物[5]。葡萄酒酿造过程中,在酸性环境或相关酶的作用下,糖苷可以被水解,释放出所结合的香气物质[6],增加葡萄酒的风味;同时,部分萜烯在酸性条件下还会发生分子重排,引起萜烯间的相互转化,对葡萄酒的香气品质产生重要影响。本文将综述葡萄酒酿酒过程中萜烯的转化及其影响因素,为葡萄酒香气化学的研究提供参考,也为优质葡萄酒香气的精准调控提供依据。
1 葡萄果实中的萜烯类物质
萜烯是葡萄中一类重要的次生代谢产物,它们通过异戊二烯(C5)途径合成,按照所含碳原子数目不同,可分为单萜(C10)、倍半萜(C15)、二萜(C20)、三萜(C30)等。从生物学功能上,萜烯可作为植保素,起到抵抗外界生物和非生物胁迫,增强葡萄抗逆性的作用[7],更为关键的,萜烯是重要的香气组成成分。目前,在酿酒葡萄果实中已经发现了70多种萜烯类物质[8],其中对葡萄和葡萄酒香气有重要贡献的萜烯是单萜、倍半萜及其衍生物[9]。
1.1 单萜
单萜是酿酒葡萄中含量最高、种类最丰富的萜类物质,对葡萄酒的香气轮廓有重要影响。按照官能团划分,单萜类化合物主要包括单萜醇类、单萜烯类和一些单萜氧化物。酿酒葡萄中常见的单萜有里那醇、香叶醇、香茅醇、橙花醇、α-萜品醇等。不同酿酒葡萄品种的单萜组分也有较大差异,根据果实中游离态单萜的总量,可将欧亚种酿酒葡萄划分为麝香型(游离单萜总量高于6 mg/L)、非麝香芳香型(游离单萜总量介于1~4 mg/L之间)和非芳香型(游离单萜总量小于1 mg/L)[8]。常见的麝香型酿酒葡萄品种有‘小白粒麝香’(又称‘小白玫瑰’)‘亚历山大麝香’‘汉堡麝香’和‘奥托奈麝香’等,常见的非麝香芳香型酿酒葡萄品种主要有‘琼瑶浆’‘雷司令’‘长相思’等,非芳香型品种如‘赤霞珠’‘西拉’‘美乐’‘霞多丽’等。单萜组分的感官阈值均较低,而在麝香型酿酒葡萄中其含量一般较高,因此,单萜类物质在这类葡萄酒中通常具有较高的气味活度值[10](odor activity value,OAV,即组分浓度与其感官阈值之比,通常认为OAV大于1的香气物质是有香气贡献的关键呈香组分)易被感知;在芳香型葡萄酒中单萜也是重要的香气贡献物,但在非芳香型葡萄酒中,更为重要的是同样以花香和果香为主要气味特征的C13降异戊二烯类物质,单萜对该类型葡萄酒的香气贡献极其有限。
多项研究表明参与单萜合成的酶,如1-脱氧-D-木酮糖-5-磷酸合酶、糖基转移酶等,均与单萜含量差异密切相关。Battilana等[11]通过对184 个葡萄品种进行QTL定位分析,发现位于5号染色体的VvDXS1基因与里那醇、橙花醇和香叶醇的含量均有较高相关性,并在随后确定了该基因上的单核苷酸多态性(single-nucleotide polymorphism,SNP)位点P1822的碱基G被T取代时,第284位氨基酸由赖氨酸(K)突变为天冬氨酸(N),导致单萜类物质的表达和积累显著增加[12]。Yang Xiaoxu等[13]发现该基因上可能存在一个新的SNP位点——P1678位点,当该位点碱基A被G取代时,第560位氨基酸由缬氨酸(V)突变为异亮氨酸(I),使得具有A/A基因型的品种具有更高的单萜含量。此外,Li Xiangyi等[14]发现,不同类型的酿酒葡萄中糖苷态单萜含量也有较大差异,麝香型品种‘小白玫瑰’中的OAV最高的糖苷态单萜依次是里那醇、香叶醇和cis-玫瑰醚,而芳香型的‘琼瑶浆’中OAV最高的糖苷态单萜则依次为香叶醇、月桂烯、cis-玫瑰醚和柠檬烯,且糖基转移酶基因VvGT14的表达在两种类型的酿酒葡萄品种中糖苷态单萜的积累均发挥了重要作用。该基因在‘小白玫瑰’转色直至成熟时期均有较高表达,在‘琼瑶浆’中则在花后42~57 d和100~106 d两个时段出现较高表达。另一个糖基转移酶基因VvGT7则仅在‘琼瑶浆’发育过程早期(花后30~72 d)呈现高表达,在‘小白玫瑰’成熟全程中未见高表达。推测VvGT14和VvGT7在两个品种间的表达差异可能是导致糖苷态单萜含量差异的原因之一。
1.2 倍半萜
与单萜类物质相比,葡萄果实和葡萄酒中倍半萜的含量都非常低[15],但同时大多数倍半萜在葡萄酒中的感官阈值均较低,可以在葡萄酒的发酵和贮藏过程中稳定地保留,因此,它们对葡萄酒香气也有一定贡献。与单萜的变化模式不同,倍半萜含量随着果实的成熟呈下降趋势[16],常规的气相色谱-质谱检测条件下一般较难检出,通常需要同时借助同位素标记和特征离子扫描才能检出部分倍半萜。目前关于倍半萜的合成路径、相互转化及含量研究报道相对较少[17-18],有些倍半萜甚至尚未被鉴定和命名。大多数倍半萜的气味特征被描述为花香和木材的香味,少数具有柑橘等水果类香气。
葡萄果实中,最重要、也是目前研究最多的倍半萜是具有特殊“黑胡椒”气味的莎草奥酮,其最早在澳洲‘西拉’葡萄中被发现,是该品种及其所酿造葡萄酒的特征香气组分。Wood等[19]采用气相色谱-质谱-嗅闻技术和以d5-莎草奥酮为内标进行稳定同位素稀释分析,结合固相微萃取气相色谱-质谱法,首次确定了莎草奥酮是‘西拉’葡萄酒中黑胡椒气味的来源,并确定了莎草奥酮在红葡萄酒和水中的感官阈值分别为16 ng/L和8 ng/L,低于葡萄酒中常见萜烯类物质和其他倍半萜感官阈值10 倍以上。目前已有的研究表明,果实中的莎草奥酮是由前体法尼基焦磷酸在萜烯合成酶的催化下形成α-愈创木烯,α-愈创木烯进一步氧化形成的。萜烯合成酶基因VvTPS24的等位基因——倍半萜烯合酶基因VvGuaS的表达差异可能是导致不同品种间莎草奥酮含量差异的根本原因[20]。此外,葡萄果实中莎草奥酮的含量也受到环境因素,尤其是温度和光照的影响[21]。
1.3 糖苷态萜烯
上世纪80年代初期,葡萄果实中首次发现了以糖苷结合态存在的萜烯物质[22]。糖苷结合态萜烯是由萜烯苷元和葡萄糖苷配基通过β-葡萄糖苷键连接组成的。葡萄果实中萜烯类物质的萜烯苷元主要是单萜醇(例如里那醇、橙花醇、香茅醇、香叶醇及里那醇的氧化物)、单萜二醇和单萜三醇[23],而糖苷配基的主要形式是双糖苷,约占总糖苷的80%以上,其次是单糖苷,约占10%左右[23-24],三糖苷含量最低,仅有少量报道[25-26]。目前葡萄中发现的所有萜烯单糖苷都是β-D-吡喃葡萄糖苷[27],若β-D-吡喃葡萄糖苷后再连接另一个糖基,则形成双糖苷,根据末端糖基的含碳数,可分为己糖基-葡萄糖苷和戊糖基-葡萄糖苷两大类,其中己糖基-葡萄糖苷主要是6-O-α-L-吡喃鼠李糖基-β-D-吡喃葡萄糖苷(又称芸香糖苷)、6-O-β-D-葡萄糖基-β-D-吡喃葡萄糖苷,戊糖基-葡萄糖苷则包括6-O-α-L-呋喃阿拉伯糖基-β-D-吡喃葡萄糖苷、6-O-α-呋喃芹菜糖基-β-D-吡喃葡萄糖苷以及6-O-β-D-吡喃木糖基-β-D-吡喃葡萄糖苷等[15,28-29],而三糖苷则是在β-D-吡喃葡萄糖苷后连接两个糖基,迄今在葡萄中发现的唯一萜烯三糖苷是单萜醇己糖-戊糖-戊糖[4]。Song Hongcong等[30]利用超高效液相色谱-四极杆飞行时间质谱在非芳香型酿酒葡萄品种‘爱格丽’‘蛇龙珠’和常见的麝香型品种‘汉堡麝香’中共检测出15 种萜烯糖苷,其中包括12 种双糖苷和3 种单糖苷,发现其中1,2-二羟基里那醇-β-D-吡喃葡萄糖苷/6,7-二羟基里那醇-β-D-吡喃葡萄糖苷、八羟基里那醇-β-D-吡喃葡萄糖苷、呋喃型氧化里那醇-α-L-呋喃阿拉伯糖基-β-D-吡喃葡萄糖苷和橙花醇-α-呋喃芹菜糖基-β-D-吡喃葡萄糖苷4 种糖苷在3 个品种中均存在。
此外,Song Hongcong等[30]还收集了有关葡萄萜烯糖苷的液相色谱-质谱裂解模式的信息以及糖苷的化学信息,利用UNIFI软件建立了包含萜烯苷元信息的糖苷数据库,其中单糖苷(即β-D-吡喃葡萄糖苷)10 种、α-L-呋喃阿拉伯糖基-β-D-吡喃葡萄糖苷9 种、α-呋喃芹菜糖基-β-D-吡喃葡萄糖苷12 种、α-L-吡喃鼠李糖基-β-D-吡喃葡萄糖苷7 种,β-D-吡喃木糖基-β-D-吡喃葡萄糖苷2 种。由于葡萄果实中的倍半萜难以检测到,该数据库中所收录的萜烯糖苷中配基均为单萜及其衍生物,尚无倍半萜的糖苷,这为开展糖苷态单萜的研究奠定了基础。表1总结了文献报道的酿酒葡萄果实中主要萜烯类物质的气味特征及含量范围。
表1 酿酒葡萄果实中主要萜烯的含量及气味特点
Table 1 Content and odor characteristics of terpenes in wine grapes
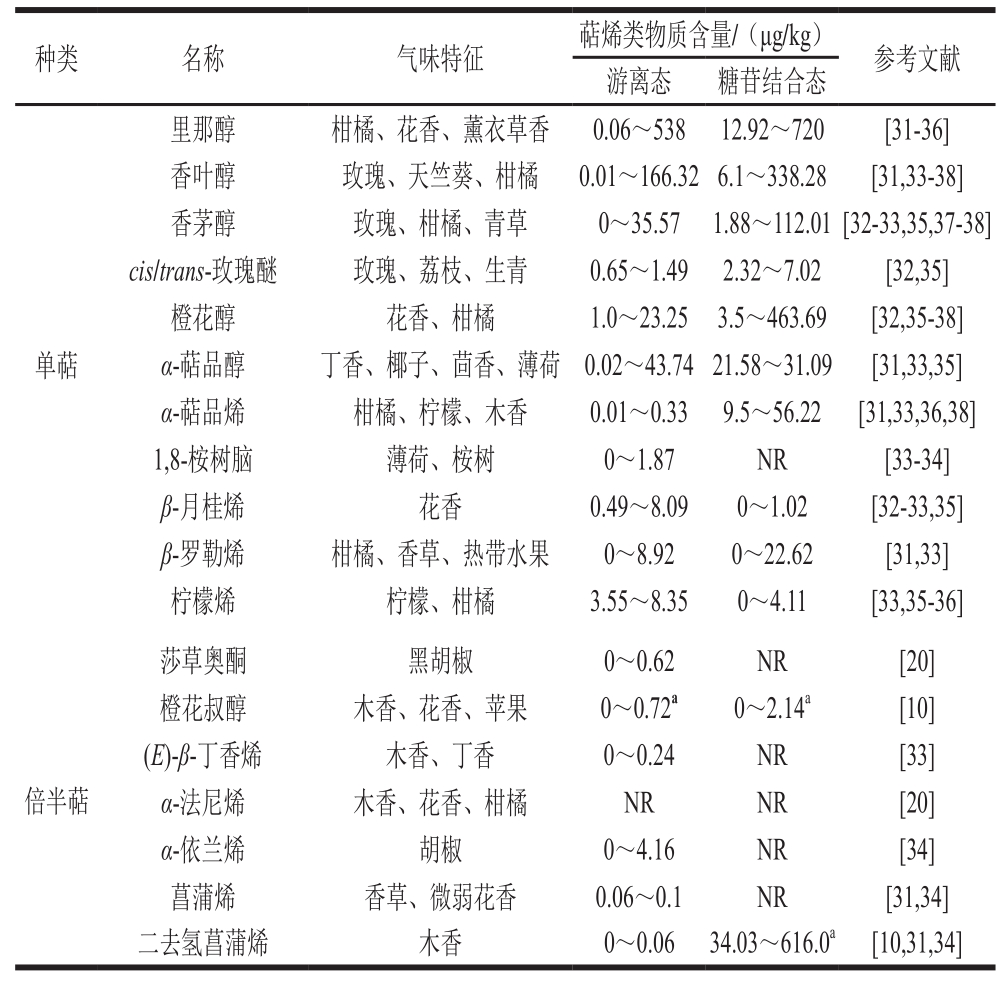
注:NR.目前尚未报道;a.单位为μg/L。
种类 名称 气味特征 萜烯类物质含量/(μg/kg) 参考文献游离态 糖苷结合态单萜里那醇 柑橘、花香、薰衣草香 0.06~538 12.92~720 [31-36]香叶醇 玫瑰、天竺葵、柑橘 0.01~166.326.1~338.28 [31,33-38]香茅醇 玫瑰、柑橘、青草 0~35.57 1.88~112.01[32-33,35,37-38]cis/trans-玫瑰醚 玫瑰、荔枝、生青 0.65~1.49 2.32~7.02 [32,35]橙花醇 花香、柑橘 1.0~23.25 3.5~463.69 [32,35-38]α-萜品醇 丁香、椰子、茴香、薄荷 0.02~43.7421.58~31.09 [31,33,35]α-萜品烯 柑橘、柠檬、木香 0.01~0.33 9.5~56.22 [31,33,36,38]1,8-桉树脑 薄荷、桉树 0~1.87 NR [33-34]β-月桂烯 花香 0.49~8.09 0~1.02 [32-33,35]β-罗勒烯 柑橘、香草、热带水果 0~8.92 0~22.62 [31,33]柠檬烯 柠檬、柑橘 3.55~8.35 0~4.11 [33,35-36]倍半萜莎草奥酮 黑胡椒 0~0.62 NR [20]橙花叔醇 木香、花香、苹果 0~0.72a 0~2.14a [10](E)-β-丁香烯 木香、丁香 0~0.24 NR [33]α-法尼烯 木香、花香、柑橘 NR NR [20]α-依兰烯 胡椒 0~4.16 NR [34]菖蒲烯 香草、微弱花香 0.06~0.1 NR [31,34]二去氢菖蒲烯 木香 0~0.06 34.03~616.0a [10,31,34]
2 葡萄酒酿造过程中萜烯的转化
酿酒葡萄果实发育过程中合成的萜烯类物质在葡萄酒发酵和陈酿过程中会发生一些变化——游离态萜烯会从果实中转移至葡萄醪和葡萄酒中,糖苷结合态萜烯会因为酿造过程酵母和乳酸菌中糖苷水解酶的作用以及陈酿过程中酒体较低pH值(2.9~3.8)而发生酸水解,释放出挥发性苷元;同时,在葡萄酒的pH值条件下(2.9~3.8),一些单萜组分会发生酸催化的重排,转化形成新的香气物质,使葡萄酒的风味更加丰富。非挥发性糖苷前体的水解以及某些挥发性化合物的化学重排被认为是促成陈年葡萄酒香气形成的两个关键现象[39]。
2.1 酶催化的糖苷结合态萜烯水解
对于与单糖苷结合的萜烯,β-葡萄糖苷酶可以直接断裂β-葡萄糖苷键从而释放萜烯配基,双糖苷和三糖苷的水解则更加复杂,还需要另一种糖基对应的糖苷酶的参与,如α-L-鼠李糖苷酶、α-L-芹菜糖苷酶和α-L-阿拉伯糖苷酶(图1)。果实中也存在一种β-葡萄糖内切酶,可以一步断开双糖苷释放萜烯[40],但在葡萄压榨成汁后形成的低pH值(pH 3.5左右)和高糖环境下,酶活性很低。糖苷酶水解可以增加葡萄酒中萜烯香气早在1996年就有报道,Gueguen等[41]研究发现,莫氏假丝酵母35M5N(Candida molischiana 35M5N)能够大量产生β-葡萄糖苷酶,且可以在较低的pH值(最适pH值3.5)和较高乙醇浓度条件下保持高活性,利用该酵母产生的β-葡萄糖苷酶处理pH 3.8、乙醇体积分数15%的麝香型葡萄酒时,可增加酒中橙花醇、里那醇、香叶醇、γ-萜品醇的浓度。
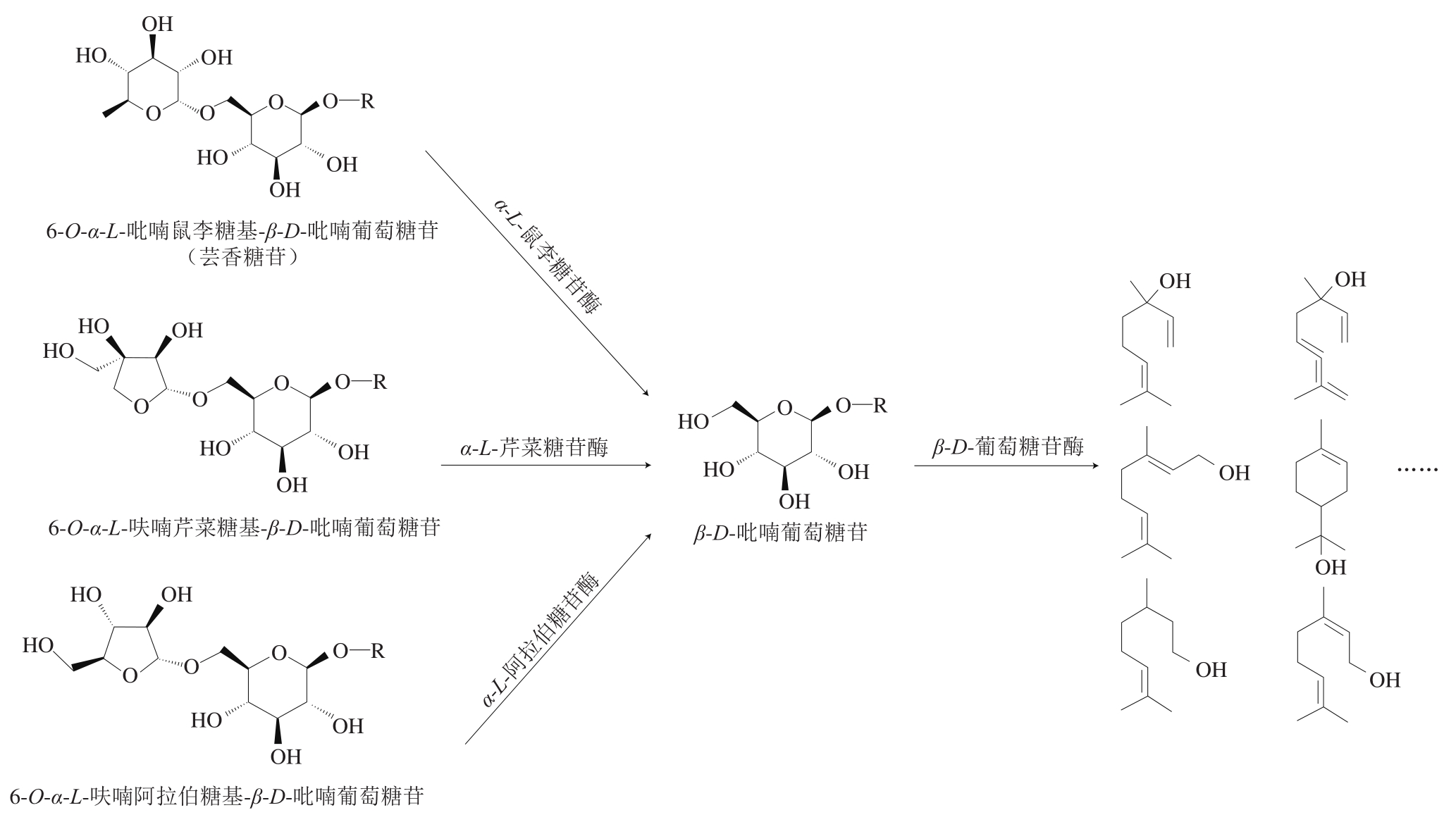
图1 酶催化的糖苷态萜烯水解
Fig. 1 Enzymatic hydrolysis of glycoside terpenes
干型葡萄酒的酿造工艺通常包含除梗破碎、压榨、乙醇发酵、苹果酸-乳酸发酵、浸渍、皮渣分离、倒罐等步骤,其中乙醇发酵和苹果酸-乳酸发酵过程中发挥作用的微生物——酿酒酵母、乳酸菌、细菌及一些非酿酒酵母大多数都具有糖苷酶活性[42-43],可以水解糖苷态萜烯。
2.1.1 乙醇发酵中相关酶对糖苷结合态萜烯的水解
许多酿酒酵母(Saccharomyces cerevisiae)本身具有内源糖苷酶,可以在发酵条件下表现出β-葡萄糖苷酶、α-阿拉伯呋喃糖苷酶和α-鼠李糖苷酶的活性,水解糖苷结合态的萜烯,增加葡萄酒中萜烯含量。但酿酒酵母中发现的大多数糖苷酶活性的最佳环境条件是pH 5.0~6.0、温度40~50 ℃[44]。在实际的葡萄酒发酵环境下,初期较高的糖浓度、整体上较低的pH值(2.9~3.8)和温度、乙醇发酵过程不断增加的乙醇浓度等均导致酿酒酵母中糖苷酶的活性受到强烈抑制,活性仅为原来的5%~15%[45-46],因此,酿酒酵母中的糖苷酶对糖苷态萜烯的水解作用十分有限。
相反,一些非酿酒酵母(non-Saccharomyces),如美极梅奇酵母(Metschnikowiapulcherrima)、德尔布有孢圆酵母(Torulaspora delbrueckii)、毕赤酵母(Pichia pastoris)、有孢汉逊酵母(Hanseniaspora)等中的糖苷酶,表现出对高糖、低pH值和较高浓度乙醇的耐受性,可以在葡萄酒发酵过程中保持中等以上水平的β-葡萄糖苷酶活性,在水解糖苷态萜烯方面显示出比酿酒酵母更高的效率[47–51]。一些非酿酒酵母菌株甚至具有多种糖苷酶活性,且能耐受一定的葡萄酒环境胁迫。Sabel等[52]对90 株从葡萄、葡萄醪或葡萄酒中分离出来的野生型酵母菌株(包括55 株酿酒酵母和35 株非酿酒酵母)进行分离和酶学测定,发现所检测的55 株酿酒酵母均未显示出β-葡萄糖苷酶活性,而非酿酒酵母中有23 株具有β-葡萄糖苷酶活性,其中从白色品种葡萄醪中分离得到的一株异常威克汉姆酵母AS1(Wickerhamomyces anomalus AS1)不仅能够产生β-D-葡萄糖苷酶,而且还能够产生高活性的β-D-吡喃木糖苷酶和α-L-阿拉伯呋喃糖苷酶,可同时水解单糖苷萜烯和双糖苷萜烯;更为重要的是,相对商业糖苷酶酶制剂,该菌株中的糖苷酶在干型葡萄酒中仍可保持较高的活性,在葡萄糖质量分数20%条件下仍有较低活性,对乙醇和糖均有较好的耐受能力,但更高的葡萄糖浓度下该菌株中糖苷酶活性也会受到抑制。非酿酒酵母虽然无法单独启动葡萄酒的乙醇发酵,但多项研究发现,在实际酿酒条件中利用具有糖苷酶活性的非酿酒酵母与酿酒酵母进行混合发酵,可以在保证发酵正常进行的同时增加葡萄酒中萜烯类香气物质的含量[53–56]。由于游离态萜烯在葡萄酒发酵过程中含量相对稳定,因此,可以利用发酵条件下非酿酒酵母中糖苷酶的理化性质相对于酿酒酵母糖苷酶更加稳定这一特点,促进糖苷态萜烯的酶水解释放,增强香气[57]。
2.1.2 苹果酸-乳酸发酵中相关酶对糖苷结合态萜烯的水解
苹果酸-乳酸发酵发生在乙醇发酵之后,相比酿酒酵母和非酿酒酵母,进行苹果酸-乳酸发酵的菌种在水解糖苷结合态萜烯方面不受到糖浓度的抑制,但需对较高的乙醇含量有很好的耐受性。参与苹果酸-乳酸发酵的乳酸菌主要包括酒酒球菌(Oenococcus oeni)、片球菌(Pediococcus damnosus)和植物乳杆菌(Lactobacillus plantarum)等[58],其中酒酒球菌和植物乳杆菌均被报道具有糖苷酶活性[59-60]。
酒酒球菌作为葡萄酒苹果酸-乳酸发酵阶段的传统启动菌种,对高乙醇体积分数、低pH值和高二氧化硫环境都有较高的耐受性[61],研究发现,酒酒球菌中的糖苷酶在底物特异性上比其他来源的糖苷酶更加广泛,与真菌糖苷酶优先释放伯醇萜烯(如香叶醇和橙花醇)相比,酒酒球菌可同时释放出伯醇和叔醇类(如里那醇、氧化里那醇和α-萜品醇)萜烯苷元[62-63]。Pérez-Martín等[64]的研究也验证了这一结论,以酒酒球菌CECT 7621为阴性对照,结果发现另外两株酒酒球菌Ab11和Da32对多种萜烯糖苷有更高的水解效率,苹果酸-乳酸发酵结束时橙花醇的浓度分别高出阴性对照组75%和77%,cis-呋喃型氧化里那醇的浓度分别提升了66%和144%,trans-吡喃型氧化里那醇的浓度分别增加了76%和150%,在释放糖苷结合态萜烯方面显示出很高的应用潜力。
近10 年来,植物乳杆菌受到越来越多的关注,已有研究表明,植物乳杆菌可作为酒酒球菌的替代者被用于启动葡萄酒的苹果酸-乳酸发酵,且可以表现出更加多样化的酶学特征[65–67],除具有多种糖苷酶活性外,还具有多种与感官品质相关的酶活性,如柠檬酸裂解酶、鞣酸酶、酯酶等,在葡萄酒香气、颜色等特征的改变中起重要作用[67]。Iorizzo等[68]对从葡萄酒中筛选出的11 株植物乳杆菌进行了鉴定,发现所有菌株都能够水解糖苷态萜烯,且在酒厂工业化生产条件下仍表现出很强的β-葡萄糖苷酶和α-葡萄糖苷酶活性,能够释放出柠檬烯、里那醇、氧化里那醇等萜烯苷元。
因此,在葡萄酒生产中,可以充分利用非酿酒酵母和植物乳杆菌中糖苷酶独有的特性,改善葡萄酒香气质量。
2.2 酸催化的糖苷态萜烯水解
在葡萄酒乙醇发酵过程中,整个发酵体系的pH值会不断降低,而在苹果酸-乳酸发酵阶段略有上升,最终发酵完成的葡萄酒pH值会稳定在2.9~3.8之间[69],这个pH值范围为水解糖苷提供了酸性环境。相较于酶促水解,酸水解不受葡萄糖和乙醇浓度等条件的抑制,理论上对于萜烯糖苷的释放比酶水解更有优势,但实际上,葡萄酒发酵过程中糖苷态萜烯的酸水解仅占总水解的很小一部分[70]。酸水解程度与pH值、温度、反应时间和糖苷配基的结构都有关系[71],酸水解实验表明,叔醇类(如里那醇、氧化里那醇和α-萜品醇)的糖苷比伯醇类(如香叶醇和橙花醇)的糖苷更易水解,这与在葡萄酒长时间储藏后观察到的现象类似[71]。在接近葡萄酒的pH值范围(2.9~3.8)内,当酸解温度为100 ℃,1~2 h内95%以上的萜烯糖苷可以被水解;当温度下降至40 ℃,酸解16~24 h才能达到25%左右的水解率;但同样温度下糖苷酶酶解24 h,几乎全部萜烯糖苷均可完全水解[38]。在实际生产中,红葡萄酒的发酵温度一般在20~32 ℃之间,白葡萄酒的发酵温度较低,一般在12~22 ℃之间,由于葡萄酒酿造和陈酿过程中的温度远低于上述实验中酸水解的温度,所以,葡萄酒中真实发生的酸水解是非常缓慢的。Loscos等[72]对比了AR 2000果胶酶水解(40 ℃、pH 5条件下水解16 h)、酸水解(100 ℃、pH 2.5条件下水解1 h)与进行乙醇发酵后酒中萜烯含量的变化,发现乙醇发酵后仅释放出少量萜烯香气,远少于酸水解和酶水解处理后的萜烯释放量。但对于一些陈酿潜力较好的葡萄酒而言,陈酿过程中发生的缓慢酸水解对提升香气品质依然有着十分重要的意义[9]。
2.3 酸催化的萜烯类物质单分子重排
有研究表明,用体积分数85%磷酸溶液处理香叶醇、橙花醇和里那醇时,会生成柠檬烯、α-萜品烯、异萜品油烯、γ-萜品烯和对伞花烃这4 种环状萜烯类物质[73];在其他低pH值的介质中,香叶醇、橙花醇也可以相应地转化为α-萜品醇和里那醇[38,74],这表明确实存在酸作用下的分子重排反应,使得萜烯物质之间发生相互转化。在葡萄汁中,不同的pH值和温度下经分子重排产生的单萜种类和组分比例是不同的[8],而在葡萄酒中,分子重排更多发生在pH值和温度相对稳定的陈酿期间,重排产物也相对稳定。
分子重排的关键环节是形成碳正离子中间体,进而经过水合、环化脱水、氢化物转移等反应转变为不同的反应产物,Wedler等[75]利用量子计算化学得出,酸性条件下,萜品基碳正离子中间体去质子化可形成柠檬烯,或通过水合作用形成α-萜品醇,再通过C=C双键的水合作用形成1,8-桉树脑的反应过程,与Fariña等[76]对‘丹娜’葡萄及葡萄酒进行氘标记实验确定的重排反应步骤一致。Waterhouse等[9]更加详细地描述了从里那醇转变为萜品基碳正离子中间体,进一步以相同机制重排形成1,8-桉树脑的过程(图2)。Yang Yu等[36]整合了前人的研究结果并结合‘媚丽’葡萄酒中萜烯的变化规律,提出了里那醇的分子重排机制,阐明了里那醇、香叶醇、α-萜品醇等单萜之间也存在相互转化,具体如下:里那醇可以通过亲核的1,3-转移(烯丙基)转化为香叶醇和橙花醇,而香叶醇也可以通过相同的方式逆向转化为里那醇;橙花醇可通过环化脱水生成α-萜品醇,再脱水可生成柠檬烯。此外,de Meireles等[77]发现倍半萜在酸性条件下也会发生重排反应,橙花叔醇可以通过形成橙花叔基碳正离子中间体转化为法尼醇(图3)。
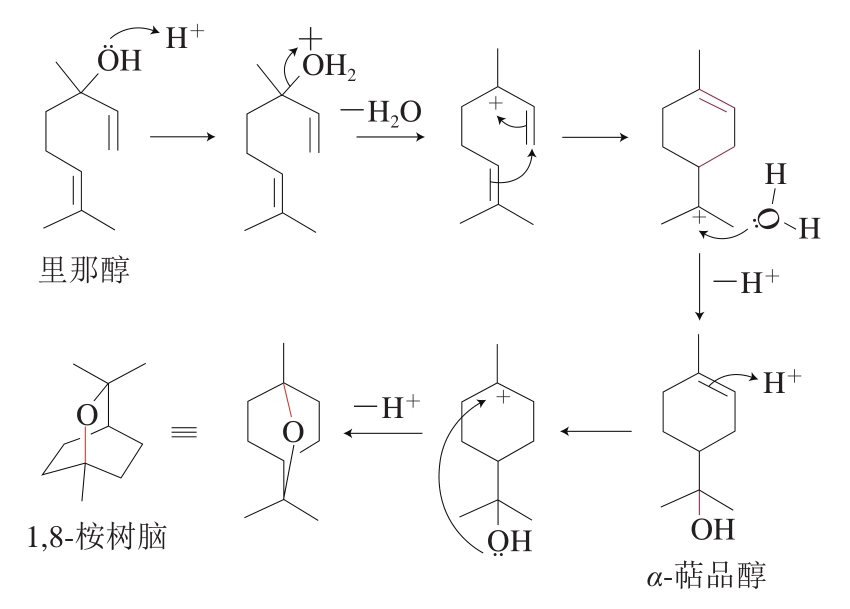
图2 里那醇在酸性条件下通过水解和环化生成1,8-桉树脑[9]
Fig. 2 Formation of 1,8-cineole from linalool through hydrolysis and intramolecular cyclization[9]
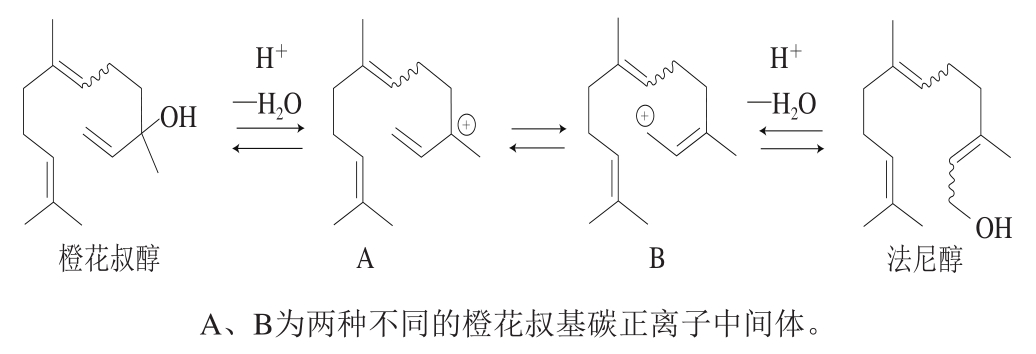
图3 酸催化橙花醇分子重排生成法尼醇[77]
Fig. 3 Schematic diagram of acid-catalyzed conversion of nerol and farnesol[77]
3 葡萄酒酿造过程中影响萜烯组分转化的因素
3.1 皮渣接触
由于酿酒葡萄果实中香气物质主要位于果皮中,在果肉中的含量非常少,发酵过程中皮渣接触(也称为浸渍)有利于果皮中香气物质浸出,从而增加葡萄酒中游离态萜烯和部分结合态萜烯的含量,且接触时间越长,酒中萜烯的含量增加越明显[78-79]。Baron等[78]研究表明,葡萄酒中萜烯含量与浸渍时间长短成正比,14 ℃下经过24 h皮渣接触后,葡萄醪中萜烯物质含量均上升,其中里那醇质量浓度从600 μg/L增加至1 014 μg/L,橙花醇和香叶醇含量均增至原来的两倍,其他萜烯类物质的含量也都在浸渍后有不同幅度增加。皮渣接触的温度也会影响酒中萜烯含量,葡萄酒生产过程中常用的浸渍方式有热浸渍(70 ℃以上)、冷浸渍(5~10 ℃)和常温浸渍(25~30 ℃)等[80],相比热浸渍和常温浸渍,冷浸渍工艺更有利于果实中萜烯的提取[81]和葡萄酒香气品质的提升,这可能是由于低温减少了香气物质的挥发散失,同时也避免了酵母菌、醋酸菌等微生物带来的不良风味[82-83]。因此,在皮渣接触过程中适当地延长浸渍时间、控制浸渍温度,有利于增加葡萄酒中萜烯含量,使葡萄酒具有更加浓郁的花果香气;也可以在发酵开始前采取压榨、添加果胶酶等方法促进酿酒葡萄果皮的裂解,使皮渣接触更加充分[9]。
3.2 外源糖苷酶的添加
糖苷酶可以水解无味的糖苷态萜烯,释放出萜烯,但通常情况下,发酵过程中使用的酿酒酵母和酒酒球菌、植物乳杆菌最主要的目的是完成乙醇发酵和苹果酸-乳酸发酵,实际生产中使用的菌种提供的内源糖苷酶对葡萄酒香气改善作用是较为微弱的,因此,葡萄酒生产中也常通过直接添加外源糖苷酶来增香,已经有一些比较成熟的商业糖苷酶制剂,例如,从黑曲霉(Aspergillus niger)中获得的AR2000糖苷酶[84]已广泛应用于葡萄酒的增香发酵中,也常用于糖苷态香气物质的检测[14,85-86]。但需要注意的是,在不同pH值、乙醇浓度和糖浓度下,不同糖苷酶制剂活性受到的影响不同[87]。因此,添加糖苷酶的时机也会影响对糖苷结合态萜烯的水解效果,鉴于葡萄糖对糖苷酶的抑制作用,通常认为在乙醇发酵后添加效果最佳[88]。
3.3 pH值
pH值与糖苷态萜烯的酸水解及随后发生的分子重排反应都有关系,较低的pH值下,酸水解效率提高[68],同时引发更广泛的分子重排,使得萜烯物质的种类和含量比例都发生改变。而且在葡萄酒pH值范围内,酸水解和分子重排更多地偏向于产生里那醇、橙花醇等对葡萄酒香气贡献有较重要作用的萜烯[8],而在更低的pH值情况下,产物更多地向1,4-桉树脑/1,8-桉树脑、罗勒烯醇等对香气贡献较小的萜烯物质转化。可以认为,随葡萄酒陈酿时间延长,糖苷态萜烯发生酸解和重排,使葡萄酒香气更加丰富。
3.4 温度
发酵和陈酿温度对葡萄酒中糖苷态萜烯的酶解和酸解均有重要的影响,从而间接影响着萜烯的释放和转化,不同发酵温度下,葡萄酒的香气特征也不同,例如,为了获得平衡的新鲜的果香,白葡萄酒的发酵温度通常低于红葡萄酒,浸渍时也更多采用冷浸渍的方式[89]。相比正常的陈酿条件(18 ℃持续1 年),在一些高温加速老化实验中,发现白葡萄酒中的花香果香会减弱,一些单萜在高温下可能会转变为其他种类的新物质而没有被检出[90]。Lukić等[91]发现,18~22 ℃长时间的浸渍和陈酿通常有利于单萜从果皮浸提和糖苷结合态萜烯的水解,但较低温度下酵母糖苷酶活性会受到抑制,不利于糖苷结合态萜烯的水解,因此在发酵过程中需要将温度维持在适宜水平。
4 结 语
萜烯类物质主要来自于酿酒葡萄果实,是葡萄酒花果香的重要来源。在葡萄酒酿造过程中,糖苷结合态萜烯会在酸性环境以及乙醇发酵和苹果酸乳酸发酵的相关菌种(如非酿酒酵母、酿酒酵母、酒酒球菌、植物乳杆菌等)中多种糖苷酶的作用下水解出挥发性萜烯,释放到葡萄酒中。在葡萄酒中,萜烯物质还会发生酸催化的分子重排,改变其在葡萄酒中的含量和相对比例。上述反应都会对葡萄酒的香气品质产生较大影响,因此,探明葡萄酒酿造过程中萜烯类物质的转化及其调控因素具有重要的生产实践意义。
目前关于发酵微生物对糖苷态萜烯香气释放的研究有很多报道,但应用于实际生产的并不多,非酿酒酵母、酒酒球菌等菌种或菌株差异都可以影响糖苷态香气的水解释放,对乙醇发酵和苹果酸-乳酸发酵后葡萄酒的香气特性有积极影响;因此,筛选合适的菌种或菌株,可以有针对性的改善葡萄酒香气品质。针对现有菌种产生的内源性糖苷酶在酿酒条件下活性不高的问题,未来的研究可以从多方面入手:一方面可以继续筛选在葡萄酒酿造环境中具有较高糖苷酶活性的酿酒酵母;另一方面应从解决酶活性本身出发,研究适合葡萄酒实际生产使用的固定化酶技术、细胞表面展示技术;另外,还需开展多菌种混合酿造对葡萄酒香气、颜色影响的理论研究和技术研发。
关于葡萄酒陈酿过程发生中的萜烯类物质分子重排虽然已经有较多报道,但现有研究中的陈酿时间往往较短,在更长的陈酿时间中,葡萄酒中萜烯类物质是否会发生更加丰富、复杂的变化,具体的影响因素有哪些,更详细、全面的反应机理等还有待进一步深入研究。
[1]BELITZ H, GROSCH W, SCHIEBERLE P. Food chemistry[M]. 4th ed. Berlin, Heidelberg: Springer, 2009: 340-402. DOI:10.1007/978-3-540-69934-7.
[2]NYKANEN L. Formation and occurrence of flavor compounds in wine and distilled alcoholic beverages[J]. American Journal of Enology and Viticulture, 1986, 37(1): 84-96.
[3]EBELER S E. Analytical chemistry: unlocking the secrets of wine flavor[J]. Food Reviews International, 2001, 17(1): 45-64.DOI:10.1081/FRI-100000517.
[4]HJELMELAND A K, EBELER S E. Glycosidically bound volatile aroma compounds in grapes and wine: a review[J]. American Journal of Enology and Viticulture, 2015, 66(1): 1-11. DOI:10.5344/ajev.2014.14104.
[5]安效辉, 苗瀛心, 陈倬, 等. 基于UPLC-Q-TOF-MS分析酵母对葡萄酒中糖苷态香气物质释放的影响[J]. 食品科学, 2020, 41(12):158-165. DOI:10.7506/spkx1002-6630-20190709-122.
[6]FERREIRA V, LOPEZ R. The actual and potential aroma of winemaking grapes[J]. Biomolecules, 2019, 9(12): 818. DOI:10.3390/biom9120818.
[7]MELE M A, KANG H M, LEE Y T, et al. Grape terpenoids: flavor importance, genetic regulation, and future potential[J]. Critical Reviews in Food Science and Nutrition, 2020, 61(9): 1429-1447. DOI:10.1080/10408398.2020.1760203.
[8]MATEO J J, JIMÉNEZ M. Monoterpenes in grape juice and wines[J].Journal of Chromatography A, 2000, 881(1/2): 557-567. DOI:10.1016/S0021-9673(99)01342-4.
[9]WATERHOUSE A L, SACKS G L, JEFFERY D W. Understanding wine chemistry[M]. Chichester, UK: John Wiley & Sons, Ltd., 2016:68-75. DOI:10.1002/9781118730720.
[10]LYU J, MA Y, XU Y, et al. Characterization of the key aroma compounds in Marselan wine by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission tests[J]. Molecules,2019, 24(16): 2978. DOI:10.3390/molecules24162978.
[11]BATTILANA J, COSTANTINI L, EMANUELLI F, et al. The 1-deoxy-D-xylulose 5-phosphate synthase gene co-localizes with a major QTL affecting monoterpene content in grapevine[J]. Theoretical and Applied Genetics, 2009, 118(4): 653-669. DOI:10.1007/s00122-008-0927-8.
[12]BATTILANA J, EMANUELLI F, GAMBINO G, et al. Functional effect of grapevine 1-deoxy-D-xylulose 5-phosphate synthase substitution K284N on Muscat flavour formation[J]. Journal of Experimental Botany,2011, 62(15): 5497-5508. DOI:10.1093/jxb/err231.
[13]YANG Xiaoxu, GUO Y, ZHU J, et al. Associations between the 1-deoxy-D-xylulose-5-phosphate synthase gene and aroma in different grapevine varieties[J]. Genes & Genomics, 2017, 39(10): 1059-1067.DOI:10.1007/s13258-017-0574-z.
[14]LI Xiangyi, WEN Yaqin, MENG Nan, et al. Monoterpenyl glycosyltransferases differentially contribute to production of monoterpenyl glycosides in two aromatic Vitis vinifera varieties[J].Frontiers in Plant Science, 2017, 8: 1226. DOI:10.3389/fpls.2017.01226.
[15]潘秋红, 段长青, 王军, 等. 葡萄酒化学[M]. 北京: 科学出版社, 2019:69-71.
[16]KALUA C M, BOSS P K. Comparison of major volatile compounds from Riesling and Cabernet Sauvignon grapes (Vitis vinifera L.)from fruitset to harvest: volatile compounds cultivar comparison[J].Australian Journal of Grape and Wine Research, 2010, 16(2): 337-348.DOI:10.1111/j.1755-0238.2010.00096.x.
[17]MAY B, LANGE B M, WÜST M. Biosynthesis of sesquiterpenes in grape berry exocarp of Vitis vinifera L.: evidence for a transport of farnesyl diphosphate precursors from plastids to the cytosol[J]. Phytochemistry,2013, 95: 135-144. DOI:10.1016/j.phytochem.2013.07.021.
[18]LI Z, HOWELL K, FANG Z, et al. Sesquiterpenes in grapes and wines:occurrence, biosynthesis, functionality, and influence of winemaking processes[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(1): 247-281. DOI:10.1111/1541-4337.12516.
[19]WOOD C, SIEBERT T E, PARKER M, et al. From wine to pepper:rotundone, an obscure sesquiterpene, is a potent spicy aroma compound[J]. Journal of Agricultural and Food Chemistry, 2008,56(10): 3738-3744. DOI:10.1021/jf800183k.
[20]DREW D P, ANDERSEN T B, SWEETMAN C, et al. Two key polymorphisms in a newly discovered allele of the Vitis vinifera TPS24 gene are responsible for the production of the rotundone precursor α-guaiene[J]. Journal of Experimental Botany, 2016, 67(3): 799-808.DOI:10.1093/jxb/erv491.
[21]HARNER A D, VANDEN HEUVEL J E, MARINI R P, et al. Modeling the impacts of weather and cultural factors on rotundone concentration in cool-climate Noiret wine grapes[J]. Frontiers in Plant Science, 2019,10: 1255. DOI:10.3389/fpls.2019.01255.
[22]WILLIAMS P J, STRAUSS C R, WILSON B, et al. Studies on the hydrolysis of Vitis vinifera monoterpene precursor compounds and model monoterpene β-D-glucosides rationalizing the monoterpene composition of grapes[J]. Journal of Agricultural and Food Chemistry,1982, 30(6): 1219-1223. DOI:10.1021/jf00114a054.
[23]FLAMINI R, MENICATTI M, ROSSO M D, et al. Combining liquid chromatography and tandem mass spectrometry approaches to the study of monoterpene glycosides (aroma precursors) in wine grape[J]. Journal of Mass Spectrometry, 2018, 53(9): 792-800. DOI:10.1002/jms.4212.
[24]SCHIEVANO E, D’AMBROSIO M, MAZZARETTO I, et al.Identification of wine aroma precursors in Moscato Giallo grape juice: a nuclear magnetic resonance and liquid chromatography-mass spectrometry tandem study[J]. Talanta, 2013, 116: 841-851.DOI:10.1016/j.talanta.2013.07.049.
[25]HJELMELAND A, ZWEIGENBAUM J, EBELER S. Profiling monoterpenol glycoconjugation in Vitis vinifera L. cv. Muscat of Alexandria using a novel putative compound database approach,high resolution mass spectrometry and collision induced dissociation fragmentation analysis[J]. Analytica Chimica Acta, 2015, 887:138-147. DOI:10.1016/j.aca.2015.06.026.
[26]GODSHAW J, HJELMELAND A K, ZWEIGENBAUM J, et al.Changes in glycosylation patterns of monoterpenes during grape berry maturation in six cultivars of Vitis vinifera[J]. Food Chemistry, 2019,297: 124921. DOI:10.1016/j.foodchem.2019.05.195.
[27]WANG X, SONG H, YANG Y, et al. Chemical profile of terpene glycosides from Meili grape detected by GC-MS and UPLC-Q-TOF-MS[J]. European Food Research and Technology, 2020:1-11. DOI:10.1007/s00217-020-03576-y.
[28]ILC T, WERCKREICHHART D, NAVROT N, et al. Meta-analysis of the core aroma components of grape and wine aroma[J]. Frontiers in Plant Science, 2016, 7: 1472-1472. DOI:10.3389/fpls.2016.01472.
[29]LIANG Z J, FANG Z X, PAI A, et al. Glycosidically bound aroma precursors in fruits: a comprehensive review[J]. Critical Reviews in Food Science and Nutrition, 2020, 2020: 1-29. DOI:10.1080/10408398.2020.1813684.
[30]SONG Hongcong, WANG Xingjie, LI Aihua, et al. Profiling terpene glycosides from Ecolly, Cabernet Gernischet, and Muscat Hamburg grapes by ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Journal of Food Science, 2020,85(7): 2032-2040. DOI:10.1111/1750-3841.15167.
[31]LUO J Q, BROTCHIE J, PANG M, et al. Free terpene evolution during the berry maturation of five Vitis vinifera L. cultivars[J]. Food Chemistry, 2019, 299: 125101. DOI:10.1016/j.foodchem.2019.125101.
[32]ZHANG H H, FAN P G, LIU C X, et al. Sunlight exclusion from Muscat grape alters volatile profiles during berry development[J]. Food Chemistry, 2014, 164: 242-250. DOI:10.1016/j.foodchem.2014.05.012.
[33]WANG J F, ABBEY T, KOZAK B, et al. Evolution over the growing season of volatile organic compounds in Viognier (Vitis vinifera L.)grapes under three irrigation regimes[J]. Food Research International,2019, 125: 108512. DOI:10.1016/j.foodres.2019.108512.
[34]ZHANG P Z, FUENTES S, SIEBERT T, et al. Terpene evolution during the development of Vitis vinifera L. cv. Shiraz grapes[J]. Food Chemistry, 2016, 204: 463-474. DOI:10.1016/j.foodchem.2016.02.125.
[35]FENOLL J, MANSO A, HELLIN P, et al. Changes in the aromatic composition of the Vitis vinifera grape Muscat Hamburg during ripening[J]. Food Chemistry, 2009, 114(2): 420-428. DOI:10.1016/j.foodchem.2008.09.060.
[36]YANG Yu, JIN G J, WANG X J, et al. Chemical profiles and aroma contribution of terpene compounds in Meili (Vitis vinifera L.) grape and wine[J]. Food Chemistry, 2019, 284: 155-161. DOI:10.1016/j.foodchem.2019.01.106.
[37]GARCÍA E, CHACÓN J L, MARTÍNEZ J, et al. Changes in volatile compounds during ripening in grapes of Airén, Macabeo and Chardonnay white varieties grown in La Mancha Region (Spain)[J].Food Science and Technology International, 2003, 9(1): 33-41.DOI:10.1177/1082013203009001006.
[38]DZIADAS M, JELEŃ H H. Comparison of enzymatic and acid hydrolysis of bound flavor compounds in model system and grapes[J]. Food Chemistry, 2016, 190: 412-418. DOI:10.1016/j.foodchem.2015.05.089.
[39]SLAGHENAUFI D, UGLIANO M. Norisoprenoids, sesquiterpenes and terpenoids content of Valpolicella wines during aging:investigating aroma potential in relationship to evolution of tobacco and balsamic aroma in aged wine[J]. Frontiers in Chemistry, 2018, 6:66. DOI:10.3389/fchem.2018.00066.
[40]刘吉彬. 葡萄萜烯类香气糖苷的质谱分析研究[D]. 杨凌: 西北农林科技大学, 2017: 2-3.
[41]GUEGUEN Y, CHEMARDIN P, JANBON G, et al. A very efficient β-glucosidase catalyst for the hydrolysis of flavor precursors of wines and fruit juices[J]. Journal of Agricultural and Food Chemistry, 1996,44(8): 2336-2340. DOI:10.1021/jf950360j.
[42]BELDA I, RUIZ J, ESTEBAN-FERNÁNDEZ A, et al. Microbial contribution to wine aroma and its intended use for wine quality improvement[J]. Molecules, 2017, 22(2): 189. DOI:10.3390/molecules22020189.
[43]BELDA I, RUIZ J, ALASTRUEYIZQUIERDO A, et al. Unraveling the enzymatic basis of wine “flavorome”: a phylo-functional study of wine related yeast species[J]. Frontiers in Microbiology, 2016, 7: 12.DOI:10.3389/fmicb.2016.00012.
[44]HERNÁNDEZ L F, ESPINOSA J C, FERNÁNDEZ-GONZÁLEZ M, et al. β-glucosidase activity in a Saccharomyces cerevisiae wine strain[J]. International Journal of Food Microbiology, 2003, 80(2):171-176. DOI:10.1016/S0168-1605(02)00149-6.
[45]POGORZELSKI E, WILKOWSKA A. Flavour enhancement through the enzymatic hydrolysis of glycosidic aroma precursors in juices and wine beverages: a review[J]. Flavour and Fragrance Journal, 2007,22(4): 251-254. DOI:10.1002/ffj.1784.
[46]张阳, 江璐, 郭志君, 等. 利用β-葡萄糖苷酶提高葡萄酒香气的研究进展[J]. 现代食品科技, 2020, 36(4): 316-324. DOI:10.13982/j.mfst.1673-9078.2020.4.041.
[47]LÓPEZ M C, MATEO J J, MAICAS S. Screening of β-glucosidase and β-xylosidase activities in four non-Saccharomyces yeast isolates:glycosidasic activities from wine yeast[J]. Journal of Food Science,2015, 80(8): C1696-C1704. DOI:10.1111/1750-3841.12954.
[48]BISOTTO A, JULIEN A, RIGOU P, et al. Evaluation of the inherent capacity of commercial yeast strains to release glycosidic aroma precursors from Muscat grape must: release of glycosidic aroma precursors[J]. Australian Journal of Grape and Wine Research, 2015,21(2): 194-199. DOI:10.1111/ajgw.12127.
[49]CORDERO-BUESO G, ESTEVE-ZARZOSO B, CABELLOS J M, et al.Biotechnological potential of non-Saccharomyces yeasts isolated during spontaneous fermentations of Malvar (Vitis Vinifera cv. L.)[J].European Food Research and Technology, 2013, 236(1): 193-207.DOI:10.1007/s00217-012-1874-9.
[50]BAFFI M A, MARTIN N, TOBAL T M, et al. Purification and characterization of an ethanol-tolerant β-glucosidase from sporidiobolus pararoseus and its potential for hydrolysis of wine aroma precursors[J]. Applied Biochemistry and Biotechnology, 2013, 171(7):1681-1691. DOI:10.1007/s12010-013-0471-0.
[51]HU K, ZHU X L, MU H, et al. A novel extracellular glycosidase activity from Rhodotorula mucilaginosa: its application potential in wine aroma enhancement[J]. Letters in Applied Microbiology, 2016,62(2): 169-176. DOI:10.1111/lam.12527.
[52]SABEL A, MARTENS S, PETRI A, et al. Wickerhamomyces anomalus AS1: a new strain with potential to improve wine aroma[J].Annals of Microbiology, 2014, 64(2): 483-491. DOI:10.1007/s13213-013-0678-x.
[53]HU K, QIN Y, TAO Y S, et al. Potential of glycosidase from non-Saccharomyces isolates for enhancement of wine aroma[J]. Journal of Food Science, 2016, 81(4): 935-943. DOI:10.1111/1750-3841.13253.
[54]AZZOLINI M, TOSI E, LORENZINI M, et al. Contribution to the aroma of white wines by controlled Torulaspora delbrueckii cultures in association with Saccharomyces cerevisiae[J]. World Journal of Microbiology and Biotechnology, 2015, 31(2): 277-293. DOI:10.1007/s11274-014-1774-1.
[55]LIU P T, LU L, DUAN C Q, et al. The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J]. LWT-Food Science and Technology, 2016, 71: 356-363. DOI:10.1016/j.lwt.2016.04.031.
[56]SADOUDI M, TOURDOT-MARÉCHAL R, ROUSSEAUX S, et al.Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J]. Food Microbiology,2012, 32(2): 243-253. DOI:10.1016/j.fm.2012.06.006.
[57]PADILLA B, GIL J V, MANZANARES P. Past and future of non-Saccharomyces yeasts: from spoilage microorganisms to biotechnological tools for improving wine aroma complexity[J].Frontiers in Microbiology, 2016, 7: 411. DOI:10.3389/fmicb.2016.00411.
[58]薛雪. 宁夏银川产区葡萄酒优良酒酒球菌的筛选及其发酵性能的研究[D]. 杨凌: 西北农林科技大学, 2018: 1-5.
[59]CAPPELLO M S, ZAPPAROLI G, LOGRIECO A, et al. Linking wine lactic acid bacteria diversity with wine aroma and flavour[J].International Journal of Food Microbiology, 2017, 243: 16-27.DOI:10.1016/j.ijfoodmicro.2016.11.025.
[60]HERNANDEZ-ORTE P, CERSOSIMO M, LOSCOS N, et al. Aroma development from non-floral grape precursors by wine lactic acid bacteria[J]. Food Research International, 2009, 42(7): 773-781.DOI:10.1016/j.foodres.2009.02.023.
[61]BATTISTELLI N, PERPETUINI G, PERLA C, et al. Characterization of natural Oenococcus oeni strains for Montepulciano d’Abruzzo organic wine production[J]. European Food Research and Technology,2020, 246: 1031-1039. DOI:10.1007/s00217-020-03466-3.
[62]MICHLMAYR H, NAUER S, BRANDES W, et al. Release of wine monoterpenes from natural precursors by glycosidases from Oenococcus oeni[J]. Food Chemistry, 2012, 135: 80-87.DOI:10.1016/j.foodchem.2012.04.099.
[63]UGLIANO M, GENOVESE A, MOIO L. Hydrolysis of wine aroma precursors during malolactic fermentation with four commercial starter cultures of Oenococcus oeni[J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5073-5078. DOI:10.1021/jf0342019.
[64]PÉREZ-MARTÍN F, IZQUIERDO-CAÑAS P M, SESEÑA S, et al.Aromatic compounds released from natural precursors by selected Oenococcus oeni strains during malolactic fermentation[J]. European Food Research and Technology, 2015, 240(3): 609-618. DOI:10.1007/s00217-014-2361-2.
[65]BRAVO-FERRADA B M, HOLLMANN A, DELFEDERICO L, et al.Patagonian red wines: selection of lactobacillus plantarum isolates as potential starter cultures for malolactic fermentation[J]. World Journal of Microbiology and Biotechnology, 2013, 29(9): 1537-1549.DOI:10.1007/s11274-013-1337-x.
[66]BRIZUELA N S, BRAVO-FERRADA B M, LA HENS D V, et al.Comparative vinification assays with selected patagonian strains of Oenococcus oeni and lactobacillus plantarum[J]. LWT-Food Science and Technology, 2017, 77: 348-355. DOI:10.1016/j.lwt.2016.11.023.
[67]BRIZUELA N, TYMCZYSZYN E E, SEMORILE L C, et al.Lactobacillus plantarum as a malolactic starter culture in winemaking:a new (old) player?[J]. Electronic Journal of Biotechnology, 2019, 38:10-18. DOI:10.1016/j.ejbt.2018.12.002.
[68]IORIZZO M, TESTA B, LOMBARDI S J, et al. Selection and technological potential of lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release[J]. LWT-Food Science and Technology, 2016, 73: 557-566. DOI:10.1016/j.lwt.2016.06.062.
[69]OBREQUE-SLIER E, ESPÍNOLA-ESPÍNOLA V, LÓPEZ-SOLÍS R. Wine pH prevails over buffering capacity of human saliva[J].Journal of Agricultural and Food Chemistry, 2016, 64(43): 8154-8159.DOI:10.1021/acs.jafc.6b03013.
[70]LOSCOS N, HERNÁNDEZ-ORTE P, CACHO J, et al. Release and formation of varietal aroma compounds during alcoholic fermentation from nonfloral grape odorless flavor precursors fractions[J]. Journal of Agricultural and Food Chemistry, 2007, 55(16): 6674-6684.DOI:10.1021/jf0702343.
[71]SARRY J, GUNATA Z. Plant and microbial glycoside hydrolases:volatile release from glycosidic aroma precursors[J]. Food Chemistry,2004, 87(4): 509-521. DOI:10.1016/j.foodchem.2004.01.003.
[72]LOSCOS N, HERNÁNDEZ-ORTE P, CACHO J, et al. Comparison of the suitability of different hydrolytic strategies to predict aroma potential of different grape varieties[J]. Journal of Agricultural and Food Chemistry, 2009, 57(6): 2468-2480. DOI:10.1021/jf803256e.
[73]MCCORMICK J P, BARTON D L. Studies in 85% H3PO4: II on the role of the α-terpinyl cation in cyclic monoterpene genesis[J]. Tetrahedron,1978, 34(3): 325-330. DOI:10.1016/S0040-4020(01)93587-2.
[74]SKOUROUMOUNIS G K, SEFTON M A. Acid-catalyzed hydrolysis of alcohols and their β-D-glucopyranosides[J]. Journal of Agricultural and Food Chemistry, 2000, 48(6): 2033-2039. DOI:10.1021/jf9904970.
[75]WEDLER H, PEMBERTON R, TANTILLO D. Carbocations and the complex flavor and bouquet of wine: mechanistic aspects of terpene biosynthesis in wine grapes[J]. Molecules, 2015, 20(6): 10781-10792.DOI:10.3390/molecules200610781.
[76]FARIÑA L, BOIDO E, CARRAU F, et al. Terpene compounds as possible precursors of 1,8-cineole in red grapes and wines[J].Journal of Agricultural and Food Chemistry, 2005, 53(5): 1633-1636.DOI:10.1021/jf040332d.
[77]DE MEIRELES A L P, DOS SANTOS COSTA M, DA SILVA ROCHA K A,et al. Heteropoly acid catalyzed cyclization of nerolidol and farnesol:synthesis of α-bisabolol[J]. Applied Catalysis A: General, 2015, 502:271-275. DOI:10.1016/j.apcata.2015.06.022.
[78]BARON M, PRUSOVA B, TOMASKOVA L, et al. Terpene content of wine from the aromatic grape variety ‘Irsai Oliver’ (Vitis vinifera L.)depends on maceration time[J]. Open Life Sciences, 2017, 12(1): 42-50. DOI:10.1515/biol-2017-0005.
[79]YILMAZTEKIN M, KOCABEY N, HAYALOGLU A. Effect of maceration time on free and bound volatiles of red wines from cv.Karaoğlan (Vitis vinifera L.) grapes grown in Arapgir, Turkey[J].Journal of Food Science, 2015, 80(3): C556-C563. DOI:10.1111/1750-3841.12767.
[80]李华, 王华, 袁春龙, 等. 葡萄酒工艺学[M]. 北京: 科学出版社, 2007:159-176.
[81]STOICA F, MUNTEAN C. Differences in Muscat wine aroma composition depending maceration and fermentation processes[J].Romanian Biotechnological Letters, 2015, 20(2): 9.
[82]JAGATIĆ KORENIKA A M, MASLOV L, JAKOBOVIĆ S, et al.Comparative study of aromatic and polyphenolic profiles of Croatian white wines produced by cold maceration[J]. Czech Journal of Food Sciences, 2018, 36(6): 459-469. DOI:10.17221/448/2017-CJFS.
[83]LUAN Y, ZHANG B Q, DUAN C Q, et al. Effects of different pre-fermentation cold maceration time on aroma compounds of Saccharomyces cerevisiae co-fermentation with Hanseniaspora opuntiae or Pichia kudriavzevii[J]. LWT-Food Science and Technology, 2018, 92: 177-186. DOI:10.1016/j.lwt.2018.02.004.
[84]LIU J, ZHU X L, ULLAH N, et al. Aroma glycosides in grapes and wine[J]. Journal of Food Science, 2017, 82(2): 248-259.DOI:10.1111/1750-3841.13598.
[85]WEN Y Q, ZHONG G Y, GAO Y, et al. Using the combined analysis of transcripts and metabolites to propose key genes for differential terpene accumulation across two regions[J]. BMC Plant Biology, 2015,15(1): 240. DOI:10.1186/s12870-015-0631-1.
[86]WANG Y, HE Y N, HE L, et al. Changes in global aroma profiles of Cabernet Sauvignon in response to cluster thinning[J]. Food Research International, 2019, 122: 56-65. DOI:10.1016/j.foodres.2019.03.061.
[87]DE ANDRADES D, GRAEBIN N G, AYUB M A Z, et al. Physicochemical properties, kinetic parameters, and glucose inhibition of several beta-glucosidases for industrial applications[J]. Process Biochemistry, 2019, 78: 82-90. DOI:10.1016/j.procbio.2019.01.008.
[88]CLAUS H, MOJSOV K. Enzymes for wine fermentation: current and perspective applications[J]. Fermentation, 2018, 4(3): 52.DOI:10.3390/fermentation4030052.
[89]DEED R C, FEDRIZZI B, GARDNER R C. Influence of fermentation temperature, yeast strain, and grape juice on the aroma chemistry and sensory profile of Sauvignon Blanc wines[J]. Journal of Agricultural and Food Chemistry, 2017, 65(40): 8902-8912. DOI:10.1021/acs.jafc.7b03229.
[90]SCRIMGEOUR N, NORDESTGAARD S, LLOYD N D R, et al.Exploring the effect of elevated storage temperature on wine composition[J]. Australian Journal of Grape and Wine Research, 2015,21(Suppl 1): 713-722. DOI:10.1111/ajgw.12196.
[91]LUKIĆ I, JEDREJČIĆ N, GANIĆ K K, et al. Phenolic and aroma composition of white wines produced by prolonged maceration and maturation in wooden barrels[J]. Food Technology and Biotechnology,2015, 53(4): 407-418. DOI:10.17113/ftb.53.04.15.4144.