白酒是世界上最古老的蒸馏酒之一,根据香气成分分为酱香型、浓香型和清香型三大香型白酒。清香型白酒是历史最久、覆盖面很广的白酒种类,而小曲清香型白酒是我国清香型白酒的重要组成,由酿酒小曲酿造生产。传统小曲多以大米、米糠、麸皮为原材料,经人工接种曲母或根霉、酵母菌培养而成,因曲块体积小得名。小曲制作过程是开放式的,容易受到自然环境因素的影响。复配小曲是相对于传统小曲而言,由多种霉菌制曲后与功能酵母复合配制成的小曲。复配小曲可通过多种功能微生物的协同发酵,解决单一微生物酿酒小曲酿造风味欠佳的问题。印度毛霉与米根霉协同发酵米酒可以提高米酒品质,改善酒体香气融合和协调[1]。纯种根霉曲与酿酒酵母复配,提高了酒曲的糖化能力、发酵能力和酯化能力[2]。
早期微生物多样性研究多利用传统微生物培养技术进行,随着分子生物技术的快速发展,聚合酶链式反应-变性梯度凝胶电泳和高通量测序技术被应用于分析微生物的群落多样性。其中高通量测序技术快速发展,具有较高的安全性和准确性,越来越多地被用于分析样品微生物的丰度和多样性[3]。近年来,高通量测序技术较多应用在大曲酒的研究中,包括大曲、窖泥和酒醅中微生物多样性和结构[4-7],但是对清香型白酒特别是小曲清香型白酒酿造过程中的微生物多样性和群落结构研究较少。周森等[8]利用高通量测序手段解析了11 份清香型大曲微生物的多样性,结果表明大曲真菌多样性较为一致,而细菌的多样性较为丰富。宁亚丽等[9]对朝鲜族传统米酒及酒曲微生物群落多样性进行分析,酒曲中的优势菌种为假单胞菌属和肠杆菌属,而米酒发酵阶段乳杆菌属成为一种优势菌。唐佳代等[10]利用高通量测序技术分析了贵州地区酿酒小曲细菌的多样性,贵州地区酿酒小曲优势细菌为芽孢杆菌、肠杆菌、乳酸杆菌、不动杆菌和片球菌。Wang Jie等[11]利用高通量测序技术分析了中国华西、湖北和四川传统小曲中细菌的群落结构,结果表明,小曲中的细菌主要是乳杆菌属、芽孢杆菌属、不动杆菌属和葡糖杆菌属。Dong Weiwei等[12]利用高通量测序分析了传统小曲和纯培养小曲微生物发酵过程中的变化规律。Wu Hechuan等[3]分析了我国3 个不同地区常用的小曲,发现细菌群落结构比真菌群落相对复杂,小曲细菌和真菌多样性和群落结构不同造成了不同产地小曲风味的不同。Tang Qiuxiang等[13]探究了小曲微生物多样性与代谢产物之间的关系,微生物群落多样性的差异导致了小曲酒挥发性物质的差异。在小曲白酒的发酵过程中,小曲是小曲白酒酿造微生物的重要来源,环境微生物群也是发酵微生物群的重要来源之一[14]。目前利用高通量测序研究小曲主要集中在各地小曲微生物多样性的差别上,在发酵过程中微生物群落结构及多样性方面研究较少。Dong Weiwei等[12]虽然通过高通量测序分析了纯培养小曲微生物的变化,但是只分析了细菌菌群的变化规律,对真菌菌群结构及变化规律没有研究。
根据浓香型白酒和酱香型白酒的研究,细菌菌群对白酒产量和品质起重要作用[4]。细菌能够代谢产生酸类、醛类等物质影响白酒风味,也可通过淀粉酶、酯化酶的合成影响白酒的出酒率和香气成分[15],小曲中功能细菌也以芽孢杆菌居多[16]。本研究通过纯种复配小曲,研究小曲酿造过程中细菌的多样性和变化规律,可以更好地了解小曲白酒功能细菌的来源及作用,对发酵过程中的功能菌进行深度挖掘并将其应用于小曲白酒酿造,对提高小曲酒品质有良好的促进。研究旨在为后续利用开发复配小曲微生物资源以及提高复配小曲白酒品质提供研究基础。
1 材料与方法
1.1 材料与试剂
本实验样品均采集自重庆市望仙酒业有限公司制酒车间,海拔900 m,小曲白酒原料为糯高粱。
十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)基因组DNA提取试剂盒 赛默飞世尔科技公司;琼脂糖凝胶DNA回收试剂盒 德国Qiagen公司;TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒 美国Illumina公司;Phusion® High-Fidelity PCR Master Mix with GC Buffer 美国New England Biolabs公司。
1.2 仪器与设备
恒温水浴锅 上海恒跃医疗器械有限公司;超净工作台 上海智城分析仪器有限公司;台式高速冷冻离心机德国Beckman公司;聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像系统 美国伯乐公司;水平电泳仪 北京六一仪器厂;NovaSeq 6000测序系统 美国Illumina公司;涡旋混合器 德国IKA公司;NanoDrop 2000超微量分光光度计 美国Thermo公司。
1.3 方法
1.3.1 样品制备与收集
将黑曲霉、黑根霉、米根霉和米曲霉的霉菌孢子分别接种到已灭菌带有麸皮的培养瓶中,30 ℃培养24~48 h,待麸皮表面长满菌丝时,扣瓶培养3~6 d,待麸皮全部长满菌丝取出,在40 ℃干燥4 h,将黑曲霉、黑根霉、米根霉和米曲霉按照质量比7∶2∶3∶1混匀制备成复配小曲,按照高粱投料干质量的0.4%进行下曲。
高粱经泡粮、蒸粮、摊凉、下曲、拌匀、收堆糖化24 h后于2019年12月17日入窖池并进行泥封,窖池为水泥材质,发酵周期为7 d,入窖池当天温度为8~13 ℃,相对湿度为76%~80%。入窖池前开始采集样品,当天记为采样的第0天,标记为D0。由于发酵周期短,在发酵前期微生物种类及丰度变化较大,发酵后期趋于稳定变化相对较小,所以在入窖池后前3 d每天取样,发酵后期第5天和第7天分别进行采样,采样点为酒醅表面以下30 cm左右,每次采样约50 g,标记为D1、D2、D3、D5、D7。每次样品取2 个重复,上述样品采集后迅速置于液氮中冷冻,之后于-80 ℃超低温冰箱中保藏。
1.3.2 样品总DNA提取及PCR
采用CTAB方法对样品基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和质量浓度,取适量的样品DNA于离心管中,使用无菌水稀释至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物,New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR。
1.3.3 PCR扩增及测序
细菌PCR扩增引物:515F(5’-GTGYCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACNVGGGTWTCTAA-3’);真菌PCR扩增引物:1737F(5’-GGAAGTAAAAGTCGTAACAAGG-3’)和2043R(5’-GCTGCGTTCTTCATCGATGC-3’)。PCR体系:10×Buffer 2 μL,dNTP 2 μL,正反引物各0.8 μL,Phusion DNA聚合酶0.2 μL,ddH2O补水至20 μL。PCR条件:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃延伸10 min。
1.3.4 高通量测序
使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和real-time PCR定量,文库合格后,使用NovaSeq 6000进行上机测序。分别对细菌V4区和真菌ITS1区序列进行测序分析(北京诺禾致源科技股份有限公司)。
1.4 数据处理
基于Illumina NovaSeq 6000测序平台,使用FLASH对每个样品的reads进行拼接,得到的拼接序列为原始数据,经过严格的过滤处理得到高质量数据,经过Tags截取和长度过滤得到最终有效数据。利用Uparse软件对所有样品的有效数据进行聚类,默认以97%的一致性将序列聚类成为可操作分类单元(operational taxonomic unit,OTU)的代表序列。对OTU序列进行物种注释,用Mothur方法比对数据库进行物种注释分析,同时计算该OTU在各样品中的相对含量。使用Qiime软件对样品的α多样性指数进行分析,使用R软件绘制群落组成图。
2 结果与分析
2.1 细菌多样性分析
为研究各样品的物种组成,对所有样品的有效序列以97%的一致性进行OTU聚类,然后对OTU的序列进行物种注释。16S rRNA V4区高通量测序结果经过滤和双端拼接后,共得到376 126 条有效序列,通过聚类得到2 387 个OTU。为直观显示小曲白酒发酵过程中的共有OTU和特有OTU,对所有小曲酒样细菌的OTU进行统计和比较。由图1可知,小曲酿造过程中共有OTU为178 个。在入窖池前,样品中特有的OTU数为171 个,进入窖池发酵后,OTU数快速下降,发酵第5天特有OTU数仅为2 个。而发酵结束后,样品在环境中获得了大量的菌体,特有OTU增加为418 个。再将每个OTU与细菌分类学数据库进行比对,得到每个OTU的物种注释,共注释得到35 个门、378 个属和216 个种水平的细菌。复配小曲由4 种霉菌组成,酿酒车间可能是发酵细菌菌群的重要来源,这也说明了环境中微生物菌群的多样性。
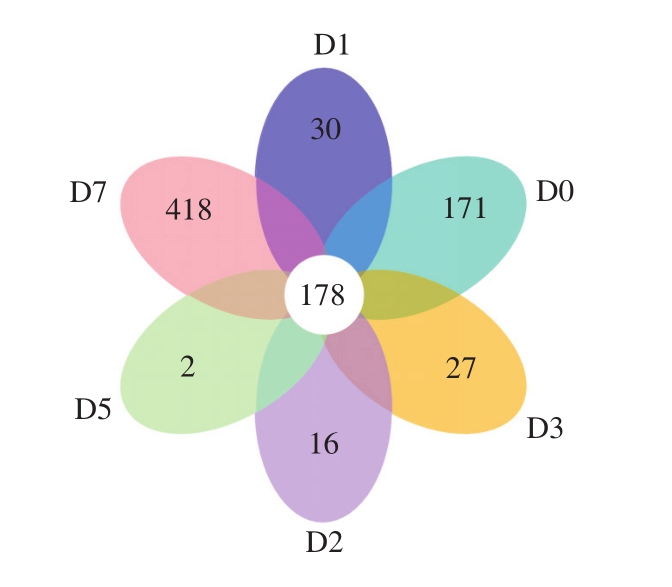
图1 小曲发酵酒样细菌OTU的统计和比较
Fig.1 Unique and shared bacterial OTUs among different times of fermentation
α多样性测定结果见表1。每个样品的覆盖率、Chao1指数和Shannon指数分别用于评估物种的测序深度、丰度和多样性。覆盖率结果表明测序数据能够覆盖目前状态下样品中细菌的种类,酿造过程中样品中覆盖率均不低于0.996,说明样品中被测出的概率较高,能真实反映样品中细菌物种丰度及多样性[10]。OTU数可以代表样品物种的丰度[9],ACE指数用来估计群落中OTU数目。Chao1指数是群落丰度指数,指数越大,表明样品中微生物群落丰度越高。小曲白酒发酵7 d,样品中OTU数、ACE指数和Chao1指数在发酵中第1天有所增加,其后逐渐降低,在发酵第5天为最低。Shannon指数是群落分布多样性指数,指数越大,表明样品微生物多样性越高。Simpson指数同样可用于估算样品中微生物多样性指数,数值越大,群落多样性越低。物种丰富度和物种多样性都是发酵第1天最高,第5天最低。
表1 小曲发酵酒样细菌α多样性指数测定结果
Table 1 Bacterial α-diversity indexes
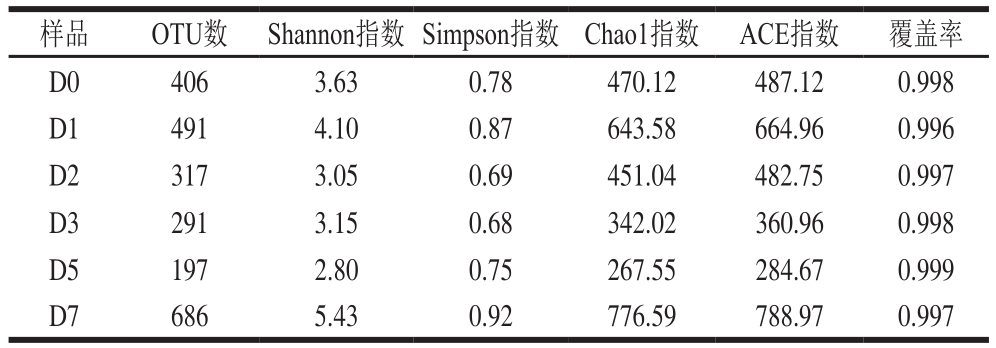
样品 OTU数 Shannon指数 Simpson指数 Chao1指数 ACE指数 覆盖率D0 406 3.63 0.78 470.12 487.12 0.998 D1 491 4.10 0.87 643.58 664.96 0.996 D2 317 3.05 0.69 451.04 482.75 0.997 D3 291 3.15 0.68 342.02 360.96 0.998 D5 197 2.80 0.75 267.55 284.67 0.999 D7 686 5.43 0.92 776.59 788.97 0.997
2.2 细菌群落结构差异性分析
2.2.1 基于门水平小曲白酒酿造中群落结构分析
在门水平下,小曲酒样品一共鉴定出35 个门类细菌物种,图2显示丰度水平前10的物种,其他物种合并为others。由图2可知,主要的细菌优势菌门分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)。在发酵前期,优势菌为厚壁菌门和变形菌门,随着小曲白酒的发酵,变形菌门相对丰度下降,厚壁菌门相对丰度占绝对优势。这可能因为变形菌门的有些好氧菌可能在低氧、酸性和高醇的环境中难以生存[9]。而厚壁菌门的乳酸菌可以适应这种环境,这也说明厚壁菌门在小曲白酒发酵中发挥了重要作用。
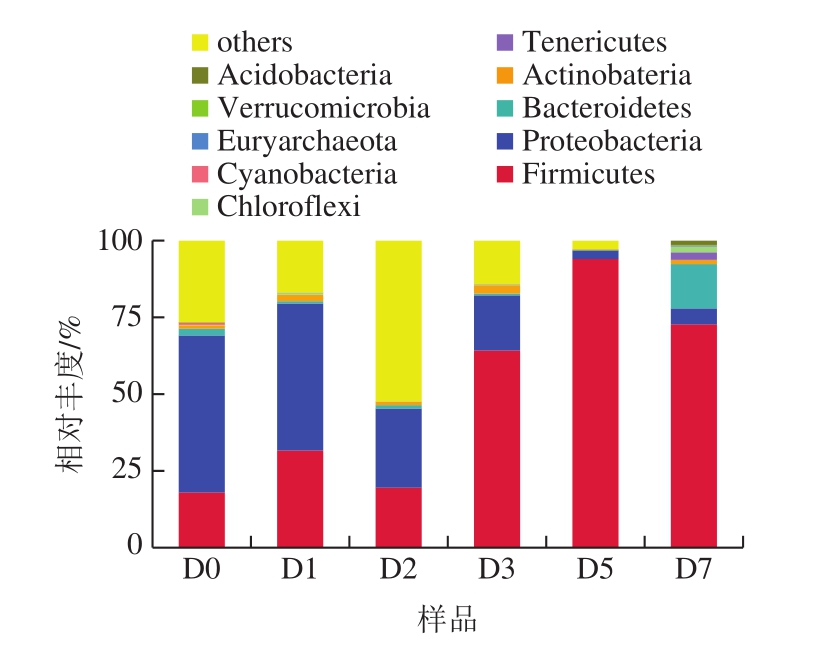
图2 基于门水平小曲发酵酒样的细菌群落结构
Fig.2 Bacterial community structure at phylum level
2.2.2 基于属水平小曲白酒酿造中群落结构分析
在属水平下,小曲酒样品共检测出378 个属细菌物种,图3显示相对丰度前10的物种,其他物种合并为others。由图3可知,相对丰度排名前10为乳杆菌属(Lactobacillus)、不明立克次体菌属(unidentified Rickettsiales)、亮光素体属(Leuconostoc)、魏斯氏菌属(Weissella)、普氏菌属(Prevotellaceae)、泛菌属(Pantoea)、乳球菌属(Lactococcus)、芽孢杆菌属(Bacillus)、赤藓菌属(Erysipelatoclostridium)、梭菌属(Clostridioides)。进入窖池发酵前2 d乳杆菌属相对丰度变化不大,发酵3 d后乳杆菌属菌相对丰度迅速增加,在发酵第5天达到最高。隶属于乳酸菌的乳杆菌属、乳球菌属和魏斯氏菌随着发酵进行,在样品中的相对丰度大幅增加,成为小曲酒样品的优势菌,特别是乳杆菌属。而立克次体菌属在进入窖池前占比较大,随着发酵的进行,其占比不断减少。魏斯氏菌属相对丰度在发酵前2 d先增加后又减少。泛菌属菌在发酵第1天相对丰度有所增加,其后不断降低。泛菌属菌群是重要的具有代谢和发酵类型的化能异养菌,是芝麻香型高温大曲[17]和酱香型郎酒高温大曲[4]作为第一优势菌群存在。
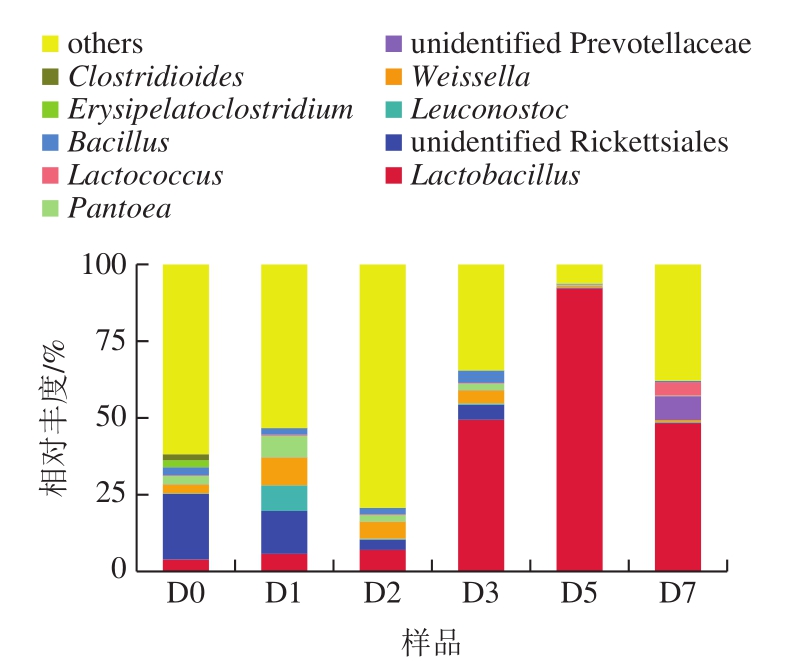
图3 基于属水平小曲发酵酒样的细菌群落结构
Fig.3 Bacterial community structure at genus level
在传统小曲和纯种培养小曲研究中,发酵周期为15 d,9~15 d乳酸菌相对丰度超过枯草芽孢杆菌属成为优势菌属[12]。在本研究中,由于发酵周期较短,乳杆菌属在发酵3 d后已经成为优势菌。乳酸菌作为白酒发酵过程中的优势细菌,其种类、数量以及动态变化对于白酒酿造过程至关重要[18]。乳酸菌大多是兼性厌氧或厌氧菌[19],在发酵中具有重要的生物学结构调节功能[20]。随着发酵时间的延长,发酵体系内酸度和乙醇浓度的升高,氧气含量逐渐减少,大部分的微生物不能耐受高酸度、高乙醇浓度、厌氧等不利条件而逐渐衰亡,而乳酸菌则成为绝对优势的细菌。小曲酒体系中的乳酸菌在利用糖产生乳酸、乙酸等。乳酸和乙酸可以和乙醇发生反应生产乳酸乙酯和乙酸乙酯,其中乙酸乙酯是小曲白酒中重要的风味物质。同时乳酸菌可以产生细菌素等拮抗物质以及与其他微生物竞争底物等途径影响其他微生物的生长[5,21-22]。种类丰富的乳酸菌在小曲白酒酿造发酵后期占据绝对优势地位,影响小曲白酒的品质。
2.3 真菌多样性分析
ITS1区高通量测序结果经过滤和双端拼接后,共得到391 303 条有效序列,通过聚类得到177 个OTU。为直观显示小曲白酒发酵过程中的真菌共有OTU和特有OTU,对所有小曲酒糟醅样品的OTU进行统计和比较。由图4可知,酿造过程中糟醅样品共有的OTU为20 个。在入窖池前,样品中特有的OTU数为3 个,进入窖池发酵后,特有OTU数都比较低,只有1~2 个。而发酵结束后,样品在环境中获得了大量菌体,特有OTU增加为19 个。再将每个OTU与真菌分类学数据库进行比对,得到每个OTU的物种注释,共注释得到4 个门、38 个属和47 个种水平的真菌。
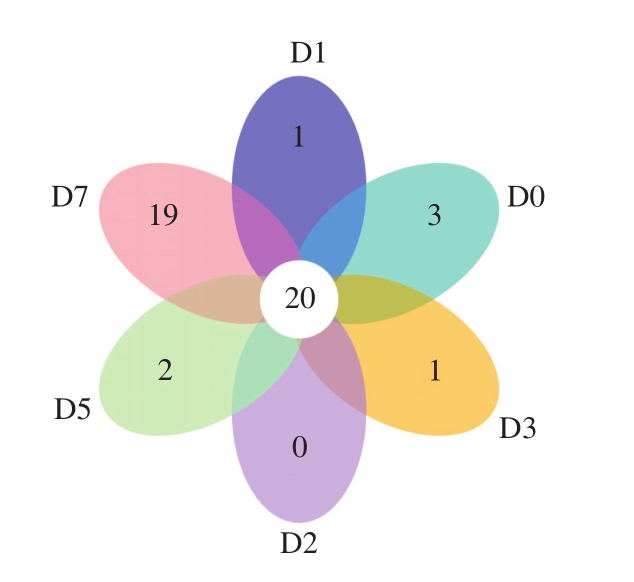
图4 小曲发酵酒样真菌OTU的统计和比较
Fig.4 Unique and shared fungal OTUs among different times of fermentation
由表2可知,覆盖率均为1,说明样品中被测出的概率较高。小曲白酒发酵7 d,样品中OTU数和ACE指数在发酵中第1天有所增加,第2天降低,随后又有所增加。Chao1指数是群落丰度指数,发酵第1天该指数最高为45.43。Shannon指数是群落分布多样性指数,该指数发酵开始时最小,发酵结束时最大。Simpson指数同样可用于估算样品中微生物多样性指数,同样也是在发酵开始时该指数最低。这说明了发酵第1天群落丰度最高。
表2 小曲发酵酒样真菌α多样性指数测定结果
Table 2 Fungal α-diversity indexes
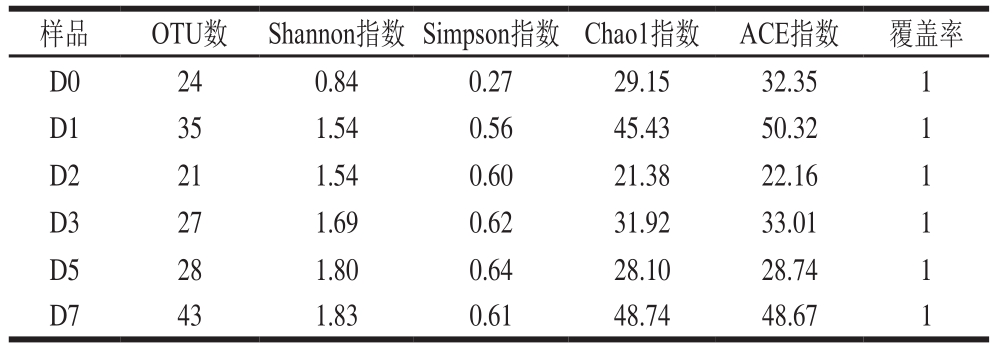
样品 OTU数 Shannon指数 Simpson指数 Chao1指数 ACE指数 覆盖率D0 24 0.84 0.27 29.15 32.35 1 D1 35 1.54 0.56 45.43 50.32 1 D2 21 1.54 0.60 21.38 22.16 1 D3 27 1.69 0.62 31.92 33.01 1 D5 28 1.80 0.64 28.10 28.74 1 D7 43 1.83 0.61 48.74 48.67 1
2.4 真菌群落结构差异性分析
2.4.1 基于门水平小曲白酒酿造中群落结构分析
在门水平下,小曲酒样品共鉴定出4 个门类真菌物种。由图5可知,真菌优势菌门分别为子囊菌门(Ascomycota)和毛霉菌门(Mucoromycota)。子囊菌门的真菌群落在发酵过程中增加并占据绝对主导地位,这说明子囊菌门在小曲白酒发酵中起到重要作用。毛霉菌门真菌群落的相对丰度在发酵过程中有所降低,毛霉在小曲酒发酵过程中有一定的糖化力[23]。随着发酵的进行,基质中的淀粉越来越低,其相对丰度也不断降低。
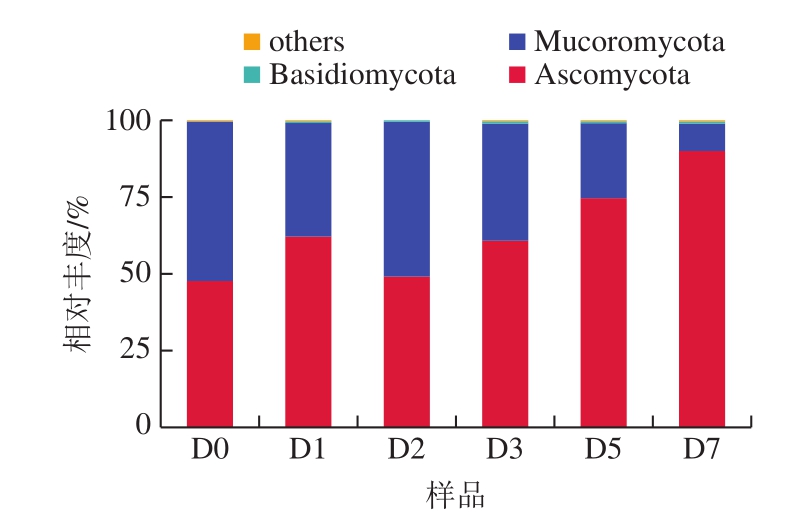
图5 基于门水平小曲发酵酒样的真菌群落结构
Fig.5 Fungal community structure at phylum level
2.4.2 基于属水平小曲白酒酿造中群落结构分析
在属水平下,小曲酒样品共检测出38 个属真菌物种,图6显示相对丰度前10的物种,其他物种合并为others。由图6可知,相对丰度前8 位菌属为伊萨酵母属(Issatchenkia)、根霉属(Rhizopus)、酵母菌属(Saccharomyces)、曲霉属(Aspergilus)、哈萨克斯坦酵母属(Kazachstania)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、丝孢酵母属(Trichosporon)。在入窖池前,伊萨酵母属和根霉属为绝对优势菌属,发酵后期酿酒酵母属为绝对优势菌属。根霉属和曲霉属的相对丰度随着发酵时间的延长不断降低。伊萨酵母属在发酵1 d后相对丰度有所增加,其后随着发酵的进行,其相对丰度不断降低。而酵母菌属相对丰度不断增加。伊萨酵母属是白酒酿造过程的功能菌,在多种不同香型的白酒大曲和酒醅中有报道[14,24-25]。该菌属在土壤和酒醅中都比较丰富,有一定的耐酸、耐高温和耐乙醇特性,同时可发酵产乙醇和乙酸乙酯。米根霉具有很高的淀粉酶生产能力[9,26],能够降解高粱中的淀粉,被广泛用于制曲、酿酒生产中。根霉一般也参与一些低沸点物质的合成[27]。曲霉是产酶能力较强的一类菌,可以分泌糖化酶[28],对高粱中淀粉的水解糖化起到重要作用。曲霉还可以促进某些酯类的合成,提高酒质。随着发酵时间的延长,小曲白酒体系中有机酸和醇类浓度不断增加,破坏了根霉和曲霉的生长环境,因而其相对丰度不断降低。酿酒酵母是白酒酿造过程中的主要功能菌株,可在厌氧条件下生长繁殖,在厌氧条件下有很强的乙醇发酵能力[29-30],是产酒的关键功能菌,因此在小曲白酒发酵过程中比例不断增加。同时,酿酒酵母和其他微生物如霉菌、细菌等可能发生相互作用[31]。酿酒酵母可以通过其强大的发酵力提高小曲白酒的出酒率和品质。在本研究所用复配小曲中没有酿酒酵母的添加,在发酵开始时其相对丰度也比较低,可能通过酿酒车间进入发酵体系中。
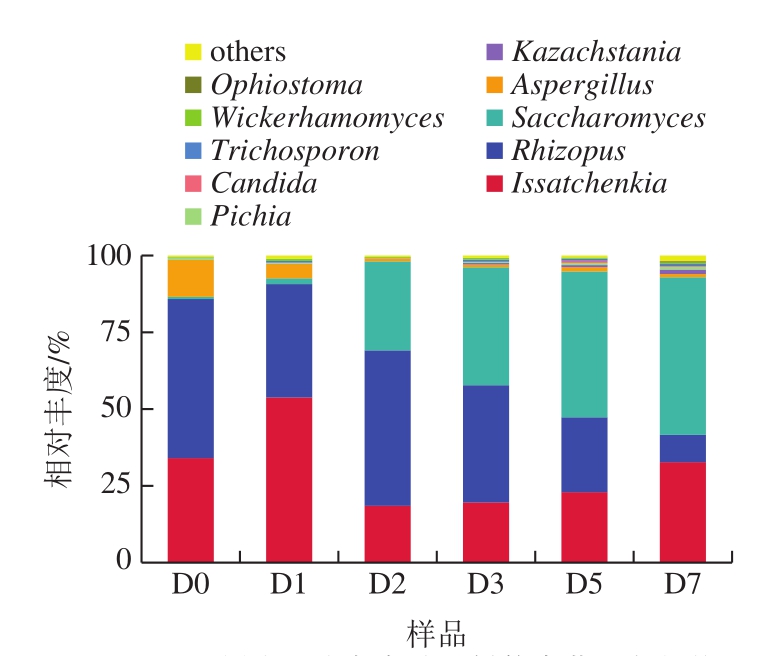
图6 基于属水平小曲发酵酒样的真菌群落结构
Fig.6 Fungal community structure at genus level
3 结 论
本研究通过高通量测序技术对复配小曲白酒发酵过程中细菌和真菌群落多样性进行了分析。结果表明,小曲白酒发酵过程中的优势菌门为厚壁菌门、变形菌门、拟杆菌门、子囊菌门和毛霉菌门;细菌多样性比真菌丰富。在属水平上,发酵过程中的细菌菌群在数量和结构分布上多样性变化较大。小曲白酒发酵前2 d最主要优势细菌属为不明立克次体菌属,发酵第3~7天主要优势菌属为乳杆菌属。优势真菌属为伊萨酵母属、根霉属、酵母菌属、曲霉属。根霉属和曲霉属在整个发酵过程中相对丰度不断降低,而酵母菌属在发酵第2天到发酵结束相对丰度不断提高。酸度和乙醇含量的提高可能抑制芽孢杆菌属、根霉属和曲霉属菌体的生长。本研究分析了复配小曲白酒生产过程中的微生物群落结构及变化规律,可为复配小曲的生产和工艺改进提供理论基础。
[1]赵婷婷, 卢倩文, 宋菲菲, 等.1 株产香真菌的筛选及其协同米根霉对米酒发酵的影响[J].食品科学, 2017, 38(14): 42-48.DOI:10.7506/spkx1002-6630-201714007.
[2]魏浩林, 周金虎, 刘凤春, 等.糯米甜酒曲根霉的筛选及强化曲的研究[J].中国酿造, 2017, 36(9): 41-44.DOI:10.11882/j.issn.0254-5071.2017.09.009.
[3]WU H C, ZHANG S Y, MA Y Y, et al.Comparison of microbial communities in the fermentation starter used to brew Xiaoqu liquor[J].Journal of the Institute of Brewing, 2017, 123(1): 113-120.DOI:10.1002/jib.388.
[4]沈毅, 陈波, 王西, 等.酱香型郎酒高温大曲、酒醅和窖泥中细菌群落结构分析[J].中国酿造, 2020, 39(2): 89-93.DOI:10.11882/j.issn.0254-5071.2020.02.016.
[5]栗连会, 肖辰, 陆震鸣, 等.泸型酒发酵酒醅中乳酸菌群落的来源、演替规律及功能预测[J].食品与生物技术学报, 2018, 37(12): 1242-1247.DOI:10.3969/j.issn.1673-1689.2018.12.002.
[6]张会敏, 王艳丽, 孟雅静, 等.浓香型白酒发酵新老窖泥理化因子和原核微生物群落结构差异分析[J].食品科学, 2020, 41(6): 207-214.DOI:10.7506/spkx1002-6630-20190226-190.
[7]唐贤华.高通量测序技术初步解析浓香型白酒窖泥细菌群落结构[J].中国酿造, 2020, 39(1): 160-164.DOI:10.11882/j.issn.0254-5071.2020.01.031.
[8]周森, 胡佳音, 崔洋, 等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报, 2019, 19(6): 244-249.DOI:10.16429/j.1009-7848.2019.06.029.
[9]宁亚丽, 跃吴, 嫱何, 等.基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J].食品科学, 2019, 40(16): 107-114.DOI:10.7506/spkx1002-6630-20180917-173.
[10]唐佳代, 邱树毅, 王春晓, 等.贵州地区酿酒小曲细菌多样性比较分析[J].中国酿造, 2019, 38(10): 55-59.DOI:10.11882/j.issn.0254-5071.2019.10.012.
[11]WANG J, ZHONG Q P, YANG Y Y, et al.Comparison of bacterial diversity between two traditional starters and the round-Koji-maker starter for traditional cantonese Chi-flavor liquor brewing[J].Frontiers in Microbiology, 2018, 9: 1053.DOI:10.3389/fmicb.2018.01053.
[12]DONG W W, YANG Q, LIAO Y X, et al.Characterisation and comparison of the microflora of traditional and pure culture Xiaoqu during the Baijiu liquor brewing process[J].Journal of the Institute of Brewing, 2020, 126(2): 213-220.DOI:10.1002/jib.597.
[13]TANG Q X, HE G Q, HUANG J, et al.Characterizing relationship of microbial diversity and metabolite in Sichuan Xiaoqu[J].Frontiers in Microbiology, 2019, 10: 696.DOI:10.3389/fmicb.2019.00696.
[14]WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology, 2018,84(4): e02369-17.DOI:10.1128/aem.02369-17.
[15]庾昌文, 薛栋升, 周敏, 等.清香型小曲白酒机械化酿造过程中细菌多样性及酿造性能分析[J].湖北农业科学, 2016, 55(11): 2860-2863.DOI:10.14088/j.cnki.issn0439-8114.2016.11.037.
[16]王春晓, 唐佳代, 吴鑫颖, 等.酿酒小曲中功能微生物的研究进展[J].食品科学, 2019, 40(17): 309-316.DOI:10.7506/spkx1002-6630-20180901-004.
[17]姚粟, 葛媛媛, 李辉, 等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业, 2012, 38(6): 1-5.DOI:10.13995/j.cnki.11-1802/ts.2012.06.018.
[18]吴莉莉, 王海燕, 徐岩, 等.酱香型与清香型白酒发酵过程中乳酸菌菌群的差异性分析[J].微生物学通报, 2013, 40(12): 2182-2188.DOI:10.13344/j.microbiol.china.2013.12.003.
[19]GÄNZLE M G.Lactic metabolism revisited: metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2: 106-117.DOI:10.1016/j.cofs.2015.03.001.
[20]邢敏钰, 杜海, 徐岩.芝麻香型白酒发酵过程中乳酸菌多样性及其演替规律[J].微生物学通报, 2018, 45(1): 19-28.DOI:10.13344/j.microbiol.china.170136.
[21]LE LAY C, COTON E, LE BLAY G, et al.Identification and quantification of antifungal compounds produced by lactic acid bacteria and propionibacteria[J].International Journal of Food Microbiology,2016, 239: 79-85.DOI:10.1016/j.ijfoodmicro.2016.06.020.
[22]MABEKU L B K, NGUE S, NGUEMO I B, et al.Potential of selected lactic acid bacteria from Theobroma cacao fermented fruit juice and cell-free supernatants from cultures as inhibitors of Helicobacter pylori and as good probiotic[J].BMC Research Notes, 2020, 13(1): 64.DOI:10.1186/s13104-020-4923-7.
[23]ZUO Y, XIE W F, PANG Y, et al.Bacterial community composition in the gut content of Lampetra japonica revealed by 16S rRNA gene pyrosequencing[J].PLoS ONE, 2017, 12(12): e0188919.DOI:10.1371/journal.pone.0188919.
[24]WU Q, LING J, XU Y.Starter culture selection for making Chinese sesame-flavored liquor based on microbial metabolic activity in mixedculture fermentation[J].Applied and Environmental Microbiology,2014, 80(14): 4450-4459.DOI:10.1128/aem.00905-14.
[25]彭俊, 杨团元, 刘蒲临, 等.白酒酿造酒醅与周边土壤中酵母菌多样性及东方伊萨酵母发酵特性比较[J].中国酿造, 2019, 38(8): 77-84.DOI:10.11882/j.issn.0254-5071.2019.08.016.
[26]GHOSH B, LAHIRI D, NAG M, et al.Bio characterization of purified isoamylase from Rhizopus oryzae[J].Preparative Biochemistry &Biotechnology, 2020, 50(5): 453-459.DOI:10.1080/10826068.2019.1706561.
[27]ZHENG X W, TABRIZI M R, NOUT M J R, et al.Daqu: a traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing,2011, 117(1): 82-90.DOI:10.1002/j.2050-0416.2011.tb00447.x.
[28]李兵, 张超, 王玉霞, 等.白酒大曲功能微生物与酶系研究进展[J].中国酿造, 2019, 38(6): 7-12.DOI:10.11882/j.issn.0254-5071.2019.06.002.
[29]陈诗佳, 李玲玲, 陈叶福, 等.高产乙偶姻酵母菌种的选育与提高白酒中四甲基吡嗪含量的研究[J].酿酒科技, 2018(18): 114-119.DOI:10.13746/j.njkj.2018280.
[30]贾丽艳, 田宇敏, 荆旭, 等.清香风味导向的酿酒酵母Y2的分离鉴定及生物学特性研究[J].中国食品学报, 2020, 20(1): 230-235.DOI:10.16429/j.1009-7848.2020.01.030.
[31]吴轩德, 李洲, 周世水.白酒酿造中酿酒酵母与巴氏醋杆菌相互作用的研究[J].现代食品科技, 2017, 33(12): 61-67.DOI:10.13982/j.mfst.1673-9078.2017.12.010.