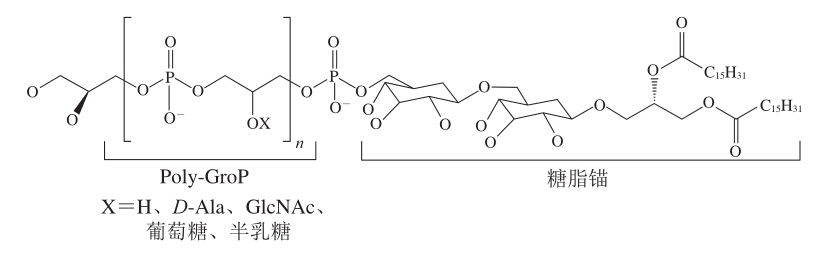
图1 典型LTA的结构[9]
Fig. 1 Structure of typical lipoteichoic acid[9]
Progress in Research on the Structure and Immune-Regulating Effect of Lactobacillus Lipoteichoic Acid
关曼缇, 张英春, 卢卫红, 等. 乳酸杆菌脂磷壁酸的结构及免疫调控功能研究进展[J]. 食品科学, 2021, 42(21): 278-284.DOI:10.7506/spkx1002-6630-20200724-325. http://www.spkx.net.cn
GUAN Manti, ZHANG Yingchun, LU Weihong, et al. Progress in research on the structure and immune-regulating effect of Lactobacillus lipoteichoic acid[J]. Food Science, 2021, 42(21): 278-284. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20200724-325. http://www.spkx.net.cn
益生乳酸杆菌在宿主体内通过对营养物质的消化和吸收,传递信号给免疫细胞,如吞噬细胞、抗原递呈细胞(antigen-presenting cell,APC)和T、B淋巴细胞等,对宿主免疫反应进行调节[1-2]。乳酸杆菌的黏附定植是其在宿主肠道发挥益生作用的重要前提[3]。国内外研究已证实脂磷壁酸(lipoteichoic acid,LTA)作为一类重要的黏附素,与病原菌竞争肠内黏附位点、参与细菌与宿主间的信号交流[4]。然而,敲除LTA合成的关键基因和特定位点可能会改变某些菌株形态,从而影响其对肠道疾病的抗炎作用。与其他研究较早的革兰氏阳性菌LTA相比,益生乳酸杆菌LTA目前的研究工作还很少。因此深入分析其LTA的结构和生理功能,为今后预防和治疗相关疾病提供新思路,也可为乳酸杆菌的营养调节提供新的线索。
磷壁酸(teichoic acid,TA)是革兰氏阳性菌表面的特异性聚合物,根据其在细菌上的分布,可分为锚定在细胞膜上的LTA和与细胞壁肽聚糖共价结合的壁磷壁酸(wall teichoic acid,WTA)[5]。LTA最初被称为膜磷壁酸,属于跨细菌表面肽聚糖层的两亲性分子。绝大多数LTA的亲水区由1,3-磷酸二酯键结合的聚磷酸甘油酯(poly-glycerol phosphate,poly-GroP)组成,GroP重复单元上的游离羟基在不同程度上被葡萄糖、半乳糖、D-丙氨酸(D-alanine,D-Ala)或N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)取代。LTA的疏水区是一种锚定在细胞膜上的糖脂,通常为Glc(β1-6)Glc(β1-3)二酰基甘油,poly-GroP链通过己糖残基与糖脂共价连接[6-7](图1)。乳酸杆菌LTA poly-GroP上的取代基以D-Ala为主,其糖脂锚定物由三己糖基-二酰基甘油组成[6]。LTA的基本生理功能有调节自溶素的活性、清除二价阳离子(如Mg2+)、贮藏磷元素、改变细胞壁的电荷性质,从而能够影响细菌与宿主细胞之间的相互作用,此外还具有抵抗微生物、抑制肿瘤细胞生长、调节免疫、抗氧化、抗衰老等作用。目前研究表明LTA的表达有3 个阶段:1)糖基转移酶合成糖脂类锚定单元;2)糖脂锚通过膜相关蛋白转运到细菌外;3)磷酸甘油转移酶将poly-GroP添加到糖脂锚中[8]。

图1 典型LTA的结构[9]
Fig. 1 Structure of typical lipoteichoic acid[9]
LTA的微观异质性(脂肪酸组成和饱和度、取代基的种类和取代程度以及亲水链的长度)导致致病菌和乳酸杆菌LTA的结构多样性。植物乳酸杆菌KCTC 10887BP LTA的poly-GroP链被葡萄糖和半乳糖取代,糖脂部分含有不饱和脂肪酸,侵袭性金黄色葡萄球菌ATCC 29213的LTA由GlcNAc修饰,糖脂上含有饱和脂肪酸,除此之外,两者重复单元被D-Ala取代的水平相似[10]。通过基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrum,MALDI-TOF MS)检测到不同乳酸杆菌(植物乳杆菌、鼠李糖乳杆菌、德氏乳杆菌和沙克乳杆菌)LTA的糖脂结构由不同脂肪酸基团和链长构成,这表明LTA分子之间结构的差异性可使其具有不同的免疫活性[11]。
LTA的高纯度和结构完整性是阐明其真正免疫活性的重要前提,从革兰氏阳性菌细胞壁肽聚糖内部和细胞膜中分离出完整的LTA,且不包含任何杂质或杂质残留量极低,选择合适的方法是提高提取率的关键。早期研究人员使用三氯乙酸法提取LTA,三氯乙酸是一种酸性较强的溶液,通过水解磷壁酸与肽聚糖之间的共价键达到分离目的[12-13]。苯酚法(尤其是热酚-水法)应用时间较长,但萃取物含有较多的蛋白质和残余不溶物质,需利用二乙氨乙基-纤维素阴离子交换层析柱和辛基-琼脂糖疏水层析柱进一步纯化,缺点是该方法可能导致poly-GroP降解和D-Ala的含量降低,此外苯酚具有毒性,必须小心使用[14-16]。TritonX-114(TX114)是一种新型非离子去垢剂,已被证明可以从水溶性蛋白质中分离出两亲性蛋白质[17]。乐军[18]使用2% TX114成功提取双歧杆菌的LTA,纯化后无明显的蛋白质和核酸的污染,提取率约为45%~55%。虽然TX114法回收LTA的产量比苯酚法低,但前者提取时间短,危险性和腐蚀性小,杂质污染更低,足以弥补产量低的缺点[19-20]。此外,正丁醇法也被广泛应用于植物乳杆菌、鼠李糖乳杆菌和金黄色葡萄球菌等LTA的提取[21-25]。利用超声波破碎法破坏细胞壁肽聚糖紧密连接的网状结构,使嵌入在其中的LTA暴露出来,随后用水饱和的正丁醇溶液萃取,即可得到LTA。该法提取的产物结构完整,纯化后检测到极少的蛋白质和内毒素。还有少数研究采用氯仿-甲醇-水提取法[26]。由此可见,需要根据不同菌株间LTA的结构和特性,对比不同提取方案对LTA结构和纯度的影响,选择最佳的提取方法。
目前已经发现乳酸杆菌表面成分,如表层蛋白(surface layer protein,SLP)、胞外多糖(exopoly saccharides,EPS)、完整肽聚糖(whole peitidoglycan,WPG)和LTA等黏附素,在细菌的黏附过程中起到一定的作用,其中国内外研究最多的是乳酸杆菌的S-层蛋白。但LTA作为乳酸杆菌外层疏水部分,介导乳酸杆菌或其他细菌与人类上皮细胞黏附的重要性已被证明。LTA通过其脂质部分与沉积在上皮细胞并结合在上皮细胞上的纤维连接蛋白受体相互作用,起到黏附分子作用,同时LTA的低等电点使菌株表面分布负电荷,赋予细菌细胞壁阴离子的性质,由此为细菌与细胞受体之间的黏附提供了基础[27-29]。
Granato等[29]将约氏乳杆菌La1用于小鼠免疫实验并提取和制备单克隆抗体,研究发现提取的单克隆抗体可检测到La1表面的LTA,进一步分离纯化LTA,发现其能强烈地抑制La1与Caco-2细胞之间的黏附,并呈浓度依赖性抑制,当LTA质量浓度为150 μg/mL时,抑制率大约为60%。孙进等[30]用三氯乙酸溶液处理植物乳杆菌Lp6,破坏细胞壁外露的LTA,并进行乳酸杆菌黏附大鼠小肠黏液实验,处理后的Lp6的黏附性降低,该研究还发现黏附性在不同菌株之间具有显著差异。杜兰兰等[31]利用质量分数0.25%胰蛋白酶和质量分数2%牛血清白蛋白酶分别处理类植物乳杆菌L-ZS9,处理后的L-ZS9对结肠癌HT-29细胞的黏附能力极显著下降,初步判定其主要黏附素为表面蛋白和LTA。
为了测定LTA是否参与乳酸杆菌对上皮细胞的黏附过程,可先用碱处理乳酸杆菌表面,NaOH溶液可破坏LTA的部分酰基链,使其结构发生改变,若经检测发现该菌株的黏附能力下降,说明该乳酸杆菌的主要黏附素之一就是LTA[32-33]。
控制肠道细胞和菌群稳态的免疫调节机制的不稳定可能导致有害炎症,甚至导致糖尿病、肥胖症和肿瘤等,例如炎症性肠病(inflammatory bowel disease,IBD),常见的有溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)等,这些与肠内促炎和抗炎分子的异常表达有关,导致肠道先天性免疫和适应性免疫系统失衡,炎症的恶化可增加患结直肠癌(colorectal cancer,CRC)的风险[34]。LTA被普遍认为是革兰氏阳性菌的主要病原相关分子模式(pathogenassociated molecular patterns,PAMPs),与各种炎症性疾病有关,可通过多种信号通路(以核因子-κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogenacivated protein kinases,MAPKs)信号转导通路为主)调节相关免疫细胞和生物体内促炎因子和抗炎因子之间的平衡,从而影响炎症进程。
金黄色葡萄球菌[35-38]、变形链球菌[32]和肺炎球菌[39]等几种致病菌的LTA已被证明在各种细胞类型中促进促炎因子、一氧化氮(NO)或肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等的产生,从而引发脓毒症休克、动脉粥样硬化和癌症等严重的炎症性疾病。有研究表明,LTA参与乳酸杆菌的免疫调控和对结肠内致病菌的抑制过程,与来自致病菌的LTA相比,益生乳酸杆菌的LTA具有较弱的刺激活性。Kim等[33]采用正丁醇萃取法分别从植物乳杆菌KCTC 10887BP和金黄色葡萄球菌中提取LTA,纯化后分别处理THP-1人单核细胞,研究发现金黄色葡萄球菌的LTA(aLTA)呈剂量依赖方式产生TNF-α,而植物乳杆菌LTA(pLTA)单独作用几乎不会诱导TNF-α的产生,同时高度纯化的pLTA抑制aLTA诱导的强烈信号转导,表现为MAPK信号通路相关的细胞外信号调节蛋白激酶1/2(extracellular signal regulated kinase,ERK1/2)、c-Jun N末端激酶1/2(c-Jun N-terminal kinases,JNK1/2)和p38 MAPK的磷酸化水平和NF-κB活性的降低,有效改善了致病菌引发的免疫反应,产生这种现象可能是两者LTA结构不同的缘故。
从益生乳酸杆菌分离出LTA还保留调控肠道相关疾病的能力,具有与亲本菌株相似的免疫调节活性。Kim等[40]利用福氏志贺氏菌(Shigella flexneri)肽聚糖刺激THP-1细胞,通过过度激活NF-κB引发肠道炎症,经植物乳杆菌K8的LTA预处理后,福氏志贺菌肽聚糖诱导的TNF-α和白细胞介素(interleukin,IL)-8含量明显减少,NF-κB活化被抑制,这种效应与NOD2-RICK信号转导密切相关,LTA通过下调核苷酸结合寡聚化结构域蛋白(nucleotide oligomerization domain-containing protein,NOD)样受体家族中的NOD2,以及下游信号通路来增强细胞的交叉耐受力。Gao Quanxin等[41]分别设计竞争实验、预防实验和治疗实验,证实植物乳杆菌CICC6257的LTA有效抑制鳗弧菌(Vibrio anguillarum)对鱼肠上皮细胞FIECs的黏附,其中竞争组抑制效果最显著;鳗弧菌诱导的细胞因子是受NF-κB转录复合体控制的,LTA能抑制NF-κB的活化和NF-κB抑制蛋白(inhibitor of NF-κB,IκB)的降解,降低IL-8和TNF-α的水平,减轻炎症;此外通过提高抑凋亡蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和抑制促凋亡Bcl-2相关x蛋白(Bcl-2 associated x protein,Bax)的含量,并降低半胱天冬酶(caspase)-9和caspase-3的活性,有效地抑制细胞凋亡和坏死,其中半胱天冬酶是半胱氨酸蛋白酶的一个重要家族,在多种细胞外和细胞内凋亡刺激下起协同作用。植物乳杆菌KCTC 10887BP的LTA分别阻断人重组rhTNF-α和病毒双链RNA合成类似物poly I:C诱导IL-8的生成,减弱p38 MAPK的磷酸化以及NF-κB的活性,从而抑制HT-29细胞和IPEC-J2细胞的过度炎症反应,减轻细胞损伤;然而用0.1 mol/L Tris-HCl和0.5 mol/L NaOH溶液分别制备重复单元缺乏D-Ala和酰基链缺失的LTA,失去了这种抑制作用,以此说明LTA的脂链和D-Ala对自身的活性尤为重要[42-43]。
Toll样受体(Toll-like receptors,TLR)是一类跨膜糖蛋白,由富含亮氨酸重复序列的胞外结构域、跨膜结构域和与信号传导有关的胞内TIR同源域组成,通常在巨噬细胞、自然杀伤细胞(natural killer cell,NK)以及树突状细胞(dendritic cells,DCs)等中表达[44]。TLRs可识别PAMPs中的分子结构,进而激活MAPK或NF-κB通路的信号转导,诱导细胞因子、趋化因子和共刺激分子的上调,因此被定义为模式识别受体(pattern recognition receptors,PRRs),是研究最多的PRRs家族之一[45]。其中TLR2常与其他TLR(如TLR1和TLR6)结合形成异源二聚体,因此能够识别较广泛的配体,包括革兰氏阳性菌的细胞壁成分,如LTA、脂蛋白和肽聚糖等[44,46]。研究证实,LTA可被宿主肠道细胞上的TLR2识别,通过TLR2介导的信号通路抑制严重的炎症反应[47-48]。
Wang Shaohua等[49]研究表明副干酪乳杆菌D3-5细胞壁成分LTA具有独特的生物活性,通过激活C57BL/6J小鼠的TLR2-p38 MAPK信号,进一步招募和启动下游信号级联,促进黏蛋白(mucin 2,MUC2)mRNA的表达和提高肠内杯状细胞质量,抑制NF-κB活化,其中MUC2是肠杯状细胞分泌的主要黏蛋白,可阻止与年龄相关的肠道渗漏和病原菌入侵,同时检测到炎症标志物IL-6、IL-1β和TNF-α被抑制,但以上现象在TLR2基因敲除小鼠中被消除,证实LTA依赖于完整的TLR2信号转导来减轻肠道炎症。来自不同乳酸杆菌的LTA对TLR2介导的细胞因子具有差异调节作用[50]。
LTA还可特异性地与TLR2和共受体CD14结合,达到抵抗炎症的目的。人单核细胞分化抗原CD14也是一种PRR,可作为TLR的一个适配器和共受体,以增加配体与TLR的亲和力并增强它们的活性[51-52]。Kim等[53]通过实验证明植物乳杆菌LTA可抑制金黄色葡萄球菌LTA或脂多糖(lipopolysacccharide,LPS)处理THP-1细胞后TLR2和CD14的表达。Matsuguchi等[54]通过实验发现单独转染CD14的HEK293T细胞不增加NF-κB对干酪乳杆菌YIT 9029和发酵乳杆菌YIT 0159的LTAs的反应活性,然而当TLR2和CD14共转染时,随着LTAs的处理NF-κB被激活。还有其他报道称,LTA的识别是通过TLR2/TLR6异源二聚体与两个共受体CD14和CD36实现的[55],前人已证实乳酸杆菌LTA与TLR2/TLR6和CD14相互作用发挥益生作用,但这种作用是否有CD36的参与还有待研究[56]。
为了更全面地认识乳酸杆菌LTA在调节肠道炎症中的稳定性,还需观察LTA突变体对菌株细胞的形态特征和生理活性的影响。例如构建鼠李糖乳杆菌GG的dltD基因敲除突变体,导致D-Ala取代基完全消失,甘油磷酸酯残基数量减少,透射电子显微镜从形态学层面上观察到突变体隔膜形成缺陷和细胞长度增加,在体外模拟胃液中的存活能力降低[57]。两株缺乏LTA的嗜酸乳杆菌突变体表现出比野生株长两倍的细胞形态,这可能是细胞异常分裂介导的,而且突变体菌株的生长繁殖在高浓度的锰离子作用下受到严重抑制,通透性或自溶性增加,导致细胞内成分的释放[58]。相反,缺失磷酸甘油酸转移酶基因的嗜酸乳杆菌NCK2025没有表现出生长速率和形态缺陷,但在体外胃液和小肠液中的存活率降低[8]。这些研究强调了LTA作为乳酸杆菌细胞壁的结构成分在维持细胞形态和离子稳态中发挥的巨大作用,其详细作用有待进一步研究。
乳酸杆菌经口服后通过肠胃道并长期定植在肠道内,提高代谢活动效率,维持本地微生物群和对肠道的免疫调节,然而敲除LTA合成关键基因可能会改变该菌株的这种特性。Mizuno等[59]利用基因敲除技术,获得植物乳杆菌CRL1506的dltD敲除株,经Western Blot法证实,与野生型相比,突变株中LTA的含量降低,用TLR3激动剂poly I:C注射预先口服突变株的BALB/c小鼠腹腔,检测发现干扰素-β(interferon-β,IFN-β)水平提高,但对小鼠肠内IL-10和促炎介质TNF-α、IL-6和IL-15的表达没有作用,并失去抑制了肠黏膜上皮内淋巴细胞(CD3+、NK1.1+、CD8αα+)激活的能力,表明在TLR3介导的肠道炎症中,LTA可能是植物乳杆菌CRL1506产生抗炎作用的关键分子。Lee等[60]证实干酪乳杆菌BL23在葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的小鼠结肠炎模型中发挥了良好的作用,喂食野生株保持了小鼠正常体质量,此过程伴随着腹泻、直肠出血以及肠道坏死和病变的改善,以及疾病活动指数(disease activity index,DAI)降低,与之相比,dltD突变株不能抑制DSS诱导的组织损伤,使小鼠恢复到与健康动物相似的水平。
与上述结论相反,有学者提出,缺乏LTA的乳酸杆菌其调节炎症的能力增加。Khazaie等[61]通过敲除嗜酸乳杆菌NCK2025上合成LTA的磷酸甘油酸转移酶基因,建立小鼠结肠息肉病模型,口服突变株使小鼠回肠末端和结肠的息肉数量明显减少,并且下调了DCs中IL-10、IL-12和TNF-α的水平,改善调节性T细胞(regulatory cell,Treg)保护功能,这些与小鼠结肠炎症的减轻现象一致。Claes等[56]用野生型鼠李糖乳杆菌GG与TLR2/6(非单独的TLR2)相互作用,可使HEK293T细胞内的NF-κB呈浓度依赖性激活,而dltD突变体在HEK293T细胞内激活TLR2/6依赖性NF-κB信号的能力降低,同时减弱了对IL-8 mRNA的诱导能力,说明dltD突变体的促炎能力显著降低,对宿主细胞负面损伤减少,甚至增强了抗炎和上皮修复活性。在这些研究基础上引出了一个重要的问题:为什么不同乳酸杆菌LTA突变体会对其炎症能力调节产生不同的影响。由于LTA突变具有多效性效应,单独考虑LTA的突变并不能解释这一现象,还需要结合菌株SLP、DNA和EPS等活性成分共同分析。
综上所述,LTA作为革兰氏阳性菌表面分子与多种生物学效应有关,过去人们对金黄色葡萄球菌、粪肠球菌和变形链球菌等的LTA在致病菌方面的研究颇多,近年来乳酸杆菌LTA的抗肿瘤、抑制动脉粥样硬化形成和治疗炎症性肠病等方面的作用已得到证实,相关的体内外研究结果层出不穷。对乳酸杆菌LTA的关键基因进行合理敲除或者改变LTA的结构,在不影响菌体本身形态和耐受能力的前提下提高其抗炎能力,是如今需要重视的热点问题。值得注意的是,乳酸杆菌LTA在病毒感染或病毒模式识别受体介导炎症中的潜在有益作用鲜有深入探讨。探究乳酸杆菌LTA的免疫调节机制,开发功能性更强的乳酸杆菌发酵食品,对于人类疾病防治具有重大指导意义。
[1]VLASOVA A N, KANDASAMY S, CHATTHA K S, et al.Comparison of probiotic lactobacilli and bifidobacteria effects,immune responses and rotavirus vaccines and infection in different host species[J]. Veterinary Immunology and Immunopathology, 2016,172: 72-84. DOI:10.1016/j.vetimm.2016.01.003.
[2]AZAD M A, SARKER M, LI T J, et al. Probiotic species in the modulation of gut microbiota: an overview[J]. Biomed Research International, 2018, 2018: 8. DOI:10.1155/2018/9478630.
[3]KRAVTSOV E G, YERMOLAYEV A V, ANOKHINA I V, et al.Adhesion characteristics of Lactobacillus is a criterion of the probiotic choice[J]. Bulletin of Experimental Biology and Medicine, 2008,145(2): 232-234. DOI:10.1007/s10517-008-0058-x.
[4]ZHANG Zhongwang, LÜ Jianliang, PAN Li, et al. Roles and applications of probiotic Lactobacillus strains[J]. Applied Microbiology and Biotechnology, 2018, 102(19): 8135-8143.DOI:10.1007/s00253-018-9217-9.
[5]SHIRAISHI T, YOKOTA S, FUKIYA S, et al. Structural diversity and biological significance of lipoteichoic acid in Gram-positive bacteria:focusing on beneficial probiotic lactic acid bacteria[J]. Bioscience of Microbiota Food and Health, 2016, 35(4): 147-161. DOI:10.12938/bmfh.2016-006.
[6]NEUHAUS F C, BADDILEY J. A continuum of anionic charge:structures and functions of D-alanyl-teichoic acids in gram-positive bacteria[J]. Microbiology and Molecular Biology Reviews, 2003,67(4): 686-723. DOI:10.1128/mmbr.67.4.686-723.2003.
[7]ABACHIN E, POYART C, PELLEGRINI E, et al. Formation of D-alanyl-lipoteichoic acid is required for adhesion and virulence of Listeria monocytogenes[J]. Molecular Microbiology, 2002, 43(1):1-14. DOI:10.1046/j.1365-2958.2002.02723.x.
[8]MOHAMADZADEH M, PFEILER E A, BROWN J B, et al.Regulation of induced colonic inflammation by Lactobacillus acidophilus deficient in lipoteichoic acid[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011,108: 4623-4630. DOI:10.1073/pnas.1005066107.
[9]LEBEER S, CLAES I J J, VANDERLEYDEN J. Anti-inflammatory potential of probiotics: lipoteichoic acid makes a difference[J]. Trends in Microbiology, 2012, 20(1): 5-10. DOI:10.1016/j.tim.2011.09.004.
[10]KYOUNG-SOON J, EUN B J, HYUN H S, et al. Multi-spectrometric analyses of lipoteichoic acids isolated from Lactobacillus plantarum[J].Biochemical and Biophysical Research Communications, 2011,407(4): 823-830. DOI:10.1016/j.bbrc.2011.03.107.
[11]JEONG J H, JANG S, JUNG B J, et al. Differential immunestimulatory effects of LTAs from different lactic acid bacteria via MAPK signaling pathway in RAW 264.7 cells[J]. Immunobiology,2015, 220(4): 460-466. DOI:10.1016/j.imbio.2014.11.002.
[12]ARCHIBALD A R, ARMSTRONG J J, BADDILEY J, et al. Teichoic acids and the structure of bacterial walls[J]. Nature, 1961, 191: 570-572. DOI:10.1038/191570a0.
[13]KELEMEN M V, BADDILEY J. Structure of the intracellular glycerol teichoic acid from Lactobacillus casei A.T.C.C. 7469[J]. The Biochemical Journal, 1961, 80: 246-254. DOI:10.1042/bj0800246.
[14]FISCHER W, KOCH H U, HAAS R. Improved preparation of lipoteichoic acids[J]. European Journal of Biochemistry, 1983, 133(3):523-530. DOI:10.1111/j.1432-1033.1983.tb07495.x.
[15]MORATH S, GEYER A, HARTUNG T. Structure-function relationship of cytokine induction by lipoteichoic acid from Staphylococcus aureus[J]. Journal of Experimental Medicine, 2001,193(3): 393-397. DOI:10.1084/jem.193.3.393.
[16]SETOYAMA T, NOMOTO K, YOKOKURA T, et al. Protective effect of lipoteichoic acid from Lactobacillus casei snd Lactobacillus fermentum against Pseudomonas-aeruginosa in mice[J]. Journal of General Microbiology, 1985, 131(9): 2501-2503.DOI:10.1099/00221287-131-9-2501.
[17]BORDIER C. Phase separation of integral membrane proteins in Triton X-114 solution[J]. The Journal of Biological Chemistry, 1981,256(4): 1604-1607. DOI:10.1016/0165-022X(81)90075-0.
[18]乐军, 胡宏. 非离子型去垢剂TritonX-114提取两歧双歧杆菌的脂磷壁酸[J]. 中国微生态学杂志, 1997, 9(4): 7-10.
[19]SUTCLIFFE I C, HOGG S D. Extraction of lipoteichoic acid from Streptococcus mutants with the non-ionic detergent Triton X-114[J]. Journal of Microbiological Methods, 1993, 17(3): 215-225.DOI:10.1016/0167-7012(93)90048-m.
[20]白莹, 孙民, 邱芳萍. 脂磷壁酸的提取纯化及抑菌活性研究[J]. 长春工业大学学报(自然科学版), 2009, 30(4): 447-450. DOI:10.3969/j.issn.1674-1374-B.2009.04.017.
[21]KIM A R, AHN K B, YUN C H, et al. Lactobacillus plantarum lipoteichoic acid inhibits oral multispecies biofilm[J]. Journal of Endodontics, 2019, 45(3): 310-315. DOI:10.1016/j.joen.2018.12.007.
[22]KIM J Y, KIM H, JUNG B J, et al. Lipoteichoic acid isolated from Lactobacillus plantarum suppresses LPS-mediated atherosclerotic plaque inflammation[J]. Molecules and Cells, 2013, 35(2): 115-124.DOI:10.1007/s10059-013-2190-3.
[23]CISZEK-LENDA M, NOWAK B, SROTTEK M, et al. Further studies on immunomodulatory effects of exopolysaccharide isolated from Lactobacillus rhamnosus KL37C[J]. Central European Journal of Immunology, 2013, 38(3): 289-298. DOI:10.5114/ceji.2013.37743.
[24]WEILL F S, CELA E M, PAZ M L, et al. Lipoteichoic acid from Lactobacillus rhamnosus GG as an oral photoprotective agent against UV-induced carcinogenesis[J]. British Journal of Nutrition, 2013,109(3): 457-466. DOI:10.1017/s0007114512001225.
[25]ELLINGSEN E A, MORATH S, FLO T H, et al. Induction of cytokine production in human T cells and monocytes by highly purified lipoteichoic acid: involvement of Toll-like receptors and CD14[J].Medical Science Monitor, 2002, 8(5): BR149-156.
[26]HAN S H, KIM J H, MARTIN M, et al. Pneumococcal lipoteichoic acid (LTA) is not as potent as Staphylococcal LTA in stimulating Tolllike receptor 2[J]. Infection and Immunity, 2003, 71(10): 5541-5548.DOI:10.1128/IAI.71.10.5541-5548.2003.
[27]庞瑞鹏. 乳酸杆菌黏附人肠道上皮功能的研究进展[J]. 中国奶牛,2014(15): 46-48. DOI:10.3969/j.issn.1004-4264.2014.15.012.
[28]SHERMAN L A, SAVAGE D C. Lipoteichoic acids in Lactobacillus strains that colonize the mouse gastric epithelium[J]. Applied and Environmental Microbiology, 1986, 52(2): 302-304. DOI:10.1128/aem.52.2.302-304.1986.
[29]GRANATO D, PEROTTI F, MASSEREY I, et al. Cell surface-associated lipoteichoic acid acts as an adhesion factor for attachment of Lactobacillus johnsonii La1 to human enterocyte-like Caco-2 cells[J]. Applied and Environmental Microbiology, 1999, 65(3): 1071-1077.
[30]孙进, 乐国伟, 施用晖, 等. 植物乳杆菌黏附大鼠小肠黏液及机制的研究[J]. 微生物学杂志, 2006(2): 19-21. DOI:10.3969/j.issn.1005-7021.2006.02.005.
[31]杜兰兰, 王洋, 刘蕾, 等. 类植物乳杆菌L-ZS9黏附特性研究及胃肠道环境对其黏附力的影响[J]. 食品科技, 2015, 40(12): 2-6; 14.
[32]WOONG H S, EUN B J, SEOK-SEONG K, et al. Lipoteichoic acid of Streptococcus mutans interacts with Toll-like receptor 2 through the lipid moiety for induction of inflammatory mediators in murine macrophages[J]. Molecular Immunology, 2014, 57(2): 284-291.DOI:10.1016/j.molimm.2013.10.004.
[33]KIM H G, LEE S Y, KIM N R, et al. Inhibitory effects of Lactobacillus plantarum lipoteichoic acid (LTA) on Staphylococcus aureus LTA-induced tumor necrosis factor-alpha production[J].Journal of Microbiology and Biotechnology, 2008, 18(6): 1191-1196.DOI:10.1007/s12275-008-0038-x.
[34]PARK J H, PEYRIN-BIROULET L, EISENHUT M, et al.Inflammatory bowel diseases (IBD) immunopathogenesis: a comprehensive review of inflammatory molecules[J]. Autoimmunity Reviews, 2017, 16(4): 416-426. DOI:10.1016/j.autrev.2017.02.013.
[35]SU B C, CHEN J Y. Epinecidin-1: an orange-spotted grouper antimicrobial peptide that modulates Staphylococcus aureus lipoteichoic acid-induced inflammation in macrophage cells[J]. Fish & Shellfish Immunology, 2020, 99: 362-367. DOI:10.1016/j.fsi.2020.02.036.
[36]WU Yongjiang, CHEN Jingbo, SUN Yawang, et al. PGN and LTA from Staphylococcus aureus induced inflammation and decreased lactation through regulating DNA methylation and histone H3 acetylation in bovine mammary epithelial cells[J]. Toxins, 2020, 12(4):238. DOI:10.3390/toxins12040238.
[37]XIA G Q, KOHLER T, PESCHEL A. The wall teichoic acid and lipoteichoic acid polymers of Staphylococcus aureus[J]. International Journal of Medical Microbiology, 2010, 300(2/3): 148-154.DOI:10.1016/j.ijmm.2009.10.001.
[38]YANG W, ZERBE H, PETZL W, et al. Bovine TLR2 and TLR4 properly transduce signals from Staphylococcus aureus and E. coli,but S. aureus fails to both activate NF-κB in mammary epithelial cells and to quickly induce TNFα and interleukin-8 (CXCL8) expression in the udder[J]. Molecular Immunology, 2008, 45(5): 1385-1397.DOI:10.1016/j.molimm.2007.09.004.
[39]HAN S H, KIM J H, SEO H S, et al. Lipoteichoic acid-induced nitric oxide production depends on the activation of platelet-activating factor receptor and Jak2[J]. Journal of Immunology, 2006, 176(1): 573-579.DOI:10.4049/jimmunol.176.1.573.
[40]KIM H G, LEE S Y, KIM N R, et al. Lactobacillus plantarum lipoteichoic acid down-regulated Shigella flexneri peptidoglycaninduced inflammation[J]. Molecular Immunology, 2011, 48(4): 382-391. DOI:10.1016/j.molimm.2010.07.011.
[41]GAO Quanxin, GAO Qian, MIN Minghua, et al. Ability of Lactobacillus plantarum lipoteichoic acid to inhibit Vibrio anguillarum-induced inflammation and apoptosis in silvery pomfret(Pampus argenteus) intestinal epithelial cells[J]. Fish & Shellfish Immunology, 2016, 54: 573-579. DOI:10.1016/j.fsi.2016.05.013.
[42]KIM H, JUNG B J, JUNG J H, et al. Lactobacillus plantarum lipoteichoic acid alleviates TNF-α-induced inflammation in the HT-29 intestinal epithelial cell line[J]. Molecules and Cells, 2012, 33(5): 479-486. DOI:10.1007/s10059-012-2266-5.
[43]KIM K W, KANG S S, WOO S J, et al. Lipoteichoic acid of probiotic Lactobacillus plantarum attenuates poly I:C-induced IL-8 production in porcine intestinal epithelial cells[J]. Frontiers in Microbiology,2017, 8: 1827. DOI:10.3389/fmicb.2017.01827.
[44]JIMENEZ-DALMARONI M J, GERSWHIN M E, ADAMOPOULOS I E. The critical role of toll-like receptors-from microbial recognition to autoimmunity: a comprehensive review[J]. Autoimmunity Reviews,2016, 15(1): 1-8. DOI:10.1016/j.autrev.2015.08.009.
[45]DOWLING J K, MANSELL A. Toll-like receptors: the swiss army knife of immunity and vaccine development[J]. Clinical &Translational Immunology, 2016, 5: 10. DOI:10.1038/cti.2016.22.
[46]LEIFER C A, MEDVEDEV A E. Molecular mechanisms of regulation of Toll-like receptor signaling[J]. Journal of Leukocyte Biology, 2016,100(5): 927-941. DOI:10.1189/jlb.2MR0316-117RR.
[47]KANG S S, SIM J R, YUN C H, et al. Lipoteichoic acids as a major virulence factor causing inflammatory responses via Toll-like receptor 2[J]. Archives of Pharmacal Research, 2016, 39(11): 1519-1529.DOI:10.1007/s12272-016-0804-y.
[48]JIMENEZ-DALMARONI M J, RADCLIFFE C M, HARVEY D J,et al. Soluble human TLR2 ectodomain binds diacylglycerol from microbial lipopeptides and glycolipids[J]. Innate Immunity, 2015,21(2): 175-193. DOI:10.1177/1753425914524077.
[49]WANG Shaohua, AHMADI S, NAGPAL R, et al. Lipoteichoic acid from the cell wall of a heat killed Lactobacillus paracasei D3-5 ameliorates aging-related leaky gut, inflammation and improves physical and cognitive functions: from C. elegans to mice[J]. Geroscience, 2020,42(1): 333-352. DOI:10.1007/s11357-019-00137-4.
[50]LEE Y D, HONG Y F, JEON B, et al. Differential cytokine regulatory effect of three Lactobacillus strains isolated from fermented foods[J].Journal of Microbiology and Biotechnology, 2016, 26(9): 1517-1526.DOI:10.4014/jmb.1601.01044.
[51]GINSBURG I. Role of lipoteichoic acid in infection and inflammation[J]. Lancet Infectious Diseases, 2002, 2(3): 171-179.DOI:10.1016/s1473-3099(2)00226-8.
[52]WU Zhenghao, ZHANG Zhenxiong, LEI Zehua, et al. CD14: Biology and role in the pathogenesis of disease[J]. Cytokine & Growth Factor Reviews, 2019, 48: 24-31. DOI:10.1016/j.cytogfr.2019.06.003.
[53]KIM H, JUNG B J, JEONG J, et al. Lipoteichoic acid from Lactobacillus plantarum inhibits the expression of platelet-activating factor receptor induced by Staphylococcus aureus lipoteichoic acid or Escherichia coli lipopolysaccharide in human monocyte-like cells[J].Journal of Microbiology and Biotechnology, 2014, 24(8): 1051-1058.DOI:10.4014/jmb.1403.03012.
[54]MATSUGUCHI T, TAKAGI A, MATSUZAKI T, et al. Lipoteichoic acids from Lactobacillus strains elicit strong tumor necrosis factor alpha-inducing activitives in macrophages through toll-like receptor 2[J]. Clinical and Diagnostic Laboratory Immunology, 2003, 10(2):259-266. DOI:10.1128/cdli.10.2.259-266.2003.
[55]NILSEN N J, DEININGER S, NONSTAD U, et al. Cellular trafficking of lipoteichoic acid and Toll-like receptor 2 in relation to signaling;role of CD14 and CD36[J]. Journal of Leukocyte Biology, 2008,84(1): 280-291. DOI:10.1189/jlb.0907656.
[56]CLAES I J, SEGERS M E, VERHOEVEN T L, et al. Lipoteichoic acid is an important microbe-associated molecular pattern of Lactobacillus rhamnosus GG[J]. Microbial Cell Factories, 2012, 11: 161-169.DOI:10.1186/1475-2859-11-161.
[57]VÉLEZ M N P, VERHOEVEN T L A, DRAING C, et al. Functional analysis of D-alanylation of lipoteichoic acid in the probiotic strain Lactobacillus rhamnosus GG[J]. Applied and Environmental Microbiology, 2007, 73(11): 3595-3604. DOI:10.1128/aem.02083-06.
[58]SELLE K, GOH Y J, JOHNSON B R, et al. Deletion of lipoteichoic acid synthase impacts expression of genes encoding cell surface proteins in Lactobacillus acidophilus[J]. Frontiers in Microbiology,2017, 8: 553. DOI:10.3389/fmicb.2017.00553.
[59]MIZUNO H, ARCE L, TOMOTSUNE K, et al. Lipoteichoic acid is involved in the ability of the immunobiotic strain Lactobacillus plantarum CRL1506 to modulate the intestinal antiviral innate immunity triggered by TLR3 activation[J]. Frontiers in Immunology,2020, 11: 571. DOI:10.3389/fimmu.2020.00571.
[60]LEE B, YIN X C, GRIFFEY S M, et al. Attenuation of colitis by Lactobacillus casei BL23 is dependent on the dairy delivery matrix[J].Applied and Environmental Microbiology, 2015, 81(18): 6425-6435.DOI:10.1128/aem.01360-15.
[61]KHAZAIE K, ZADEH M, KHAN M W, et al. Abating colon cancer polyposis by Lactobacillus acidophilus deficient in lipoteichoic acid[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(26): 10462-10467. DOI:10.1073/pnas.1207230109.