透明质酸(hyaluronic acid,HA)(图1),俗称玻尿酸,最早由美国哥伦比亚大学教授Meyer和Plamer从牛眼玻璃体中分离得到[1]。自然界中,HA广泛存在于动物的各种组织中,如关节腔、血管、心脏、眼、脑及皮肤等,其由D-葡萄糖醛酸(D-glucuronic acid,GlcA)和N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)通过β-1,3糖苷键相连组成双糖单元结构,然后又通过β-1,4-糖苷键连接形成线性非硫酸化的糖胺聚糖。一个完整的HA分子中重复双糖单元的数量可以达到10 000或更多,分子质量约为400万 Da(每个双糖分子质量约为400 Da)[2]。HA广泛分布于细胞外间质(extracellular matrix,ECM),并以高浓度存在于结缔组织中,如皮肤、滑液和玻璃体液[3]。HA是关节滑液的主要成分,起到润滑、减震、滋养关节的作用。其在人体膝关节中的质量浓度约为2~3 mg/mL,年轻人略高于老年人[4-5]。HA也是眼睛玻璃体的主要成分,但质量浓度较低,约为200 μg/mL[6];其次,HA在肺、肾、脑和肌肉中也有一定量的分布,但在肝脏组织中很少,在血清中的含量最低[3]。
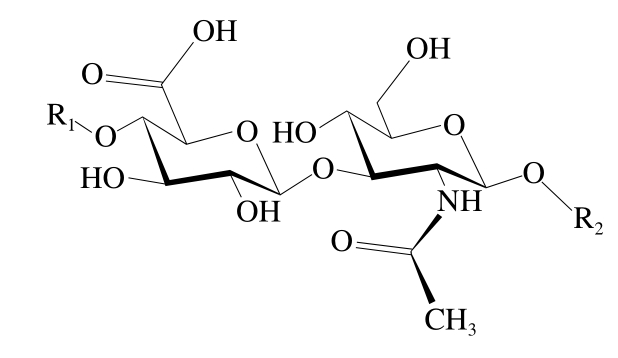
图1 HA的分子结构示意图
Fig. 1 Molecular structure of HA
体内的HA由HA合成酶(hyaluronan synthase,HAS)合成,其家族共有3个成员,分别为HAS1、HAS2和HAS3,主要合成分子质量为100~2 000 kDa的HA。HA可以被HA酶切割降解;人类有6个HA酶基因,它们编码具有不同特性和细胞位置的HA酶[7]。HA在体内是动态分子,其合成和降解的过程均受到严格的调控。哺乳动物每天降解并重新合成的HA约占其总量的三分之一(质量约为5 g),以保证HA保持发挥其最佳生理效应[3]。HA的代谢半衰期在不同组织间、根据其发挥的不同作用而有较大变化,在皮肤中的代谢半衰期只有1.5 d,而在软骨组织中则可维持2~3 周[8]。此外利用一些工程细菌(如链球菌属)也可在体外通过发酵技术生物合成外源性HA,其与动物体内合成的内源性HA非常一致[9-11]。
HA具有超强的保水能力,能够与自身质量1 000 倍的水结合。皮肤、结缔组织、关节滑膜液、眼睛玻璃体中含有较高浓度的HA,发挥细胞维持、保水、营养物质运输等重要生理功能。此外,HA及其盐还在润滑、溶质运输、细胞迁移、中性粒细胞黏附、细胞相互作用、细胞分裂、骨吸收、伤口愈合等方面扮演重要的角色[12]。HA作为一种医疗辅助剂,在眼科、骨科、皮肤、整形、内镜、烧伤等领域有着广泛的应用。然而,与其他国家相比,我国HA产品的研发和临床使用范围尚为有限。在海外市场中,食品级HA原料已广泛用于各种食饮料及保健品等。2021年1月7日,国家卫生健康委员会(以下简称卫健委)发文,批准透明质酸钠(即玻尿酸)为“新食品原料”,可应用于普通食品添加[13]。原卫生部副部长张凤楼在2021年“推动新食品原料应用,发展食物营养健康产业——功能性食品发展趋势圆桌论坛”上表示,“新食品原料”不仅丰富了食品内容,满足不同健康需求,也将促进相关产业发展,意义重大[14]。与皮下注射相比,口服HA具有无需专业人员操作、患者无需忍受痛楚、使用依从性高等诸多优势。本文综述目前已发表的经口给予HA相关代表性研究成果,主要关注HA在体内的吸收、分布和代谢途径,以及HA对于不同组织、器官的作用功效,并结合药理、毒理研究为口服HA产品的开发和应用提供科学依据,同时提高大众对于口服HA的正确认知。
1 经口给予HA的吸收与代谢
根据分子质量的不同,HA可以分为高分子质量HA(high molecular weight HA,HMW-HA,≥1 000 kDa)、中等分子质量HA(medium molecular weight HA,MMW-HA,250~1000 kDa)、低分子质量HA(low molecular weight HA,LMW-HA,10~250 kDa)以及寡聚HA(oligo HA,OHA,<10 kDa)。有研究表明,鸡梳状细胞来源的MMW-HA(900 kDa)经口给予后80%能够被机体吸收,而后部分HA运转至皮肤、关节等部位[15]。在放射性标记的HMW-HA经口给药实验中,大约90%的HA可以在机体内检测到,主要集中在粪便[16-17]。使用Caco-2细胞(人克隆结肠腺癌细胞,结构和功能类似于分化的小肠上皮细胞)进行的实验结果显示,分子质量大于等于100 kDa的HA难以被细胞直接吸收,分子质量不超过70 kDa的HA则可以渗透进入肠上皮细胞,更低分子质量的HA(≤5 kDa)还可以通过被动扩散进入细胞内[18]。另外,HA经口给予的吸收效果与相对分子质量有相关性,推测一种或多种蛋白质(HA受体)介导了HA的吸收,且蛋白质与HA的亲和力具有相对分子质量相关性[19-20]。以上结果提示,根据其分子质量不同,HA经口给予后的吸收部位、吸收方式和进入血液循环的途径都有所不同,而HA的介导转运有待更多的研究阐明。
经口给予HA后,其在体内的滞留时间分别为:胃部2 h、小肠4 h、盲肠24 h(图2)[15-16]。人造胃液和人造小肠液的体外实验研究结果显示,HA不会被人造胃液或人造小肠液中的酶降解,反而能够在盲肠内容物中被降解为寡糖,且以二糖为主。HA在大肠中被分解后,在盲肠、结肠和直肠区域均会被吸收,未吸收部分则由粪便排出体外。HA被吸收后进入血液循环,而后转运至其他组织和器官[17]。同位素示踪法给药实验结果显示,小鼠经口给予HA后,HA能够迅速经血液分布至各组织中,13个受检组织(包括眼球、脑、皮肤、睾丸、骨骼肌、脂肪、肝脏、脾脏、肾脏、肺、心脏、小肠、胃)均有不同程度的放射性分布。其中,在0~4 h内,脾脏的代谢速率快于肝脏,睾丸和皮肤的代谢速率较慢;在0~12 h内,38.7%的放射性经粪便排出、18.6%的放射性经尿液排出[21]。HMW-HA可以通过内吞或胞饮进入细胞内,即细胞膜脂质层或网格蛋白包被高分子HA后通过内陷过程完成内吞。HA可在内吞小体中被HA酶1降解为HA寡糖;HA寡糖会被β-D-GlcA酶和β-N-乙酰-D-己糖胺酶通过协同活性降解为GlcA和GlcNAc结构单元或者HA寡糖通过胞吐被排出细胞外,胞吐的HA片段具有多种生物学功能[22]。上述结果提示HMW-HA需要经过胞饮/内吞进入胞内被降解,其降解片段再经胞吐作用被排至胞外发挥其生物学效应。
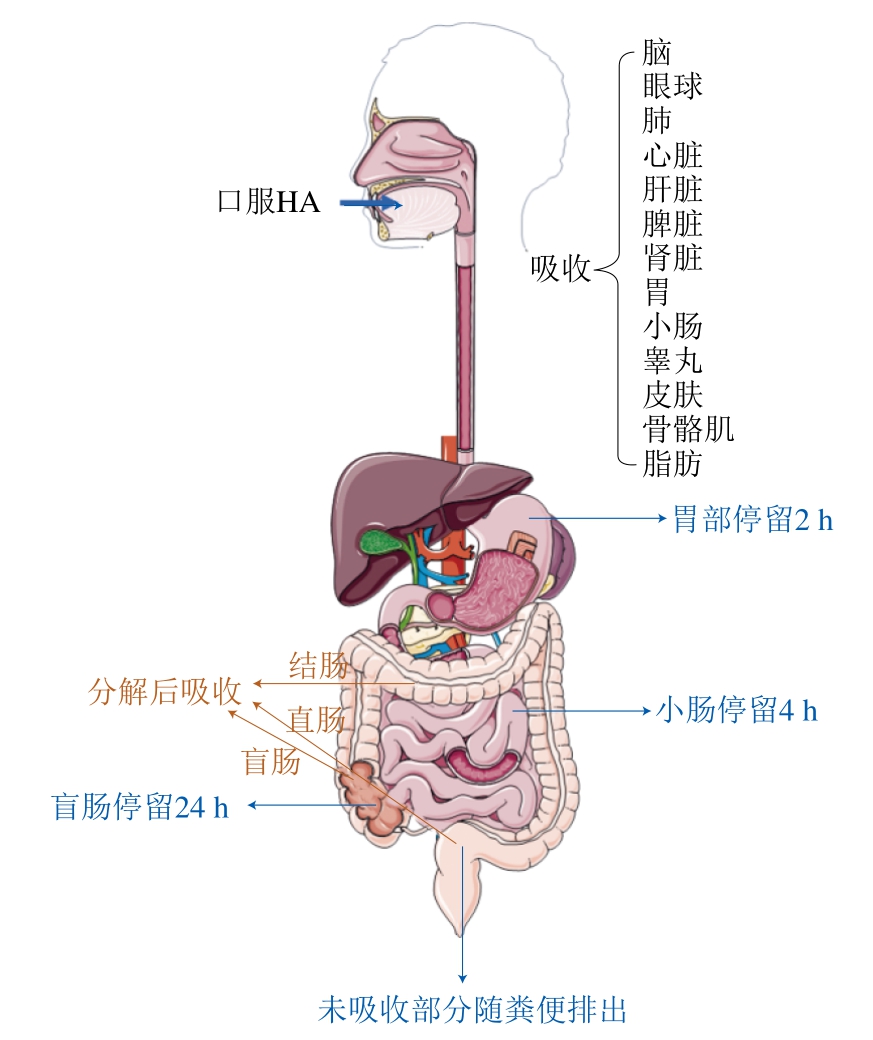
图2 经口给予HA的吸收途径
Fig. 2 Absorption pathways of oral HA
肠道微生物中含有的HA酶将HA降解为不饱和2~6元糖,不饱和HA可以被结肠细胞吸收,通过血液循环运转至关节、皮肤等多个部位。人的肠道中具有能够有效降解HA的拟杆菌属HJ-15(Bacteroides stercoris HJ-15)、金黄色葡萄球菌(Staphylococcus aureus)、产气荚膜梭菌(Clostridium perfringens)[23-25]。另外,乳杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium)也能够在HA吸收过程中发挥重要的作用[26]。基于HA在肠道中能被降解的特性,针对不同分子质量的HA设计出更加有效、靶向病灶部位转移并发挥功能的口服制剂,是口服HA在未来制剂中的一个不可忽略的方向。
2 经口给予HA对皮肤健康的影响
皮肤作为人体最大的器官,是保护机体免受外界有害物质入侵和水分流失的第一道屏障。随着年龄的增长和紫外线的长期辐射,加之吸烟、空气污染物等外界不良刺激,皮肤的屏障功能逐渐受损,外在表现为皮肤变薄、干燥、弹性缺失、细纹形成等皮肤衰老或炎症表征,实则为年龄相关的细胞内脂质减少以及角质层中游离氨基酸和特定盐等自然保湿因子减少所造成[27-29]。皮肤中HA的含量是皮肤含水量的决定性因素之一。HA含量的减少会降低皮肤张力,增加皮肤干燥[30]。
皮肤中的HA由表皮角质细胞和真皮成纤维细胞中的HAS合成,其中真皮中的HA含量高于表皮[31-32]。在真皮中,HA通过其高保水性和黏性调节水平衡和维持细胞结构[33]。外用HA能够增强皮肤天然防御功能,加速伤口愈合;改善皮肤生理特性,提高皮肤紧致程度,缓解皮肤炎症和皱纹生成;刺激真皮层成纤维细胞,进而促进胶原蛋白合成。近年来,作为面部抗衰除皱的一种方法,局部HA填料在医疗美容手术中得到了广泛的应用,HA注射到真皮层可以长期改善面部皱纹并增强面部软组织,与胶原蛋白相比副作用更小、耐受性更好[34]。
连续经口摄入HA 30 d后,小鼠皮肤中游离HA含量显著升高,推测外源性HA经口给予后可能进入到皮肤HA的游离库中作为储备[35]。一项随机、双盲、安慰剂对照的临床研究发现,口服摄入HA可以增加皮肤水分,改善皮肤干燥;通过检测受试者血清丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)的含量变化,发现口服HA还具有抗氧化功效[36]。一方面,HA可以被机体吸收并运转至皮肤部位,同时,摄入的HA还有助于增加自身HA的合成,促进皮肤成纤维细胞增殖。此外,有研究认为口服HA的保湿效果并不依赖于HA的来源和分子质量[37]。口服HA可以提高紫外照射后皮肤中水分含量以及减缓皱纹生成和皮肤老化速率[38-39]。来自日本东京东穗大学医学中心皮肤科的一项研究结果显示,持续12 周、每天口服120 mg的高分子质量(300 kDa)或低分子质量(2 kDa)HA均可以显著提升受试者的皮肤光泽程度和柔韧性、淡化鱼尾纹[40]。
HA经口给予可以被肠道内的细菌降解为极低分子质量的HA寡糖(1~2 kDa),而后通过血液循环或淋巴循环迁移至皮肤[17]。HA寡糖具有重要的生理学意义,包括改善紫外照射后皮肤功能的恢复、磷酸化CD44进而诱导表皮分化[41]等。HA与存在于角质形成细胞表面的受体CD44相结合,通过一系列信号转导发挥其功能[42]。此外,HA寡糖能够同时作为刺激因子和原料增加皮肤成纤维细胞中HMW-HA的合成[43]。HMW-HA通过促进成纤维细胞增殖以填充细胞间隙、增加皮肤细胞内HA总量来共同抑制皮肤的水分流失;HMW-HA还可以减少紫外线诱导的表皮细胞凋亡,进而防止表皮厚度增加[44]。与HMW-HA相比,LMW-HA具有更强的清除自由基和抗氧化活性,因此口服LMW-HA能够显著减少紫外照射对皮肤的氧化应激[44]。在特定情况下,HA可以与氧自由基发生反应,通过HA的降解来清除过量的自由基[45]。综上所述,LMW-HA和HMW-HA均可转移至皮肤,促进成纤维细胞增殖和HA再合成,最终实现改善皮肤状态、减缓皮肤衰老的功效。
HA对皮肤保持水分、维持弹性、塑形美容以及保持其防御功能等的效应已经得到广泛的验证和认可。目前的给药途径主要是经皮吸收和皮下/局部注射等,而口服HA无疑更加经济、方便,依从性更好,如何根据其不同的分子质量、不同的作用效应、不同的吸收模式以及不同的使用目的等设计出更有效、更安全、更便利的口服HA制剂,针对不同人群的不同诉求进行精准治疗或干预,将是未来口服HA惠及更多人群的策略之一。
3 经口给予HA对关节的影响
骨关节炎(osteoarthritis,OA)是一种与衰老相关的退行性疾病,随着人们平均预期寿命的延长,近年来该病发病率呈上升趋势。流行病学统计显示,世界范围内65 岁及以上人口中50%患有OA。其中,膝关节炎是OA的主要类型。HA作为关节滑膜液的主要成分,内源性HA浓度和分子质量的降低是导致滑膜液黏弹性下降和炎症发生的重要原因,因此在临床中HA通常被用于治疗膝关节骨性关节炎[46]。经口给予HA能够有效预防并治疗小鼠骨关节炎,减轻关节红肿症状,改善血清指标,包括肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素(interleukin,IL)-1、MDA和SOD水平等[47-49],且将硫酸氨基葡萄糖作为口服HA佐剂后增效明显[50]。相关研究显示,口服HA能够有效减轻膝关节炎的疼痛[46];2008—2015年进行的随机、双盲、安慰剂对照实验结果表明,口服HA可用于治疗滑膜炎相关症状,缓解膝关节疼痛、滑膜积液和炎症,提高膝关节力量等[46]。连续8 周口服HA后,关节疼痛患者的疼痛感、僵硬感都有明显缓解[51]。膝关节OA患者服用富含HA的鸡冠提取物后,疼痛明显减轻[52],并且其还能够抑制球员的软骨降解并促进骨重塑[53];分子质量为900 kDa的HA能够有效治疗膝盖骨关节炎[54];膝关节疼痛患者连续3个月口服含鸡冠提取物的酸奶后,肌肉功能改善、滑膜积液减少以及疼痛减轻[55];而口服HMW-HA(2 500~2800 kDa)也能够减缓慢性关节疼痛[56]。与注射用HA相比,口服HA对于患者的依从性更高、副作用更小,且经济、方便,具有更广阔的应用前景和开发潜力。
关于HA缓解关节疼痛的原因,目前主要有以下几种可能的机制。一方面,HA通过直接调节免疫,抑制炎症反应,从而实现对关节疼痛的改善。此类观点认为,HMW-HA与CD44的结合使其具有抗炎作用,可能通过抑制IL-2介导的II类胶原mRNA表达下调起到在关节中的消炎和镇痛作用[56-57]。然而HA可作用于多种靶点,具体的相互作用机制,不同研究者提出了不同的推测。Asari等在研究HA经口给予后对小鼠肠道免疫调节的影响时指出,HA可通过与TLR-4蛋白结合调节信号通路抑制因子3(suppressor of cytokine signaling-3,SOCS3),这一因子亦有助于关节炎的改善[58]。Oe、Asari等认为,HA通过TLR-4蛋白的调节通路在关节炎改善中同样起到作用[46,58]。Tashiro等则认为这种调节机制下,HA可能保留在肠道发挥相关作用而不必吸收至关节[59]。
HA也可能通过分解产生活性因子对关节疼痛起到抑制作用。葡萄糖胺是一种可以减轻膝骨关节炎症状并可以抑制疾病进展的膳食补充剂。在体内,通过一系列溶酶体酶的作用,葡萄糖胺在细胞内转化为N-乙酰基谷氨酰胺。HA在体内分解产生GlcNAc,该产物进一步转化可得到N-乙酰基谷氨酰胺,因此,口服HA可能以与葡萄糖胺类似的机制改善关节疼痛[59]。HA尤其是HMW-HA对OA特别是膝关节炎的治疗效果已经得到广泛认可,而如何能够提高口服HMW-HA的生物学利用度是未来该治疗领域需要攻克的难题之一。
4 经口给予HA对于肠道健康的影响
菌群与肠道功能之间的反馈调节是维持肠道稳态的关键。由环境、遗传、感染、免疫等综合因素而引起的一种肠道黏膜免疫系统异常反应称为炎症性肠病(inflammatory bowel disease,IBD),主要表现为肠道黏液层的损害、伴随着肠道屏障功能的缺失和严重的肠道菌群失调。基于HA的纳米颗粒药物以其安全性高、副作用小、效果良好的优势正在逐渐替代IBD的传统治疗药物。HA-胆红素纳米药物(hyaluronic acidbilirubin nanomedicine,HABN)能够靶向调节结肠炎模型小鼠的肠道屏障功能、菌群稳态以及免疫反应[60]。一方面,HA本身具有免疫调节特性,能够激活巨噬细胞、树突状细胞和调节性T细胞(regulatory T cell,Treg细胞)并减少中性粒细胞和单核细胞数量,诱导抗菌肽表达,发挥抗炎、修复肠道屏障功能的作用;另一方面,以HA为亲水载体,使得疏水性的抗氧化药物(例如胆红素)得以通过口服、吸收进入细胞内发挥作用。研究结果显示,HABN有效抑制了由于葡聚糖硫酸钠所致的结肠组织损伤和免疫细胞浸润,同时,肠道组织中紧密连接蛋白(Claudins、Occludin、ZO-1)表达水平升高、促炎因子和凋亡因子的表达水平降低等。16S rRNA测序结果显示,HABN能够显著提高肠道菌群多样性并改善菌群失调,增加Akkermansia muciniphila、Clostridium XIVα、Lactobacillus等益生菌丰度。其中,A. muciniphila促进肠道内黏液生成和紧密连接蛋白表达,Clostridium XIVα的代谢产物丁酸可以激活固有层中的Treg细胞,乳酸菌发挥良好的抗炎活性[60]。另有研究报道,HA经口给予后能够提高小鼠对肠道李斯特氏菌(Listeria monocytogenes)、柠檬酸杆菌(Citrobacter rodentium)、肠致病性大肠杆菌(enteropathogenic Escherichia coli)感染的控制能力,即HA经口给予后能显著降低小鼠体内的有害细菌的载量[61]。
随着饮食方式的改变,我国居民胃食管反流症的发生率逐年提高,患者的胃酸和胆汁从胃部反流至食管,引起食管炎症和胃灼热。HA作为一种高分子质量的糖胺聚糖,能够组装成网状结构和分子框架作为过滤器,防止高分子质量物质的扩散[62]。基于HA和硫酸软骨素的生物黏合剂作为机械屏障覆盖食管黏膜,改善胃酸和胃蛋白酶造成的食管黏膜损伤、减弱黏膜渗透性,对于胃食管反流症具有良好的改善效果[63]。同时,HA参与溃疡愈合的关键过程,包括调控上皮细胞分化、促进上皮形成和黏膜水化等。对于患者来说,该药物起效迅速、显著减缓胃部烧灼感(烧心)和反酸的发生,50%的患者在用药期间症状完全消失,另外,HA建立起的黏膜层屏障,还可以用于治疗复发性口腔溃疡[63]。提示在黏膜溃疡创面愈合的治疗上,HA是一个非常有潜力的候选药物。
HA在增强肠道的先天性防御方面发挥着重要的作用,在受损组织中,大分子HA被分解为具有诱导炎症基因表达能力的HA片段,HA片段通过Toll样受体(Toll-like receptor,TLR)作为内源性“危险信号”或“损伤相关的分子”被机体识别,并诱导产生局部先天防御反应[64-66]。一种小于750 kDa的HA片段通过TLR4依赖的信号通路保护结肠炎小鼠模型免受菌群紊乱介导的肠道上皮细胞损伤[67]。LMW-HA还可以提高抗菌肽蛋白表达水平,其对于包括沙门氏菌(Salmonella)在内的多种人类病原体具有直接的抗菌活性,进而维持上皮细胞屏障完整,增强胃肠道、泌尿生殖系统、肺上皮、阴道等的上皮防御功能[68-69]。分子质量为35 kDa的HA(HA35)在小鼠模型中被多次证明能够通过维持肠道屏障功能进而预防肠道细菌感染和减少肠道炎症;在幼犬模型上,其同样展现出良好地降低肠道通透性、抑制细菌移位定植、减少促炎因子释放的功效[70]。值得注意的是,在所有特定分子质量大小的HA中,HA35是紧密连接蛋白和抗菌肽表达最有效的诱导剂。另外,HA35作为一种抑菌剂可以抑制克雷伯氏菌(Klebsiella)、沙门氏菌(Salmonella)的感染,从而降低菌血症和系统炎症水平。另有研究提出,HA对于结肠炎的另一个保护机制是影响紧密连接蛋白的表达和定位。肠道发生炎症时,紧密连接蛋白在细胞膜上的分布显著减少;而经口给予HA35治疗组的结肠炎小鼠、幼犬以及患者的结肠上皮细胞的紧密连接蛋白表达显著高于非治疗组[70-72],提示HA35能够显著提高病灶部位紧密连接蛋白的表达或者募集,抑制炎症的发生发展。
HA通过与肠道受体(TLR4、TLR2)结合,促进抗炎细胞因子IL-10和细胞因子SOCS3的表达,从而发挥抗炎作用[58]。在酒精诱发的肝损伤模型中,HA35经口给予可以恢复Toll相互作用蛋白(Tollip)的水平,其与IL-1受体相关激酶1形成复合物,进而抑制炎症相关蛋白转录因子核因子κB的活化,降低TNF-α的表达;Tollip还可以通过与受体的直接相互作用减少TLR4、TLR2介导的炎症反应[73]。这些实验结果展示了HA抵御肠道炎症的多途径、多靶点、多效应的广谱作用特征。
5 经口给予HA对于眼部的影响
干眼病(dry eye disease,DED)是一种常见的慢性眼表疾病,特征为泪膜稳态的紊乱,主要表现为泪膜不稳定、高渗、炎症以及神经感觉异常,最终导致眼部不适和视力障碍[74-75]。DED的基础治疗主要依靠滴加润滑性滴眼剂或增黏剂等。HA作为一种大分子黏多糖,广泛分布于结缔组织、上皮组织和神经组织[76-77],已被添加进泪液补充剂用于治疗DED,作为一种局部药剂起到增强润滑的作用,同时还能够促进角膜上皮伤口的愈合[78-79]。
有研究通过单独使用0.15% HA眼用悬浮液的局部润滑剂(对照组),以及HA局部顺滑剂结合每天240 mg的HA口服(390 kDa)的方式(实验组),比较了两种方案对DED的治疗效果。采用检测眼表疾病指数(ocular surface disease index,OSDI)进行评分,用泪膜破裂时间(tear break up time,TBUT)和角膜荧光素染色(corneal fluorescein staining,CFS)斑点数来评估口服HA对于治疗DED的效果。结果显示,口服和局部HA联合用药治疗DED的效果显著优于单独HA局部用药[80],提示口服HA具有协同治疗DED的潜在优势。
机制研究表明,在治疗DED的研究中,研究者根据眼表CD4+ T细胞的存在以及局部施用环孢菌素(一种T细胞活性抑制剂)对眼表炎症的改善结果,提出了适应性免疫机制在DED中的作用[81]。并且越来越多的证据支持CD4+ T细胞和DED致病性的关系[82-83]。而正如前面也提到的,经口给予MRLlpr/lpr(系统性红斑狼疮)自身免疫性疾病小鼠HMW-HA,可以调节Th-1型自身免疫疾病和炎症[58]。
此外,HA经口给予也能够促进角膜上皮伤口愈合。HA及其降解产物能够激活特定的细胞内反应,包括上皮细胞增殖、细胞凋亡和新血管形成等[84]。现在普遍认为HA激活细胞内反应相关的关键因素之一是CD44蛋白受体。HA是CD44的配体,CD44是多功能细胞表面黏附受体,在整个身体组织中广泛表达[85-86],并在人类的眼角膜也有表达[87]。相关的体外实验表明, HA可以促进角膜上皮伤口愈合和角膜上皮细胞的迁移,这些影响与细胞CD44有关[88-89]。
有意思的是,最早HA是从牛眼玻璃体中分离得到的,而直到目前为止,外源性的HA尤其是经口给予HA对人类眼睛玻璃体某些病变的影响和改善作用的相关研究报道甚少。未来,口服HA能否用于眼部相关疾病的预防和治疗仍亟待探究。
6 经口给予HA的安全性研究
对于口服HA安全性的探究始源较早。鸡冠,一种含有高浓度HA的食物,早已在法国、德国、中国等被消费者青睐,早期甚至将其视为皇家菜肴,“吃鸡冠可以变美”的说法也是得益于HA的功效。在日本,HA从1992年起被批准可以作为膳食补充剂,用以改善皮肤健康和缓解关节疼痛。在韩国、美国、加拿大、意大利、比利时等国家,HA也被认可作为食品添加剂和健康功能食品使用[46]。2021年1月,国家卫健委批准将HA的使用范围从保健品扩大至普通食品,从“外用”至“内服”的跨越归功于科学家们的多年探索和安全性验证。小鼠、大鼠、家兔、幼犬、人体等多个实验模型的研究结果显示,HA具有较高的安全性,不具有免疫原性,也并非过敏原,无生殖、发育和遗传毒性,对癌症转移无影响等[12]。
在一项双盲的人体实验中,连续12个月、每天口服200 mg HA以及连续8 周、每天口服240 mg HA均未显示出任何副作用[59,90];单剂量毒性实验结果显示,HA经口给予的最大半数致死量(median lethal doses,LD50)对于小鼠、大鼠、家兔来说分别为2 400、800、1 000 mg/kg,远超日常摄入推荐剂量[91]。重复剂量毒性研究结果显示,1 330 mg/kg连续经口给予90 d并未对家兔产生毒性作用[92]。同时,670 mg/kg的口服剂量也不会对大鼠造成生殖和发育毒性[93]。如表1所示,多个研究均证明口服HA具有较高的安全性。
表1 HA经口给予的安全性实验[46]
Table 1 Safety test of oral HA[46]

方法 对象 口服方案 结果 参考文献人随机、双盲、安慰剂对照实验60 mg/d;2 周 无相关不良反应 [94]人 48 mg/d;2个月 无相关不良反应 [52]人 240 mg/d;8 周 无相关不良反应 [90]人 200 mg/d;8 周 无相关不良反应 [54]人 60 mg/d;4个月 无相关不良反应 [95]人 200 mg/d;12个月 无相关不良反应 [59]人 52 mg/d;3个月 无相关不良反应 [96-97]人 225 mg/d;2 周;150 mg/d;2 周 无相关不良反应 [56]单剂量毒性实验小鼠 LD50 >2 400 mg/kg [91]小鼠 LD50 >500 mg/kg [98]大鼠 LD50 >800 mg/kg [91]大鼠 LD50 >200 mg/kg [99]家兔 LD50 >1 000 mg/kg [91]重复剂量毒性实验大鼠 1 500 mg/(kg mb·d);30 d 无损害剂量 [100]大鼠 1 333 mg/(kg mb·d);90 d 无损害剂量 [92]大鼠 1 000 mg/(kg mb·d);90 d 无损害剂量 [92]大鼠 3 500 mg/(kg mb·d);28 d 无损害剂量 [101]大鼠 12.5 mg/(kg mb·d);13 周 无损害剂量 [102]大鼠 48 mg/(kg mb·d);90 d;28 d回收实验 无损害剂量 [103]生殖与发育毒性实验 大鼠 670 mg/(kg mb·d) 无损害剂量 [93]对肿瘤影响实验 小鼠 200 mg/d;4 周 对肿瘤生长无影响 [104]
7 结 语
HA作为一种结构稳定的重复二糖(D-GlcA和GlcNAc)单元线性链状糖胺聚糖,广泛存在于机体细胞表面与细胞间基质中,具有多种生理功能,参与机体的多个生物学过程。HA经口给予后在体内被肠道菌群或酶降解为大小不同的片段,并被运送至不同部位分别发挥功能(图3)。随着年龄的增长,体内HA水平逐渐降低,口服HA有望对机体的HA进行补充,进而调节机体相关功能,促进和维持机体健康。目前,体内、体外实验以及患者双盲实验初步证明,口服HA在维持皮肤健康、修复关节损伤、调节肠道免疫、缓解干眼等方面扮演着重要的角色;同时,其安全性较高,不具有免疫原性、非过敏原,无生殖、发育和遗传毒性,对癌症转移无影响等。
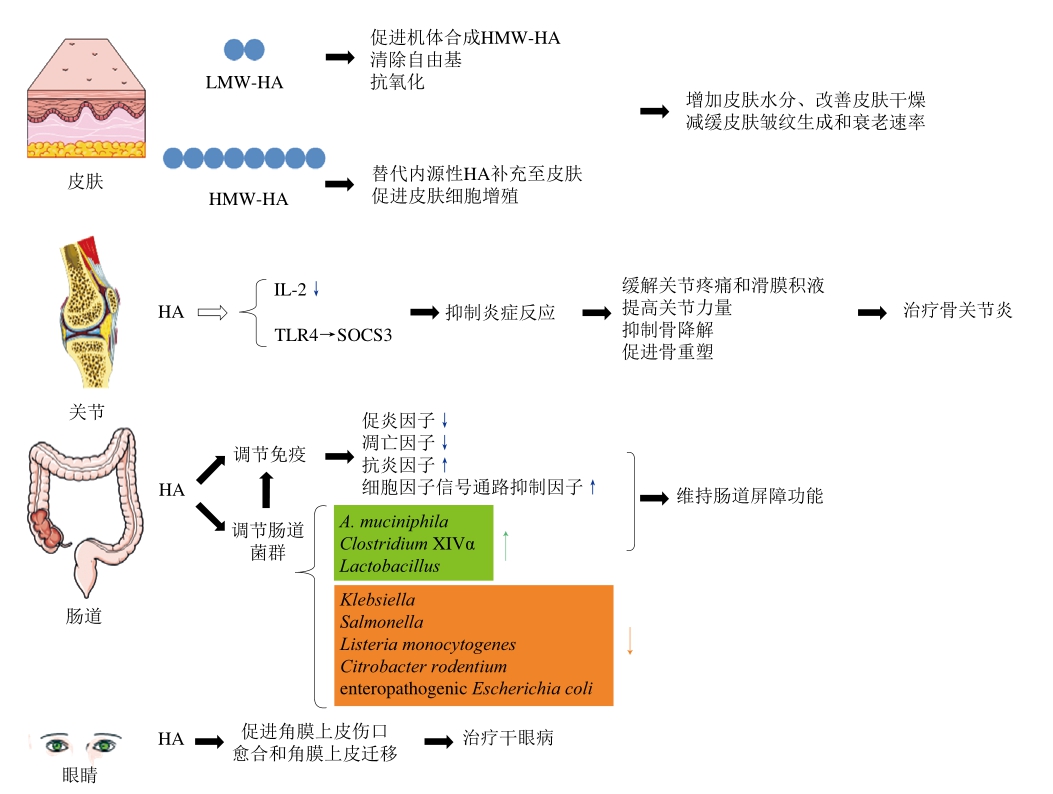
图3 经口给予HA的主要功能及其作用机制
Fig. 3 Function and mechanisms of oral HA
关于HA对于组织稳态维持和损伤修复的生物学功能及其具体机制仍有较多未知。总体来看,人体内HA的水平随年龄增加而下降,因此,长期口服HA是否能够延缓衰老或改善衰老相关疾病,其是否参与了经典的衰老信号通路的调控,也是值得关注的研究方向。已有研究显示,HA主要通过免疫调节参与炎症反应,然而,其对于2型糖尿病、脂肪肝等疾病发展过程中的炎症积累是否具有减缓作用等仍尚待探究。另一方面,针对不同分子质量HA分子的生物学功能和吸收转运机制的研究将会有效提高HA口服制剂的作用效率,同时,能够提高其精准靶向作用,增强其靶向应用价值。作为天然来源的药食兼用黏多糖分子,除了其已经广为人知的医药保健作用之外,HA作为一种不可多得的生物材料也具有潜在的巨大应用前景,值得重视研究和挖掘开发。
[1]MEYER K, PALMER J W. The polysaccharide of the vitreous humor[J]. Journal of Biological Chemistry, 1934, 107(3): 629-634.
[2]CYPHERT J M, TREMPUS C S, GARANTZIOTIS S. Size matters: molecular weight specificity of hyaluronan effects in cell biology[J]. International Journal of Cell Biology, 2015, 2015: 563818.DOI:10.1155/2015/563818.
[3]FRASER J R, LAURENT T C, LAURENT U B. Hyaluronan: its nature, distribution, functions and turnover[J]. Journal of Internal Medicine, 1997, 242(1): 27-33. DOI:10.1046/j.1365-2796.1997.00170.x.
[4]BALAZS E A, WATSON D, DUFF I F, et al. Hyaluronic acid in synovial fluid. I. Molecular parameters of hyaluronic acid in normal and arthritis human fluids[J]. Arthritis and Rheumatism, 1967, 10(4):357-376. DOI:10.1002/art.1780100407.
[5]DAHL L B, DAHL I M, ENGSTRÖM-LAURENT A, et al.Concentration and molecular weight of sodium hyaluronate in synovial fluid from patients with rheumatoid arthritis and other arthropathies[J]. Annals of the Rheumatic Diseases, 1985, 44(12): 817-822. DOI:10.1136/ard.44.12.817.
[6]OSTERLIN S. On the molecular biology of the vitreous in the aphakic eye[J]. Acta Ophthalmologica, 1977, 55(3): 353-361. DOI:10.1111/j.1755-3768.1977.tb06109.x.
[7]CSOKA A B, FROST G I, STERN R. The six hyaluronidase-like genes in the human and mouse genomes[J]. Matrix Biology, 2001, 20(8):499-508. DOI:10.1016/s0945-053x(1)00172-x.
[8]PANDEY M S, HARRIS E N, WEIGEL J A, et al. The cytoplasmic domain of the hyaluronan receptor for endocytosis (HARE)contains multiple endocytic motifs targeting coated pit-mediated internalization[J]. The Journal of Biological Chemistry, 2008, 283(31):21453-21461. DOI:10.1074/jbc.M800886200.
[9]DEANGELIS P L, PAPACONSTANTINOU J, WEIGEL P H.Molecular cloning, identification, and sequence of the hyaluronan synthase gene from group A Streptococcus pyogenes[J]. The Journal of Biological Chemistry, 1993, 268(26): 19181-19184. DOI:10.1111/j.1432-1033.1993.tb18209.x.
[10]DONG Y, ARIF A, OLSSON M, et al. Endotoxin free hyaluronan and hyaluronan fragments do not stimulate TNF-α, interleukin-12 or upregulate co-stimulatory molecules in dendritic cells or macrophages[J]. Scientific Reports, 2016, 6: 36928. DOI:10.1038/srep36928.
[11]WANG Y, HU L Y, HUANG H, et al. Eliminating the capsulelike layer to promote glucose uptake for hyaluronan production by engineered Corynebacterium glutamicum[J]. Nature Communications,2020, 11(1): 3120. DOI:10.1038/s41467-020-16962-7.
[12]BECKER L C, BERGFELD W F, BELSITO D V, et al. Final report of the safety assessment of hyaluronic acid, potassium hyaluronate,and sodium hyaluronate[J]. International Journal of Toxicology, 2009,28(Suppl 4): 5-67. DOI:10.1177/1091581809337738.
[13]食品安全标准与监测评估司. 解读《关于蝉花子实体(人工培植)等15 种“三新食品”的公告》[EB/OL]. (2021-01-07)[2021-07-29].http://www.nhc.gov.cn/sps/s7892/202101/7b251e3af454452e894dc6f5 5941be85.shtml.
[14]中国日报网. 从“可以抹”到“可以吃”,专家呼吁加强透明质酸等新食品原料的研发和应用[EB/OL]. (2021-05-31)[2021-07-29]. https://baijiahao.baidu.com/s?id=1701253770659855284&wfr=spider&for=pc.
[15]OE M, MITSUGI K, ODANAKA W, et al. Dietary hyaluronic acid migrates into the skin of rats[J]. Scientific World Journal, 2014, 2014:378024. DOI:10.1155/2014/378024.
[16]BALOGH L, POLYAK A, MATHE D, et al. Absorption, uptake and tissue affinity of high-molecular-weight hyaluronan after oral administration in rats and dogs[J]. Journal of Agricultural and Food Chemistry, 2008, 56(22): 10582-10593. DOI:10.1021/jf8017029.
[17]KIMURA M, MAESHIMA T, KUBOTA T, et al. Absorption of orally administered hyaluronan[J]. Journal of Medicinal Food, 2016, 19(12):1172-1179. DOI:10.1089/jmf.2016.3725.
[18]HISADA N, SATSU H, MORI A, et al. Low-molecular-weight hyaluronan permeates through human intestinal Caco-2 cell monolayers via the paracellular pathway[J]. Bioscience, Biotechnology,and Biochemistry, 2008, 72(4): 1111-1114. DOI:10.1271/bbb.70748.
[19]蒋秋燕, 凌沛学, 黄思玲, 等. 单剂量及多剂量口服透明质酸的吸收研究[C]// 第六届中国药学会学术年会. 北京: 中国药学会, 2006: 6.
[20]蒋秋燕, 凌沛学, 黄思玲, 等. 口服透明质酸在大鼠体内吸收机制的研究[J]. 中国药学杂志, 2005(23): 1811-1813.
[21]蒋秋燕, 凌沛学, 程艳娜, 等. 口服透明质酸在动物体内的分布[J]. 中国生化药物杂志, 2008(2): 73-76. DOI:10.3321/j.issn:1001-2494.2005.23.014.
[22]RODÉN L, CAMPBELL P, FRASER J R, et al. Enzymic pathways of hyaluronan catabolism[J]. The Biology of Hyaluronan, 1989, 143: 60-86. DOI:10.1002/9780470513774.ch5.
[23]AHN M Y, SHIN K H, KIM D H, et al. Characterization of a Bacteroides species from human intestine that degrades glycosaminoglycans[J]. Canadian Journal of Microbiology, 1998,44(5): 423-429. DOI:10.1139/cjm-44-5-423.
[24]JONES R C, DECK J, EDMONDSON R D, et al. Relative quantitative comparisons of the extracellular protein profiles of Staphylococcus aureus UAMS-1 and its sarA, agr, and sarA agr regulatory mutants using one-dimensional polyacrylamide gel electrophoresis and nanocapillary liquid chromatography coupled with tandem mass spectrometry[J]. Journal of Bacteriology, 2008, 190(15): 5265-5278.DOI:10.1128/jb.00383-08.
[25]SHIMIZU T, OHTANI K, HIRAKAWA H, et al. Complete genome sequence of Clostridium perfringens, an anaerobic flesh-eater[J].Proceedings of the National Academy of Sciences, 2002, 99(2): 996-1001. DOI:10.1073/pnas.022493799.
[26]ISHIBASHI G, YAMAGATA T, RIKITAKE S, et al. Digestion and fermentation of hyaluronic acid[J]. Journal for the Integrated Study of Dietary Habits, 2002, 13(2): 107-111. DOI:10.2740/jisdh.13.107.
[27]SIMPSON R M, MERAN S, THOMAS D, et al. Age-related changes in pericellular hyaluronan organization leads to impaired dermal fibroblast to myofibroblast differentiation[J]. The American Journal of Pathology, 2009, 175(5): 1915-1928. DOI:10.2353/ajpath.2009.090045.
[28]HOLMES M W, BAYLISS M T, MUIR H. Hyaluronic acid in human articular cartilage. Age-related changes in content and size[J].Biochemical Journal, 1988, 250(2): 435-441. DOI:10.1042/bj2500435.
[29]UITTO J. Understanding premature skin aging[J]. The New England Journal of Medicine, 1997, 337(20): 1463-1465. DOI:10.1056/nejm199711133372011.
[30]OH J H, KIM Y K, JUNG J Y, et al. Intrinsic aging- and photoagingdependent level changes of glycosaminoglycans and their correlation with water content in human skin[J]. Journal of Dermatological Science, 2011, 62(3): 192-201. DOI:10.1016/j.jdermsci.2011.02.007.
[31]SAYO T, SUGIYAMA Y, TAKAHASHI Y, et al. Hyaluronan synthase 3 regulates hyaluronan synthesis in cultured human keratinocytes[J].Journal of Investigative Dermatology, 2002, 118(1): 43-48.DOI:10.1046/j.0022-202x.2001.01613.x.
[32]RöCK K, GRANDOCH M, MAJORA M, et al. Collagen fragments inhibit hyaluronan synthesis in skin fibroblasts in response to ultraviolet B (UVB): new insights into mechanisms of matrix remodeling[J]. Journal of Biological Chemistry, 2011, 286(20): 18268-18276. DOI:10.1074/jbc.M110.201665.
[33]STERN R, MAIBACH H I. Hyaluronan in skin: aspects of aging and its pharmacologic modulation[J]. Clinics in Dermatology, 2008, 26(2):106-122. DOI:10.1016/j.clindermatol.2007.09.013.
[34]ESSENDOUBI M, GOBINET C, REYNAUD R, et al. Human skin penetration of hyaluronic acid of different molecular weights as probed by Raman spectroscopy[J]. Skin Research and Technology, 2016,22(1): 55-62. DOI:10.1111/srt.12228.
[35]蒋秋燕, 凌沛学, 张天民, 等. 连续口服透明质酸的吸收研究[C]//中国药学会全国骨科药物与临床应用学术研讨会. 北京: 中国药学会学术会务部, 2006: 5.
[36]冯宁, 石艳丽, 郭风仙, 等. 口服透明质酸对皮肤水分的改善作用及体内抗氧化作用研究[J]. 食品与药品, 2016, 18(6): 386-390.DOI:10.3969/j.issn.1672-979X.2016.06.003.
[37]KAWADA C, YOSHIDA T, YOSHIDA H, et al. Ingested hyaluronan moisturizes dry skin[J]. Nutrition Journal, 2014, 13: 70.DOI:10.1186/1475-2891-13-70.
[38]KAWADA C, WATANABE M, NOMURA Y, et al. Orally administrated hyaluronic acid improves photoaged skin in hairless mice[J]. Japanese Pharmacology and Therapeutics, 2013, 41(7): 697-704.
[39]KAWADA C, KURIHARA H, KIMURA M, et al. Orally administered hyaluronan affects skin dryness and epidermal thickening in photoaged hairless mice[J]. Bioscience, Biotechnology, and Biochemistry, 2016,80(6): 1192-1195. DOI:10.1080/09168451.2016.1146065.
[40]OE M, SAKAI S, YOSHIDA H, et al. Oral hyaluronan relieves wrinkles: a double-blinded, placebo-controlled study over a 12-week period[J]. Clinical, Cosmetic and Investigational Dermatology, 2017,10: 267-273. DOI:10.2147/ccid.S141845.
[41]KAGE M, TOKUDOME Y, MATSUNAGA Y, et al. Effect of hyaluronan tetrasaccharides on epidermal differentiation in normal human epidermal keratinocytes[J]. International Journal of Cosmetic Science, 2014, 36(1): 109-115. DOI:10.1111/ics.12105.
[42]BOURGUIGNON L Y. Matrix hyaluronan-activated CD44 signaling promotes keratinocyte activities and improves abnormal epidermal functions[J]. The American Journal of Pathology, 2014, 184(7): 1912-1919. DOI:10.1016/j.ajpath.2014.03.010.
[43]LÜKE H J, PREHM P. Synthesis and shedding of hyaluronan from plasma membranes of human fibroblasts and metastatic and nonmetastatic melanoma cells[J]. The Biochemical Journal, 1999, 343: 71-75. DOI:10.1042/0264-6021:3430071.
[44]KAWADA C, KIMURA M, MASUDA Y, et al. Oral administration of hyaluronan prevents skin dryness and epidermal thickening in ultraviolet irradiated hairless mice[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 153: 215-221. DOI:10.1016/j.jphotobiol.2015.09.020.
[45]蒋秋燕, 凌沛学, 张天民. 透明质酸口服给药的研究进展[J].中国药学杂志, 2006(10): 729-731. DOI:10.3321/j.issn:1001-2494.2006.10.003.
[46]OE M, TASHIRO T, YOSHIDA H, et al. Oral hyaluronan relieves knee pain: a review[J]. Nutrition Journal, 2016, 15(1): 11. DOI:10.1186/s12937-016-0128-2.
[47]刘杰. 口服透明质酸对实验性小鼠骨关节炎的作用及其药物动力学的初步探讨[D]. 上海: 第二军医大学, 2011: 20-27.
[48]陈洁, 增田泰伸, 臼田美香, 等. 口服透明质酸对小鼠佐剂性关节炎的作用[J]. 食品科学, 2012, 33(23): 287-290.
[49]杭兴伟. 硫酸氨基葡萄糖对口服透明质酸缓解关节炎症的增效作用[D]. 上海: 上海海洋大学, 2015: 14-17; 28-36.
[50]杭兴伟, 增田泰伸, 木村守, 等. 硫酸氨基葡萄糖对口服透明质酸缓解小鼠佐剂性关节炎的增效作用[J]. 食品科学, 2015, 36(5): 189-194. DOI:10.7506/spkx1002-6630-201505036.
[51]陈洁. 口服透明质酸对关节炎治疗作用的研究[D]. 上海: 上海海洋大学, 2013: 22-25.
[52]KALMAN D S, HEIMER M, VALDEON A, et al. Effect of a natural extract of chicken combs with a high content of hyaluronic acid(Hyal-Joint) on pain relief and quality of life in subjects with knee osteoarthritis: a pilot randomized double-blind placebo-controlled trial[J]. Nutrition Journal, 2008, 7: 3. DOI:10.1186/1475-2891-7-3.
[53]YOSHIMURA M, AOBA Y, WATARI T, et al. Evaluation of the effect of a chicken comb extract-containing supplement on cartilage and bone metabolism in athletes[J]. Experimental and Therapeutic Medicine,2012, 4(4): 577-580. DOI:10.3892/etm.2012.646.
[54]SATO T, IWASO H J J N R, CLIN. An effectiveness study of hyaluronic acid [Hyabest®(J)]in the treatment of osteoarthritis of the knee on the patients in the United States[J]. Journal New Remedy &Clinic, 2009, 58(3): 249-256.
[55]MORIÑA D, FERNÁNDEZ-CASTILLEJO S, VALLS R M, et al.Effectiveness of a low-fat yoghurt supplemented with rooster comb extract on muscle strength in adults with mild knee pain and mechanisms of action on muscle regeneration[J]. Food & Function,2018, 9(6): 3244-3253. DOI:10.1039/C8FO00286J.
[56]JENSEN G S, ATTRIDGE V L, LENNINGER M R, et al. Oral intake of a liquid high-molecular-weight hyaluronan associated with relief of chronic pain and reduced use of pain medication: results of a randomized, placebo-controlled double-blind pilot study[J]. Journal of Medicinal Food, 2015, 18(1): 95-101. DOI:10.1089/jmf.2013.0174.
[57]MASUKO K, MURATA M, YUDOH K, et al. Anti-inflammatory effects of hyaluronan in arthritis therapy: not just for viscosity[J].International Journal of General Medicine, 2009, 2: 77. DOI:10.2147/IJGM.S5495.
[58]ASARI A, KANEMITSU T, KURIHARA H J J O B C. Oral administration of high molecular weight hyaluronan (900 kDa)controls immune system via Toll-like receptor 4 in the intestinal epithelium[J]. Journal of Biological Chemistry, 2010, 285(32): 24751-8. DOI:10.1074/jbc.M110.104950.
[59]TASHIRO T, SEINO S, SATO T, et al. Oral administration of polymer hyaluronic acid alleviates symptoms of knee osteoarthritis: a doubleblind, placebo-controlled study over a 12-month period[J]. The Scientific World Journal, 2012, 2012: 167928. DOI:10.1100/2012/167928.
[60]LEE Y, SUGIHARA K, GILLILLAND M G, et al. Hyaluronic acidbilirubin nanomedicine for targeted modulation of dysregulated intestinal barrier, microbiome and immune responses in colitis[J]. Nature Materials,2020, 19(1): 118-126. DOI:10.1038/s41563-019-0462-9.
[61]牛沂菲, 王海方, 付杰, 等. 透明质酸促进肠道抵抗感染[J]. 生物化学与生物物理进展, 2018, 45(9): 981-986.
[62]NEWBURG D S. Neonatal protection by an innate immune system of human milk consisting of oligosaccharides and glycans[J]. Journal of Animal Science, 2009, 87(Suppl 13): 26-34. DOI:10.2527/jas.2008-1347.
[63]HILL D R, RHO H K, KESSLER S P, et al. Human milk hyaluronan enhances innate defense of the intestinal epithelium[J]. The Journal of Biological Chemistry, 2013, 288(40): 29090-29104. DOI:10.1074/jbc.M113.468629.
[64]CHEN G Y, NUÑEZ G J N R I. Sterile inflammation: sensing and reacting to damage[J]. Nature Reviews Immunology, 2010, 10(12):826-837. DOI:10.1038/nri2873.
[65]TAYLOR K R, YAMASAKI K, RADEK K A, et al. Recognition of hyaluronan released in sterile injury involves a unique receptor complex dependent on Toll-like receptor 4, CD44, and MD-2[J].Journal of Biological Chemistry, 2007, 282(25): 18265-18275.DOI:10.1074/jbc.M606352200.
[66]SCHEIBNER K A, LUTZ M A, BOODOO S, et al. Hyaluronan fragments act as an endogenous danger signal by engaging TLR2[J].The Journal of Immunology, 2006, 177(2): 1272-1281. DOI:10.4049/jimmunol.177.2.1272.
[67]ZHENG L, RIEHL T E, STENSON W F J G. Regulation of colonic epithelial repair in mice by Toll-like receptors and hyaluronic acid[J]. Gastroenterology, 2009, 137(6): 2041-2051. DOI:10.1053/j.gastro.2009.08.055.
[68]SELSTED M E, OUELLETTE A J J N I. Mammalian defensins in the antimicrobial immune response[J]. Nature Immunology, 2005, 6(6):551-557. DOI:10.1038/ni1206.
[69]GARREIS F, SCHLORF T, WORLITZSCH D, et al. Roles of human β-defensins in innate immune defense at the ocular surface: arming and alarming corneal and conjunctival epithelial cells[J]. Histochemistry and Cell Biology, 2010, 134(1): 59-73. DOI:10.1007/s00418-010-0713-y.
[70]GUNASEKARAN A, ECKERT J, BURGE K, et al. Hyaluronan 35 kDa enhances epithelial barrier function and protects against the development of murine necrotizing enterocolitis[J]. Pediatric Research,2020, 87(7): 1177-1184. DOI:10.1038/s41390-019-0563-9.
[71]BERGMANN K R, LIU S X, TIAN R, et al. Bifidobacteria stabilize claudins at tight junctions and prevent intestinal barrier dysfunction in mouse necrotizing enterocolitis[J]. The American Journal of Pathology,2013, 182(5): 1595-1606. DOI:10.1016/j.ajpath.2013.01.013.
[72]KIM Y, KESSLER S P, OBERY D R, et al. Hyaluronan 35 kDa treatment protects mice from Citrobacter rodentium infection and induces epithelial tight junction protein ZO-1 in vivo[J]. Matrix Biology, 2017, 62: 28-39. DOI:10.1016/j.matbio.2016.11.001.
[73]SAIKIA P, ROYCHOWDHURY S, BELLOS D, et al. Hyaluronic acid 35 normalizes TLR4 signaling in Kupffer cells from ethanol-fed rats via regulation of microRNA291b and its target Tollip[J]. Scientific Reports, 2017, 7(1): 15671. DOI:10.1038/s41598-017-15760-4.
[74]CRAIG J P, NICHOLS K K, AKPEK E K, et al. TFOS DEWS II definition and classification report[J]. The Ocular Surface, 2017, 15(3):276-283. DOI:10.1016/j.jtos.2017.05.008.
[75]WILLIS K A, POSTNIKOFF C K, FREEMAN A, et al. The closed eye harbours a unique microbiome in dry eye disease[J]. Scientific Reports, 2020, 10(1): 12035. DOI:10.1038/s41598-020-68952-w.
[76]TOOLE B P. Hyaluronan: from extracellular glue to pericellular cue[J].Nature Reviews Cancer, 2004, 4(7): 528-539. DOI:10.1038/nrc1391.
[77]LAURENT T C, FRASER J R. Hyaluronan[J]. FASEB Journal, 1992,6(7): 2397-2404. DOI:10.1016/S0740-8315(82)80016-8.
[78]HO W T, CHIANG T H, CHANG S W, et al. Enhanced corneal wound healing with hyaluronic acid and high-potassium artificial tears[J]. Clinical & Experimental Optometry, 2013, 96(6): 536-541.DOI:10.1111/cxo.12073.
[79]CAMILLIERI G, BUCOLO C, ROSSI S, et al. Hyaluronan-induced stimulation of corneal wound healing is a pure pharmacological effect[J]. Journal of Ocular Pharmacology and Therapeutics, 2004,20(6): 548-553. DOI:10.1089/jop.2004.20.548.
[80]KIM Y, MOON C H, KIM B Y, et al. Oral hyaluronic acid supplementation for the treatment of dry eye disease: a pilot study[J]. Journal of Ophthalmology, 2019, 2019: 5491626.DOI:10.1155/2019/5491626.
[81]KUNERT K S, TISDALE A S, STERN M E, et al. Analysis of topical cyclosporine treatment of patients with dry eye syndrome: effect on conjunctival lymphocytes[J]. Archives of Ophthalmology, 2000,118(11): 1489-1496. DOI:10.1001/archopht.118.11.1489.
[82]CHAUHAN S K, EL ANNAN J, ECOIFFIER T, et al. Autoimmunity in dry eye is due to resistance of Th17 to Treg suppression[J].Journal of Immunology, 2009, 182(3): 1247-1252. DOI:10.4049/jimmunol.182.3.1247.
[83]NIEDERKORN J Y, STERN M E, PFLUGFELDER S C, et al.Desiccating stress induces T cell-mediated Sjögren’s syndrome-like lacrimal keratoconjunctivitis[J]. Journal of Immunology, 2006, 176(7):3950-3957. DOI:10.4049/jimmunol.176.7.3950.
[84]ZHONG J, DENG Y P, TIAN B, et al. Hyaluronate acid-dependent potection and enhanced corneal wound healing against oxidative damage in corneal epithelial cells[J]. Journal of Ophthalmology, 2016,2016: 6538051. DOI:10.1155/2016/6538051.
[85]BANERJI S, WRIGHT A J, NOBLE M, et al. Structures of the Cd44-hyaluronan complex provide insight into a fundamental carbohydrateprotein interaction[J]. Nature Structural & Molecular Biology, 2007,14(3): 234-239. DOI:10.1038/nsmb1201.
[86]SENBANJO L T, CHELLAIAH M A. CD44: a multifunctional cell surface adhesion receptor is a regulator of progression and metastasis of cancer cells[J]. Frontiers in Cell and Developmental Biology, 2017,5: 18. DOI:10.3389/fcell.2017.00018.
[87]ZHU S N, NÖLLE B, DUNCKER G. Expression of adhesion molecule CD44 on human corneas[J]. The British Journal of Ophthalmology,1997, 81(1): 80-84. DOI:10.1136/bjo.81.1.80.
[88]GOMES J A, AMANKWAH R, POWELL-RICHARDS A, et al.Sodium hyaluronate (hyaluronic acid) promotes migration of human corneal epithelial cells in vitro[J]. The British Journal of Ophthalmology, 2004, 88(6): 821-825. DOI:10.1136/bjo.2003.027573.
[89]LEE J S, LEE S U, CHE C Y, et al. Comparison of cytotoxicity and wound healing effect of carboxymethylcellulose and hyaluronic acid on human corneal epithelial cells[J]. International Journal of Ophthalmology, 2015, 8(2): 215-221. DOI:10.3980/j.issn.2222-3959.2015.02.01.
[90]IWASO H, SATO T. Examination of the efficacy and safety of oral administration of Hyabest J, highly pure hyaluronic acid, for knee joint pain[J]. Japanese Journal of Clinical Sports Medicine, 2009, 58:566-572.
[91]NAGANO K, GOTO S, OKABE R, et al. Acute toxicity test of sodium hyaluronate[J]. Japanese Pharmacology & Therapeutics, 1984, 12: 37-45.
[92]郭风仙, 高芃, 耿桂英, 等. 透明质酸钠的毒理学研究[J]. 中国生化药物杂志, 2010, 31(5): 316-319.
[93]郭风仙, 耿桂英, 汪会玲, 等. 透明质酸钠排除致畸性的试验[J]. 食品与药品, 2010, 12(9): 321-323.
[94]HATAYAMA T, NAGANO M, YAMAGUCHI N, et al. The effect of a supplement on knee pain and discomfort evaluated by visual analogue scale (VAS): a randomized, double-blind, placebo-controlled study[J].Kenkoshien, 2008, 10: 13-17.
[95]NAGAOKA I, NABESHIMA K, MURAKAMI S, et al. Evaluation of the effects of a supplementary diet containing chicken comb extract on symptoms and cartilage metabolism in patients with knee osteoarthritis[J]. Experimental and Therapeutic Medicine Journal,2010, 1(5): 817-827. DOI:10.3892/etm.2010.114.
[96]MARTINEZ-PUIG D, MÖLLER I, FERNÁNDEZ C, et al. Efficacy of oral administration of yoghurt supplemented with a preparation containing hyaluronic acid (Mobilee™) in adults with mild joint discomfort: a randomized, double-blind, placebo-controlled intervention study[J]. Mediterranean Journal of Nutrition and Metabolism, 2013, 6(1): 63-68. DOI:10.1007/s12349-012-0108-9.
[97]MORIÑA D, SOLÀ R, VALLS R, et al. Efficacy of a low-fat yogurt supplemented with a rooster comb extract on joint function in mild knee pain patients: a subject level meta-analysis[C]// IUNS 20th International-Congress of Nutrition, Granada, 2013: 224.
[98]WAKIZAWA Y, EIRO H, MATSUMOTO H, et al. Acute toxicity study of sodium yaluronate (SL-1010) in mice[J]. Japanese Pharmacology &Therapeutics, 1991, 19: 7-12.
[99]MORITA H, KAWAKAMI Y, SHIMOMURA K, et al. Acute toxicity study of sodium hyaluronate (SL-1010) in rats and dogs[J]. Japanese Pharmacology & Therapeutics, 1991, 19(1): 13-18.
[100]杨桂兰, 张天亮, 郭学平, 等. 透明质酸钙毒理学研究[J]. 食品与药品, 2009, 11(7): 46-48.
[101]OE M Y T, KANEMITSU T, MATSUOKA R, et al. Repeated 28-day oral toxicological study of hyaluronic acid in rats[J]. Pharmacometrics,2011, 81: 11-21.
[102]KATO T J T C R. Preliminary study for the toxicity study on sodium hyaluronate (Na-HA) in rats by repeated oral administration for 13 weeks[J]. The Clinical Report, 1993, 27: 5809-5830.
[103]SEINO S, TAKESHITA F, ASARI A, et al. Toxicity study on sodium hyaluronate (Na-HA) in rats by repeated oral administration for 90 days followed by a 28-day recovery study[J]. Pharmacometrics, 1996,51(2): 97-113.
[104]SEINO S, TAKESHITA F, ASARI A, et al. No Influence of exogenous hyaluronan on the behavior of human cancer cells or endothelial cell capillary formation[J]. Journal of Food Science, 2014, 79(7):T1469-T1475. DOI:10.1111/1750-3841.12500.
