米糠蛋白作为一种丰富而廉价的植物蛋白资源,因其过敏性低、氨基酸组成合理、生物效价高以及较好的生理活性,可作为功能因子应用于食品和医药工业中[1-2]。米糠蛋白还具有良好的溶解性和乳化性,是一种潜在的天然食品乳化剂,可作为配料应用于饮料、肉制品和焙烤制品中[2]。鉴于米糠蛋白良好的营养价值及其在食品开发中的新兴潜力,目前越来越多研究聚焦于采用新的提取方法或改性方法拓展其功能性质及应用领域[3]。米糠蛋白的功能性质与其结构特征密切相关,例如:米糠蛋白的持水性和持油性与蛋白质表面电荷、极性氨基酸、表面疏水性等密切相关;乳化性和乳化稳定性与蛋白分子柔性、分子质量大小等密切相关;起泡性和起泡稳定性不仅与表面电荷、极性氨基酸等相关,还受无规卷曲结构变化影响[4-5]。pH值偏移是一种操作简单、成本低廉并且效果显著的改变蛋白质结构及改善蛋白质功能性质的方法。当蛋白质暴露在极端pH值条件下时,其亚基结构、表面疏水性、内源色氨酸荧光强度等结构特征会发生变化,使之处于变性与未变性之间的熔球态,处于熔球态的蛋白质的部分功能性质会发生一定程度的改善[6-8]。pH值偏移处理尤其是碱性偏移,可以显著改善植物蛋白(大豆蛋白、豌豆蛋白等)的凝胶性和成膜性[8-9]。近年来,部分研究还侧重于将不同的蛋白质改性方法相结合,以期获得更加精准的蛋白质功能性质定向调控方法。例如,王健等[10]通过对大豆蛋白进行pH值酸碱偏移结合热处理,揭示了蛋白质分子柔性在功能性质中的作用。鉴于米糠蛋白在碱溶液中良好的溶解度以及较低的变性温度(约70 ℃)[7],本实验拟研究pH值碱性偏移(pH 11)结合温和热处理(50、60 ℃)对米糠蛋白结构和功能性质的影响,以期获得一种简便有效的米糠蛋白结构和性质的调控方法,为合理开发米糠蛋白提供理论依据。
1 材料与方法
1.1 材料与试剂
脱脂米糠 连云港瑾宏生物科技有限公司;标准分子蛋白(14~100 ku) 上海生物化学研究所;1-苯氨基萘-8-磺酸、5,5’-二硫代二硝基苯甲酸(5,5’-dithiobis(2-nitrobenzoic acid),DTNB) 美国Sigma-Aldrich公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tr i s)等试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
IRTracer-100傅里叶变换红外光谱仪、LC-20液相色谱仪 日本岛津公司;F4600荧光分光光度计 日本日立公司;Blue Star紫外-可见分光光度计 北京莱伯泰科仪器股份公司;Nano ZS纳米粒度分析仪 英国Malvern公司。
1.3 方法
1.3.1 米糠蛋白制备
参考吴伟等[11]方法,将100 g脱脂米糠与1 000 mL去离子水混合,用2 mol/L NaOH溶液将混合液调至pH 9.0,40 ℃、120 r/min水浴搅拌4 h,然后4 ℃、8 000 r/min离心20 min。取上清液用2 mol/L HCl溶液调至pH 4.0,静置20 min,待出现明显沉淀后4 ℃、8 000 r/min离心15 min。水洗沉淀并4 ℃、8 000 r/min离心15 min,重复2 次。随后用去离子水分散蛋白沉淀,并用2 mol/L HCl溶液调至pH 7.0,冷冻干燥得到米糠蛋白。
1.3.2 米糠蛋白处理
参考Jiang Jiang[8]和耿蕊[12]等的方法对米糠蛋白进行pH值碱性偏移结合热处理。用去离子水将米糠蛋白配制成20 mg/mL的蛋白溶液(对照),用2 mol/L NaOH溶液调节蛋白溶液至pH 11,将温度分别设定为室温(25 ℃)、50、60 ℃,水浴加热蛋白溶液1、3、5 h。然后采用2 mol/L HCl溶液调节蛋白溶液至pH 7.0,保温1 h后再调至pH 4.0,用去离子水洗涤沉淀3 次。最后用去离子水分散离心后的蛋白沉淀,用2 mol/L NaOH溶液调至pH 7.0,冷冻干燥得到处理后的米糠蛋白样品。
1.3.3 傅里叶变换红外光谱分析
参考Liu Yongle等[13]方法,取米糠蛋白样品2 mg与200 mg KBr研磨成粉末,混合均匀,用压片机压片3~5 min,制成透明薄片,用傅里叶变换红外光谱仪进行扫描,波数范围400~4 000 cm-1,扫描次数64,分辨率4 cm-1。
1.3.4 游离巯基和总巯基含量测定
将米糠蛋白样品配制成质量浓度20 mg/mL的待测蛋白溶液,溶液中蛋白质含量采用考马斯亮蓝法进行测定。参考Huang Youru等[14]的方法,采用DTNB比色法测定米糠蛋白的游离巯基和总巯基含量。
1.3.5 分子质量分布测定
将米糠蛋白样品配制成10 mg/mL的蛋白溶液,过孔径0.45 μm的醋酸纤维素膜,对滤液采用LC-20A高效液相色谱仪进行分析。色谱条件:色谱柱:TSKgel SW G4000 SWXL;检测器:Waters 996光电二极管阵列检测器;检测波长280 nm;柱温25 ℃;流动相:0.05 mol/L磷酸盐缓冲液(pH 7.2,含0.05 mol/L NaCl);流速1 mL/min。将蛋白质分子质量标准品配制成10 mg/mL溶液,采用高效液相色谱仪在同样条件下进行分析,以保留时间为x轴,相对分子质量对数为y轴,得到标准曲线:y=-0.312 8x+8.517 1(R2=0.990 2),通过标准曲线可以计算得到不同保留时间米糠蛋白组分的相对分子质量。
1.3.6 粒径分布测定
将米糠蛋白样品配制成1 mg/mL的蛋白溶液,在25 ℃条件下采用纳米粒度分析仪测定米糠蛋白溶液的粒径分布。
1.3.7 十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳分析
参考吴伟等[11]的测定方法,采用质量分数分别为12.5%的分离胶和4%的浓缩胶,含有0.05 mol/L Tris-0.384 mol/L甘氨酸、0.1% SDS(pH 8.3)的电极缓冲液。在烧杯中分别加入10% SDS、5 mL β-巯基乙醇、10 mL甘油、20 mg溴酚蓝、20 mL 0.05 mol/L pH 8.0 Tris-HCl缓冲液,最后加水至总体积100 mL,配制成样品溶解液,再把米糠蛋白溶于样品溶解液中配成1.5 mg/mL的电泳样品。上样量10 μL,起始电流10 mA,样品进入分离胶后增大到25 mA。
1.3.8 内源荧光光谱分析
参考Wu Wei等[15]方法。将米糠蛋白样品用去离子水稀释成0.1 mg/mL的蛋白溶液,采用F-4600型荧光光谱仪在激发波长280 nm下扫描300~500 nm之间的发射光谱(狭缝宽度2.5;灵敏度为1),以去离子水为空白。
1.3.9 表面疏水性测定
参考Wu Wei等[15]方法,将米糠蛋白样品用去离子水配制成20 mg/mL的蛋白溶液,再将其稀释为0.005~0.50 mg/mL之间5 个不同质量浓度梯度的蛋白溶液。在试管中分别加入不同质量浓度的蛋白溶液4 mL和8 mmol/L 1-苯氨基萘-8-磺酸溶液50 μL,激发波长390 nm、发射波长470 nm下测定荧光强度。以蛋白质质量浓度为横坐标、荧光强度为纵坐标作图,米糠蛋白表面疏水指数即曲线初始阶段的斜率。
1.3.10 溶解性测定
将米糠蛋白样品10 mg/mL分散于去离子水中,室温条件磁力搅拌2 h后,8 000 r/min离心20 min,收集上清液,随后采用微量凯氏定氮法测定上清液中可溶解氮含量,溶解性表示为可溶解氮与样品中总氮的百分比。
1.3.11 持水性和持油性测定
参考Benelhadi等[16]方法,将1.0 g米糠蛋白与10 mL蒸馏水或精制大豆油充分混合,3 000 r/min离心20 min,将蒸馏水或大豆油排干30 min后测定样品质量,以每单位质量米糠蛋白吸收水或油的质量分别表示其持水性和持油性。
1.3.12 起泡性和泡沫稳定性测定
参考Kamara等[17]方法,将200 mg米糠蛋白用0.05 mol/L pH 7.0磷酸盐缓冲液配制成10 mg/mL的溶液,10 000 r/min均质30 s,重复3 次,测量均质后的体积V0,静置30 min后测量泡沫体积V1。计算公式如下:
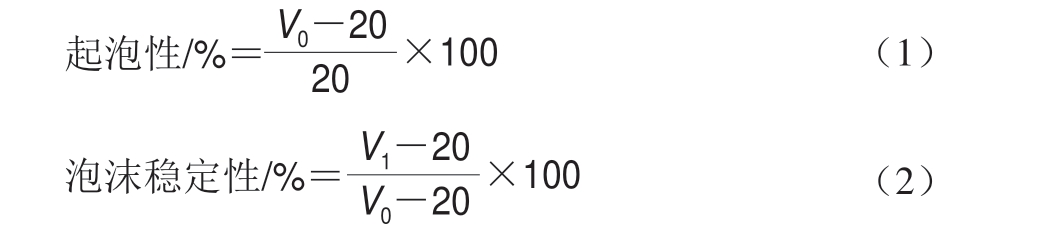
1.3.13 乳化性和乳化稳定性测定
参 考M o l i n a 等[1 8]方 法,取1 2 m L 蛋 白 溶 液(1 mg/mL)和4 mL大豆油混合,在10 000 r/min均质2 min,取100 μL米糠蛋白-大豆油乳状液与5 mL 0.1% SDS用涡流振荡器混合均匀,在500 nm波长处测定吸光度。计算公式如下:
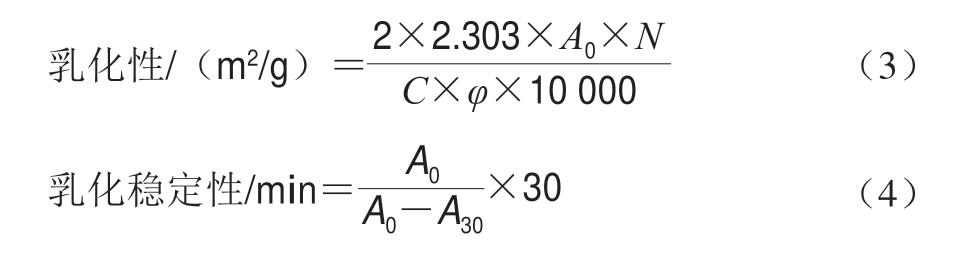
式中:N为稀释倍数;C为样品溶解液中蛋白质质量浓度/(g/mL);φ为油相占比/%;A0和A30分别为乳液在第0和30分钟时的吸光度。
1.4 数据处理与统计分析
采用Microsoft Excel 2010和Origin 7.5进行数据处理,结果用 s表示,重复3 次。
s表示,重复3 次。
2 结果与分析
2.1 pH值碱性偏移结合热处理对米糠蛋白二级结构的影响
傅里叶变换红外光谱是分析蛋白质结构变化的主要技术之一,特别是酰胺I带(1 700~1 600 cm-1),是表征蛋白质二级结构最常用的特征频率区域[19]。蛋白质二级结构变化会影响其表面疏水性和柔性,进而影响功能性质[20]。参考Sun Weizheng等[21]的方法对pH 11偏移以及结合热处理的米糠蛋白去卷积酰胺I带吸收光谱进行Gaussian拟合,得到11 个特征吸收峰(表1)。1 609 cm-1是由氨基酸侧链(尤其是酪氨酸残基等)产生的特征吸收峰[21]。1 610~1 628 cm-1的特征吸收峰通常被认为是β-折叠平行排列产生的,而1 630~1 640 cm-1和1 675~1 695 cm-1的特征吸收峰则被认为是β-折叠反平行排列产生的[22]。1 653 cm-1的强吸收峰是α-螺旋结构的C=O伸缩振动产生的[21,23]。1 671 cm-1的特征吸收峰可归属于β-转角结构,而1 646 cm-1和1 662 cm-1的特征吸收峰被认为是无规卷曲结构产生的[24]。结果显示,相比于未处理的米糠蛋白,pH 11偏移处理使得米糠蛋白β-折叠含量明显降低,α-螺旋含量略微降低,无规卷曲、β-转角和氨基酸侧链结构含量有所增加。pH值会改变蛋白表面带电氨基酸、α-羰基和α-氨基末端质子化状态,影响蛋白质分子结构的稳定性,促使蛋白质分子展开,这可能是导致米糠蛋白二级结构从有序向无序转化的主要原因[25]。相比于pH值碱性偏移处理,pH值碱性偏移结合热处理1 h的米糠蛋白β-折叠含量显著升高(P<0.05),无规卷曲和β-转角的含量显著降低(P<0.05);当加热时间延长到3 h时,米糠蛋白β-折叠含量显著降低(P<0.05),无规卷曲和β-转角的含量显著升高(P<0.05);当加热时间延长到5 h时,米糠蛋白β-折叠含量增加到44%左右,无规卷曲和β-转角的含量又随之下降。在蛋白质处于极端碱性环境中,由于碱的作用使蛋白质分子展开,暴露出蛋白质内部的疏水基团,暴露出来的疏水基团又因为相互作用而聚集;当蛋白质处于加热环境中时,温度升高导致蛋白质分子展开,然后通过疏水作用、氢键、二硫键等相互作用而聚集[26]。因而,pH 11偏移结合热处理时,米糠蛋白的二级结构呈现折叠-去折叠-复折叠的复杂变化过程。
表1 pH值碱性偏移结合热处理对米糠蛋白二级结构的影响
Table 1 Effects of alkaline pH-shifting combined with heating treatment on the secondary structures of rice bran protein
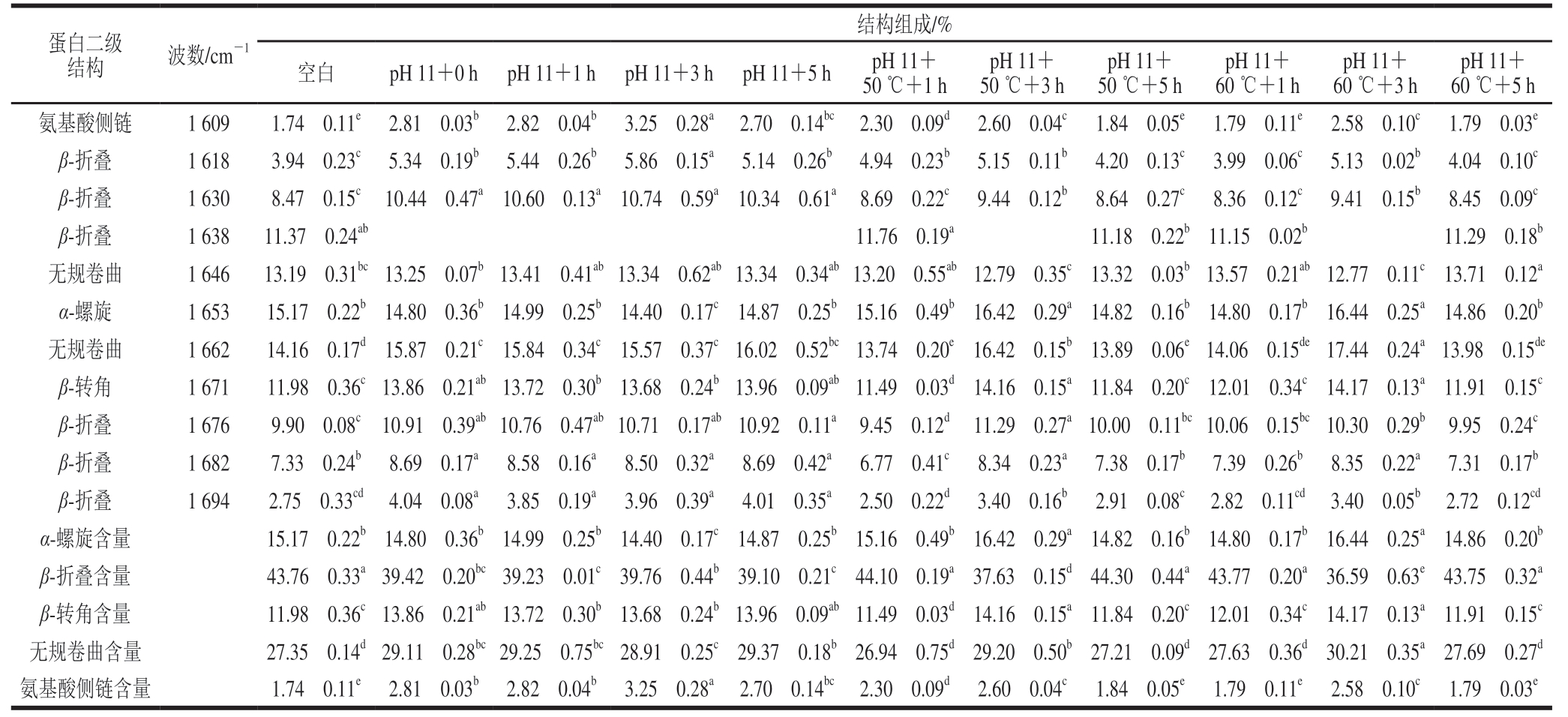
注:同行不同肩标小写字母表示差异显著,P<0.05。ü.未检出。
?
2.2 pH值碱性偏移结合热处理对米糠蛋白游离巯基和总巯基含量的影响
pH 11偏移以及结合热处理的米糠蛋白巯基变化如表2所示,相比于未处理的米糠蛋白,单独pH值碱性偏移以及结合热处理的米糠蛋白总巯基和游离巯基含量均显著下降(P<0.05)。pH值偏移处理大豆蛋白的研究表明,随着碱性pH值增加,巯基通过去质子化而形成硫醇化合物,并且碱性环境会加速巯基氧化[27],这可能也是造成米糠蛋白在碱性偏移条件下巯基含量下降的原因。单独采用pH值碱性偏移处理时,随着处理时间的延长,米糠蛋白游离巯基和总巯基含量都略微增加。通常巯基含量的增加主要有2 种原因:一是蛋白质亚基解离,导致二硫键断裂形成新的巯基;二是蛋白质分子内部结构展开,暴露出新的巯基[10]。结合傅里叶变换红外光谱中呈现的氨基酸侧链和无序结构含量略微增加等现象,推断极端pH值条件下蛋白质结构稳定性下降导致部分侧链结构展开重排是引起巯基含量增加的重要因素。从表2还发现,相比于单独pH值偏移处理的米糠蛋白,结合热处理的米糠蛋白游离巯基含量更低,并且随着加热时间的延长,游离巯基含量进一步下降。加热条件下蛋白质游离巯基更易被氧化形成分子间二硫键[28]。蛋白质巯基氧化是一个复杂过程,巯基通常先被自由基攻击生成亚磺酰自由基,随后再与分子氧形成硫醇自由基,然后继续氧化形成二硫键,这一阶段是可逆氧化反应,而不可逆氧化反应则进一步生成亚磺酸、磺酸等[29]。随着热处理时间的延长,米糠蛋白总巯基含量也呈略微下降的趋势,由此可见,pH值碱性偏移结合热处理米糠蛋白,不仅使游离巯基氧化形成分子间二硫键,还生成了一些不可逆的含硫化合物。
表2 pH值碱性偏移结合热处理对米糠蛋白总巯基、游离巯基的影响
Table 2 Effects of alkaline pH-shifting combined with heat treatment on total and free sulfhydryl group contents of rice bran protein
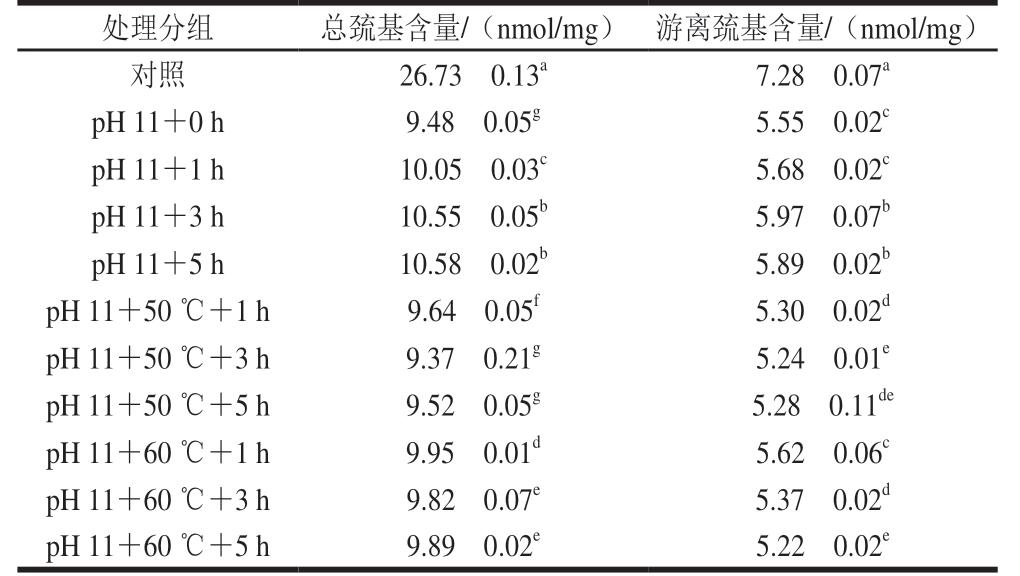
注:同列不同肩标小写字母表示差异显著,P<0.05。下同。
处理分组 总巯基含量/(nmol/mg) 游离巯基含量/(nmol/mg)对照 26.73f 0.13a 7.28f 0.07a pH 11+0 h 9.48f 0.05g 5.55f 0.02c pH 11+1 h 10.05f 0.03c 5.68f 0.02c pH 11+3 h 10.55f 0.05b 5.97f 0.07b pH 11+5 h 10.58f 0.02b 5.89f 0.02b pH 11+50 ℃+1 h 9.64f 0.05f 5.30f 0.02d pH 11+50 ℃+3 h 9.37f 0.21g 5.24f 0.01e pH 11+50 ℃+5 h 9.52f 0.05g 5.28f 0.11de pH 11+60 ℃+1 h 9.95f 0.01d 5.62f 0.06c pH 11+60 ℃+3 h 9.82f 0.07e 5.37f 0.02d pH 11+60 ℃+5 h 9.89f 0.02e 5.22f 0.02e
2.3 pH值碱性偏移结合热处理对米糠蛋白分子质量和粒径分布的影响
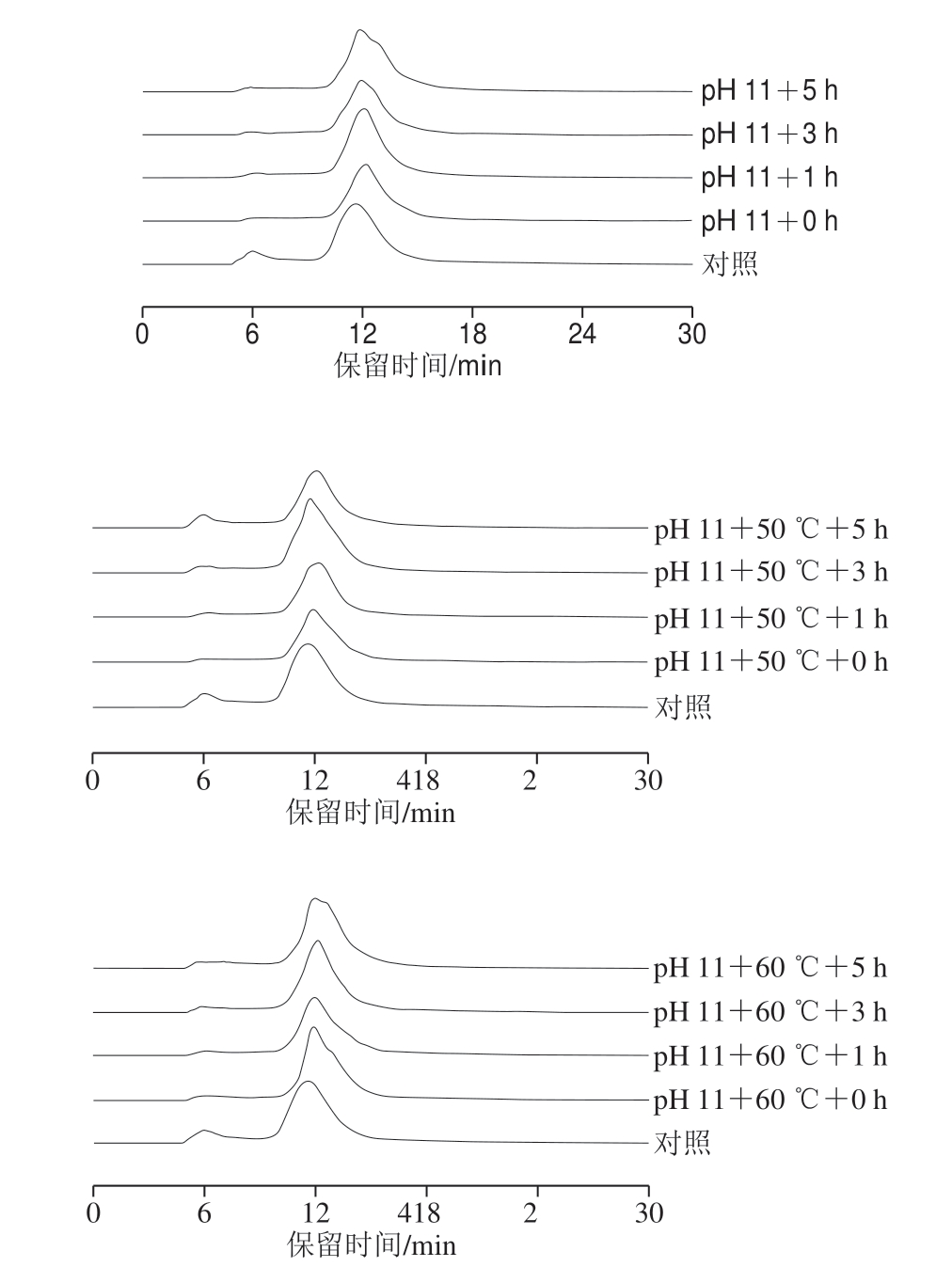
图1 pH值碱性偏移结合热处理对米糠蛋白分子质量分布的影响
Fig.1 Effects of alkaline pH-shifting combined with heat treatment on molecular mass distribution of rice bran protein
如图1所示,未处理的米糠蛋白主要有2 个特征吸收峰,对应保留时间分别为6.04 min和11.93 min,峰面积百分比分别为13.57%和86.43%,前者主要是分子质量大于1 000 kDa的蛋白质聚集体等大分子物质,后者主要是分子质量在3~200 kDa的米糠蛋白及其亚基等小分子物质[11]。采用pH 11偏移、pH 11偏移结合50 ℃和60 ℃处理均会在一定程度上促使米糠蛋白聚集体分解,当处理时间1 h时,保留时间6.04 min的峰面积百分比分别为1.03%、4.65%和3.66%。Jiang Jiang等[30]关于pH值偏移处理大豆蛋白11S组分的研究也认为,极端pH值条件下,酸性亚基和碱性亚基组成的复合物容易被解离。但随着处理时间的延长,单独碱性偏移处理以及结合热处理的米糠蛋白中聚集体含量又会增加,当处理时间5 h时,保留时间6.04 min的峰面积百分比分别为1.40%、11.05%和6.63%。由于天然的米糠蛋白本身极易受脂质氧化酸败产物氧化,而碱性环境和热处理均会加速蛋白质氧化,这可能是导致聚集体不断增加的重要原因[29]。
相比于未处理的米糠蛋白,单独采用碱性偏移处理的米糠蛋白粒径分布曲线明显向大尺寸方向移动(图2A),当米糠蛋白置于pH 11的溶液中时,平均粒径就从129.92 nm增加到190.45 nm(图2B)。结合分子质量分布结果分析,应该是极端pH值环境下蛋白质分子快速展开导致粒径增加。随着处理时间的延长,平均粒径逐渐下降,当处理时间为5 h时,平均粒径降低到114.33 nm,一方面可能是酸性亚基-碱性亚基复合物的解离起了主导作用,另一方面展开的蛋白质分子可能通过疏水作用等再次聚集[26]。pH 11偏移结合热处理的米糠蛋白平均粒径呈现类似的先增后减的变化趋势,但处理5 h时,平均粒径略大于单独pH值偏移处理的样品,这可能也是因为加热提高了米糠蛋白中氧化聚集体的含量。
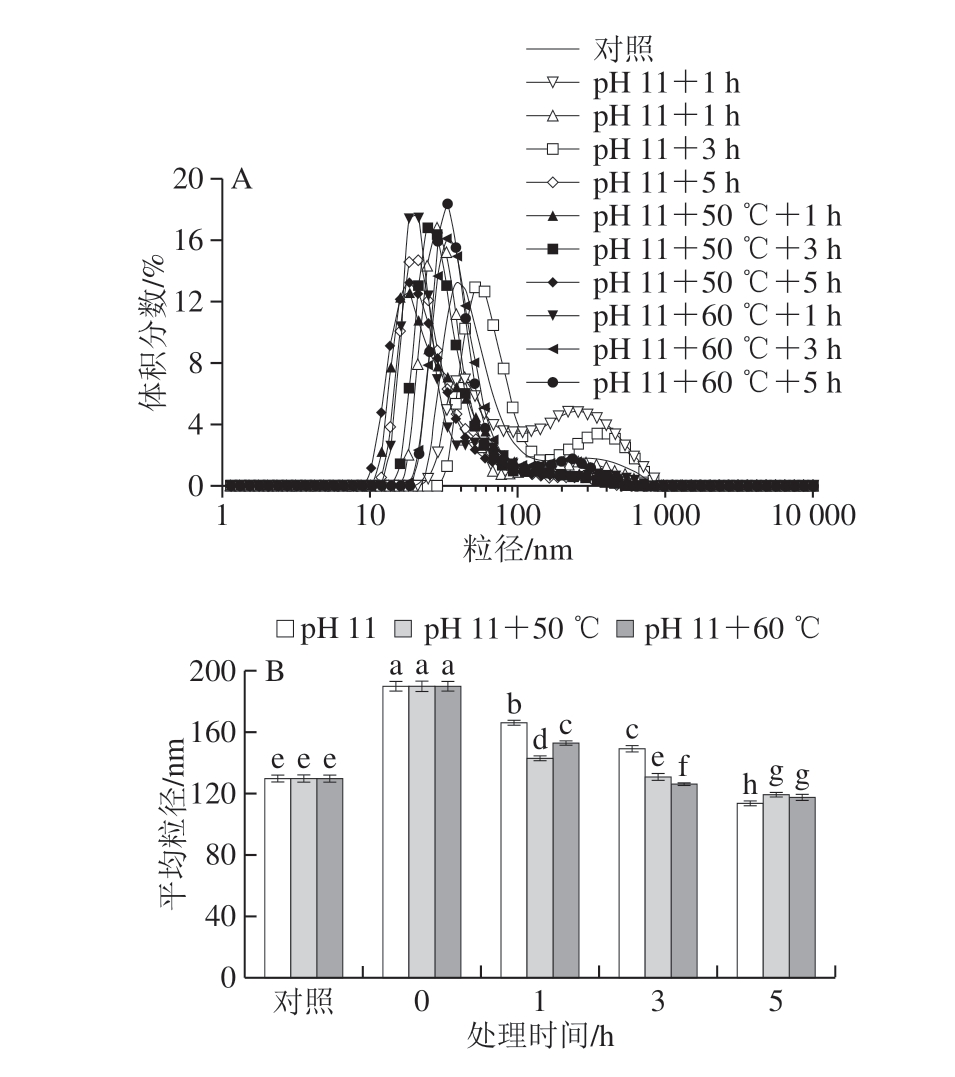
图2 pH值碱性偏移结合热处理对米糠蛋白粒径分布的影响
Fig.2 Effect of alkaline pH-shifting combined with heat treatment on particle size distribution of rice bran protein
A.粒径分布曲线;B.平均粒径。
2.4 pH值碱性偏移结合热处理对米糠蛋白亚基结构的影响
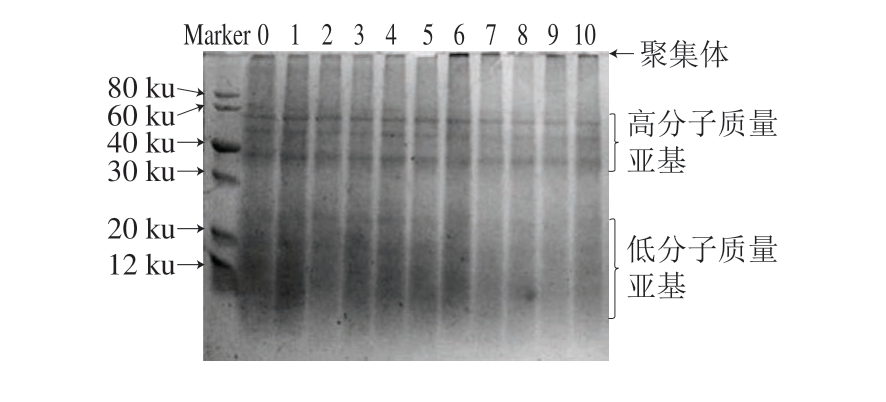
图3 pH值碱性偏移结合热处理的米糠蛋白电泳图
Fig.3 Electrophoresis pattern of rice bran protein treated with alkaline pH-shifting combined with heating
泳道0 ~1 0.对照、p H 1 1+0 h、p H 1 1+1 h、p H 1 1+3 h、pH 11+5 h、pH 11+50 ℃+1 h、pH 11+50 ℃+3 h、pH 11+50 ℃+5 h、pH 11+60 ℃+1 h、pH 11+60 ℃+3 h、pH 11+60 ℃+5 h。
如图3所示,未处理的米糠蛋白亚基主要分布在60~70,40~50、37~38 ku和低于25 ku (泳道0),其中37~38 ku是谷蛋白酸性亚基对应的条带[31]。当将米糠蛋白置于pH 11的溶液时(泳道1),明显看到37~38 ku条带的颜色变深,这印证了前面分子质量分布结果推测的蛋白质聚集体中酸性亚基和碱性亚基复合物发生解离的现象。随着处理时间的延长,亚基结构对应的条带又逐渐变浅。当在50、60 ℃下分别加热3、5 h时,分离胶顶部出现明显的聚集体条带(泳道6、7、9、10),这表明pH 11偏移结合热处理导致米糠蛋白形成了一些非二硫共价键交联的聚集体。结合前面巯基变化的结果分析,二硫键和非二硫共价键共同参与了这一过程中蛋白质聚集体的形成。
2.5 pH值碱性偏移结合热处理对米糠蛋白内源荧光光谱的影响
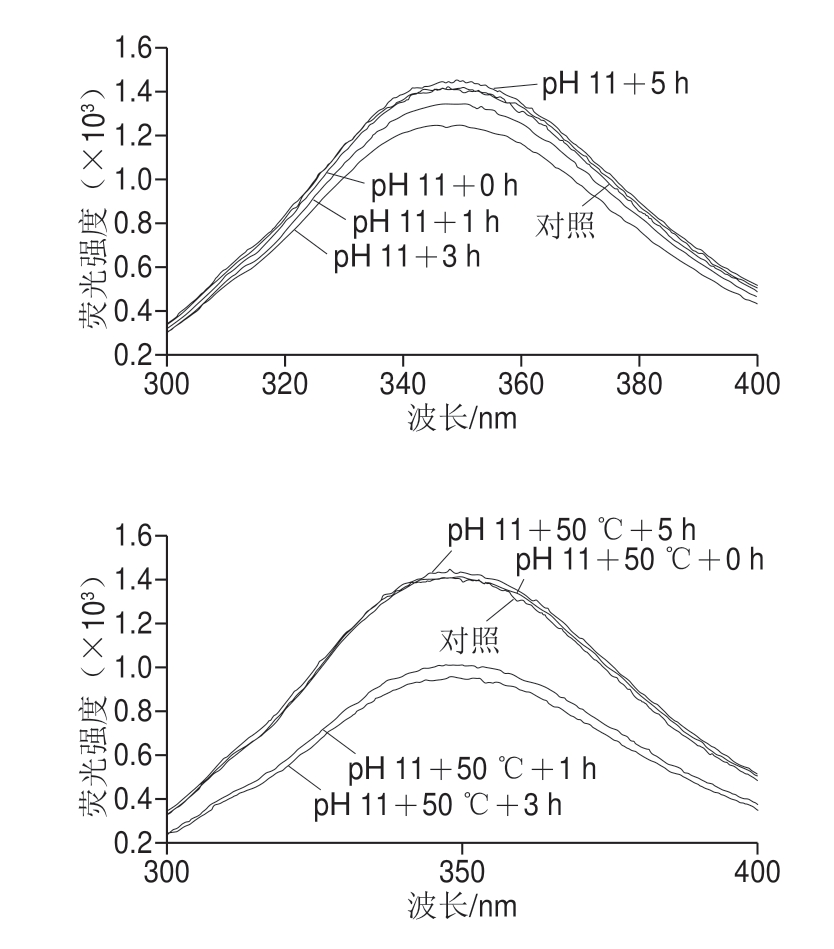
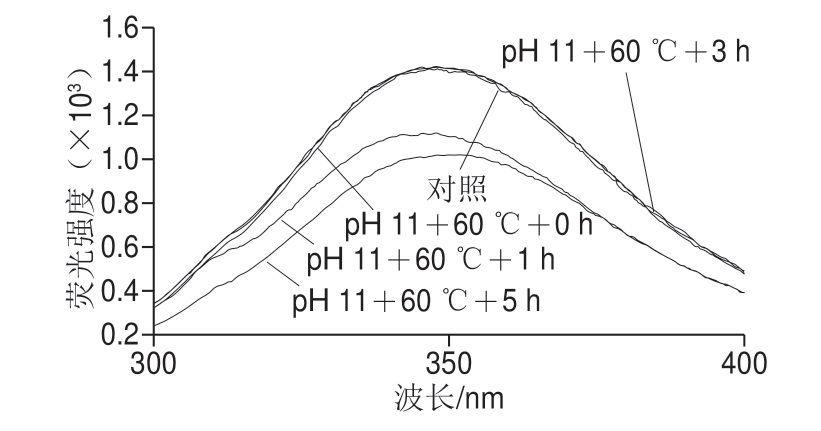
图4 pH值碱性偏移结合热处理对米糠蛋白内源荧光光谱的影响
Fig.4 Effect of alkaline pH-shifting combined with heat treatment on intrinsic fluorescence spectrum of rice bran protein
如图4所示,随着处理时间延长,米糠蛋白最大荧光峰位均出现先红移再蓝移的变化趋势。未处理的米糠蛋白最大荧光峰位为346.61 nm,单独pH 11、pH 11偏移结合50 ℃和60 ℃处理的米糠蛋白最大荧光峰位均在处理时间1 h时达到最大值,分别为350.63、348.65 nm和348.04 nm。内源荧光光谱中最大荧光峰位红移表明蛋白质中色氨酸残基微环境极性增强[11]。王健等[10]对大豆分离蛋白采用pH 11偏移短时(15 min)处理,也发现最大荧光峰位发生红移。pH值碱性偏移处理会诱导原先包裹在蛋白质内部的疏水侧链暴露到分子表面的极性环境中,使色氨基残基微环境发生改变[27]。随着碱性偏移处理时间延长,米糠蛋白最大荧光峰位发生蓝移,结合前面二级结构变化结果进行分析,推断可能是暴露出来的疏水基团又因为疏水相互作用而聚集,使米糠蛋白中色氨酸残基微环境非极性增强。结果还显示,热处理会抑制米糠蛋白最大荧光峰位红移,结合分子质量分布和亚基结构变化结果推测,可能是热处理诱导蛋白质聚集造成的。
2.6 pH值碱性偏移结合热处理对米糠蛋白表面疏水性的影响
pH值偏移处理大豆分离蛋白的研究证实,极端碱性条件下蛋白质分子结构容易展开,致使表面疏水性显著增加[27]。但不同于大豆分离蛋白表面疏水性的持续增加,pH 11偏移以及结合热处理的米糠蛋白表面疏水性随着处理时间的延长呈先上升后下降的趋势(图5)。这可能是由于相比大豆分离蛋白,米糠蛋白中残留的内源脂质氧化酸败产物更容易与其疏水侧链基团反应,导致表面疏水性下降[11]。从图5还可以看出,pH值偏移结合热处理的米糠蛋白表面疏水性显著大于单独pH值偏移处理(P<0.05)。关于肌原纤维蛋白的研究也发现,热处理会显著增加蛋白质的表面疏水性,并且热处理导致的表面疏水性增加有利于蛋白质无定形或纤维状聚集体的形成[32-33]。随着热处理时间的延长,米糠蛋白通过疏水相互作用形成聚集体,又会导致表面疏水性下降。
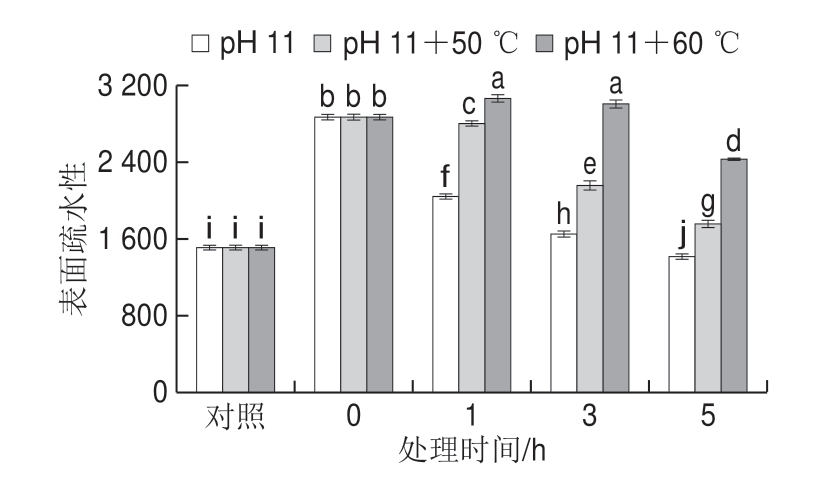
图5 pH值碱性偏移结合热处理对米糠蛋白表面疏水性的影响
Fig.5 Effect of alkaline pH-shifting combined with heat treatment on hydrophobicity of rice bran protein
2.7 pH值碱性偏移结合热处理对米糠蛋白功能性质的影响
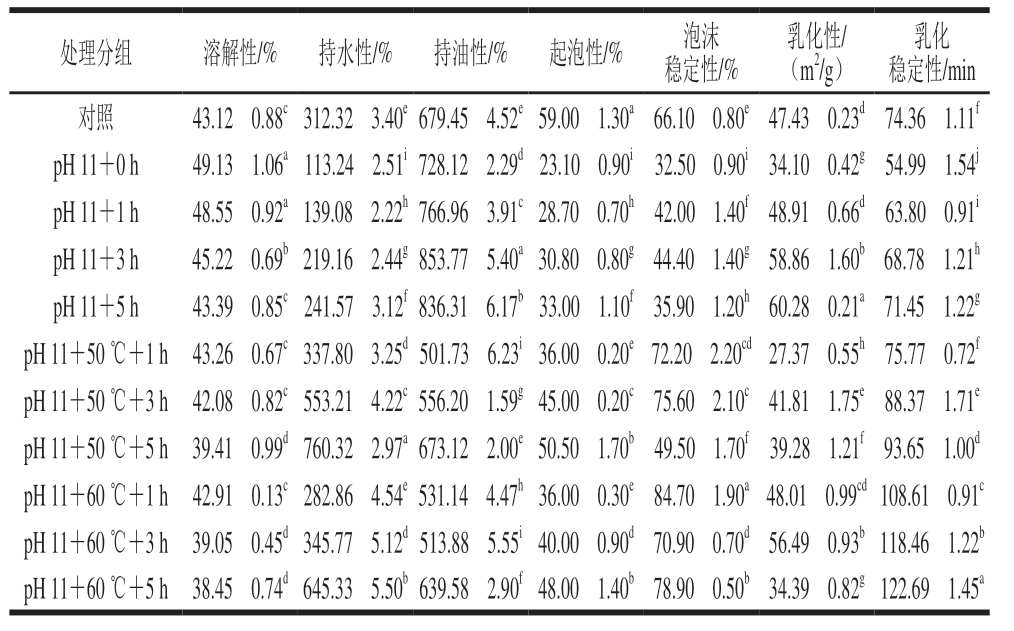
表3 pH值碱性偏移结合热处理对米糠蛋白功能性质的影响
Table 3 Effects of alkaline pH-shifting combined with heat treatment on functional properties of rice bran protein
乳化性/(m2/g)乳化稳定性/min对照 43.12f 0.88c 312.32f 3.40e 679.45f 4.52e 59.00f 1.30a 66.10f 0.80e 47.43f 0.23d 74.36f 1.11f pH 11+0 h 49.13f 1.06a 113.24f 2.51i 728.12f 2.29d 23.10f 0.90i 32.50f 0.90i 34.10f 0.42g 54.99f 1.54j pH 11+1 h 48.55f 0.92a 139.08f 2.22h 766.96f 3.91c 28.70f 0.70h 42.00f 1.40f 48.91f 0.66d 63.80f 0.91i pH 11+3 h 45.22f 0.69b 219.16f 2.44g 853.77f 5.40a 30.80f 0.80g 44.40f 1.40g 58.86f 1.60b 68.78f 1.21h pH 11+5 h 43.39f 0.85c 241.57f 3.12f 836.31f 6.17b 33.00f 1.10f 35.90f 1.20h 60.28f 0.21a 71.45f 1.22g pH 11+50 ℃+1 h 43.26f 0.67c 337.80f 3.25d 501.73f 6.23i 36.00f 0.20e 72.20f 2.20cd 27.37f 0.55h 75.77f 0.72f pH 11+50 ℃+3 h 42.08f 0.82c 553.21f 4.22c 556.20f 1.59g 45.00f 0.20c 75.60f 2.10c 41.81f 1.75e 88.37f 1.71e pH 11+50 ℃+5 h 39.41f 0.99d 760.32f 2.97a 673.12f 2.00e 50.50f 1.70b 49.50f 1.70f 39.28f 1.21f 93.65f 1.00d pH 11+60 ℃+1 h 42.91f 0.13c 282.86f 4.54e 531.14f 4.47h 36.00f 0.30e 84.70f 1.90a 48.01f 0.99cd 108.61f 0.91c pH 11+60 ℃+3 h 39.05f 0.45d 345.77f 5.12d 513.88f 5.55i 40.00f 0.90d 70.90f 0.70d 56.49f 0.93b 118.46f 1.22b pH 11+60 ℃+5 h 38.45f 0.74d 645.33f 5.50b 639.58f 2.90f 48.00f 1.40b 78.90f 0.50b 34.39f 0.82g 122.69f 1.45a处理分组 溶解性/% 持水性/% 持油性/% 起泡性/% 泡沫稳定性/%
通常,良好的溶解性有助于蛋白质部分功能性质的发挥,并且还会影响其在食品领域的应用。pH值碱性偏移结合热处理米糠蛋白的溶解性和功能性质如表3所示。相比于未处理的米糠蛋白,pH值碱性偏移处理的米糠蛋白溶解性显著(P<0.05)增加。Jiang Jiang等[34]关于大豆蛋白的研究也发现,pH值碱性偏移处理的蛋白质在pH 6~7范围内溶解度高于未经处理。结合热处理后,米糠蛋白的溶解性显著(P<0.05)低于单独pH值碱性偏移处理的米糠蛋白,这可能归因于加热促使疏水基团的暴露以及不溶性聚集体的产生[35]。随着处理时间的延长,单独pH值碱性偏移以及结合热处理的米糠蛋白溶解性均逐渐下降。相比于未处理的米糠蛋白,pH值碱性偏移处理0 h的米糠蛋白持水性、起泡性、泡沫稳定性、乳化性和乳化稳定性都显著(P<0.05)下降,仅持油性显著(P<0.05)提高。随着pH值偏移处理时间的延长,米糠蛋白持水性、起泡性、乳化性和乳化稳定性有所回升。其中,乳化性回升效果最明显,当pH 11偏移处理5 h时,乳化性达到最大值60.28 m2/g,是未处理米糠蛋白的1.3 倍。随着pH值偏移处理时间延长,持油性和泡沫稳定性则呈先上升后下降的趋势,分别在处理时间3 h时达到最大值853.77%和44.40%。pH值碱性偏移结合热处理可以改善米糠蛋白的持水性、泡沫稳定性和乳化稳定性。米糠蛋白的持水性、泡沫稳定性和乳化稳定性分别在pH 11+50 ℃+5 h、pH 11+60 ℃+1 h和pH 11+60 ℃+5 h达到最大值,分别为760.32%、84.70%和122.69 min,是未处理米糠蛋白的2.4、1.3、1.6 倍。热处理(尤其是50 ℃条件下)可以在一定程度上缓解pH值偏移对米糠蛋白起泡性的负面影响,但难以使其回复到处理前的起泡能力。同时,pH值碱性偏移结合热处理还会显著降低单独pH值偏移对米糠蛋白持油性和乳化性的改善作用。
3 结 论
米糠蛋白经pH值碱性偏移结合热处理后,其结构特征发生了显著变化。pH值碱性偏移促使米糠蛋白二级结构由有序向无序转化,pH值碱性偏移结合热处理使得米糠蛋白二级结构呈现折叠-去折叠-复折叠的复杂变化,并伴随巯基氧化。结合分子质量分布、粒径分布和亚基结构变化分析,pH值碱性偏移促使米糠蛋白展开,随着处理时间的延长,米糠蛋白重新聚集,热处理会加剧这种聚集行为。内源荧光光谱和表面疏水性的变化进一步展现了米糠蛋白在pH值碱性偏移结合热处理过程中空间结构的复杂变化,并印证了这一过程中分子的展开-聚集行为。单独pH值碱性偏移处理会使得米糠蛋白的持水性、起泡性、泡沫稳定性、乳化性和乳化稳定性显著下降,仅持油性有所改善。但pH值碱性偏移结合热处理则可显著改善米糠蛋白的持水性、起泡性、泡沫稳定性和乳化稳定性。pH值碱性偏移结合热处理有望成为一种很好调控米糠蛋白功能性质的方法。
[1] GUL K, YOUSUF B, SINGH A K, et al.Rice bran: nutritional values and its emerging potential for development of functional food:a review[J].Bioactive Carbohydrates and Dietary Fibre, 2015, 6(1):24-30.DOI:10.1016/j.bcdf.2015.06.002.
[2] SHARIF M K, BUTT M S, ANJUM F M, et al.Rice bran: a novel functional ingredient[J].Critical Reviews in Food Science and Nutrition,2014, 54(6): 807-816.DOI:10.1080/10408398.2011.608586.
[3] FABIAN C, JU Y.A review on rice bran protein: its properties and extraction methods[J].Critical Reviews in Food Science and Nutrition,2011, 51: 816-827.DOI:10.1080/10408398.2010.482678.
[4] SINGH T P, SOGI D S.Comparative study of structural and functional characterization of bran protein concentrates from superfine, fine and coarse rice cultivars[J].International Journal of Biological Macromolecules, 2018, 111: 281-288.DOI:10.1016/j.ijbiomac.2017.12.161.
[5] AMAGLIANI L, O’REGAN J, KELLY A L, et al.The composition,extraction, functionality and applications of rice proteins: a review[J].Trends in Food Science & Technology, 2017, 64: 1-12.DOI:10.1016/j.tifs.2017.01.008.
[6] 赵谋明, 辛佩贤, 赵强忠, 等.酸性条件下花生分离蛋白亚基结构的变化规律[J].现代食品科技, 2014, 30(12): 37-42.DOI:10.13982/j.mfst.1673-9078.2014.12.007.
[7] 王长远, 全越, 许凤, 等.pH处理对米糠蛋白理化特性及结构的影响[J].中国生物制品学杂志, 2015, 28(5): 483-487.DOI:10.13200/j.cnki.cjb.000904.
[8] JIANG J, XIONG Y L.Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat Science, 2013, 93(3): 469-476.DOI:10.1016/j.meatsci.2012.11.002.
[9] 蒋将, 李开放, 刘元法, 等.pH值偏移处理豌豆分离蛋白的胶凝性质[J].食品科学, 2013, 34(21): 10-15.DOI:10.7506/spkx1002-6630-201321003.
[10] 王健, 徐晔晔, 于洁, 等.pH偏移结合热处理对大豆蛋白柔性与乳化性的影响[J].食品科学, 2018, 39(14): 22-28.DOI:10.7506/spkx1002-6630-201814004.
[11] 吴伟, 蔡勇建, 吴晓娟, 等.米糠贮藏时间对米糠蛋白结构的影响[J].现代食品科技, 2017, 33(1): 173-178; 205.DOI:10.13982/j.mfst.1673-9078.2017.1.027.
[12] 耿蕊, 刘骞, 卢岩, 等.pH偏移结合加热处理对大豆分离蛋白结构特性的影响[J].中国食品学报, 2015, 11(15): 219-226.DOI:10.16429/j.1009-7848.2015.11.033.
[13] LIU Y L, LI X H, ZHOU X L, et al.Effects of glutaminase deamidation on the structure and solubility of rice glutelin[J].LWT-Food Science and Technology, 2011, 44(10): 2205-2210.DOI:10.1016/j.lwt.2011.05.011.
[14] HUANG Y R, HUA Y F, QIU A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39(2): 240-249.DOI:10.1016/j.foodres.2005.07.012.
[15] WU W, ZHANG C M, KONG X Z, et al.Oxidative modification of soy protein by peroxyl radicals[J].Food Chemistry, 2009, 116(1):295-301.DOI:10.1016/j.foodchem.2009.02.049.
[16] BENELHADI S, GHARSALLAOUI A, DEGRAEVE P, et al.Effect of pH on the functional properties of Arthrospira (Spirulina) platensis protein isolate[J].Food Chemistry, 2016, 194(1): 1056.DOI:10.1016/j.foodchem.2015.08.133.
[17] KAMARA M T, AMADOU I, TARAWALIE F, et al.Effect of enzymatic hydrolysis on the functional properties of foxtail millet(Setaria italica L.) proteins[J].International Journal of Food Science and Technology, 2010, 45(6): 1175-1183.DOI:10.1111/j.1365-2621.2010.02260.x.
[18] MOLINA E, PAPADOPOULOU A, LEDWARD D A.Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J].Food Hydrocolloids, 2001, 5(3): 263-269.DOI:10.1016/S0268-005X(01)00023-6.
[19] CRUZ-ANGELES J, MARTÍNEZ L M, VIDEA M.Application of ATR-FTIR spectroscopy to the study of thermally induced changes in secondary structure of protein molecules in solid state[J].Biopolymers,2015, 103(10): 574-584.DOI:10.1002/bip.22664.
[20] LI R, CUI Q, WANG G R, et al.Relationship between surface functional properties and flexibility of soy protein isolate-glucose conjugates[J].Food Hydrocolloids, 2019, 95: 349-357.DOI:10.1016/j.foodhyd.2019.04.030.
[21] SUN W Z, ZHOU F B, SUN D W, et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology, 2013, 6(7): 1703-1712.DOI:10.1007/s11947-012-0823-8.
[22] JACKSON M, MANTSCH H H.The use and misuse of FTIR spectroscopy in the determination of protein structure[J].Critical Reviews in Biochemistry and Molecular Biology, 1995, 30(2): 95-120.DOI:10.3109/10409239509085140.
[23] BÖCKER U, OFSTAD R, BERTRAM H C, et al.Salt-induced changes in pork myofibrillar tissue investigated by FT-IR microspectroscopy and light microscopy[J].Journal of Agricultural and Food Chemistry,2006, 54(18): 6733-6740.DOI:10.1021/jf060178q.
[24] ZHOU F B, ZHAO M M, CUI C, et al.Influence of linoleic acidinduced oxidative modifications on physicochemical changes and in vitro digestibility of porcine myofibrillar proteins[J].LWTFood Science and Technology, 2015, 61(2): 414-421.DOI:10.1016/j.lwt.2014.12.037.
[25] 常通.酸碱法提取鳙鱼蛋白及鱼糜凝胶品质的研究[D].武汉: 华中农业大学, 2014: 49-58.
[26] 付湘晋, 许时婴, 王璋, 等.酸碱处理对鲢鱼肌原纤维蛋白热变性、聚集、胶凝性质的影响[J].食品科学, 2008, 29(6): 100-103.DOI:10.3321/j.issn:1002-6630.2008.06.016.
[27] JIANG J, CHEN J, XIONG Y L.Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J].Journal of Agricultural and Food Chemistry, 2009,57(16): 7576-7583.DOI:10.1021/jf901585n.
[28] ZHOU C Y, PAN D D, SUN Y Y, et al.The effect of cooking temperatures on the aggregation and digestion rate of myofibrillar proteins in Jinhua ham[J].Journal of the Science of Food and Agriculture, 2018, 98(9): 3563-3570.DOI:10.1002/jsfa.8872.
[29] 尤翔宇, 黄慧敏, 吴晓娟, 等.过氧自由基氧化对米糠蛋白结构和功能性质的影响[J].食品科学, 2019, 40(4): 34-41.DOI:10.7506/spkx1002-6630-20171227-346.
[30] JIANG J, XIONG Y L, CHEN J.Role of β-conglycinin and glycinin subunitsin the pH-shifting-induced structural and physicochemical changes of soy protein isolate[J].Journal of Food Science, 2011,76(2): 293-302.DOI:10.1111/j.1750-3841.2010.02035.x.
[31] XIA N, WANG J M, GONG Q, et al.Characterization and in vitro digestibility of rice protein prepared by enzyme-assisted microfluidization: comparison to alkaline extraction[J].Journal of Cereal Science, 2012, 56(2): 482-489.DOI:10.1016/j.jcs.2012.06.008.
[32] BAX M L, AUBRY L, FERREIRA C, et al.Cooking temperature is a key determinant of in vitro meat protein digestion rate: investigation of underlying mechanisms[J].Journal of Agricultural and Food Chemistry, 2012, 60(10): 2569-2576.DOI:10.1021/jf205280y.
[33] MORRIS A M, WATZKY M A, FINKE R G.Protein aggregation kinetics, mechanism, and curve-fitting: a review of the literature[J].Biochimica et Biophysica Acta, 2009, 1794: 375-397.DOI:10.1016/j.bbapap.2008.10.016.
[34] JIANG J, XIONG Y L, CHEN J.pH shifting alters solubility characteristics and thermal stability of soy protein isolate and its globulin fractions in different pH, salt concentration, and temperature conditions[J].Journal of Agricultural and Food Chemistry, 2010,58(13): 8035-8042.DOI:10.1021/jf101045b.
[35] LV S W, SUN L H, ZHAO S Y, et al.Effect of dry heat stabilisation on the functional properties of rice bran proteins[J].International Journal of Food Science and Technology, 2017, 52: 1836-1843.DOI:10.1111/ijfs.13458.