铁蛋白是广泛存在于生物体中的一种铁储藏蛋白,其主要生物学功能有两种:一是将二价铁离子转化成可溶无毒且生物可利用的三价铁形式并储存于蛋白质内部空腔,调节铁代谢平衡;二是清除亚铁离子介导的自由基反应,保护细胞免受氧化性损伤。天然的铁蛋白由蛋白质外壳和内部铁核两部分组成,外壳是由24 个相同或不同的亚基构成的具有高度对称结构的中空笼状蛋白质分子,铁核则是由大量氢氧化铁和磷酸盐组成。在无氧条件下可利用还原反应将铁核去除,从而制备得到具有内部空腔的脱铁铁蛋白外壳[1-2]。铁蛋白的笼状外壳非常稳定,具有较强的酸碱耐受性(pH 2.0~12.0)以及热稳定性(蛋白质变性温度为70~80 ℃)。铁蛋白的高级结构主要是由亚基间的氢键和疏水作用维持,故可以通过物理化学的手段将其亚基解离及重新组装,其可逆的解离重组特性为铁蛋白纳米笼作为包埋外壳以及递送载体的应用奠定了基础[3]。
由于铁蛋白纳米笼独特的结构、优良的理化性质和良好的生物相容性,其内部空腔被广泛地用于封装无机或有机客体分子,应用于食品营养、生物医药与纳米材料等领域。铁蛋白作为纳米载体具有以下优势:第一,铁蛋白封装纳米颗粒尺寸较小且均一性好,一般为12 nm左右。第二,生理条件下,铁蛋白在细胞内或血液中具有良好的溶解性和稳定性。第三,铁蛋白在特定条件(如强酸或者强碱)下可解离成单亚基,而当恢复至生理环境时,铁蛋白又可以重新组装成笼形结构且性质不变。利用这种可逆自组装特性,客体分子可以容易地被包埋进内部空腔中。第四,铁蛋白的界面位置容易进行遗传或化学修饰以赋予其他功能性[4]。目前为止,铁蛋白已被广泛用于包埋花青素、姜黄素、芦丁等多种食品营养素以提高其水溶性、稳定性以及细胞吸收率,利用铁蛋白装载抗癌药物、造影剂等成分可用于实现药物的靶向传递、细胞成像以及肿瘤治疗等研究。此外,由于天然蛋白质结构单一,铁蛋白也被科学家们广泛用于人工设计制造不同结构性质的新型笼形蛋白,这极大拓展了铁蛋白作为纳米载体的应用范围。本篇综述对铁蛋白分子的结构特点进行系统总结,并重点介绍其作为纳米载体应用于食品科学、营养健康及医药成像等领域的研究进展。
1 铁蛋白的结构
1.1 铁蛋白的典型结构特征
不同来源铁蛋白的亚基种类与氨基酸组成有一定差异,但其空间结构具有很高的保守性。典型的铁蛋白结构是由24 个相同或相似的亚基自组装形成的一种中空笼状分子,内外径分别约为8 nm和12 nm。铁蛋白亚基的外形近似圆柱体,长、宽分别约5.0、2.5 nm。亚基结构由1 个两两成反向平行的α螺旋簇(A、B和C、D螺旋)和1 个较短α螺旋(E螺旋)组成,B和C螺旋之间由一段被称为BC-环的氨基酸链连接,E螺旋位于α螺旋簇的尾端并与之成60°夹角(图1A)。铁蛋白亚基的氨基端、BC-环、A螺旋和C螺旋构成铁蛋白的外表面,B螺旋和D螺旋则位于内表面[1,5-7]。铁蛋白内表面富含谷氨酸、天冬氨酸等酸性氨基酸残基,因此在pH值为中性的条件下,铁蛋白内表面具有较高的负电荷密度,而外表面的净电荷接近于零或略带正电荷。
铁蛋白分子具有3 种化学性质不同的活性界面:内表面、外表面、亚基间界面(图1B),而这3 种界面均可通过化学和基因手段进行修饰来实现铁蛋白的功能调控[8]。化学修饰指将染料分子、猝灭剂等功能性小分子与铁蛋白特定氨基酸进行化学偶联,基因修饰是定点突变、添加或删除特定氨基酸改变铁蛋白的基因序列。铁蛋白外表面偶联修饰一些官能团可赋予其发光成像等特性,内表面主要是作为纳米反应器合成无机纳米材料或用于包埋活性营养小分子,亚基间界面则可用于调控铁蛋白分子的解离重组以及设计新型笼状蛋白。通过对这3 种活性界面的修饰和改造,可以拓展铁蛋白分子应用空间。
作为一种典型的笼形蛋白,铁蛋白分子通过亚基界面之间的复杂而精确的作用力自组装形成具有高度对称性的四级结构。参与铁蛋白笼状结构组装的亚基间界面包括C2、C3、C4以及C3-C4界面,其中C2和C3-C4界面是维持亚基间相互作用的主要区域(图1C)。一般认为铁蛋白的亚基先形成1 个反向平行的二聚体,之后二聚体形成铁蛋白的四级结构,若把二聚体当作1 个面,铁蛋白则为一种呈4-3-2点对称的菱形十二面体。该十二面体上沿二、三、四重旋转轴分别为铁蛋白亚基与亚基之间组成的12 个二重轴通道、8 个三重轴通道、6 个四重轴通道。其中铁蛋白的三重轴通道和四重轴通道的孔径在0.3~0.5 nm之间,起到连接内部空腔和外部环境的作用。金属离子和带正电荷的小于铁蛋白通道孔径的有机小分子可以通过静电吸引扩散到空腔中,但大分子由于空间位阻则不能通过铁蛋白通道进入内部空腔[1-2]。
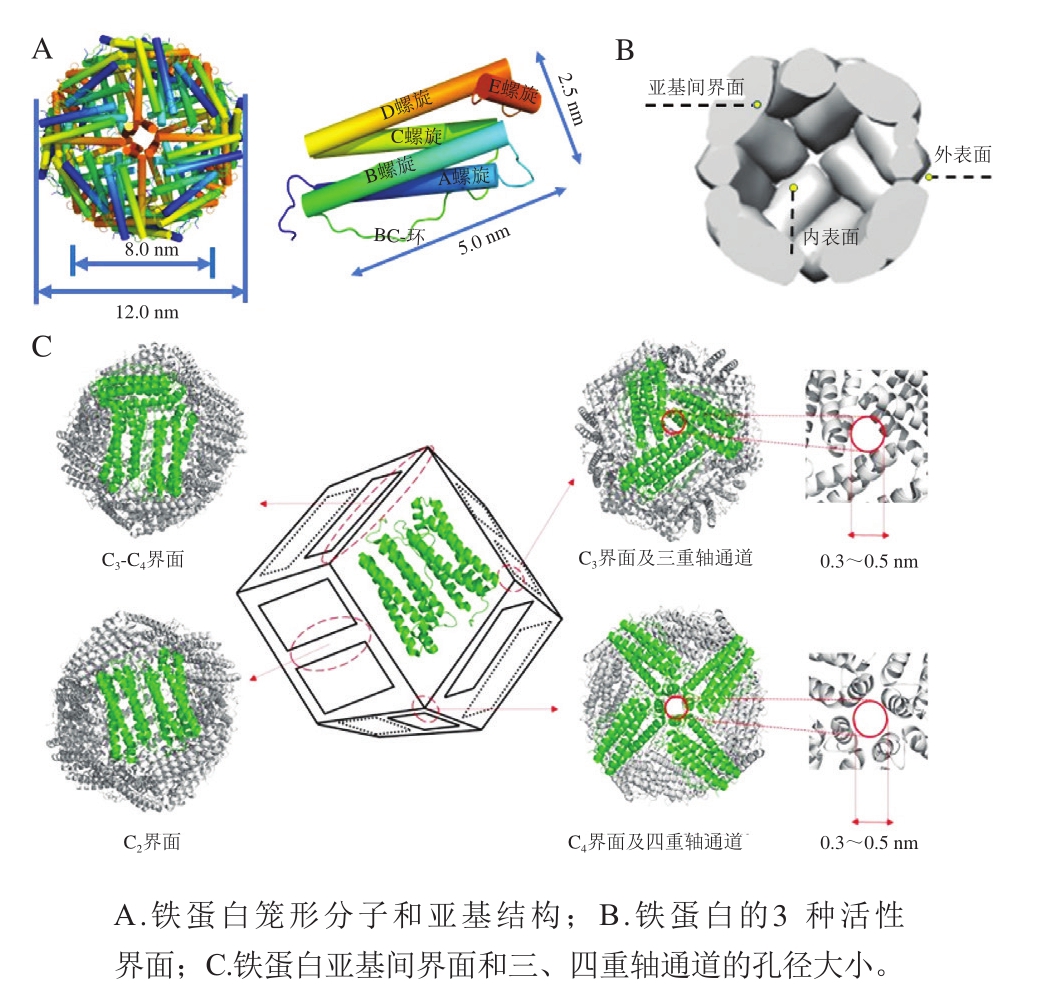
图1 铁蛋白结构特征
Fig. 1 Structural characteristics of ferritin
1.2 不同来源天然铁蛋白特征
动物铁蛋白通常由功能差异很大的H型(重链,分子质量约为21 kDa)和L型(轻链,分子质量约为19.5 kDa)两种亚基组成。H型亚基包含1 个亚铁氧化中心,可将二价铁离子氧化成三价铁离子。1 个亚铁氧化中心能够同时结合2 个二价铁离子,亚铁氧化中心包含2 个铁离子结合位点,A位点由Glu27、Glu61、Glu62、His65和Glu107 5 个氨基酸残基构成,B位点由Tyr34和Gln141两个氨基酸残基构成[7,9]。L型亚基不具备氧化亚铁离子的功能,但其具有1 个成核中心,负责将氧化后的三价铁离子转化为矿化核[5]。铁蛋白H和L亚基的比例在不同器官和组织中有所区别,脑、心脏等代谢旺盛的器官中铁蛋白富含H亚基,而脾脏和肝脏等器官中铁蛋白L亚基比例较高[1]。H和L亚基可分别专一识别人体细胞的表面受体,一种是转铁蛋白受体(transferrin receptor,TfR)1,特异性识别铁蛋白H型亚基[10];另一种是清道夫A类受体5号蛋白,负责识别结合铁蛋白L型亚基[11]。
植物铁蛋白的24 个亚基均为具有亚铁氧化中心的H型亚基,其氨基酸组成与动物铁蛋白H型亚基相似度约为40%[12]。从豌豆、大豆、黑豆、玉米、苜蓿和拟南芥等植物体中分离得到的植物铁蛋白都是由H-1亚基(26.5 kDa)和H-2亚基(28.0 kDa)以不同的比例组成,H-1与H-2亚基氨基酸序列同源性为80%[2]。成熟的植物铁蛋白亚基N端位于蛋白壳的外表面具有一段特殊的延伸肽段(extension peptide,EP肽段)。重组大豆铁蛋白4的晶体结构表明,EP肽段通过与壳表面相邻亚基相互作用稳定植物铁蛋白的整体结构[13]。一方面,EP肽段具有二价亚铁离子氧化能力[14];另一方面,EP肽段还具有丝氨酸蛋白酶活性,能够调控铁蛋白的自降解,也与铁离子的还原释放过程有关[15]。不同于动物铁蛋白疏水性四重轴通道,植物铁蛋白的四重轴是由组氨酸组成的亲水性通道,研究表明植物铁蛋白的三重轴和四重轴亲水通道均为铁离子进出的主要通道[16]。
细菌铁蛋白(bacterioferritin,BFR)亚基结构与动植物铁蛋白类似,且具有亚铁氧化中心,但不同点在于细菌铁蛋白是一种亚基均聚物。目前在原核生物中发现的铁蛋白有3 类:第一类是与动物铁蛋白的H亚基结构相似的典型铁蛋白(canonical ferritin,FTN);第二类是结合血红素的BFR;第三类是DNA结合蛋白Dps[3]。大多数FTN具有典型的正八面体4-3-2对称结构,且具备铁氧化还原中心。与FTN不同,结合血红素的BFR包含12 个血红素,通过亚基二聚体中间界面的两个甲硫氨酸残基与血红素结合。研究表明,大肠杆菌和铜绿假单胞菌铁蛋白中的血红素虽然不是铁氧化沉淀或笼状组装所必需,但对于铁还原释放有显著作用[17]。Dps蛋白又称小铁蛋白,由12 个亚基组成1 个2-3对称的笼形结构,内径约为4.5 nm,外径约为9 nm。除此之外,科学家们也发现结构独特的BFR:来自火焰色古生菌的铁蛋白(Archaeoglobus fulgidus ferritin,AfFtn)以一种独特的方式组装成呈四面体2-3对称的笼状结构,表面有4 个直径约45 Å的大孔[18]。AfFtn和海栖热袍菌铁蛋白在低离子强度下以亚基二聚体形式存在,通过添加特定的矿物离子可重新组装为24聚体结构[19]。
1.3 铁蛋白的结构改造
由于天然蛋白质的尺寸和形状比较单一,限制了其应用范围。于是科学家们通过人工设计构建新型铁蛋白纳米笼。铁蛋白分子4 种亚基间界面对铁蛋白笼状结构的形成非常重要,其中C3-C4界面的表面积最大,其次是C2、C3和C4界面。Zhang Shengli等[20-21]通过在C3-C4界面关键位置插入或者删除氨基酸使24聚体铁蛋白分别转变为16聚体和48聚体笼形铁蛋白(图2A)。16聚体铁蛋白由两个相似的8聚体通过疏水作用连接在一起,形成扁球形中空结构。48聚体铁蛋白的外径则扩大为17 nm,其内部空腔容量大约是原来的4.3 倍,但在溶液条件下48聚体不稳定,会转化为直径约为10 nm的碗状8聚体铁蛋白。之后Zang Jiachen等[22]以上述碗状8聚体铁蛋白为模板,通过设计链内二硫键和链间二硫键为作用力,分别成功将其转化为3 种新型的笼形蛋白:笼形24聚体(外径12 nm)、椭圆16聚体(长轴10 nm、短轴8 nm)以及笼形48聚体(外径17 nm)(图2B)。而当完全消除铁蛋白的C3-C4界面,即删除铁蛋白亚基羧基端49 个残基时,铁蛋白将转化为8聚体纳米环状结构[23](图2C)。该纳米环内壁仅由B螺旋组成,而其外壁由A螺旋、C螺旋和BC-环组成,其高度为5.1 nm,内外径分别为3.2 nm和7 nm。
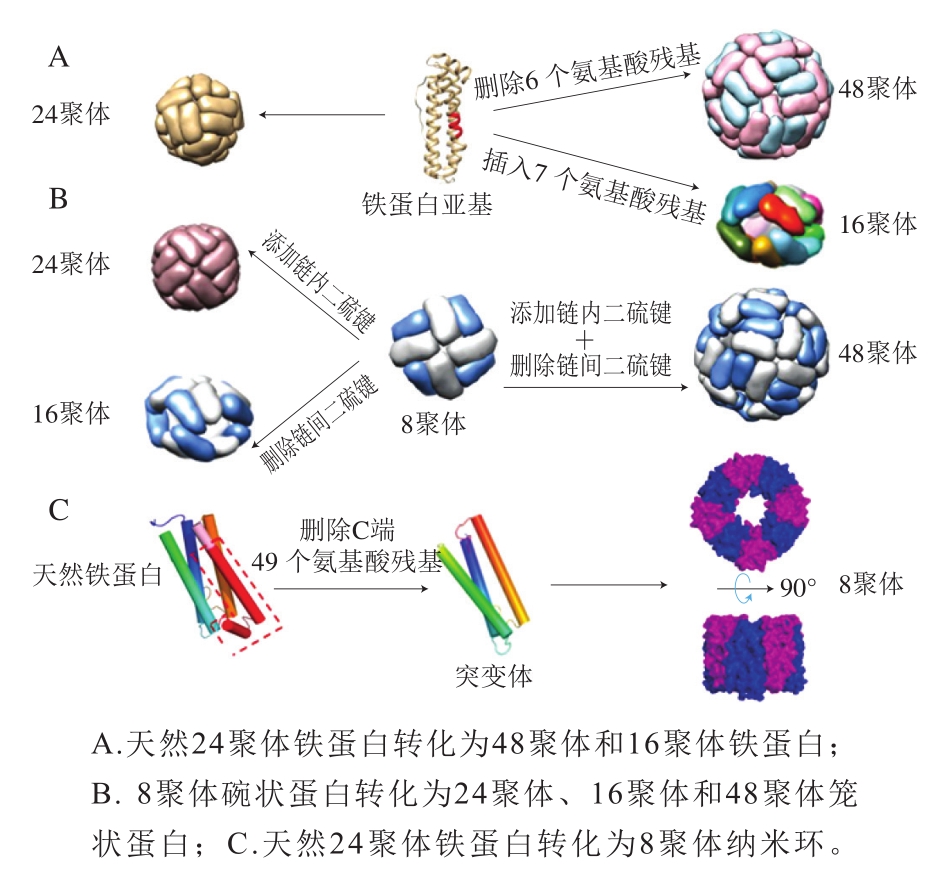
图2 铁蛋白的结构改造
Fig. 2 Structural transformation of ferritin
除了重新设计界面作用力得到更多不同尺寸形状的新型铁蛋白外,对于铁蛋白分子内组装调控的研究也取得了成功。Huard等[24]通过改造铁蛋白C2界面使得铁蛋白的自组装可以通过二价铜离子的结合来进行控制。而Gu Chunkai等[25]通过将组氨酸结构域插入到铁储藏蛋白C4界面处,成功制备得到一种新型4聚体铁蛋白,镍、铜以及锌等过渡金属离子在接近中性条件下可以诱导其重新自组装成24聚体笼形蛋白,而加入螯合剂后笼形蛋白又可重新解离成4聚体,该研究也为铁蛋白在中性条件下包埋生物活性物质提供了良好的应用模型。
2 铁蛋白在食品营养领域的应用
2.1 矿质元素载体
铁是生物体必需的微量元素之一,而缺铁性贫血(iron deficiency anemia,IDA)则是世界范围内最为普遍的一种营养素缺乏症,严重影响着人类的营养与健康,其主要原因在于铁摄入不足或过量消耗,因此科学家们在不断探索高效且安全的补铁制剂。目前,市场上常见的补铁剂主要是以硫酸亚铁或葡萄糖酸亚铁为代表,该类补剂虽然铁含量高、价格便宜,但性质不稳定且易受到食物其他组分的影响,同时会对人体产生一定副作用,如腹泻、呕吐、生长迟缓等[26]。天然植物铁蛋白特别是豆科类种子中的铁蛋白,由于其广泛来源以及丰富的铁含量受到了科学家的关注,被认为是一种新型天然膳食的补铁因子。得益于蛋白质外壳的保护,植物铁蛋白的铁不容易受到膳食中螯合剂如植酸和单宁酸的影响[27]。在豆科类种子中,90%以上的铁元素以铁蛋白的形式贮存在淀粉质体中,研究者比较了大鼠对硫酸亚铁与分离提取的大豆铁蛋白的铁吸收效果后发现,两组之间没有显著性差异,故大豆铁蛋白中的铁能被人体很好地吸收,具有与硫酸亚铁相似的补铁功效[28]。铁蛋白可以抑制亚铁离子自氧化生成具有毒副作用的活性氧, 具有去毒作用,蛋白可作为一种植物来源的新型补铁制剂。
钙是人体含量最为丰富的无机元素,参与体内多种生理过程,对人体的生长发育、营养健康起着重要作用。目前我国缺钙现象仍然普遍,市场上补钙制剂主要分为无机钙、生物活性钙、有机钙以及氨基酸螯合钙等,这些钙制剂均存在一定的应用缺陷,随后以多肽或蛋白质为主要配体的钙制剂迅速发展,研究发现钙或其他矿物元素可以通过肽转运机制或蛋白质的特异性受体被小肠细胞所吸收[29]。虽然乳制品是生物可利用钙的良好来源,但不适合于素食主义者等人群,因此开发植物来源蛋白质为载体的补钙制剂尤为重要。为解决上述问题,研究人员将钙离子装载进植物铁蛋白空腔中,制备得到铁蛋白钙复合物。细胞吸收实验发现,植物铁蛋白能够保护钙离子不受膳食抑制因子如草酸、单宁酸的干扰。此外,与已知的二价金属离子转运蛋白1(divalent metal-ion transporter-1,DMT1)介导的二价金属离子吸收途径不同,细胞可通过新的TfR1参与途径吸收铁蛋白-钙复合物,故铁蛋白包裹的钙离子不会干扰其他二价金属离子的吸收[30]。随后,锌、铜、硒等多种矿物元素被装载到铁蛋白空腔已得到实验验证,其特殊的中空结构和笼形的蛋白质外壳可以克服金属离子溶解度低以及易受外界环境干扰的缺点,显著提高矿质元素的生物利用率[31]。综上所述,铁蛋白作为矿质营养元素载体具有广阔的应用前景。
2.2 活性营养物质包埋
食品中存在着许多高生物活性小分子,如β-胡萝卜素、姜黄素、芦丁、花青素、叶黄素、原花青素等,这些物质被认为具有抗氧化、抗癌和抗炎症等生物活性,对于人体健康具有较大促进功能。然而这些化合物大多对于环境条件十分敏感,如水不溶性或光、热不稳定性等,这极大限制了其在营养和人类健康领域的应用,因此克服这些限制因素显得至关重要。近年来,动植物铁蛋白在食品科学和营养健康领域受到广泛关注,科学家们利用铁蛋白受pH值控制的可逆解离组装特性来包埋各种水溶性或脂溶性活性营养素[32-37]。这一方法简单易行且环境友好,同时研究发现包埋后营养小分子的水溶性、光热稳定性和细胞摄取活性明显优于游离状态,铁蛋白分子同时还能防止包埋物质受到食品中其他成分的干扰。
2.2.1 水溶性活性物质包埋
花青素属于类黄酮类物质,是一种重要的水溶性植物色素,水果、蔬菜等丰富的色彩大部分与之有关。花青素是一种强抗氧化剂,能够保护人体免受自由基的损伤,还能够增强血管弹性、抑制炎症和过敏,在食品中不但可作为营养强化剂,而且还可作为着色剂应用于饮料产品中[38]。然而在商品加工和贮存过程中,温度、氧气、光和酶等因素严重影响着花青素的稳定性,通过与各种有机酸酰基化、自缔合等方法虽然可以达到稳定花青素的作用,然而对花青素的保护仍非常有限[39]。矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)是桑椹花青素的主要成分之一,利用pH值介导铁蛋白解离重组的方法可以将C3G包裹在重组大豆铁蛋白的空腔内,研究结果显示平均1 个铁蛋白内部空腔可以装载约37.5 个C3G分子,包埋后C3G分子的热稳定性和光稳定性提高了约2 倍。更重要的是,将C3G分子包埋在铁蛋白空腔中可以显著提高C3G的小肠吸收效率[35]。
原花青素属于多酚类物质,广泛存在于各种植物中,其中以葡萄籽中原花青素含量最为丰富,提取率可达到9.5%[40]。作为一种国际公认的抗氧化剂,原花青素还具有降血脂、降血糖、抗病毒、抗肿瘤等生物活性,故被广泛应用于食品、保健品和药品等领域[41]。由于其酚羟基的结构在加工和贮存过程中容易受到温度、氧气和光照的影响,且在胃肠道运输中原花青素可能会发生降解从而降低其生物利用率,这些因素严重限制了原花青素在食品与医药行业上的应用。利用铁蛋白pH值介导的可逆组装特性,原花青素被成功装载于铁蛋白空腔中,包埋率为23.2%,并且与游离的原花青素相比,原花青素在铁蛋白纳米笼中的光和热稳定性显著提高。体外消化实验表明铁蛋白纳米笼能延长原花青素在胃肠道的释放时间[37]。
2.2.2 脂溶性活性物质包埋
姜黄素是从植物姜黄的根茎中分离出的活性成分,具有防腐和抗氧化作用。作为天然着色剂,姜黄素不会产生毒副作用且可以预防和治疗多种炎症疾病以及具备潜在的抗癌功能[42]。但是姜黄素生物利用率低,水溶性差,温度、pH值、光照、氧气等外界因素都会影响其稳定性进而降低活性。研究人员利用铁蛋白在不同pH值条件下的可逆组装特性,将其包埋于人重链铁蛋白内部空腔中,平均1 个铁蛋白分子可以装载约14.7 个姜黄素分子,包埋率和装载率分别为14.7%和1.07%。经铁蛋白包埋后姜黄素的水溶性从11 ng/mL增加到5 415 ng/mL,光热稳定性测定结果表明姜黄素的降解抑制率可达64.99%~69.10%[33]。研究认为铁蛋白包埋生物活性营养分子实现稳定性的显著提高得益于铁蛋白的性质,一方面来自于铁蛋白外壳的物理和化学的双重保护作用,铁蛋白具有良好的热稳定性,其笼状结构作为物理壁垒不仅隔绝了温度,还能够减少营养物质与外部的氧化剂分子相互作用,铁蛋白的半胱氨酸残基和其他官能团作为潜在的抗氧化剂还能够提供化学保护作用。另一方面是铁蛋白内部空腔可以通过疏水作用、范德华力或氢键等弱相互作用与营养物质形成复合物,有助于营养物质负载于内部空腔的稳定性。
叶黄素属于类胡萝卜素家族,是一种重要的天然植物色素,在蔬菜水果中广泛存在。叶黄素安全无毒、提取方便,且在保护视力、预防心脑血管疾病、抑制肿瘤生长方面发挥着重要作用,在食品和医药领域具有广阔的应用前景[43]。叶黄素的稳定性很差,主要易受氧气、光照、加热、pH值等因素的影响,如热处理过程可引起叶黄素产生异构化,此外水不溶性、生物利用度低等性质也严重限制了其实际应用。研究人员以大豆铁蛋白和壳聚糖为材料,通过铁蛋白受pH值控制的可逆解离重组特性和铁蛋白与壳聚糖的相互作用,制备出一种壳聚糖-大豆铁蛋白-叶黄素的复合材料。包埋结果显示每个铁蛋白包埋约25.2 个叶黄素分子,包埋率和装载率分别为16.8%和2.50%,与游离叶黄素相比,复合物的光、热稳定性均有较大提高。此外,由于铁蛋白的包埋和与壳聚糖的结合,复合物在模拟胃肠道消化过程中叶黄素的释放时间延长。同时研究发现食物成分对叶黄素的释放有不同的影响,表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、葡萄籽原花青素和牛奶对叶黄素的释放有抑制作用,而果胶对叶黄素的释放有促进作用[36]。
2.2.3 铁蛋白包埋策略的改良
以上结果表明,铁蛋白作为一种纳米载体在脂溶性以及水溶性活性营养成分包埋与递送具有广阔应用前景。然而,天然蛋白纳米笼对营养物质分子的包埋存在以下缺陷:一是传统的酸碱、变性剂促使解离重组的包埋方法(pH值低于2.0或高于12.0、8.0 mol/L尿素处理)会对铁蛋白分子造成一定的损伤,一部分蛋白质无法重新组装成完整的笼状结构;二是包埋的条件可能无法维持活性营养物质的稳定性,从而影响包埋物质的生物活性。针对上述不足,科学家们开始研究探索不同的处理方法,使铁蛋白分子能在较为温和的实验条件下进行活性物质的包埋。目前为止,各种改进的包埋策略已经实现,可以总结为3 类:第一类是通过物理处理或定向改造铁蛋白纳米笼使其能在pH值更为温和的条件下解离(图3A);第二类是不破坏蛋白的笼状结构,通过改变通道特性将营养物质包埋进铁蛋白空腔之中(图3B);第三类则是制备能在中性pH值条件下存在的铁蛋白低聚体,利用外部刺激等诱导蛋白质自组装成笼形结构应用于活性物质包埋(图3C)。下面具体介绍各种包埋改进策略。
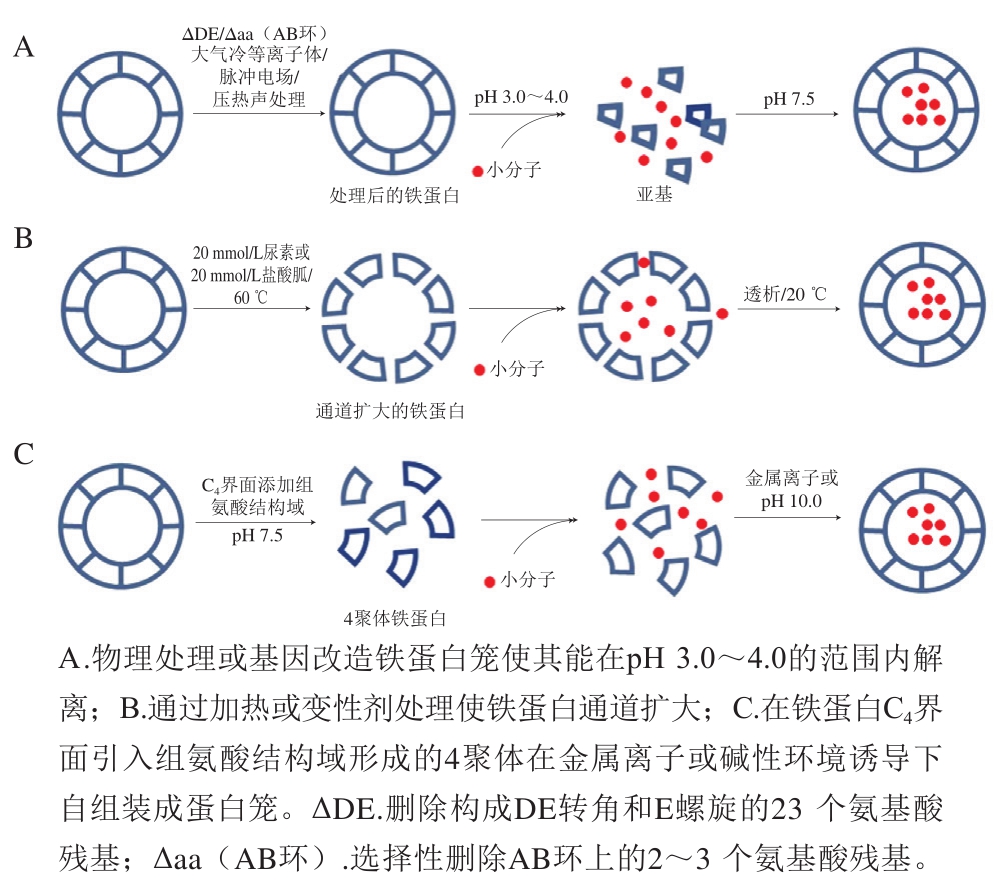
图3 通过不同策略改良铁蛋白对营养物质的包埋
Fig. 3 Improved strategies for molecule encapsulation within ferritin cavity
铁蛋白作为纳米载体在不同领域的应用如图4所示。Chen Hai等[44]通过删除人铁蛋白(human ferritin,HFn)DE转角和E螺旋位置的氨基酸制备铁蛋白突变体,该突变体在pH 4.0时就能实现亚基解离,在pH值调回中性时重新组装。利用这种pH值较为温和的解离条件同样可将姜黄素分子包埋进内部空腔中,姜黄素的水溶性得到了极大提高(图4A)。但删除参与四重轴作用的这些氨基酸使得四重轴通道直径扩大至1.8 nm左右,通道的扩大可能会引起较小包埋物质的泄漏。Wang Wenming等[45]则通过删除铁蛋白C3-C4界面AB环中的若干氨基酸,同样得到了可在较为温和pH值条件下可逆自组装的铁蛋白突变体,成功将姜黄素等活性物质包埋于空腔中,而且该突变体不会产生可能引起包埋物质泄漏的大孔道。此外,通过一些物理方法对铁蛋白进行处理,同样可以将其应用于温和条件下营养物质的包埋。研究发现大气压冷等离子体[46]、脉冲电场[47]、压热超声处理[48]等加工技术处理后的铁蛋白比未处理的铁蛋白能在pH值更为温和的条件下解离成单亚基,并在中性环境下重新自组装成纳米笼结构,利用这种方法成功将姜黄素、芦丁、EGCG等活性营养物质包埋于铁蛋白纳米笼中。
Yang Rui等[49]研究发现低浓度尿素(20 mmol/L)处理会将植物铁蛋白的通道直径扩大4 倍左右,营养小分子如EGCG可以通过扩大的通道进入铁蛋白空腔,而不需要破坏铁蛋白的笼状结构。透析去除尿素分子后,通道恢复正常大小,营养小分子则被包埋在铁蛋白纳米笼中,包埋率可达17.6%。由于铁蛋白通道处氨基酸相互作用对于变性剂分子的敏感性,低浓度(2 mmol/L)的盐酸胍也可用来制备铁蛋白活性分子包埋复合物[50]。此外,研究发现60 ℃热处理可以通过展开周围的α-螺旋来扩大植物铁蛋白的四重轴通道,活性分子芦丁可在pH值为中性的条件下通过通道进入空腔。当温度降低到20 ℃时,芦丁被封装在铁蛋白空腔内。利用此方法,平均1 个铁蛋白分子可包埋约10.5 个芦丁分子,包埋率为8.08%[51]。张晨曦等[52]则利用超声辅助加热的方法处理铁蛋白,虾青素可通过扩大的铁蛋白通道进入内部空腔之中,包埋率为19.8%。温和的包埋处理不会严重破坏虾青素等营养物质的生物活性,且虾青素的水溶性和光热稳定性均可得到显著改善。与游离的虾青素相比,铁蛋白-虾青素复合物能显著抑制H2O2诱导的HepG2细胞的氧化应激损伤。
前面提到的人工改造的铁蛋白在活性物质包埋方面也表现出显著优势。以16聚体新型蛋白笼为载体可在pH值为3.0的条件解离从而包埋姜黄素,姜黄素的溶解度可提高至游离状态的458 倍[20]。在铁蛋白C4界面引入组氨酸结构域,使其在中性pH值条件下以四聚体的形式存在,在过渡金属离子或pH值等外部刺激下可实现蛋白自组装成铁蛋白笼状结构。将这种组氨酸介导的可逆蛋白自组装特性应用于姜黄素等活性物质包埋,其效率几乎是已报道的酸碱变性包埋方法的3 倍,这极大地拓宽了铁蛋白在活性物质包埋递送的应用前景[25]。
2.3 重金属检测
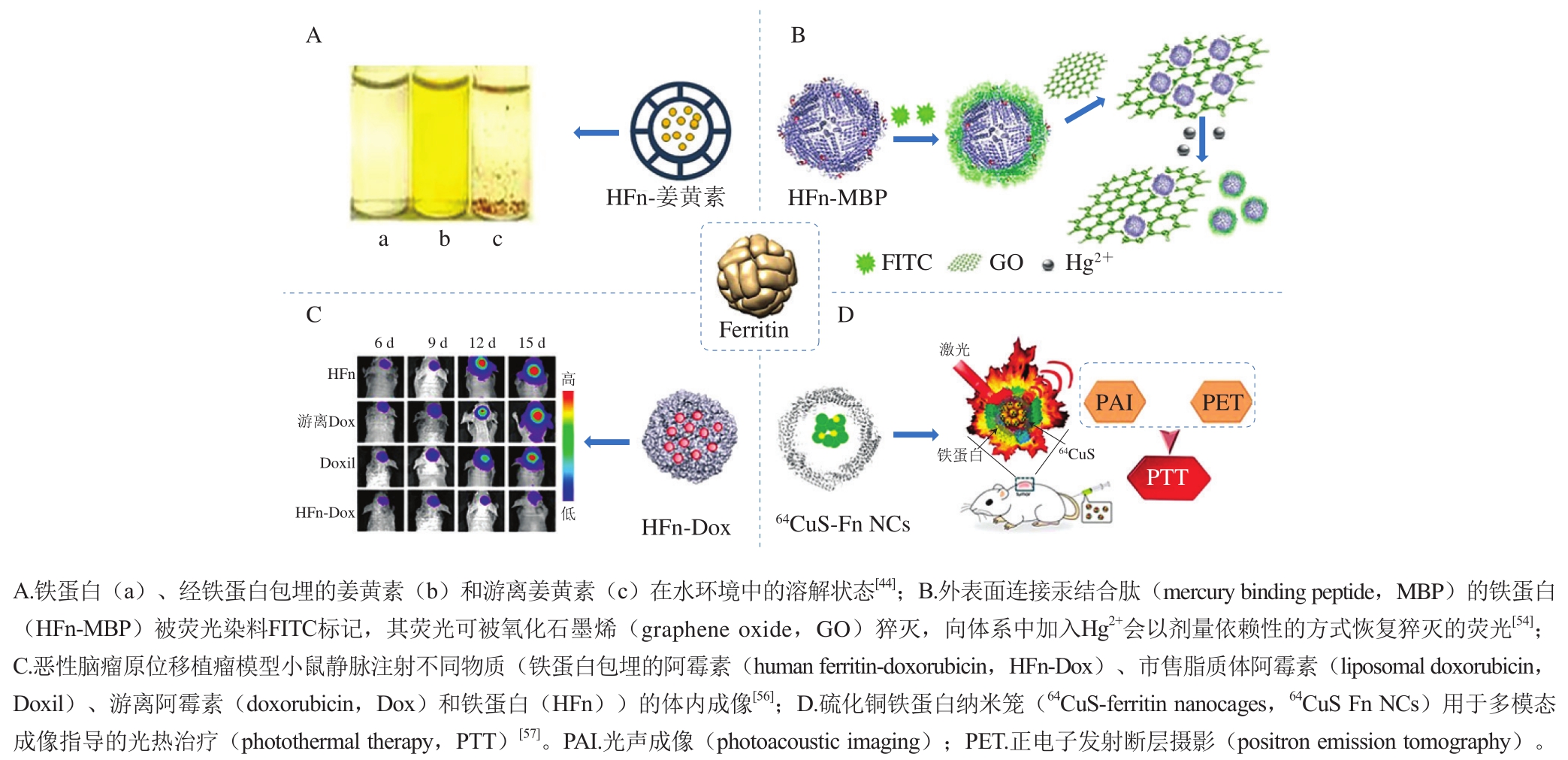
图4 铁蛋白作为纳米载体在食品营养、医药、诊断等领域的应用
Fig. 4 Application of ferritin as nanocarrier in food nutrition, medicine and diagnosis
汞是一种剧毒重金属,其可通过食物链进行生物累积从而严重威胁着人体健康。汞化合物可以分为无机汞和有机汞。无机汞主要以二价汞离子(Hg2+)形式存在于环境中,摄入或吸入会对人神经、胃肠道系统以及内脏器官等产生严重危害,因此建立能快速准确检测汞离子的方法对于食品安全、人类健康以及环境检测等方面具有重要意义。目前,原子吸收光谱、原子发生光谱、电感耦合等离子体质谱、电化学法等仪器方法可用于检测Hg2+等重金属离子,但这些传统方法存在成本高、处理过程繁琐等应用缺陷。近年来,荧光探针检测技术由于其灵敏度高、选择性好、应用方便等优势逐渐受到了研究人员的广泛关注[53]。Wang Yingjie等[54]通过在HFn纳米笼外表面连接一段MBP,成功制备了一种对Hg2+具有高结合能力的蛋白纳米笼(HFn-MBP)。用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的HFn-MBP的荧光可以被GO猝灭,而在上述体系中加入Hg2+可以以剂量依赖的方式恢复被猝灭的荧光(图4B)。该传感器由FITC标记的HFn-MBP和GO组成,对Hg2+具有较高的灵敏度和选择性,检测限可达1.0 nmol/L。此研究为铁蛋白纳米笼在重金属离子检测中的应用开辟了新的途径。
一般来说,有机汞化合物的毒性要远高于无机汞,而在有机汞中,甲基汞(methylmercury,MeHg+)危害性最大。由于分子质量小,脂肪溶解性强,故MeHg+容易通过血脑屏障,具有较强的神经毒性。金纳米团簇因其独特的荧光特性和优良的化学稳定性在化学传感和生物成像领域得到了广泛的应用,同时也被用于汞化合物检测等探针开发。Lü Chenyan等[55]利用非天然的16聚体铁蛋白作为生物模板,在水环境中以简便绿色的方法制备了一种新型16聚体铁蛋白-金纳米簇(7A-Au NCs),所制备的铁蛋白-金纳米簇复合物可在体内和体外高选择性地检测Hg2+和MeHg+,其不仅适用于血脑屏障内皮细胞的生物成像,而且可作为一种脑特异性MeHg+生物成像的有效探针。由此可见,以铁蛋白为模板制备的纳米材料在食品安全及医学领域的重金属离子检测方面具有很大的前景。
3 铁蛋白在生物医药领域的应用
3.1 抗癌药物递送
恶性肿瘤是全球范围的健康问题,据国际癌症研究机构统计,2008—2018年全球癌症死亡病例增加了26.3%[58]。持续增长的癌症死亡率提示着肿瘤治疗仍存在着巨大的挑战,除了各种抗癌药物的研发,对于纳米药物载体的研究同样引起了广泛的关注。由于人重链铁蛋白可以特异识别TfR1,通过冷冻电子显微镜技术对TfR1与人重链铁蛋白的复合物结构解析发现,H型亚基A螺旋的氨基端、BC-环和C螺旋的羧基端是铁蛋白与TfR1结合的相应区域[59]。TfR1在肿瘤细胞中过表达,利用其固有的肿瘤靶向性,人重链铁蛋白已被广泛用于装载顺铂、卡铂、奥沙利铂等铂类化合物[60]、Dox[61]、金基化合物(Au2phen和Auoxo4)[62]、钌络合物(DiRu-1)[63]等多种抗癌药物。研究发现铁蛋白作为药物载体能够穿越血脑屏障,实现对原位恶性脑胶质瘤的靶向治疗(图4C)[56]。血脑屏障是维持中枢神经系统稳态和保护脑组织免受代谢物损伤的天然屏障,几乎所有大分子药物和大部分小分子药物无法穿越血脑屏障抵达脑组织,故中枢神经系统疾病如恶性脑瘤无法得到有效治疗。由于TfR1在脑内皮细胞和恶性肿瘤细胞中均能高表达,实验结果表明铁蛋白可通过脑内皮细胞的转胞吞作用穿过血脑屏障且不会阻断在溶酶体,又可以通过TfR1介导特异性富集到恶性脑瘤细胞的溶酶体中降解。铁蛋白包埋并靶向释放药物Dox从而靶向杀伤癌细胞[56]。铁蛋白与TfR1特异性的靶向结合及理想的纳米尺寸效应是其既可以穿越血脑屏障又具有肿瘤组织高选择性的重要原因。
在其他铁蛋白外表面进行基因修饰同样可以赋予其癌细胞靶向性,de Turris等[64]在AfFtn表面设计一段序列来模拟人重链铁蛋白,突变体保留了AfFtn能够在中性pH值条件下由矿物离子控制的解离组装特性,同时能通过TfR1受体识别并被HeLa细胞内吞。Jiang Bing等在激烈火球菌铁蛋白表面修饰肝癌细胞靶向肽SP94使其能够特异结合肝癌细胞表面的受体葡萄糖调节蛋白78,当内腔装载Dox时,铁蛋白药物能够精准杀伤肝癌细胞[65]。当内部空腔装载Co3O4纳米酶时,利用纳米酶的过氧化物酶活性,铁蛋白探针可催化过氧化物酶底物,使肝癌细胞可视化[66]。同时该课题组研究发现药物分子进入人重链铁蛋白的通道是位于铁蛋白二重对称轴处的柔性区域,通道的大小可受温度调控。温度升高有助于周围的氨基酸残基摆动到远离二重轴的位置,药物从此处进入铁蛋白内腔。基于这一发现可以通过温度调节的方法将Dox、铂类等抗癌药物装载到铁蛋白内腔[67]。
3.2 诊断及光热治疗
铁蛋白空腔的生物矿化能力以及表面易于修饰的特性使得铁蛋白成为了良好的生物成像设备,其在核磁共振成像(magnetic resonance imaging,MRI)和PAI中得到了广泛的应用。MRI是一种强大的诊断技术,由于其高灵敏度和准确性,被广泛用于肿瘤成像。然而,目前使用的钆基造影剂缺乏对癌细胞的特异性导致假阳性出现,同时MRI由于空间分辨率不够可能无法检测到隐匿的肿瘤微沉积。Cao Changqian等[68]通过在铁蛋白纳米笼内合成磁铁矿核作为MRI造影剂用于癌症的体内检测,其具备极高的造影性能和TfR1依赖的MRI信号。Wang Zhantong等[57]利用仿生合成的方法在铁蛋白空腔内合成了硫化铜纳米颗粒(图4D),64CuS-Fn NCs具有极灵敏的肿瘤特异性靶向效应,在放射性核素64Cu标记后可利用PET及PAI两种成像模式表征肿瘤。同时,该材料具有较强的近红外吸收光热转化效率,靶向癌细胞后利用较低的激光照射便可达到高效的肿瘤PTT效果,可实现多模态成像指导的PTT。综上所述,诸多研究表明铁蛋白纳米笼是一种极具前景的肿瘤成像和PTT的纳米载体。
4 结 语
由于铁蛋白具有单分散性、高溶解性、高生物安全性和高稳定性等优点,利用铁蛋白纳米笼状结构、解离自组装以及易于修饰的特性将活性物质或抗癌药物进行包埋和靶向递送具有重要的意义。经过铁蛋白包埋后,活性营养物质的水溶性、热稳定性、光稳定性和细胞摄取率均得到显著提高,药物分子能够精准地靶向杀伤肿瘤细胞,且能够穿越血脑屏障抵达脑组织。诸多研究表明铁蛋白可作为一种新的包埋生物活性物质的纳米载体。此外,在食品重金属检测以及活体成像诊断等方面,铁蛋白纳米载体也具有非常广阔的应用前景。尽管针对铁蛋白包埋物质的制备方法和应用已经取得了很大的进展,但仍存在一些问题需要解决。首先,铁蛋白的包埋效率以及装载能力仍需提高,通过人工设计更多不同形状和性质的新型铁蛋白纳米笼或制备蛋白组装体利用组装间隙的空间是可能的解决方案,但具体的应用体系需深入探索。其次,目前研究大多集中在铁蛋白包埋物质的制备方法和医药应用,铁蛋白纳米载体在食品营养与检测方面的应用应受到更多关注。最后,铁蛋白在胃中的稳定性以及客体分子的细胞摄取效率有待进一步提高,这样才能保证铁蛋白运载体系对人体营养与健康的贡献进入实际临床应用。
[1]HARRISON P M, AROSIO P. The ferritins: molecular properties, iron storage function and cellular regulation[J]. Biochimica et Biophysica Acta, 1996, 1275(3): 161-203. DOI:10.1016/0005-2728(96)00022-9.
[2]ZHAO G. Phytoferritin and its implications for human health and nutrition[J]. Biochimica et Biophysica Acta, 2010, 1800(8): 815-823.DOI:10.1016/j.bbagen.2010.01.009.
[3]ZANG J, CHEN H, ZHAO G, et al. Ferritin cage for encapsulation and delivery of bioactive nutrients: from structure, property to applications[J]. Critical Reviews in Food Science and Nutrition, 2017,57(17): 3673-3683. DOI:10.1080/10408398.2016.1149690.
[4]ZHANG C, ZHANG X, ZHAO G. Ferritin nanocage: a versatile nanocarrier utilized in the field of food, nutrition, and medicine[J].Nanomaterials, 2020, 10(9): 1894. DOI:10.3390/nano10091894.
[5]CRICHTON R R, HERBAS A, CHAVEZ-ALBA O, et al.Identification of catalytic residues involved in iron uptake by L-chain ferritins[J]. Journal of Biological Inorganic Chemistry, 1996, 1(6):567-574. DOI:10.1007/s007750050093.
[6]MASUDA T, GOTO F, YOSHIHARA T, et al. Crystal structure of plant ferritin reveals a novel metal binding site that functions as a transit site for metal transfer in ferritin[J]. Journal of Biological Chemistry, 2010, 285(6): 4049-4059. DOI:10.1074/jbc.M109.059790.
[7]CHASTEEN N D, HARRISON P M. Mineralization in ferritin: an efficient means of iron storage[J]. Journal of Structural Biology, 1999,126(3): 182-194. DOI:10.1006/jsbi.1999.4118.
[8]UCHIDA M, KANG S, REICHHARDT C, et al. The ferritin superfamily: supramolecular templates for materials synthesis[J].Biochimica et Biophysica Acta, 2010, 1800(8): 834-845. DOI:10.1016/j.bbagen.2009.12.005.
[9]CRICHTON R R, DECLERCQ J P. X-ray structures of ferritins and related proteins[J]. Biochimica et Biophysica Acta, 2010, 1800(8):706-718. DOI:10.1016/j.bbagen.2010.03.019.
[10]LI L, FANG C J, RYAN J C, et al. Binding and uptake of H-ferritin are mediated by human transferrin receptor-1[J]. Proceedings of the National Academy of Sciences, 2010, 107(8): 3505-3510.DOI:10.1073/pnas.0913192107.
[11]LI J Y, PARAGAS N, NED R M, et al. Scara5 is a ferritin receptor mediating non-transferrin iron delivery[J]. Developmental Cell, 2009,16(1): 35-46. DOI:10.1016/j.devcel.2008.12.002.
[12]MASUDA T, GOTO F, YOSHIHARA T. A novel plant ferritin subunit from soybean that is related to a mechanism in iron release[J]. Journal of Biological Chemistry, 2001, 276(22): 19575-19579. DOI:10.1074/jbc.M011399200.
[13]MASUDA T, GOTO F, YOSHIHARA T, et al. Crystal structure of plant ferritin reveals a novel metal binding site that functions as a transit site for metal transfer in ferritin[J]. Journal of Biological Chemistry, 2010, 285(6): 4049-4059. DOI:10.1074/jbc.M109.059790.
[14]LI C, HU X, ZHAO G. Two different H-type subunits from pea seed(Pisum sativum) ferritin that are responsible for fast Fe(II) oxidation[J].Biochimie, 2009, 91(2): 230-239. DOI:10.1016/j.biochi.2008.09.008.
[15]FU X, DENG J, YANG H, et al. A novel EP-involved pathway for iron release from soya bean seed ferritin[J]. Biochemical Journal, 2010,427(2): 313-321. DOI:10.1042/BJ20100015.
[16]LV C, ZHANG S, ZANG J, et al. Four-fold channels are involved in iron diffusion into the inner cavity of plant ferritin[J]. Biochemistry,2014, 53(14): 2232-2241. DOI:10.1021/bi500066m.
[17]ANDREWS S C, LE BRUN N E, BARYNIN V, et al. Site-directed replacement of the coaxial heme ligands of bacterioferritin generates heme-free variants[J]. Journal of Biological Chemistry, 1995, 270(40):23268-23274. DOI:10.1074/jbc.270.40.23268.
[18]JOHNSON E, CASCIO D, SAWAYA M R, et al. Crystal structures of a tetrahedral open pore ferritin from the hyperthermophilic archaeon archaeoglobus fulgidus[J]. Structure, 2005, 13(4): 637-648.DOI:10.1016/j.str.2005.01.019.
[19]CECI P, FORTE E, DI CECCA G, et al. The characterization of thermotoga maritima ferritin reveals an unusual subunit dissociation behavior and efficient DNA protection from iron-mediated oxidative stress[J]. Extremophiles Life Under Extreme Conditions, 2011, 15(3):431-439. DOI:10.1007/s00792-011-0374-3.
[20]ZHANG Shengli, ZANG Jiachen, WANG Wenming, et al. Conversion of the native 24-mer ferritin nanocage into its non-native 16-mer analogue by insertion of extra amino acid residues[J]. Angewandte Chemie International Edition, 2016, 55(52): 16064-16070.DOI:10.1002/anie.201609517.
[21]ZHANG Shengli, ZANG Jiachen, ZHANG Xiaorong, et al. “Silent”amino acid residues at key subunit interfaces regulate the geometry of protein nanocages[J]. ACS Nano, 2016, 10(11): 10382-10388.DOI:10.1021/acsnano.6b06235.
[22]ZANG Jiachen, CHEN Hai, ZHANG Xiaorong, et al. Disulfidemediated conversion of 8-mer bowl-like protein architecture into three different nanocages[J]. Nature Communications, 2019, 10(1): 778.DOI:10.1038/s41467-019-08788-9.
[23]WANG W, WANG L, CHEN H, et al. Selective elimination of the key subunit interfaces facilitates conversion of native 24-mer protein nanocage into 8-mer nanorings[J]. Journal of the American Chemical Society, 2018, 140(43): 14078-14081. DOI:10.1021/jacs.8b09760.
[24]HUARD D J, KANE K M, TEZCAN F A. Re-engineering protein interfaces yields copper-inducible ferritin cage assembly[J].Nature Chemical Biology, 2013, 9(3): 169-176. DOI:10.1038/NCHEMBIO.1163.
[25]GU Chunkai, ZHANG Tuo, LÜ Chenyan, et al. His-mediated reversible self-assembly of ferritin nanocages through two different switches for encapsulation of cargo molecules[J]. ACS Nano, 2020,14(12): 17080-17090. DOI:10.1021/acsnano.0c06670.
[26]赵聪, 黄浩, 陈贵堂. 缺铁性贫血与补铁剂研究概况[J]. 食品安全质量检测学报, 2016, 7(8): 3216-3221. DOI:10.19812/j.cnki.jfsq11-5956/ts.2016.08.037.
[27]LIAO X, YUN S, ZHAO G. Structure, function, and nutrition of phytoferritin: a newly functional factor for iron supplement[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(10): 1342-1352.DOI:10.1080/10408398.2011.635914.
[28]BO L, ANNIKA B, LIU X, et al. Iron absorption from soybean ferritin in nonanemic women[J]. American Journal of Clinical Nutrition, 2006,83(1): 103-107. DOI:10.1002/hlca.19930760515.
[29]赵梓月, 王思远, 廖森泰, 等. 多肽螯合钙的研究进展[J].食品研究与开发, 2020, 41(5): 200-206. DOI:10.12161/j.issn.1005-6521.2020.05.033.
[30]LI M, ZHANG T, YANG H, et al. A novel calcium supplement prepared by phytoferritin nanocages protects against absorption inhibitors through a unique pathway[J]. Bone, 2014, 64: 115-123.DOI:10.1016/j.bone.2014.04.006.
[31]李美良, 蒲彪, 赵广华. 铁蛋白: 一种新型矿质元素营养强化剂载体[J].食品科学, 2014, 35(13): 326-333. DOI:10.7506/spkx1002-6630-201413062.
[32]CHEN L, BAI G, YANG R, et al. Encapsulation of β-carotene within ferritin nanocages greatly increases its water-solubility and thermal stability[J]. Food Chemistry, 2014, 149: 307-312. DOI:10.1016/j.foodchem.2013.10.115.
[33]CHEN L, BAI G, YANG S, et al. Encapsulation of curcumin in recombinant human H-chain ferritin increases its water-solubility and stability[J]. Food Research International, 2014, 62: 1147-1153.DOI:10.1016/j.foodres.2014.05.054.
[34]YANG R, ZHOU Z, SUN G, et al. Synthesis of homogeneous proteinstabilized rutin nanodispersions by reversible assembly of soybean(Glycine max) seed ferritin[J]. RSC Advances, 2015, 5(40): 31533-31540. DOI:10.1039/C5RA03542B.
[35]ZHANG T, LV C, CHEN L, et al. Encapsulation of anthocyanin molecules within a ferritin nanocage increases their stability and cell uptake efficiency[J]. Food Research International, 2014, 62: 183-192.DOI:10.1016/j.foodres.2014.02.041.
[36]YANG R, GAO Y, ZHOU Z, et al. Fabrication and characterization of ferritin-chitosan-lutein shell-core nanocomposites and lutein stability and release evaluation in vitro[J]. RSC Advances, 2016, 6(42): 35267-35279. DOI:10.1039/C6RA04058F.
[37]ZHOU Z, SUN G, LIU Y, et al. A novel approach to prepare proteinproanthocyanidins nano-complexes by the reversible assembly of ferritin cage[J]. Food Science and Technology Research, 2017, 23(2):329-337. DOI:10.3136/fstr.23.329.
[38]辛宇, 孙敬蒙, 张炜煜. 花青素生物活性及制剂的研究进展[J].食品工业科技, 2021, 42(17): 415-424. DOI:10.13386/j.issn1002-0306.2020080078.
[39]曾茜茜, 雷琳, 赵国华, 等. 花青素加工贮藏稳定性的改善及应用研究进展[J]. 食品科学, 2018, 39(11): 269-275. DOI:10.7506/spkx1002-6630-201811042.
[40]丁玉峰, 郭书贤, 张弘弛, 等. 葡萄籽中原花青素水浴提取工艺[J].食品工业, 2019, 40(8): 32-36.
[41]陈梦雨, 黄小丹, 王钊, 等. 植物原花青素的研究进展及其应用现状[J]. 中国食物与营养, 2018, 24(3): 54-58. DOI:10.3969/j.issn.1006-9577.2018.03.012.
[42]周阿容, 葛胜晗, 孔子浩, 等. 姜黄素的功能特性及其毒理学研究进展[J]. 食品研究与开发, 2019, 40(16): 219-224. DOI:10.12161/j.issn.1005-6521.2019.16.038.
[43]杨敏, 张倩玉, 黄宏伟, 等. 叶黄素对人RPE细胞氧化应激损伤的保护作用[J]. 中国食物与营养, 2017, 23(8): 57-61.
[44]CHEN Hai, ZHANG Shengli, ZHAO Guanghua, et al. Engineering protein interfaces yields ferritin disassembly and reassembly under benign experimental conditions[J]. Chemical Communications, 2016,52(46): 7402-7405. DOI:10.1039/c6cc03108k.
[45]WANG Wenming, WANG Lele, LI Guobang, et al. Ab loop engineered ferritin nanocages for drug loading under benign experimental conditions[J]. Chemical Communications, 2019, 55(82): 12344-12347.DOI:10.1039/C9CC05247J.
[46]YANG R, LIU Y, MENG D, et al. Effect of atmospheric cold plasma on structure, activity, and reversible assembly of the phytoferritin[J]. Food Chemistry, 2018, 264: 41-48. DOI:10.1016/j.foodchem.2018.04.049.
[47]MENG D, WANG B, ZHEN T, et al. Pulsed electric fields-modified ferritin realizes loading of rutin by a moderate pH transition[J]. Journal of Agricultural and Food Chemistry, 2018, 66(46): 12404-12411.DOI:10.1021/acs.jafc.8b03021.
[48]MENG D, ZUO P, SONG H, et al. Influence of manothermosonication on the physicochemical and functional properties of ferritin as a nanocarrier of iron or bioactive compounds[J]. Journal of Agricultural and Food Chemistry, 2019, 67(23): 6633-6641. DOI:10.1021/acs.jafc.9b01739.
[49]YANG Rui, LIU Yuqian, MENG Demei, et al. Urea-driven epigallocatechin gallate (EGCG) permeation into the ferritin cage, an innovative method for fabrication of protein-polyphenol co-assemblies[J]. Journal of Agricultural and Food Chemistry, 2017,65(7): 1410. DOI:10.1021/acs.jafc.6b04671.
[50]YANG R, LIU Y Q, BLANCHARD C, et al. Channel directed rutin nano-encapsulation in phytoferritin induced by guanidine hydrochloride[J]. Food Chemistry, 2018, 240: 935-939. DOI:10.1016/j.foodchem.2017.07.088.
[51]YANG R, TIAN J, LIU Y, et al. Thermally induced encapsulation of food nutrients into phytoferritin through the flexible channels without additives[J]. Journal of Agricultural and Food Chemistry, 2017, 65(46):9950-9955. DOI:10.1021/acs.jafc.7b03949.
[52]张晨曦, 张晓荣, 吕晨艳, 等. 超声辅助法制备铁蛋白-虾青素包埋物[J].食品科学, 2021, 42(11): 94-101. DOI:10.7506/spkx1002-6630-20200604-055.
[53]沈洋, 胡继文, 刘婷婷, 等. 纳米光学传感器用于检测汞离子[J].化学进展, 2019, 31(4): 536-549. DOI:10.7536/PC180933.
[54]WANG Yingjie, CHEN Hai, ZANG Jiachen, et al. Re-designing ferritin nanocages for mercuric ion detection[J]. The Analyst, 2019,144(19): 5890-5897. DOI:10.1039/c9an01110b.
[55]LÜ Chenyan, YIN Shuhua, ZHANG Xiuqing, et al. 16-Mer ferritinlike protein templated gold nanoclusters for bioimaging detection of methylmercury in the brain of living mice[J]. Analytica Chimica Acta,2020, 1127: 149-155. DOI:10.1016/j.aca.2020.06.055.
[56]FAN K, JIA X, ZHOU M, et al. Ferritin nanocarrier traverses the blood brain barrier and kills glioma[J]. ACS Nano, 2018, 12(5): 4105-4115.DOI:10.1021/acsnano.7b06969.
[57]WANG Zhantong, HUANG Peng, JACOBSON O, et al.Biomineralization-inspired synthesis of copper sulfide-ferritin nanocages as cancer theranostics[J]. ACS Nano, 2016, 10(3):3453-3460. DOI:10.1021/acsnano.5b07521.
[58]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492.
[59]MONTEMIGLIO L C, TESTI C, CECI P, et al. Cryo-EM structure of the human ferritin-transferrin receptor 1 complex[J]. Nature Communications, 2019, 10(1): 1121. DOI:10.1038/s41467-019-09098-w.
[60]YANG Z, WANG X, DIAO H, et al. Encapsulation of platinum anticancer drugs by apoferritin[J]. Chemical Communications,2007(33): 3453-3455. DOI:10.1039/b705326f.
[61]LIANG M, FAN K, ZHOU M, et al. H-ferritin-nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection[J]. Proceedings of the National Academy of Sciences, 2014,111(41): 14900-14905. DOI:10.1073/pnas.1407808111.
[62]MONTI D M, FERRARO G, PETRUK G, et al. Ferritin nanocages loaded with gold ions induce oxidative stress and apoptosis in MCF-7 human breast cancer cells[J]. Dalton Transactions, 2017, 46(44):15354-15362. DOI:10.1039/C7DT02370G.
[63]PETRUK G, MONTI D M, FERRARO G, et al. Encapsulation of the dinuclear trithiolato-bridged arene ruthenium complex diruthenium-1 in an apoferritin nanocage: structure and cytotoxicity[J]. ChemMedChem,2019, 14(5): 594-602. DOI:10.1002/cmdc.201800805.
[64]DE TURRIS V, TRABUCO M C, PERUZZI G, et al. Humanized archaeal ferritin as a tool for cell targeted delivery[J]. Nanoscale, 2017,9(2): 647-655. DOI:10.1039/c6nr07129e.
[65]JIANG Bing, ZHANG Ruofei, ZHANG Jianlin, et al. GRP78-targeted ferritin nanocaged ultra-high dose of doxorubicin for hepatocellular carcinoma therapy[J]. Theranostics, 2019, 9(8): 2167. DOI:10.7150/thno.30867.
[66]JIANG Bing, YAN Liang, ZHANG Jianlin, et al. Biomineralization synthesis of the cobalt nanozyme in SP94-ferritin nanocages for prognostic diagnosis of hepatocellular carcinoma[J]. ACS Applied Materials and Interfaces, 2019, 11(10): 9747-9755. DOI:10.1021/acsami.8b20942.
[67]JIANG Bing, CHEN Xuehui, SUN Guoming, et al. A natural drug entry channel in the ferritin nanocage[J]. Nano Today, 2020, 35:100948. DOI:10.1016/j.nantod.2020.100948.
[68]CAO Changqian, WANG Xuxia, CAI Yao, et al. Targeted in vivo imaging of microscopic tumors with ferritin-based nanoprobes across biological barriers[J]. Advanced Materials, 2014, 26(16): 2566-2571.DOI:10.1002/adma.201304544.