植物在进化过程中为了适应环境而逐渐在体内形成复杂的胁迫应答信号传导网络,以提高植物对低温、高温、虫害、病害等各类非生物和生物胁迫的抗性[1]。新鲜果蔬是常见的食用类植物,是居民膳食的重要组成部分,但因富含水分和糖类,常常在采后及贮藏运输过程中受到各种生理性病害和侵染性病害的影响而发生腐烂变质[2-3]。为了响应采后病害的胁迫,果蔬中存在复杂的调控网络,以增强果蔬对采后病害的抗性。
在调控网络中,转录因子可特定识别和结合下游胁迫应答基因启动子中的顺式作用元件来响应胁迫[4]。转录因子又称为反式作用因子,其本质为蛋白质。AP2/ERF转录因子为植物特有的一类转录因子家族[5],该家族成员可以通过调控相关基因的表达来参与植物的各项生命活动和逆境胁迫,还可以调节植物激素的生物合成[6],响应水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)、乙烯(ethylene,ET)等各种植物激素信号[7]。
目前果蔬中AP2/ERF转录因子家族的研究主要集中于其对生长发育和成熟衰老[8]的调控,对于该家族转录因子调控果蔬采后抗病性方面已有一定的研究,但还需继续完善。本文对AP2/ERF转录因子及其调控果蔬响应采后生理性病害和侵染性病害的作用及机理进行综述,期望为通过AP2/ERF转录因子的调控提高采后果蔬抗病性提供理论依据。
1 AP2/ERF转录因子概述
1.1 AP2/ERF转录因子的结构特点和分类
AP2/ERF转录因子的结构中存在着1 个或2 个特有的AP2 DNA结合结构域,该结构域含有60~70 个高度保守的氨基酸残基,由1 个β-折叠和平行β-折叠的α-螺旋组成[5],根据该结构特点将其定义为AP2/ERF转录因子超家族。AP2结构域中YRG(氨基酸序列)和RAYD(氨基酸序列)元件在DNA结合活性中起着重要作用[5],位于结构域N端的YRG元件由约20 个亲水性氨基酸残基组成,可通过碱基和亲水性基团促进DNA结合;位于C端的RAYD元件包含约40 个残基,可通过α-螺旋来介导蛋白质与蛋白质的相互作用或通过α-螺旋的疏水面与DNA沟相互作用促使其与DNA结合[9]。
根据AP2/ERF转录因子家族的结构特点,可将其分为AP2、ERF、脱水反应元件结合因子(dehydration responsive element binding factor,DREB)和RAV 4 个主要亚族和1 个Soloist亚族[10]。在4 个亚族中,ERF和DREB亚族都只包含1 个AP2结构域[5],ERF亚族的启动子区域存在GCC-box(AGCCGCC),主要与ET应答和生物胁迫响应有关;DREB亚族可以通过核心基序DRE(A/GCCGAC)和CRT(TGGCCGAC)调控干燥响应基因RD、冷调节基因COR等应激响应基因的表达[9]。AP2亚族成员有2 个AP2结构域,RAV亚族成员有1 个AP2结构域和1 个DNA结合域B3,其对应的作用基序分别为CAACA和CACCTG。Soloist亚族成员具有类似AP2的结构域,但其保守性很低,缺少特定的WLG基序,所以被单独列为一类[9]。
1.2 果蔬中AP2/ERF转录因子的分布和数量
AP2/ERF转录因子最初是从模式植物拟南芥中分离出,随着对AP2/ERF转录因子的深入研究,除了烟草、拟南芥等模式植物外,目前已基本完成了对梨[11]、枣[12]、猕猴桃[13]、萝卜[9]、芹菜[14]等果蔬中AP2/ERF转录因子家族的全基因组鉴定。例如,在龙眼中共存在125 条AP2/ERF转录因子,其中101 条属于ERF/DREB亚家族,19 条属于AP2亚族,4 条属于RAV亚族,1 条为Soloist亚族[15]。Karanja等[9]在萝卜中共发现了247 条AP2/ERF转录因子,其中113 条属于ERF亚家族,99 条为DREB亚家族,25 条为AP2亚家族,9 条为RAV亚族,1 条为Soloist亚族,具体数据如表1所示。由此可以推测出,目前已报道的果蔬AP2/ERF转录因子超家族中,ERF和DREB两个亚族成员较多,AP2和RAV两个亚族的成员相对较少,Soloist亚族数量很少,大部分果蔬中只有1 条,枣、菠萝、芹菜等果蔬中甚至没有Soloist亚族的AP2/ERF转录因子。
表1 不同果蔬中AP2/ERF转录因子的分布及数量
Table 1 Distribution and quantity of AP2/ERF transcription factors in different fruits and vegetables
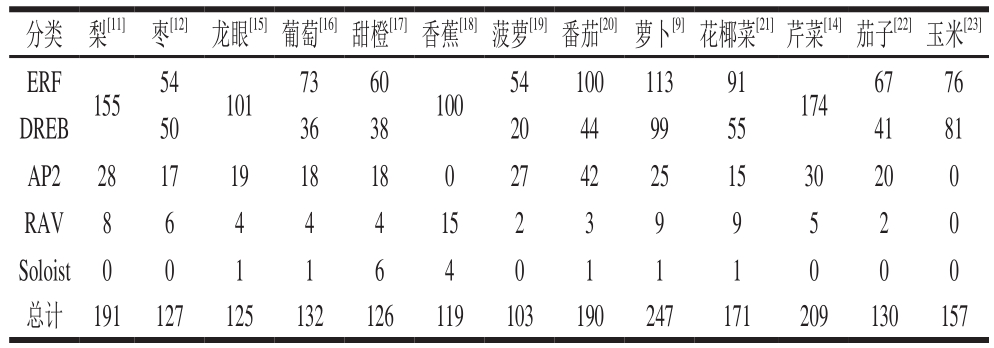
注:梨、龙眼、香蕉和芹菜分离鉴定得到的AP2/ERF转录因子中未将ERF亚族与DREB亚族分开统计。
分类 梨[11] 枣[12] 龙眼[15]葡萄[16]甜橙[17]香蕉[18]菠萝[19]番茄[20]萝卜[9]花椰菜[21]芹菜[14]茄子[22]玉米[23]ERF 155 54 101 73 60 100 54 100 113 91 174 67 76 DREB 50 36 38 20 44 99 55 41 81 AP2 28 17 19 18 18 0 27 42 25 15 30 20 0 RAV 8 6 4 4 4 15 2 3 9 9 5 2 0 Soloist 0 0 1 1 6 4 0 1 1 1 0 0 0总计 191 127 125 132 126 119 103 190 247 171 209 130 157
2 AP2/ERF转录因子对果蔬采后生理性病害的调控
果蔬在采后贮藏及运输过程中发生的病害可分为生理性病害和侵染性病害,其中生理性病害是由于果蔬受到某种不适宜理化因素的影响而造成的,其主要包括低温伤害、高温伤害、气体伤害[24]以及酶促褐变[25]等。果蔬中的AP2/ERF转录因子可以积极地响应各种不适宜理化因素的影响,通过自身的诱导表达以及对下游的转录调控来响应外界刺激,从而增强果蔬对采后生理性病害的抗性[26]。
2.1 AP2/ERF转录因子调控果蔬对低温伤害的响应
果蔬采后常利用低温保鲜来延长贮藏期[2],然而不同品种果蔬的最佳贮藏温度存在差异[27]。在低温条件下,起源于热带和亚热带的果蔬产品的正常生理活动和组织结构极易受到影响[28]而发生冷害;当果蔬组织处于冰点以下的环境中时,细胞会结冰破裂,果蔬表面出现变色以及坏死而发生冻害[24-29]。目前对于AP2/ERF转录因子在果蔬采后冷害胁迫中的调控作用已有相关的研究,而在果蔬采后冻害中的调控尚不明确。
当温度低于13 ℃时,香蕉果实便会发生冷害[30],香蕉中的转录因子MaERF10可以响应低温胁迫和茉莉酸甲酯(methyl jasmonate,MeJA)的处理,MaERF10与MaJAZ3可通过蛋白互作来协同抑制JA生物合成相关基因的表达,在MeJA诱导的香蕉果实响应低温胁迫中起负调控作用[31]。苹果中MdERF72是ET正调控转录因子,对过表达MdERF72的苹果愈伤组织进行低温处理,发现转基因苹果愈伤组织的生长势明显好于野生型,MdERF72可显著增强苹果耐冷性[32]。枇杷果实发生冷害反应时会出现严重的果肉木质化现象,在0 ℃贮藏可显著诱导枇杷EjERF27、EjERF30、EjERF36和EjERF39的表达上调,其转录水平与果肉木质化呈正相关,其中EjERF39可结合并激活木质素生物合成基因Ej4CL1启动子区域DRE元件,还可与EjMYB8形成蛋白复合物并对Ej4CL1的激活起到协同增效作用,在低温下促进枇杷果实木质化[33],从而加剧枇杷果实的冷害。
黄瓜是典型的冷敏感型果实,在温度低于10 ℃时极易发生冷害。黄瓜中转录因子CsERF29与组蛋白去乙酰化酶CsHDA18存在互作,减缓了黄瓜冷害症状的发展[34];低温会影响黄瓜的膜脂合成代谢和CsERF17/24/27的表达,从而调控黄瓜果实响应冷害。CsERF17可以结合并激活CsDGK1、CsPLDα1、CsPLDβ1等多个膜脂合成相关代谢基因的启动子,通过对膜脂合成代谢相关基因转录水平的调控来参与黄瓜对低温胁迫的响应[35]。辣椒同样对10 ℃以下的温度敏感[36],高表达ERF1的辣椒在冷藏条件下通过参与活性氧(reactive oxygen species,ROS)清除介导的胁迫响应而表现出更强的抗氧化能力,以改善低温胁迫下的氧化还原状态[37]。Lee等[36]研究发现ERF家族的调控和JA合成信号途径可能与辣椒果实的冷害反应有关。番茄SlDREB3过表达可通过上调抗氧化基因和SILEA的表达来增强转基因番茄的耐冷性,在低温胁迫诱导下,SlDREB3在果实中表达量较高[38]。
2.2 AP2/ERF转录因子调控果蔬对高温伤害的响应
热水处理是果蔬采后贮藏保鲜常用的物理方法[39],但是如果温度控制不当,果蔬硬度等品质指标在高温下会受到严重影响。高温处理会促进猕猴桃果实的软化[40],从而加速果实品质劣变。高温处理时,猕猴桃果实中AdERFs的表达模式变化较大,其中AdERF7、AdERF9和AdERF10的表达均与高温胁迫有关[40];对茄子中33 个SmERFs转录因子进行研究发现,大多数SmERFs都受胁迫诱导表达,在高温处理下,SmERF16、SmERF18等基因表达持续上调,诱导茄子对高温胁迫作出响应[22]。
2.3 AP2/ERF转录因子调控果蔬对酶促褐变的响应
褐变会影响果蔬在采后贮藏过程中的外观和营养价值,减少其抗氧化成分,并降低其营养价值[41]。酶促褐变是果蔬发生褐变的主要原因[42]。在‘皇家嘎拉’苹果中,ERF106在MYB10的激活下显著上调表达,并通过激活ET生物合成相关关键基因ACS和ACO的表达来调控ET的生物合成,提高了多酚氧化酶的活力,从而促进了苹果果实的褐变[43]。莲藕NnERF5在低温、二氧化碳气调包装和真空条件下的表达均被抑制,与莲藕的褐变进程一致,且NnERF5和NnPAL1的表达量存在显著相关性,由此推测NnERF5下调可抑制NnPAL1基因的表达,调控苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活力,从而参与对莲藕褐变的调控[44]。
2.4 AP2/ERF转录因子调控果蔬对高CO2伤害的响应
果蔬贮藏环境中CO2含量过高会引发高CO2伤害,使果蔬表面或果肉组织出现褐斑并脱水萎蔫[45]。柿果实利用高CO2进行采后脱涩的同时也有可能导致果实过度软化而造成损耗,Wu Wei等[46]发现DkERF8和DkERF16可对下游编码半纤维素降解相关酶的DkEGase1基因启动子起到转录调控作用,推测ERFs可通过参与柿果实脱涩软化过程的纤维素和半纤维素降解来响应高CO2处理;高CO2处理猕猴桃时,AdERF4和AdERF6也会被诱导表达[40],以响应胁迫。
当采后果蔬受到生理性病害的胁迫时,AP2/ERF转录因子可以积极响应低温、高温、酶促褐变以及高CO2伤害等胁迫,从而调控果蔬对生理性病害的抗性。在调控过程中,AP2/ERF转录因子大多起到正调控作用,通过自身及诱导下游相关抗性基因如黄瓜CsERF29诱导组蛋白去乙酰化酶基因HDACs、辣椒ERF1诱导JA相关基因LOX、AOS、JAZ1等表达上调,从而增强果蔬的抗性。而在某些果蔬中,AP2/ERF的上调可以抑制下游抗性基因的表达从而降低果蔬抗性,如香蕉MaERF10上调表达后抑制JA生物合成相关基因的表达水平,降低香蕉的耐冷性[31];AP2/ERF的上调还可以激活致病相关基因的表达从而加剧病害,如枇杷EjERF39结合并激活木质素生物合成基因Ej4CL1,促进了枇杷果实在低温下的木质化[33]。当这些AP2/ERF表达下调时,可以减少对抗性基因的抑制或者对致病相关基因的诱导表达,从而增强了果蔬的抗病性。
3 AP2/ERF转录因子对果蔬采后侵染性病害的调控
除了生理性病害,果蔬面临的采后病害更多的是在贮藏运输过程中由病原微生物引起的侵染性病害,根据病原微生物的种类可将其分为真菌性病害和细菌性病害。目前,使用各类化学杀菌剂是果蔬防治采后侵染性病害最主要的方法,但过度使用化学杀菌剂会出现环境污染、危害健康等问题[47],因此利用生物方法对侵染性病害进行绿色防治成为近年来的研究热点,如通过诱导农作物体内防御相关基因的表达来增强抗病性等。AP2/ERF转录因子可以通过调控抗病相关基因的表达来调控农作物的抗病性,如大豆GmERF113可以提高大豆对疫霉菌侵染的抗性[48],水稻OsERF83可以正调控水稻对稻瘟病菌的抗病性[49]。而果蔬作为人们日常生活中最重要的农产品之一,进一步明确AP2/ERF转录因子在果蔬采后受到侵染性病害胁迫时起到的转录调控作用具有重要意义。
3.1 AP2/ERF转录因子对果蔬采后真菌性病害的调控
由真菌侵染导致的病害是水果采后腐烂的主要原因之一[50],例如,由葡萄座腔菌(Botryosphaeria dothidea)引起的苹果轮纹病是我国苹果生产中的重要病害。Wang Jiahui等[51]发现侵染B. dothidea的苹果果实中MdERF11基因表达量明显上升,过表达MdERF11可提高苹果愈伤组织中的SA含量并可诱导SA合成途径与信号途径中EDS1、PAL、PR1、NPR1等基因的表达,从而激活防御响应,增强了抗病性,MdERF11沉默则会降低其抗病性。此外,转录因子MdERF113也参与了对苹果轮纹病侵染的防御响应,其调控作用可能与MdERF11相似[52]。中国野生毛葡萄‘丹凤-2’中VqERF112、VqERF114和VqERF072可以积极响应生物胁迫,这3 个转录因子可通过诱导下游响应SA信号的抗病相关基因AtNPR1、AtPR1、AtICS1和响应JA/ET信号的抗病相关基因AtPDF1.2、AtLOX3、AtPR3、AtPR4表达上调,以增强葡萄对灰霉病的抗性[53]。
在马铃薯中,StERF94可响应茄腐镰刀菌的侵染,过表达StERF94可诱导编码病程相关蛋白(pathogenesisrelated proteins,PRs)和抗氧化酶的相关基因表达上调,促使相关抗性蛋白的表达及物质的积累,并抑制真菌在细胞组织中的增殖,从而提高抗病性[54],而马铃薯StERF3对疫霉菌的抗性具有负调控作用[55]。辣椒疫霉病是辣椒采后病害中最具破坏性的病害之一,辣椒中CaAP2/ERF064的转录受植物激素信号通路的协同调控,对辣椒致病相关基因CaBPR1的表达有转录调节作用,CaAP2/ERF064的沉默使辣椒防御相关基因CaBPR1、CaPO2和CaSAR82表达下调,增加了辣椒对疫霉病的敏感性,而CaAP2/ERF064过表达可诱导NBPR1b转录水平上调,从而增强辣椒的抗病性[56]。
3.2 AP2/ERF转录因子对果蔬采后细菌性病害的调控
水果中细菌性病害的发生大多数只存在于采前,如苹果和梨果实梨火疫病、柑橘溃疡病和黄龙病、芒果黑斑病、桃和李果实细菌性穿孔病、西瓜细菌性角斑病和细菌性果斑病等病害,目前对AP2/ERF转录因子调控水果细菌性病害的研究主要集中于果树植株病害,如桃ERFs在果树细菌性穿孔病的防御中起正调节作用[57],苹果中MdERF100在拟南芥中过表达提高了拟南芥对白粉病的抗性[58],而对于AP2/ERF在果实采后贮藏过程中调控细菌性病害的研究还鲜有报道。
在蔬菜中,茄子青枯病是由茄科类雷尔氏菌(Ralstonia solanacearum)侵染引起的病害,R. solanacearum侵染茄子后,24 个SmERFs的表达水平发生变化,对其中显著表达的8 个SmERFs构建沉默体系,发现SmERF66和SmERF88参与茄子对青枯病抗性的调控[22]。木薯极易受到病原菌的侵染而发生细菌性枯萎病。当病原菌侵染时,启动子区域均含有胁迫响应元件的MeERF08、MeERF33、MeERF56等多个转录因子均可作出响应,可在强致病菌株中被诱导表达并在弱致病菌株中被抑制表达,从而对病害侵染起到转录调控作用[59]。
当采后果蔬受到细菌或真菌微生物的侵染而发生病害时,AP2/ERF转录因子可作为调控关键点在其中起到正调控或负调控作用,其大多数是通过上调或下调自身的转录水平来诱导下游相关抗病或致病基因的表达,通过介导植物激素信号通路、ROS清除或积累等相关抗病途径参与对果蔬采后侵染性病害的响应。目前对于AP2/ERF转录因子在果蔬采后病害的调控作用已有一定的研究(表2),但对其如何发挥调控作用的机制未形成清晰的信号网络,因此进一步明确AP2/ERF转录因子对果蔬采后病害的调控机理、完善调控信号网络,对于后续研究其他果蔬中AP2/ERF转录因子具有重要的参考价值。
表2 AP2/ERF转录因子对不同果蔬采后病害的调控作用
Table 2 Regulatory effects of AP2/ERF transcription factors on postharvest diseases of different fruits and vegetables
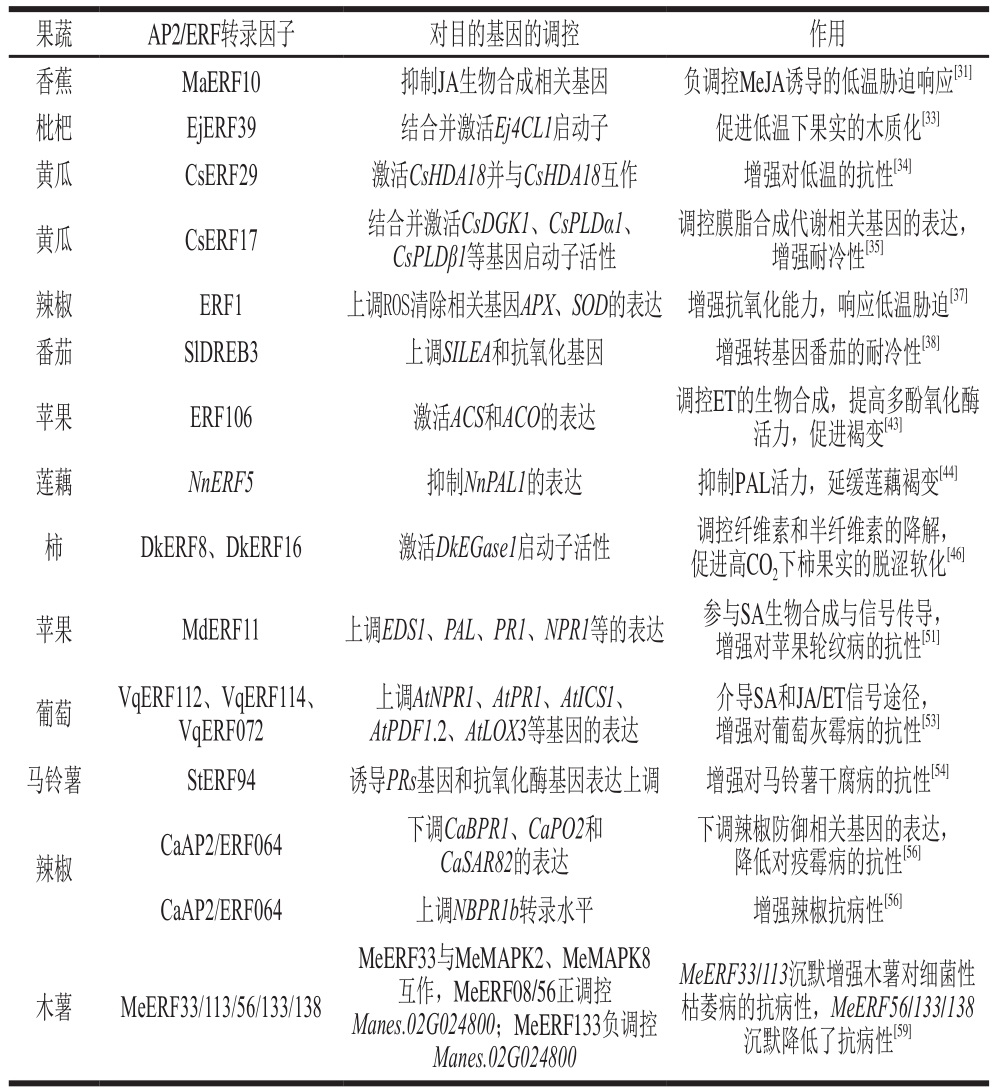
果蔬 AP2/ERF转录因子 对目的基因的调控 作用香蕉 MaERF10 抑制JA生物合成相关基因 负调控MeJA诱导的低温胁迫响应[31]枇杷 EjERF39 结合并激活Ej4CL1启动子 促进低温下果实的木质化[33]黄瓜 CsERF29 激活CsHDA18并与CsHDA18互作 增强对低温的抗性[34]黄瓜 CsERF17 结合并激活CsDGK1、CsPLDα1、CsPLDβ1等基因启动子活性介导SA和JA/ET信号途径,增强对葡萄灰霉病的抗性[53]马铃薯 StERF94 诱导PRs基因和抗氧化酶基因表达上调 增强对马铃薯干腐病的抗性[54]辣椒 CaAP2/ERF064 下调CaBPR1、CaPO2和CaSAR82的表达调控膜脂合成代谢相关基因的表达,增强耐冷性[35]辣椒 ERF1 上调ROS清除相关基因APX、SOD的表达 增强抗氧化能力,响应低温胁迫[37]番茄 SlDREB3 上调SILEA和抗氧化基因 增强转基因番茄的耐冷性[38]苹果 ERF106 激活ACS和ACO的表达 调控ET的生物合成,提高多酚氧化酶活力,促进褐变[43]莲藕 NnERF5 抑制NnPAL1的表达 抑制PAL活力,延缓莲藕褐变[44]柿 DkERF8、DkERF16 激活DkEGase1启动子活性 调控纤维素和半纤维素的降解,促进高CO2下柿果实的脱涩软化[46]苹果 MdERF11 上调EDS1、PAL、PR1、NPR1等的表达 参与SA生物合成与信号传导,增强对苹果轮纹病的抗性[51]葡萄 VqERF112、VqERF114、VqERF072上调AtNPR1、AtPR1、AtICS1、AtPDF1.2、AtLOX3等基因的表达下调辣椒防御相关基因的表达,降低对疫霉病的抗性[56]CaAP2/ERF064 上调NBPR1b转录水平 增强辣椒抗病性[56]木薯 MeERF33/113/56/133/138 MeERF33与MeMAPK2、MeMAPK8互作,MeERF08/56正调控Manes.02G024800;MeERF133负调控Manes.02G024800 MeERF33/113沉默增强木薯对细菌性枯萎病的抗病性,MeERF56/133/138沉默降低了抗病性[59]
4 AP2/ERF转录因子对果蔬采后病害的调控机理
AP2/ERF转录因子作为胁迫信号传导网络中的枢纽,在果蔬受到采后病害胁迫时,可与靶基因启动子中GCC-box、DRE/CRT等顺式作用元件相结合并调控其活性[60],对相关基因及蛋白的表达水平进行调控,并参与抗病相关途径的信号传导,以调控果蔬的抗病性。大多数时候,AP2/ERF转录因子并不是只介导单一的抗病信号通路,而是同时参与多个途径的信号传导来调控果蔬的抗病能力[61]。
4.1 参与植物激素信号途径,诱导防御相关基因的表达
AP2/ERF转录因子是连接植物激素信号的关键调节因子,其主要是依赖于SA、ET、JA等植物激素信号途径来对果蔬病害进行调控[62]。SA是介导植物防御的常见激素,SA信号途径可激活植物系统获得性抗性(systemic acquired resistance,SAR),并伴随着ROS的积累,通过激活SA信号途径中抗病相关的标志基因,包括诱导一系列PRs基因如PR1、PR2等的表达[63],从而参与对病害的调控。在ET介导的胁迫应答信号传导途径中,AP2/ERF转录因子作为ET响应因子,在下游起着重要的调控作用[7]。1-氨基环丙烷-1-羧酸合成酶(1-aminocyclopropane-1-carboxylate synthase,ACS)调控ET的生物合成,ET被各类ET受体识别并与其结合后,抑制了与受体关联的CTR1(constitutive triple response 1)激酶的活性,从而无法对EIN2(ethylene insensitive 2)的C端起到磷酸化作用。EIN2进入细胞核后可以激活转录因子EIN3,EIN3可激活下游ERF1等转录因子的转录表达,进而对信号通路中其他ET应答基因起到转录调控作用[64]。JA作为高等植物体内的生长调节物质,参与植物各项生理活动,其生物合成和信号传导与植物抗性密切相关。JA/ET介导的信号途径可触发诱导系统抗性,并可激活PR1b、PR3、PR4等病程相关基因[63]。
在辣椒转录因子CaDREB3的抗病调控过程中,CaDREB3可同时受到上游SA和JA/ET介导的信号途径的调节,从而提高PRs基因PR1、PR2、PR3和PR4的表达水平,增强抗病性[63]。辣椒CaERF14在外源SA、MeJA、乙烯利、脱落酸(abscisic acid,ABA)等植物激素的处理下均表达上调[63],构建CaERF14过表达烟草植株发现其脯氨酸含量和抗氧化酶活力提高,NtCA、NtSOD等防御相关基因表达显著上调,说明辣椒中CaERF14能诱导宿主增强对各种胁迫的抗性[63]。Zhu Ziguo等[65]对中国野葡萄中3 种AP2/ERF转录因子进行分析发现,VpERF1、VpERF2和VpERF3参与了ET和MeJA信号途径,其过表达显著提高了NtPR4的表达水平,VpERF1和VpERF3还参与了SA信号途径,诱导了NtPR1的表达,在不同程度上参与低温伤害等生理性病害胁迫响应,VpERF1和VpERF2还能通过ABA信号整合多种胁迫应答信号途径,以调控防御相关基因的表达,提高葡萄对病害胁迫的抗性。
4.2 增强细胞壁的防御能力
在植物中,细胞壁是抵御逆境胁迫和病原菌侵染的一道物理屏障,也是信号传递过程中必不可少的一部分,在防御响应中起着重要作用[66],而AP2/ERF转录因子主要通过介导木质素生物合成途径来参与细胞壁防御能力的调控。植物中ERF139可通过诱导LAC5、LBD15、MYB86等次生细胞壁合成相关基因的表达来参与木质素合成途径,木质素的积累及其与纤维素和半纤维素之间形成的网状结构增强了物理屏障,从而增强了植物对胁迫的抗性[67]。枇杷转录抑制因子EjAP2-1的表达与果实木质化呈负相关,该转录因子与木质素生物合成相关的EjMYB1和EjMYB2存在互作,并对木质素合成相关基因Ej4CL1启动子的表达具有抑制作用,通过抑制木质素的生物合成来减弱枇杷果实在低温下的木质化现象[68]。在信号传递方面,细胞壁中Ca2+浓度升高是ROS及超敏反应发生所必需的信号[69]。过表达SlERF01可增强番茄的超敏反应,提高相关防御基因的表达水平;其转基因株系在病原菌侵染后,木质素、胼胝质和过氧化氢等抗性物质的积累增加,PR1基因表达上调,提高了细胞壁的防御能力,这也说明SlERF01在SA、JA和ROS多个信号通路中起着不可或缺的作用[70]。另外,细胞壁中存在一些抗性相关的酶类,过氧化物酶(peroxidase,POD)等氧化还原酶类可以促进细胞壁组分形成屏障,阻止病原菌侵入;几丁质酶和β-1,3-葡聚糖酶等水解酶类可以通过对病原菌细胞壁的水解作用直接杀死病原菌;PAL、POD等防御相关酶活力在宿主受到病原菌侵染时也会发生变化[69],但是果蔬中AP2/ERF转录因子通过该作用来增强细胞壁防御能力的相关研究还存在空缺。
4.3 通过磷酸化参与丝裂原活化蛋白激酶级联信号通路
磷酸化对于ERF转录因子响应生物胁迫也是一种重要的调控形式,防御相关基因所编码的Pti4可被PTO激酶特异性地磷酸化,从而增强Pti4与下游靶基因的结合[71]。当病原菌激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联信号通路后,会触发SA、JA等激素信号途径,通过ERF转录因子表达水平的变化来介导防御相关基因的表达,激活防御相关酶的活力和诱导抗菌物质的累积[72],进而调控果蔬物理屏障和生化防御反应以响应病害侵染。
4.4 形成蛋白复合体
AP2/ERF转录因子还常与其他转录因子通过相互作用形成蛋白复合体,对下游靶基因起到协同或拮抗的调控作用。如图1所示,柿果实采后脱涩的过程中DkERF8和DkERF16可通过与DkNAC9蛋白相互作用而形成复合体,对下游基因DkEGase1启动子的调控起到协同增效作用,表明ERF可通过与NAC转录因子的互作参与柿果实对高CO2处理的响应[46]。
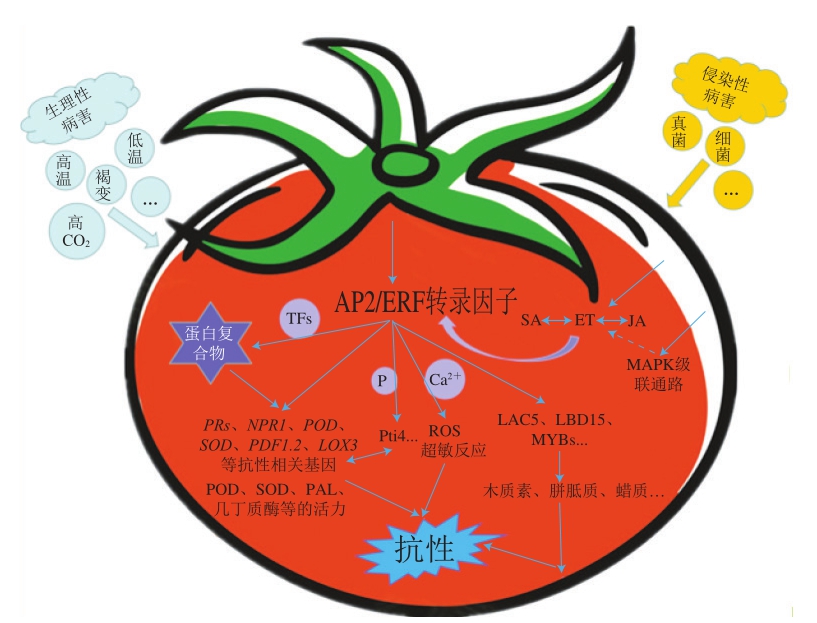
图1 AP2/ERF转录因子对果蔬采后病害的主要调控机制
Fig. 1 Major regulatory mechanisms of AP2/ERF transcription factors on postharvest diseases of fruits and vegetables
5 结 语
总的来说,AP2/ERF转录因子在果蔬响应采后生理性病害和侵染性病害的过程中起着重要的调控作用,该家族转录因子主要依赖于植物激素等信号途径来诱导或抑制下游防御相关基因的表达,并伴随着抗氧化防御系统的激活、PRs蛋白的积累、细胞壁防御能力增强以及磷酸化作用等抗病途径的变化,从而调控果蔬对低温伤害、酶促褐变、真菌及细菌侵染性病害等采后病害的抗性。目前对于AP2/ERF转录因子在调控抗病性方面的研究较多的是水稻、烟草、拟南芥等植物,在果蔬中的研究集中于生长发育、成熟衰老方面,对于AP2/ERF转录因子调控果蔬采后病害的作用及机理需要进一步深入探究。已有研究发现AP2/ERF转录因子在调控果蔬采后病害中大多起积极作用,对于加剧果蔬采后病害的转录因子所参与的调控网络仍需进一步完善。另外,随着分子生物学和高通量测序等技术的发展,通过基因工程选育抗性品种已成为部分农作物防治病害的重要手段,而对于在调控抗病性方面起着重要作用的转录因子其在基因工程育种方面的研究却存在较大的空缺。
今后可以在现有研究方法的基础上,利用分子生物学技术对更多其他品种果蔬中的AP2/ERF转录因子及其在采后病害调控中的功能进行研究,并进一步明确AP2/ERF转录因子调控果蔬采后病害所参与的信号传导途径,重点关注AP2/ERF转录因子对于生理性病害和侵染性病害调控机制的异同、在联合多个信号途径进行调控过程中的作用及机制以及AP2/ERF转录因子与其他家族转录因子共同调控时所参与的抗病信号途径及可能机制。可通过基因过表达及沉默技术,从多角度考虑AP2/ERF转录因子在响应果蔬采后病害过程中所起到的作用。期望能通过构建与完善AP2/ERF转录因子在果蔬采后病害调控中的信号网络模型,明确AP2/ERF转录因子的调控机制,以提高果蔬采后贮藏品质,并为通过基因工程育种及其他现代生物技术选育抗性果蔬提供理论参考。
[1]潘宣丞, 居超明, 杜雪竹. ERFs转录因子对植物生物胁迫和非生物胁迫反应调控的研究[J]. 分子植物育种, 2017, 15(11): 4433-4440.DOI:10.13271/j.mpb.015.004433.
[2]方庆. 果蔬贮藏保鲜技术现状与展望[J]. 农业工程, 2019, 9(8): 69-71. DOI:10.3969/j.issn.2095-1795.2019.08.021.
[3]高红豆, 胡文忠, 管玉格, 等. 采后果蔬呼吸代谢途径及其调控研究进展[J]. 包装工程, 2021, 42(15): 30-38. DOI:10.19554/j.cnki.1001-3563.2021.15.004.
[4]宋康华, 黎宇婷, 张鲁斌. AP2/ERF转录因子调控果实品质研究进展[J]. 热带作物学报, 2019, 40(5): 1032-1040. DOI:10.3969/j.issn.1000-2561.2019.05.028.
[5]OWJI H, HAJIEBRAHIMI A, SERADJ H, et al. Identification and functional prediction of stress responsive AP2/ERF transcription factors in Brassica napus by genome-wide analysis[J]. Computational Biology and Chemistry, 2017, 71: 32-56. DOI:10.1016/j.compbiolchem.2017.09.004.
[6]WANG X B, ZENG W F, DING Y F, et al. Peach ethylene response factor PpeERF2 represses the expression of ABA biosynthesis and cell wall degradation genes during fruit ripening[J]. Plant Science, 2019,283: 116-126. DOI:10.1016/j.plantsci.2019.02.009.
[7]XIE Z L, NOLAN T M, JIANG H, et al. AP2/ERF transcription factor regulatory networks in hormone and abiotic stress responses in Arabidopsis[J]. Frontiers in Plant Science, 2019, 10: 228.DOI:10.3389/fpls.2019.00228.
[8]ZHANG Z, LI X G. Genome-wide identification of AP2/ERF superfamily genes and their expression during fruit ripening of Chinese jujube[J]. Scientific Reports, 2018, 8(1): 7315-7324. DOI:10.1038/s41598-018-33744-w.
[9]KARANJA B K, XU L, WANG Y, et al. Genome-wide characterization of the AP2/ERF gene family in radish (Raphanus sativus L.): unveiling evolution and patterns in response to abiotic stresses[J]. Gene, 2019, 718: 144048. DOI:10.1016/j.gene.2019.144048.
[10]LÜ K W, LI J, ZHAO K, et al. Overexpression of an AP2/ERF family gene, BpERF13, in birch enhances cold tolerance through upregulating CBF genes and mitigating reactive oxygen species[J]. Plant Science,2020, 292: 110375. DOI:10.1016/j.plantsci.2019.110375.
[11]LI X L, TAO S T, WEI Shuwei, et al. The mining and evolutionary investigation of AP2/ERF genes in pear (Pyrus)[J]. BMC Plant Biology, 2018, 18(1): 46. DOI:10.1186/s12870-018-1265-x.
[12]纪晴, 周凡, 周军, 等. 枣AP2/EREBP转录因子的全基因组鉴定及生物信息学分析[J]. 基因组学与应用生物学, 2018, 37(7): 2983-2997.DOI:10.13417/j.gab.037.002983.
[13]邓浪, 沈兵琪, 王连春, 等. ‘红阳’猕猴桃全基因组AP2/EREBP转录因子生物信息学分析[J]. 果树学报, 2017, 34(7): 790-805.DOI:10.13925/j.cnki.gsxb.20160425.
[14]LI M Y, LIU J X, HAO J N, et al. Genomic identification of AP2/ERF transcription factors and functional characterization of two cold resistance-related AP2/ERF genes in celery (Apium graveolens L.)[J].Planta, 2019, 250(4): 1265-1280. DOI:10.1007/s00425-019-03222-2.
[15]ZHANG S T, ZHU C, LIU Y M, et al. Genome-wide identification,molecular evolution, and expression analysis provide new insights into the APETALA2/ethylene responsive factor (AP2/ERF) superfamily in Dimocarpus longan Lour[J]. BMC Genomics, 2020, 21(1): 62.DOI:10.1186/s12864-020-6469-4.
[16]ZHUANG J, PENG R H, CHENG Z M, et al. Genome-wide analysis of the putative AP2/ERF family genes in Vitis vinifera[J].Scientia Horticulturae, 2009, 123(1): 73-81. DOI:10.1016/j.scienta.2009.08.002.
[17]胡健兵. 全基因组发掘甜橙胁迫应答ERF类基因及其表达分析[D].武汉: 华中农业大学, 2016: 27-39.
[18]侯晓婉. 香蕉AP2/ERF超家族全基因组分析及MaERF25和MaERF27基因的功能研究[D]. 海口: 海南大学, 2015: 22-43.
[19]HUANG Y M, LIU Y H, ZHANG M, et al. Genome-wide identification and expression analysis of the ERF transcription factor family in pineapple (Ananas comosus (L.) Merr.)[J]. PeerJ, 2020, 8:e10014. DOI:10.7717/peerj.10014.
[20]张麒, 陈静, 李俐, 等. 植物AP2/ERF转录因子家族的研究进展[J]. 生物技术通报, 2018, 34(8): 1-7. DOI:10.13560/j.cnki.biotech.bull.1985.2017-1142.
[21]LI H, WANG Y, WU M, et al. Genome-wide identification of AP2/ERF transcription factors in cauliflower and expression profiling of the ERF family under salt and drought stresses[J]. Frontiers in Plant Science,2017, 8: 946. DOI:10.3389/fpls.2017.00946.
[22]邵欣欣. 茄子ERF转录因子表达分析及参与抗青枯病的初步研究[D].广州: 暨南大学, 2016: 36-57.
[23]HAO L D, SHI S B, GUO H B, et al. Genome-wide identification and expression profiles of ERF subfamily transcription factors in Zea mays[J]. PeerJ, 2020, 8: e9551. DOI:10.7717/peerj.9551.
[24]郭晓敏. 桃、李果实采后病害发生特点及其控制措施研究[D].北京: 北京工商大学, 2011: 9-21.
[25]白鸽, 王甄妮, 朱丹实, 等. 采后果实的果皮褐变机理及防褐变研究进展[J]. 包装工程, 2021, 42(5): 80-87. DOI:10.19554/j.cnki.1001-3563.2021.05.010.
[26]高春艳, 吴芮, 袁玉, 等. 植物AP2/ERF转录因子及其在非生物胁迫应答中的作用[J]. 江汉大学学报(自然科学版), 2017, 45(3): 236-240.DOI:10.16389/j.cnki.cn42-1737/n.2017.03.008.
[27]张丹丹, 屈红霞, 段学武, 等. 热带果蔬采后冷害研究进展[J].热带作物学报, 2020, 41(10): 2062-2079. DOI:10.3969/j.issn.1000-2561.2020.10.013.
[28]LIU D K, XU C C, GUO C X, et al. Sub-zero temperature preservation of fruits and vegetables: a review[J]. Journal of Food Engineering,2020, 275: 109881. DOI:10.1016/j.jfoodeng.2019.109881.
[29]马雷雷. 模拟苹果果实发生冻害的特性观察与研究[D]. 杨凌: 西北农林科技大学, 2018: 14-17.
[30]齐新娜. 香蕉MaJAZ3与转录因子MaERF10协同调控MeJA诱导果实耐冷性的机制分析[D]. 广州: 华南农业大学, 2016: 28-45.
[31]QI X N, XIAO Y Y, FAN Z Q, et al. A banana fruit transcriptional repressor MaERF10 interacts with MaJAZ3 to strengthen the repression of JA biosynthetic genes involved in MeJA-mediated cold tolerance[J]. Postharvest Biology and Technology, 2016, 120: 222-231. DOI:10.1016/j.postharvbio.2016.07.001.
[32]王佳慧, 顾凯迪, 王楚堃, 等. 苹果乙烯响应因子MdERF72对非生物胁迫的响应[J]. 中国农业科学, 2019, 52(23): 4374-4385.DOI:10.3864/j.issn.0578-1752.2019.23.017.
[33]ZHANG J, YIN X R, LI H, et al. ETHYLENE RESPONSE FACTOR39-MYB8 complex regulates low-temperature-induced lignification of loquat fruit[J]. Journal of Experimental Botany, 2020,71(10): 3172-3184. DOI:10.1093/jxb/eraa085.
[34]王晓晨. ERFs参与调控黄瓜果实贮藏冷害机制研究[D]. 广州: 华南农业大学, 2016: 38-46.
[35]赵普莹. ERFs调控黄瓜果实贮藏冷害及其与膜脂代谢关系研究[D].广州: 华南农业大学, 2018: 43-60.
[36]LEE J G, YI G, SEO J, et al. Jasmonic acid and ERF family genes are involved in chilling sensitivity and seed browning of pepper fruit after harvest[J]. Scientific Reports, 2020, 10(1): 17949. DOI:10.1038/s41598-020-75055-z.
[37]SHIN S Y, PARK M H, CHOI J W, et al. Gene network underlying the response of harvested pepper to chilling stress[J]. Journal of Plant Physiology, 2017, 219: 112-122. DOI:10.1016/j.jplph.2017.10.002.
[38]WANG G D, XU X P, WANG H, et al. A tomato transcription factor,SlDREB3 enhances the tolerance to chilling in transgenic tomato[J].Plant Physiology and Biochemistry, 2019, 142: 254-262. DOI:10.1016/j.plaphy.2019.07.017.
[39]洪阳, 田理刚, 邓丽莉, 等. 热水处理控制柠檬绿霉病及其抑菌机理初探[J]. 包装工程, 2020, 41(7): 16-24. DOI:10.19554/j.cnki.1001-3563.2020.07.003.
[40]YIN X R, ALLAN A C, XU Q, et al. Differential expression of kiwifruit ERF genes in response to postharvest abiotic stress[J].Postharvest Biology and Technology, 2012, 66: 1-7. DOI:10.1016/j.postharvbio.2011.11.009.
[41]KELVIN D G, PRITI R F, KAMLESH G P, et al. Plant polyphenol oxidase: biochemical properties and browning of fruits and vegetables[J]. Indian Journal of Agricultural Biochemistry, 2018,31(1): 1-8. DOI:10.5958/0974-4479.2018.00001.1.
[42]MOON K M, KWON E B, LEE B, et al. Recent trends in controlling the enzymatic browning of fruit and vegetable products[J]. Molecules,2020, 25(12): 2754. DOI:10.3390/molecules25122754.
[43]ESPLEY R V, LEIF D, PLUNKETT B, et al. Red to brown: an elevated anthocyanic response in apple drives ethylene to advance maturity and fruit flesh browning[J]. Frontiers in Plant Science, 2019,10: 1248. DOI:10.3389/fpls.2019.01248.
[44]谢君. ERF及NAC转录因子在莲藕采后褐变过程中的表达调控[D].武汉: 武汉轻工大学, 2018: 59-84.
[45]朱明. 一、果蔬贮藏保鲜特性(二)[J]. 中国农民合作社, 2018(11):68-69.
[46]WU Wei, WANG Miaomiao, GONG Hui, et al. High CO2/hypoxiainduced softening of persimmon fruit is modulated by DkERF8/16 and DkNAC9 complexes[J]. Journal of Experimental Botany, 2020, 71(9):2690-2700. DOI:10.1093/jxb/eraa009.
[47]马世龙, 崔明奎, 解辉, 等. 农药残留的危害及解决对策[J].农业技术与装备, 2018(9): 33-34; 36. DOI:10.3969/j.issn.1673-887X.2018.09.015.
[48]ZHAO Y L, CHANG X, QI D Y, et al. A novel soybean ERF transcription factor, GMERF113, increases resistance to Phytophthora sojae infection in soybean[J]. Frontiers in Plant Science, 2017, 8: 299.DOI:10.3389/fpls.2017.00299.
[49]TEZUKA D, KAWAMATA A, KATO H, et al. The rice ethylene response factor OsERF83 positively regulates disease resistance to Magnaporthe oryzae[J]. Plant Physiology and Biochemistry, 2019,135: 263-271. DOI:10.1016/j.plaphy.2018.12.017.
[50]李侨飞, 张红印, 杨其亚, 等. 防治水果病害的生防酵母及生防制剂研究进展[J]. 食品科学, 2018, 39(1): 291-296. DOI:10.7506/spkx1002-6630-201801044.
[51]WANG Jiahui, GU Kaidi, HAN Pengliang, et al. Apple ethylene response factor MdERF11 confers resistance to fungal pathogen Botryosphaeria dothidea[J]. Plant Science, 2020, 291: 110351.DOI:10.1016/j.plantsci.2019.110351.
[52]丁安然, 孙晓红, 侯鸿敏, 等. 苹果MdERF113基因克隆及响应轮纹病菌侵染的表达分析[J]. 青岛农业大学学报(自然科学版), 2018,35(3): 161-170. DOI:10.3969/J.ISSN.1674-148X.2018.03.03.001.
[53]王岚. 中国野生毛葡萄转录因子ERF调控抗病相关基因的研究[D].杨凌: 西北农林科技大学, 2019: 50-69.
[54]CHARFEDDINE M, SAMET M, CHARFEDDINE S, et al. Ectopic expression of StERF94 transcription factor in potato plants improved resistance to Fusarium solani infection[J]. Plant Molecular Biology Reporter, 2019, 37(5/6): 450-463. DOI:10.1007/s11105-019-01171-4.
[55]TIAN Z D, HE Q, WANG H X, et al. The potato ERF transcription factor StERF3 negatively regulates resistance to Phytophthora infestans and salt tolerance in potato[J]. Plant Cell Physiology, 2015,56(5): 992-1005. DOI:10.1093/pcp/pcv025.
[56]JIN J H, ZHANG H X, ALI M, et al. The CaAP2/ERF064 regulates dual functions in pepper: plant cell death and resistance to Phytophthora capsici[J]. Genes, 2019, 10(7): 541. DOI:10.3390/genes10070541.
[57]SHERIF S, EL-SHARKAWY I, PALIYATH G, et al. Differential expression of peach ERF transcriptional activators in response to signaling molecules and inoculation with Xanthomonas campestris pv. pruni[J]. Journal of Plant Physiology, 2012, 169(7): 731-739.DOI:10.1016/j.jplph.2012.02.003.
[58]ZHANG Y P, ZHANG L, MA H, et al. Overexpression of the apple(Malus × domestica) MdERF100 in Arabidopsis increases resistance to powdery mildew[J]. International Journal of Molecular Sciences,2021, 22(11): 5713. DOI:10.3390/ijms22115713.
[59]宋娜. 木薯MeERFs转录因子调控的抗病通路初步分析[D]. 海口:海南大学, 2020: 34-51.
[60]ZUO K J, QIN J, ZHAO J Y, et al. Over-expression GbERF2 transcription factor in tobacco enhances brown spots disease resistance by activating expression of downstream genes[J]. Gene, 2007, 391(1/2):80-90. DOI:10.1016/j.gene.2006.12.019.
[61]PRE M, ATALLAH M, CHAMPION A, et al. The AP2/ERF domain transcription factor ORA59 integrates jasmonic acid and ethylene signals in plant defense[J]. Plant Physiology, 2008, 147(3): 1347-1357.DOI:10.1104/pp.108.117523.
[62]AMORIM L L B, DOS SANTOS R D F, NETO J P B, et al.Transcription factors involved in plant resistance to pathogens[J].Current Protein & Peptide Science, 2017, 18(4): 335-351. DOI:10.2174/1389203717666160619185308.
[63]冯冬林. 辣椒防御反应相关基因的全长cDNA分离及CaERF14和CaDREB3功能分析[D]. 福州: 福建农林大学, 2012: 21-59.
[64]GUO H W, ECKER J R. The ethylene signaling pathway: new insights[J]. Current Opinion in Plant Biology, 2004, 7(1): 40-49.DOI:10.1016/j.pbi.2003.11.011.
[65]ZHU Ziguo, SHI Jiangli, XU Weirong, et al. Three ERF transcription factors from Chinese wild grapevine Vitis pseudoreticulata participate in different biotic and abiotic stress-responsive pathways[J].Journal of Plant Physiology, 2013, 170(10): 923-933. DOI:10.1016/j.jplph.2013.01.017.
[66]龚意辉, 石宁波, 庞学群, 等. 果皮蜡质与果实贮藏关系的研究进展[J]. 包装工程, 2020, 41(9): 23-28. DOI:10.19554/j.cnki.1001-3563.2020.09.004.
[67]WESSELS B, SEYFFERTH C, ESCAMEZ S, et al. An AP2/ERF transcription factor ERF139 coordinates xylem cell expansion and secondary cell wall deposition[J]. New Phytologist, 2019, 224(4):1585-1599. DOI:10.1111/nph.15960.
[68]ZENG Jiaoke, Li Xian, Xu Qian, et al. EjAP2-1, an AP2/ERF gene, is a novel regulator of fruit lignification induced by chilling injury, via interaction with EjMYB transcription factors[J]. Plant Biotechnology Journal, 2015, 13(9): 1325-1334. DOI:10.1111/pbi.12351.
[69]陈贵华, 王萍, 石岭. 细胞壁在植物抗病反应中的能动作用研究进展[J]. 内蒙古农业大学学报(自然科学版), 2021, 42(5): 117-120.DOI:10.16853/j.cnki.1009-3575.2021.05.019.
[70]YANG H H, SHEN F Y, WANG H X, et al. Functional analysis of the SlERF01 gene in disease resistance to S. lycopersici[J]. BMC Plant Biology, 2020, 20(1): 908-915. DOI:10.1186/s12870-020-02588-w.
[71]GUTTERSON N, REUBER T L. Regulation of disease resistance pathways by AP2/ERF transcription factors[J]. Current Opinion in Plant Biology, 2004, 7(4): 465-471. DOI:10.1016/j.pbi.2004.04.007.
[72]ZHANG X Y, WU F, GU N, et al. Postharvest biological control of Rhizopus rot and the mechanisms involved in induced disease resistance of peaches by Pichia membranefaciens[J]. Postharvest Biology and Technology, 2020, 163: 111146. DOI:10.1016/j.postharvbio.2020.111146.