乳液凝胶被定义为由乳液分散体和凝胶相结合形成的复杂胶体材料,可以由稳定的乳液填充到凝胶连续相中产生[1-2]。在食品体系中,组成乳液凝胶的基质主要分为3 类,即蛋白质、多糖以及蛋白质-多糖复合物。近年来以蛋白质-多糖复合物制备的乳液凝胶是一大研究热点。花生蛋白具有较高的蛋白质消化率校正氨基酸评分[3]以及较好的乳化性、起泡性和凝胶性等功能特性[4-5],是优良的凝胶基质来源。果胶作为一种高价值的功能性食品成分,具有出色的增稠性和稳定性[6-7]。对比单一凝胶基质制备的乳液凝胶,将具有较好乳化性的花生蛋白和较好增稠性和稳定性的果胶复配使用则会有更好效果。
研究表明蛋白-多糖的加入可显著增强乳液凝胶热稳定性,提高凝胶网络结构强度,并使乳液凝胶的硬度、弹性及持水性显著增加[8-9]。乳液凝胶的理化性质主要取决于凝胶基质与填充油相的种类和制备方式。同时,在食品配方中应用乳液凝胶可以生产低脂肪含量的食品,而胶凝剂和油的结合是实现这一目标的有效方法。Zhang Xin等[10]将超声波加入乳液凝胶的制备过程中,可以使凝胶结构更加致密,并显著提高乳液凝胶的储存稳定性。但研究主要集中在蛋白和多糖的浓度以及种类等对蛋白-多糖复合乳液凝胶特性的影响研究,对于填充油相对乳液凝胶特性影响的研究较少。目前,流变学和微观结构分析是研究乳液凝胶特性最广泛的方法,乳液凝胶的流变学特性分析有助于理解各食品组分的组织结构和相互作用[11-12],微观结构分析则可以从微观角度观察乳液凝胶的液滴形状、分布以及大小[13]。Zhang Bao等[14]将玉米蛋白/羧甲基糊精纳米颗粒稳定的Pickering乳液与κ-角叉菜胶基凝胶基质结合制备乳液凝胶,流变结果表明黏度和凝胶状结构取决于交联剂和乳液浓度,并从微观角度印证了这一结果。综上所述,本实验将花生蛋白和高酯果胶通过超声波复合并制备乳液凝胶,研究不同油相(橄榄油、花生油、24度棕榈油)及其添加量对乳液凝胶表观特性、质构、流变特性和微观结构的影响,阐明油相及其添加量对凝胶强度和机械特性的影响规律并探索乳液凝胶的形成机理。研究结果将为花生蛋白-果胶复合乳液凝胶在乳制品和烘焙食品等食品领域中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
低温脱脂花生粕(蛋白质45.9%) 青岛长寿公司;高酯果胶(high methoxyl pectin,HMP)(半乳糖醛酸(干基计)≥74%) 上海Macklin公司;鲁花花生油、欧丽薇兰橄榄油 市购;24度棕榈油(棕榈油经干法分提后得到熔点24 ℃的棕榈液油) 嘉里粮油(天津)有限公司;谷氨酰胺转氨酶(transglutaminase,TG)泰兴市东圣食品科技公司;尼罗红、异硫氰酸荧光素(fluorescein isothiocyanate,FITC) 美国Sigma公司;盐酸、氢氧化钠 国药集团化学试剂有限公司;实验所用试剂均为分析纯。
1.2 仪器与设备
SCIENTZ-IID型超声波破碎仪(配有DC-2030低温恒温槽) 宁波新芝生物科技股份有限公司;高速剪切分散乳化机 上海弗鲁克科技发展有限公司;90-3型恒温磁力搅拌器 广州艾卡仪器设备有限公司;TX-XT Plus型物性测试仪 美国SMS公司;Discovery HR 10混合型流变仪 美国TA公司;LGJ-25C型冷冻干燥机 北京四环科学仪器厂。
1.3 方法
1.3.1 花生蛋白制备
碱溶酸沉法制备花生分离蛋白(peanut protein isolate,PPI)。将一定量脱脂花生粕与磷酸盐缓冲液(0.02 mol/L,pH 8.5)按质量比1∶10混合。在60 ℃搅拌2 h,4 000 r/min离心20 min,取上清液。在上清液中逐滴加入1.0 mol/L的盐酸,调pH 4.5,边搅拌边调,此时有大量絮状沉淀出现。静置10~30 min后再次离心(4 000 r/min,20 min),收集沉淀。加蒸馏水复溶(比例1∶5)后用1 mol/L NaOH溶液调节pH值到7.0,在4 ℃透析48 h。冷冻干燥后存于4 ℃冰箱中备用。PPI的蛋白质质量分数为87.5%,采用凯氏定氮法测定(凯氏定氮系数5.46)。
1.3.2 蛋白-果胶复合物制备
PPI溶液在4 ℃下水合过夜(12 h)。将不同量的HMP加入制备的PPI溶液(100 mL、40 mg/mL)中,使PPI-HMP质量比分别为5∶2、5∶1、10∶1、20∶1和40∶1。通过加入HCl或NaOH溶液(0.1~2.0 mol/L)将PPI-HMP的pH值调整为pH 2.0、3.0、4.0、5.0、6.0、7.0和8.0。
取75 mL上述PPI-HMP溶液置入超声波破碎仪中超声处理。设置超声功率密度4.07 W/cm3;超声时间25 min;超声温度25 ℃,工作时间和间歇时间2 s,以循环水调节超声温度,获得超声处理花生分离蛋白-高酯果胶(peanut protein isolate-high methoxyl pectin,PPI-HMP)复合物,冷冻干燥备用。
1.3.3 乳液凝胶制备
称取一定量超声处理后的PPI-HMP复合物溶于去离子水中,室温搅拌2 h。配制15 g/100 mL的PPI-HMP悬浮液,作为水相;取橄榄油、花生油、24度棕榈液油作为乳液的油相,两者混合后经13 500 r/min高速剪切2 min制备乳液。乳液制备结束加入30 U/g的TG酶在40 ℃下水浴加热2 h后85 ℃加热30 min,取出后迅速冷却(用自来水流动冲洗),4 ℃放置过夜后充分形成凝胶,测定前自然恢复到室温。
1.3.4 质构测试
在对乳液凝胶样品进行质构分析时,设置参数为:使用P36探头,测前速率3 mm/s,测中速率1 mm/s,测后速率1 mm/s,压缩率30%,2 次压缩时间5 s,触发力1 g。每个样品测定5 次并取平均值。
1.3.5 流变特性分析
1.3.5.1 静态流变测试
参考韩鹏等[15]的方法并稍作修改。取制备好的花生分离蛋白-果胶乳液凝胶样品置于流变仪夹具上。平板夹具直径40 mm,固定间隙0.5 mm,频率1 Hz,应变1%。测试温度25 ℃,并恒温3 min,在剪切速率0.1~200 s-1范围内做黏度-剪切速率曲线。用幂律方程对乳液凝胶样品的流变曲线拟合,如下式所示:
式中:τ为剪切应力/Pa;K为黏度系数/(Pa·sn);γ为剪切速率/s-1;n为流动指数。
1.3.5.2 时间扫描测试
平板夹具直径40 mm,间隙1 mm,固定频率1 Hz,应变范围1%。将PPI-HMP乳液加入TG酶(30 U/g PPI)迅速混匀,取2 mL样品加到平板上,并在夹具边缘滴加一圈硅油。设置初始温度为45 ℃,保持2 h后以5 ℃/min升温到85 ℃,保温10 min,后以5 ℃/min降温至25 ℃,测定样品储能模量(G’)和损耗模量(G”)。
1.3.5.3 频率扫描测试
设置初始温度25 ℃,固定扫描应变值(线性黏弹区范围内,1%),振荡频率设定为0.1~10 Hz,平衡3 min,保留时间60 s,测定样品G’、G”随角频率的变化。
1.3.6 微观结构分析
使用激光共聚焦显微镜(confocal laser scanning microscope,CLSM)观察乳液凝胶的微观结构。研究利用FITC和尼罗红(溶于丙酮)分别对乳液凝胶的水相和油相染色,取1 mg乳液凝胶分别加入10 µL 0.01 g/100 mL FITC和0.10 g/100 mL尼罗红制片观察。采用氩离子激发光,波长分别为514 nm和488 nm,发射光波长分别为660 nm和519 nm。用Ar离子(488 nm)和He/Ne离子(633 nm)激发荧光,乳液凝胶中的油相呈现红色,而水相中的蛋白质在CLSM图像中显示绿色。使用双激光模式扫描样品。通过微观结构分析确定液滴在乳液凝胶中的分布。
1.4 数据处理
SPSS 21.0软件用于评估样本之间的差异。数据以 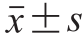 表示。使用Origin Pro 8.5软件绘制图表。
表示。使用Origin Pro 8.5软件绘制图表。
2 结果与分析
2.1 PPI-HMP复合乳液凝胶表观特征
考察PPI-HMP比例、pH值和油相对PPI-HMP复合乳液凝胶表观特征的影响,结果如图1所示。pH 4.0时,PPI-HMP比例在10∶1和5∶1时不能形成凝胶,而是一种乳白色的黏稠液体;在40∶1和20∶1时形成弱凝胶,颜色偏透明,触感柔软;而在5∶2时形成的乳液凝胶色泽均一,质地较硬(图1a)。因此为了保证形成的乳液凝胶有最佳质地,选定PPI-HMP比例5∶2,并考察pH 2.0~8.0的乳液凝胶形成情况。由图1b可知,在pH 6.0时形成的乳液凝胶质地最佳,而在pH 7.0和pH 8.0时油滴聚集析出不能形成稳定的乳液,难以形成乳液凝胶。这是因为在中性及碱性条件下,PPI和HMP带相反电荷,颗粒互斥难以稳定油滴。因此,选用蛋白-果胶比例5∶2,pH 6.0条件下制备乳液凝胶。
同时考察油相类型及添加量对PPI-HMP复合乳液凝胶表观特征的影响,结果如图2所示。以橄榄油和花生油为油相,添加量80%(V/V)时不能形成乳液凝胶;以24度棕榈油为油相,添加量大于70%(V/V)时即不能形成乳液凝胶。随着油相添加量增加,乳液凝胶表面越细腻光滑,质地越硬。这表明作为活性填充的液滴通过机械方式与蛋白-果胶组成的凝胶基质相互作用,从而能够影响乳液凝胶的质地和凝胶强度[16]。根据Dickinson[17]的理论,乳液凝胶的硬度高于同种蛋白凝胶,这是油滴对半固体的强增强作用的标志。
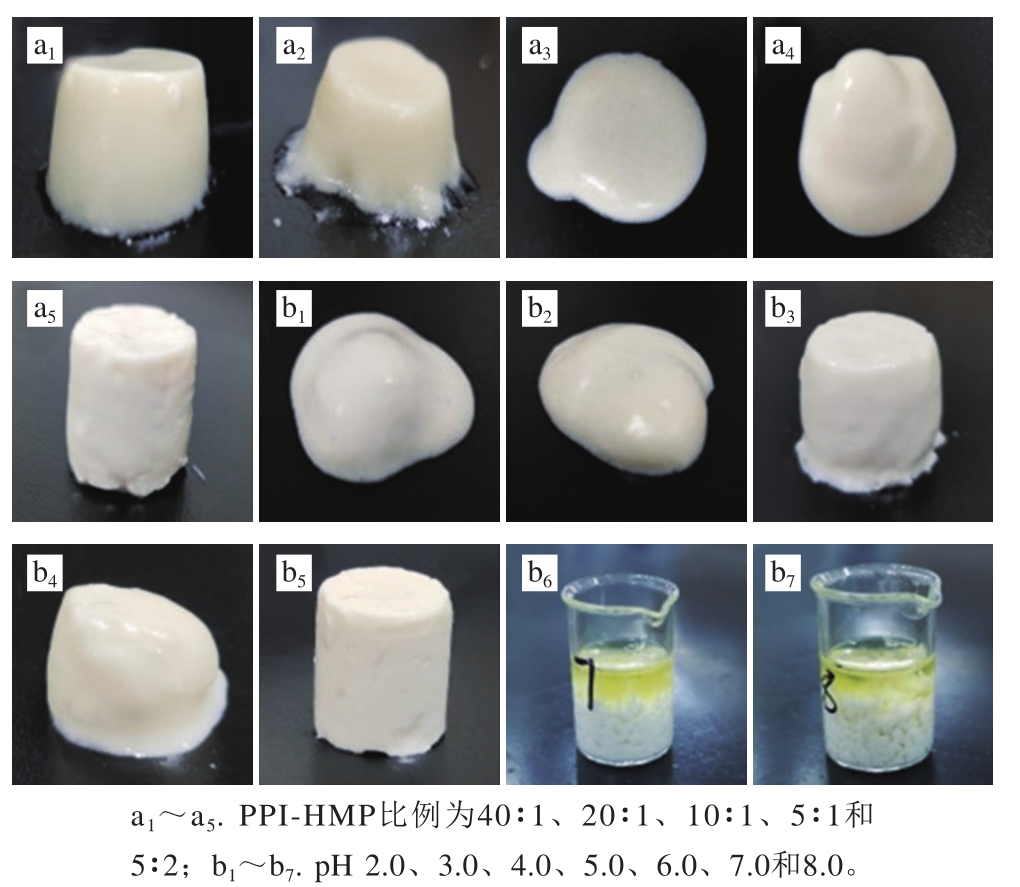
图1 PPI-HMP比(a)和pH值(b)对PPI-HMP复合乳液凝胶表观特征的影响
Fig. 1 Effects of PPI-to-HMP ratio (a) and pH (b) on the apparent characteristics of PPI-HMP composite emulsion gels

图2 油相及其添加量对PPI-HMP复合乳液凝胶外观的影响
Fig. 2 Effects of oil phase type and concentration on the appearance of PPI-HMP composite emulsion gels
2.2 油相及其添加量对PPI-HMP复合乳液凝胶质构的影响
表1 油相及其添加量对PPI-HMP复合乳液凝胶质构的影响
Table 1 Effects of oil phase type and concentration on the texture properties of PPI-HMP composite emulsion gels
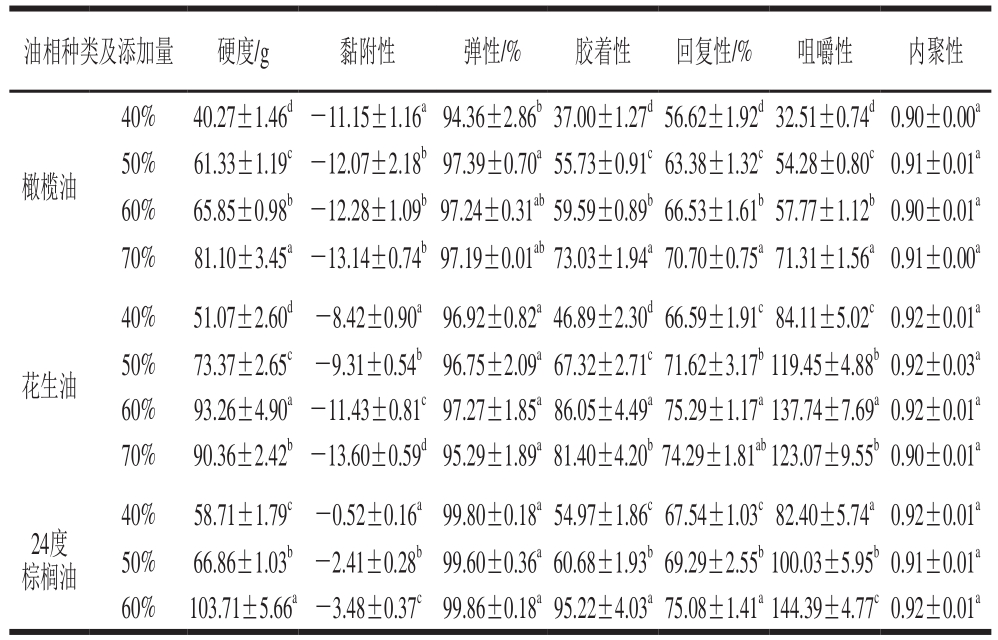
注:同行小写字母不同表示差异显著(P<0.05)。
油相种类及添加量 硬度/g 黏附性 弹性/% 胶着性 回复性/% 咀嚼性 内聚性橄榄油40% 40.27±1.46d -11.15±1.16a94.36±2.86b37.00±1.27d56.62±1.92d32.51±0.74d0.90±0.00a 50% 61.33±1.19c -12.07±2.18b97.39±0.70a55.73±0.91c63.38±1.32c54.28±0.80c0.91±0.01a 60% 65.85±0.98b -12.28±1.09b97.24±0.31ab59.59±0.89b66.53±1.61b57.77±1.12b0.90±0.01a 70% 81.10±3.45a -13.14±0.74b97.19±0.01ab73.03±1.94a70.70±0.75a71.31±1.56a0.91±0.00a花生油40% 51.07±2.60d -8.42±0.90a96.92±0.82a46.89±2.30d66.59±1.91c84.11±5.02c0.92±0.01a 50% 73.37±2.65c -9.31±0.54b96.75±2.09a67.32±2.71c71.62±3.17b119.45±4.88b0.92±0.03a 60% 93.26±4.90a -11.43±0.81c97.27±1.85a86.05±4.49a75.29±1.17a137.74±7.69a0.92±0.01a 70% 90.36±2.42b -13.60±0.59d95.29±1.89a81.40±4.20b74.29±1.81ab123.07±9.55b0.90±0.01a 24度棕榈油40% 58.71±1.79c -0.52±0.16a99.80±0.18a54.97±1.86c67.54±1.03c82.40±5.74a0.92±0.01a 50% 66.86±1.03b -2.41±0.28b99.60±0.36a60.68±1.93b69.29±2.55b100.03±5.95b0.91±0.01a 60% 103.71±5.66a -3.48±0.37c99.86±0.18a95.22±4.03a75.08±1.41a144.39±4.77c0.92±0.01a
如表1所示,不同油相种类的乳液凝胶均随着油相添加量增加,硬度、黏附性、胶着性、回复性和咀嚼性也随之增加,水凝胶因无法形成凝胶状外观,故未在表中体现。油相作为活性填充材料,以机械方式与蛋白-果胶组成的凝胶基质相互作用,影响乳液凝胶的凝胶强度,从而使乳液凝胶的硬度得到显著增加(P<0.05)。油相添加量的增加会增强乳液凝胶的凝胶网络强度,机械性能得到较大幅度提升。而油相添加量的变化未对乳液凝胶的弹性和内聚性产生显著影响(P<0.05)。研究表明乳液凝胶的弹性与果胶浓度有关[18-19]。在各个乳液凝胶样品中,以油相添加量60%的24度棕榈油制备的乳液凝胶硬度最高。表明乳液凝胶的硬度同时与油脂本身的硬度有关。
2.3 油相及其添加量对PPI-HMP复合乳液凝胶流变学特性的影响
2.3.1 表观黏度
如图3所示,当油相添加量从体积分数40%增加至70%时,体系的初始黏度逐渐增大,且添加花生油、橄榄油和24度棕榈油样品均表现出假塑性流体行为。由表2可知,随着油相添加量的增加,复配体系的黏度系数逐渐增加。各油相在最高添加量下制备的乳液凝胶样品分别对应最大的黏度系数K(代表体系的表观黏度)与最小的流体指数n。这表明在高油相制备的乳液凝胶中,油滴不仅作为“活性填充物”同时作为结构单元参与凝胶网络的形成,使凝胶网络机械性能增强,表观黏度增加[20-21]。
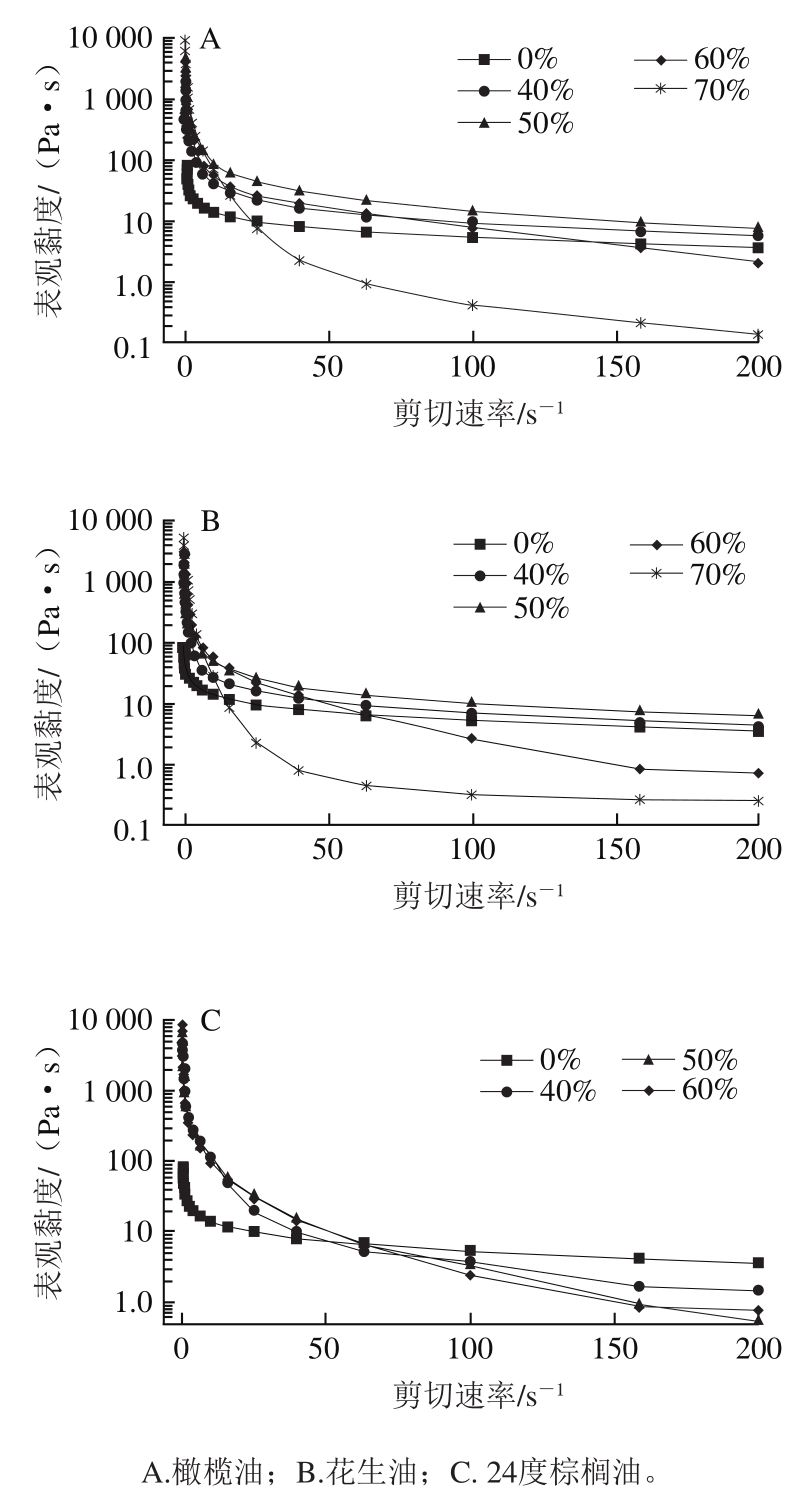
图3 PPI-HMP复合乳液凝胶表观黏度随剪切速率的变化
Fig. 3 Apparent viscosity of PPI-HMP composite emulsion gels as a function of shear rate
表2 PPI-HMP复合乳液凝胶的幂律方程
Table 2 Power law equations for PPI-HMP composite emulsion gels
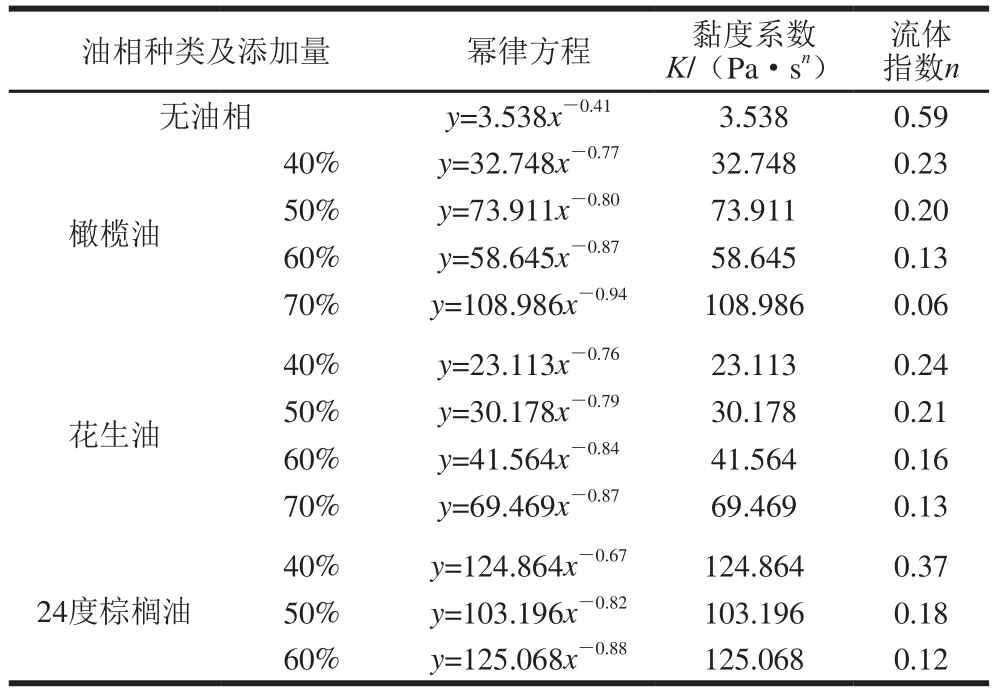
油相种类及添加量 幂律方程 黏度系数K/(Pa·sn)流体指数n无油相 y=3.538x-0.41 3.538 0.59橄榄油40% y=32.748x-0.77 32.748 0.23 50% y=73.911x-0.80 73.911 0.20 60% y=58.645x-0.87 58.645 0.13 70% y=108.986x-0.94 108.986 0.06花生油40% y=23.113x-0.76 23.113 0.24 50% y=30.178x-0.79 30.178 0.21 60% y=41.564x-0.84 41.564 0.16 70% y=69.469x-0.87 69.469 0.13 24度棕榈油40% y=124.864x-0.67 124.864 0.37 50% y=103.196x-0.82 103.196 0.18 60% y=125.068x-0.88 125.068 0.12
2.3.2 储能模量和损耗模量
如图4所示,加入TG酶后45 ℃保温1 h的过程中,所有样品G’值均随时间延长而缓慢增加,且所有样品(除PPI-HMP水凝胶外)G’值均高于G”值。水凝胶G’最先低于G”,随时间延长G’最终高于G”,并在76 min存在凝胶转换点。PPI在TG酶的作用下缓慢交联形成网络结构,并且加入油相后,乳液变得较为黏稠,流动性较差,G’值较高,从而在测试之初就表现了一定的刚性[22]。在温度从45 ℃升至85 ℃过程中,水凝胶和乳液凝胶的G’和G”均随时间延长而下降。可能是水凝胶和乳液凝胶均有较高黏度,而高黏度流体随温度升高黏度下降,进而引起G’和G”下降。温度升高至85 ℃并保温30 min时,水凝胶和乳液凝胶的G’和G”均有增加,尤其是水凝胶。这是因为PPI高温变性,并且在氢键及疏水相互作用的影响下进一步形成凝胶结构[15]。当温度从85 ℃降到25 ℃时,G’和G”均有上升趋势,并且保持在较高值。主要归因于熵效应和在降低温度时PPI氢键和分子间作用力的增强[23-24]。由图4B~D可知,随着油相添加量增加PPI-HMP复合乳液凝胶G’值增加。这表明油相添加量增加可以使乳液凝胶的结构刚性更强[25]。且在油相添加量60%时,不同油相下乳液凝胶的G’值分别为:24度棕榈油>橄榄油>花生油。同一条件下,与花生油和橄榄油相比,24度棕榈油制备的乳液凝胶刚性最强,凝胶强度最大。这与2.2节质构测试结果一致。
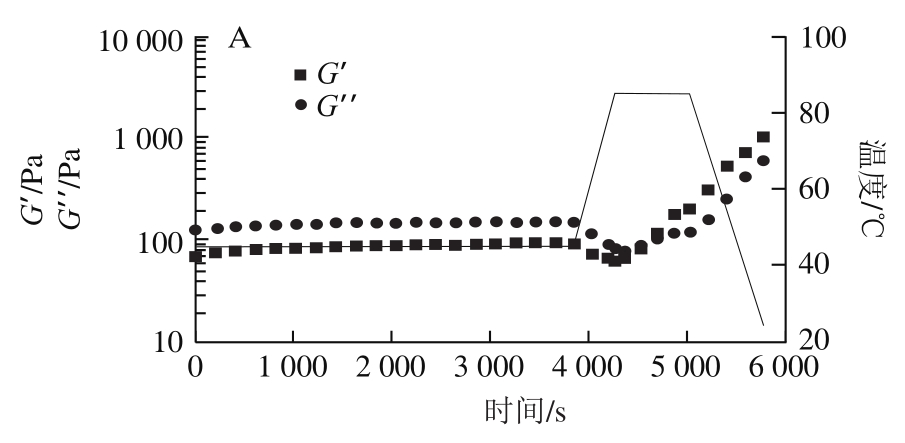
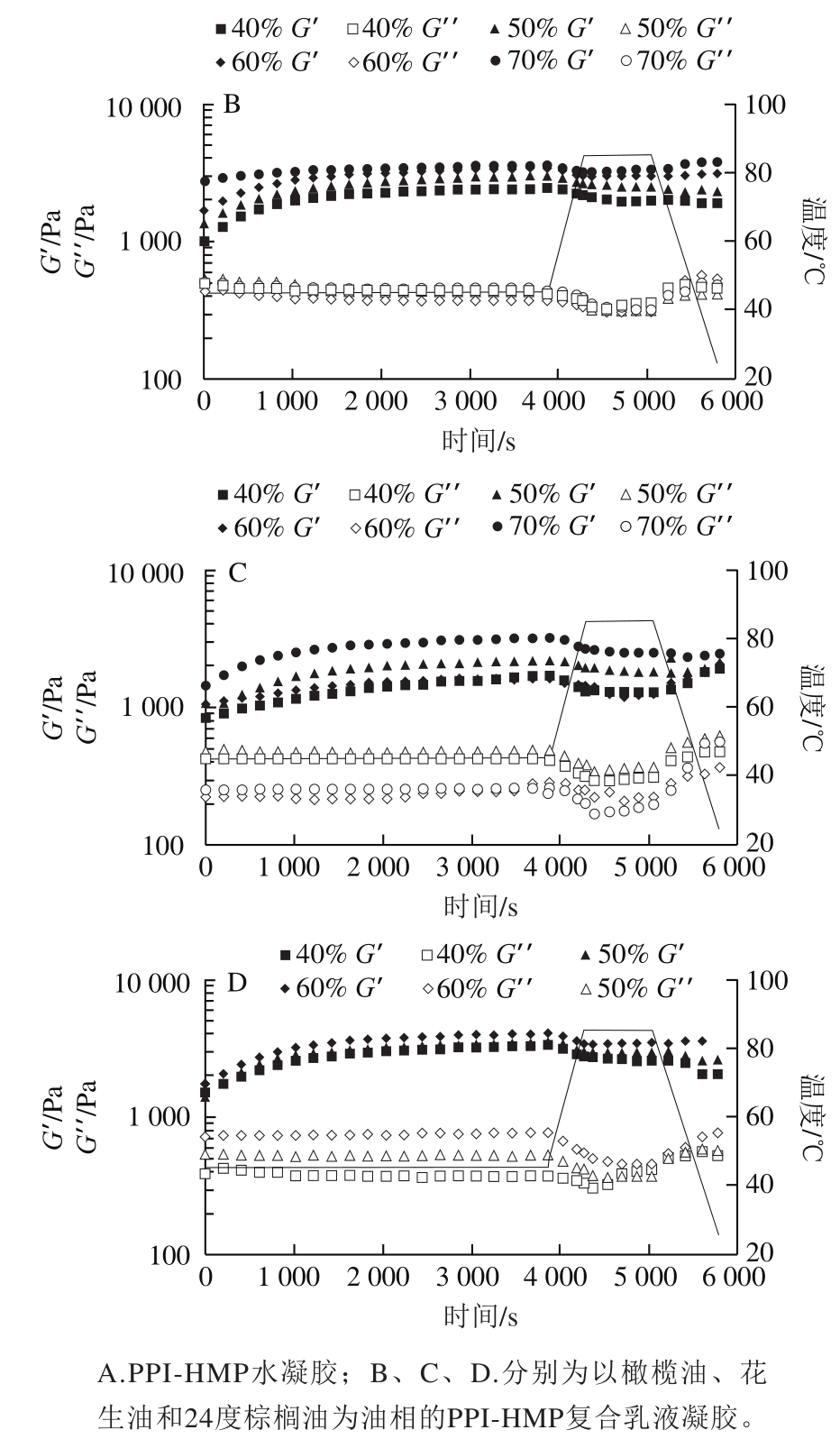
图4 PPI-HMP复合乳液凝胶G’和G”随时间的变化
Fig. 4 Storage modulus (G’) and loss modulus (G”) of PPI-HMP composite emulsions as a function of storage time
2.3.3 黏弹特性
如图5所示,各乳液凝胶样品的G’均大于G”,并且随着频率的增加而增加。PPI-HMP水凝胶在频率0.40 Hz后G”开始大于G’,由于在强凝胶中,模量与频率无关且不相交,而在弱凝胶中会出现频率依赖性[26-27]。含不同油相的乳液凝胶的G’和G”均大于水凝胶,且橄榄油为油相的乳液凝胶大于以花生油为油相的乳液凝胶。说明乳液凝胶的凝胶网络结构稳定性大于水凝胶,以橄榄油为油相的乳液凝胶网络结构的稳定性大于以花生油为油相的乳液凝胶。这可能与液滴表面吸附层和凝胶基质之间的化学亲和以及填料颗粒的机械性质有关[26]。随着油相添加量增加,各乳液凝胶的G’和G”随之增加,这表明油相添加量的增加可以使乳液凝胶的机械性能增强。Kim等[28]观察了由大豆分离蛋白和大豆油形成的热固乳液填充凝胶的小变形振荡剪切特性,并研究了不同体积分数的影响,得出油含量越高,G’值越高的结论,说明分散的油滴作为活性填料可与凝胶基质相互作用。
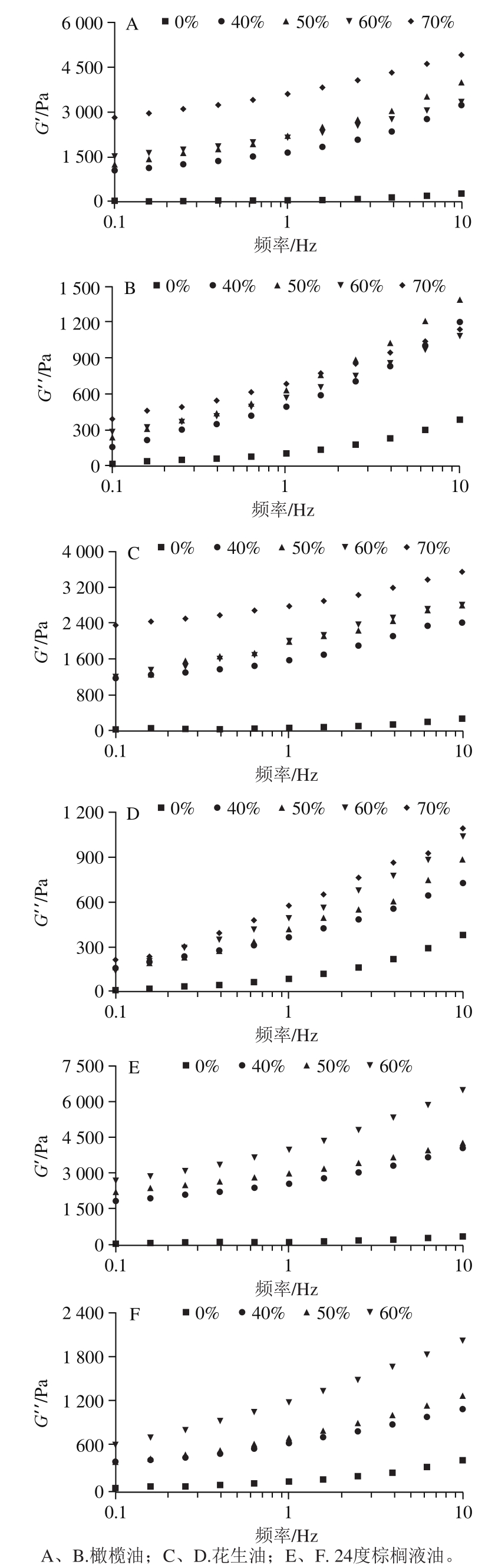
图5 PPI-HMP复合乳液凝胶G’和G”随频率的变化
Fig. 5 Storage modulus (G’) and loss modulus (G”) of PPI-HMP composite emulsion gels as a function of angular frequency
2.4 油相及其添加量对PPI-HMP复合乳液凝胶微观结构的影响
如图6所示,本研究中的乳液凝胶由液滴包裹在凝胶基质中形成。图6A显示PPI-HMP悬浮液已经出现了类似的凝胶网状结构。TG酶加入催化蛋白质间(或内)发生酰基转移反应,使蛋白发生共价交联[1]。低油相下乳液凝胶网络结构的形成主要通过未吸附到油滴表面的蛋白质之间的交联作用而形成[17]。随着油相添加量增加,液滴逐渐由密集的类球状液滴转变成了不规则的结构。这表明随着油相添加量增加,大部分的液滴开始相互聚集,大小和分布变得不均匀。这是因为随着油相比例的增加,油滴之间的疏水作用导致油滴合并,使蛋白吸附量逐渐下降,且高油相乳液体系的黏度过高,不利于蛋白与酶作用。因此高油相下乳液凝胶网络结构的形成是油滴表面包裹的PPI-HMP复合界面膜之间发生酶的共价交联作用和高黏度作用共同影响的结果[17,29]。对于活性填充的液滴而言,液滴的尺寸和表面性质决定了液滴的变形能力,从而决定了液滴对凝胶基质[30-31]的影响。在油相添加量60%时,24度棕榈油制备的乳液凝胶网络结构更加致密,且油滴聚集程度相对较弱。表明此时以24度棕榈油为油相的乳液凝胶的网络结构刚性更强。不同的油相组成可通过影响油滴大小与分布,使乳液凝胶的G’和硬度改变,最终影响乳液凝胶的结构[1]。这和质构测试和流变测试的研究结果相符。
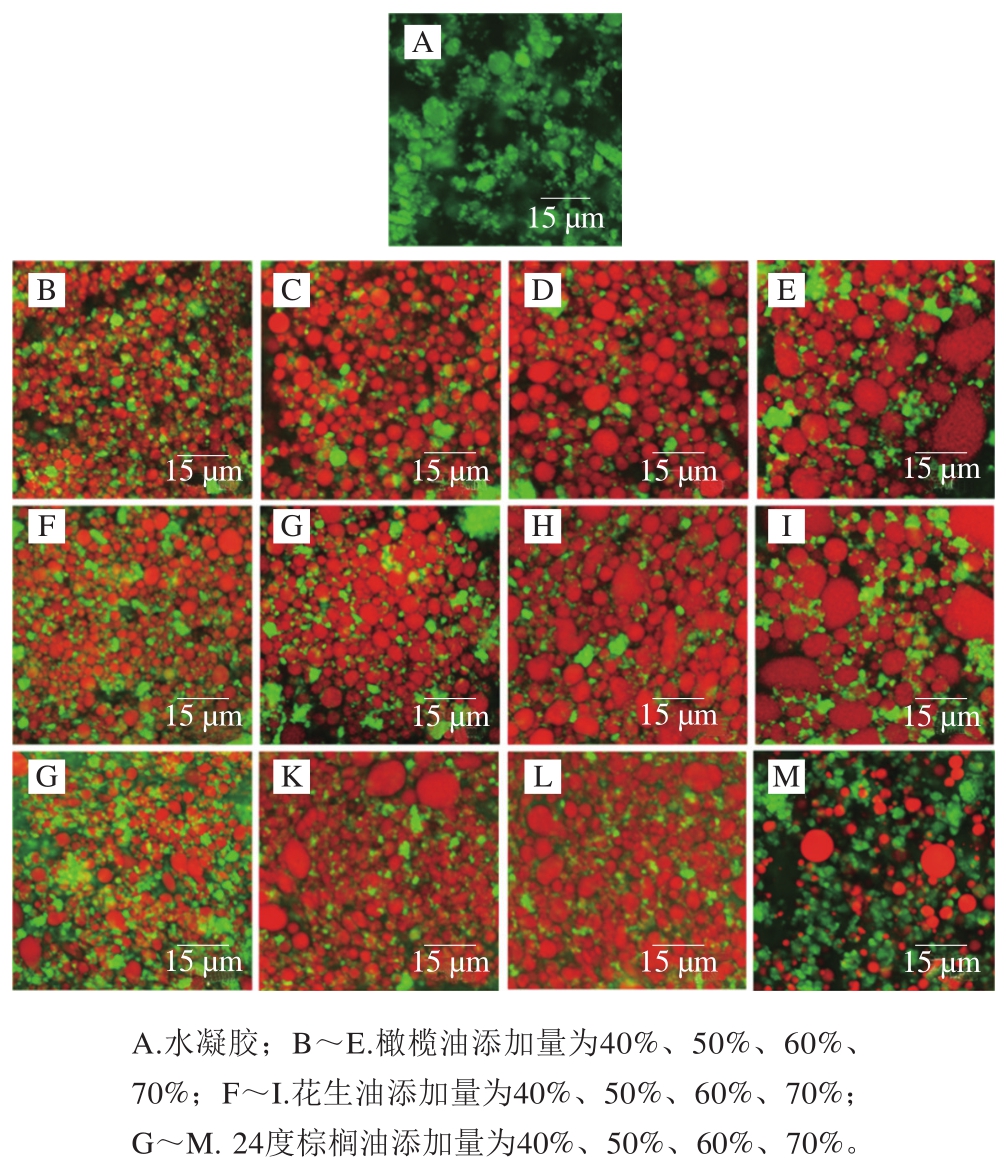
图6 油相及其添加量对PPI-HMP复合乳液凝胶微观结构的影响
Fig. 6 Effects of oil phase type and concentration on the microstructure of PPI-HMP composite emulsion gels
3 结 论
通过研究不同油相及其添加量对PPI-HMP复合乳液凝胶表观特性、质构、流变性能和微观结构的影响。结果显示,在蛋白-果胶比例5∶2、pH 6.0时形成的乳液凝胶色泽均一,质地较硬;在中性及偏碱性条件下不能制成稳定乳液凝胶。随着油相添加量增加,乳液凝胶表面更细腻光滑,其硬度、黏附性、胶着性、回复性和咀嚼性均增加;24度棕榈油添加量在60%(V/V)时,乳液凝胶具有最高的硬度、胶着性、回复性和咀嚼性值。流变学结果表明,不同油相乳液凝胶的G’和G”均显著高于水凝胶,且乳液凝胶的G’值和表观黏度值随着油相添加量增加而升高;相同油相添加量下,乳液凝胶对应的表观黏度和G’值分别为:24度棕榈油>橄榄油>花生油。PPI-HMP复合乳液凝胶微观结构结果显示,随着油相添加量增加,液滴开始聚集且不均匀分布;在油相添加量60%(V/V)时,24度棕榈油填充的乳液凝胶稳定油滴能力最好,网络结构最致密。研究结果表明油滴作为活性填充物与花生蛋白-果胶组成的凝胶基质相互作用,油相添加量的增加有助于凝胶网络形成,使凝胶网络机械性能增强,表观黏度增加,凝胶结构刚性更强。本研究结果为PPI-HMP复合乳液凝胶在乳制品和烘焙食品等领域的开发利用提供了思路。
[1]崔梦楠, 鹿瑶, 高彦祥, 等. 食品乳液凝胶的制备及其应用研究进展[J].食品科学, 2019, 40(3): 323-329. DOI:10.7506/spkx1002-6630-20171222-282.
[2]OLIVER L, SCHOLTEN E, VAN AKEN G A. Effect of fat hardness on large deformation rheology of emulsion-filled gels[J]. Food Hydrocolloids, 2015, 43: 299-310. DOI:10.1016/j.foodhyd.2014.05.031.
[3]ARYA S S, SALVE A R, CHAUHAN S. Peanuts as functional food: a review[J]. Journal of Food Science and Technology, 2016, 53(1): 31-41. DOI:10.1007/s13197-015-2007-9.
[4]BASSE B, BOSC V, SAITER J M, et al. Combined effects of ionic strength and enzymatic pre-treatment in thermal gelation of peanut proteins extracts[J]. Food Research International, 2020, 137: 109362.DOI:10.1016/j.foodres.2020.109362.
[5]汪少芸, 冯雅梅, 伍久林, 等. 蛋白质-多糖多尺度复合物结构的形成机制及其应用前景[J]. 食品科学, 2021, 42(17): 1-9. DOI:CNKI:SUN:SPKX.0.2021-17-001.
[6]KHAMSUCHARIT P, LAOHAPHATANALERT K,GAVINLERTVATANA P, et al. Characterization of pectin extracted from banana peels of different varieties[J]. Food Science & Biotechnology,2018, 27(3): 623-629. DOI:10.1007/s10068-017-0302-0.
[7]周士琪. 海带多糖复乳凝胶脂肪替代物的制备及其在低脂鸡肉肠中的应用[D]. 上海: 华东理工大学, 2020. DOI:10.27148/d.cnki.ghagu.2020.000427.
[8]朱秀清, 王婵, 孙禹凡, 等. 多糖对大豆分离蛋白乳液及乳液凝胶性质的影响[J]. 东北农业大学学报, 2020, 51(2): 45-52. DOI:10.19720/j.cnki.issn.1005-9369.2020.02.0006.
[9]BI C H, CHI S Y, WANG X Y, et al. Effect of flax gum on the functional properties of soy protein isolate emulsion gel[J]. LWTFood Science and Technology, 2021, 149: 111846. DOI:10.1016/j.lwt.2021.111846.
[10]ZHANG X, CHEN X, GONG Y, et al. Emulsion gels stabilized by soybean protein isolate and pectin: effects of high intensity ultrasound on the gel properties, stability and β-carotene digestive characteristics[J]. Ultrasonics Sonochemistry, 2021, 79: 105756.DOI:10.1016/j.ultsonch.2021.105756.
[11]LORENZO G, ZARITZKY N, CALIFANO A. Rheological analysis of emulsion-filled gels based on high acyl gellan gum[J].Food Hydrocolloids, 2013, 30(2): 672-680. DOI:10.1016/j.foodhyd.2012.08.014.
[12]PEREIRA R, MATIA-MERINO L, JONES V, et al. Influence of fat on the perceived texture of set acid milk gels: a sensory perspective[J].Food Hydrocolloids, 2005, 20(2): 305-313. DOI:10.1016/j.foodhyd.2005.01.009.
[13]李红娟, 刘婷婷, 邹璇, 等. 乳清蛋白-黄油乳液凝胶对低脂酸奶理化特性及品质的影响[J]. 食品与发酵工业, 2021, 47(7): 71-77.DOI:10.13995/j.cnki.11-1802/ts.025857.
[14]ZHANG B, MENG R, LI X L, et al. Preparation of Pickering emulsion gels based on κ-carrageenan and covalent crosslinking with EDC: gelation mechanism and bioaccessibility of curcumin[J]. Food Chemistry, 2021, 357: 129726. DOI:10.1016/j.foodchem.2021.129726.
[15]韩鹏, 王林波, 李苗, 等. 聚乙二醇400黏度测定方法的研究[J].中国药事, 2012, 26(12): 1360-1362. DOI:10.16153/j.1002-7777.2012.12.032.
[16]SALA G, VAN AKEN G A, STUART M A C, et al. Effect of dropletmatrix interactions on large deformation properties of emulsion-filled gels[J]. Journal of Texture Studies, 2007, 38(4): 511-535. DOI:10.1111/j.1745-4603.2007.00110.x.
[17]DICKINSON E. Emulsion gels: the structuring of soft solids with protein-stabilized oil droplets[J]. Food Hydrocolloids, 2012, 28(1):224-241. DOI:10.1016/j.foodhyd.2011.12.017.
[18]LUO N, YE A Q, WOLBER F M, et al. Structure of whey protein emulsion gels containing capsaicinoids: impact on in-mouth breakdown behaviour and sensory perception[J]. Food Hydrocolloids,2019, 92: 19-29. DOI:10.1016/j.foodhyd.2019.01.019.
[19]张鹏龙, 陈复生, 殷丽君, 等. WBAXs-SPI复合乳液填充凝胶的制备及其性能的研究[J]. 食品科技, 2019, 44(2): 252-258. DOI:10.13684/j.cnki.spkj.2019.02.043.
[20]汤洋, 高成成, 张岩, 等. 多糖基颗粒稳定的Pickering乳液凝胶研究进展[J]. 食品科学, 2022, 43(3): 11-13. DOI:10.7506/spkx1002-6630-20201030-316.
[21]YE A Q, TAYLOR S. Characterization of cold-set gels produced from heated emulsions stabilized by whey protein[J]. International Dairy Journal, 2009, 19(12): 721-727. DOI:10.1016/j.idairyj.2009.06.003.
[22]JIANG Y, ZHANG C, YUAN J H, et al. Exploiting the robust network structure of zein/low-acyl gellan gum nanocomplexes to create Pickering emulsion gels with favorable properties[J]. Food Chemistry,2021, 349: 129112. DOI:10.1016/j.foodchem.2021.129112.
[23]CUADRI A A, BENGOECHEA C, ROMERO A, et al. A naturalbased polymeric hydrogel based on functionalized soy protein[J].European Polymer Journal, 2016, 85: 164-174. DOI:10.1016/j.eurpolymj.2016.10.026.
[24]NGUYEN B T, NICOLAI T, BENYAHIA L, et al. The effect of the competition for calcium ions between kappa-carrageenan and betalactoglobulin on the rheology and the structure in mixed gels[J]. Food Hydrocolloids, 2015, 475: 9-18. DOI:10.1016/j.colsurfa.2014.09.008.
[25]LIU C H, ZHENG Z J, SHI Y F, et al. Development of lowoil emulsion gel by solidifying oil droplets: roles of internal beeswax concentration[J]. Food Chemistry, 2021, 345(11): 128811.DOI:10.1016/j.foodchem.2020.128811.
[26]LIANG X P, MA C C, YAN X J, et al. Structure, rheology and functionality of whey protein emulsion gels: effects of double crosslinking with transglutaminase and calcium[J]. Food Hydrocolloids,2019, 102: 105569. DOI:10.1016/j.foodhyd.2019.105569.
[27]GEREMIAS-ANDRADE I M, SOUKI N P B G, MORAES I C F, et al.Rheology of emulsion-filled gels applied to the development of food materials[J]. Gels (Basel, Switzerland), 2016, 2(3): 22. DOI:10.3390/gels2030022.
[28]KIM K H, RENKEMA J M S, VAN VLIET T. Rheological properties of soybean protein isolate gels containing emulsion droplets[J].Food Hydrocolloids, 2001, 15(3): 295-302. DOI:10.1016/S0268-005X(01)00028-5.
[29]张蒙琪. 鸡蛋蛋白与大豆分离蛋白间相互作用及其凝胶特性的研究[D]. 无锡: 江南大学, 2021. DOI:10.27169/d.cnki.gwqgu.2021.000056.
[30]OLIVER L, WIECK L, SCHOLTEN E. Influence of matrix inhomogeneity on the rheological properties of emulsion-filled gels[J]. Food Hydrocolloids, 2016, 52, 116-125. DOI:10.1016/j.foodhyd.2015.06.003.
[31]XU Q Q, QI B K, HAN L, et al. Study on the gel properties,interactions, and pH stability of pea protein isolate emulsion gels as influenced by inulin[J]. LWT-Food Science and Technology, 2021,137: 110421. DOI:10.1016/J.LWT.2020.110421.