人体肠道是一个大型、复杂的生态系统,肠道菌群的数量、比例、功能等常受到外在因素的影响,如饮食、生活方式等[1],菌群失调可能引起机体天然免疫系统受损、肠内稳态失衡,有诱发肠道炎症、动脉粥样硬化[2]或胰岛素抵抗[3]的风险,导致2型糖尿病、高血糖等病症的发生。小肠是人体消化吸收的重要场所,主要通过酶类物质作用糖类、胆固醇、蛋白质等营养物质,小肠微生物数量远低于大肠,然而有研究表明,小肠菌群的失调在各类疾病的发生发展中有着独特的作用机制:1)小肠菌群失调可能导致小肠绒毛排列不规则并发生不同程度的断裂,使黏膜通透性增加,屏障功能下降;2)小肠上皮细胞中大量表达钠-钾-ATP酶,该酶在菌群失调时含量下降,导致细胞渗透压改变,细胞结构受到破坏,这两种机制可能协同破坏小肠对糖类、蛋白质、脂肪等物质的吸收作用,引发糖尿病等疾病的发生[4]。因此通过改善饮食等途径增加小肠内益生菌数量、控制有害菌繁殖可作为维持小肠稳态、调节体内代谢、预防疾病的重要举措。
抗性淀粉(resistant starch,RS)可作为底物被结肠微生物发酵并利用,因此具有促进益生菌生长及增强其活性的益生元作用,且能够与其他益生元如膳食纤维相互作用发挥其益生元效应[5]。近年来,已有许多研究报道了RS的功能特性,如张亚楠等[6]研究发现,RS不仅可以增加大鼠体内的Bifidobacterium、Ruminococcaceae_UCG_014等益生菌相对丰度,还有利于预防肥胖。莲子补脾益肾,对控制2型糖尿病人血糖和胰岛素水平有显著影响[7],且莲子中直链淀粉含量高达42%,是提供RS的良好来源[8]。经过压热、微波等处理后的莲子抗性淀粉(lotus seed resistant starch,LRS)表面具有特殊的沟壑状结构,能提高益生菌在不良肠道环境的适应性,使其更好地利用碳源,促进自身增殖[9],并能通过参与胰岛素分泌、调节抗氧化活性等各种关键因素的表达水平发挥预防炎症等益生作用[10]。Qin Renbing等[11]研究发现,III型RS有利于肠道菌群发酵产生乳酸。乳酸盐是RS经肠道菌群发酵后产生的一种后生元,其益生机制主要是调节宿主菌群、改善肠上皮屏障功能、调节全身代谢反应等[12-13]。目前对LRS和乳酸钠(sodium lactate,SL)的生理功能已进行了一定研究,但对于LRS和SL的协同作用尚鲜有报道,为研究两者是否存在协同益生作用,本实验以LRS和SL为饮食干预,研究大鼠小肠菌群、代谢谱的影响,旨在探讨LRS及SL影响小肠菌群及代谢的潜在机制,从饮食干预角度为调节人体代谢、预防糖尿病等疾病提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性SD大鼠购自上海斯莱克实验动物有限责任公司,实验动物使用许可证编号:SYXK(闽)2016-0005。动物实验在福建省福建中医药大学实验室进行,实验经福建省中医科学院动物伦理委员会批准,批准编号为FJATCM-IAEC2021002。
大鼠饲料 北京华阜康生物科技股份有限公司;新鲜莲子 福建绿地有限公司;SL(纯度≥98%)上海阿拉丁生化科技有限公司;生理盐水 江西科伦药业有限公司;无水乙醇 上海国药集团化学试剂有限公司;异丙醇 美国Merck公司;苯丙氨酸 上海阿达玛斯试剂有限公司;AxyPrepDNA凝胶回收试剂盒美国AXYGEN公司。
1.2 仪器与设备
Centrifuge 5430R型高速冷冻离心机 德国Eppendorf公司;QuantiFluor-ST微型荧光计 美国Promega公司;Vanquish Horizon system超高效液相色谱系统串联Q-Exactive HF-X复合四极杆-轨道阱质谱仪美国Thermo Fisher Scientific公司;HSS T3色谱柱(100 mm×2.1 mm,1.8 μm) 美国Waters公司;JXDC-20型氮气吹扫仪 上海净信实业发展有限公司。
1.3 方法
1.3.1 LRS制备和动物分组
LRS参考文献[14]制备。24 只体质量(70±5)g SPF级雄性SD大鼠饲养在标准的聚丙烯笼中,动物房温度(22±2)℃、相对湿度(55±5)%、12 h昼夜循环。将大鼠随机分为4 组:正常对照(normal control,NC)组、LRS、SL组以及LRS+SL组。依照文献[15]的方法进行灌胃,NC组灌胃2.0 mL/100 g mb的生理盐水;LRS组灌胃0.25 g/100 g mb的III型LRS,SL组灌胃0.018 g/100 g mb SL;LRS+SL组大鼠每100 g体质量灌胃0.25 g的LRS和0.018 g的SL,各组自由摄食饮水干预4 周,每周记录体质量。对大鼠按剂量40 mg/kg mb进行腹腔注射戊巴比妥钠,麻醉处死后切开腹腔,取3~5 cm回肠肠段,将内容物挤入15 mL无菌离心管中。将含有大鼠小肠内容物的离心管置于液氮中,全部处理结束后转移置于-80 ℃冰箱中冻存。
1.3.2 高通量测序
委托上海美吉生物医药科技有限公司完成高通量测序,流程如图1所示。采用DNA提取试剂盒并按照操作说明对大鼠小肠内容物中的总DNA进行提取,并用1%(质量分数)琼脂糖凝胶电泳检测,按指定测序区域(16S V3~V4区)合成带有barcode的特异引物。随后取特异引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,随机选取具有代表性的样本进行预实验,确保在最低循环数中使绝大多数样本能够扩增出浓度合适的产物。混合同一样本的PCR产物并用2%(质量分数)琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,用Tris-HCl洗脱,再用2%(质量分数)琼脂糖电泳初步定量。将PCR产物用QuantiFluor™-ST蓝色荧光定量系统定量,之后按照每个样本的测序量要求,进行相应比例的混合。最后进行Miseq文库构建和Miseq测序并计算Shannon指数和Chao指数。
图1 测序实验流程
Fig. 1 Flow chart of gene sequencing
1.3.3 超高效液相色谱串联复合四极杆-轨道阱质谱分析
参照文献[15]的方法,取1.3.1节中所得样品50 mg,置于2 mL离心管中,加入400 μL含0.02 mg/mL L-2-氯苯丙氨酸(内标)溶液(溶剂为甲醇-水(体积比4∶1)溶液)。然后-10 ℃下用冷冻组织研磨机50 Hz研磨6 min,接着低温超声(5 ℃、40 kHz)30 min。样品于-20 ℃条件下放置30 min后,4 ℃、13 000×g离心15 min,收集上清液备用,并经0.22 μm滤膜过滤。采用Vanquish Horizon system超高效液相色谱系统串联Q-Exactive HF-X复合四极杆-轨道阱质谱仪进行分析。色谱条件:HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相A为95%水+5%乙腈(含体积分数0.1%甲酸),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含体积分数0.1%甲酸);进样量2 μL;柱温40 ℃。质谱条件:样品经电喷雾电离,分别采用正、负离子扫描模式采集质谱信号。每个样品取20 μL上清液,混匀后作为质控(quality control,QC)样本。在分析的过程中,每检测5~15 个分析样本后测定1 个QC样本,以考察整个检测过程的稳定性。代谢组学分析得到各化合物的保留时间、质荷比和峰强度的数据矩阵,同时将质谱和串联质谱信息与人类代谢组数据库(human metabolome database,HMDB)METLIN数据库以及美吉自建数据库进行比对分析。
1.4 数据统计与分析
实验设置3 个平行,结果用平均值±标准差表示。采用SPSS 20.0软件进行单因素方差分析,采用Tukey-Kramer检验进行显著性分析,P<0.05表示差异显著。采用OriginPro 8.5软件和GraphPad Prism 8.0软件作图。物种组间重叠数据采用fastp、FLASH软件进行主坐标分析(principal co-ordinates analysis,PCoA)。采用R-3.3.1(stat)软件分析组间物种差异并绘制Venn图,通过假设检验评估差异的显著性水平。采用python-2.7软件进行菌群群落分析、群落Circos分析并作图;采用python-2.7软件、R-3.3.1(stat)软件进行菌群聚类分析。代谢谱差异数据采用ropls(R packages)软件进行正交偏最小方差判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。差异代谢物差异倍数(fold change,FC)和变量投影重要性值(variable projection importance value,VIP)采用ropls(R packages)、scipy(Python)软件计算。采用ropls(R packages)软件计算某一代谢物在两组间的FC。筛选VIP>1,P<0.05、FC<1或FC>1的差异代谢物与京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行比对分析,功能通路数据采用scipy(Python)软件进行拓扑学分析。采用scipy(Python)软件对菌群多样性与代谢谱进行皮尔森相关性分析。
2 结果与分析
2.1 LRS、SL干预对大鼠肠道菌群多样性的影响
为描述肠道菌群多样性和丰富度,分别计算Shannon指数和Chao指数,结果表明,相较于NC组,LRS组(P<0.05)、SL组(P<0.01)、LRS+SL组(P<0.05)物种丰富度均有显著提高,且LRS组多样性降低(P<0.05),这与林珊[16]的研究结果一致,SL组无显著变化(P>0.05),LRS+SL组物种多样性显著增加(P<0.05)(图2A、B),且LRS+SL组相比LRS组(P<0.001)及SL组(P<0.05)物种多样性均显著增加,说明LRS和SL协同有利于增加大鼠小肠菌群的多样性。各组样本的PCoA分析如图2C所示,该差异检验结果为0.021,样本间差异显著。NC组与LRS组和SL组间重叠少,与LRS+SL组重叠较多,差异性小。如图2D所示,4 组中共有的物种数为118 个,NC组有20 个特有物种,LRS组有33 个特有物种,SL组有64 个特有物种,LRS+SL组有145 个特有物种。结果表明,当添加LRS和SL时特有物种数均有增加,而在LRS与SL协同作用时增加效果最为显著。
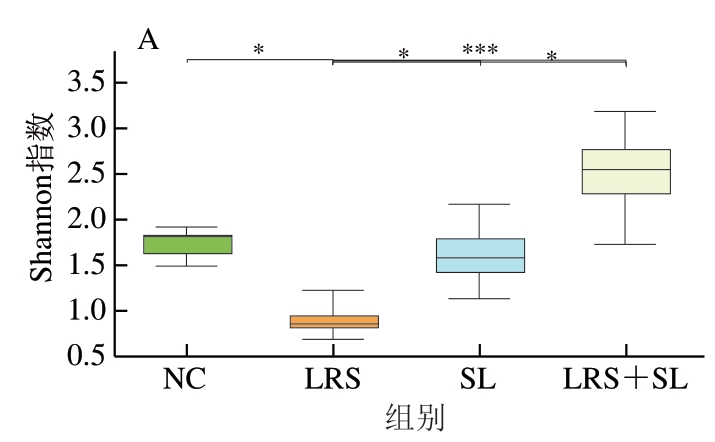
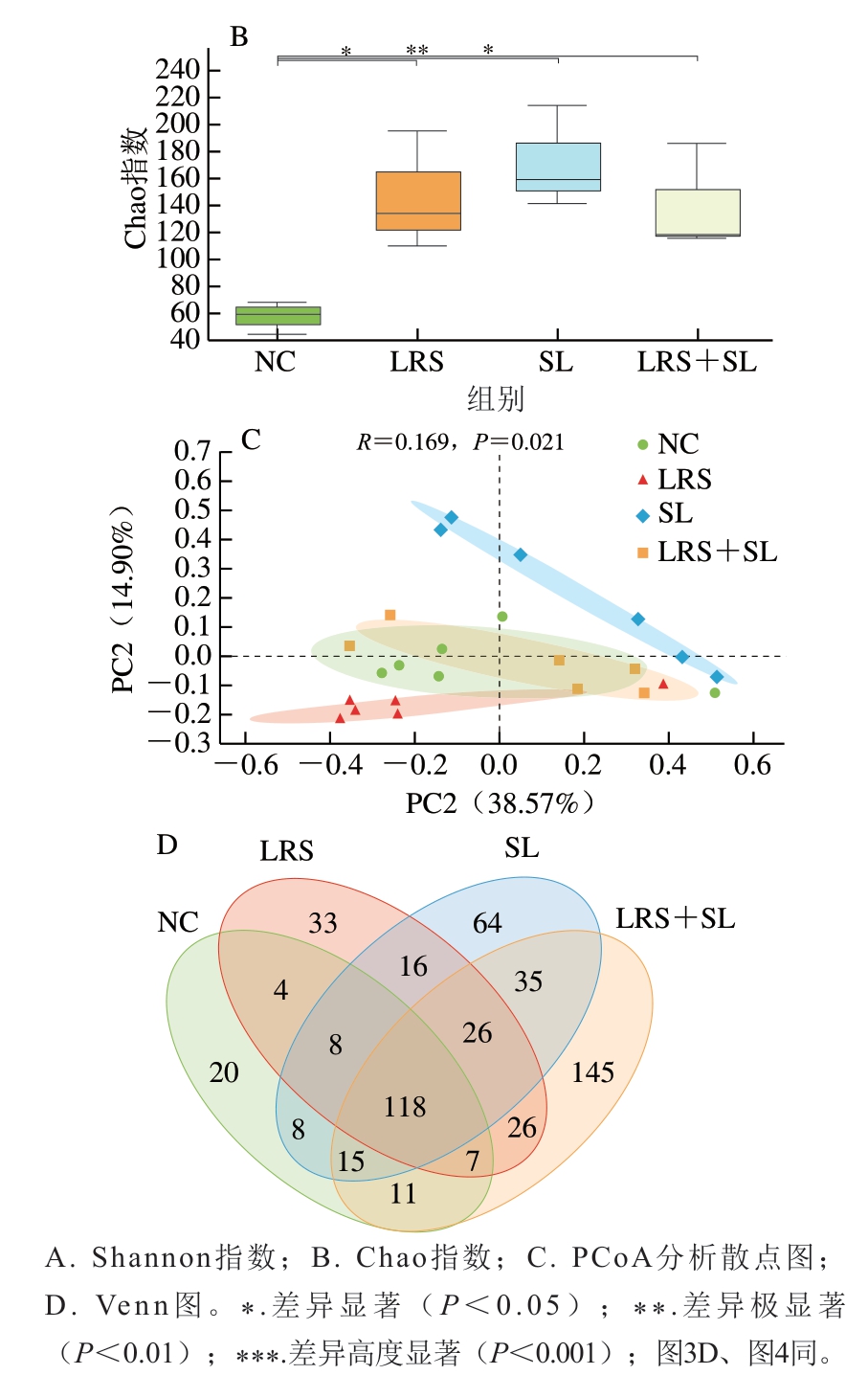
图2 LRS、SL干预对大鼠肠道菌群多样性的影响(n=6)
Fig. 2 Effects of LRS and SL intervention on intestinal flora diversity in rats (n = 6)
2.2 LRS、SL干预对大鼠肠道菌落组成及组间差异的影响
在不同分类学水平上对物种组成进行分析,如图3A所示,从门水平来看,厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)和变形菌门(Proteobacteria)是各组中的优势菌群,相比NC组,LRS组Firmicutes相对丰度增加,Actinobacteriota相对丰度减小;SL组Firmicutes相对丰度减小;LRS+SL组拟杆菌门(Bacteroidota)相对丰度增加。其中,Firmicutes代谢产物丁酸盐具有抗炎、改善胰岛素抵抗的作用,其相对丰度增加有利于预防肥胖和2型糖尿病的发生发展[17],Firmicutes利用或分解乳酸的能力较弱,在SL组中相对丰度下降,这与Policastro等[18]研究结果一致。科水平以乳酸杆菌科(Lactobacillaceae)为主要物种,其次是棒状杆菌科(Corynebacteriaceae)和消化链球菌科(Peptostreptococcaceae),相较于NC组,LRS组乳酸杆菌科、消化链球菌科相对丰度上调,且棒状杆菌科相对丰度下调,SL组和LRS+SL组均表现为消化链球菌科相对丰度下调(图3B)。属水平上,乳酸杆菌属(Lactobacillus)相对丰度最高,棒状杆菌属(Corynebacterium)、Romboutsia次之,LRS组Lactobacillus上调而Corynebacterium相对丰度下调,LRS组Romboutsia相对丰度增加,在其余两组Romboutsia相对丰度降低(图3C)。对图3C中相对丰度前15的物种进行筛选,其中具有显著差异的物种如图3D所示,结合图3E和图3F可知,Dietzia在LRS组中的相对丰度低于其余3 组,漫游球菌属(Vagococcus)在LRS组、SL组和LRS+SL组中的水平均极显著低于NC组(P<0.01)。LRS+SL组相较其余各组表现出显著促进unclassified_f__Ruminococcaceae生长(P<0.01)和抑制异杆菌属(Allobaculum)繁殖(P<0.05)的效果。其中,Lactobacillus被认为是保护肠道屏障、调控免疫应答、抗病原菌感染、调节代谢、预防炎症的益生菌[19];Dietzia可通过产生天然类胡萝卜素(角黄素)发挥抗氧化、预防癌症的作用[20];Vagococcus与人类肠道感染疾病有关,类似于肠杆菌属(Enterococcus)和肉食杆菌属(Carnobacterium)等致病菌[21]。
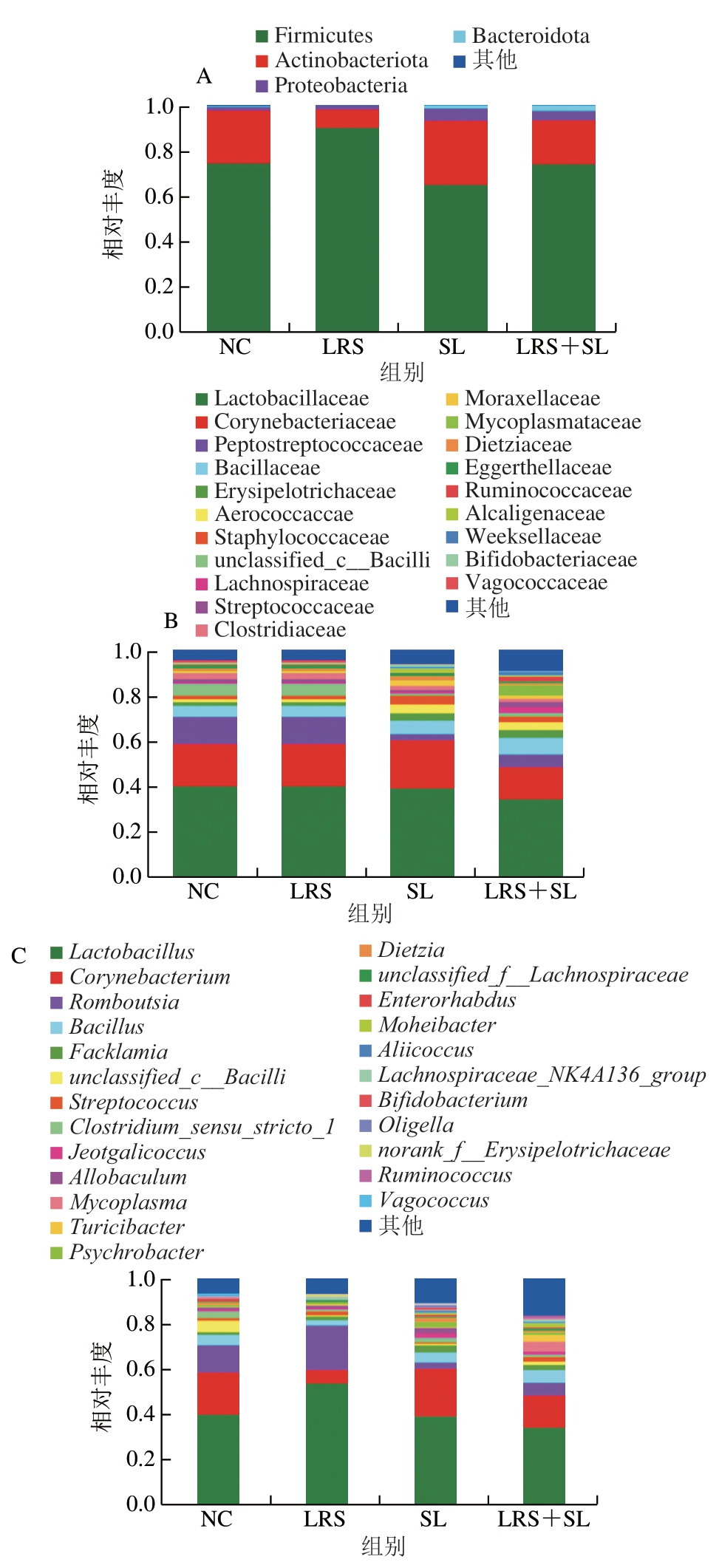
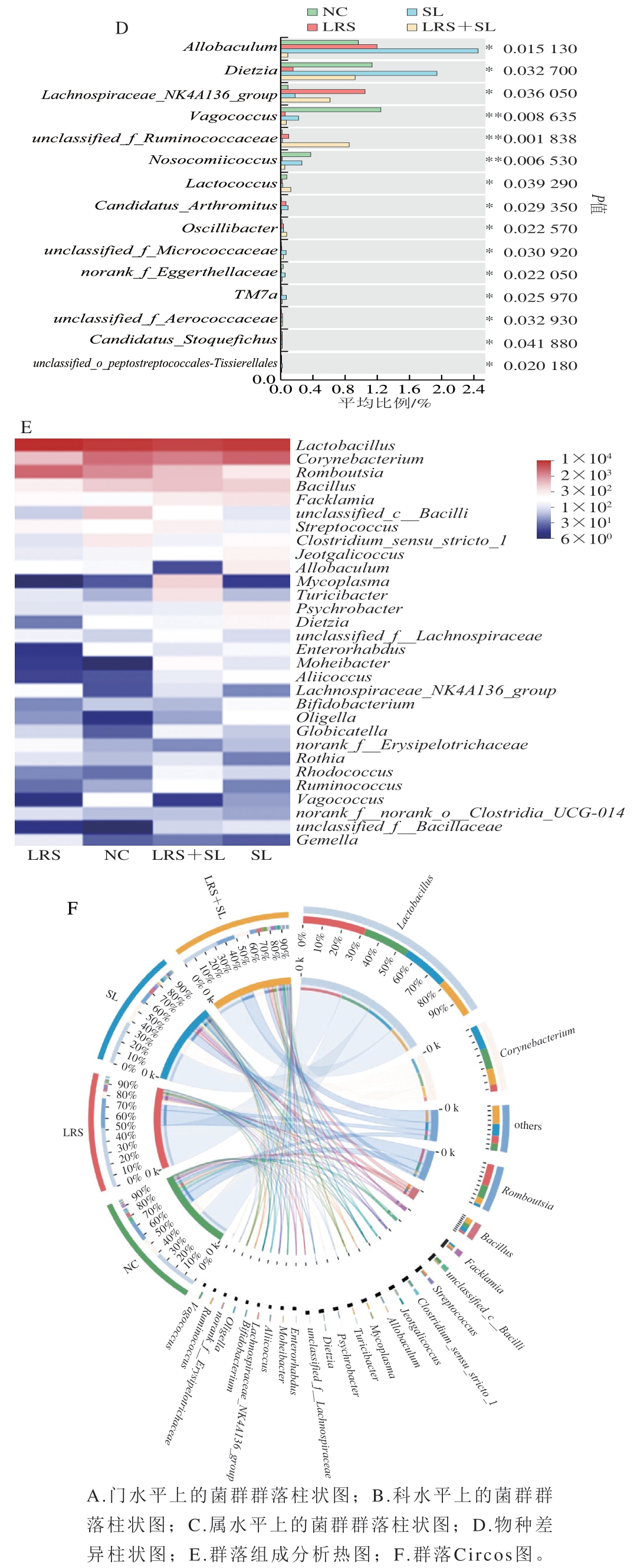
图3 群落组成及多组间差异分析结果
Fig. 3 Analysis of intestinal bacterial community composition and differential species among groups
在属水平上,与NC组相比,LRS组Vagococcus(P<0.01)、Dietzia(P<0.05)、Enterorhabdus(P<0.05)、Coriobacteriaceae_UCG-002相对丰度显著或极显著降低,norank_f__Erysipelotrichaceae、Lachnospiraceae_NK4A136_group相对丰度显著增加(P<0.05)(图4A)。有研究表明,Enterorhabdus被认为是人体肠道致病菌之一,其参与了肠道内未消化蛋白的发酵,可能破坏肠道稳态,其产物氨、腐胺等与结直肠癌的发生有密切联系[22];Coriobacteriaceae_UCG-002被证明在病态肥胖个体肠道菌群中相对丰度较高,可能具有潜在的致代谢紊乱作用[23]。SL组Lactococcus相对丰度显著降低(P<0.05),unclassified_f__Micrococcaceae、unclassified_f__Aerococcaceae相对丰度显著增加(P<0.05)(图4B)。LRS+SL组Vagococcus、Allobaculum相对丰度极显著降低(P<0.01),unclassified_f__Ruminococcaceae(P<0.01)、Lachnospiraceae_NK4A136_group(P<0.05)相对丰度极显著或显著增加(图4C)。此外,Lachnospiraceae和Ruminococcaceae同属Firmicutes,是人类肠道中常见的菌群,能水解淀粉和糖类从而产生丁酸盐及短链脂肪酸[24]。同时,LRS组和SL组相对LRS+SL组均表现出显著较低的unclassified_f__Ruminococcaceae相对丰度(P<0.05)和极显著较高的Allobaculum相对丰度(P<0.01)(图4D、E)。Allobaculum的相对丰度与ANGPTL4(即一种脂质代谢的关键调节因子,也是肠道微生物群和脂肪沉积的循环介质)的表达呈正相关,且有实验表明,高脂饮食处理也使小鼠Allobaculum相对丰度显著增加[25]。
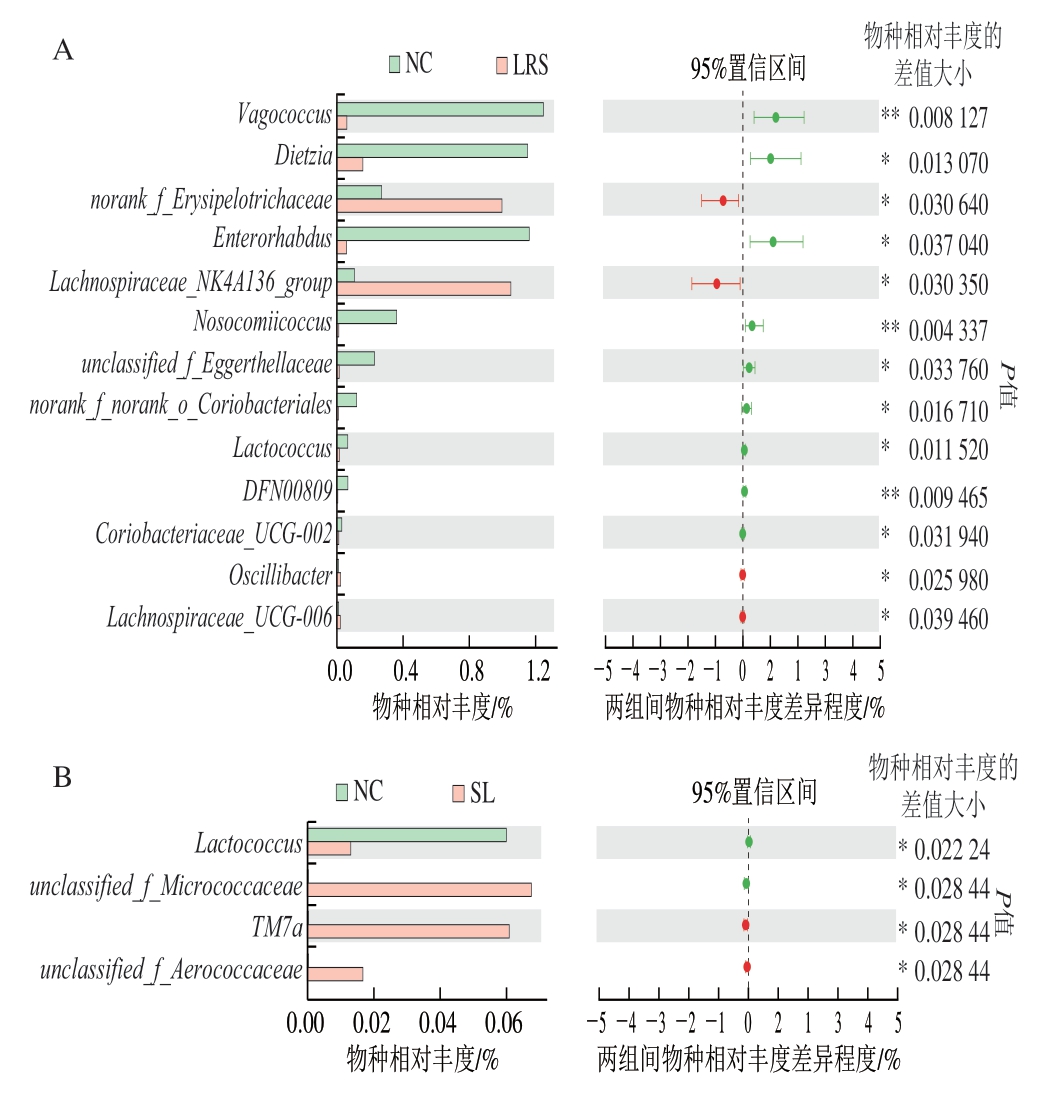
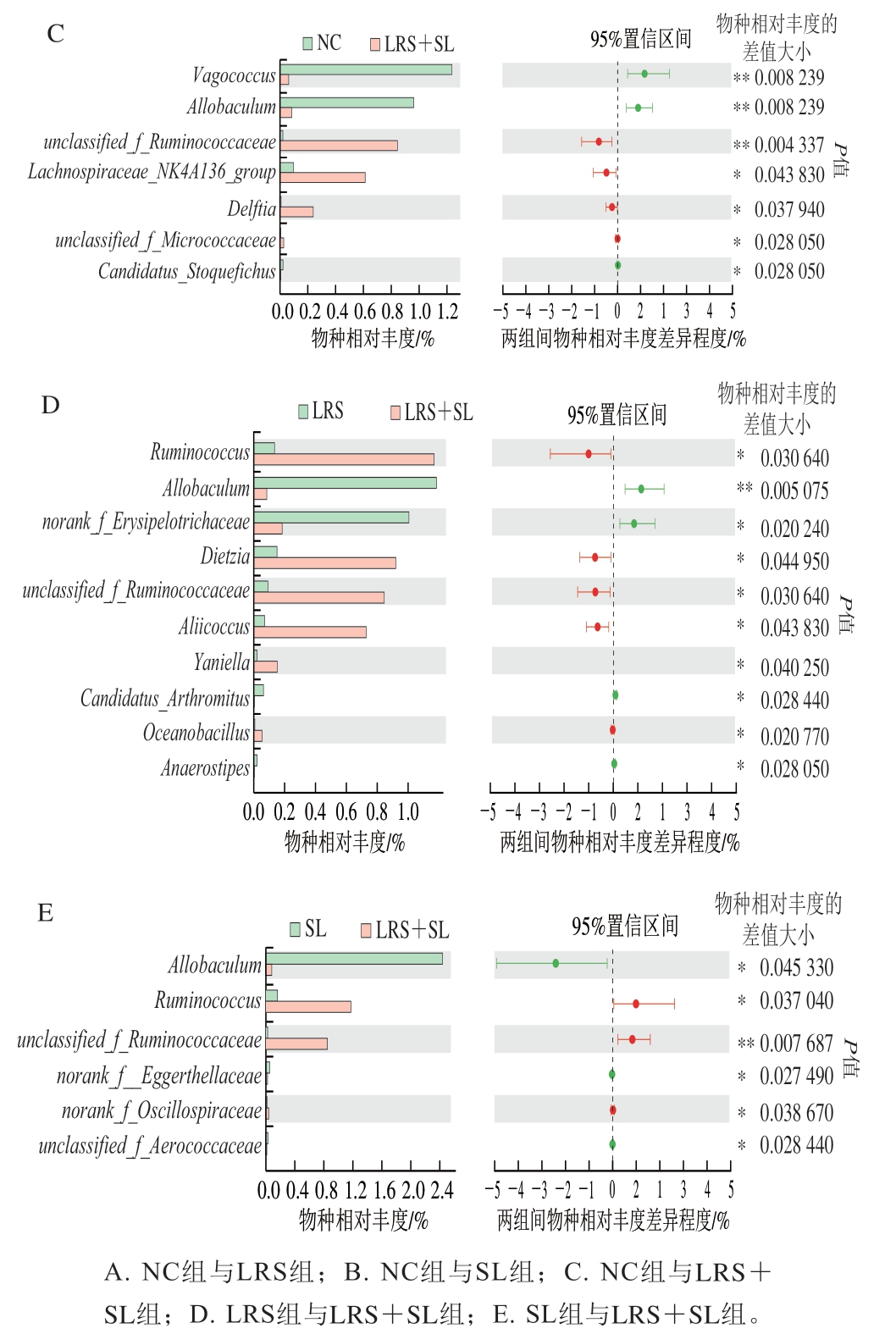
图4 两组间群落组成差异分析结果
Fig. 4 Analysis of differences in intestinal bacterial community composition between two groups
由此可见,LRS和SL的饮食干预有利于小肠菌群结构的优化、维持肠道稳态,这与Zeng Hongliang等[26]研究结果具有一致性。另外,LRS和SL协同作用促进了unclassified_f__Ruminococcaceae的增殖并抑制了Allobaculum的增殖,具有预防代谢紊乱的潜在功效。
2.3 LRS、SL干预后大鼠肠道代谢谱差异
代谢谱数据的OPLS-DA结果如图5所示。在阴离子模式下,LRS组与NC组、LRS+SL组与NC组、LRS组与LRS+SL组、SL组与LRS+SL组代谢模式均可完全分离,表明LRS及LRS与SL协同作用均可有效干预代谢模式的变化。
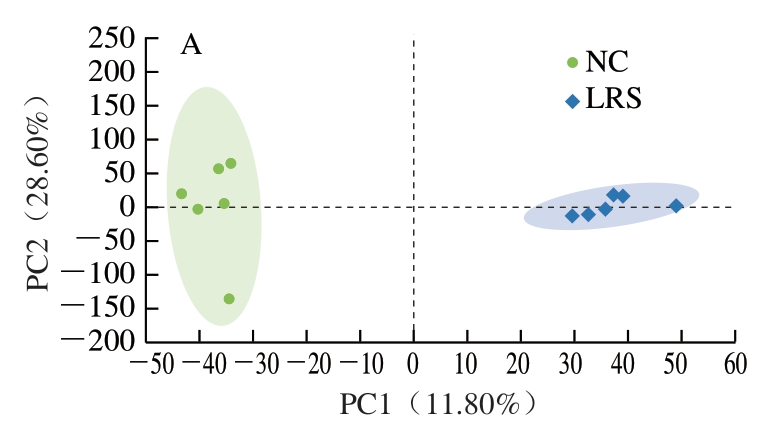
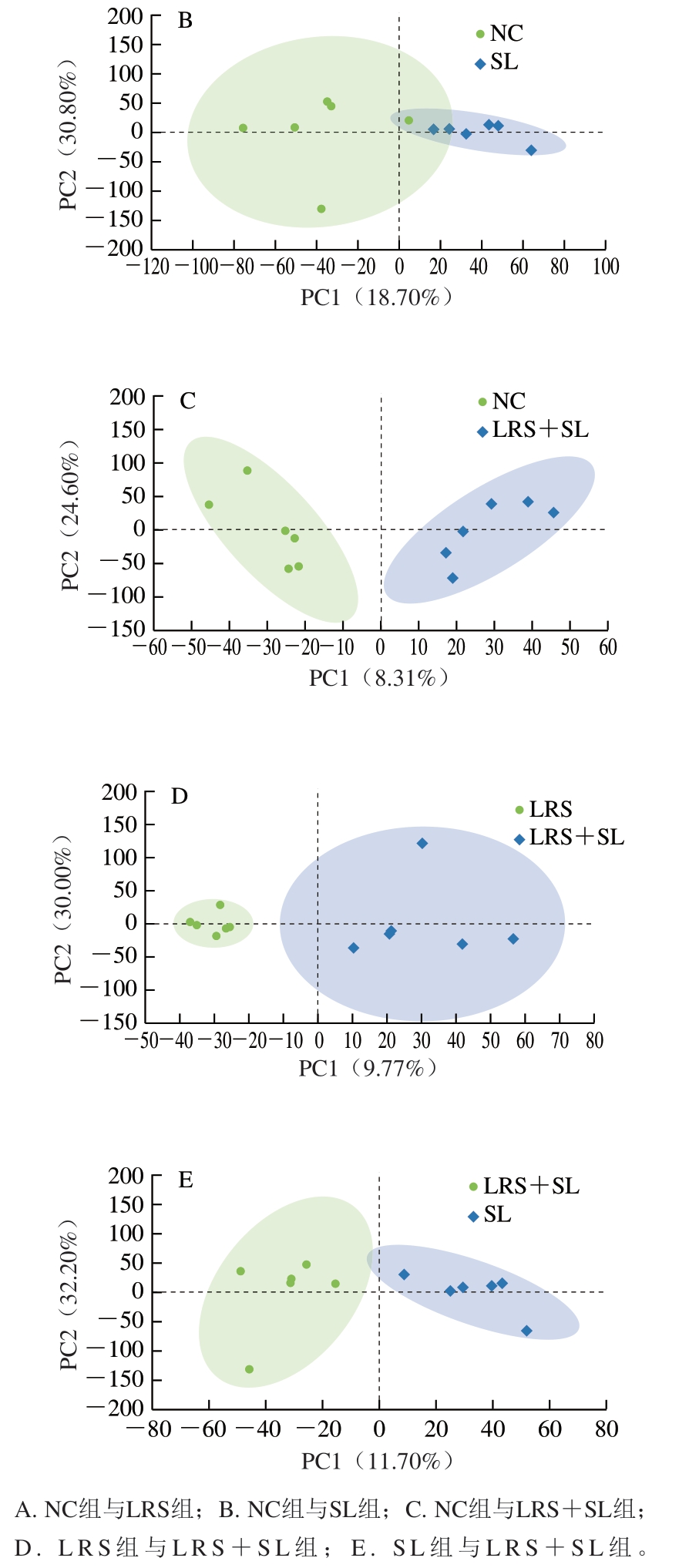
图5 组间代谢差异OPLS-DA评分图
Fig. 5 OPLS-DA score plots for differential metabolites between groups
在VIP>1,P<0.05、FC<1或FC>1的条件下,将所筛选出的差异代谢物与KEGG数据库比对分类,结果如图6所示,具体差异代谢物见表1。
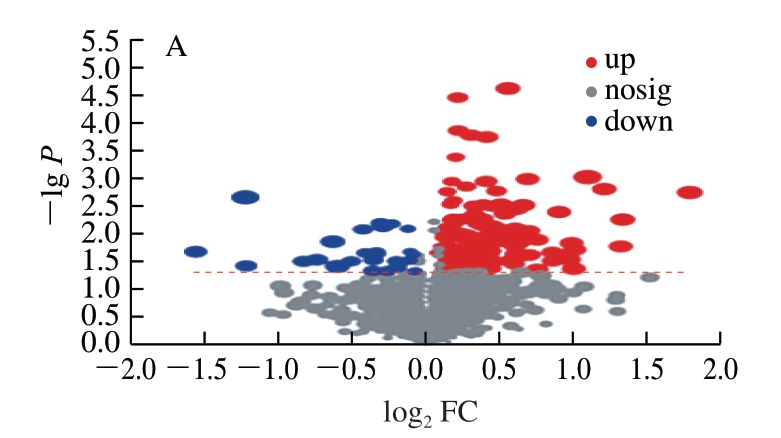
图6 组间KEGG差异代谢物分析结果
Fig. 6 KEGG differential metabolite analysis between groups
由表1可知,相对于NC组,LRS极显著或显著地促进了(R)-硫辛酸(P<0.01)、α-姜黄素(P<0.05)、17,18-乙醇酰胺(P<0.05)、银杏内酯A(P<0.01)、17-β-雌二醇3-硫酸盐-17-(β-D-葡萄糖醛酸)(P<0.01)、油酰乙醇酰胺(P<0.05)、类固醇激素(雌三醇、雌激素、皮质甾酮)(P<0.05)等代谢物的上调,以及磷脂(LysoPC(17:0))、氨基酸(L-丝氨酸)等的显著下调(P<0.05),表明LRS对体内脂类、氨基酸代谢有调节作用。其中,α-姜黄素是改善脂质代谢、保护肠道健康,降低血液胆固醇水平的重要代谢物[27]。LysoPC(17:0)可能通过氧化应激在机体损伤过程中发挥重要作用[28-29]。L-丝氨酸为非必需氨基酸,丝氨酸的从头合成在提高机体免疫功能方面有积极影响[30]。在SL作用下,大鼠体内磷脂代谢有明显变化(LysoPC(18:1(9Z))、LysoPC(20:2(11Z,14Z))显著下调(P<0.05),LysoPC(24:1(15Z))显著上调(P<0.05)),油酰乙醇酰胺、类固醇激素(脱氢表雄酮、皮质醇、糖皮质类固醇激素、皮质甾酮、雄烯二酮)水平显著上调(P<0.05)。LRS与SL协同作用时,大鼠体内氨基酸代谢变化(L-组氨酸、L-色氨酸下调,瓜氨酸上调)显著(P<0.05),同时表现出3a,7a-二羟基-5b-胆甾烷、维生素(泛酸)水平显著上调(P<0.05)和磷脂(LysoPC(17:0))水平下调。此外,与LRS单独作用相比,该协同作用对维生素代谢的调节(烟酸、抗坏血酸显著下调(P<0.05))有更显著的影响;相较于SL单独作用,二者协同对17-羟基亚麻酸、LysoPC(16:1(9Z)/0:0)水平有上调作用,对脱氧雪腐镰刀菌烯醇、山柰酚等代谢物有下调作用。其中,瓜氨酸在机体氮素循环中发挥重要作用,在体内吸收后可转化为精氨酸,具有提高机体的免疫力、保持正常的胆固醇水平、平衡正常的血糖水平、清除自由基等作用[31]。脱氧雪腐镰刀菌烯醇是一种引起机体免疫抑制和肠道菌群紊乱的毒素,对肠道屏障功能有破坏作用[32]。综上所述,LRS和SL均有利于类固醇激素的合成,且LRS单独作用时可促进大鼠体内(R)-硫辛酸、银杏内酯A、α-姜黄素等物质水平的增加,有利于调节氨基酸和脂质代谢;SL干预可调节类固醇激素及磷脂等代谢物水平;二者共同作用时,对氨基酸代谢和维生素代谢的调节作用更为明显,并可能提高机体对有害代谢物的抵抗作用。
表1 LRS组、SL组、LRS+SL组与NC组及LRS组、SL组与LRS+SL组小肠差异代谢物对比
Table 1 Differential metabolites in small intestine of LRS, SL and LRS + SL versus NC groups, and LRS and SL versus LRS + SL groups
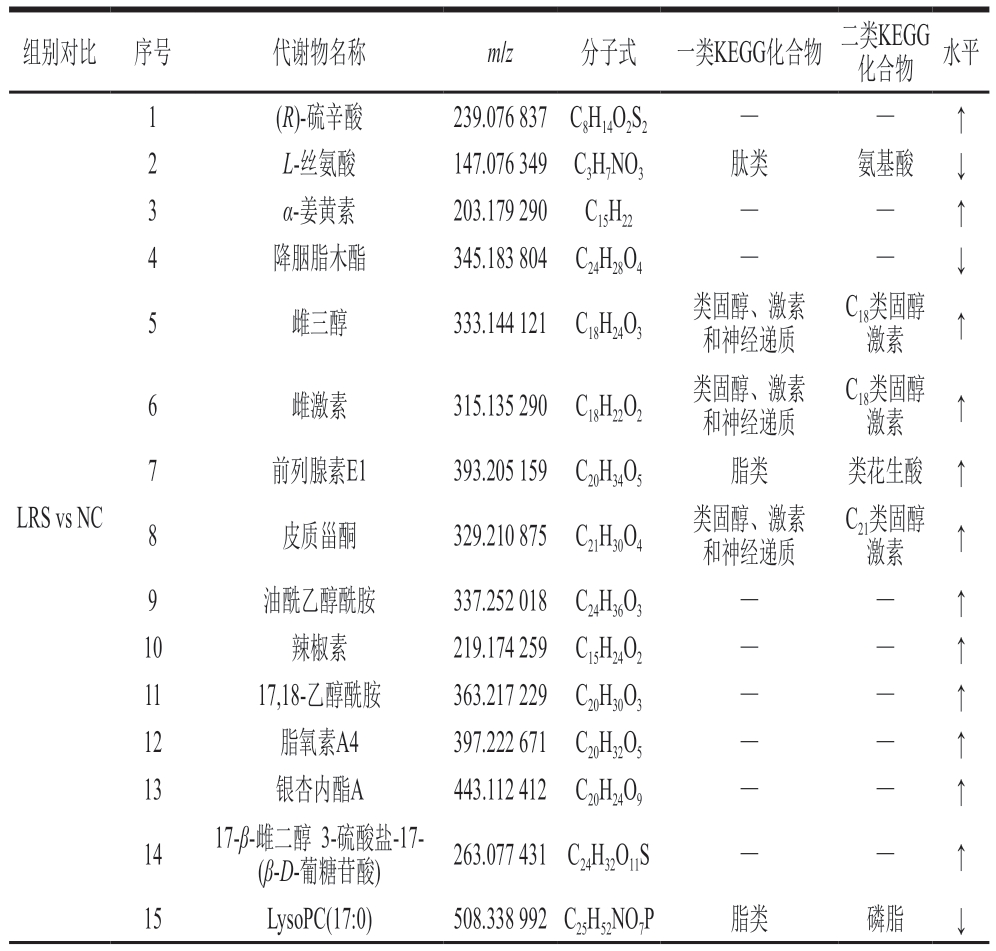
组别对比 序号 代谢物名称 m/z 分子式 一类KEGG化合物 二类KEGG化合物 水平1(R)-硫辛酸 239.076 837 C8H14O2S2 — — ↑2 L-丝氨酸 147.076 349 C3H7NO3 肽类 氨基酸 ↓3 α-姜黄素 203.179 290 C15H22 — — ↑4降胭脂木酯 345.183 804 C24H28O4 — — ↓5雌三醇 333.144 121 C18H24O3类固醇、激素和神经递质C18类固醇激素 ↑6雌激素 315.135 290 C18H22O2类固醇、激素和神经递质C18类固醇激素 ↑7 LRS vs NC前列腺素E1 393.205 159 C20H34O5 脂类 类花生酸 ↑8皮质甾酮 329.210 875 C21H30O4类固醇、激素和神经递质C21类固醇激素 ↑9 油酰乙醇酰胺 337.252 018 C24H36O3 — — ↑10 辣椒素 219.174 259 C15H24O2 — — ↑11 17,18-乙醇酰胺 363.217 229 C20H30O3 — — ↑12 脂氧素A4 397.222 671 C20H32O5 — — ↑13 银杏内酯A 443.112 412 C20H24O9 — — ↑14 17-β-雌二醇 3-硫酸盐-17-(β-D-葡糖苷酸) 263.077 431 C24H32O11S — — ↑15 LysoPC(17:0) 508.338 992 C25H52NO7P 脂类 磷脂 ↓
续表1
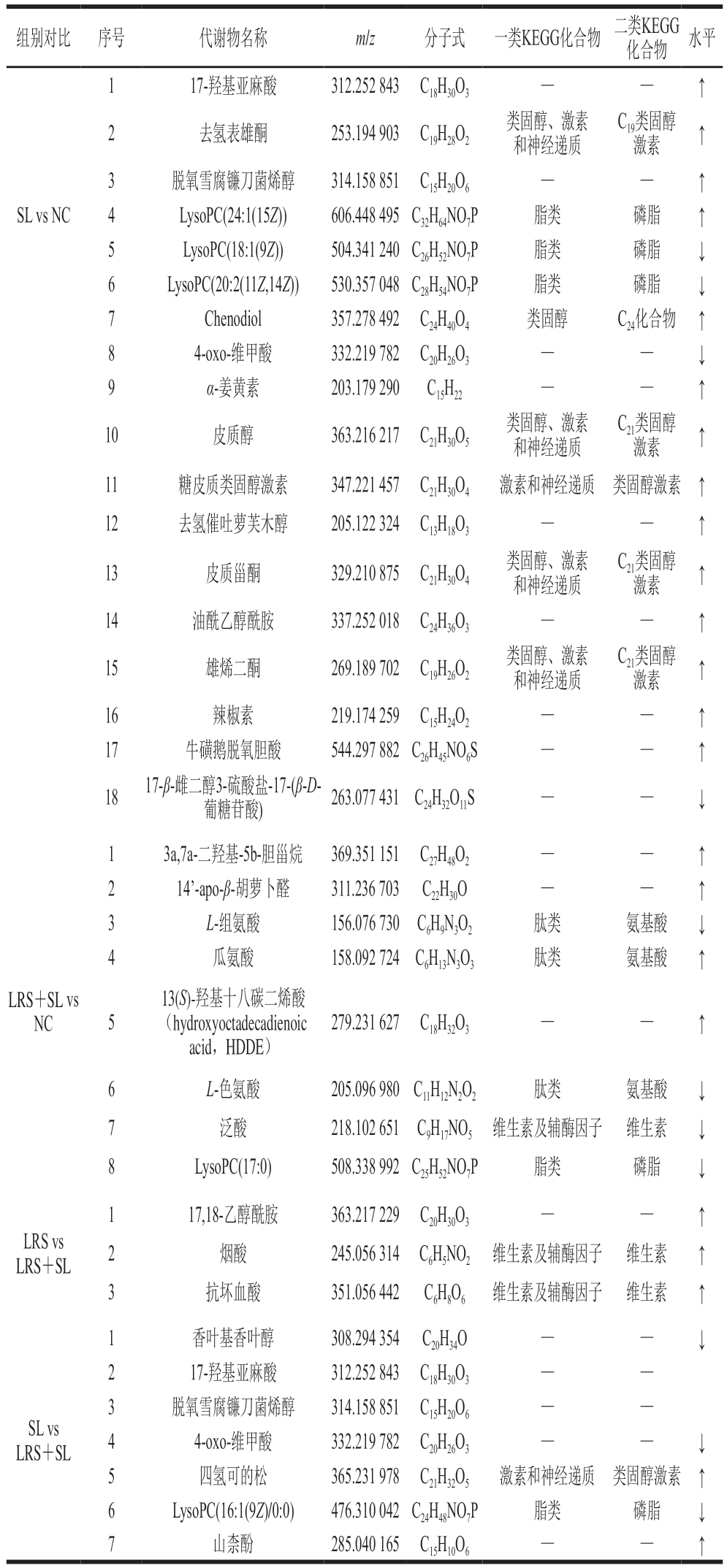
注:↑. LRS、SL或LRS+SL组相对于NC组及LRS、SL组相对于LRS+SL组代谢物水平显著上调(P<0.05);↓. LRS、SL或LRS+SL组相对于NC组及LRS、SL组相对于LRS+SL组代谢物水平显著下调(P<0.05)。—.没有具体分类。
组别对比 序号 代谢物名称 m/z 分子式 一类KEGG化合物 二类KEGG化合物 水平1 17-羟基亚麻酸 312.252 843 C18H30O3 — — ↑2去氢表雄酮 253.194 903 C19H28O2类固醇、激素和神经递质C19类固醇激素 ↑3 脱氧雪腐镰刀菌烯醇 314.158 851 C15H20O6 — — ↑SL vs NC 4 LysoPC(24:1(15Z)) 606.448 495 C32H64NO7P 脂类 磷脂 ↑5 LysoPC(18:1(9Z)) 504.341 240 C26H52NO7P 脂类 磷脂 ↓6 LysoPC(20:2(11Z,14Z)) 530.357 048 C28H54NO7P 脂类 磷脂 ↓7 Chenodiol 357.278 492 C24H40O4 类固醇 C24化合物 ↑8 4-oxo-维甲酸 332.219 782 C20H26O3 — — ↓9 α-姜黄素 203.179 290 C15H22 — — ↑10 皮质醇 363.216 217 C21H30O5类固醇、激素和神经递质C21类固醇激素 ↑11 糖皮质类固醇激素 347.221 457 C21H30O4 激素和神经递质 类固醇激素 ↑12 去氢催吐萝鞭木醇 205.122 324 C13H18O3 — — ↑13 皮质甾酮 329.210 875 C21H30O4类固醇、激素和神经递质C21类固醇激素 ↑14 油酰乙醇酰胺 337.252 018 C24H36O3 — — ↑15 雄烯二酮 269.189 702 C19H26O2类固醇、激素和神经递质C21类固醇激素 ↑16 辣椒素 219.174 259 C15H24O2 — — ↑17 牛磺鹅脱氧胆酸 544.297 882 C26H45NO6S — — ↑18 17-β-雌二醇3-硫酸盐-17-(β-D-葡糖苷酸) 263.077 431 C24H32O11S — — ↓1 3a,7a-二羟基-5b-胆甾烷 369.351 151 C27H48O2 — — ↑2 14’-apo-β-胡萝卜醛 311.236 703 C22H30O — — ↑3 L-组氨酸 156.076 730 C6H9N3O2 肽类 氨基酸 ↓4瓜氨酸 158.092 724 C6H13N3O3 肽类 氨基酸 ↑LRS+SL vs NC 5 13(S)-羟基十八碳二烯酸(hydroxyoctadecadienoic acid,HDDE)279.231 627 C18H32O3 — — ↑6 L-色氨酸 205.096 980 C11H12N2O2 肽类 氨基酸 ↓7泛酸 218.102 651 C9H17NO5 维生素及辅酶因子 维生素 ↓8 LysoPC(17:0) 508.338 992 C25H52NO7P 脂类 磷脂 ↓LRS vs LRS+SL 1 17,18-乙醇酰胺 363.217 229 C20H30O3 — — ↑2烟酸 245.056 314 C6H5NO2 维生素及辅酶因子 维生素 ↑3抗坏血酸 351.056 442 C6H8O6 维生素及辅酶因子 维生素 ↑SL vs LRS+SL 1 香叶基香叶醇 308.294 354 C20H34O — — ↓2 17-羟基亚麻酸 312.252 843 C18H30O3 — —3 脱氧雪腐镰刀菌烯醇 314.158 851 C15H20O6 — —4 4-oxo-维甲酸 332.219 782 C20H26O3 — — ↓5四氢可的松 365.231 978 C21H32O5 激素和神经递质 类固醇激素 ↑6 LysoPC(16:1(9Z)/0:0) 476.310 042 C24H48NO7P 脂类 磷脂 ↓7山柰酚 285.040 165 C15H10O6 — — ↑
LRS组、SL组、LRS+SL组与NC组间及LRS组、SL组与LRS+SL组之间差异显著的功能通路如图7所示。其中,横轴表示通路中代谢物在通路中的相对重要性,气泡大小代表通路重要性值。NC组与LRS组有2 条差异较大的功能通路:类固醇激素(steroid hormone)、半胱氨酸和蛋氨酸代谢(cysteine and methionine metabolism)通路(图7A)。类固醇激素功能通路与雌激素、皮质甾酮、脱氢表雄酮等类固醇及其衍生物有关,并与一种调节胆汁酸代谢及脂质代谢的细菌Oscillibacter丰度呈正相关[33]。NC与SL组有4 条差异较明显的功能通路:类固醇降解(steroid degradation)、类固醇激素生物合成(steroid hormone biosynthesis)、初级胆汁酸合成(primary bile acid synthesis)、谷胱甘肽代谢(glutathione metabolism)通路(图7B)。其中,初级胆汁酸合成对抗胆汁淤积有重要作用[34]。谷胱甘肽代谢是机体内重要的抗氧化和代谢调节的途径,能够清除氮氧自由基、预防肝脏疾病[35]。对照组与LRS+SL组有3 条差异较明显的功能通路:氨酰tRNA生物合成(aminoacyl-tRNA biosynthesis)、β-丙氨酸代谢(β-alanine metabolism)、星孢菌素生物合成(staurosporine biosynthesis)通路(图7C)。LRS组与LRS+SL组间有2 条差异较大的功能通路:谷胱甘肽代谢(Glutathione metabolism)、抗坏血酸和醛酸代谢(ascorbate and aldarate metabolism)(图7D)。SL组与LRS+SL组间有3 条差异较大的功能通路:黄酮和黄酮醇(flavone and flavonol)、类黄酮生物合成(flavonoid biosynthesis)和甘油磷脂代谢(glycerophospholipid metabolism)通路(图7E)。β-丙氨酸代谢等氨基酸代谢通路及甘油磷脂代谢等脂质代谢通路均与预防代谢综合征等疾病有关[36]。综上,LRS及SL单独作用时均表现出氨基酸代谢和激素代谢调节的重要作用,SL还在优化肝功能、增强肝防御系统方面有促进作用;二者协同作用时有利于维持脂质代谢、维生素代谢稳定并促进生物活性物质的合成和表达。
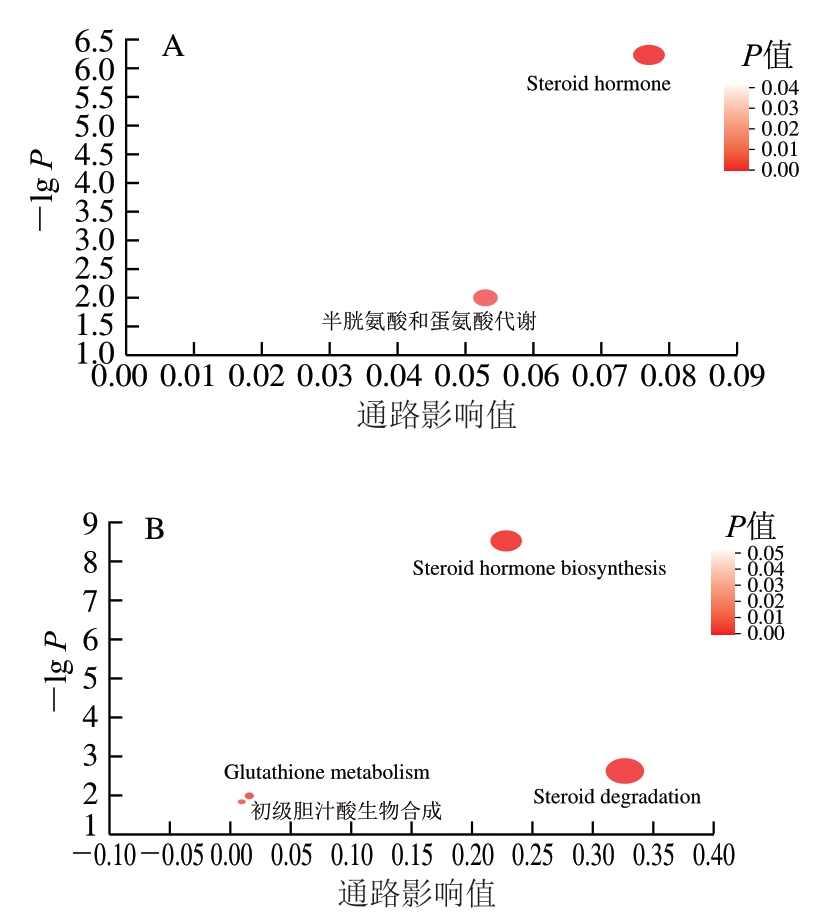
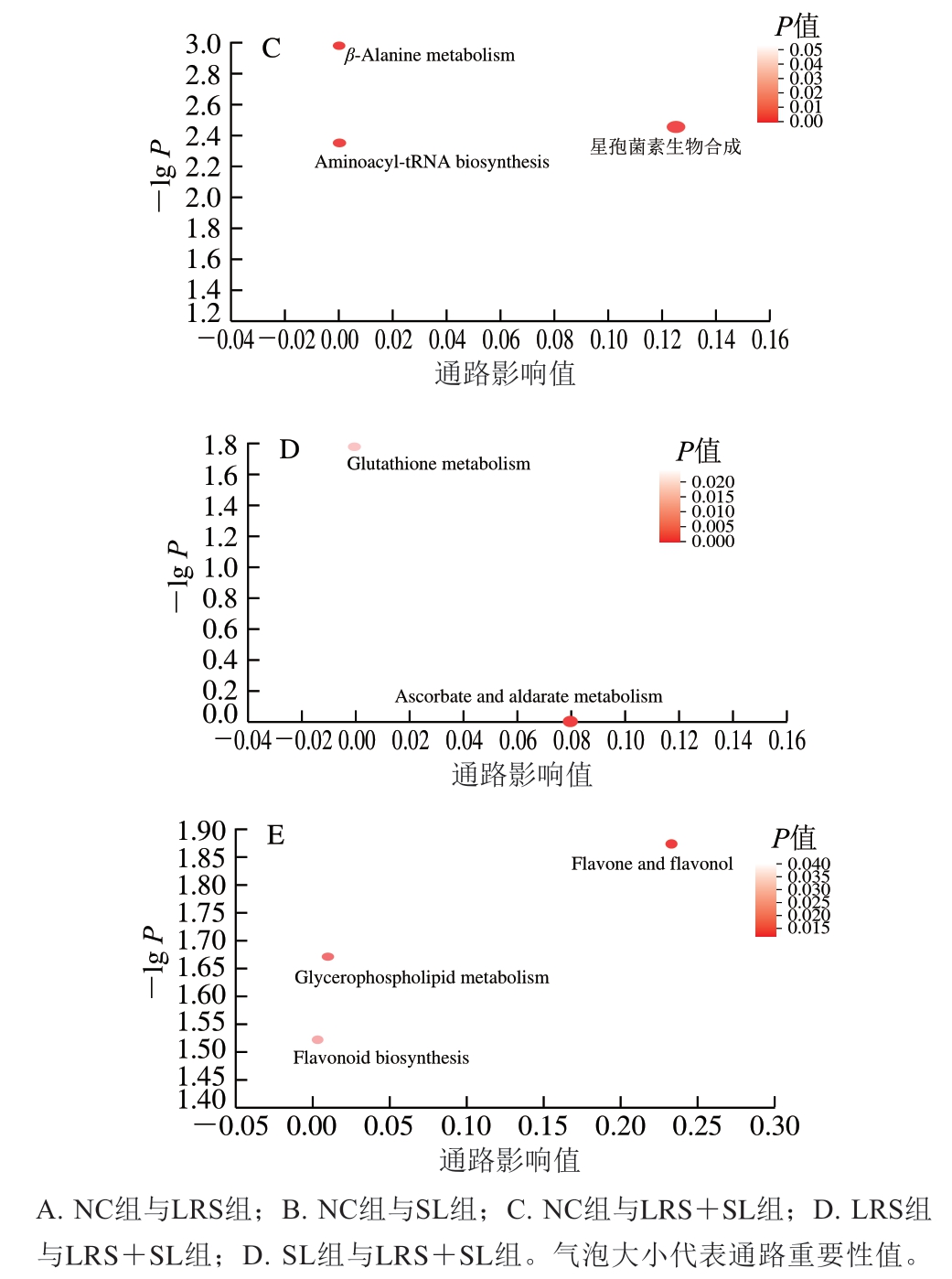
图7 组间功能通路差异拓扑学分析结果
Fig. 7 Topological analysis of differential functional pathways between groups
2.4 菌群多样性与代谢谱相关性分析结果
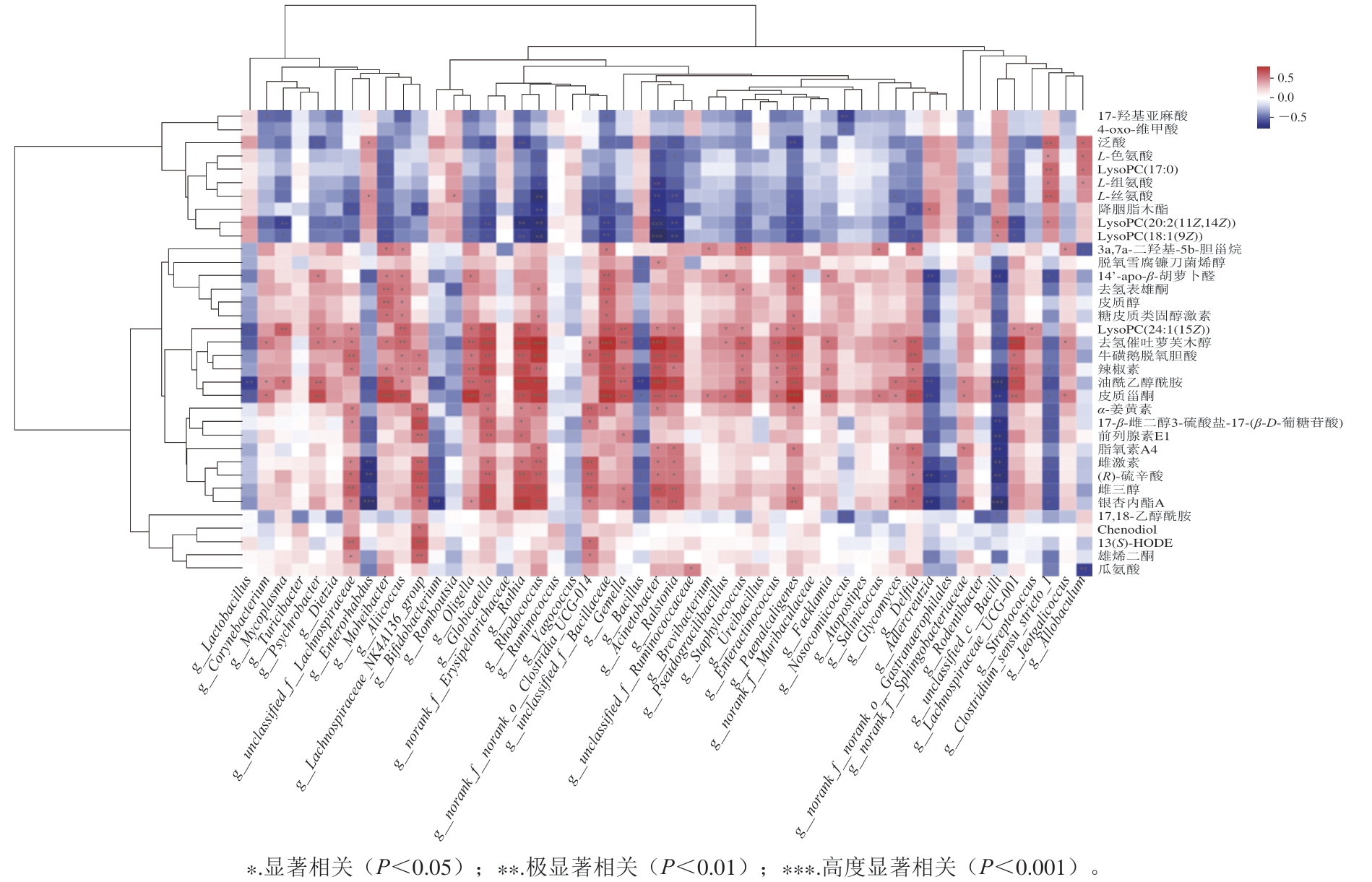
图8 肠道菌群-代谢相关性分析结果
Fig. 8 Correlation analysis between intestinal flora and metabolism
对小肠菌群差异菌属与差异代谢物进行相关性分析,所得结果如图8所示,球链菌属(Globicatella)、罗斯氏菌属(Rothia)、红球菌(Rhodococcus)、Bacillaceae、Gemella、不动杆菌(Acinetobacter)、Ralstonia与LysoPC(24:1(15Z))(P<0.05)、去氢催吐萝鞭木醇(P<0.001)、辣椒素、油酰乙醇酰胺、皮质甾酮、雌激素、(R)-硫辛酸、雌三醇、银杏内酯A(P<0.05)呈显著正相关,与L-丝氨酸、降胭脂木酯、LysoPC(20:2(11Z,14Z))、LysoPC(18:1(9Z))呈显著负相关(P<0.05)。Lachnospiraceae_UCG-001与LysoPC(24:1(15Z))(P<0.05)、去氢催吐萝鞭木醇(P<0.001)、辣椒素(P<0.05)、油酰乙醇酰胺(P<0.01)、皮质甾酮(P<0.01)呈显著正相关。Enterorhabdus与雌激素、(R)-硫辛酸、银杏内酯A呈显著负相关(P<0.01)。Allobaculum与瓜氨酸呈显著负相关(P<0.01),与LysoPC(17:0)、组氨酸等维生素呈显著正相关(P<0.05)。其中,银杏内酯A参与血清和肝组织TC与TG含量的调控,降低肝细胞脂肪变性和脂质蓄积程度,有效预防非酒精性脂肪性肝病[37-38]。有研究表明[39],(R)-硫辛酸能调节线粒体功能和脂肪细胞胰岛素敏感性,是改善胰岛素抵抗和相关代谢紊乱的潜在有效营养素。肝脏是雌激素代谢的主要部位,也是雌激素作用的主要非生殖靶器官[40];雌激素调节肝脏蛋白质的合成、肝脏能量稳态,参与脂质和葡萄糖代谢的肝脏基因以及肝细胞的增殖和凋亡,对肝功能有重要调节作用[41]。辣椒素是从辣椒中提取的主要活性成分,研究表明其不仅具有抗氧化、清除活性氧自由基和改善线粒体活性等功能,还在改善肝细胞膨大、气球样变及脂肪空泡等病理损伤方面发挥积极作用[42]。油酰乙醇酰胺作为一种天然存在的脂质信号分子,主要通过改善脂肪酸诱导的氧化应激,预防非酒精性脂肪性肝病[43]。与银杏内酯A呈正相关的Rhodococcus可以降解脂肪酶、腈水合酶和胆固醇氧化酶为丁酸、丙酸等短链脂肪酸,对促进脂肪氧化、改善代谢健康有重要作用[44]。Rothia也是一种产丁酸的细菌,在调节肠道能量代谢、防止肠道微生态失衡方面有重要作用[45]。结合小肠菌群和代谢谱差异可得,LRS单独作用时不仅有利于促进Lachnospiraceae_NK4A136_group等有益菌的增殖,增加银杏内酯A、(R)-硫辛酸、油酰乙醇酰胺、辣椒素等有益代谢物的产生,促进Rothia和Rhodococcus产短链脂肪酸细菌的繁殖,降低Enterorhabdus等有害菌相对丰度,起到调节氨基酸、激素、脂类代谢的作用。LRS和SL协同作用时,可通过降低Allbaculum相对丰度,调节维生素代谢,可能对维持体内代谢平衡、预防代谢综合征有潜在效果。
3 结 论
本研究探讨了LRS及SL对大鼠的小肠道菌群结构及代谢的影响。通过小肠菌群结构、代谢物组成及其相关性的分析,结果表明,LRS的饮食干预促进了Lachnospiraceae_NK4A136_group的增殖并降低了Enterorhabdus相对丰度,与辣椒素、油酰乙醇酰胺、雌激素、(R)-硫辛酸、银杏内酯A正相关,影响了类固醇激素和半胱氨酸和蛋氨酸代谢代谢通路,可能在调节氨基酸、激素代谢等方面发挥积极作用;SL的干预提高了unclassified_f__Aerococcaceae、unclassified_f__Micrococcaceae的相对丰度,影响了初级胆汁酸合成及谷胱甘肽代谢通路,具有预防胆汁酸堆积、增强肝功能的潜在效果;当二者协同作用时,能够增加小肠菌群多样性,同时促进unclassified_f__Ruminococcaceae的增殖并降低Allobaculum的相对丰度,与瓜氨酸呈负相关并与LysoPC(17:0)呈正相关,能够富集维生素、脂质、氨基酸代谢通路,与LRS和SL单独作用相比,其在维持机体稳态方面有着更为显著的效果。研究结果可为益生元及其后生元协同效应的研究提供一定的理论依据。
[1]ZIERER J, JACKSON M A, KASTENMULLER G, et al. The fecal metabolome as a functional readout of the gut microbiome[J]. Nature Genetics, 2018, 50(6): 790-795. DOI:10.1038/s41598-019-45640-y.
[2]JIE Z Y, XIA H H, ZHONG S L, et al. The gut microbiome in atherosclerotic cardiovascular disease[J]. Nature Communications,2017, 8(1): 845. DOI:10.1038/s41467-017-00900-1.
[3]BACKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004,101(44): 15718-15723. DOI:10.1073/pnas.0407076101.
[4]钟尉. 糖尿病大鼠肠道菌群失衡后小肠对糖吸收影响的研究[D].大连: 大连医科大学, 2018: 64.
[5]RAIGOND P, EZEKIEL R, RAIGOND B. Resistant starch in food:a review[J]. Journal of the Science of Food and Agriculture, 2015,95(10): 1968-1978. DOI:10.1002/jsfa.6966.
[6]张亚楠, 毛传武, 熊成龙, 等. 菊粉、抗性淀粉RS3及其复合物对小鼠脂肪代谢及肠道菌群的影响[J]. 上海预防医学, 2022, 34(1): 66-72. DOI:10.19428/j.cnki.sjpm.2021.21054.
[7]田建华, 胡建民, 周菲, 等. 食物中添加山药、莲子对46 例2型糖尿病的影响[J]. 陕西中医, 2005, 35(3): 198-200. DOI:10.3969/j.issn.1000-7369.2005.03.003.
[8]黄敏丽, 曾木花, 刘思迪, 等. 莲子淀粉纳米晶的制备及其结构特性研究[J/OL]. 中国粮油学报, (2021-12-05)[2022-04-19]. https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname=C APJLAST&filename=ZLYX2021120100F&uniplatform=NZKPT&v=CEyCh8fPdKf8pzElGmjJ5RGoblhAMDjcA9o9PK2PGsna-MAAq0SlopTLknEWhO1x.
[9]ZHANG Y, WANG Y, ZHENG B D, et al. The in vitro effects of retrograded starch (resistant starch type 3) from lotus seed starch on the proliferation of Bifidobacterium adolescentis[J]. Food & Function,2013, 4(11): 1609. DOI:10.1039/c3fo60206k.
[10]WANG Q, ZHENG Y F, ZHUANG W J, et al. Genome-wide transcriptional changes in type 2 diabetic mice supplemented with lotus seed resistant starch[J]. Food Chemistry, 2018, 264: 427-434.DOI:10.1016/j.foodchem.2018.05.056.
[11]QIN Renbing, WANG Jin, CHAO Chen, et al. RS5 produced more butyric acid through regulating the microbial community of human gut microbiota[J]. Journal of Agricultural and Food Chemistry, 2021,69(10): 3209-3218. DOI:10.1021/acs.jafc.0c08187.
[12]ZHANG Y L, PENG Y, ZHAO L J, et al. Regulating the gut microbiota and SCFAs in the faeces of T2DM rats should be one of antidiabetic mechanisms of mogrosides in the fruits of Siraitia grosvenorii[J].Journal of Ethnopharmacology, 2021, 274: 114033. DOI:10.1016/j.jep.2021.114033.
[13]毛红艳, 徐鑫, 于明. 鹰嘴豆抗性淀粉对高脂饮食小鼠生理功能及肠道菌群影响[J]. 新疆农业科学, 2021, 58(5): 929-936.DOI:10.6048/j.issn.1001-4330.2021.05.017.
[14]LEI S Z, LI X, LIU L, et al. Effect of lotus seed resistant starch on tolerance of mice fecal microbiota to bile salt[J]. International Journal of Biological Macromolecules, 2020, 151(4): 384-393. DOI:10.1016/j.ijbiomac.2020.02.197.
[15]LIU L, LIN Y J, LEI S Z, et al. Synergistic effects of lotus seed resistant starch and sodium lactate on hypolipidemic function and serum nontargeted metabolites in hyperlipidemic rats[J]. Journal of Agricultural and Food Chemistry, 2021, 69(48): 14580-14592.DOI:10.1021/acs.jafc.1c05993.
[16]林姗. 莲子抗性淀粉分级分离及其益生元作用的研究[D]. 福州:福建农林大学, 2016:108.
[17]ZHANG J D, SONG L J, WANG Y J, et al. Beneficial effect of butyrate-producing Lachnospiraceae on stress-induced visceral hypersensitivity in rats[J]. Journal of Gastroenterology and Hepatology, 2019, 34(8): 1368-1376. DOI:10.1111/jgh.14536.
[18]POLICASTRO G, CARRATURO F, COMPAGNONE M, et al. A preliminary study on a novel bioaugmentation technique enhancing lactic acid production by mixed cultures fermentation[J]. Bioresource Technology, 2021, 340: 125595. DOI:10.1016/j.biortech.2021.125595.
[19]HUANG R J, WU F, ZHOU Q, et al. Lactobacillus and intestinal diseases: mechanisms of action and clinical applications[J].Microbiological Research, 2022, 260: 127019. DOI:10.1016/j.micres.2022.127019.
[20]SAIYED FAROOK ABUTHAHIR S, VENIL C K, MALATHI M. M, et al.Optimization of submerged fermentation for enhanced production of canthaxanthin by Dietzia maris AURCCBT01[J]. Materialstoday:Proceedings, 2021, 47: 2132-2137. DOI:10.1016/j.matpr.2021.05.150.
[21]ALTINTAS I, ANDREWS V, LARSEN M V. First reported human bloodstream infection with Vagococcus lutrae[J]. New Microbes and New Infections, 2020, 34: 100649. DOI:10.1016/j.nmni.2020.100649.
[22]KAUR H, DAS C, MANDE S S. In silico analysis of putrefaction pathways in bacteria and its implication in colorectal cancer[J]. Frontiers in Microbiology, 2017, 8: 2116. DOI:10.3389/fmicb.2017.02166.
[23]ZHANG H S, DIBAISE J K, ZUCCOLO A, et al. Human gut microbiota in obesity and after gastric bypass[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009,106(7): 2365-2370. DOI:10.1073/pnas.0812600106.
[24]LOUIS P, FLINT H J. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine[J].FEMS Microbiology Letters, 2009, 294(1): 1-8. DOI:10.1111/j.1574-6968.2009.01514.x.
[25]ZHENG Z B, LYU W T, REN Y, et al. Allobaculum involves in the modulation of intestinal ANGPTLT4 expression in mice treated by high-fat diet[J]. Frontiers in Nutrition, 2021, 8: 690138. DOI:10.3389/fnut.2021.690138.
[26]ZENG Hongliang, HUANG Cancan, LIN Shan, et al. Lotus seed resistant starch regulates gut microbiota and increases short-chain fatty acids production and mineral absorption in mice[J]. Journal of Agricultural and Food Chemistry, 2017, 65(42): 9217-9225.DOI:10.1021/acs.jafc.7b02860.
[27]BENGMARK S. Curcumin, an atoxic antioxidant and natural NFκB, cyclooxygenase-2, lipooxygenase, and inducible nitric oxide synthase inhibitor: a shield against acute and chronic diseases[J].Journal of Parenteral & Enteral Nutrition, 2006, 30(1): 45-51.DOI:10.1177/014860710603000145.
[28]MALDONADO P D, BARRERA D, RIVERO I, et al. Antioxidant S-allylcysteine prevents gentamicin-induced oxidative stress and renal damage[J]. Free Radical Biology and Medicine, 2003, 35(3): 317-324.DOI:10.1016/s0891-5849(03)00312-5.
[29]MALDONADO P D, BARRERA D, MEDINA-CAMPOS O N, et al.Aged garlic extract attenuates gentamicin induced renal damage and oxidative stress in rats[J]. Life Sciences, 2003, 73(20): 2543-2556.DOI:10.1016/s0024-3205(03)00609-x.
[30]MADDOCKS O, BE RKERS C R, MASON S M, et al. Serine starvation induces stress and p53-dependent metabolic remodelling in cancer cells[J]. Nature, 2013, 493: 542. DOI:10.1038/nature11743.
[31]WU G Y, KNABE DARRELL A, KIM SUNG W. Arginine nutrition in neonatal pigs[J]. The Journal of Nutrition, 2004, 134(10):2783S-2790S. DOI:10.1093/jn/134.10.2783S.
[32]陈昱君. 光催化的脱氧雪腐镰刀菌烯醇脱毒产品可减轻BLAB/c小鼠肠道屏障损伤和肠道菌群紊乱[J]. 广东饲料, 2021, 30(11): 52.
[33]张福蓉. 太极拳运动对2型糖尿病患者肠道菌群及宿主代谢影响的研究[D]. 成都: 成都中医药大学, 2020: 205.
[34]ZHU G X, FENG F. UPLC-MS-based metabonomic analysis of intervention effects of Da-Huang-Xiao-Shi decoction on anit-induced cholestasis[J]. Journal of Ethnopharmacology, 2019, 238(28): 111860.DOI:10.1016/j.jep.2019.111860.
[35]宋佳. 黄芩花抗衰老作用及其对谷氨酰胺-谷氨酸代谢通路的调节机制研究[D]. 太原: 山西大学, 2019: 86.
[36]方佳. 基于代谢组学和肠道菌群分析探讨麦冬寡糖抗2型糖尿病的作用机制[D]. 广州: 广州中医药大学, 2021: 102.
[37]KIM M J, LEE K J. Analysis of the dietary factors associated with suspected pediatric nonalcoholic fatty liver disease and potential liver fibrosis: Korean National Health and Nutrition Examination Survey 2014-2017[J]. BMC Pediatrics, 2020, 20: 121. DOI:10.1186/s12887-020-02022-y.
[38]MARRA F, SVEGLIATI-BARONI G. Lipotoxicity and the gut-liver axis in NASH pathogenesis[J]. Journal of Hepatology, 2017, 68(2):280. DOI:10.1016/j.jhep.2017.11.014.
[39]ZENG Mengqi, XU Jie, ZHANG Zhengyi, et al. Htd2 deficiencyassociated suppression of α-lipoic acid production provokes mitochondrial dysfunction and insulin resistance in adipocytes[J].Redox Biology, 2021, 41: 101948. DOI:10.1016/j.redox.2021.101948.
[40]QIU S Q, TORRENS V J, ERIN B, et al. Hepatic estrogen receptor α is critical for regulation of gluconeogenesis and lipid metabolism in males[J]. Scientific Reports, 2017, 7(1): 1661. DOI:10.1038/s41598-017-01937-4.
[41]GROSSMANN M, WIERMAN M E, ANGUS P, et al. Reproductive endocrinology of nonalcoholic fatty liver disease[J]. Endocrine Reviews, 2019, 40(2): 417. DOI:10.1210/er.2018-00158.
[42]陈凤东, 秦杏清, 梁微霞, 等. 辣椒素对小鼠急性酒精性肝损伤的保护作用[J]. 右江医学, 2020, 48(8): 570-574. DOI:10.3969/j.issn.1003-1383.2020.08.003.
[43]MA L, GUO X B, CHEN W. Inhibitory effects of oleoylethanolamide(OEA) on H2O2-induced human umbilical vein endothelial cell (HUVEC) injury and apolipoprotein E knockout (ApoE-/-)atherosclerotic mice[J]. International Journal of Clinical and Experimental Pathology, 2015, 8(6): 6301-6311.
[44]邱孜博, 汪荣, 张杨, 等. 红球菌及其生物降解作用研究进展[J].食品科学, 2016, 37(7): 1275-1283. DOI:10.7506/spkx1002-6630-201607045.
[45]MACHIELS K, JOOSSENS M, SABINO J, et al. A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis[J]. Gut,2014, 63(8): 1275-1283. DOI:10.1136/gutjnl-2013-304833.
