抗性淀粉(resistant starch,RS)是指不能被健康人体小肠消化吸收的淀粉及其降解产物的总称[1]。如图1所示,一般可将RS分为5 类。物理包埋淀粉(physically trapped starch,RS1)是指由于细胞壁的包埋或蛋白质成分的阻隔作用而难以被淀粉酶接触的淀粉颗粒,主要存在于完整的或部分研磨的谷物、种子及豆类中[2];天然淀粉颗粒(resistant starch granules,RS2)是指由于紧凑的构象或结构而不被淀粉酶水解的淀粉颗粒,主要存在于生马铃薯和绿香蕉中[2];老化淀粉(retrograded starch,RS3)是指淀粉经过加热糊化、冷却回生重新聚合而形成的重结晶组分,主要存在于即食早餐谷物、面包、煮熟后冷却的马铃薯中[3-4];化学改性淀粉(chemically modified starch,RS4)主要是指通过醚化、酯化及交联等化学方法引入新的化学官能团至淀粉分子内部,使分子结构发生改变而产生酶抗性的一类淀粉[5-6];直链淀粉-脂质复合物(amylose-lipid complexed starch,RS5)是近几年新发现的一类抗性淀粉,在外加条件的作用下,直链淀粉形成左手螺旋空腔结构,脂质进入直链淀粉的螺旋空腔发生不同程度的复合[7-8]。
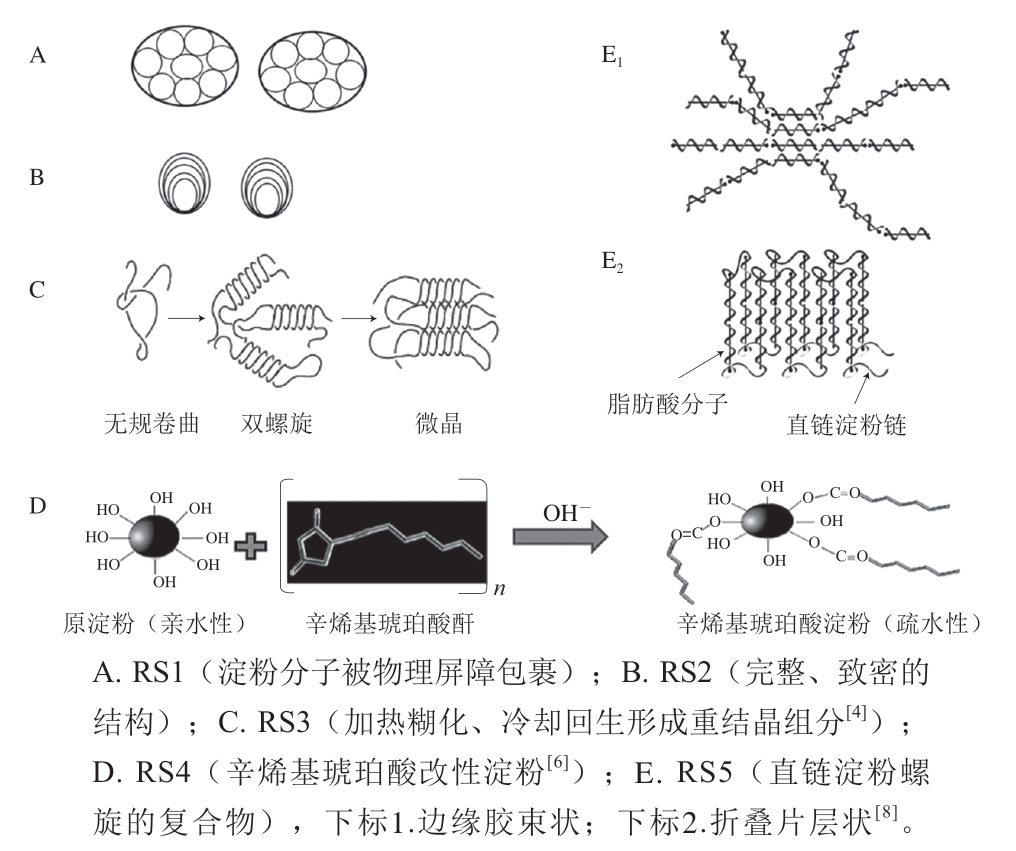
图1 不同类型抗性淀粉的结构模拟示意图
Fig. 1 Structural models of different types of RS
在5 种类型的抗性淀粉中,RS1和RS2稳定性较差,RS1易受咀嚼或碾磨、粉碎等过程的影响,导致抗性淀粉含量减少,RS2热稳定性相对较差,蒸煮过程会破坏其抗酶解特性,使其易转变为快速消化淀粉,而RS3、RS4和RS5在加热或咀嚼过程中比较稳定[9-10]。淀粉结构包括精细结构、螺旋结构、结晶结构、层状结构、短程有序结构和表观形貌结构,任何一类抗性淀粉均具备上述几个层次结构。当前研究尚未揭示不同抗性淀粉的特有结构特征。而抗性淀粉结构与消化特性之间存在一定的内在关联,国内外已有一些学者对此进行了分析和探讨。Chi Chengdeng等[11]综述了淀粉多尺度结构(直链淀粉和支链淀粉的精细结构、短程有序结构、螺旋、结晶、层状、聚集结构以及食品加工后形成的结构)对淀粉消化率的影响,总结了调控淀粉消化率的关键结构,建立了降低淀粉消化率的基本原则,如增加半结晶片层和结晶片层的厚度以及纳米级聚合物、V/A/B型晶体、双螺旋、长支链淀粉螺旋、短程有序结构、直链淀粉组分和高支链淀粉的含量。此外,Chi Chengdeng等[12]还提到,通过酶处理能够显著增加高分支支链淀粉的含量,减缓淀粉的消化;通过遗传或酶处理的方式增加直链淀粉含量和延长支链淀粉链长,水热处理以及与非淀粉成分的络合可以促进淀粉重组形成螺旋和结晶结构,从而导致淀粉消化率下降。Li Cheng等[13]对淀粉链长分布及与其理化性质的关系进行了分析,结果表明淀粉的糊化和消化特性在很大程度上受链长分布的控制。Mohamed等[14]的综述重点介绍了导致淀粉理化性质和消化性能变化的一些机制,讨论了淀粉、蛋白质和脂肪酸之间的三元复合物,并推测这些大分子之间的相互作用。周梦露等[15]总结了蛋白质对谷物淀粉糊化、回生以及消化性的影响。李部[16]、常然然[17]和涂园[18]等也针对淀粉结构与消化特性进行了一系列研究。
抗性淀粉作为一种新型膳食纤维,能够调节肠道菌群组成,促进有益菌增殖和抑制致病菌增殖,并生成乙酸、丙酸、丁酸等短链脂肪酸(short chain fatty acids,SCFAs),对保护肠道屏障、降低肠道通透性等具有重要的作用。此外,抗性淀粉还参与调节糖脂代谢,在控制体质量、降脂、预防糖尿病等方面发挥有益作用[19-20]。不同类型的抗性淀粉在调节肠道菌群及维护机体健康等方面存在差异。近几年,国内外研究者对抗性淀粉的结构特征、发酵特性、生理功能以及抗性淀粉与肠道菌群的关联等进行了大量研究。Xu Hanbin等[21]对淀粉结构的表征方法及其应用进行了全面综述。Liu Guodong等[22]总结了脱支淀粉的颗粒形态、分子组成、晶体结构和螺旋结构、功能以及应用前景;Wang Xu等[23]根据近30 年的文献,从整体上总结并阐明了淀粉研究的主题、趋势和知识结构。Ma Zhen等[3,24]综述了RS3形成机理和不同加工条件下RS3结构特征变化,介绍了不同加工条件制备抗性淀粉的结构表征,探讨了抗性淀粉的结构与生理特性之间的潜在关系。Wen Jiajia等[25]主要从抗性淀粉的定义与类型、抗性淀粉作为膳食纤维对健康的影响、抗性淀粉影响肠道微生物群以及抗性淀粉的应用几个方面进行了分析和探讨。Fang Fang等[26]综述了用于改善肠道健康的天然和人造纤维基质,重点介绍了肠道微生物群的变化及其产生的代谢物。林炎等[27]也对抗性淀粉结构特性与肠道菌群调节功能的关联进行了分析探讨。何书琪等[28]通过构建“RS-肠道菌群-代谢产物”营养轴系统,总结了抗性淀粉通过调节肠道菌群及肠道代谢物改善代谢性疾病的作用机制。Li Cheng等[29]总结了当前抗性淀粉类型定义中的缺陷,从抗性淀粉发酵速率、发酵终产物、对肠道菌群的特异性等角度重新定义抗性淀粉的类型。本综述介绍不同类型抗性淀粉的表观形貌结构与多尺度结构特征,比较不同类型抗性淀粉对肠道菌群、SCFAs生成情况、肠道健康以及糖脂代谢的影响,并对抗性淀粉类型与肠道菌群调节功能之间的潜在关联进行分析和探讨。
1 抗性淀粉的多尺度结构特征
1.1 不同类型抗性淀粉的表观形貌结构特征
抗性淀粉的表观形貌结构一般可通过扫描电子显微镜(scanning electron microscope,SEM)、环境扫描电子显微镜(environmental scanning electron microscope,ESEM)、激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)和原子力显微镜(atomic force microscope,AFM)等设备进行观察分析。RS1和RS2是天然存在的抗性淀粉,天然淀粉颗粒通常表现为表面光滑的不规则球形或椭球形。据报道,高直链玉米淀粉呈光滑的球形和细长棒状颗粒状[30]。RS3一般表现为不规则的片状聚合结构。例如,采用高温高压处理和普鲁兰酶脱支的高直链玉米淀粉,冷却回生后可得到抗性淀粉(RS3),结果显示,未处理的高直链玉米淀粉为圆形颗粒和多角颗粒的混合物,而抗性淀粉表观结构变得松散、粗糙、破碎,双折射交叉现象消失[31]。超声波高压蒸煮法制备的薏苡仁RS3淀粉颗粒呈现孔洞状结构,这可能是由于超声波的空化作用;高压蒸煮法和酶高压处理法制备的RS3表面具有浅层条带;微波处理法制备的RS3表面具有深层条带,形成密集的条纹状沟壑,这可能是微波的快速导热机制导致其表面更加粗糙[32]。通过杂豆原料所制得的RS3呈现出不规则、紧密的块状堆积形态,表面粗糙且有分层,这可能是压热处理过程中,淀粉颗粒溶胀及其部分成分溢出,从而导致出现抗性淀粉回生重结晶时重排的分子链和新的结晶结构组成的连续基质[33]。
通过化学改性法所制备的RS4基本能够保持相对完整的颗粒结构。Xu等[34]采用乙酰化技术对籼米淀粉进行化学改性,原生大米淀粉颗粒呈不规则多边形,改性后的RS4淀粉颗粒形状发生变化,淀粉颗粒表面粗糙,结构中空,但仍然保持了相对完整的颗粒结构,随着乙酰化程度的增加,分子间氢键断裂,导致更多的淀粉颗粒被破坏。另一项研究也表明,随着乙酰化程度的加深,淀粉颗粒表面出现大小不等的小孔[35]。Xia Huiping等[36]对RS4型甘薯抗性淀粉的研究结果显示,仅经过湿热处理后的淀粉颗粒呈球形、多边形或椭圆形,淀粉颗粒的形状和完整性没有发生明显变化,表面有凹陷;而柠檬酸酯化抗性淀粉与湿热处理柠檬酸酯化抗性淀粉(RS4)则出现了塌陷和碎片。羟丙基化制备RS4的SEM图显示,淀粉颗粒形态的差异可能是由于羟丙基化水平的差异,更高的羟丙基含量导致淀粉颗粒表面粗糙,出现凹痕和颗粒碎块[37]。RS5形状更加不规则,在偏振光下可以观察到较强的双折射[38]。Garcia等[39]利用透射电子显微镜观察到,直链淀粉与单硬脂酸甘油酯交织形成聚集链结构。
1.2 不同类型抗性淀粉的多尺度结构特征
X射线衍射(X-ray diffraction,XRD)可用来表征抗性淀粉的晶型并量化其相对结晶度,但存在一定的局限性,通常与高分辨率13C固体核磁共振(solid state 13C nuclear magnetic resonance spectroscopy,13C NMR)和小角X射线散射(small angle X-ray scattering,SAXS)等技术结合使用。XRD能够反映淀粉颗粒的长程有序结构(即双螺旋的堆积),通过XRD图谱中的衍射峰可分析淀粉颗粒晶型,衍射峰的面积与总面积的比通常被用来表征抗性淀粉的相对结晶度[40]。一般利用高分辨率13C NMR技术分析淀粉短程有序结构(即亚晶区、非晶区的短链有序结构和重叠的晶体,以及在无定形区的双螺旋结构),通过13C NMR图谱不仅可获得淀粉的晶型结构特征,还可以进一步拟合计算出淀粉相对结晶度、非晶相比例以及单/双螺旋含量[41]。傅里叶变换红外光谱主要反映淀粉分子内部原子间伸缩振动、分子间转动和短程有序结构等相关信息,通过分析计算峰强度比995/1 022 cm-1和1 047/1 022 cm-1,可以进一步确定淀粉颗粒有序度和双螺旋度的变化[42]。高效分子筛排阻色谱仪、凝胶渗透色谱仪、高效阴离子交换色谱和荧光团辅助碳水化合物电泳可用于测定抗性淀粉的分子质量分布和链长分布等。综合利用这些技术,可以全面分析抗性淀粉的结构特征[23]。
根据XRD图谱可将抗性淀粉的晶体类型分为4 类,即A、B、C型和V型[40]。A型晶体由平行的左手双螺旋链组成,具有排列紧密的单斜晶胞;B型晶体由平行的左手双螺旋链组成,具有六角形晶胞,其结构中包含更多的水分子;V型晶体与A型和B型晶体不同的是,它是由许多复杂片段的单个直链淀粉螺旋与内源性脂质复合而成的;而A型和B型晶体的复合物则使XRD图谱呈现出C型晶体。抗性淀粉颗粒的晶型通常与其来源以及加工方式等有关。
据报道,高直链玉米淀粉含有74.6%~84.6%的B型晶体和15.4%~22.6%的V型晶体,结晶度在0.154~0.170之间[43]。杂豆原淀粉为典型的C型晶体,而压热处理后的杂豆淀粉主要表现为B型晶体,同时还出现了V型晶体特征峰[33]。研究表明,焙烤和发芽小扁豆淀粉的晶型与生小扁豆淀粉相同,均为C型,且相对结晶度差异也较小;而小扁豆经过发酵、蒸煮、微波和高压处理后,淀粉的晶型变为B+V型,相对结晶度显著降低[44]。Zhou Dingting等[45]研究了从天然、不同加工处理的豌豆淀粉样品中分离的抗性淀粉的多尺度结构,加工处理制备的RS3样品与天然豌豆淀粉中分离得到的RS2相比,结晶度和有序度显著升高,其中酸解-压热处理的豌豆抗性淀粉含量最高。有报道称,糊化淀粉在25 ℃老化时易生成A型晶体,而老化温度为4 ℃时,低温条件能够促进直链淀粉分子聚合,从而更易产生B型晶体[46]。Zeng Feng等[47]通过对脱支糯玉米淀粉进行反复老化处理制备RS3,发现随着老化次数增加,抗性淀粉相对结晶度增大,结晶结构表现为B+V型,多次重结晶处理可能导致直链淀粉分子间缔合程度增大,分子间排列也更加紧密。
Mun等[48]研究发现,RS3和RS4分别为B型和A型晶体。有研究表明,低乙酰化RS4的XRD图谱与天然淀粉相似,均为A型晶体,随着乙酰含量的增加,相对结晶度逐渐降低[34]。柠檬酸酯化得到的RS4也具有相似的结构特征[36]。Chang Fengdan等[49]通过XRD图谱分析发现,高直链玉米淀粉与月桂酸形成的复合物(RS5)表现为V型晶体。RS5的相对结晶度主要取决于直链淀粉含量和反应温度,研究发现长直链淀粉较短直链淀粉更容易与脂质复合[50]。Chang Fengdan等[49]将高直链玉米淀粉分别在80、85 ℃和90 ℃条件下与月桂酸复合,复合物相对结晶度分别为25.3%、28.7%和29.5%,说明相对结晶度随温度升高而逐渐增加。另外,先将高直链玉米淀粉用普鲁兰酶进行脱支,再与月桂酸生成复合物(RS5),XRD图谱显示为B型和V型的混合物,在0~24 h的脱支处理时间内,复合物相对结晶度由29.4%上升至41.8%,相对结晶度随脱支时间的延长而增加[38]。
有报道称,与原淀粉相比,经过脱支处理和脱支-湿热复合处理所制备的抗性淀粉中聚合度小于13的淀粉组分含量降低,而聚合度在13~30之间以及聚合度大于30的淀粉组分含量增加[51]。Giuberti等[52]比较了湿热处理所得的抗性淀粉和普鲁兰酶脱支所获得抗性淀粉的结构特征,结果表明湿热处理可以促进淀粉结晶和非晶区域内的结构变化,而酶脱支处理可以从支链淀粉中获得更多的线性短链结构,从而提高抗性淀粉的产量。研究表明,小扁豆经发酵、蒸煮、微波和高压加工后,淀粉发生不同程度的降解,淀粉中的短链线性分子数量变多,淀粉的平均分子质量降低了1 个数量级,其中高压处理效果最明显;与生小扁豆淀粉相比,抗性淀粉的双螺旋含量和短程有序结构变化幅度不大,说明小扁豆经过这几种加工,降解的淀粉分子重新排列为新的双螺旋结构,具有较高的短程有序结构[44]。Zeng Shaoxiao等[53]研究表明,经超声-蒸压法制备的抗性淀粉的平均分子质量最高,而蒸压法制备的抗性淀粉平均分子质量最低,抗性淀粉的多分散性指数也低于天然淀粉,表明天然淀粉的直链淀粉含量可能高于其他类型的淀粉。另一项研究也得到了类似的结果,表明RS3制备过程中容易形成稳定的双螺旋结构,淀粉分子整体有序水平升高[54]。Zhou Dingting等[45]指出,抗性淀粉样品的重均相对分子质量MW范围为2.448×104~9.750×106,其中压热处理的豌豆抗性淀粉(RS3)最高,天然豌豆抗性淀粉(RS2)最低。据报道,以普通玉米淀粉为原料用压热法制备的抗性淀粉,其相对分子质量绝大部分分布于6 300~35 000之间,重均相对分子质量MW=18 614,数均相对分子质量MN=12 681[55]。
2 不同类型及不同结构抗性淀粉对肠道菌群的调节功能
2.1 具有降解抗性淀粉能力的主要肠道微生物
布氏瘤胃球菌(Ruminococcus bromii)和青春双歧杆菌(Bifidobacterium adolensentis)是被广泛认可的抗性淀粉主要降解菌。布氏瘤胃球菌是人体肠道菌群的主要成员,具有独特的淀粉酶结构,可以形成多酶复合物附着在细胞表面,对抗性淀粉具有特殊的活性,是降解抗性淀粉的关键菌种[56]。布氏瘤胃球菌降解抗性淀粉释放的糖和乙酸可作为其他不具备降解抗性淀粉能力肠道微生物的底物,从而使抗性淀粉发挥有益作用[57-58]。青春双歧杆菌与布氏瘤胃球菌具有相似的作用,能够降解抗性淀粉生成乳酸和糖[59]。抗性淀粉降解菌本身无法产生丁酸,抗性淀粉的产丁酸特性要通过其他肠道微生物才得以产生。例如,直肠真杆菌是一种共生细菌,长期以来一直与丁酸盐的产生有关[60]。
2.2 不同类型抗性淀粉对肠道菌群的影响
抗性淀粉在肠道中发酵可选择性调节特定肠道菌群的水平,不同类型的抗性淀粉对肠道菌群结构和动态的影响存在差异。研究发现,分别从天然、普鲁兰酶脱支及酸水解豌豆淀粉中分离得到的抗性淀粉体外发酵24 h后,酶解处理抗性淀粉(RS3)组厚壁菌门相对丰度明显增加、变形菌门相对丰度最低;各处理组放线菌相对丰度都显著增加,其中天然豌豆抗性淀粉(RS2)最为明显[61]。Liang Dan等[62]以RS1、RS2、RS3和RS4为研究对象,经体外发酵24 h后,所有抗性淀粉组肠道菌群组成发生显著变化,厚壁菌门/拟杆菌门比值均显著降低(P<0.05),其中RS2组最低。此外,RS4组双歧杆菌属的相对丰度显著增加,而RS2组则促进了巨单胞菌属和普雷沃氏菌属的增殖。Qin Renbing等[63]研究比较3 种抗性淀粉RS2、RS3和RS5的体外发酵能力,结果显示,与其他组相比,RS3组和RS5组的双歧杆菌属、布劳特氏菌属、巨单胞菌属等显著富集,而在RS2组中,肠单胞菌等的相对丰度显著增加。Sorndech等[64]以不同类型的RS(RS2、RS3、RS4)为唯一碳源对健康志愿者粪便中的细菌进行体外培养,对培养的样品进行微生物组变化分析发现,各处理组均能刺激双歧杆菌和乳酸菌的生长,抑制梭状芽孢杆菌和拟杆菌的生长,其中RS3组效果最明显。另一项对这3 种抗性淀粉的研究发现,RS2和RS3显著改变了个体肠道微生物组的蛋白表达,而RS4没有显著改变;此外,RS3组双歧杆菌属丰度显著增加[65]。有研究表明,RS2可促进直肠真杆菌和布氏瘤胃球菌的增殖[66-67]。Zeng Hongliang等[68]通过无糖MRS培养基体外培养,研究莲子抗性淀粉(RS3)对肠道益生菌体外增殖的影响,结果发现RS3主要促进双歧杆菌与乳杆菌的增殖。Wang Shaokang等[69]的研究表明RS4增加了梭菌属、布劳氏菌属和罗斯氏菌属等的相对丰度,降低了粪杆菌属和瘤胃菌属的相对丰度。Zhou Qianwen等[70]的研究表明RS5增加了罗斯氏菌属和普雷沃氏菌属的相对丰度。
如表1所示,研究者们对抗性淀粉进行了大量体内研究。Kieffer等[71]以高直链玉米淀粉RS2喂养慢性肾病模型的大鼠,结果显示肠道内放线菌门和变形菌门的相对丰度显著增加,厚壁菌门的相对丰度显著降低,拟杆菌门与厚壁菌门比值增加。另一项研究表明,喂食RS3的小鼠肠道细菌多样性水平低于正常组以及高直链玉米淀粉组,且小鼠的肠道中乳酸菌属、双歧杆菌属、毛螺菌科、瘤胃菌科等淀粉利用菌的数量增加,而理研菌科和紫单胞菌科数量则降低[72]。Kawakami等[73]研究发现,以饲料补充剂RS2饲养的大鼠盲肠内容物的厌氧菌水平高于以饲料补充剂RS3饲养的大鼠。Xu Jiangbin等[74]分别从未处理和压热处理的小扁豆淀粉中分离出RS2和RS3,二者均有效地抑制了高脂饮食诱导的小鼠肠道菌群变化,厚壁菌门与拟杆菌门的比值明显降低,其中RS3组(3.24)比RS2组(7.05)的作用更显著;RS3和RS2的结构表征结果表明,二者的超分子结构存在显著差异,其中RS3被分类为CB型晶体,表现出较高的结晶度比例、双螺旋含量及更均一的分子质量分布。有报道称,丙酰化抗性淀粉能够改变小鼠肠道菌群组成结构,促进瘤胃球菌属等有益菌的增殖,降低由高脂饮食引起的颤螺菌属、乳酸菌属和螺杆菌属相对丰度的升高[75]。另一项研究表明,柠檬酸乙酰化甘薯淀粉、羟丙基交联甘薯淀粉及交联辛烯基琥珀酸酯化甘薯淀粉3 种RS4能不同程度改善高脂饮食小鼠肠道菌群,维持肠道菌群多样性,其中前两者效果优于第三者[76]。
Martinez等[80]研究比较了RS2和RS4对人类个体粪便微生物群的影响。10 名健康志愿者连续3 周食用含有RS2、RS4或原淀粉的饼干,结果表明,两种抗性淀粉均可导致粪便菌群组成发生显著变化,且两者对群落结构的影响存在差异。在门水平上,RS4显著增加了放线菌门和拟杆菌门的相对丰度,而抑制了厚壁菌门的增殖;在种水平上,RS4促进青春双歧杆菌和狄氏副拟杆菌的增殖,而RS2显著提高了布氏瘤胃球菌和直肠真杆菌的比例。RS2和RS4对人类粪便微生物群组成的影响存在差异,可能是由于这两者的结构特征决定了其在肠道菌群中的可及性:RS2是一种颗粒状的高直链玉米淀粉,而RS4是一种通过磷酸基交联的化学改性淀粉,不同的肠道微生物对RS2和RS4颗粒的黏附能力可能存在差异,对这两种RS类型产生不同活性的酶,从而促进肠道菌群的不同组成。另一项研究发现,14 名超重男性连续10 周进行高RS3饮食后,粪便中布氏瘤胃球菌和直肠真杆菌的相对丰度显著增加[81]。一项对20 名代谢综合征患者肠道微生物群组成的研究表明,RS4能够显著富集青春双歧杆菌和狄氏副拟杆菌等[82]。
抗性淀粉对肠道菌群的不同作用,可能主要是由于其结构的差别,大量研究表明抗性淀粉的结构特征与肠道菌群之间存在密切联系。例如,莲子抗性淀粉(RS3)表面粗糙,具有明显的分层条状和特殊沟壑状表观结构,而益生菌(特别是双歧杆菌)对这种特殊结构更具敏感性,能够更好地利用抗性淀粉,从而促进自身增殖[84-85]。Huang Yaping等[86]也指出,抗性淀粉对短双歧杆菌的黏附力、增殖作用可能与抗性淀粉的表面微观结构和结晶度差异有关。其采用不同处理方式制备莲子抗性淀粉,结果表明,抗性淀粉都形成了鳞片状和沟壑状的表面微观结构、B型晶体结构和轻微变化的双螺旋结构,但微波处理的抗性淀粉结晶度更高,双螺旋结构更紧密,对短双歧杆菌的黏附力最高,增殖作用最强。Lesmes等[87]研究比较A型和B型晶体对肠道菌群调节功能的差异,人粪便体外发酵24 h后,A型晶体和B型晶体发酵过程中的总细菌数没有显著差异,但对肠道中主要菌群进行分析时发现,B型晶体主要诱导双歧杆菌增殖,增加丁酸产量,而A型晶体主要诱导拟杆菌增殖,此外,B型晶体促进了双歧杆菌在结肠近端的生长,并使其在远端结肠微生物群中的相对比例增加一倍。另一项研究表明,不同晶体类型的微生物群落结构相似,但对关键细菌种类的影响不同,A型晶体极大地促进了产丁酸菌的丰度,而B型晶体则倾向于促进产丙酸菌增殖[88]。Zeng Hongliang等[85]也提出,更多的有序结构和双螺旋结构对青春双歧杆菌和嗜酸乳杆菌的益生元活性更强。Gu Fangting等[89]研究了5 种不同直链淀粉含量(相对含量19.1%~40.6%)大米淀粉对肠道菌群的影响,结果表明,当RS3中聚合度在36~100之间的链更多、RS3分子尺寸较小时,显著增加布劳特氏菌属等的丰度;而聚合度在36~100之间的链较少或分子尺寸较大的抗性淀粉则可以促进其他肠道菌群的增殖。抗性淀粉的平均分子质量也会对肠道菌群的调节功能产生影响,如林姗[90]报道,莲子抗性淀粉的平均分子质量越小,其对益生菌的增殖效果就越弱。
表1 不同类型抗性淀粉的肠道菌群调节功能(体内实验)
Table 1 Intestinal flora-regulatory effect of different types of RS evaluated by in vivo tests

结论 参考文献腺嘌呤诱导的慢性肾病SD雄性大鼠实验对象 抗性淀粉类型 干预剂量/实验期模型(10 周龄) RS2 59%(质量分数,下同);3 周 细菌种类平均减少15%,促进放线菌门和变形菌门增殖,抑制厚壁菌门增殖,拟杆菌门与厚壁菌门比值升高;放线菌门中双歧杆菌属比例升高 [71]BALB/c雄性小鼠(体质量(18.0±1.0)g)RS2 RS3 10% RS2,5%、10%和15% RS3;15 d RS3组乳酸菌属、双歧杆菌属、毛螺菌科、瘤胃菌科及梭菌属等淀粉利用菌和产丁酸菌丰度增加,理研菌科和紫单胞菌科数量减少;RS3组乳酸和SCFAs水平高于RS2组 [72]Fischer雄性大鼠(7 周龄) RS2 RS3 30%;4 周 RS2组厌氧菌、乳酸杆菌属、双歧杆菌属丰度高于RS3组;RS2组乙酸、丙酸、丁酸及总SCFAs含量高于RS3组 [73]BALB/c雄性小鼠(体质量(31.86±1.95)g)RS2 RS3 400 mg/kg mb;6 周 厚壁菌门与拟杆菌门的比值降低,其中RS3作用更显著 [74]C57BL/6J雄性小鼠(体质量(21±2)g) RS4 150 g/kg饲料;12 周 RS4型抗性淀粉能不同程度改善高脂饮食小鼠的肠道菌群,维持肠道菌群的多样性 [76]健康猪(3 月龄) RS3 40%;12 周 毛螺菌科和瘤胃球菌属丰度增加,α-多样性降低 [77]健康成人(17~29 岁) RS2 40 g/d;3 周 马铃薯RS2组双歧杆菌和布氏瘤胃球菌等丰度增加,丁酸及总SCFAs含量升高;玉米RS2组丁酸含量没有显著增加 [78]健康成人(18~55 岁) RS2 40 g/d;4 周 补充RS2后,某些肠道微生物显著减少,而布氏瘤胃球菌的丰度增加 [79]健康成人(23~38 岁) RS2 RS4 33 g/d;3 周 RS2组布氏瘤胃球菌和直肠真杆菌丰度增加;RS4组放线菌门和拟杆菌门丰度增加,厚壁菌门丰度减少 [80]超重男性(27~73 岁) RS3 5.5 mJ/kg;3 周 布氏瘤胃球菌和直肠真杆菌丰度增加 [81]代谢综合征患者 RS4 30%;12 周 拟杆菌属3 个物种,副拟杆菌属、颤螺旋菌属、布劳氏菌属、瘤胃球菌属、克里斯滕森菌属以及真杆菌属各1 个物种丰度增加;乙酸、丙酸、丁酸及总SCFAs含量升高 [82]健康成人(18~50 岁) RS4 每周逐渐增加到10、20、35、50 g/d;4 周玉米RS4组促进青春双歧杆菌、直肠真杆菌、颤杆菌克属及瘤胃球菌属增殖;木薯RS4组促进青春双歧杆菌、紫单胞菌科及副乳杆菌属等增殖;马铃薯RS4组肠道菌群相对丰度无显著变化 [83]
2.3 不同类型抗性淀粉对SCFAs生成情况的影响
肠道菌群通过部分或完全发酵饮食中无法被酶完全水解的底物产生SCFAs(包括乙酸、丙酸、丁酸等),结肠是人体内产生SCFAs的主要部位。SCFAs的种类和数量主要受个体肠道内环境、发酵位置、底物种类以及发酵菌种(如淀粉利用菌、丁酸产生菌等)等诸多因素的影响,从而导致其在肠道功能、机体健康等方面发挥的作用也有所不同[91]。乙酸主要是由双歧杆菌和乳酸菌发酵碳水化合物产生的,参与某些物质的合成和代谢,可作为宿主的能量来源,进入机体后为周边组织提供所需能量,是机体从抗性淀粉中获取能量的主要途径[92]。丙酸主要由拟杆菌门发酵产生,被肠道吸收后能够抑制肝脏细胞胆固醇的合成,通过丙酮酸转化成葡萄糖可为肝脏代谢提供能量[93]。丁酸是厚壁菌门的主要代谢产物,能够被结肠上皮细胞分解利用作为其主要能量来源[94]。虽然乙酸和丙酸都有一定的益处,但丁酸在人类肠道健康中发挥着重要作用,具有抗癌、抗炎作用以及改善肠道屏障功能的重要作用[95-96]。此外,肠道菌群可通过乙酰辅酶A途径将乙酸和乳酸转化为丁酸[72],例如,乙酸可被拟杆菌等乙酸利用菌进一步利用而转化为丁酸[97]。异杆菌、双歧杆菌和雷尔氏菌等能够促进乳酸转化为丁酸[98]。
Lehmann等[99]发现以RS2为底物时,体外发酵后SCFAs含量为370~1 800 μmol/g,以RS3作为底物时,体外发酵后SCFAs含量为890~2 100 μmol/g,且RS3发酵产生更多的丁酸。有研究指出,RS3会影响小鼠粪便中的总SCFAs和乳酸的生成量,并可通过肠道菌群将乳酸发酵为丁酸[72]。Liang Dan等[62]对不同类型的抗性淀粉(RS1~RS4)进行体外发酵,在整个发酵过程中,所有抗性淀粉组的pH值都呈现出相似的下降趋势,各组乙酸、丙酸和丁酸含量均显著升高,其中RS4组乙酸含量高于其他各组,RS2和菊粉组产丁酸量高于其他组,RS2组和RS3组丙酸含量高于其他组。Sorndech等[64]指出,与RS2和RS4相比,RS3发酵24 h后利用率最高,pH值较低,产生大量的SCFAs(尤其是丁酸),而RS2的底物利用率最低,这可能是由于RS2的颗粒结构更加紧凑,限制了粪便中细菌的降解活性。另一项对RS2、RS3和RS5进行体外发酵的研究表明,RS2、RS3和RS5组的pH值逐渐降低,但RS3和RS5较RS2更大程度上降低了发酵培养物的pH值,说明RS3和RS5可被肠道菌群更有效地发酵;此外,与RS2和RS5相比,RS3的相对结晶度较高,产生的乳酸也最多,而RS5组的丁酸含量最高[63]。
同类型抗性淀粉来源不同、细微结构差异等也会导致发酵产生SCFAs含量的不同。体外发酵实验表明,RS1发酵产生的丁酸浓度随着细胞壁完整性的减弱而增强[100]。据报道,马铃薯RS2和玉米RS2发酵后SCFAs的含量存在差异,前者发酵后丁酸及总SCFAs含量显著增加,而后者丁酸含量没有明显变化[78]。对普通玉米淀粉和高直链玉米淀粉进行热处理制备抗性淀粉(RS3),热处理能够降低普通玉米淀粉分子原有的有序性结构,生成的抗性淀粉属于快速发酵型底物,发酵后会产生大量的乳酸和乙酸,且丁酸的合成会受到抑制;而对于高直链玉米淀粉,热处理对淀粉结构影响不明显,抗性淀粉仍保留较高的分子结构有序性,其发酵模式属于缓速发酵型,这样的模式有利于生产高浓度的丁酸[101]。Zhou Dingting等[61]的研究表明,不同加工处理制备的抗性淀粉体外发酵24 h后,各处理组的乙酸、丙酸及丁酸含量均有所下降,其中,与酶解豌豆抗性淀粉(RS3)和天然豌豆抗性淀粉(RS2)相比,酸解豌豆抗性淀粉(RS3)发酵后的丙酸和丁酸含量较低。有报道称,3 种化学改性淀粉RS4的微小结构差异对肠道菌群具有高度特异性的影响,从而能够直接改变丙酸或丁酸产量[83]。Li Lingjin等[102-103]指出,丁酰化淀粉能够增加发酵后丁酸盐和总SCFAs含量。此外,该学者采用3 种不同来源的淀粉制备丁酰化淀粉,丁酰化糯玉米淀粉颗粒内部发生了较大程度的取代,其颗粒表面的多孔形态有助于加快发酵速度。另一项研究表明,不同取代度的丙酰化抗性淀粉在体外酵解过程中表现出相似且缓慢的酵解速率,但酵解产生的丙酸浓度随着取代度的升高而升高[75]。据报道,脱支高直链淀粉与不同饱和脂肪酸的复合物发酵速率相似且缓慢,发酵后丁酸浓度没有观察到显著差异,但丙酸浓度存在显著差异[70]。Zhou Zhongkai等[104]通过静态厌氧体外培养系统研究了由生和熟高直链淀粉制备的抗性淀粉结构对SCFAs产量的影响,结果表明,具有较大分子(支链淀粉组分)的抗性淀粉比未含支链淀粉组分的抗性淀粉具有更高的丁酸产量。此外,研究表明,A型晶体比例较高的RS3发酵特性较差,降解速率较慢,微生物产生的总SCFAs和丁酸含量较低,而B型晶体比例较高的RS3具有较好的发酵能力,能够获得较高的总SCFAs和丁酸水平[105-106]。抗性淀粉能够促使丁酸含量显著增加,但对个体反应的进一步分析发现,丁酸含量的变化存在差异[107]。Walker[81]和Alfa[108]等的研究也得到了类似的结果。
2.4 不同类型抗性淀粉对肠道健康的影响
肠道菌群(瘤胃球菌和双歧杆菌等)利用抗性淀粉发酵产生SCFAs,可降低肠道环境pH值,从而抑制肠道中耐酸性较差的致病菌的生长繁殖,同时抗性淀粉降解产生的气体还能够使粪便体积蓬松增大,促进肠道蠕动,维护肠道健康,降低结肠癌的发病率[107]。饮食补充抗性淀粉对改善机体肠道功能、预防或治疗结肠炎、降低结肠癌等肠道疾病的发病率具有重要作用。不同类型的抗性淀粉在肠道中有着不同的发酵模式,因此对肠道环境产生的影响也不完全相同[109]。
将抗性淀粉应用于动物模型,研究不同类型抗性淀粉对肠道健康的影响。在小鼠饲料中分别添加15%的抗性淀粉(RS2、RS3和RS4),3 种抗性淀粉组的盲肠总质量、盲肠壁质量和盲肠内容物湿质量都明显增加,其中RS3组测得以上指标水平最高,抗性淀粉可改变小肠和盲肠的生理结构,如使盲肠的绒毛高度和黏膜厚度显著降低,盲肠的肌肉厚度显著增加等,但与对照组小鼠相比,并没有引起小肠和盲肠可检测到的病理变化[110]。另一项针对RS2、RS3和RS4的研究表明,在控制体质量方面,RS4组大鼠体质量增加量最小;在调节大鼠肠道代谢产物方面,RS3效果最优;在调节血脂方面,RS3对血清甘油三酯的降低效果最显著,平均降低水平可达30%左右,而RS4对血清胆固醇的调节效果最优[111]。
le Leu等[112]利用右旋糖酐硫酸钠(dextran sulphate sodium,DSS)诱导小鼠结肠炎模型,研究在红肉饮食中添加RS2和不添加RS2对结肠炎的影响,疾病活动指数和组织病理学评分结果显示,高红肉饮食加重了DSS诱导的结肠炎,而添加RS2对结肠炎具有一定的缓解作用。le Leu等[113]另一项研究饲喂大鼠含有0%、10%、20%高直链玉米淀粉RS2的饲料4 周,之后利用偶氮甲烷诱导结肠癌25 周,对结肠癌发病率进行评估,结果显示10%和20%高直链玉米淀粉组都抑制了结肠肿瘤的发展,增加了SCFAs含量。Bauer-Marinovic等[114]给结肠癌大鼠饮食中添加RS3,结果表明,与对照组大鼠相比,RS3抑制了肿瘤的发展,说明RS3可能促进了结肠癌细胞凋亡、减少了结肠癌细胞增殖。以双重修饰籼米抗性淀粉饲喂早期结肠癌小鼠,发现小鼠异常隐窝灶数量减少,抗性淀粉可通过调控相关基因的表达诱导癌细胞凋亡[115]。另一项研究也表明,RS5可有效预防结肠癌前病变[116]。
目前,关于抗性淀粉对人体肠道健康的作用也相继有文献进行了报道。Dronamraju等[117]将65 例术前结肠癌患者随机分为2 组,令其分别摄入RS3或普通淀粉,持续4 周。结肠隐窝上部细胞增殖是一种癌症标志物,RS3组结肠隐窝上部有丝分裂细胞比例显著降低,表明RS3可能对结肠癌具有一定的生理功能,但RS3治疗对隐窝大小和肿瘤细胞增殖指数无影响。有研究表明,在结肠癌患者中,摄入抗性淀粉或安慰剂对于结肠细胞增殖的影响没有明显差异[118]。另一项研究中,23 例结肠腺瘤切除术后患者,持续4 周每天食用45 g天然高直链玉米淀粉(含28 g RS2)或麦芽糊精(安慰剂),结果表明,食用RS2受试者的粪便胆汁酸浓度降低15%,但结肠细胞增殖、粪便干湿质量、pH值以及SCFAs没有明显变化[119]。一项随机、安慰剂对照实验中,抗性淀粉组和安慰剂组对结肠癌的发病风险没有显著差异[120]。未来可以考虑进行临床前或临床长期饮食干预,以探讨抗性淀粉对炎症性肠病或结肠癌的预防或改善作用。
2.5 不同类型抗性淀粉对糖脂代谢的影响
近几十年来,随着人们生活水平的提高与生活方式的改变,肠道健康问题不仅给临床医学带来严峻考验,2型糖尿病(type 2 diabetes mellitus,T2DM)发病率也急剧上升,成为全球人类健康的一大威胁[121]。据估计,到2030年,全球2型糖尿病患者将达到4.39亿[122]。肥胖症作为一种健康问题和慢性疾病(如2型糖尿病、心血管疾病和癌症)的诱发因素,近年来在全球范围内也呈上升趋势[123]。除了药物治疗外,饮食摄入高含量抗性淀粉可以修复胰腺损伤、提高肝糖原合成能力,进而控制血糖水平,对预防肥胖和2型糖尿病等多种代谢疾病具有重要意义[124-125]。此外,肠道菌群与肥胖、糖尿病之间的关系已引起越来越多的关注,报道称,抗性淀粉调节糖脂代谢可能是由微生物介导的[126-127]。
Si Xu等[128]将抗性淀粉用于高脂饮食诱导的肥胖大鼠模型,研究高直链淀粉(RS2)和酯化高直链淀粉(RS4)的抗肥胖作用。与对照组相比,RS2和RS4处理组小鼠血糖水平和胰岛素水平显著降低,血清甘油三酯、总胆固醇和丙二醛浓度均显著降低,提高了总抗氧化能力、超氧化物歧化酶水平和谷胱甘肽过氧化物酶活力,且RS4在降低血糖、降低血脂水平和增强肝脏功能等方面优于RS2。Shimotoyodome等[129]也进行了类似的研究,RS4组小鼠比RS2组具有更低的体质量、内脏脂肪和胰岛素水平,并提高了肝脂肪酸氧化能力,说明RS4在调节血脂水平和改善大鼠肝脏脂质代谢方面的效果更显著。据报道,饲喂玉米RS3的小鼠血糖值下降了14.70%,说明玉米RS3也能够有效降低2型糖尿病小鼠的血糖值[130]。Wang Qi等[131]也得到了类似的研究结果。有研究表明,RS4可以改善高脂饮食引起的肠道菌群紊乱,缓解高脂饮食引起的肥胖,提高肥胖小鼠血糖调节能力,从而改善血脂紊乱[75-76]。
除动物实验外,研究者们也进行了大量临床研究。健康志愿者饮食摄入生香蕉粉(15 g/周),空腹胰岛素水平有所下降,饥饿感减少而饱腹感增加[132]。Bodinham等[133]指出,健康志愿者摄入RS2后,虽然餐后血糖浓度和食欲方面的差异并不显著,但餐后胰岛素反应显著降低。另外,一项针对20 名胰岛素抵抗受试者的单盲、随机、平行营养干预研究表明,RS2可改善胰岛素敏感性,降低腰围和胫骨肌肉脂肪积累量[134]。研究证明,摄入RS3后,血糖增量和胰岛素水平显著降低[135]。健康志愿者食用含有直链淀粉-棕榈酸复合物(RS5)的面包后,具有更低的餐后血糖水平和胰岛素反应[136]。不同类型的抗性淀粉引起的血糖反应显著不同,健康志愿者被随机分为3 组,分别摄入30 g葡萄糖、RS2或RS4,食用前后的2 h内采集手指血液样本,测量血糖,与葡萄糖组相比,两种抗性淀粉血糖水平显著降低(P<0.05),且与RS2组相比,RS4组效果更显著[137]。Upadhyaya等[82]的研究也表明RS4可显著降低胆固醇和空腹血糖水平,且RS4处理组的腰围和体脂也低于对照组。通过分析宿主肠道菌群组成和SCFAs水平,发现肠道菌群与宿主代谢功能和短链脂肪酸水平之间存在特异性关联。何书琪等[28]指出,抗性淀粉可影响肠道菌群,并通过肠道菌群及其代谢物的共同作用改善机体代谢性疾病。例如,抗性淀粉可通过调控肠道菌群影响SCFAs的产生,SCFAs进而通过调控脂质相关基因的表达或者刺激机体释放胰高血糖素样肽-1等达到抗肥胖作用。
3 结 语
不同类型或结构的抗性淀粉有利于不同类型的微生物群增殖,并可作为独特的肠道微生物群基质,调节肠道菌群组成,从而影响SCFAs的生成。此外,对人类微生物群的研究表明,即使在健康人群中,肠道菌群多样性和丰度也存在很大差异。因此,个体初始微生物群组成对抗性淀粉改善肠道菌群结构及代谢物水平具有至关重要的作用,未来研究仍需特别关注个体差异。
即使同类型的抗性淀粉也可能导致肠道菌群组成和SCFAs等发生明显改变,未来可根据肠道菌群调节功能和健康效应重新构建抗性淀粉分类系统。此外,为了更好地理解抗性淀粉调节肠道菌群的潜在机制,还需要对抗性淀粉的结构特征与肠道菌群调节功能之间的关联进行全面研究,通过改变抗性淀粉的结构,进行针对性、个性化设计,精准调控肠道菌群,以提高其营养价值或健康效益。
[1]ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(Suppl 2): S33-S55.DOI:10.1128/IAI.01649-06.
[2]RAIGOND P, EZEKIEL R, RAIGOND B. Resistant starch in food:a review[J]. Journal of the Science of Food and Agriculture, 2015,95(10): 1968-1978. DOI:10.1002/jsfa.6966.
[3]MA Zhen, HU Xinzhong, BOYE J I. Research advances on the formation mechanism of resistant starch type III: a review[J]. Critical Reviews in Food Technology, 2020, 60(2): 276-297. DOI:10.1080/10408398.2018.1523785.
[4]HARALAMPU S G. Resistant starch-a review of the physical properties and biological impact of RS3[J]. Carbohydrate Polymers,2000, 41(3): 285-292. DOI:10.1016/S0144-8617(99)00147-2.
[5]LUNN J, BUTTRISS J L. Carbohydrates and dietary fibre[J]. Nutrition Bulletin, 2007, 32: 21-64. DOI:10.1111/j.1467-3010.2007.00616.x.
[6]REMYA R, JYOTHI A N, SREEKUMAR J. Morphological, structural and digestibility properties of RS4 enriched octenyl succinylated sweet potato, banana and lentil starches[J]. Food Hydrocolloids, 2018, 82:219-229. DOI:10.1016/j.foodhyd.2018.04.009.
[7]贾祥泽, 陈秉彦, 赵蓓蓓, 等. 直链淀粉-脂质复合物的形成及其结构性质研究进展[J]. 食品与发酵工业, 2017, 43(3): 276-284.DOI:10.13995/j.cnki.11-1802/ts.201703047.
[8]MARINOPOULOU A, PAPASTERGIADIS E, RAPHAELIDES S N, et al. Structural characterization and thermal properties of amylose-fatty acid complexes prepared at different temperatures[J].Food Hydrocolloids, 2016, 58: 224-234. DOI:10.1016/j.foodhyd.2016.02.034.
[9]MAO Xinhui, LU Jun, HUANG Hanan, et al. Four types of winged yam (Dioscoreaalata L.) resistant starches and their effects on ethanolinduced gastric injury in vivo[J]. Food Hydrocolloids, 2018, 85: 21-29.DOI:10.1016/j.foodhyd.2018.06.036.
[10]PERERA A, MEDA V, TYLER R T. Resistant starch: a review of analytical protocols for determining resistant starch and of factors affecting the resistant starch content of foods[J]. Food Research International, 2010, 43(8): 1959-1974. DOI:10.1016/j.foodres.2010.06.003.
[11]CHI Chengdeng, LI Xiaoxi, HUANG Shuangxia, et al. Basic principles in starch multi-scale structuration to mitigate digestibility: a review[J]. Trends in Food Science & Technology, 2021, 109: 154-168.DOI:10.1016/j.tifs.2021.01.024.
[12]CHI Chengdeng, LI Xiaoxi, ZHANG Yiping, et al. Progress in tailoring starch intrinsic structures to improve its nutritional value[J]. Food Hydrocolloids, 2020, 113: 106447. DOI:10.1016/j.foodhyd.2020.106447.
[13]LI Cheng, WU A C, YU Wenwen, et al. Parameterizing starch chainlength distributions for structure-property relations[J]. Carbohydrate Polymers, 2020, 241: 116390. DOI:10.1016/j.carbpol.2020.116390.
[14]MOHAMED I O. Effects of processing and additives on starch physicochemical and digestibility properties[J]. Carbohydrate Polymer Technologies and Applications, 2021, 2: 100039. DOI:10.1016/j.carpta.2021.100039.
[15]周梦露, 钱晓洁, 孙冰华, 等. 蛋白质及其水解物对谷物淀粉糊化、回生及消化性的影响研究进展[J]. 中国粮油学报, 2022, 37(2): 180-187.http://kns.cnki.net/kcms/detail/11.2864.TS.20211025.1053.002.html.
[16]李部. 水稻淀粉慢消化特性的结构基础和遗传研究[D]. 扬州: 扬州大学, 2021: 1-46.
[17]常然然. 重结晶型抗性淀粉制备、消化过程及酵解规律研究[D].无锡: 江南大学, 2021: 1-25.
[18]涂园, 李晓玺, 陆萍, 等. 发酵过程中原花青素对大米淀粉多尺度结构及体外消化特性的调控[J]. 现代食品科技, 2022, 38(3): 152-158;285. DOI:10.13982/j.mfst.1673-9078.2022.3.0251.
[19]MAIER T V, LUCIO M, LEE L H, et al. Impact of dietary resistant starch on the human gut microbiome, metaproteome,and metabolome[J]. mBio, 2017, 8(5): e01343-17. DOI:10.1128/mBio.01343-17.
[20]BAGHURST P A, BAGHURST K I, RECORD S J. Dietary fiber,non-starch polysaccharides and resistant starch: a review[J]. Food Australia, 1996, 48(3): S3-S35. DOI:10.1016/j.ijbiomac.2018.10.195.
[21]XU Hanbin, ZHOU Jiaping, LIU Xia, et al. Methods for characterizing the structure of starch in relation to its applications: a comprehensive review[J/OL]. Critical Reviews in Food Science and Nutrition,2021[2022-04-01]. DOI:10.1080/10408398.2021.2007843.
[22]LIU Guodong, GU Zhengbiao, HONG Yan, et al. Structure,functionality and applications of debranched starch: a review[J].Trends in Food Science & Technology, 2017, 63: 70-79. DOI:10.1016/j.tifs.2017.03.004.
[23]WANG Xu, HONG Yan, GU Zhengbiao, et al. Themes, trends, and knowledge structure in 30 years of starch research in food science and technology: a visualization review[J]. Starch-Stärke, 2021, 74(5/6):2100274. DOI:10.1002/star.202100274.
[24]MA Zhen, BOYE J I. Research advances on structural characterization of resistant starch and its structure-physiological function relationship:a review[J]. Critical Reviews in Food Science and Nutrition, 2016,58(7): 1059-1083. DOI:10.1080/10408398.2016.1230537.
[25]WEN Jiajia, LI Mingzhi, HU Jielun, et al. Resistant starches and gut microbiota[J]. Food Chemistry, 2022, 387: 132895. DOI:10.1016/j.foodchem.2022.132895.
[26]FANG Fang, JUNEJO S A, WANG Kai, et al. Fibre matrices for enhanced gut health: a mini review[J/OL]. International Journal of Food Science and Technology, 2022[2022-04-01]. DOI:10.1111/ijfs.15702.
[27]林炎, 王培鑫, 吕芳澜, 等. 抗性淀粉结构特性和肠道菌群调节功能的研究进展[J]. 食品科学, 2020, 41(11): 222-232. DOI:10.7506/spkx1002-6630-20190611-113.
[28]何书琪, 童铭瑶, 雷素珍, 等. “抗性淀粉-肠道菌群-代谢产物”营养轴的研究进展[J]. 食品科学, 2022, 43(5): 264-274. DOI:10.7506/spkx1002-6630-20210223-258.
[29]LI Cheng, HU Yiming. New definition of resistant starch types from the gut microbiota perspectives: a review[J/OL]. Critical Reviews in Food Science and Nutrition, 2022[2022-04-01]. DOI:10.1080/10408398.2022.2031101.
[30]JIANG Hongxin, HORNER H T, PEPPER T M, et al. Formation of elongated starch granules in high-amylose maize[J]. Carbohydrate Polymers, 2010, 80(2): 533-538. DOI:10.1016/j.carbpol.2009.12.016.
[31]ZHANG Binjia, CHEN Ling, ZHAO Yue, et al. Structure and enzymatic resistivity of debranched high temperature-pressure treated high-amylose corn starch[J]. Journal of Cereal Science, 2013, 57(3):348-355. DOI:10.1016/j.jcs.2012.12.006.
[32]BAO Chen, ZENG Hongliang, ZHANG Yi, et al. Structural characteristics and prebiotic effects of Semen coicis resistant starches(type 3) prepared by different methods[J]. International Journal of Biological Macromolecules, 2017, 105: 671-679. DOI:10.1016/j.ijbiomac.2017.07.091.
[33]XU Jiangbin, MA Zhen, REN Namei, et al. Understanding the multiscale structural changes in starch and its physicochemical properties during the processing of chickpea, navy bean, and yellow field pea seeds[J]. Food Chemistry, 2019, 289(15): 582-590. DOI:10.1016/j.foodchem.2019.03.093.
[34]XU S S, ZHANG J X, LI B, et al. Preparation and physical characteristics of resistant starch (type 4) in acetylated indica rice[J]. Food Chemistry,2012, 134(1): 149-154. DOI:10.1016/j.foodchem.2012.02.081.
[35]SHAH A, MASOODI F A, GANI A, et al. Physicochemical,rheological and structural characterization of acetylated oat starches[J].LWT-Food Science and Technology, 2017, 80: 19-26. DOI:10.1016/j.lwt.2017.01.072.
[36]XIA Huiping, LI Yunyun, GAO Qunyu. Preparation and properties of RS4 citrate sweet potato starch by heat-moisture treatment[J]. Food Hydrocolloids, 2016, 55: 172-178. DOI:10.1016/j.foodhyd.2015.11.008.
[37]MOIN A, ALI T M, HASNAIN A. Characterization and utilization of hydroxy propylated rice starches for improving textural and storage properties of rice puddings[J]. International Journal of Biological Macromolecules, 2017, 105: 843-851. DOI:10.1016/j.ijbiomac.2017.07.109.
[38]ZHANG Bin, HUANG Qiang, LUO Faxing, et al. Structural characterizations and digestibility of debranched high-amylose maize starch complexed with lauric acid[J]. Food Hydrocolloids, 2012, 28(1):174-181. DOI:10.1016/j.foodhyd.2011.12.020.
[39]GARCIA M C, PEREIRA-DA-SILVA M A, TABOGA S, et al.Structural characterization of complexes prepared with glycerol monoestearate and maize starches with different amylose contents[J].Carbohydrate Polymers, 2016, 148: 371-379. DOI:10.1016/j.carbpol.2016.04.067.
[40]VERMEYLEN R, GODERIS B, DELCOUR J A. An X-ray study of hydrothermally treated potato starch[J]. Carbohydrate Polymers, 2006,64(2): 364-375. DOI:10.1016/j.carbpol.2005.12.024.
[41]GIDLEY M J, BOCIEK S M. Molecular organization in starches: a carbon 13 CP/MAS NMR study[J]. Journal of the American Chemical Society, 1985, 107(24): 7040-7044. DOI:10.1021/ja00310a047.
[42]VAN SOEST J, TOURNOIS H, DE WIT D, et al. Short-range structure in (partially) crystalline potato starch determined with attenuated total reflectance fourier-transform IR spectroscopy[J].Carbohydrate Research, 1995, 279(27): 201-214. DOI:10.1016/0008-6215(95)00270-7.
[43]GEMAT C, RADOSTA S, ANGER H, et al. Crystalline parts of three different conformations detected in native and enzymatically degraded starches[J]. Starch-Stärke, 1993, 45(9): 309-314. DOI:10.1002/star.19930450905.
[44]MA Zhen, YIN Xiuxiu, HU Xinzhong, et al. Structural characterization of resistant starch isolated from Laird lentils (Lens culinaris) seeds subjected to different processing treatments[J]. Food Chemistry, 2018,263: 163-170. DOI:10.1016/j.foodchem.2018.04.122.
[45]ZHOU Dingting, MA Zhen, XU Jiangbin, et al. Resistant starch isolated from enzymatic, physical, and acid treated pea starch:preparation, structural characteristics, and in vitro bile acid capacity[J].LWT-Food Science and Technology, 2019, 11: 108541. DOI:10.1016/j.lwt.2019.108541.
[46]SHAMAI K, BIANCO-PELED H, SHIMONI E. Polymorphism of resistant starch type III[J]. Carbohydrate Polymers, 2003, 54(3): 363-369. DOI:10.1016/S0144-8617(03)00192-9.
[47]ZENG Feng, CHEN Fuquan, KONG Fansheng, et al. Structure and digestibility of debranched and repeatedly crystallized waxy rice starch[J]. Food Chemistry, 2015, 187: 348-353. DOI:10.1016/j.foodchem.2015.04.033.
[48]MUN S H, SHIN M. Mild hydrolysis of resistant starch from maize[J]. Food Chemistry, 2006, 96(1): 115-121. DOI:10.1016/j.foodchem.2005.02.015.
[49]CHANG Fengdan, HE Xiaowei, HUANG Qiang. The physicochemical properties of swelled maize starch granules complexed with lauric acid[J]. Food Hydrocolloids, 2013, 32(2): 365-372. DOI:10.1016/j.foodhyd.2013.01.021.
[50]ZHOU Xing, WANG Ren, ZHANG Yuxian, et al. Effects of amylose chain length and heat treatment on amylose-glycerol monocaprate complex formation[J]. Carbohydrate Polymers, 2013, 95(1): 227-232.DOI:10.1016/j.carbpol.2013.02.051.
[51]黄婷婷. 复合湿热处理对甘薯慢消化淀粉形成及结构性质的影响[D].合肥: 合肥工业大学, 2016: 12-28.
[52]GIUBERTI G, MARTI A, FORTUNATI P, et al. Gluten free rice cookies with resistant starch ingredients from modified waxy rice starches: nutritional aspects and textural characteristics[J]. Journal of Cereal Science, 2017, 76: 157-164. DOI:10.1016/j.jcs.2017.06.008.
[53]ZENG Shaoxiao, WU Xiaoting, LIN Shan, et al. Structural characteristics and physicochemical properties of lotus seed resistant starch prepared by different methods[J]. Food Chemistry, 2015, 186:213-222. DOI:10.1016/j.foodchem.2015.03.143.
[54]ZHANG Binjia, CHEN Ling, XIE Fengwei, et al. Understanding the structural disorganization of starch in water-ionic liquid solutions[J].Physical Chemistry Chemical Physics, 2015, 17(21): 13860-13871.DOI:10.1039/c5cp01176k.
[55]杨光, 丁霄霖. 抗性淀粉分子量分布的研究[J]. 中国粮油学报, 2000,15(5): 37-40. DOI:10.3321/j.issn:1003-0174.2000.05.009.
[56]ZE Xiaolei, DUNCAN S H, LOUIS P, et al. Ruminococcus bromii is a keystone species for the degradation of resistant starch in the human colon[J]. ISME Journal, 2012, 6(8): 1535-1543. DOI:10.1038/ismej.2012.4.
[57]CROST E H, LE GALL G, LAVERDE-GOMEZ J A, et al. Mechanistic insights into the cross-feeding of Ruminococcus gnavus and Ruminococcus bromii on host and dietary carbohydrate[J]. Frontiers in Microbiology,2018, 9: 2558. DOI:10.3389/fmicb.2018.02558.
[58]COCKBURN D W, KOROPATKIN N M. Polysaccharide degradation by the intestinal microbiota and its influence on human health and disease[J]. Journal of Molecular Biology, 2016, 428(16): 3230-3252.DOI:10.1016/j.jmb.2016.06.021.
[59]BELENGUER A, DUNCAN S H, CALDER A G, et al. Two routes of metabolic cross-feeding between Bifidobacterium adolescentis and butyrate-producing anaerobes from the human gut[J]. Applied and Environmental Microbiology, 2006, 72(5): 3593-3599. DOI:10.1128/AEM.72.5.3593-3599.2006.
[60]BARCENILLA A, PRYDE S E, MARTIN J C, et al. Phylogenetic relationships of butyrate producing bacteria from the human gut[J].Applied and Environmental Microbiology, 2000, 66(4): 1654-1661.DOI:10.1128/AEM.66.4.1654-1661.2000.
[61]ZHOU Dingting, MA Zhen, HU Xinzhong. Isolated pea resistant starch substrates with different structural features modulate the production of short-chain fatty acids and metabolism of microbiota in anaerobic fermentation in vitro[J]. Journal of Agricultural and Food Chemistry, 2021, 69(18): 5392-5404. DOI:10.1021/acs.jafc.0c08197.
[62]LIANG Dan, LI Nan, DAI Xiaofeng, et al. Effects of different types of potato resistant starches on intestinal microbiota and short-chain fatty acids under in vitro fermentation[J]. International Journal of Food Science and Technology, 2020, 56(5): 2432-2442. DOI:10.1111/ijfs.14873.
[63]QIN Renbing, WANG Jin, CHAO Chen, et al. RS5 produced more butyric acid through regulating the microbial community of human gut microbiota[J]. Journal of Agricultural and Food Chemistry, 2021,69(10): 3209-3218. DOI:10.1021/acs.jafc.0c08187.
[64]SORNDECH W, RODTONG S, BLENNOW A, et al. Impact of resistant maltodextrins and resistant starch on human gut microbiota and organic acids production[J]. Starch-Stärke, 2018, 71(5/6):1800231. DOI:10.1002/star.201800231.
[65]LI Leyuan, RYAN J, NING Zhibin, et al. A functional ecological network based on metaproteomics responses of individual gut microbiomes to resistant starches[J]. Computational and Structural Biotechnology Journal, 2020, 18: 3833-3842. DOI:10.1016/j.csbj.2020.10.042.
[66]ABELL G C J, COOKE C M, BENNETT C N, et al. Phylotypes related to Ruminococcus bromii are abundant in the large bowel of humans and increase in response to a diet high in resistant starch[J].FEMS Microbiology Ecology, 2008, 66(3): 505-515. DOI:10.1111/j.1574-6941.2008.00527.x.
[67]MARTÍNEZ I, WALLACE G, ZHANG C, et al. Diet-induced metabolic improvements in a hamster model of hypercholesterolemia are strongly linked to alterations of the gut microbiota[J]. Applied and Environmental Microbiology, 2009, 75(12): 4175-4184. DOI:10.1128/AEM.00380-09.
[68]ZENG Hongliang, ZHENG Yixin, LIN Yan, et al. Effect of fractionated lotus seed resistant starch on proliferation of Bifidobacterium longum and Lactobacillus delbrueckii subsp. bulgaricus and its structural changes following fermentation[J]. Food Chemistry, 2018, 268:134-142. DOI:10.1016/j.foodchem.2018.05.070.
[69]WANG Shaokang, ZHANG Bin, CHEN Tingting, et al. Chemical cross-linking controls in vitro fecal fermentation rate of high-amylose maize starches and regulates gut microbiota composition[J]. Journal of Agricultural and Food Chemistry, 2019, 67(49): 13728-13736.DOI:10.1021/acs.jafc.9b04410.
[70]ZHOU Qianwen, FU Xiong, DHITAL S, et al. In vitro fecal fermentation outcomes of starch-lipid complexes depend on starch assembles more than lipid type[J]. Food Hydrocolloids, 2021, 120:106941. DOI:10.1016/j.foodhyd.2021.106941.
[71]KIEFFER D A, PICCOLO B D, VAZIRI N D, et al. Resistant starch alters gut microbiome and metabolomic profiles concurrent with amelioration of chronic kidney disease in rats[J]. American Journal of Physiology Renal Physiology, 2016, 310(9): F851-F871. DOI:10.1152/ajprenal.00513.2015.
[72]ZENG Hongliang, HUANG Cancan, LIN Shan, et al. Lotus seed resistant starch regulates gut microbiota and increases short-chain fatty acids production and mineral absorption in mice[J]. Journal of Agricultural and Food Chemistry, 2017, 65(42): 9217-9225.DOI:10.1021/acs.jafc.7b02860.
[73]KAWAKAMI S, HAN K H, ARAKI T, et al. Potato powders prepared by successive cooking-process depending on resistant starch content affect the intestinal fermentation in rats[J]. Bioscience Biotechnology and Biochemistry, 2017, 81(2): 359-364. DOI:10.1080/09168451.2016.1254537.
[74]XU Jiangbin, MA Zhen, LI Xiaoping, et al. A more pronounced effect of type III resistant starch vs. type II resistant starch on ameliorating hyperlipidemia in high fat diet-fed mice is associated with its supramolecular structural characteristics[J]. Food & Function, 2020,11(3): 1982-1995. DOI:10.1039/c9fo02025j.
[75]谢竹青. 丙酰化抗性淀粉的体外大肠酵解特性及其对高脂饮食喂养小鼠的菌群调控规律研究[D]. 广州: 华南理工大学, 2020: 13-60.
[76]邬应龙, 王文婷. RS4型抗性淀粉对高脂饮食C57BL/6J小鼠肠绒毛形态及肠道菌群的影响[J]. 食品科学, 2013, 34(21): 333-338.DOI:10.7506/spkx1002-6630-201321067.
[77]UMU O C O, FRANK J A, FANGEL J U, et al. Resistant starch diet induces change in the swine microbiome and a predominance of beneficial bacterial populations[J]. Microbiome, 2015, 3: 16.DOI:10.1186/s40168-015-0078-5.
[78]BAXTER N T, SCHMIDT A W, VENKATARAMAN A, et al.Dynamics of human gut microbiota and short-chain fatty acids in response to dietary interventions with three fermentable fibers[J].mBio, 2019, 10(1): e02566-18. DOI:10.1128/mBio.02566-18.
[79]ZHANG Lei, OUYANG Yang, LI Huating, et al. Metabolic phenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial[J]. Scientific Reports, 2019, 9: 4736. DOI:10.1038/s41598-018-38216-9.
[80]MARTINEZ I, KIM J, DUFFY P R, et al. Resistant starches types 2 and 4 have differential effects on the composition of the fecal microbiota in human subjects[J]. PLoS ONE, 2010, 5(11): e15046.DOI:10.1371/journal.pone.0015046.
[81]WALKER A W, INCE J, DUNCAN S H, et al. Dominant and diet responsive groups of bacteria within the human colonic microbiota[J].ISME Journal, 2011, 5(2): 220-230. DOI:10.1038/ISMEJ.2010.118.
[82]UPADHYAYA B, MCCORMACK L, FARDIN-KIA A R, et al.Impact of dietary resistant starch type 4 on human gut microbiota and immunometabolic functions[J]. Scientific Reports, 2016, 6: 28797.DOI:10.1038/srep28797.
[83]DEEHAN E C, YANG C, PEREZ-MUNOZ M E, et al. Precision microbiome modulation with discrete dietary fiber structures directs short-chain fatty acid production[J]. Cell Host & Microbe, 2020, 27(3):389. DOI:10.1016/j.chom.2020.01.006.
[84]ZHANG Yi, WANG Ying, ZHENG Baodong, et al. The in vitro effects of retrograded starch (resistant starch type 3) from lotus seed starch on the proliferation of Bifidobacterium adolescentis[J]. Food &Function, 2013, 4(11): 1609-1616. DOI:10.1039/c3fo60206k.
[85]ZENG Hongliang, CHEN Peilin, CHEN Chuanjie, et al. Structural properties and prebiotic activities of fractionated lotus seed resistant starches[J]. Food Chemistry, 2018, 251: 33-40. DOI:10.1016/j.foodchem.2018.01.057.
[86]HUANG Yaping, YANG Shujie, HUANG Zifeng, et al. Difference in the adhesion of Bifidobacterium breve to lotus seed resistant starch is attributable to its structural performance conferred by the preparation method[J]. International Journal of Biological Macromolecules, 2022,195: 309-316. DOI:10.1016/j.ijbiomac.2021.11.210.
[87]LESMES U, BEARDS E J, GIBSON G R, et al. Effects of resistant starch type III polymorphs on human colon microbiota and short chain fatty acids in human gut models[J]. Journal of Agricultural and Food Chemistry, 2008, 56(13): 5415-5421. DOI:10.1021/jf800284d.
[88]LIU Jiaying, LIU Feitong, ARIOGLU-TUNCIL S, et al. In vitro faecal fermentation outcomes and microbiota shifts of resistant starch spherulites[J]. International Journal of Food Science and Technology,2021, 57(5): 2782-2792. DOI:10.1111/ijfs.15237.
[89]GU Fangting, LI Cheng, HAMAKER B R, et al. Fecal microbiota responses to rice RS3 are specific to amylose molecular structure[J].Carbohydrate Polymers, 2020, 243: 116475. DOI:10.1016/j.carbpol.2020.116475.
[90]林姗. 莲子抗性淀粉分级分离及其益生元作用的研究[D]. 福州:福建农林大学, 2016: 45-68.
[91]刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学, 2013, 40(11): 99-103. DOI:10.3969/j.issn.1004-874X.2013.11.029.
[92]POMARE E, BRANCH W, CUMMINGS J. Carbohydrate fermentation in the human colon and its relation to acetate concentrations in venous blood[J]. Journal of Clinical Investigation,1985, 75(5): 1448-1454. DOI:10.1172/JCI111847.
[93]CUMMINGS J H, BEATTY E R, KINGMAN S M, et al. Digestion and physiological properties of resistant starch in the human large bowel[J]. British Journal of Nutrition, 1996, 75(5): 733-747.DOI:10.1079/BJN19960177.
[94]REEVES P G, NIELSEN F H, FAHEY G C. AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J]. Journal of Nutrition, 1993, 123(11): 1939-1951. DOI:10.1093/jn/123.11.1939.
[95]VAN DER BEEK C M, DEJONG C H C, TROOST F J, et al. Role of short-chain fatty acids in colonic inflammation, carcinogenesis, and mucosal protection and healing[J]. Nutrition Reviews, 2017, 75(4):286-305. DOI:10.1093/nutrit/nuw067.
[96]KNUDSEN K E B, LAERKE H N, HEDEMANN M S, et al. Impact of diet-modulated butyrate production on intestinal barrier function and inflammation[J]. Nutrients, 2018, 10(10): 1499. DOI:10.3390/nu10101499.
[97]LOUIS P, FLINT H J. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine[J].FEMS Microbiology Letters, 2009, 294(1): 1-8. DOI:10.1111/j.1574-6968.2009.01514.x.
[98]WANG Zhiyun, LIN Yan, LIU Lu, et al. Effect of lotus seed resistant starch on lactic acid conversion to butyric acid fermented by rat fecal microbiota[J]. Journal of Agricultural and Food Chemistry, 2022,70(5): 1525-1535. DOI:10.1021/acs.jafc.1c06000.
[99]LEHMANN U, JACOBASCH G, SCHMIEDL D. Characterization of resistant starch type III from banana (Musa acuminata)[J]. Journal of Agricultural and Food Chemistry, 2002, 50(18): 5236-5240.DOI:10.1021/jf0203390.
[100]GUAN Nannan, HE Xiaowei, WANG Shaokang, et al. Cell wall integrity of pulse modulates the in vitro fecal fermentation rate and microbiota composition[J]. Journal of Agricultural and Food Chemistry, 2020, 68(4): 1091-1100. DOI:10.1021/acs.jafc.9b06094.
[101]周中凯, 陈晓姗, 张岩, 等. 淀粉结构调控大肠微生物发酵生产丁酸的机制研究[J]. 食品工业科技, 2014, 35(4): 199-203. DOI:10.13386/j.issn1002-0306.2014.04.035.
[102]LI Lingjin, CHENG Li, LI Zhaofeng, et al. Butyrylated starch protects mice from DSS-induced colitis: combined effects of butyrate release and prebiotic supply[J]. Food & Function, 2021, 12(22): 11290-11302.DOI:10.1039/d1fo01913a.
[103]LI Lingjin, LI Wei, YANG Lihong, et al. Butyl group distribution,intestinal digestion, and colonic fermentation characteristics of different butyrylated starches[J]. Journal of Agricultural and Food Chemistry, 2022, 70(10): 3289-3299. DOI:10.1039/d1fo01913a.
[104]ZHOU Zhongkai, CAO Xiaohong, ZHOU J Y H. Effect of resistant starch structure on short-chain fatty acids production by human gut microbiota fermentation in vitro[J]. Starch-Stärke, 2013, 65(5/6): 509-516. DOI:10.1002/star.201200166.
[105]SCHMIEDL D, BAUERLEIN M, BENGS H, et al. Production of heat-stable, butyrogenic resistant starch[J]. Carbohydrate Polymers,2000, 43(2): 183-193. DOI:10.1016/S0144-8617(00)00147-8.
[106]DONGOWSKI G, JACOBASCH G, SCHMIEDL D. Structural stability and prebiotic properties of resistant starch type 3 increase bile acid turnover and lower secondary bile acid formation[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9257-9267.DOI:10.1021/jf0507792.
[107]VENKATARAMAN A, SIEBER J R, SCHMIDT A W, et al. Variable responses of human microbiomes to dietary supplementation with resistant starch[J]. Microbiome, 2016, 4: 33. DOI:10.1186/s40168-016-0178-x.
[108]ALFA M J, STRANG D, TAPPIA P S, et al. A randomized trial to determine the impact of a digestion resistant starch composition on the gut microbiome in older and mid-age adults[J]. Clinical Nutrition,2018, 37(3): 797-807. DOI:10.1016/j.clnu.2017.03.025.
[109]PHILLIPS J, MUIR J, BIRKETT A, et al. Effect of resistant starch on fecal bulk and fermentation-dependent events in humans[J]. American Journal of Clinical Nutrition, 1995, 62(1): 121-130. DOI:10.1093/ajcn/62.1.121.
[110]QIAN Y, LI G J, ZHU K, et al. Effects of three types of resistant starch on intestine and their gastric ulcer preventive activities in vivo[J].Journal of the Korean Society for Applied Biological Chemistry, 2013,56(6): 739-746. DOI:10.1007/s13765-013-3229-z.
[111]冯铄涵, 骞宇, 张璐, 等. 抗性淀粉种类对大鼠肠道代谢产物和血脂的影响[J]. 食品科学, 2012, 33(19): 297-302. DOI:10.13386/j.issn1002-0306.2014.04.035.
[112]LE LEU R K, YOUNG G, HU Y, et al. Dietary red meat aggravates dextran sulfate sodium induced colitis in mice whereas resistant starch attenuates inflammation[J]. Digestive Diseases and Sciences, 2013,58(12): 3475-3482. DOI:10.1007/s10620-013-2844-1.
[113]LE LEU R K, BROWN I L, HU Y, et al. Suppression of azoxymethane-induced colon cancer development in rats by dietary resistant starch[J]. Cancer Biology and Therapy, 2007, 6(10): 1621-1626. DOI:10.4161/cbt.6.10.4764.
[114]BAUER-MARINOVIC M, FLORIAN S, MULLER-SCHMEHL K, et al. Dietary resistant starch type 3 prevents tumor induction by 1,2-dimethylhydrazine and alters proliferation, apoptosis and dedifferentiation in rat colon[J]. Carcinogenesis, 2006, 27(9): 1849-1859. DOI:10.1093/carcin/bgl025.
[115]YUAN Huaibo, ZHU Xiping, CHEN Deyi, et al. Effects of dual modified resistant indica rice starch on azoxymethane-induced incipient colon cancer in mice[J]. Experimental and Therapeutic Medicine, 2017, 13(5): 2036-2042. DOI:10.3892/etm.2017.4172.
[116]ZHAO Yinsheng, AI Yongfeng, LI Li, et al. Inhibition of azoxymethane-induced preneoplastic lesions in the rat colon by a stearic acid complexed high-amylose cornstarch using different cooking methods and assessing potential gene targets[J].Journal of Functional Foods, 2014, 6(1): 499-512. DOI:10.1016/j.jff.2013.11.016.
[117]DRONAMRAJU S S, COXHEAD J M, KELLY S B, et al. Cell kinetics and gene expression changes in colorectal cancer patients given resistant starch: a randomized controlled trial[J]. Gut, 2009,58(3): 413-420. DOI:10.1136/gut.2008.162933.
[118]VAN GORKOM B A P, KARRENBELD A, VAN DER SLUIS T, et al.Calcium or resistant starch does not affect colonic epithelial cell proliferation throughout the colon in adenoma patients: a randomized controlled trial[J]. Nutrition and Cancer, 2002, 43(1): 31-38.DOI:10.1207/S15327914NC431_3.
[119]GRUBBEN M J A L, VAN DEN BRAAK C C M, ESSENBERG M, et al. Effect of resistant starch on potential biomarkers for colonic cancer risk in patients with colonic adenomas-a controlled trial[J].Digestive Diseases and Sciences, 2001, 46(4): 750-756. DOI:10.1023/A:1010787931002.
[120]BURN J, BISHOP D T, MECKLIN J P, et al. Effect of aspirin or resistant starch on colorectal neoplasia in the lynch syndrome[J].New England Journal of Medicine, 2008, 359(24): 2567-2578.DOI:10.1056/NEJMoa0801297.
[121]KRUG E G. Trends in diabetes: sounding the alarm[J]. Lancet, 2016,387: 1485-1486. DOI:10.1016/S0140-6736(16)30163-5.
[122]KOH G Y, ROWLING M J. Resistant starch as a novel dietary strategy to maintain kidney health in diabetes mellitus[J]. Nutrition Reviews, 2017, 75(5): 350-360. DOI:10.1093/nutrit/nux006.
[123]FINUCANE M M, STEVENS G A, COWAN M J, et al. National,regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants[J]. Lancet, 2011,377: 557-567. DOI:10.1016/S0140-6736(10)62037-5.
[124]ALFA M J, STRANG D, TAPPIA P S, et al. A randomized placebo controlled clinical trial to determine the impact of digestion resistant starch MSPrebiotic® on glucose, insulin, and insulin resistance in elderly and mid-age adults[J]. Frontiers in Medicine, 2017, 4: 260.DOI:10.3389/fmed.2017.00260.
[125]KEENAN M J, JANES M, ROBERT J, et al. Resistant starch from high amylose maize (HAM-RS2) reduces body fat and increases gut bacteria in ovariectomized (OVX) rats[J]. Obesity, 2013, 21(5): 981-984. DOI:10.1002/oby.20109.
[126]ZHANG Chi, MA Shuangshuang, WU Jiahui, et al. A specific gut microbiota and metabolomic profiles shifts related to antidiabetic action: The similar and complementary antidiabetic properties of type 3 resistant starch from Canna edulis and metformin[J]. Pharmacological Research, 2020, 159: 104985. DOI:10.1016/j.phrs.2020.104985.
[127]JOHNSTONE A M, JENNIFER K, SHEILA R, et al. Nondigestible carbohydrates affect metabolic health and gut microbiota in overweight adults after weight loss[J]. Journal of Nutrition, 2020, 150(7): 1859-1870. DOI:10.1093/jn/nxaa124.
[128]SI Xu, ZHOU Zhongkai, STRAPPE P, et al. A comparison of RS4-type resistant starch to RS2-type resistant starch in suppressing oxidative stress in high-fat-diet-induced obese rats[J]. Food &Function, 2017, 8(1): 232-240. DOI:10.1039/c6fo01225f.
[129]SHIMOTOYODOME A, SUZUKI J, FUKUOKA D, et al. RS4-type resistant starch prevents high-fat diet-induced obesity via increased hepatic fatty acid oxidation and decreased postprandial GIP in C57BL/6J mice[J].American Journal of Physiology-Endocrinology and Metabolism, 2010,298(3): E652-E662. DOI:10.1152/ajpendo.00468.2009.
[130]肖兵. 抗性淀粉对糖尿病小鼠血糖和短链脂肪酸的影响及代餐产品开发[D]. 南昌: 南昌大学, 2018: 23-34.
[131]WANG Qi, ZHENG Yafeng, ZHUANG Weijing, et al. Genome-wide transcriptional changes in type 2 diabetic mice supplemented with lotus seed resistant starch[J]. Food Chemistry, 2018, 264: 427-434.DOI:10.1016/j.foodchem.2018.05.056.
[132]SARDA F A H, GIUNTINI E B, GOMEZ M L P A, et al. Impact of resistant starch from unripe banana flour on hunger, satiety, and glucose homeostasis in healthy volunteers[J]. Journal of Functional Foods, 2016, 24: 63-74. DOI:10.1016/j.jff.2016.04.001.
[133]BODINHAM C L, FROST G S, ROBERTSON M D. Acute ingestion of resistant starch reduces food intake in healthy adults[J].British Journal of Nutrition, 2010, 103(6): 917-922. DOI:10.1017/S0007114509992534.
[134]JOHNSTON K L, THOMAS E L, BELL J D, et al. Resistant starch improves insulin sensitivity in metabolic syndrome[J]. Diabetic Medicine,2010, 27(4): 391-397. DOI:10.1111/j.1464-5491.2010.02923.x.
[135]KENDALL C W C, ESFAHANI A, SANDERS L M, et al. The effect of a pre-load meal containing resistant starch on spontaneous food intake and glucose and insulin responses[J]. Journal of Food Technology, 2010, 8(2): 67-73. DOI:10.3923/jftech.2010.67.73.
[136]HASJIM J, LEE S O, HENDRICH S, et al. Characterization of a novel resistant-starch and its effects on postprandial plasma-glucose and insulin responses[J]. Cereal Chemistry, 2010, 87(4): 257-262.DOI:10.1094/CCHEM-87-4-0257.
[137]HAUB M D, HUBACH K L, AL-TAMIMI E K, et al. Different types of resistant starch elicit different glucose responses in humans[J]. Journal of Nutrition and Metabolism, 2010, 2010: 230501.DOI:10.1155/2010/230501.
