火柿(Diospyros kaki L. Huoshi)是我国主栽柿品种之一,富含多种营养成分[1],具有降压、抗脂质过氧化、抗肿瘤、免疫调节等保健作用,深受消费者喜爱[2]。火柿属典型呼吸跃变型果实,产量大且收获时节集中,在收获后会发生明显的软化,在其软化后更容易受到机械损伤并发生腐烂,这很大程度上限制了柿果的长途运输及其货架期[3],因此探究贮藏技术对火柿采后贮藏过程中软化及贮藏品质的影响尤为重要。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)是一种乙烯受体抑制剂,可强烈竞争乙烯受体,与其发生不可逆结合,进而抑制乙烯释放,达到减缓果蔬后熟衰老进程、延长贮藏保鲜期的目的。气调贮藏(modified atmosphere packaging,MA)通过贮藏环境内外气体交换和产品自身呼吸作用,形成相对高CO2、低O2浓度的贮藏微环境,调控产品采后生理代谢,进而提高保鲜效果[4]。由于1-MCP具有高效、无毒、低残留的优点,且在延缓果蔬后熟衰老、维持品质和延长贮藏期方面呈现出显著效果,因此在采后果蔬贮藏保鲜上具有重要的应用价值。已有研究表明1-MCP处理对桃[5]、梨[6-7]、苹果[8-9]等呼吸跃变型水果具有显著的保鲜效果;相关研究表明不同浓度1-MCP处理均可保持柿果的感官品质、色泽及VC含量,降低乙烯生成速率和丙二醛含量,并有效抑制柿果实软化[10-12];1-MCP和其他处理联合使用的效果更为显著,如对比单一处理,1-MCP联合聚氯乙烯保鲜膜处理能更有效抑制柿果硬度的下降、褐变程度的加剧、丙二醛含量的升高[13];联合低温(1 ℃)处理[14-15]或气调包装[16-17]可明显减轻柿果冷害。
果萼是离体幼柿果实的乙烯生物合成起点和柿果采后蒸腾失水的主要部位[18],果实失水胁迫诱导萼片中脱落酸(abscisic acid,ABA)的积累并启动离体幼果软化生理生化程序,加速柿果软化[19],因此柿采后果萼处理对贮藏效果也有一定影响。目前鲜见有关去萼片预处理后再采用1-MCP和MA单独及联合处理火柿在贮藏期内软化及品质变化的研究报道。本实验在冰温(-0.5±0.3)℃条件下利用1-MCP和MA单独及联合处理保留萼片和去除萼片火柿,从柿果在贮藏过程中环境中气体含量、生理指标和营养指标等变化的角度探讨1-MCP、MA及协同处理(1-MCP+MA)对有、无萼片的火柿在贮藏过程中软化的影响,为采后柿果的贮藏保鲜技术提供理论参考。
1 材料与方法
1.1 材料与试剂
火柿采摘自北京平谷;1-MCP 国家农产品保鲜工程技术研究中心(天津)。所用试剂均为分析纯级。
1.2 仪器与设备
Check point便携式O2/CO2测定仪 丹麦Dansensor公司;TA.XT Plus质构仪 英国SMS公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;2010气相色谱仪 日本岛津公司。
1.3 方法
1.3.1 火柿预处理和实验分组
火柿于2019年10月采收,采后筛选果实质量((95±5)g)、颜色指数(12.5±0.5,颜色指数=1 000×a*/L*b*)相近且无机械损伤的柿果作为实验用果,并立即运往实验室。筛选后的火柿先分为两组,其中一组人工去除萼片,另一组不作处理。再将两组火柿分别分为对照(CK)、MA、1-MCP、1-MCP+MA组,每组12 箱,每箱20 个火柿。在室温下1-MCP、1-MCP+MA组用1-MCP(剂量为1.0 μL/L)处理24 h,对照组和MA组不作处理。将所有组放入精准温控库((-0.5±0.3)℃)预冷24 h后,在MA组和1-MCP+MA组箱体上安装气调元件,所有箱盖扣紧置于精准温控库冰温((-0.5±0.3)℃)贮藏60 d。每5 d测定保鲜箱内CO2、O2体积分数,每15 d测定其他相应指标。
1.3.2 硬度测定
每组随机抽取6 个柿果,使用质构仪在赤道中部直接测定果皮硬度,而后在赤道中部去皮测定果肉硬度。质构仪参数设置为探头直径5 mm、预压速率1.00 mm/s、下压速率5 mm/s、压后上行速率1.00 mm/s、停留间隔5 s、样品受压变形60%、触发力5 g。以每次测定最大力值为硬度,测定重复3 次,取平均值。
1.3.3 纤维素酶、多聚半乳糖醛酸酶和β-半乳糖苷酶活力测定
纤维素酶(cellulase,CX)、多聚半乳糖醛酸酶(polygalactosidase,PG)的提取参照文献[20],采用DNS比色法进行测定,单位为mg/(h·g)。
β-半乳糖苷酶(β-galactosidase,β-Gal)的提取和测定参照文献[21],单位为μmol/(30 min·g)。
1.3.4 O2、CO2体积分数的测定
每组使用Check point便携式O2/CO2测定仪从箱体两侧扎入箱内,测定其O2、CO2体积分数,测定后使用胶带封闭针眼,测定重复3 次,取平均值。
1.3.5 呼吸强度和乙烯生成速率的测定
呼吸强度参照文献[20]采用静置法测定。乙烯生成速率参考Both等[22]的方法并略作修改。每组随机选择5 个柿果装入1 L的密封容器中,2.5 h后在容器顶部抽取20 mL气体,采用气相色谱仪测定乙烯体积分数。设置气相色谱仪烘箱、进样器和检测器的温度分别为110、50、150 ℃,氮气、氢气和压缩空气的流速分别为50、50、400 mL/min。乙烯生成速率单位为μL/(kg·h)。
1.3.6 VC、总酚、总黄酮水平的测定
VC含量测定:每组中随机选择6 个柿果取其果肉。将5.0 g果肉匀浆后与45 mL 0.4%(质量分数)草酸溶液混合,过滤后将1 mL滤液和9 mL 2,6-二氯苯酚吲哚酚钠盐溶液进行混合,测定520 nm波长处的吸光度,重复测定3 次,取其平均值,代入标准曲线方程计算VC含量。总酚质量分数采用福林-酚法进行测定,总黄酮质量分数采用比色法[23]测定。
1.4 数据处理与分析
本实验中每个指标测定均重复3 次,结果以平均值±标准差表示。采用Excel 2010软件处理数据,采用SPSS 26.0软件进行单因素方差分析,通过单因素方差分析中的Kruskal-Wallis 法及邓肯多重比较检验组间差异显著性,P<0.05表示差异显著。采用Simca 14.1软件对火柿于冰温贮藏期间不同处理方式下的不同品质指标数据进行主成分分析(principal component analysis,PCA),采用Origin 2020软件作图。
2 结果与分析
2.1 不同处理对火柿冰温贮藏期间硬度的影响
如图1A、B所示,在冰温贮藏条件下,火柿果皮硬度随贮藏时间的延长整体呈下降趋势,且在贮藏期第15天后对照组硬度基本均小于其他处理组,下降幅度最大。至冰温贮藏期结束,有萼片和无萼片柿果皮硬度均为1-MCP+MA>1-MCP>MA>对照,其中除有萼片对照组硬度高于无萼片对照组以外,其他无萼片各处理组硬度均高于有萼片处理组。如图1C、D所示,至冰温贮藏期结束,有萼片火柿果肉硬度除1-MCP+MA对比初始硬度无明显变化外,1-MCP、MA和对照组均有所下降,其果肉硬度为1-MCP+MA>1-MCP>MA>对照(图1C);无萼片火柿果肉硬度1-MCP处理组对比初始硬度增高14.1%,1-MCP+MA处理组对比初始硬度无明显变化,其果肉硬度为1-MCP>1-MCP+MA>MA>对照(图1D),且无萼片柿果实果肉硬度各处理组均显著大于有萼片柿果实(P<0.05)。硬度是果实软化的直观表现,通过其可评估贮藏条件的适宜程度,综上说明,去除萼片处理对比保留萼片可有效延缓火柿硬度的下降,1-MCP+MA联合处理在维持柿果硬度方面效果更佳,进而有效保护柿果组织的完整性。
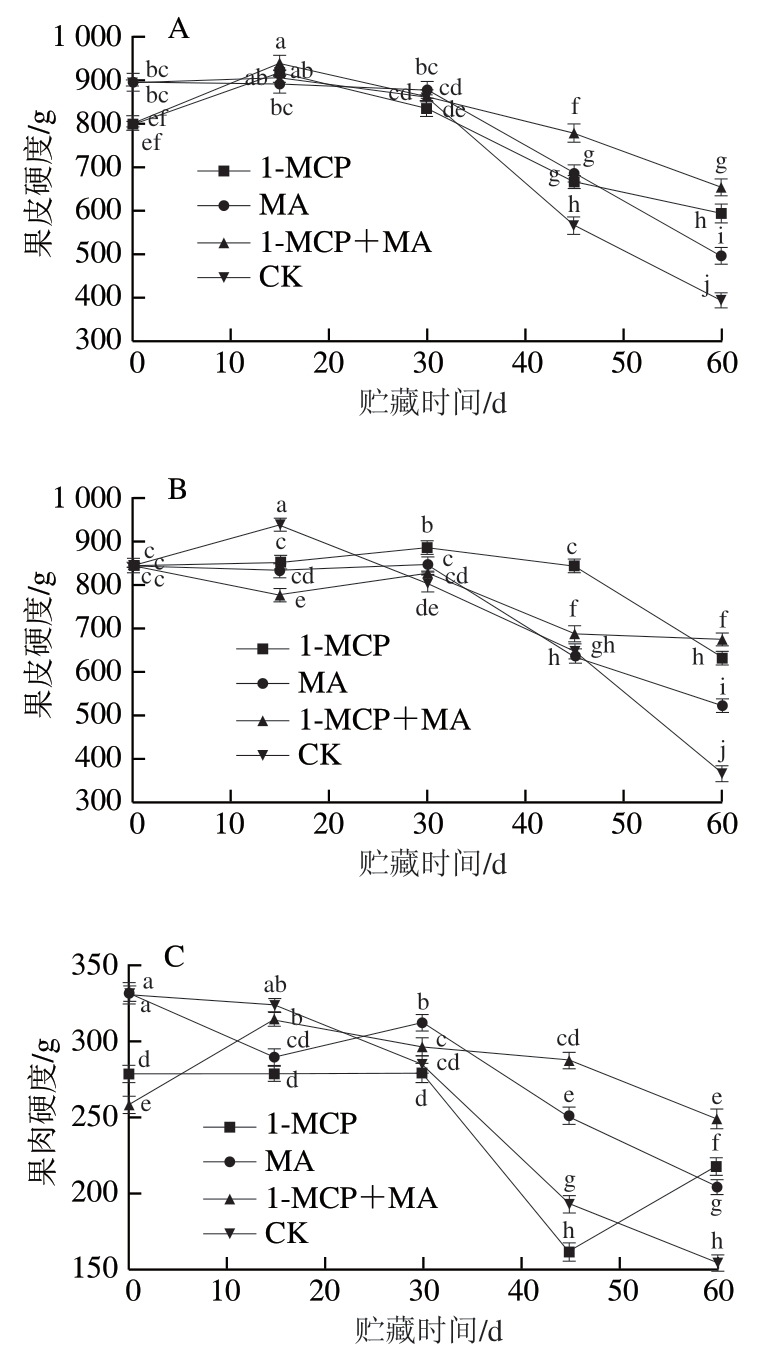
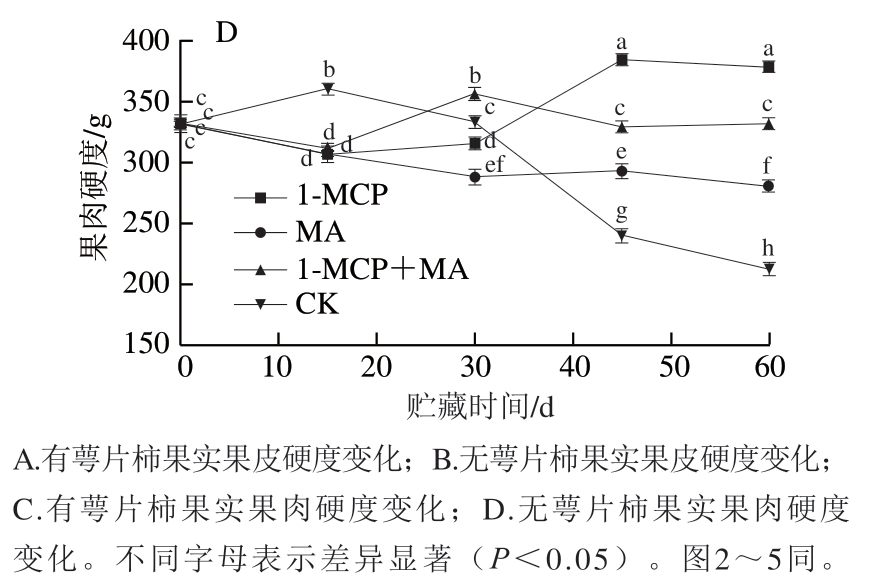
图1 冰温贮藏过程中有萼片和无萼片柿果实硬度的变化
Fig. 1 Changes in the firmness of persimmon fruit with and without calyx lobes during freezing point storage
2.2 不同处理对火柿冰温贮藏期间细胞壁降解相关酶活力的影响
如图2A~D所示,火柿冰温贮藏至第45天时,有、无萼片火柿对照组CX、PG活力均高于其他处理组,无萼片各处理组CX、PG活力略低于有萼片组,说明当贮藏45 d时,1-MCP、MA及1-MCP+MA处理均对火柿CX、PG活力起到抑制作用,且结合去萼片处理效果更佳。从贮藏期的第45天至结束,有萼片对照组CX、PG活力急剧下降,贮藏期结束时对比其他处理组最低;而无萼片对照组CX、PG活力缓慢下降,至贮藏期结束时仍高于其他处理组,说明1-MCP、MA及1-MCP+MA在贮藏中后期均能抑制CX、PG活力,且结合去萼处理对CX、PG活力的抑制作用优于保留萼片处理,其中尤其以无萼片1-MCP处理组效果最佳。如图2E、F所示,在冰温贮藏过程中,至第60天时,1-MCP+MA处理组β-Gal活力显著大于其他各处理组(P<0.05),有萼片MA处理组β-Gal活力低于对照组,有萼片处理对比去萼片处理抑制效果显著,说明有萼片结合MA处理更能抑制β-Gal活力。
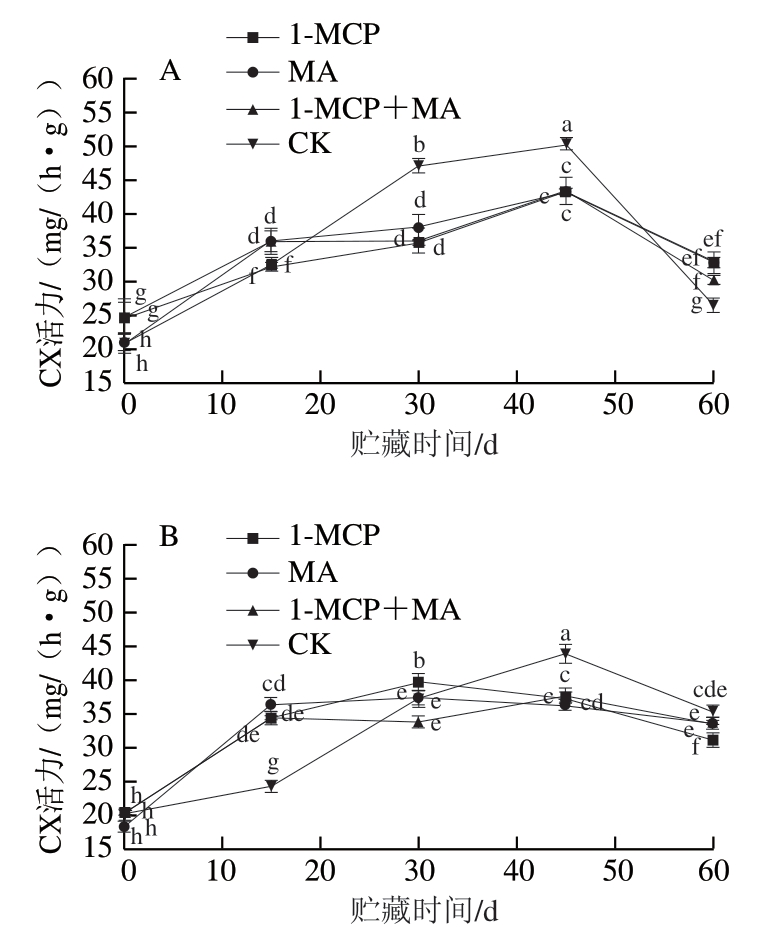
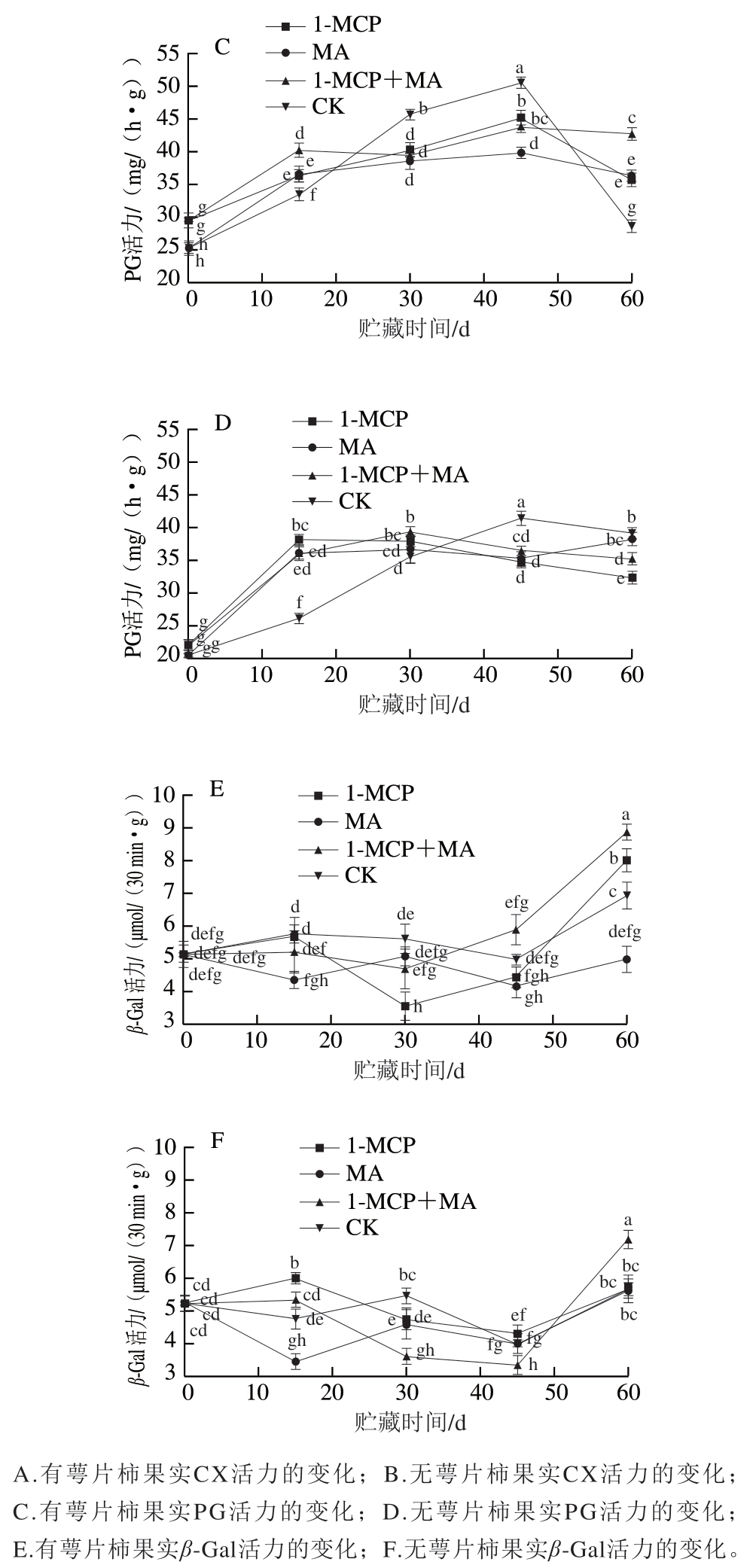
图2 冰温贮藏过程中有萼片和无萼片柿果CX、PG和β-Gal活力的变化
Fig. 2 Changes in CX, PG and β-Gal activities of persimmon fruit with and without calyx lobes during freezing point storage
2.3 不同处理对火柿冰温贮藏期间箱内气体成分组成的影响
如图3A、B所示,在冰温条件下,随着贮藏时间的延长,经MA和1-MCP+MA处理的有、无萼片柿果在冰温贮藏过程中环境内CO2体积分数均呈上升趋势。贮藏结束时,有萼片MA处理组柿果贮藏环境内CO2体积分数为2.9%,有萼片1-MCP+MA处理组柿果贮藏环境内CO2体积分数为2.3%,整个贮藏期间上升速率为MA>1-MCP+MA;无萼片MA处理组柿果贮藏环境内CO2体积分数为2.3%,无萼片1-MCP+MA处理组柿果贮藏环境内CO2体积分数为2.4%,整个贮藏期间的上升速率为1-MCP+MA>MA;其他处理的柿果在冰温贮藏过程中CO2体积分数无明显变化。对比有萼片处理结果,无萼片处理箱体内的CO2体积分数整体较低,表明萼片的保留增强了柿果的呼吸作用,且MA处理通过箱内气体交换能够维持高CO2、低O2平衡,使MA结合保留萼片、冰温贮藏处理对维持贮藏环境中一定CO2水平效果显著。
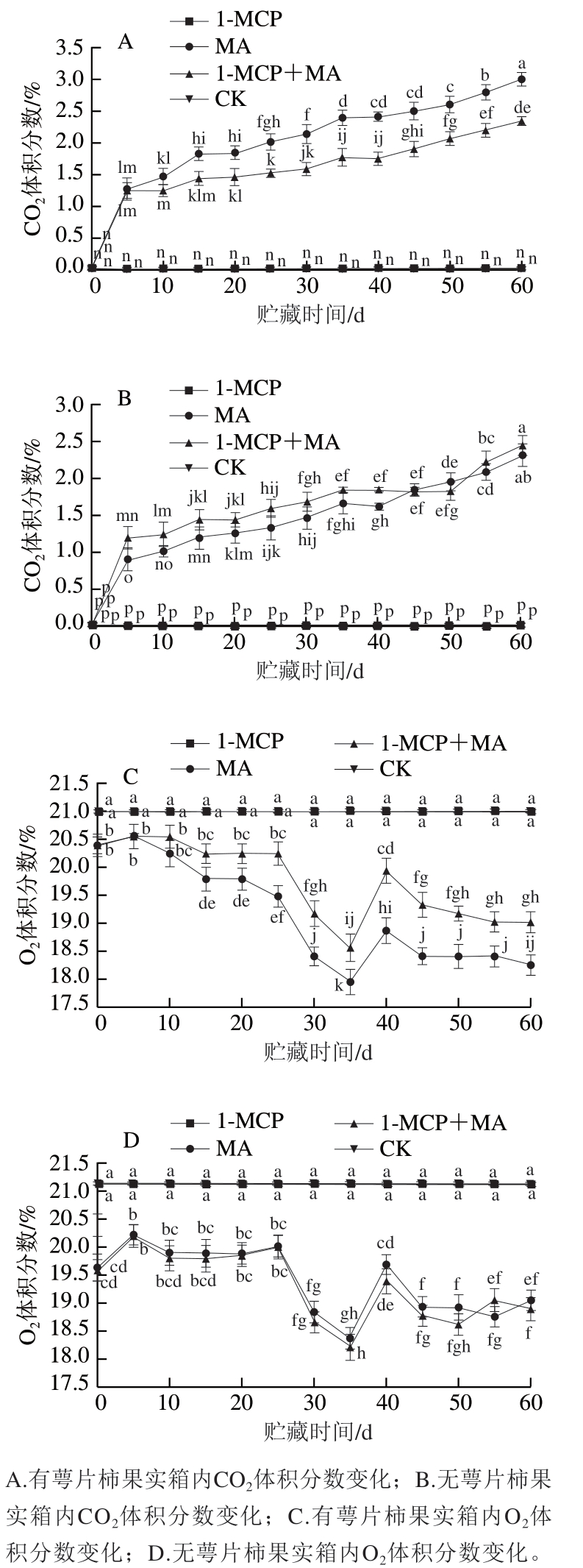
图3 冰温贮藏过程中有萼片和无萼片柿果箱内CO2、O2体积分数变化
Fig. 3 Changes in CO2 and O2 conconcentration in boxes containing persimmon fruit with and without calyx lobes during freezing point storage
贮藏环境中的O2体积分数变化趋势与CO2体积分数相反,如图3C、D所示,随着贮藏时间的延长,有萼片火柿的O2体积分数下降速率MA>1-MCP+MA,至贮藏期结束,MA组O2体积分数显著低于其他处理组(P<0.05);去萼片结合MA、1-MCP+MA处理组箱内O2体积分数下降速率无明显差异;有、无萼片1-MCP和对照组均无明显变化。由此可知,有萼片时,MA处理对于贮藏环境中O2体积分数的降低最有效果。
2.4 不同处理对火柿冰温贮藏期间呼吸强度和乙烯生成速率的影响
如图4A、B所示,经不同处理火柿的呼吸强度变化趋势基本一致,均为前15 d下降,之后上升,至第30天时达到呼吸峰值后再下降,第45天后再次上升。有、无萼片柿果在贮藏第30天时均出现首次呼吸高峰,具有典型的跃变型果实呼吸特征,其中有、无萼片对照组呼吸强度峰值均最高,且有萼片对照组呼吸强度峰值高于无萼片对照组;处理组在首次呼吸高峰时的呼吸强度峰值均维持在较低水平,说明1-MCP、MA、1-MCP+MA在冰温贮藏前期均可抑制火柿呼吸强度,且1-MCP和1-MCP+MA处理显著低于对照(P<0.05),抑制呼吸作用效果显著。至第60天时,有萼片和无萼片火柿呼吸强度均为MA>1-MCP+MA>对照>1-MCP,且有萼片组1-MCP处理组呼吸强度为最低,说明有萼片组1-MCP处理在贮藏后期抑制柿果呼吸强度效果最好。
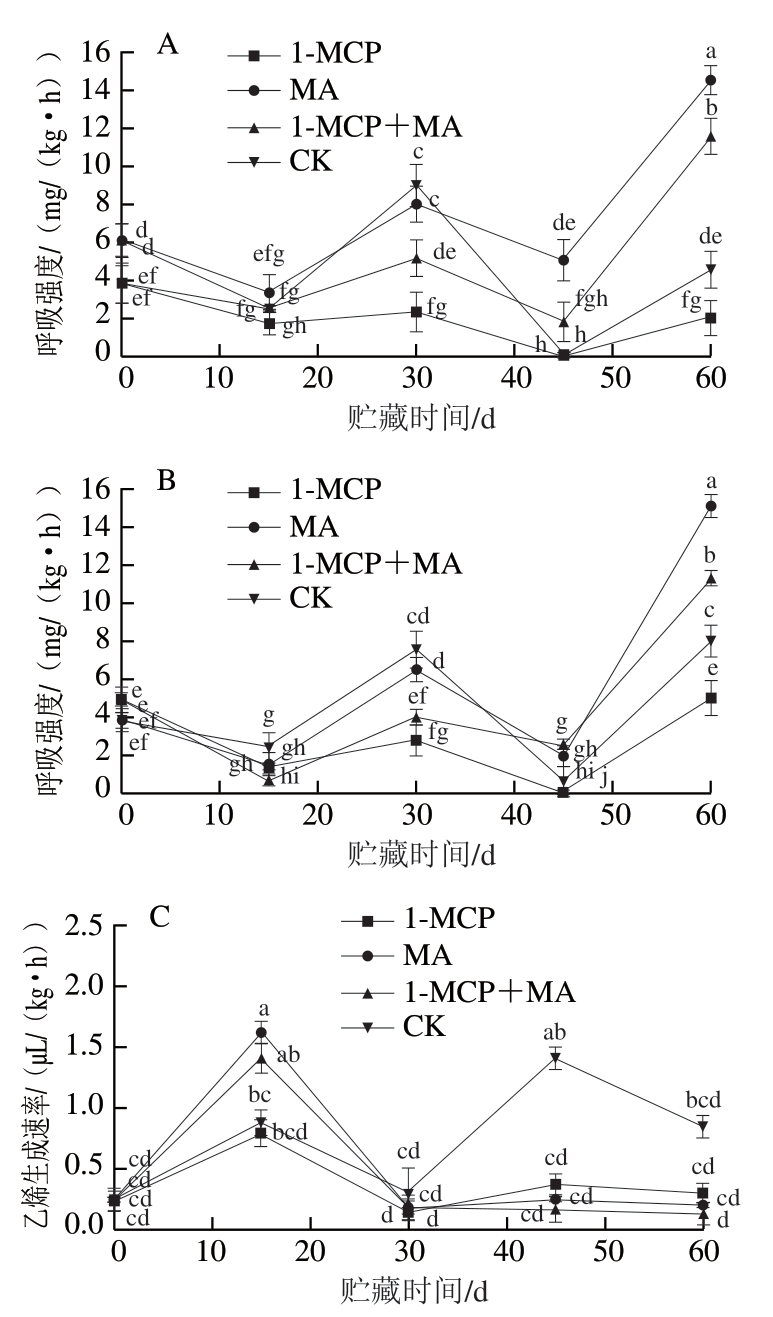
图4 冰温贮藏过程中有萼片和无萼片柿果呼吸强度和乙烯生成速率的变化
Fig. 4 Changes in respiration intensity and ethylene production rate of persimmon fruit with and without calyx lobes during freezing point storage
乙烯生成速率与呼吸强度呈正相关,如图4C、D所示,有、无萼片火柿在第15天时均达到乙烯释放高峰,其中MA>1-MCP+MA>对照>1-MCP。有萼片各处理组中除1-MCP+MA外,其他处理均出现不同强度的二次乙烯释放高峰;而无萼片各处理组在贮藏30 d后不再出现乙烯释放高峰。此外,在第15天火柿达到乙烯释放高峰时,在有、无萼片的样品中MA处理组均高于其他处理组,且无萼片MA处理样品明显高于有萼片MA处理样品,推测是因为贮藏环境内高CO2体积分数使得乙烯生成速率短暂升高,萼片可进行呼吸作用,保留萼片结合MA处理使得箱内CO2体积分数较高,而高CO2体积分数可抑制乙烯释放[24],进而使无萼片MA处理组在达到乙烯释放高峰时的峰值显著高于其他处理组(P<0.05)。综上说明1-MCP结合去萼片、冰温贮藏可较好地抑制火柿的乙烯生成速率,降低贮藏环境内乙烯生成速率,从而延缓火柿的成熟软化进程。
2.5 不同处理对火柿冰温贮藏期间VC、总酚、总黄酮水平的影响
如图5A、B所示,在冰温贮藏过程中,至第60天时,有萼片和无萼片处理柿果VC含量均为1-MCP+MA>1-MCP>MA>对照,且1-MCP+MA、1-MCP处理组VC含量均显著高于对照;但对比初始VC含量,有萼片柿果各处理组略有降低,而无萼片柿果各处理组均有所增加。说明1-MCP、MA、1-MCP+MA处理均可减少火柿VC的损失,其中1-MCP+MA、1-MCP处理效果最佳,结合去萼片处理,能促进火柿VC含量增加,阻止自由基的积累,延缓柿果衰老。如图5C、D所示,在冰温贮藏至第60天时,各处理组总酚质量分数均有所降低,但处理组的总酚质量分数均高于对照组,其中去萼片的1-MCP+MA处理组下降幅度最小,显著高于对照组(P<0.05),说明该处理能在贮藏中后期有效阻止火柿总酚质量分数的降低,控制果肉褐变的发生,保持火柿营养品质。如图5E、F所示,在冰温贮藏过程中,至第60天时,柿果总黄酮质量分数均有所下降,但各处理组的总黄酮质量分数均显著高于对照(P<0.05),其中有萼片柿果1-MCP+MA>1-MCP>MA>对照,无萼片柿果1-MCP>MA>1-MCP+MA>对照,说明1-MCP、MA、1-MCP+MA处理均可减少火柿总黄酮质量分数的降低。综上,至冰温贮藏结束,有、无萼片对照组VC、总酚、总黄酮质量分数总为最低,说明1-MCP、MA、1-MCP+MA处理在贮藏中后期均能降低火柿中VC、总酚、总黄酮质量分数的损耗,尤其以1-MCP+MA效果最佳。
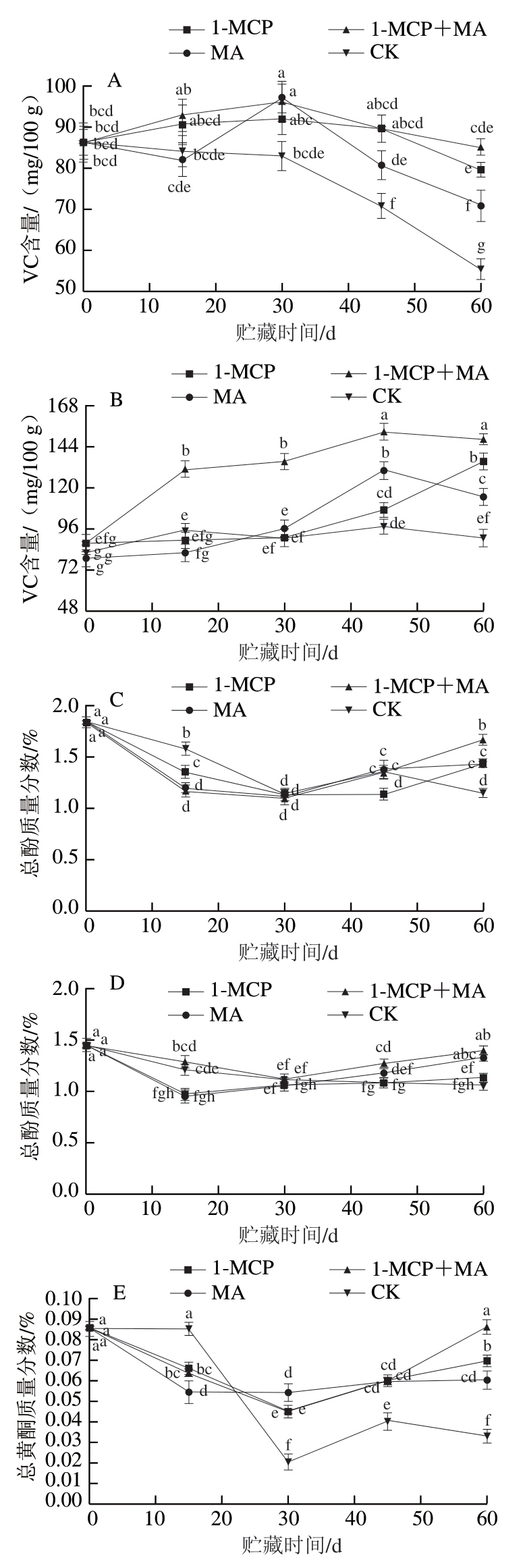
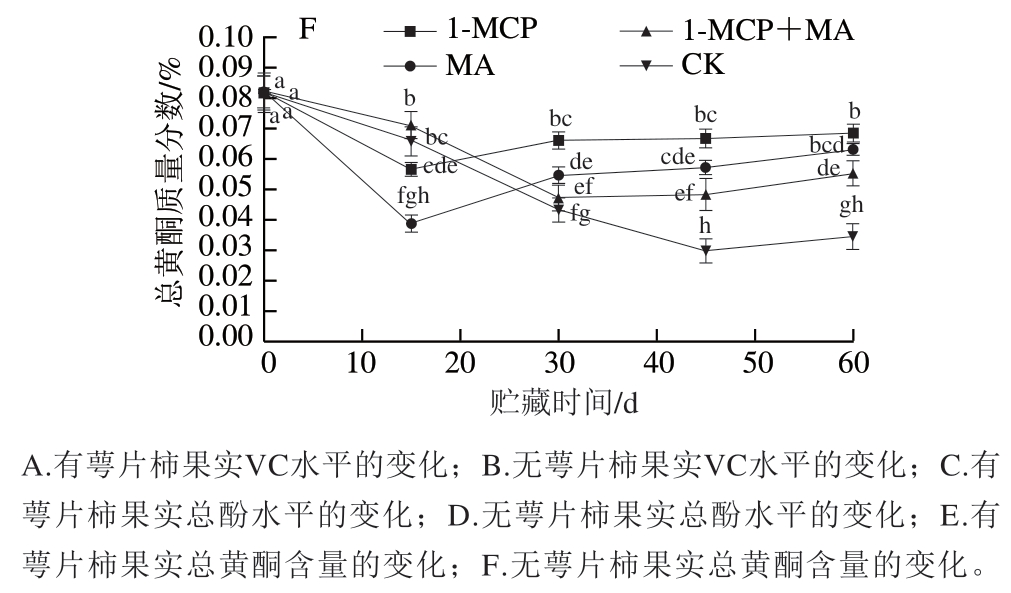
图5 冰温贮藏过程中有萼片和无萼片柿果VC、总酚和总黄酮水平的变化
Fig. 5 Changes in contents of VC, total phenols and total flavonoids in persimmon fruit with and without calyx lobes during freezing point storage
2.6 不同条件处理火柿冰温贮藏期间品质指标的PCA结果
为综合分析各指标与处理条件之间的关系,引入PCA-X可视化与量化不同指标、处理条件之间的相关性。如图6A所示,共提取2 个主成分(principal component,PC)(特征值>1),其中R2X累计方差贡献为0.589,能反映火柿贮藏期间品质变化。为更加直观表现不同指标在不同PC下的表现以及与不同处理方式之间的相关性绘制Biplot双标图,以火柿在冰温贮藏期间不同处理方式下的不同品质指标变化为分析对象,对其进行相关性分析,不同处理方式样品的位置越接近,表示其具有更相近的贮藏品质;不同指标与处理方式的位置越接近,表示其相关性越高。如图6B所示,保留萼片处理与去萼片之间有较明显的区域分布差异,其中尤其以去萼片结合1-MCP+MA、MA处理样品的位置与有萼片各处理样品的位置距离最远,说明去萼片结合1-MCP+MA、MA处理对比对照所引起的贮藏品质变化效果明显。结合各指标在图中的位置可知,去萼片处理与柿果VC含量、果肉硬度、O2体积分数、CO2体积分数、乙烯生成速率、总黄酮质量分数及CX、PG活力的相关性更高,而保留萼片处理与柿果呼吸强度、果皮硬度、总酚质量分数、β-Gal活力的相关性更高。
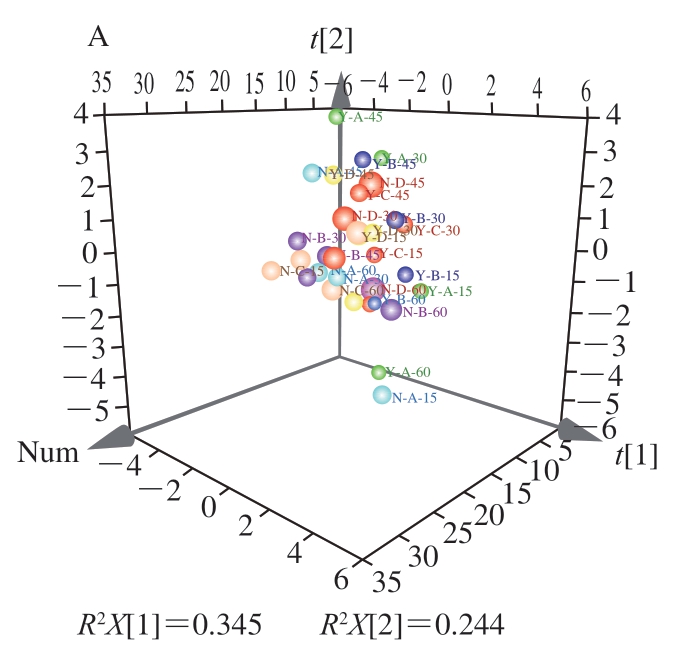
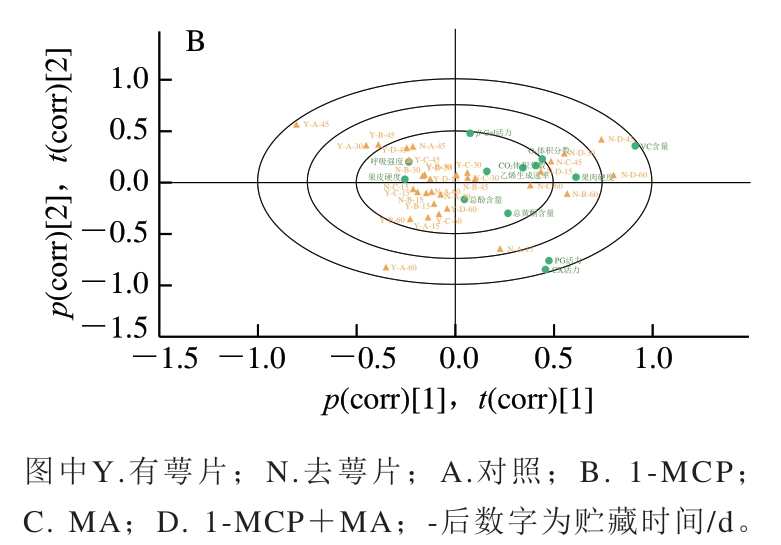
图6 不同条件处理火柿冰温贮藏期间品质指标的PCA-X载荷图(A)及其Biplot双标图(B)
Fig. 6 Principal component analysis-X loading plots of quality indicators in persimmon fruit under different treatment conditions during freezing point storage (A) and their corresponding biplot plots (B)
3 讨 论
柿果实采后软化是一个复杂有序的过程,包括营养成分含量的变化、细胞壁降解相关酶活力的上升、呼吸作用的增强、乙烯释放的急剧增加等,这些因素相互影响。果萼是柿果实的气体交换器官,同时也是环境胁迫的感知器官,比果实的其他部位对胁迫因素更加敏感[19]。1-MCP和MA处理已经成为延长果蔬保鲜期及提高贮藏品质的有效措施,但去除萼片结合1-MCP或MA处理对火柿的软化及贮藏品质的影响尚不明确。在本研究中,综合实验结果发现,去除萼片结合1-MCP、1-MCP+MA处理火柿相对于保留萼片的火柿,延缓软化和提高贮藏品质效果更好。呼吸强度往往与贮藏环境内O2、CO2体积分数、乙烯释放量密切相关,是衡量果实生理代谢强弱的重要指标。乙烯是调控果实成熟、衰老的植物激素,通过与质膜上的受体结合启动下游信号传导,引起一系列生理生化反应,如提高果实呼吸强度、促进果实内容物质分解或转化、加剧果实软化等[11,25]。在本研究中,MA结合冰温贮藏能维持火柿贮藏环境一定的CO2体积分数,并降低O2体积分数,建立平衡条件下的适宜气体组成,抑制柿果呼吸作用,且有萼片处理效果优于去萼片处理(图3),可能是因为去除萼片阻断了火柿通过萼片呼吸作用产生CO2的途径。相同贮藏时间下,有、无萼片的1-MCP+MA处理组贮藏环境中体积分数无明显差异;相同贮藏时间有萼片1-MCP+MA组贮藏环境中CO2体积分数明显低于有萼片MA组,去萼片1- MCP+MA组贮藏环境中CO2体积分数总体上低于去萼片MA组(图3A、B),而1-MCP结合冰温贮藏可显著降低采后火柿的呼吸强度和乙烯生成速率(P<0.05)(图4),说明1-MCP和去萼片处理同样具有抑制柿果呼吸作用、降低乙烯生成速率的效果,主要是因为1-MCP在果实贮藏成熟过程中通过抑制乙烯受体的感知来阻碍其与受体的正常结合,并强烈竞争乙烯受体,通过金属原子与乙烯受体紧密结合,使受体保持钝化状态,抑制乙烯释放[4],且本实验均在冰温条件下进行,冰温贮藏措施通过减缓柿果代谢活性,对乙烯释放同样起到了抑制作用[26]。此外,本实验发现有、无萼片火柿在第15天时均达到乙烯释放高峰(图4C、D),出现在首次呼吸强度高峰(贮藏30 d)之前,推测是因为贮藏环境中高CO2体积分数使乙烯生成速率暂时升高[27]。不同果实的呼吸强度高峰与乙烯释放高峰出现时间的先后次序不同[28],在本实验中,火柿的乙烯释放高峰先于呼吸强度高峰,且通过对比发现,不同处理方式仅影响柿果呼吸强度与乙烯生成速率,并不影响呼吸强度高峰与乙烯释放高峰的出现时间。有萼片各处理组中除1-MCP+MA外,其他处理均出现不同程度的二次乙烯释放高峰(图4C),而去萼片处理在30 d后不再出现乙烯释放高峰(图4D),可能是因为采后柿果中乙烯的生物合成最初发生在果萼中[29],而去萼片处理使柿果失去了萼片参与的呼吸作用,并且无法将萼片中产生的乙烯扩散到其他组织并产生二次乙烯释放高峰。
果实呼吸强度和乙烯生成与VC、总酚、总黄酮的合成和降解密切相关。采后生理代谢受多种因素影响,且在贮藏期间个体差异较大,因此本实验火柿中的VC、总酚、总黄酮水平变化有一定的波动性。但仍可看出1-MCP、MA、1-MCP+MA结合冰温处理均有助于减少火柿在贮藏期间VC、总酚、总黄酮的损失,尤其在贮藏后期,1-MCP+MA处理总体上效果最为显著(P<0.05),且去萼片处理效果整体上优于保留萼片。
柿采后果实软化是细胞壁结构、组分的改变以及内部多糖降解的结果[30],其中细胞壁降解酶(CX、PG、果胶甲酯酶和β-Gal)的作用是导致果实软化的主要原因[11,31]。一般细胞壁降解相关酶的活力越高,表明果实硬度越低,软化程度越高,越不利于贮藏。在经过1-MCP、MA、1-MCP+MA处理后,各处理组火柿硬度均高于对照组(图1),这与在梨[32-33]、苹果[34]、桃[35]、樱桃[36]等果实得出的结论一致,其中尤其以1-MCP、1-MCP+MA结合去萼片处理效果显著。此外,本实验发现1-MCP处理组果肉硬度对比初始硬度明显增高,出现非正常硬化,推测是否由于去除萼片而导致缺氧引起,其生理机制有待进一步研究。对比CX、PG和β-Gal活力实验结果(图2),发现随着CX、PG活力的降低,火柿果皮、果肉硬度下降幅度变小,CX、PG活力和柿果硬度呈负相关。此外,虽然至第60天时对照组CX、PG活力对比其他处理最低,但硬度依旧最低,柿果软化最严重。本实验证明1-MCP处理火柿可通过抑制CX、PG活力来维持柿子的硬度[3,37],且去萼片处理对抑制CX、PG活力效果优于保留萼片,推测是由于去萼片处理降低火柿总体呼吸强度,抑制其内部代谢。有研究报道采后柿果会因为自身呼吸作用而失水,发生水分胁迫,进而诱导萼片中DK-NCED1基因的表达并诱导产生ABA,而ABA诱导乙烯生物合成酶基因DK-ACS2和乙烯生物合成氧化酶基因DK-ACO1表达,促进乙烯的产生并扩散至果肉组织中,作为次级信号激活乙烯自我催化,导致乙烯释放激增[18-19],因此去萼片处理对CX、PG活力的抑制起到了协同作用。β-Gal主要作用于水果软化早期的细胞壁多糖,使细胞壁发生膨胀进而加速果实软化[38-39]。在本实验贮藏结束时,MA处理组β-Gal活力均低于其他处理组(图2E、F),说明MA处理可抑制β-Gal活力,而1-MCP处理对β-Gal活力无明显抑制作用,推测与本实验1-MCP剂量不足以明显影响β-Gal活力有关,有待进一步研究。有萼片火柿中PG、β-Gal活力整体上大于去萼片火柿,可能是因为去萼片处理影响细胞中多糖的合成,而PG参与降解细胞多糖中的多聚半乳糖醛酸,β-Gal参与降解多聚醛酸,萼片的去除使PG、β-Gal部分代谢通路受到影响,进而导致酶活力降低[40]。
4 结 论
本实验研究1-MCP、MA、1-MCP+MA处理对有、无萼片火柿采后冰温贮藏期间软化及相关生理指标的影响。结果发现,1-MCP、MA及1-MCP+MA均可不同程度降低火柿软化速度,而去除萼片预处理有效延缓了火柿二次乙烯生成高峰的出现,且联合1-MCP显著延缓果肉硬度下降,抑制CX、PG活力,降低呼吸强度、乙烯生成速率以及总黄酮含量的下降,从而延缓了火柿软化进程,提高了贮藏品质。
[1]PARK Y S, CVIKROVA M, MARTINCOVA O, et al. In vitro antioxidative and binding properties of phenolics in traditional, citrus and exotic fruits[J]. Food Research International, 2015, 74: 37-47.DOI:10.1016/j.foodres.2015.04.021.
[2]QI Y W, LIU J, LIU Y F, et al. Polyphenol oxidase plays a critical role in melanin formation in the fruit skin of persimmon (Diospyros kaki cv. ‘Heishi’)[J]. Food Chemistry, 2020, 330(11): 127253.DOI:10.1016/j.foodchem.2020.127253.
[3]LUO Z S. Effect of 1-methylcyclopropene on ripening of postharvest persimmon (Diospyros kaki L.) fruit[J]. LWT-Food Science and Technology, 2007, 40(2): 285-291. DOI:10.1016/j.lwt.2005.10.010.
[4]BELAY Z A, CALEB O J, OPARA L. Influence of initial gas modification on physicochemical quality attributes and molecular changes in fresh and fresh-cut fruit during modified atmosphere packaging[J]. Food Packaging and Shelf Life, 2019, 21: 100359.DOI:10.1016/j.fpsl.2019.100359.
[5]LIU H, JIANG W B, CAO J K, et al. A combination of 1-methylcyclopropene treatment and intermittent warming alleviates chilling injury and affects phenolics and antioxidant activity of peach fruit during storage[J]. Scientia Horticulturae, 2018, 229: 175-181.DOI:10.1016/j.scienta.2017.11.010.
[6]李英丽, 张少颖, 董宇. 采前1-甲基环丙烯处理对货架期‘Bartlett’梨虎皮病和抗氧化特性的影响[J]. 食品科学, 2021, 42(1): 250-256.DOI:10.7506/spkx1002-6630-20191202-006.
[7]LWIN H P, CHOI J H, CHUN J P, et al. 1-Methylcyclopropene treatment alters fruit quality attributes and targeted metabolites in‘Wonhwang’ pears during shelf life[J]. Scientia Horticulturae, 2021,284: 110125. DOI:10.1016/j.scienta.2021.110125.
[8]郭丹, 韩英群, 魏鑫, 等. 1-MCP处理对“岳帅”苹果冷藏软化及相关生理指标的影响[J]. 食品科学, 2017, 38(17): 266-272. DOI:10.7506/spkx1002-6630-201717043.
[9]WIN N M, YOO J, NAING A H, et al. 1-Methylcyclopropene (1-MCP)treatment delays modification of cell wall pectin and fruit softening in“Hwangok” and “Picnic” apples during cold storage[J]. Postharvest Biology and Technology, 2021, 180: 111599. DOI:10.1016/j.postharvbio.2021.111599.
[10]王慧, 陈燕华, 林河通, 等. 纸片型1-MCP处理对安溪油柿果实采后生理和贮藏品质的影响[J]. 食品科学, 2018, 39(21): 253-259.DOI:10.7506/spkx1002-6630-201821038.
[11]WANG H, CHEN Y H, LIN H T, et al. 1-Methylcyclopropene containing-papers suppress the disassembly of cell wall polysaccharides in Anxi persimmon fruit during storage[J].International Journal of Biological Macromolecules, 2020, 151: 723-729. DOI:10.1016/j.ijbiomac.2020.02.146.
[12]ZHANG W L, ZHAO H D, JIANG H T, et al. Multiple 1-MCP treatment more effectively alleviated postharvest nectarine chilling injury than conventional one-time 1-MCP treatment by regulating ROS and energy metabolism[J]. Food Chemistry, 2020, 330: 127256.DOI:10.1016/j.foodchem.2020.127256.
[13]张鲜桃, 杜美军, 李海登, 等. 1-MCP结合PVC膜低温贮藏下磨盘柿品质变化的研究[J]. 食品研究与开发, 2020, 41(15): 58-62.DOI:10.12161/j.issn.1005-6521.2020.15.011.
[14]TESSMER M A, APPEZZATO-DA-GlÓRIA B, KLUGE R A.Evaluation of storage temperatures to astringency ‘Giombo’persimmon: storage at 1 ℃ combined with 1-MCP is recommended to alleviate chilling injury[J]. Scientia Horticulturae, 2019, 257: 108675.DOI:10.1016/j.scienta.2019.108675.
[15]魏宝东, 梁冰, 张鹏, 等. 1-MCP处理结合冰温贮藏对磨盘柿果实软化衰老的影响[J]. 食品科学, 2014, 35(10): 236-240. DOI:10.7506/spkx1002-6630-201410044.
[16]ZHAO Q, JIN M, GUO L, et al. Modified atmosphere packaging and 1-methylcyclopropene alleviate chilling injury of ‘Youhou’ sweet persimmon during cold storage[J]. Food Packaging and Shelf Life,2020, 24: 100479. DOI:10.1016/j.fpsl.2020.100479.
[17]赵倩兮. 自发性气调包装与1-甲基环丙烯处理对‘阳丰’甜柿采后冷害的控制作用[D]. 杨凌: 西北农林科技大学, 2019: 21-35.
[18]NAKANO R, OGURA E, INABA K A. Ethylene biosynthesis in detached young persimmon fruit is initiated in calyx and modulated by water loss from the fruit[J]. Plant Physiology, 2003, 131(1): 276-286.DOI:10.2307/4280887.
[19]冷平, 张光连, 李祥欣, 等. 柿果萼ABA生物合成关键酶基因NCED的克隆及ABA对柿离体幼果乙烯的调节[J]. 科学通报, 2009,54(14): 2082-2088. DOI:10.1360/csb2009-54-14-2082.
[20]曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007: 48.
[21]CHANG E H, LEE J S, KIM J G. Cell wall degrading enzymes activity is altered by high carbon dioxide treatment in postharvest‘Mihong’ peach fruit[J]. Scientia Horticulturae, 2017, 225: 399-407.DOI:10.1016/j.scienta.2017.07.038.
[22]BOTH V, THEWES F R, BRACKMANN A, et al. Effect of low oxygen conditioning and ultralow oxygen storage on the volatile profile, ethylene production and respiration rate of ‘Royal Gala’apples[J]. Scientia Horticulturae, 2016, 209: 156-164. DOI:10.1016/j.scienta.2016.06.028.
[23]LU H F, LOU H Q, ZHENG H, et al. Nondestructive evaluation of quality changes and the optimum time for harvesting during jujube(Zizyphus Jujuba Mill. cv. Changhong) fruits development[J]. Food &Bioprocess Technology, 2012, 5(6): 2586-2595. DOI:10.1007/s11947-011-0640-5.
[24]WILD H, BALK P A, FERNANDES E, et al. The action site of carbon dioxide in relation to inhibition of ethylene production in tomato fruit[J]. Postharvest Biology & Technology, 2005, 36(3): 273-280.DOI:10.1016/j.postharvbio.2005.02.004.
[25]KHAN A S, SINGH Z. 1-MCP regulates ethylene biosynthesis and fruit softening during ripening of ‘Tegan Blue’ plum[J]. Postharvest Biology & Technology, 2007, 43(3): 298-306. DOI:10.1016/j.postharvbio.2006.10.005.
[26]ARNAL L, DEL RÌO M A. Effect of cold storage and removal astringency on quality of persimmon fruit (Diospyros kaki, L.) cv. rojo brillante[J]. Food Science & Technology International, 2004, 10(3):179-185. DOI:10.1177/1082013204044824.
[27]ISHIMARU M, CHACHIN K, WADA Y, et al. Relationship between fruit softening and the change of pectic or hemicellulosic compounds in cell wall of Japanese persimmon ‘Hiratanenashi’ treated with different methods for removing astringency[J]. Food Preservation Science, 2001, 27(4): 197-204. DOI:10.5891/jafps.27.197.
[28]GOLDENING J B, SHEARER D, WHLLIE S G, et al. Application of 1-MCP and propylene to identify ethylenedependent ripening progresses in mature banana fruit[J]. Postharvest Biology and Technology,1998, 14(1): 87-98. DOI:10.1016/S0925-5214(98)00032-5.
[29]NAKANO R, OGURA E, INABA K A. Ethylene biosynthesis in detached young persimmon fruit is initiated in calyx and modulated by water loss from the fruit[J]. Plant Physiology, 2003, 131(1): 276-286.DOI:10.2307/4280887.
[30]FISCHER R L, BENNETT A B. Role of cell wall hydrolases in fruit ripening[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42(1): 675-703. DOI:10.1146/annurev.pp.42.060191.003331.
[31]CORNUAULT V, POSE S, KNOX J P. Extraction, texture analysis and polysaccharide epitope mapping data of sequential extracts of strawberry, apple, tomato and aubergine fruit parenchyma[J]. Data in Brief, 2018: 314-320. DOI:10.1016/j.dib.2018.01.013.
[32]GUO J M, WEI X Y, LV E L, et al. Ripening behavior and quality of 1-MCP treated d’Anjou pears during controlled atmosphere storage[J]. Food Control, 2020, 117: 107364. DOI:10.1016/j.foodcont.2020.107364.
[33]ZHAO J, XIE X B, WANG S S, et al. 1-Methylcyclopropene affects ethylene synthesis and chlorophyll degradation during cold storage of ‘Comice’ pears[J]. Scientia Horticulturae, 2020, 260: 108865.DOI:10.1016/j.scienta.2019.108865.
[34]何近刚, 冯云霄, 程玉豆, 等. 采后1-MCP和MAP处理对‘红富士’苹果冷藏和货架期品质的影响[J]. 食品科学, 2016, 37(22): 301-306.DOI:10.7506/spkx1002-6630-201622046.
[35]CAI H F, HAN S, JIANG L, et al. 1-MCP treatment affects peach fruit aroma metabolism as revealed by transcriptomics and metabolite analyses[J]. Food Research International, 2019, 122: 573-584.DOI:10.1016/j.foodres.2019.01.026.
[36]SERRADILLA M J, FALAGAN N, BOHMER B, et al. The role of ethylene and 1-MCP in early-season sweet cherry ‘Burlat’ storage life[J]. Scientia Horticulturae, 2019, 258: 108787. DOI:10.1016/j.scienta.2019.108787.
[37]WANG H, CHEN Y H, LIN H T, et al. 1-Methylcyclopropene containing-papers suppress the disassembly of cell wall polysaccharides in Anxi persimmon fruit during storage[J].International Journal of Biological Macromolecules, 2020, 151: 723-729. DOI:10.1016/j.ijbiomac.2020.02.146.
[38]CHEN Y, HUNG Y, CHEN M, et al. Effects of acidic electrolyzed oxidizing water on retarding cell wall degradation and delaying softening of blueberries during postharvest storage[J]. LWTFood Science and Technology, 2017, 84: 650-657. DOI:10.1016/j.lwt.2017.06.011.
[39]ZHENG G H, SUGIURA A. Changes in sugar composition in relation to invertase activity in the growth and ripening of persimmon (Diospyros kaki) fruits[J]. Journal of the Japanese Society for Horticultural Science, 1990, 59(2): 281-287. DOI:10.2503/jjshs.59.281.
[40]NG J, SCHRÖDER R, BRUMMELL D A, et al. Lower cell wall pectin solubilisation and galactose loss during early fruit development in apple (Malus x domestica) cultivar ‘Scifresh’ are associated with slower softening rate[J]. Journal of Plant Physiology, 2015, 176: 129-137. DOI:10.1016/j.jplph.2014.12.012.