蓝莓(Vaccinium spp.)和蓝靛果(Lonicera cearulea L.)均含有丰富的营养成分及生物活性物质(如维生素、氨基酸、花青素、多酚及黄酮等)[1-2],具有较强的抗氧化能力和保健功能,如预防心血管疾病、糖尿病及其他慢性疾病[3-5],抗癌[6]和护肝[7]。然而蓝靛果令人不愉悦的酸味和苦涩味[7]影响了消费者对其接受程度。将蓝莓和蓝靛果进行复配可以改善蓝靛果的口感,并提升复合产品的营养品质。此外,蓝莓和蓝靛果的水分含量高、表皮较软,运输过程中碰撞易受机械损伤,采后损失率较高,不易贮藏[8]。因此,一般主要将蓝莓和蓝靛果加工为果脯、果汁、果粉等产品[9-10],以延长其保质期,同时提升其经济价值。
真空冷冻干燥是目前浆果加工的主要方式之一,具有营养物质保留率高的优点,同时可以减少加工及贮藏过程中影响产品品质的化学反应的发生[11-12]。目前,关于蓝莓和蓝靛果的研究主要集中在不同干燥方式的比较、营养和外观品质的评价方面[2,13]。Reyes等[14]探究了红外预处理、常压冷冻干燥和真空冷冻干燥对蓝莓营养品质的影响,Mejia-Meza等[15]研究了微波-真空、热风和真空冷冻干燥对蓝莓营养品质的影响,邵春霖等[16]研究了不同干燥方式对蓝莓品质的影响。结果均表明真空冷冻干燥或者真空条件下可以更好地保持蓝莓的营养成分、酚类物质和复水性、保色性。而对于蓝莓和蓝靛果产品在不同温度及相对湿度(relative humidity,Hr)条件下贮藏稳定性的研究较少。
本实验以蓝莓-蓝靛果复合冻干粉为研究对象,研究复合果粉在不同温度(4、25、37 ℃)及Hr(43%、75%、95%)贮藏12 周内的水分质量分数、玻璃化转变温度(Tg)、亮度、抗氧化能力和抗氧化物质的动态变化规律,并探究复合果粉的加工特性变化及花色苷降解规律,旨在为蓝莓-蓝靛果复合冻干粉加工、运输和销售过程中评估其贮藏稳定性提供参考依据。
1 材料与方法
1.1 材料与试剂
‘蓝丰’蓝莓和‘蓝精灵’蓝靛果产自黑龙江哈尔滨。
氢氧化钠、亚硝酸钠、无水碳酸钠、氯化钾(均为分析纯试剂) 国药集团化学试剂有限公司;2,2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2’-azinobis(3-ehtylbenzthiazolin-6-sulphonate,ABTS)阳离子自由基清除能力测定试剂盒、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定试剂盒、铁离子还原能力(ferric reducing ability of plasma,FRAP)测定试剂盒南京建成生物工程研究所;飞燕草素-3-O-葡萄糖苷(delphinidin-3-O-glucoside,Del-3-O-glu)、矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,Cya-3-O-glu)、飞燕草素-3-O-阿拉伯糖苷(delphinidin-3-O-arabinoside,Del-3-O-ara)、矮牵牛素-3-O-半乳糖苷(petunidin-3-O-galactoside, Pet-3-O-gal)、芍药素-3-O-葡萄糖苷(peonidin-3-O-glucoside,Peo-3-O-glu)、矢车菊素-3-O-芸香糖苷(cyanidin-3-O-rutinoside,Cya-3-O-rut)、芦丁、没食子酸标准品 上海源叶生物科技有限公司。
1.2 仪器与设备
3K15离心机 德国Sigma公司;UV1800紫外-分光光度计 日本岛津公司;DK-S26电热恒温水浴锅上海精宏实验设备有限公司;KQ-500E超声清洗设备昆山市超声仪器有限公司;CPA124S电子天平 北京赛多利斯科学仪器有限公司;DHG-9203电热恒温鼓风干燥箱 上海一恒科技有限公司;DSC-800差示扫描量热仪 美国PE公司;FT4多功能粉体分析仪 英国Freeman Technology公司;DVS-Intrinsic水分动态吸附仪英国SMS公司;JYL-C51V料理机 中国九阳股份有限公司;D700数码相机 日本Nikon公司;电子眼色彩分析系统1.5.5.0 美国Lens Eye-NET公司;6470液相色谱-三重四极杆串联质谱联用仪 美国安捷伦公司;LG-50真空冷冻干燥设备 沈阳航天新阳速冻设备制造有限公司。
1.3 方法
1.3.1 样品前处理
选择新鲜、成熟度一致的蓝莓和蓝靛果果粒,于-40 ℃冷库保存备用。首先分别取500 g蓝莓、蓝靛果,化冻后分别匀浆3 次,每次10 s;再将蓝莓、蓝靛果果浆按照质量比5∶3进行复配;经胶体磨匀浆3 次得到均匀度一致的复配果浆后立即装入不锈钢盒(200 mm×110 mm×48 mm)中,容积约400 mL,放置于-80 ℃冰箱保存,预冻不少于8 h后进行冷冻干燥。
1.3.2 真空冷冻干燥及粉体制备
设置真空冷冻干燥升温程序:30 min由室温升至50 ℃,保持至330 min,20 min升温至60 ℃;真空压力为65 Pa,冷阱温度为-35 ℃;待冷阱温度稳定,取出已预冻好的果浆立即放入真空冷冻干燥仓,冻干至水分质量分数低于5%。干燥样品经粉碎机粉碎15 s,得到蓝莓-蓝靛果复合冻干粉,粉体粒径在150~300 目之间。
1.3.3 包装及贮藏条件
选择聚对苯二甲酸乙二醇酯/铝/聚乙烯为蓝莓-蓝靛果复合果粉的最佳包材,其中水蒸气透过量为0.3 g/(m2·d),氧气透过量为0.1 cm3/(m2·d·0.1 MPa),包装规格为45 mm×150 mm(12 g/条)。
在Hr为75%时,研究不同贮藏温度(4、25、37 ℃)对蓝莓-蓝靛果复合冻干粉基本理化指标、抗氧化能力及花色苷含量的影响;在贮藏温度25 ℃下,研究不同Hr(43%、75%和95%)对蓝莓-蓝靛果复合冻干粉贮藏品质的影响。总贮藏时间为12 周,每两周测定其亮度、Tg、吸湿等温线、抗氧化物质、抗氧化能力及粉体加工特性。其中,以贮藏初始(0 d)的样品作为对照组。
1.3.4 基本理化指标测定
1.3.4.1 水分质量分数
取蓝莓-蓝靛果复合冻干粉参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[17]测定水分质量分数。
1.3.4.2 亮度
采用数码相机对样品进行拍照,然后采用电子眼色彩分析系统1.5.5.0标准黑板、白板校正后,测定贮藏过程中的蓝莓-蓝靛果复合冻干粉的亮度(L*值)。
1.3.4.3 玻璃化转变温度
参照文献[18]并稍作修改,采用差示扫描量热仪双扫描程序测定含非冻结水样品的Tg:样品以10 ℃/min的速率从室温(25 ℃)降至-70 ℃,保持10 min,然后以10 ℃/min的速率升温至60 ℃。再重复以上步骤,从60 ℃以10 ℃/min的速率降至-70 ℃,然后再以10 ℃/min的速率升温至60 ℃。采用仪器自带软件分析热流密度曲线,得到玻璃化转化初始点、中点及终点的转变温度,中点处的温度即为Tg。
1.3.5 抗氧化物质含量和抗氧化能力测定
1.3.5.1 提取液制备
参照文献[19]进行提取液制备。精密称取2.00 g冻干果粉于具塞试管中,加入10.0 mL 80%(体积分数)甲醇溶液,于室温下40 kHz超声提取30 min,经10 000 r/min离心10 min后,取上清液,重复上述提取操作3 次,合并上清液并定容至50 mL,于-20 ℃下保存用于总酚、总黄酮含量及抗氧化能力测定。
1.3.5.2 总酚含量的测定
参照文献[19]测定总酚含量。取1 mL 1.3.5.1节提取液稀释10 倍,然后取2 mL稀释后的待测液于试管中,加入1 mL 10%(体积分数)福林-酚显色剂,静置5 min后加入2 mL 4%(质量分数)碳酸钠溶液,混匀后于85 ℃反应5 min,再加入5 mL蒸馏水定容至10 mL。取2 mL稀释后的待测液于试管中,加入3 mL 80%(体积分数)甲醇溶液,再加入5 mL蒸馏水定容至10 mL作为空白对照,测定765 nm波长处的吸光度。以没食子酸为标准品绘制标准曲线,总酚含量以没食子酸当量表示,单位为mg/g。
1.3.5.3 总黄酮含量
参照文献[19]测定总黄酮含量。取0.2 mL 1.3.5.1节提取液,加入80%(体积分数)甲醇溶液定容至4.0 mL,再加入0.5 mL 5%(质量分数)亚硝酸钠溶液,摇匀,放置6 min,加入0.5 mL 10%(质量分数)硝酸铝溶液,摇匀,放置6 min,加入4.0 mL 4%氢氧化钠溶液,蒸馏水定容至10.0 mL,摇匀,放置15 min。取0.2 mL 1.3.5.1节提取液,加入80%(体积分数)甲醇溶液定容至4.0 mL,加入蒸馏水定容至10.0 mL作为对照,测定510 nm波长处的吸光度。以芦丁为标准品制作标准曲线。总黄酮含量以芦丁当量表示,单位为mg/g。
1.3.5.4 抗氧化能力测定
取1.3.5.1节提取液分别参照ABTS阳离子自由基清除能力、DPPH自由基清除能力、FRAP测定试剂盒说明书测定抗氧化能力,结果以Trolox当量表示,单位分别为μmol/g、mg/g、μmol/g。
1.3.6 花色苷组成的分析
1.3.6.1 花色苷提取液制备
取1.5 g蓝莓-蓝靛果复合冻干粉置于具塞试管中,加入15 mL提取液(含0.1%(体积分数)浓盐酸(质量分数36.5%)的无水甲醇溶液),在4 ℃条件下避光静置14 h后,11 000 r/min离心10 min,收集上清液置于-40 ℃保存,沉淀物重复上述花色苷提取操作两次。收集合并上清液,真空旋转浓缩(温度低于30 ℃)提取液至近干,残留物用色谱级甲醇定容至10 mL,经0.45 μm滤膜过滤后待用。
1.3.6.2 花色苷含量的测定
采用6470液相色谱-三重四极杆串联质谱联用仪分析贮藏过程中样品中6 种花色苷组成。色谱柱为orbax SB-C18柱(2.1 mm×50 mm×1.8 μm),流速为0.300 mL/min,进样量为2 μL。采用二元流动相体系:流动相A为1%(体积分数)甲酸水溶液,流动相B为乙腈(色谱纯);梯度洗脱程序:0~5 min,95% A;5~20 min,95%~91% A;20~22 min,91%~30% A;22~23 min,30%~10% A;23~25 min,10% A;25~26 min,10%~95% A;26~29 min,95% A。电离方式:电喷雾电离正离子模式;扫描方式:多反应检测;检测特征离子参数见表1。以各种花色苷含量为横坐标,峰面积为纵坐标绘制标准曲线,所得标准曲线方程如表2所示。
表1 6 种花色苷特征离子检测参数
Table 1 Mass spectrometric parameters for six anthocyanins
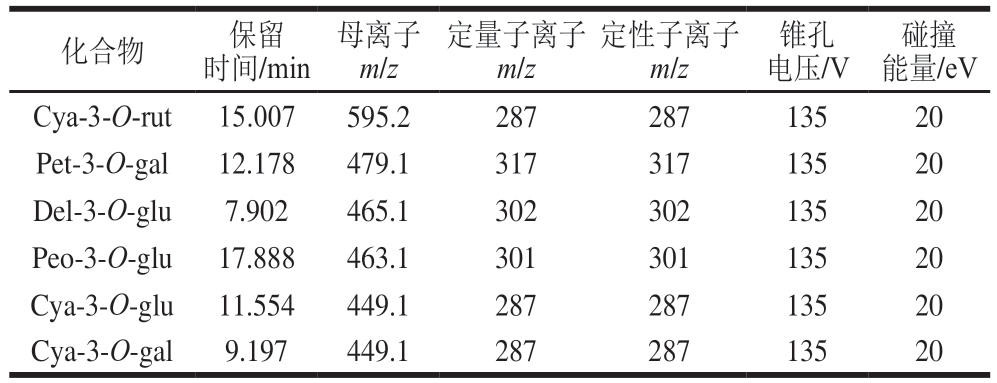
碰撞能量/eV Cya-3-O-rut 15.007 595.2 287 287 135 20 Pet-3-O-gal 12.178 479.1 317 317 135 20 Del-3-O-glu 7.902 465.1 302 302 135 20 Peo-3-O-glu 17.888 463.1 301 301 135 20 Cya-3-O-glu 11.554 449.1 287 287 135 20 Cya-3-O-gal 9.197 449.1 287 287 135 20化合物 保留时间/min母离子m/z定量子离子m/z定性子离子m/z锥孔电压/V
表2 6 种花色苷含量的线性范围、标准曲线方程、决定系数
Table 2 Linear ranges, calibration curves equation, and determination coefficients for six anthocyanins content
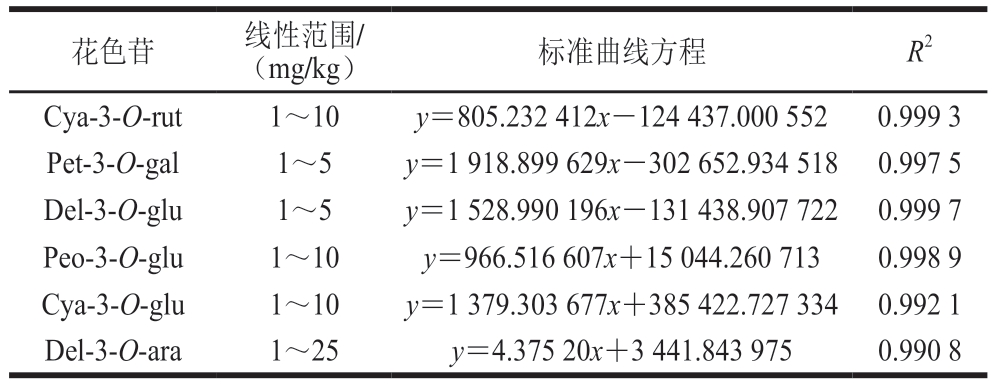
花色苷 线性范围/(mg/kg) 标准曲线方程 R2 Cya-3-O-rut 1~10 y=805.232 412x-124 437.000 552 0.999 3 Pet-3-O-gal 1~5 y=1 918.899 629x-302 652.934 518 0.997 5 Del-3-O-glu 1~5 y=1 528.990 196x-131 438.907 722 0.999 7 Peo-3-O-glu 1~10 y=966.516 607x+15 044.260 713 0.998 9 Cya-3-O-glu 1~10 y=1 379.303 677x+385 422.727 334 0.992 1 Del-3-O-ara 1~25 y=4.375 20x+3 441.843 975 0.990 8
1.3.7 粉体加工特性分析
粉体流动特性是评估贮藏稳定性的重要指标,采用FT4多功能粉体分析仪在室温下测定粉体基本流动能(basic flow energy,BFE)。BFE用来定量描述容器中粉体在特定流动模式下所需能量。测定方法:首先对样品去除包装进行预处理,将蓝莓-蓝靛果复合冻干粉置于玻璃量杯(25 mm×25 mL)中,仪器自动记录样品质量,并采用23.5 mm螺旋桨以顺时针旋转下降速率为40 mm/s对粉体样品预处理1 次,以消除在测试前粉体颗粒间的残余应力和过量空气,使堆积应力在粉体样品中均匀分布。然后设置螺旋桨逆时针旋转下降速率为100 mm/s,当螺旋桨下行穿过粉体时,通过测定轴向阻力以及转矩所做功来计算不同高度下粉体的能量变化以及粉体流动所需要的能量-能量变化曲线[20-21](式(1));特别流动能(specific energy,SE)为螺旋桨以顺时针旋转上升速率为40 mm/s时单位质量粉体的流动能(式(2)),其主要描述处于松散或者堆积状态下的流动性质。实验重复3 次。
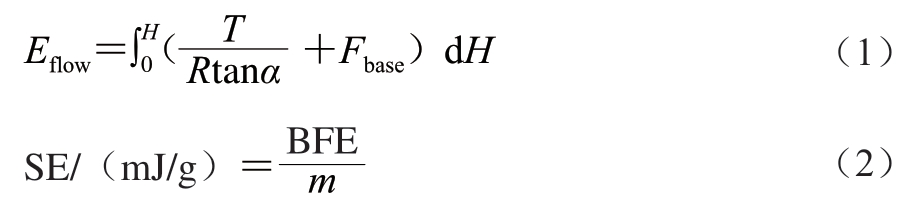
式中:Eflow为粉体BFE/mJ;T为转矩/(mN·m);R为叶片半径/mm;α为螺旋角/(°);Fbase为螺旋桨垂直于粉体底部的作用力/N;H为穿入粉体深度/mm;m为粉体质量/g。
1.4 数据处理与统计分析
每个实验重复3 次,结果用平均值±标准差表示。采用Excel 2016软件、Origin 2018软件及SPSS 22.0软件进行数据处理及统计分析,采用单因素方差分析比较数据差异,采用Duncan检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 蓝莓-蓝靛果复合冻干粉贮藏过程中基本理化性质变化
2.1.1 水分质量分数及Tg
水分质量分数及Tg与样品贮藏品质密切相关,其在贮藏期间的变化规律如图1所示。不同贮藏条件下的样品贮藏至12 周均出现了水分质量分数升高的趋势。其中在25 ℃下贮藏12 周后,Hr 75%条件下水分质量分数增加最多,由4.2%(贮藏0 d)上升至9.5%;Hr 43%时次之(升至9.2%);Hr 95%条件下增加最少(升至9.0%);不同相对湿度条件对蓝莓-蓝靛果复合冻干粉的水分质量分数影响不明显。在Hr 75%条件下贮藏12 周后,25 ℃下样品的水分质量分数增加最多(升至9.5%),37 ℃下样品次之(升至9.1%),但二者之间水分质量分数差异不明显,而4 ℃下样品的水分质量分数增加最少(升至8.4%)。相比于温度,相对湿度条件对粉体的水分质量分数影响更明显。低温和低湿度条件更利于粉体的贮藏。
食品的Tg主要与含水量、溶质成分和分子质量有关[22]。由于贮藏期间水分质量分数的增加,Tg呈明显下降趋势;贮藏12 周的粉体样品的热流曲线未检测出熔融峰,与先前研究结果[23-26]相似。其中,25 ℃、Hr 95 %条件下样品的Tg降低最多,由18.81 ℃降低至10.97 ℃;25 ℃、Hr 75%次之;25 ℃、Hr 43%条件下样品的Tg下降(4.62 ℃)最少,4 ℃、Hr 75%次之;表明低温和低湿度条件下粉体更利于贮藏。
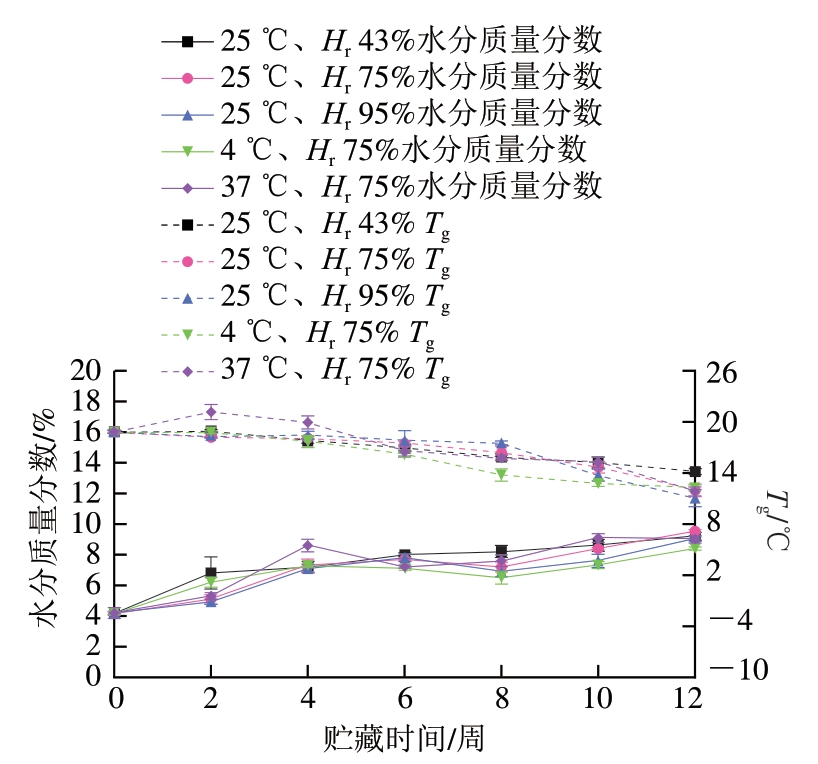
图1 贮藏时间对蓝莓-蓝靛果复合冻干粉的水分质量分数及Tg的影响
Fig. 1 Effect of storage time on moisture content and Tg of freeze-dried mixed blueberry-blue honeysuckle berry powder
2.1.2 亮度
色泽是消费者对产品直观评判的一个重要因素,其中L*值是反映蓝莓-蓝靛果复合浆果粉色泽品质的重要指标。如图2所示,不同条件下贮藏12 周后L*值均明显降低。其中,在25 ℃下,随着Hr增大,L*值逐渐降低;在Hr 75%条件下,温度越高,总体上L*值降低程度越明显。但是,在贮藏10~12 周,蓝莓-蓝靛果复合果粉在不同贮藏条件下的L*值(约10)均趋于稳定,此时,温度和相对湿度对蓝莓-蓝靛果复合冻干粉L*值的影响不明显;与贮藏前相比,不同贮藏条件下L*值下降约33%。
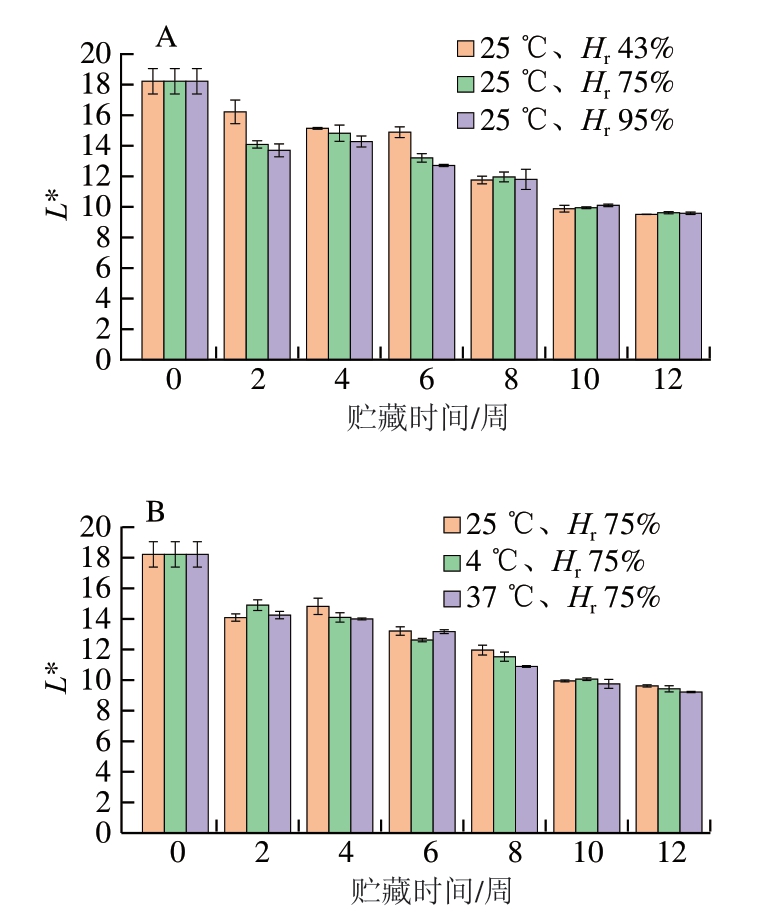
图2 贮藏时间对不同相对湿度(A)和温度(B)条件下样品L*值的影响
Fig. 2 Effect of storage time on L* value of freeze-dried mixed blueberry-blue honeysuckle berry powder under different relative humidities (A) and temperatures (B)
2.2 蓝莓-蓝靛果复合冻干粉贮藏过程中抗氧化物质含量及抗氧化能力变化
2.2.1 总酚含量
酚类物质是蓝莓-蓝靛果复合冻干粉中主要的抗氧化物质之一,总酚变化规律如图3所示。不同条件粉体贮藏12 周的总酚含量均呈下降趋势。对照组样品的总酚含量为(469.72±9.40)mg/g,测定结果与殷海松等[27]测定蓝莓总酚含量结果存在差异,可能是品种间差异或者复配造成的。如图3所示,25 ℃不同相对湿度条件下,随着相对湿度的增加,总酚含量明显下降;在Hr 75%条件下,随着贮藏温度的升高,总酚含量总体逐渐降低。贮藏12 周,25 ℃、Hr 95%条件下总酚含量下降最多(降至187.12 mg/g),下降了60.16%;其次是37 ℃、Hr 75%条件下总酚含量下降较多(降至215.32 mg/g),下降了54.16%。贮藏12 周,25 ℃、Hr 43%条件下总酚含量下降最少(降至249.12 mg/g),下降了46.96%;其次总酚含量下降幅度较小的贮藏条件依次为25℃、Hr 75%(下降了52.93%)和4 ℃、Hr 75%(总酚含量下降了53.85%)。由于酚类物质对高温和高湿度条件敏感,因此37 ℃、Hr 75%和25 ℃、Hr 95%两个条件下总酚含量损失较多。相比于温度,相对湿度条件对总酚含量的影响较大,低温低湿度条件利于蓝莓-蓝靛果复合冻干粉总酚的保留。
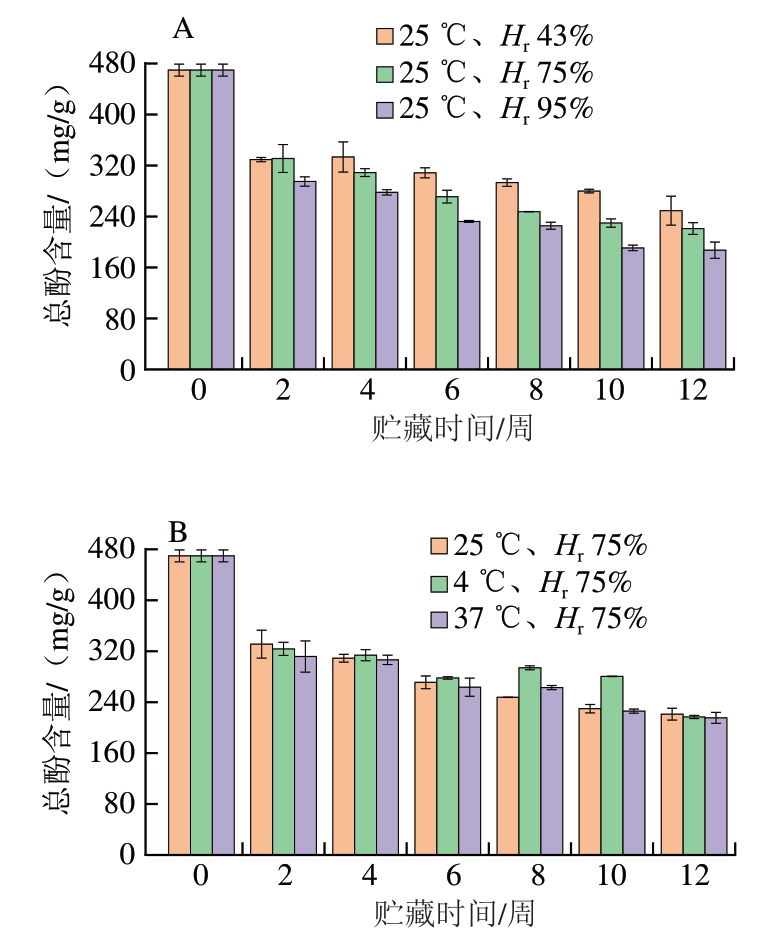
图3 贮藏时间对不同相对湿度(A)和温度(B)条件下样品总酚含量的影响
Fig. 3 Effect of storage time on total phenol content of freeze-dried mixed blueberry-blue honeysuckle berry powder under different relative humidities (A) and temperatures (B)
2.2.2 总黄酮含量
黄酮是蓝莓-蓝靛果复合冻干粉中的主要活性物质,其贮藏期间含量的变化规律如图4所示。不同条件粉体贮藏12 周的总黄酮含量均呈下降趋势。对照组样品的总黄酮含量为(288.32±2.52)mg/g,可能是由于蓝莓-蓝靛果的复配导致总黄酮含量升高[28]。其中,不同贮藏条件下粉体的总黄酮含量均在第2周时下降最多(约40%),与总酚含量呈相同下降趋势。由图4A可以看出,25 ℃下贮藏至12 周,随着Hr的增加,总黄酮含量逐渐下降。贮藏12 周后,Hr 43%条件下总黄酮含量下降最少,降低了60.85%。黄酮类物质与酚类有相同特性,不耐高温和高湿。由图4B可知,贮藏至第12周Hr 75%、4 ℃条件下总黄酮含量下降最少,降低了59.59%;37 ℃下粉体的总黄酮含量下降最多,下降至104 mg/g,降低了63.94%。说明温度较低(4 ℃和25 ℃)黄酮保留率较高,而高温及高湿不利于黄酮物质的保留[29]。当贮藏至第10周后,不同贮藏条件下蓝莓-蓝靛果复合冻干粉的总黄酮含量趋于稳定(约为120 mg/g)。
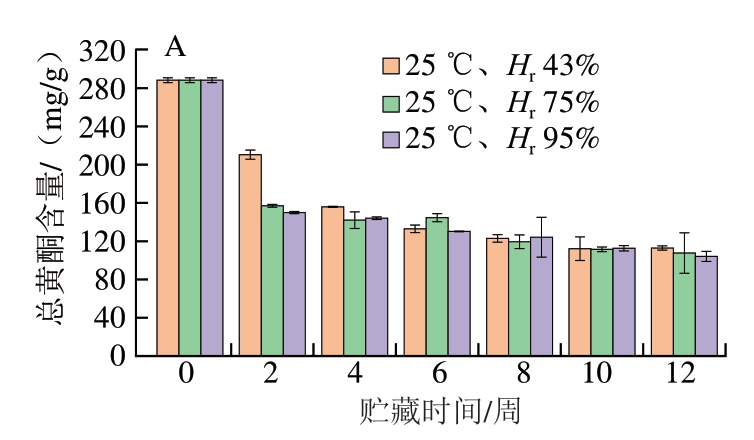
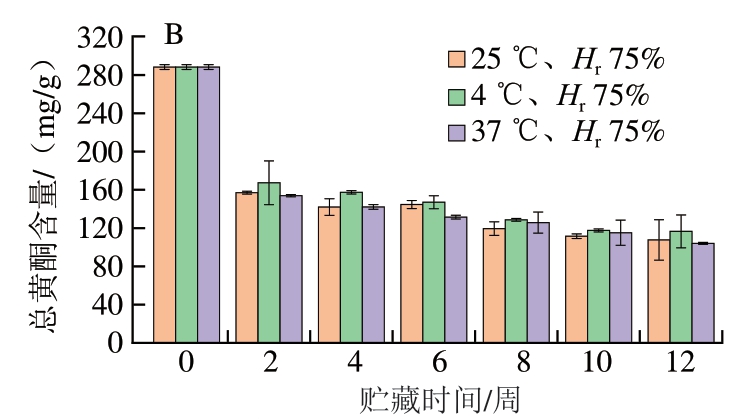
图4 贮藏时间对不同相对湿度(A)和温度(B)条件下样品总黄酮含量的影响
Fig. 4 Effect of storage time on total flavonoid content of freeze-dried mixed blueberry-blue honeysuckle berry powder under different relative humidities (A) and temperatures (B)
2.2.3 花色苷组成
由表3可知,蓝莓-蓝靛果复合冻干粉中Del-3-O-ara含量最高(约占总花色苷含量的87%),Cya-3-O-glu次之(约10%)。蓝莓-蓝靛果复合冻干粉中所测定的总花色苷含量约为总酚含量的65%。对照组浆果粉中6 种花色苷含量由高到低依次为Del-3-O-ara>Cya-3-O-glu>Peo-3-O-glu>Del-3-O-glu>Pet-3-O-gal>Cya-3-O-rut。
从表3可知,不同条件粉体贮藏12 周的6 种花色苷含量均呈下降趋势。对照组样品的总花色苷含量为303.36 mg/g。贮藏12 周后,25 ℃下随着Hr增加,6 种花色苷含量及总花色苷含量下降量升高。其中,Hr 43%条件下6 种花色苷含量及总花色苷含量下降的最少(总花色苷含量降低了22.92%),6 种花色苷中含量最高的Del-3-O-ara下降了55.98 mg/g,含量次之的Cya-3-O-glu下降了11.42 mg/g,可能是由于这两种花色苷稳定性不高[30],在贮藏过程中因为相对湿度高更容易发生降解。同时,相比于温度,湿度对6 种花色苷含量及总花色苷含量影响更大。如表3所示,贮藏12 周后Hr 75%条件下,25 ℃下总花色苷含量(152.19 mg/g)最多,37 ℃下次之(144.40 mg/g),而4 ℃下最少(137.78 mg/g)。贮藏12 周后,不同条件下总花色苷含量虽有降低,但仍可维持在118.13~233.83 mg/g,可能是由于花色苷在60 ℃以下分解速率较低[31],因此在4、25 ℃及37 ℃下,花色苷处于较适宜温度,稳定性较好。
表3 不同条件下贮藏12 周后蓝莓-蓝靛果复合冻干粉中花色苷含量
Table 3 Anthocyanin contents in freeze-dried mixed blueberry-blue honeysuckle berry powderbefore and after storage for 12 weeks under different conditions mg/g
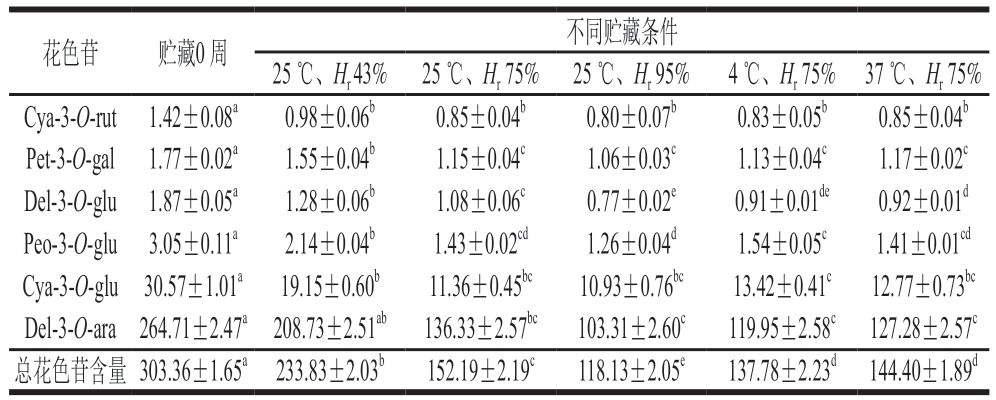
注:同行肩标小写字母不同表示差异显著(P<0.05)。
花色苷 贮藏0 周 不同贮藏条件25 ℃、Hr 43% 25 ℃、Hr 75% 25 ℃、Hr 95% 4 ℃、Hr 75% 37 ℃、Hr 75%Cya-3-O-rut 1.42±0.08a 0.98±0.06b 0.85±0.04b 0.80±0.07b 0.83±0.05b 0.85±0.04b Pet-3-O-gal 1.77±0.02a 1.55±0.04b 1.15±0.04c 1.06±0.03c 1.13±0.04c 1.17±0.02c Del-3-O-glu 1.87±0.05a 1.28±0.06b 1.08±0.06c 0.77±0.02e 0.91±0.01de 0.92±0.01d Peo-3-O-glu 3.05±0.11a 2.14±0.04b 1.43±0.02cd 1.26±0.04d 1.54±0.05c 1.41±0.01cd Cya-3-O-glu 30.57±1.01a 19.15±0.60b 11.36±0.45bc 10.93±0.76bc 13.42±0.41c 12.77±0.73bc Del-3-O-ara 264.71±2.47a 208.73±2.51ab 136.33±2.57bc 103.31±2.60c 119.95±2.58c 127.28±2.57c总花色苷含量 303.36±1.65a 233.83±2.03b 152.19±2.19c 118.13±2.05e 137.78±2.23d 144.40±1.89d
2.2.4 抗氧化能力
本研究对贮藏12 周蓝莓-蓝靛果复合冻干粉进行了ABTS阳离子自由基清除能力、DPPH自由基清除能力和FRAP分析,结果如表4所示。贮藏过程中3 种方法测定的抗氧化能力均呈下降趋势,且与对照组抗氧化能力均存在明显差异,这可能与酚类物质含量下降有关[32]。贮藏12 周后粉体在25 ℃、Hr 43%条件下的ABTS阳离子自由基清除能力最强,由贮藏起始时的200.07 μmol/g下降至110.37 μmol/g,下降了44.83%;而37 ℃、Hr 75%条件下粉体的ABTS阳离子自由基清除能力最差,比贮藏起始时下降了78.74%;与总酚含量降低趋势相同,表明抗氧化能力与总酚保留率相关。25 ℃、Hr 95%条件下,4 ℃、Hr 75%条件下及37 ℃、Hr 75%条件下ABTS阳离子自由基清除能力不同,但不存在显著性差异(P>0.05)。
DPPH自由基清除能力和FRAP在25 ℃、Hr 43%和4 ℃、Hr 75%条件下较高,贮藏第12周总体仍保持在贮藏初始水平的50%以上。DPPH自由基清除能力在25 ℃、Hr 43%和4 ℃、Hr 75%条件下分别为18.45、17.97 mg/g,不存在显著性差异(P>0.05)。3 种抗氧化能力分析方法结果均表明低温低湿度条件利于粉体抗氧能力的贮藏。
表4 贮藏12 周内蓝莓-蓝靛果复合冻干粉的体外抗氧化能力评价
Table 4 In vitro antioxidant activities of freeze-dried mixed blueberryblue honeysuckle berry powder stored for up to 12 weeks
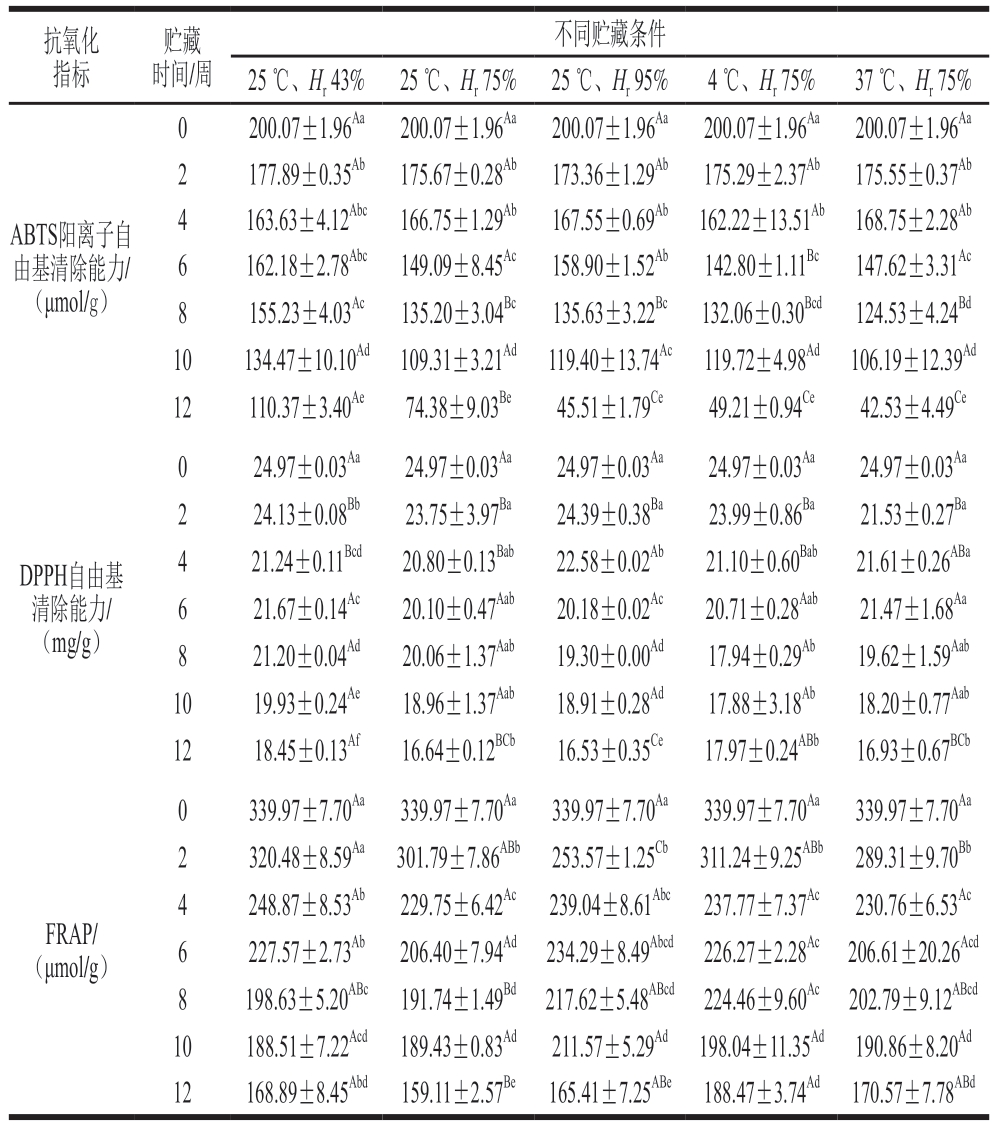
注:同行肩标大写字母不同表示差异显著(P<0.05);相同指标同列肩标小写字母不同表示差异显著(P<0.05)。
抗氧化指标贮藏时间/周不同贮藏条件25 ℃、Hr 43% 25 ℃、Hr 75% 25 ℃、Hr 95% 4 ℃、Hr 75% 37 ℃、Hr 75%ABTS阳离子自由基清除能力/(μmol/g)0 200.07±1.96Aa 200.07±1.96Aa 200.07±1.96Aa 200.07±1.96Aa 200.07±1.96Aa 2 177.89±0.35Ab 175.67±0.28Ab 173.36±1.29Ab 175.29±2.37Ab 175.55±0.37Ab 4 163.63±4.12Abc 166.75±1.29Ab 167.55±0.69Ab 162.22±13.51Ab 168.75±2.28Ab 6 162.18±2.78Abc 149.09±8.45Ac 158.90±1.52Ab 142.80±1.11Bc 147.62±3.31Ac 8 155.23±4.03Ac 135.20±3.04Bc 135.63±3.22Bc 132.06±0.30Bcd 124.53±4.24Bd 10 134.47±10.10Ad 109.31±3.21Ad 119.40±13.74Ac 119.72±4.98Ad 106.19±12.39Ad 12 110.37±3.40Ae 74.38±9.03Be 45.51±1.79Ce 49.21±0.94Ce 42.53±4.49Ce DPPH自由基清除能力/(mg/g)0 24.97±0.03Aa 24.97±0.03Aa 24.97±0.03Aa 24.97±0.03Aa 24.97±0.03Aa 2 24.13±0.08Bb 23.75±3.97Ba 24.39±0.38Ba 23.99±0.86Ba 21.53±0.27Ba 4 21.24±0.11Bcd 20.80±0.13Bab 22.58±0.02Ab 21.10±0.60Bab 21.61±0.26ABa 6 21.67±0.14Ac 20.10±0.47Aab 20.18±0.02Ac 20.71±0.28Aab 21.47±1.68Aa 8 21.20±0.04Ad 20.06±1.37Aab 19.30±0.00Ad 17.94±0.29Ab 19.62±1.59Aab 10 19.93±0.24Ae 18.96±1.37Aab 18.91±0.28Ad 17.88±3.18Ab 18.20±0.77Aab 12 18.45±0.13Af 16.64±0.12BCb 16.53±0.35Ce 17.97±0.24ABb 16.93±0.67BCb FRAP/(μmol/g)0 339.97±7.70Aa 339.97±7.70Aa 339.97±7.70Aa 339.97±7.70Aa 339.97±7.70Aa 2 320.48±8.59Aa 301.79±7.86ABb 253.57±1.25Cb 311.24±9.25ABb 289.31±9.70Bb 4 248.87±8.53Ab 229.75±6.42Ac 239.04±8.61Abc 237.77±7.37Ac 230.76±6.53Ac 6 227.57±2.73Ab 206.40±7.94Ad 234.29±8.49Abcd 226.27±2.28Ac 206.61±20.26Acd 8 198.63±5.20ABc 191.74±1.49Bd 217.62±5.48ABcd 224.46±9.60Ac 202.79±9.12ABcd 10 188.51±7.22Acd 189.43±0.83Ad 211.57±5.29Ad 198.04±11.35Ad 190.86±8.20Ad 12 168.89±8.45Abd 159.11±2.57Be 165.41±7.25ABe 188.47±3.74Ad 170.57±7.78ABd
2.3 蓝莓-蓝靛果复合冻干粉贮藏过程中加工特性研究
BFE是一种定量描述容器中粉体在特定流动模式时所需的能量[33]。BFE增大表明粉体从静止状态过渡到流动状态所需要能量增大,流动性变差。如图5所示,贮藏12 周,37 ℃、Hr 75%条件下BFE最大,由91.02 mJ上升至138.95 mJ,升高了52.66%,表明流动性变差。25 ℃、Hr 43%条件下BFE最小,由91.02 mJ升高至116.14 mJ,升高了19.24%,相比于其他条件下粉体流动性较好,其次是4 ℃、Hr 75%,升高了24.37%,表明较低温度和相对湿度利于粉体保持较好的流动性,进而利于贮藏。
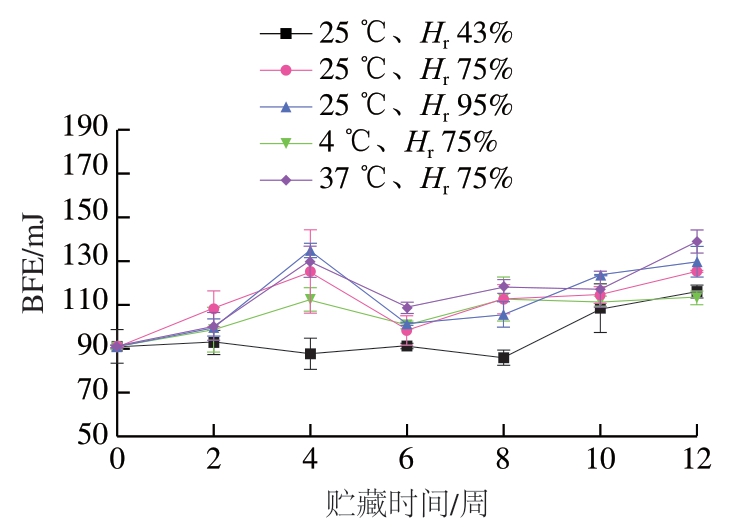
图5 贮藏时间对不同条件下样品BFE的影响(100 mm/s)
Fig. 5 Effect of storage time on basic flow energy of freeze-dried mixed blueberry-blue honeysuckle berry powder under different conditions (100 mm/s)
如图6所示,对照组的SE为 6.34 mJ/g;贮藏12 周,25 ℃、Hr 43%条件下,25 ℃、Hr 75%条件下,25 ℃、Hr 95%条件下,4 ℃、Hr 75%条件下及37 ℃、Hr 75%条件下SE分别为4.19、6.11、7.66、7.40、5.61 mJ/g。实验结果表明,蓝莓-蓝靛果复合果粉贮藏12 周,在25 ℃条件下,Hr 43%样品的SE(4.19 mJ/g)最小,Hr 95%样品的SE(7.66 mJ/g)最大,表明其颗粒间机械咬合力增强,不易发生流动,可能是由于粉体在较高相对湿度条件下发生吸湿导致粉体颗粒黏结成团。Hr 75%条件下,37 ℃样品的SE(5.61 mJ/g)最小,但整体来讲,各温度下粉体的流动特性差异不明显。
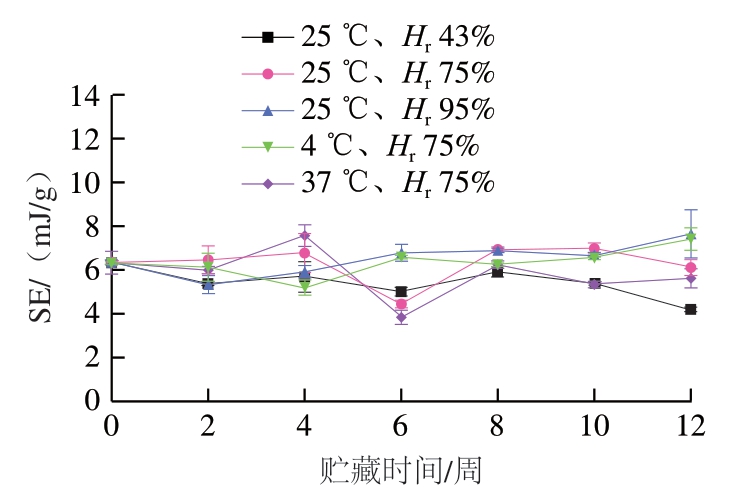
图6 贮藏时间对不同条件下样品SE的影响(40 mm/s)
Fig. 6 Effect of storage time on specific energy of freeze-dried mixed blueberry-blue honeysuckle berry powder under different conditions (40 mm/s)
3 结 论
本实验以蓝莓-蓝靛果复合冻干粉为对象,研究其贮藏12 周内温度及湿度对其理化性质及加工特性的影响。结果表明,与温度相比,Hr对蓝莓-蓝靛果复合冻干粉的品质影响更显著。综合分析发现:25 ℃、Hr 43%和4 ℃、Hr 75%条件下更利于蓝莓-蓝靛复合冻干粉的贮藏,其在贮藏过程中水分质量分数及Tg变化程度较低,活性物质总酚、总黄酮及花色苷的保留率较高,且具有良好的流动性。
[1]CHEN Y H, HUNG Y C, CHEN M Y, et al. Enhanced storability of blueberries by acidic electrolyzed oxidizing water application may be mediated by regulating ROS metabolism[J]. Food Chemistry, 2019,270: 229-235. DOI:10.1016/j.foodchem.2018.07.095.
[2]SENICA M, STAMPAR F, MIKULIC-PETKOVSEK M. Blue honeysuckle (Lonicera cearulea L. subs. edulis) berry; a rich source of some nutrients and their differences among four different cultivars[J]. Scientia Horticulturae, 2018, 238: 215-221. DOI:10.1016/j.scienta.2018.04.056.
[3]BARRAJÓN-CATALÁN E, HERRANZ-LÓPEZ M, JOVEN J, et al.Molecular promiscuity of plant polyphenols in the management of age-related diseases: far beyond their antioxidant properties[J].Advances in Experimental Medicine and Biology, 2014, 824: 141-159.DOI:10.1007/978-3-319-07320-0_11.
[4]ZHANG H, TSAO R. Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects[J]. Current Opinion in Food Science, 2016, 8: 33-42. DOI:10.1016/j.cofs.2016.02.002.
[5]ISTEK N, GURBUZ O. Investigation of the impact of blueberries on metabolic factors influencing health[J]. Journal of Functional Foods,2017, 38: 298-307. DOI:10.1016/j.jff.2017.09.039.
[6]ALI S M, OURTH A, CHE C T, et al. Abstract 1592: anti-cancer evaluation of various solvent extracts of blue honeysuckle berry(Lonicera caerulea L.) against prostate cancer cells[J]. Cancer Research, 2017, 77(Suppl 13): 1592-1592. DOI:10.1158/1538-7445.AM2017-1592.
[7]WANG M Y, SRINIVASAN M, DASARI S, et al. Antioxidant activity of Yichun blue honeysuckle (YBHS) berry counteracts CCl4-induced toxicity in liver injury model of mice[J]. Antioxidants,2017, 6(3). DOI:10.3390/antiox6030050.
[8]VEGA-GÁLVEZ A, LEMUS-MONDACA R, TELLO-IRELAND C, et al.Kinetic Study of convective drying of blueberry variety O’Neil(Vaccinium corymbosum L.)[J]. Chilean Journal of Agricultural Research, 2009, 69(2): 171-178. DOI:10.4067/S0718-58392009000200006.
[9]李圣桡, 李若萌, 陈博朴, 等. 蓝靛果的营养价值与加工技术研究进展[J]. 农产品加工, 2020(2): 68-73. DOI:10.16693/j.cnki.1671-9646(X).2020.01.054.
[10]谭飞菲, 孙斐. 我国蓝莓产业发展概况[J]. 中国果菜, 2017, 37(8):39-43. DOI:10.19590/j.cnki.1008-1038.2017.08.013.
[11]HARNKARNUJARIT N, CHAROENREIN S, ROOS Y H.Microstructure formation of maltodextrin and sugar matrices in freezedried systems[J]. Carbohydrate Polymers, 2012, 88(2): 734-742.DOI:10.1016/j.carbpol.2012.01.028.
[12]WANG H Y, ZHANG S Z, CHEN G M. Glass transition and state diagram for fresh and freeze-dried Chinese gooseberry[J].Journal of Food Engineering, 2007, 84(2): 307-312. DOI:10.1016/j.jfoodeng.2007.05.024.
[13]GRACE M H, XIONG J, ESPOSITO D, et al. Simultaneous LC-MS quantification of anthocyanins and non-anthocyanin phenolics from blueberries with widely divergent profiles and biological activies[J]. Food Chemistry, 2018, 277: 336-346. DOI:10.1016/j.foodchem.2018.10.101.
[14]REYES A, EVSEEV A, MAHN A, et al. Effect of operating conditions in freeze-drying on the nutritional properties of blueberries[J].International Journal of Food Sciences and Nutrition, 2011, 62(3):303-306. DOI:10.3109/09637486.2010.534078.
[15]MEJIA-MEZA E I, YÁÑEZ J A, DAVIES N M, et al. Improving nutritional value of dried blueberries (Vaccinium corymbosum L.)combining microwave-vacuum, hot-air drying and freeze drying technologies[J]. International Journal of Food Engineering, 2008, 4(6):10. DOI:10.2202/1556-3758.1364.
[16]邵春霖, 孟宪军, 毕金峰, 等. 不同干燥方式对蓝莓品质的影响[J].食品与发酵工业, 2013, 39(11): 109-113. DOI:10.13995/j.cnki.11-1802/ts.2013.11.034.
[17]国家卫生和计划生育委员会. 食品安全国家标准食品中水分的测定: GB 5009.3—2016[S]. 北京: 中国标准出版社, 2016.
[18]SHI Q L, WANG X H, ZHAO Y, et al. Glass transition and state diagram for freeze-dried Agaricus bisporus[J]. Journal of Food Engineering,2012, 111(4): 667-674. DOI:10.1016/j.jfoodeng.2012.02.038.
[19]SONG H H, BI J F, CHEN Q Q, et al. Structural and health functionality of dried goji berries as affected by coupled dewaxing pretreatment and hybrid drying methods[J]. International Journal of Food Properties, 2018, 21(1): 2527-2538. DOI:10.1080/10942912.2018.1536148.
[20]ADDO K A, BI J F, CHEN Q Q, et al. Understanding the caking behavior of amorphous jujube powder by powder rheometer[J]. LWT-Food Science and Technology, 2018, 101: 483-490. DOI:10.1016/j.lwt.2018.11.059.
[21]HARE C, ZAFAR U, GHADIRI M, et al. Analysis of the dynamics of the FT4 powder rheometer[J]. Powder Technology, 2015, 285: 123-127. DOI:10.1016/j.powtec.2015.04.039.
[22]RAHMAN M S. State diagram of foods: its potential use in food processing and product stability[J]. Trends in Food Science &Technology, 2005, 17(3): 129-141. DOI:10.1016/j.tifs.2005.09.009.
[23]RAHMAN M S, SABLANI S S, AL-HABSI N, et al. State diagram of freeze dried garlic powder by differential scanning calorimetry and cooling curve methods[J]. Journal of Food Science, 2006, 70(2):E135-E141. DOI:10.1111/j.1365-2621.2005.tb07086.x.
[24]SYAMALADEVI R M, SABLANI S S, TANG J M, et al. State diagram and water adsorption isotherm of raspberry (Rubus idaeus)[J].Journal of Food Engineering, 2008, 91(3): 460-467. DOI:10.1016/j.jfoodeng.2008.09.025.
[25]赵金红, 朱明慧, 温馨, 等. 芒果玻璃化转变与状态图研究[J].农业机械学报, 2015, 46(4): 226-232. DOI:10.6041/j.issn.1000-1298.2015.04.033.
[26]GUIZANI N, AL-SAIDI G S, RAHMAN M S, et al. State diagram of dates: glass transition, freezing curve and maximal-freezeconcentration condition[J]. Journal of Food Engineering, 2010, 99(1):92-97. DOI:10.1016/j.jfoodeng.2010.02.003.
[27]殷海松, 汤卫华, 张仁宽, 等. 野生和栽培蓝莓营养物质分析及抗氧化作用研究[J]. 食品研究与开发, 2015, 36(18): 39-41. DOI:10.3969/j.issn.1005-6521.2015.18.010.
[28]周笑犁, 陈丽, 王瑞, 等. 蓝莓不同部位常规营养成分及活性物质的比较分析[J]. 食品工业科技, 2016, 37(9): 363-366. DOI:10.13386/j.issn1002-0306.2016.09.063.
[29]PAPOUTSIS K, PRISTIJONO P, GOLDING J B, et al. Effect of vacuum-drying, hot air-drying and freeze-drying on polyphenols and antioxidant capacity of lemon (Citrus limon) pomace aqueous extracts[J]. International Journal of Food Science & Technology, 2017,52(4): 880-887. DOI:10.1111/ijfs.13351.
[30]CESA S, CARRADORI S, BELLAGAMBA G, et al. Evaluation of processing effects on anthocyanin content and colour modifications of blueberry (Vaccinium spp.) extracts: comparison between HPLC-DAD and CIELAB analyses[J]. Food Chemistry, 2017, 232: 114-123.DOI:10.1016/j.foodchem.2017.03.153.
[31]MARTIN-GOMEZ J, VARO M Á, MERIDA J, et al. Influence of drying processes on anthocyanin profiles, total phenolic compounds and antioxidant activities of blueberry (Vaccinium corymbosum)[J].LWT-Food Science and Technology, 2020, 120: 108931. DOI:10.1016/j.lwt.2019.108931.
[32]HWANG S J, YOON W B, LEE O, et al. Radical-scavenginglinked antioxidant activities of extracts from black chokeberry and blueberry cultivated in Korea[J]. Food Chemistry, 2014, 146: 71-77.DOI:10.1016/j.foodchem.2013.09.035.
[33]薛玉洁, 陈芹芹, 毕金峰, 等. 5 种苹果微粉的理化品质与行为特征[J].食品科学, 2017, 38(7): 109-114. DOI:10.7506/spkx1002-6630-201707018.