草莓脯是近年来的新兴果脯,但草莓脯贮藏过程中会发生褐变,影响其商品价值和产品外观。褐变是食品贮藏和加工中普遍存在的现象,可分为酶促褐变和非酶褐变,草莓脯贮藏期间的褐变以非酶褐变为主,其中的化学机制一般包括抗坏血酸降解、酚类物质的氧化聚集、美拉德反应、糖的裂解等,直接参与非酶褐变的化学成分往往包括抗坏血酸、还原糖、多酚、氨基酸等[1]。另外,5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)作为非酶褐变的中间产物也一直广受关注,它通过六碳糖的烯醇化、脱水、环化反应以及美拉德反应中的Amadori重排形成[2-3]。食品成分复杂,其非酶褐变往往为多种途径的共同作用,不同食品在不同的加工条件及贮藏环境下,造成褐变的主要途径和关键控制点不同,如Paravisini等[4]认为美拉德反应是橙汁褐变的主要途径,关键成分有葡萄糖、色氨酸和谷氨酸;Wang Chen等[5]则认为东北酸菜褐变主要受抗坏血酸氧化降解和多酚氧化聚合两个途径影响。
果脯为我国传统食品,其通过糖渍干燥等工艺使水果保存期延长。近年来,消费市场对果脯产品提出了低糖、无硫、天然色的健康营养新要求[6-8],给果脯类食品的色泽控制技术带来新的挑战。但目前对果脯褐变的研究仍多集中于护色工艺优化[7-8],机理与工艺结合角度的研究仍待深入。果脯的种类很多,草莓脯作为新型果脯品类,目前仅有部分研究介绍了其制作方法[9],鲜见对其品质变化的研究。草莓鲜果含有丰富的抗坏血酸、多酚(花青素等)以及还原糖和氨基酸类物质[10-11],这些成分均为褐变研究中广受关注的化学物质,但是这些成分在草莓脯中如何变化并在褐变中发挥什么作用尚鲜见报道。为探明草莓脯贮藏期间褐变的发生、发展与温度、时间的关系以及内在化学成分的变化机制,本实验对不同温度贮藏期间草莓脯的色泽以及抗坏血酸、还原糖、多酚、氨基酸、5-HMF含量进行测定,对色泽及化学成分变化的关系进行分析,并采用相关性分析和相似性聚类对关键途径进行探讨,旨在为草莓脯贮藏期间的褐变控制提供参考。
1 材料与方法
1.1 材料与试剂
本实验以某品牌同批次草莓脯为试材。
色谱纯甲醇 德国Merck公司;色谱纯乙腈美国TEDIA公司;抗坏血酸 西陇科学股份有限公司;氨基酸混合标准溶液 美国Sigma公司;3-巯基丙酸、乙醇、偏磷酸、二水合磷酸二氢钠、四硼酸钠、邻苯二甲醛(o-phthalaldehyde,OPA) 国药集团化学试剂有限公司;5-HMF 上海阿拉丁试剂有限公司。
1.2 仪器与设备
FD-1A-50真空冻干机 上海比朗仪器有限公司;WSC-S型色差仪 上海精密科学仪器有限公司;1200型高效液相色谱仪(配备二极管阵列及示差检测器) 美国Agilent公司;DNP-9052BS-III电热恒温培养箱 上海新苗医疗器械制造有限公司;H3-16KR台式高速冷冻离心机 湖南可成仪器设备有限公司;LBI-150生化培养箱 上海龙跃仪器设备有限公司。
1.3 方法
1.3.1 草莓脯的贮藏与预处理
草莓脯生产3 d后分装于磨砂18 丝拉骨自封袋(8 cm×12 cm)密封,每袋20 g,以分装日期作为起始日期,取1 袋样品作为贮藏0 d样品置于-18 ℃冻藏待分析。其他样品分为3 组,每组不少于6 袋,分别置于37、25 ℃培养箱或4 ℃冰箱恒温贮藏,37 ℃贮藏样品在贮藏15、30、60、75、90 d取样,25 ℃和4 ℃贮藏样品在贮藏30、60、90、120、150 d取样,取样后将样品置于-18 ℃冻藏待分析。
除色泽外,其余指标测定前将待测草莓脯冷冻干燥,然后加入液氮研磨粉碎,备用。
1.3.2 色泽的测定
取在包装内自然化冻至室温的草莓脯,采用色差仪测定L*、a*、b*值,每次测定6 个草莓脯计算平均值。按下式计算草莓脯色差(ΔE)。ΔE越大,表明样品色泽与初始状态差别越大。
式中:![]() 值分别为贮藏0 d即初始草莓脯样品的亮度、红绿度和黄蓝度;L*、a*、b*值分别为贮藏一定时间草莓脯样品的亮度、红绿度和黄蓝度。
值分别为贮藏0 d即初始草莓脯样品的亮度、红绿度和黄蓝度;L*、a*、b*值分别为贮藏一定时间草莓脯样品的亮度、红绿度和黄蓝度。
1.3.3 抗坏血酸含量的测定
取1.0 g研磨粉碎的草莓脯冻干样品于10 mL离心管中,加入少量预冷的0.25%(质量分数,后同)偏磷酸溶液冰浴浸提,然后用0.25%偏磷酸溶液定容至10 mL,4 ℃、10 000 r/min离心10 min,上清液经0.45 μm微孔滤膜过滤后待测。
采用1200型高效液相色谱仪测定抗坏血酸的含量:色谱柱为ZORBAX 300SB-C18(4.6 mm×250 mm,5 μm),流动相为0.03 mol/L磷酸溶液,流速为0.8 mL/min,柱温25 ℃,检测波长240 nm,进样量20 μL。
定量方法:以抗坏血酸为标准品绘制标准曲线,采用外标法进行定量,抗坏血酸含量单位为mg/g。
1.3.4 总酚含量的测定
取2.0 g研磨粉碎的草莓脯冻干样品,加入5.0 mL福林-酚试剂混匀,静置4 min后加入4.0 mL质量浓度7.5 g/100 mL的Na2CO3溶液,室温避光放置60 min后,在765 nm波长处测定吸光度,以没食子酸为标准品绘制标准曲线,结果用1 g冻干草莓脯中的没食子酸当量表示,单位为mg/g。
1.3.5 游离糖和游离氨基酸含量的测定
样品前处理:取1.0 g研磨粉碎的草莓脯冻干样品,加入2 mL蒸馏水进行研磨,用5 mL蒸馏水分3 次冲洗研钵,将草莓脯浆液转移至容量瓶并用蒸馏水定容至10 mL,60 ℃超声处理40 min。超声处理后混匀并吸取5.0 mL移至10 mL离心管,4 ℃、10 000 r/min离心10 min,取上清液用0.45 μm的微孔滤膜过滤后于-18 ℃冷冻保存,待分析。
采用1200型高效液相色谱仪测定游离糖含量:Carbohydrate色谱柱(150.0 mm×4.6 mm,5 μm);检测器为示差检测器,流动相为乙腈-水溶液(体积比75∶25),柱温设为30 ℃,进样量20 μL,流速为0.8 mL/min。
采用1200型高效液相色谱仪测定游离氨基酸的含量:ZORBAX Eclipse-AAA色谱柱(4.6 mm×150 mm,3.5 μm);检测器为二极管阵列检测器。参照文献[12],样品采用OPA衍生后进行高效液相色谱分析。
定性定量方法:通过与糖及氨基酸标准样品比对进行定性,采用外标法进行定量,单位为mg/g。
1.3.6 5-HMF含量的测定
样品预处理:取1.0 g研磨粉碎的冻干草莓脯于研钵中,加入2.0 mL甲醇-水溶液(体积比1∶9)研磨,60 W超声30 min后取出。于4 ℃下8 000 r/min离心10 min,取上清液用0.45 μm微孔滤膜过滤,待分析。
采用1200型高效液相色谱仪测定5-HMF含量:ZORBAX 300SB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水(体积比1∶9),柱温为35 ℃,进样量为20 μL,流速为0.8 mL/min。
定性定量方法:通过与5-HMF标准样品比对进行定性,采用外标法进行定量,单位为mg/g。
1.4 数据统计与分析
实验设置3 组重复,结果以平均值±标准差表示。采用Originpro 2016软件作折线图。采用JMP 10.0软件进行单因素方差分析、Pearson相关性分析与聚类分析并作图。采用Tukey检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同贮藏温度下草莓脯的色泽变化
各项色泽参数中,L*值为亮度,其值越大表明色泽越明亮;a*值为红绿度,a*>0表示偏红,a*<0表示偏绿;b*值为黄蓝度,b*>0表示偏黄,b*<0表示偏蓝。由图1可以看出,草莓脯初始色泽中L*值较高,a*、b*值均为正值,总体呈现明亮的红色。食品贮藏过程中L*值下降往往表明样品存在褐变现象,但是不同食品褐变过程中3 个参数的变化规律并不相同。在蜂蜜[13]、苹果酱[14]贮藏过程中褐变表现为L*、b*值下降但a*值上升;荔枝贮藏6 d后发生褐变,表现为红色果皮的L*、a*、b*值全部下降[15]。草莓脯贮藏过程中,L*、a*、b*值均呈下降趋势,并且温度越高变化越快,变化程度最大的贮藏条件为37 ℃下贮藏90 d,L*、a*、b*值分别下降为初始值的64.46%、17.95%和21.07%。25 ℃和4 ℃下变化较慢,即便延长贮藏至150 d,L*值下降为初始值的64.81%和74.37%,a*值下降为初始值的22.79%和60.51%,b*值分别下降为初始值的37.22%和35.53%,仍高于37 ℃下贮藏90 d时的b*值。这种温度越高,变化越快的现象与蜂蜜、果汁等食品[13-15]一致。由以上数据还可以看出,3 个色泽参数对温度变化的敏感度不同,其中a*值对温度差异最为敏感,即对于贮藏时间相同的样品,不同温度间差异最大。
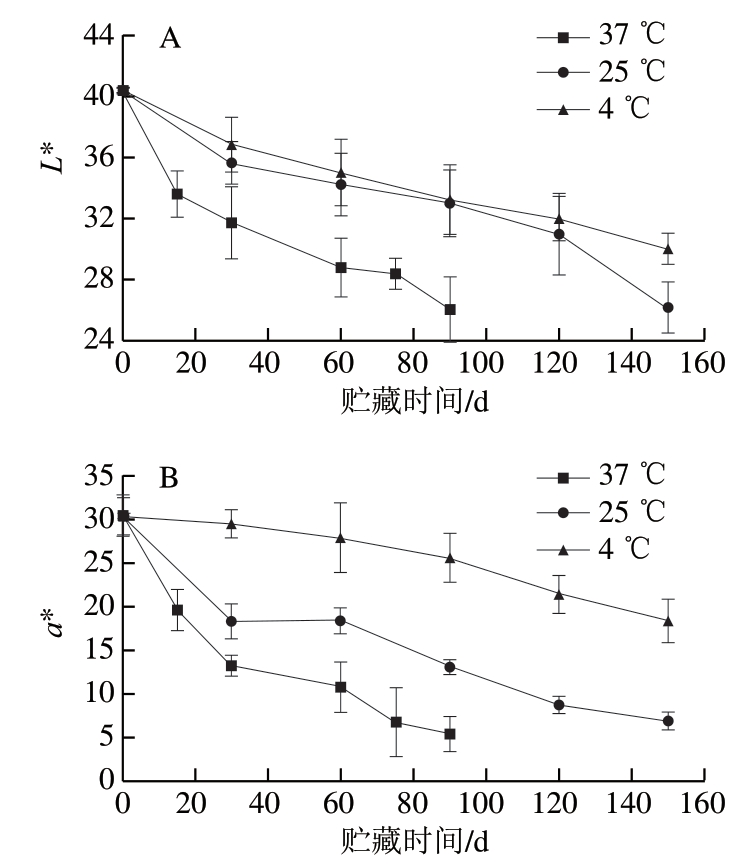
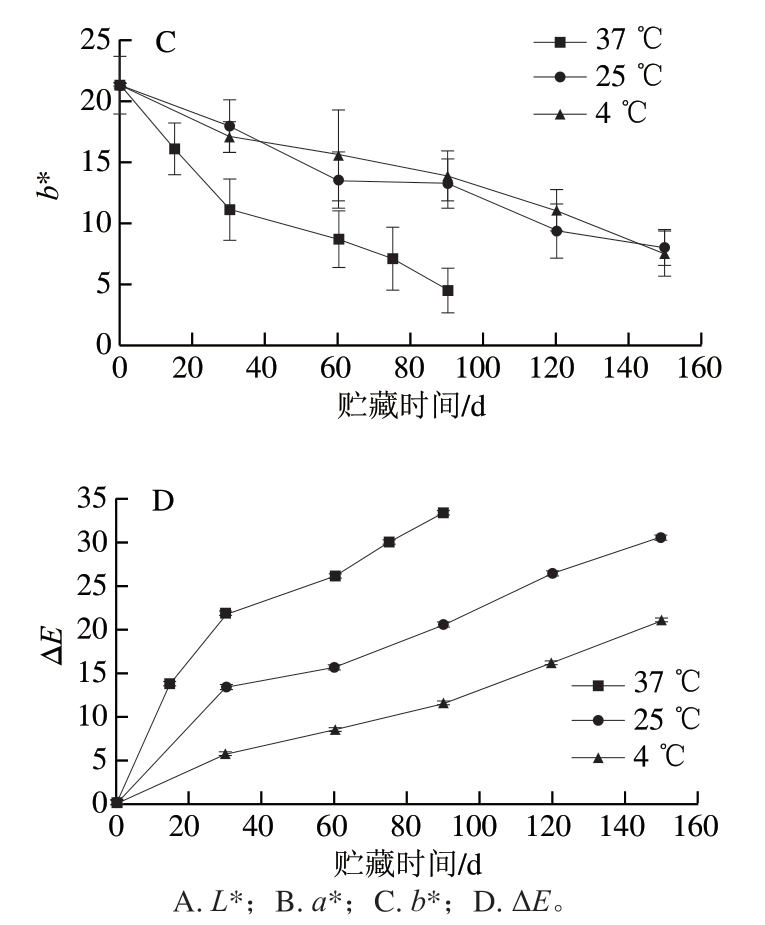
图1 不同贮藏温度对草莓脯色泽指标的影响
Fig. 1 Effect on color parameters of preserved strawberry during storage at different temperatures
另外,从色差值ΔE的变化来看,3 个温度下ΔE均随时间延长呈现上升趋势,ΔE增加说明色泽变化越来越明显。相比初始值,37 ℃下贮藏90 d时ΔE达33.33,25 ℃和4 ℃下贮藏90 d时ΔE分别为20.49与11.42,150 d时则达30.51和20.99,均大于报道中贮藏后蜂蜜ΔE(<7)[13]和苹果酱ΔE(<20)[14],这说明草莓脯色泽在贮藏期发生了明显变化,也说明草莓脯贮藏期间的色泽控制是非常有必要的。
2.2 不同贮藏温度下草莓脯抗坏血酸及总酚含量变化
抗坏血酸和酚类物质是草莓中备受关注的具有抗氧化功能的活性成分,其中抗坏血酸极易降解,往往作为反映食品新鲜度的标志性成分[16]。食品中抗坏血酸和总酚在贮藏期间含量往往会逐渐降低,并且温度越高降低速度越快[17-19]。由图2可知,草莓脯中抗坏血酸和总酚含量在贮藏初期迅速下降,随后下降速率减缓,并且贮藏温度越高,下降速率越快,与以往对果蔬汁的研究一致[17-19]。草莓脯中抗坏血酸含量在37、25、4 ℃下贮藏90 d时分别降至初始值的1.07%、16.16%、25.44%,总酚含量则分别下降至初始值的25.61%、32.23%、39.18%,与橙汁[17-18]、西梅汁[19]和草莓汁[20]相比,草莓脯中抗坏血酸和总酚的损失率更高,虽然这种差异与包装等外界因素有关,但仍说明果脯作为一种有效延长水果食用期的加工产品,其贮藏过程中的营养成分损失值得重视。另据报道,果汁贮藏初期抗坏血酸和总酚含量下降速率最快与其中溶解氧的消耗有关,而后期降解则与包装材料的氧阻隔性有关[17-18],因此,普通密封包装(未采取除氧措施)的草莓脯贮藏过程中出现的这种抗坏血酸和总酚含量初期下降速率快、后期减缓的特点也有可能与包装中氧气的存在与消耗有关。在果汁生产过程中往往通过脱气或充氮等方法来减少抗坏血酸和酚类物质氧化造成的褐变,因此是否可以通过避免与氧的接触来控制草莓脯的褐变程度也是值得探讨的。
图2 草莓脯抗坏血酸(A)和总酚(B)含量随贮藏时间的变化
Fig. 2 Changes of ascorbic acid (A) and total phenol (B) contents in preserved strawberry during storage at different temperatures
2.3 不同贮藏温度下草莓脯游离糖及氨基酸含量变化
草莓中的游离糖主要有果糖、葡萄糖和蔗糖[10,21],草莓脯中的糖也主要为这3 种(表1)。在贮藏过程中,3 种糖含量随时间延长均表现为下降趋势,37 ℃和25 ℃下贮藏初期迅速下降,30 d时果糖、葡萄糖和蔗糖含量为初始值的25.18%~59.01%,随后下降速率变缓,60 d时3 种糖含量为30 d时的83.67%~96.37%。在4 ℃下,3 种糖降解较慢,30 d时果糖含量与初始值无显著差异,葡萄糖和蔗糖含量则显著高于37 ℃和25 ℃下贮藏30 d时含量。不同温度下蔗糖含量在相同贮藏时间均存在显著差异,表现为37 ℃<25 ℃<4 ℃,说明温度越高,变化越快。但是,3 个温度下果糖和葡萄糖含量的变化均出现了平台期,即37 ℃下贮藏30~75 d,25 ℃和4 ℃下贮藏90~120 d,同一温度下随时间延长差异不显著。果汁中果糖和葡萄糖含量在贮藏过程中往往变化不显著甚至上升,这是因为蔗糖分解为果糖和葡萄糖,弥补了果糖和葡萄糖的损失[22]。本研究中草莓脯贮藏期间蔗糖含量呈下降趋势,但果糖和葡萄糖含量在初期下降后,出现了一段平台期,而且贮藏温度越高,此平台期出现的越早,说明草莓脯贮藏过程中同样存在蔗糖降解为果糖和葡萄糖的过程,并且温度越高蔗糖降解速率越快,对果糖和葡萄糖含量的补充越快。总体而言,葡萄糖的损失最为严重,至测试结束时3 个温度下草莓脯中葡萄糖含量为初始值的5.68%~16.47%,而果糖含量为初始值的17.74%~27.24%,蔗糖含量为初始值的17.58%~23.12%。
表1 草莓脯贮藏过程中游离糖和氨基酸含量变化
Table 1 Changes in free sugar and amino acid contents in preserved strawberry during storage
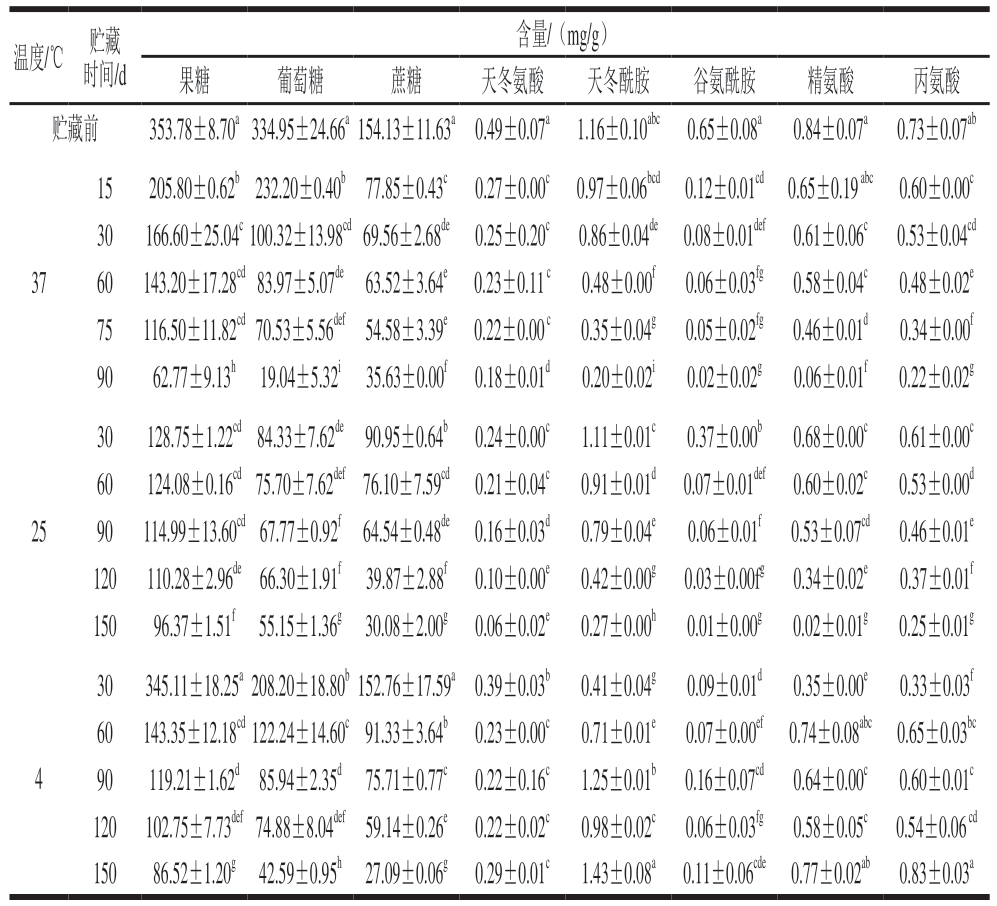
注:同列肩标小写字母不同表示差异显著(P<0.05)。
温度/℃ 贮藏时间/d含量/(mg/g)果糖 葡萄糖 蔗糖 天冬氨酸 天冬酰胺 谷氨酰胺 精氨酸 丙氨酸贮藏前 353.78±8.70a334.95±24.66a154.13±11.63a0.49±0.07a 1.16±0.10abc 0.65±0.08a 0.84±0.07a 0.73±0.07ab 37 15 205.80±0.62b232.20±0.40b77.85±0.43c 0.27±0.00c 0.97±0.06bcd 0.12±0.01cd 0.65±0.19 abc 0.60±0.00c 30 166.60±25.04c100.32±13.98cd69.56±2.68de 0.25±0.20c 0.86±0.04de 0.08±0.01def 0.61±0.06c 0.53±0.04cd 60 143.20±17.28cd83.97±5.07de63.52±3.64e 0.23±0.11 c 0.48±0.00f 0.06±0.03fg 0.58±0.04c 0.48±0.02e 75 116.50±11.82cd70.53±5.56def54.58±3.39e 0.22±0.00 c 0.35±0.04g 0.05±0.02fg 0.46±0.01d 0.34±0.00f 90 62.77±9.13h 19.04±5.32i 35.63±0.00f 0.18±0.01d 0.20±0.02i 0.02±0.02g 0.06±0.01f 0.22±0.02g 25 30 128.75±1.22cd84.33±7.62de90.95±0.64b 0.24±0.00c 1.11±0.01c 0.37±0.00b 0.68±0.00c 0.61±0.00c 60 124.08±0.16cd75.70±7.62def76.10±7.59cd 0.21±0.04c 0.91±0.01d 0.07±0.01def 0.60±0.02c 0.53±0.00d 90 114.99±13.60cd67.77±0.92f64.54±0.48de 0.16±0.03d 0.79±0.04e 0.06±0.01f 0.53±0.07cd 0.46±0.01e 120 110.28±2.96de66.30±1.91f 39.87±2.88f 0.10±0.00e 0.42±0.00g 0.03±0.00fg 0.34±0.02e 0.37±0.01f 150 96.37±1.51f 55.15±1.36g 30.08±2.00g 0.06±0.02e 0.27±0.00h 0.01±0.00g 0.02±0.01g 0.25±0.01g 4 30 345.11±18.25a208.20±18.80b152.76±17.59a0.39±0.03b 0.41±0.04g 0.09±0.01d 0.35±0.00e 0.33±0.03f 60 143.35±12.18cd122.24±14.60c91.33±3.64b 0.23±0.00c 0.71±0.01e 0.07±0.00ef 0.74±0.08abc 0.65±0.03bc 90 119.21±1.62d85.94±2.35d 75.71±0.77c 0.22±0.16c 1.25±0.01b 0.16±0.07cd 0.64±0.00c 0.60±0.01c 120 102.75±7.73def74.88±8.04def59.14±0.26e 0.22±0.02c 0.98±0.02c 0.06±0.03fg 0.58±0.05c 0.54±0.06 cd 150 86.52±1.20g 42.59±0.95h 27.09±0.06g 0.29±0.01c 1.43±0.08a 0.11±0.06cde 0.77±0.02ab 0.83±0.03a
游离氨基酸的降解在橙汁[4]、浓缩胡萝卜汁[23]、浓缩梨汁[24]等食品贮藏中均有报道,不同果汁中氨基酸总量损失可达60%以上,但是对于单一氨基酸而言,不同氨基酸的变化规律不同。草莓脯中仅检测到5 种游离氨基酸(表1),分别为天冬氨酸、天冬酰胺、谷氨酰胺、精氨酸、丙氨酸,与草莓鲜果氨基酸的组成[10]类似,5 种氨基酸中含量最高的为天冬酰胺。由表1可知,不同温度下氨基酸的变化趋势不同,37 ℃和25 ℃下5 种氨基酸含量随时间延长均表现出下降趋势,除天冬氨酸外,37 ℃下其他氨基酸含量的下降幅度均大于25 ℃。但是在4 ℃下贮藏时,5 种氨基酸含量则表现出先下降后上升的变化特点,尤其是天冬酰胺和丙氨酸在贮藏150 d时含量甚至高于初始水平。另外,5 种氨基酸中含量下降幅度最大的为谷氨酰胺,以25 ℃贮藏为例,150 d时天冬氨酸、天冬酰胺、精氨酸、丙氨酸含量分别降至初始水平的12.33%、23.3 4%、2.63%、34.40%,而谷氨酰胺仅为初始水平的1.53%。
食品中糖和氨基酸作为褐色成分的前体物质,其含量变化一直广受关注。其中具有羰基结构的果糖、葡萄糖等还原糖和具有氨基结构的氨基酸等化学成分通过聚合、缩合等美拉德反应历程,可生成棕色甚至黑色大分子物质。据报道,影响甘蔗汁色泽的首要因素为果糖,其次为赖氨酸[25];橙汁贮藏中发生褐变,葡萄糖、谷氨酰胺和色氨酸可能发挥了重要作用[4]。贮藏期间草莓脯的游离糖中以葡萄糖含量降幅最大,氨基酸中则以谷氨酰胺含量下降幅度最大,这种变化与橙汁[4]类似,而草莓脯的褐变机理与橙汁是否相似仍待进一步分析。
2.4 不同贮藏温度下5-HMF含量变化
5-HMF是葡萄糖或果糖在酸性条件下脱水分解产物,是美拉德反应、焦糖化反应及抗坏血酸氧化分解反应共同的中间产物,可参与美拉德反应的晚期阶段生成褐色物质[3-5]。5-HMF往往与食品褐变程度显著相关,并作为预测褐变速率的指标[26]。如图3所示,草莓脯贮藏过程中5-HMF含量呈线性增加,且贮藏温度越高增加越快,37 ℃下增长速率分别为25 ℃和4 ℃的26.92、293.88 倍。据报道,温度对甘蔗汁美拉德褐变具有明显影响[25],不同温度下草莓脯5-HMF的生成速率存在较大差异,说明温度也是影响草莓脯褐变的重要因素。此外,由于5-HMF具有多种前体及形成途径,因此探究草莓脯贮藏过程中5-HMF形成的主要途径对于控制其褐变具有重要意义。
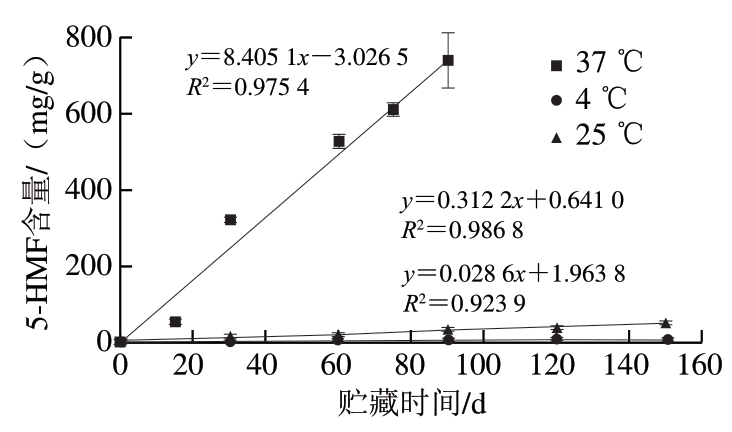
图3 草莓脯贮藏期间5-HMF含量的变化
Fig. 3 Change in 5-HMF content in preserved strawberry during storage
2.5 色泽变化与化学指标的相关性分析结果
为更好地探究色泽变化与理化指标的关系,本研究对各指标进行了相关性分析。色泽、抗坏血酸、总酚、游离糖和氨基酸、5-HMF水平的相关性分析结果如图4所示,可以看出,色泽参数L*、a*、b*、ΔE之间具有明显的正相关性,说明几个参数在表征色泽变化时具有一致性,其中ΔE*与L*、a*、b*值之间的相关性均达到高度显著水平(P<0.001)。以ΔE来表征总色泽变化,发现与其高度显著相关的化学指标有抗坏血酸含量(P<0.001),其次为蔗糖、总酚、5-HMF和葡萄糖含量(P<0.01),然后为天冬氨酸、果糖、精氨酸、丙氨酸和天冬酰胺含量(P<0.05),测定的11 个化学指标中谷氨酰胺含量与其相关性不显著。但是,谷氨酰胺含量与L*值、天冬酰胺和抗坏血酸含量显著相关(P<0.05),与总酚含量极显著相关(P<0.01)。据报道,抗坏血酸的降解可分为有氧降解与无氧降解,其无氧降解主要经过水解、脱羧、脱水和成环等步骤生成二羰基化合物,可与氨基酸发生羰氨缩合等反应生成有色物质;在有氧条件下则裂解为高反应活性的小分子化合物,可与其他成分进一步反应生成褐色大分子化合物[27]。抗坏血酸含量在草莓脯贮藏过程中快速下降,与L*值、a*值、b*值、ΔE以及蔗糖和总酚含量极显著(P<0.01)或高度显著相关(P<0.001),并且和其他2 种游离糖、3 种氨基酸(天冬氨酸、谷氨酰胺、精氨酸)、5-HMF含量均表现出显著的相关性(P<0.05),说明其与褐变反应密切相关,可能发生了有氧降解、无氧降解以及与氨基酸的羰氨缩合等多途径反应。除果糖含量与b*值外,3 种游离糖含量与L*值、a*值、b*值、ΔE、抗坏血酸、总酚含量两两间均达到显著以上水平的相关(P<0.05)。但与除天冬氨酸外的其他4 种氨基酸和5-HMF含量相关性不显著(P>0.05),说明还原糖参与的美拉德反应造成的褐变与整体色泽变化存在不一致性。总体而言,根据色泽指标与各成分间的相关性,可以认为抗坏血酸、酚类物质、糖及氨基酸均参与了草莓脯褐色物质的生成,但不同反应途径具有不同步性。
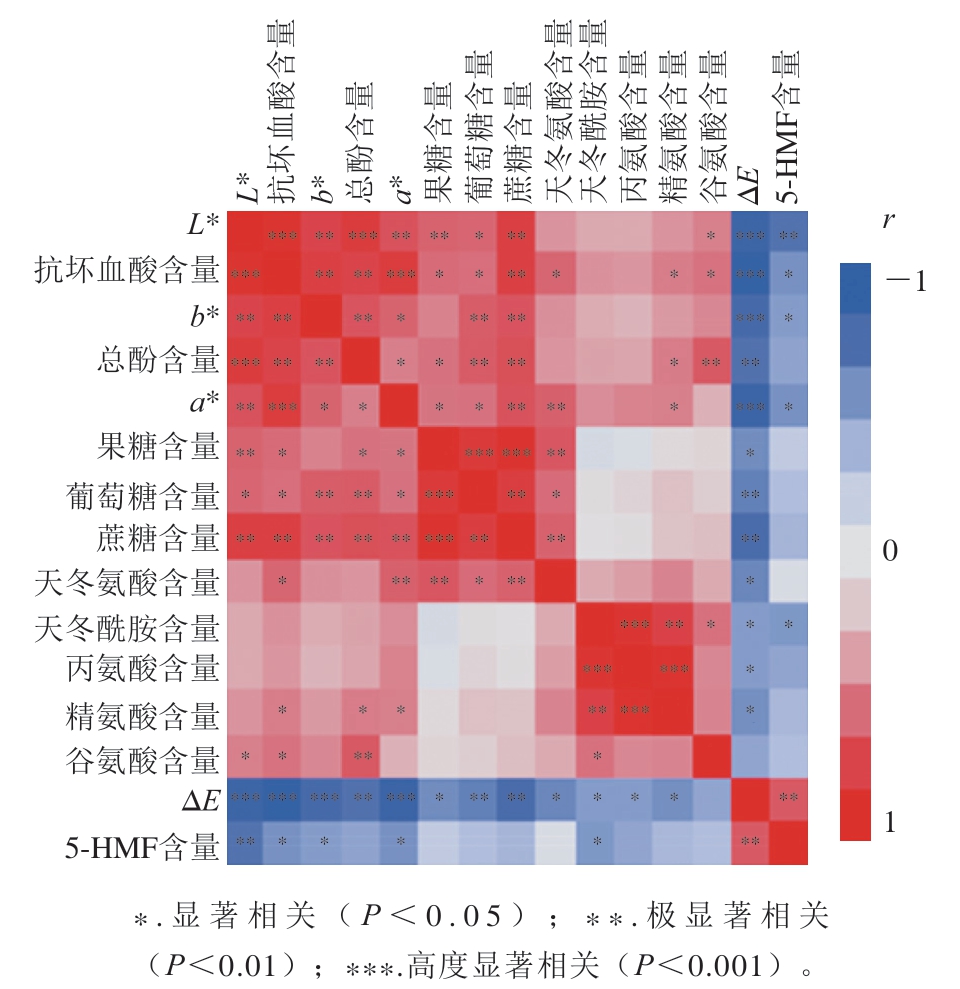
图4 草莓脯理化指标相关性分析结果
Fig. 4 Correlations among physiochemical parameters of preserved strawberry
各项指标和样品双向聚类的结果如图5所示。3 个温度下不同贮藏期的15 个样品聚为两类:4 ℃下贮藏的5 个样品、25 ℃下贮藏时间较短(30~90 d)的3 个样品与37 ℃下贮藏15 d及30 d的2 个样品聚为类别I;其他5 个较高温度下贮藏时间较长的样品聚为类别II。所有指标可以分为4 组:1)L*值、抗坏血酸含量、总酚含量、b*值、谷氨酰胺含量;2)a*值、天冬氨酸含量、果糖含量、蔗糖含量、葡萄糖含量;3)天冬酰胺含量、精氨酸含量、丙氨酸含量;4)ΔE与5-HMF含量。两种类别的主要区别在于类别I中的样品第1~3组指标值较高(红/黑色为主),ΔE与5-HMF作为第4组指标红色区域仅分布于37 ℃下贮藏60~90 d的3 个样品与25 ℃下贮藏120 d及150 d的样品中,体现了5-HMF含量变化与整体色泽变化具有一定的同步性,并具有温度敏感性。5-HMF的这种变化特点说明其含量的增加可能来自于几种不同褐变途径的叠加。
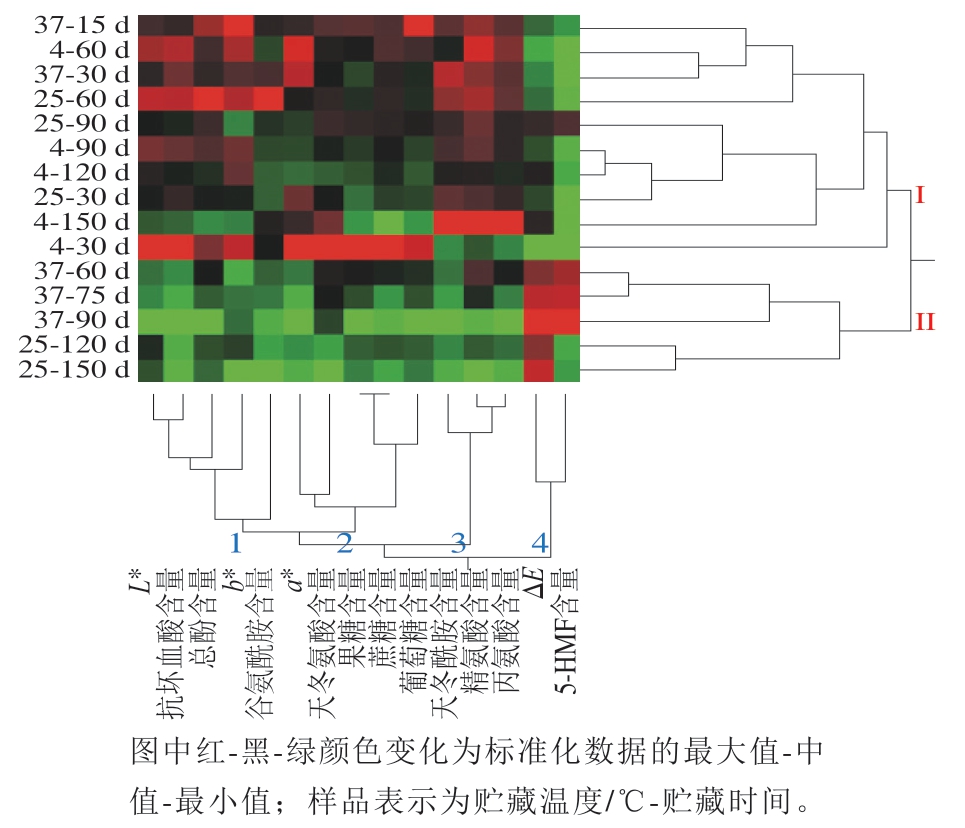
图5 色泽参数与化学组成的聚类相关性分析结果
Fig. 5 Correlations between color parameters and chemical constituents
3 结 论
本实验通过对不同温度下草莓脯贮藏过程中色泽变化和成分变化的研究,发现随贮藏时间延长,37、25、4 ℃下草莓脯L*、a*、b*值均呈下降趋势,5-HMF含量则线性上升,说明草莓脯贮藏过程中存在明显的褐变现象。果糖、葡萄糖和蔗糖3 种游离糖中蔗糖含量随时间延长呈下降趋势,而果糖和葡萄糖含量则出现了平台期,说明可能存在蔗糖分解为果糖和葡萄糖的反应。5 种氨基酸含量在37 ℃和25 ℃下贮藏呈下降趋势,但在4 ℃下则先下降后上升,说明温度对氨基酸与糖的美拉德反应途径影响较大。总之,色泽参数与5-HMF的线性变化可能是抗坏血酸和酚类的氧化反应以及美拉德反应等褐变途径的综合作用。
食品贮藏过程中广泛存在非酶褐变,但相关化学成分的变化趋势与主要途径因食品特点而异。柑橘汁在贮藏过程中抗坏血酸含量呈直线下降,与褐变显著相关,因此抗坏血酸的降解被认为是褐变的主要途径[28]。草莓脯中抗坏血酸和酚类氧化可造成褐变,另外果糖、葡萄糖、天冬氨酸等作为美拉德反应的主要组分也呈现下降趋势,因此可以认为在草莓脯贮藏褐变中,同时存在氧化褐变和美拉德反应褐变两种途径。较高温度下贮藏时间较长的样品通过聚类分析与其他样品得以区分,说明温度和时间为影响褐变程度的重要外界因素。抗坏血酸和多酚的含量与草莓清除自由基和抗氧化能力等营养特性显著相关[29],而糖与氨基酸又是重要的风味成分[30],这些成分的降解不仅会导致褐变,还会降低草莓脯的营养风味品质,因此,如何有针对性地采取措施,如抗氧化处理与包装方式改进,将对草莓脯的品质提高及产业升级具有重要意义。
[1]FRIEDMAN M. Food browning and its prevention: an overview[J].Journal of Agricultural and Food Chemistry, 1996, 44(3): 631-653.DOI:10.1021/jf950394r.
[2]AKTAĞ I G, GÖOKMEN V. Investigations on the formation of α-dicarbonyl compounds and 5-hydroxymethylfurfural in fruit products during storage: new insights into the role of Maillard reaction[J]. Food Chemistry, 2021, 363: 130280. DOI:10.1016/j.foodchem.2021.130280.
[3]CHEN Y, LIN H, LI Y, et al. Non-enzymatic browning and the kinetic model of 5-hydroxymethylfurfural formation in residual solution of vinegar soaked-soybean[J]. Industrial Crops and Products, 2019, 135:146-152. DOI:10.1007/s00217-005-0202-z.
[4]PARAVISINI L, PETERSON D G. Mechanisms non-enzymatic browning in orange juice during storage[J]. Food Chemistry, 2019,289: 320-327. DOI:10.1016/j.foodchem.2019.03.049.
[5]WANG Chen, ZHANG Xiaoli, GAO Ya, et al. Path analysis of nonenzymatic browning in Dongbei Suancai during storage caused by different fermentation conditions[J]. Food Chemistry, 2020, 335.127620. DOI:10.1016/j.foodchem.2020.127620.
[6]杨硕, 张双灵, 姜文利, 等. 低糖大樱桃裂果果脯的加工工艺及品质评价[J]. 现代食品科技, 2021, 37(1): 192-198; 267. DOI:10.13982/j.mfst.1673-9078.2021.01.0627.
[7]姚舒婷, 周声怡, 吴文艳, 等. 樱桃番茄果脯的无硫复合护色工艺优化[J]. 包装工程, 2020, 41(11): 1-7. DOI:10.19554/j.cnki.1001-3563.2020.11.001.
[8]曹家乐, 迟岩, 孙静瑶, 等. 李光杏干制过程护色剂优化及非酶褐变分析[J]. 现代食品科技, 2021, 37(4): 189-198. DOI:10.13982/j.mfst.1673-9078.2021.4.0884.
[9]杭州维本食品科技有限公司. 一种草莓干的制备方法:CN201911131406.2[P/OL]. (2020-02-21)[2021-10-30]. http://psssystem.cnipa.gov.cn/sipopublicsearch/patentsearch/showViewListjumpToView.shtml.
[10]ORNELAS-PAZ J D J, YAHIA E M, RAMÍREZ-BUSTAMANTE N, et al.Physical attributes and chemical composition of organic strawberry fruit (Fragaria × ananassa Duch, Cv. Albion) at six stages of ripening[J]. Food Chemistry, 2013, 138(1): 372-381. DOI:10.1016/j.foodchem.2012.11.006.
[11]ZHANG H, WANG Z, YANG X, et al. Determination of free amino acids and 18 elements in freeze-dried strawberry and blueberry fruit using an amino acid analyzer and ICP-MS with micro-wave digestion[J]. Food Chemistry, 2014, 147: 189-194. DOI:10.1016/j.foodchem.2013.09.118.
[12]牛丽影, 李大婧, 刘春泉, 等. 鲜食玉米发育过程中游离糖和氨基酸变化[J].食品科学, 2020, 41(16): 165-172. DOI:10.7506/spkx1002-6630-20190628-395.
[13]BULUT L, KILIC M. Kinetics of hydroxymethylfurfural accumulation and color change in honey during storage in relation to moisture content[J]. Journal of Food Processing and Preservation, 2009, 33(1):22-32. DOI:10.1111/j.1745-4549.2008.00233.x.
[14]IBARZ A, PAGÁN J, GARZA S. Kinetic models of nonenzymatic browning in apple puree[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1162-1168. DOI:10.1002/1097-0010(200006)80:8<1162::AID-JSFA613>3.0.CO;2-Z.
[15]CHEN X, WU Q, CHEN Z, et al. Changes in pericarp metabolite profiling of four litchi cultivars during browning[J]. Food Research International, 2019, 120: 339-351. DOI:10.1016/j.foodres.2019.02.046.
[16]GONÇALVES E M, ABREU M, PINHEIRO J, et al. Quality changes of carrots under different frozen storage conditions: a kinetic study[J].Journal of Food Processing and Preservation, 2020, 44(12): e14953.DOI:10.1111/jfpp.14953.
[17]张晓雨, 魏星, 赵靓, 等. 高阻隔 HDPE包装对 NFC橙汁品质及货架期的影响[J]. 包装工程, 2021, 42(8): 72-84. DOI:10.19554/j.cnki.1001-3563.2021.15.009.
[18]BELTRÁN F, PÉREZ-LÓPEZ A J, LÓPEZ-NICOLÁS J M, et al.Color and vitamin C content in mandarin orange juice as affected by packaging material and storage temperature[J]. Journal of Food Processing and Preservation, 2009, 33(Suppl 1): 27-40. DOI:10.1111/j.1745-4549.2008.00247.x .
[19]夏娜, 周茜, 魏健, 等. 不同储藏温度对NFC西梅汁品质变化的影响[J]. 保鲜与加工, 2021, 21(8): 7-14. DOI:10.3969/j.issn.1009-6221.2021.08.002.
[20]张元元, 张映曈, 胡花丽, 等. 草莓汁贮藏期维生素C的降解动力学研究[J]. 现代食品科技, 2020, 36(1): 120-126. DOI:10.13982/j.mfst.1673-9078.2020.1.017.
[21]李佳秀, 张春岭, 刘 慧, 等. 草莓汁中糖酸组成分析及其在掺假鉴别中的应用[J]. 食品工业科技, 2019, 40(21): 268-273. DOI:10.13386/j.issn1002-0306.2019.21.044.
[22]LI M, LIU Q, ZHANG W, et al. Evaluation of quality changes of differently formulated cloudy mixed juices during refrigerated storage after high pressure processing[J]. Current Research in Food Science,2021, 4: 627-635. DOI:10.1016/j.crfs.2021.09.002.
[23]WANG H, NI Y, HU X, et al. Kinetics of amino acid loss in carrot juice concentrate during storage[J]. LWT-Food Science and Technology, 2006, 40(5): 785-792. DOI:10.13386/j.issn1002-0306.2019.21.044.
[24]孙珊珊. 梨浓缩汁非酶褐变影响因素及控制的研究[D]. 泰安: 山东农业大学, 2011: 36-45.
[25]卢家炯, 郭海蓉, 刘里萍, 等. 蔗汁中美拉德反应的影响因素研究[J].甘蔗糖业, 2000(2): 43-50.
[26]ZAPPALA M, FALLICO B, ARENA E. Methods for the determination of HMF in honey: a comparison[J]. Food Control, 2005,16: 273-277. DOI:10.1016/j.foodcont.2004.03.006.
[27]冯亮, 杨艳, 刘双双, 等. 基于L-抗坏血酸非酶褐变反应研究进展[J]. 食品与发酵工业, 2021, 47(22): 301-308. DOI:10.13995/j.cnki.11-1802/ts.027349.
[28]ROIG M G, BELLOB J F, RIVERA Z.S, et al. Studies on the occurrence of non-enzymatic browning during storage of citrus juice[J]. Food Research International, 1999, 32(9): 609-619.DOI:10.1016/S0963-9969(99)00128-3.
[29]MARTINSEN B K, AABY K, SKREDE G. Effect of temperature on stability of anthocyanins, ascorbic acid and color in strawberry and raspberry jams[J]. Food Chemistry, 2020, 316: 126297. DOI:10.1016/j.foodchem.2020.126297.
[30]CUI H, YU J, XIA S, et al. Improved controlled flavor formation during heat-treatment with a stable Maillard reaction intermediate derived from xylose-phenylalanine[J]. Food Chemistry, 2019, 271: 47-53.DOI:10.1016/j.foodchem.2018.07.161.