随着人们生活质量的改善和医疗水平的提高,全球平均健康预期寿命稳定增长。然而,糖尿病等代谢类疾病发生率出现惊人的增长,已成为许多国家的重大公共卫生问题[1]。目前,糖尿病是仅次于肿瘤和心脑血管病威胁人类健康的第3大疾病[2]。根据国际糖尿病联合会的数据表明,截至2019年全世界患有糖尿病的成年人总数已达4.63亿[3],中国糖尿病患者人数已达1.1亿[4]。糖尿病的主要危害在于糖尿病并发症导致的死亡[5]。管理糖尿病的主要策略是减少糖的摄入[6],抑制碳水化合物的水解,主要通过抑制碳水化合物水解过程中起关键作用的两种淀粉消化酶α-淀粉酶和α-葡萄糖苷酶实现[7-8]。
目前,阿卡波糖、二甲双胍和米格列醇等药物已经在临床被用于抑制α-淀粉酶和α-葡萄糖苷酶活性,以治疗II型糖尿病[9]。但是使用这些药物往往会对肠胃产生很大的副作用,包括恶心、胀气、腹泻、腹痛和肠胃气胀[10],其主要原因是未被消化的碳水化合物在肠道菌群的作用下异常发酵而引起[11]。近年来,随着人们越来越重视天然和健康食品,一些天然来源的植物或提取物已被研究发现具有抑制消化酶的作用[12-13],并且毒性较低,尤其是联合使用两种或两种以上天然化合物可以起到协同治疗的效果,减少剂量和毒性,同时能够减少耐药性的诱导。Wu Xiaqing等[14]的研究发现表儿茶素没食子酸酯与阿卡波糖或表没食子儿茶素没食子酸酯联合对α-淀粉酶表现为拮抗作用,对α-葡萄糖苷酶则表现为协同作用。
苦荞因其高营养和药用价值已显示出良好的市场潜力。研究发现,苦荞富含淀粉,尤其是抗性淀粉,可以作为糖尿病患者的理想食物[15-16]。同时,苦荞中含有较丰富的黄酮类化合物,包括芦丁、槲皮素、山柰酚等成分,是降血糖的主要功能因子[17],其中芦丁是苦荞黄酮的主要成分,占黄酮类化合物的70%以上[18-19]。已有研究指出,苦荞黄酮的浓度与抑制淀粉消化酶的效率呈正相关[20-21]。同时,研究发现苦荞总黄酮对淀粉消化酶的抑制效果强于苦荞水溶性提取物和苦荞醇溶性提取物[22],说明苦荞黄酮的降血糖功效往往是多种成分共同发挥的作用。
苦荞中黄酮对淀粉消化酶抑制作用的研究往往局限于单独抑制,而缺乏对联合抑制作用的探讨,因此本实验通过模拟苦荞淀粉体外消化体系,探讨苦荞中的主要黄酮(芦丁和槲皮素)对淀粉消化酶的单独抑制效果和机制,以及同时存在时对淀粉消化酶活性的抑制作用,为苦荞产品的深加工提供一定理论基础,以期为调控苦荞的功能性,最大化苦荞的降血糖效果指引方向。
1 材料与方法
1.1 材料与试剂
芦丁(纯度≥98%)、槲皮素(纯度≥98%)、阿卡波糖、对硝基苯基-α-D-吡喃葡萄糖苷(纯度≥98%)上海阿拉丁生化科技股份有限公司;猪胰腺α-淀粉酶(酶活力2 000 U/g) 美国Adamas-beta公司;α-葡萄糖苷酶(酶活力100 000 U/mL) 上海源叶生物技术有限公司;磷酸氢二钠、磷酸二氢钠(均为分析纯) 国药集团(上海)化学试剂有限公司;苦荞淀粉由实验室自制。
1.2 仪器与设备
M200 PRO酶标仪 奥地利帝肯公司;RF-5301 PC荧光分光光度计 日本岛津株式会社;PURELAB Classic超纯水机 英国ELGA公司;SHZ-B水浴恒温振动摇床中国上海博讯公司。
1.3 方法
1.3.1 芦丁和槲皮素对淀粉消化酶的单独抑制实验
对α-淀粉酶的抑制实验参照王静等[23]的方法。将60 μL不同质量浓度(0~1 mg/mL)芦丁或槲皮素和60 μL 2 U/mL α-淀粉酶混合,37 ℃预孵育10 min。添加2.5 mL 20 mg/mL Tris缓冲盐溶液、0.4 mL 0.1 mol/L磷酸钠缓冲液(pH 6.9)和0.98 mL超纯水,37 ℃、150 r/min恒温水浴摇床中反应3 min。最后加入2 mL 3,5-二硝基水杨酸,在沸水浴中加热5 min后终止反应。反应溶液冷却至室温后,稀释至25 mL,在540 nm处用酶标仪测定吸光度。
对α-葡萄糖苷酶的抑制实验参照Zhao Chunchao等[24]的方法。将100 μL不同质量浓度芦丁或槲皮素和100 μL 2 U/mL α-淀粉酶混合,37 ℃预孵育10 min。添加250 μL 3 mmol/L对硝基苯基-α-D-吡喃葡萄糖苷、1 mL磷酸钠缓冲液和0.98 mL超纯水,37 ℃、150 r/min恒温水浴摇床中反应10 min。最后,加入Na2CO3溶液(2 mL、1 mol/L)停止反应,在405 nm处用酶标仪测定吸光度。
设置仅添加酶为空白组,抑制剂和酶都不添加为空白对照组,添加抑制剂和酶为样品组,仅添加抑制剂为样品对照组。以阿卡波糖作为阳性对照。按下式计算芦丁和槲皮素对α-淀粉酶和α-葡萄糖苷酶活性的抑制率:
1.3.2 芦丁和槲皮素对淀粉消化酶的抑制动力学实验
参照陈雨涔等[25]的方法,固定底物质量浓度(2 g/mL、2.5 mL),测定不同质量浓度芦丁(0、0.2、0.4、0.6、0.8 mg/mL)和槲皮素(0、0.1、0.3、0.5、0.7 mg/mL)存在时,对应体系的反应速率随α-淀粉酶活力的变化,判断抑制剂的可逆性。固定底物浓度(3 mmol/L、250 μL),测定不同质量浓度芦丁(0、0.5、1.0、1.5、2.0 mg/mL)和槲皮素(0、0.2、0.4、0.6、0.8 mg/mL)存在时,对应体系的反应速率随α-葡萄糖苷酶活力的变化,判断抑制剂的可逆性。
固定α-淀粉酶(2 U/mL、60 μL)活力,测定不同质量浓度芦丁(0、0.2、0.4、0.6、0.8 mg/mL)和槲皮素(0、0.1、0.3、0.5、0.7 mg/mL)存在时,对应体系的反应速率随底物质量浓度的变化。固定α-葡萄糖苷酶(2 U/mL、100 μL)活力,测定不同质量浓度芦丁(0、0.5、1.0、1.5、2.0 mg/mL)和槲皮素(0、0.2、0.4、0.6、0.8 mg/mL)存在时,对应体系的反应速率随底物质量浓度的变化。
进一步以底物浓度的倒数为横坐标,反应初速率的倒数为纵坐标,绘制Lineweaver-Burk曲线图,根据所得直线的相交情况,确定芦丁和槲皮素对α-淀粉酶和α-葡萄糖苷酶的抑制类型。
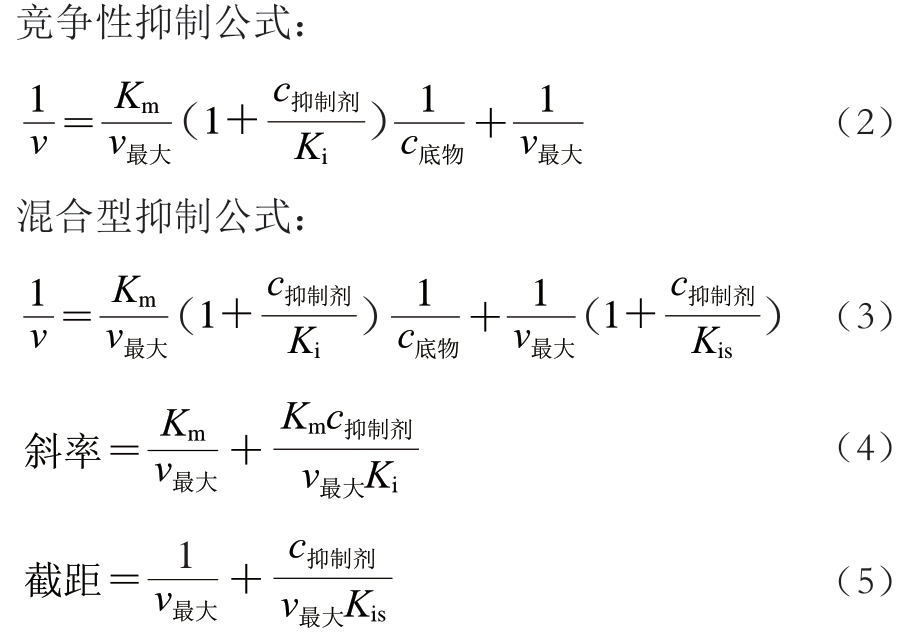
式(2)~(5)中:v为存在或不存在芦丁和槲皮素时的酶促反应速率;v最大为最大酶反应速率;c底物为苦荞淀粉和对硝基苯基-α-D-吡喃葡萄糖苷浓度;c抑制剂为芦丁和槲皮素质量浓度;Km为米氏常数;Ki为抑制剂与酶结合的平衡常数;Kis为抑制剂与酶-底物复合物结合的平衡常数。
1.3.3 淀粉消化酶的荧光猝灭分析
参考梁宗瑶等[26]的方法,在3 种温度(298、304、310 K)下用荧光分光光度计分别测定α-淀粉酶和α-葡萄糖苷酶的荧光变化,加入不同浓度的芦丁或槲皮素(0~64 μmol/L)孵育5 min后,继续进行测量。激发波长280 nm;发射波长300~500 nm;激发和发射狭缝宽度均5.0 nm。通过Stern-Vlomer方程可以判断芦丁和槲皮素对α-淀粉酶和α-葡萄糖苷酶的荧光猝灭机理,如下:
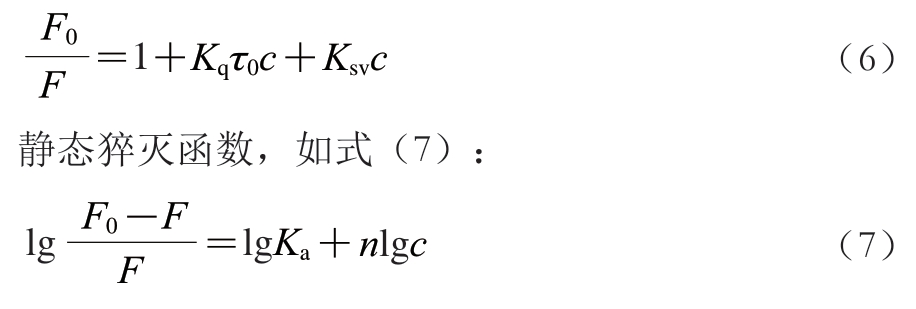
式(6)~(7)中:F0和F分别为α-淀粉酶和α-葡萄糖苷酶在不存在或存在芦丁和槲皮素时的荧光强度;c为芦丁和槲皮素的浓度;τ0为荧光团的平均荧光寿命;Kq、Ksv和Ka分别为猝灭速率常数、猝灭常数和结合常数;n为结合位点数。
芦丁和槲皮素与α-淀粉酶和α-葡萄糖苷酶的主要作用力类型可以通过Van’t-Hoff方程进行判断,如下:
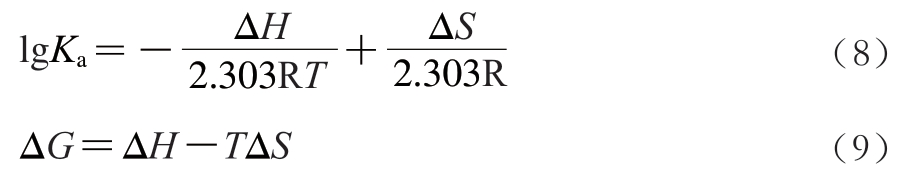
式(8)~(9)中:T为温度;R为气体常数;ΔG为自由能变化;ΔH为焓变;ΔS为熵变。
1.3.4 芦丁和槲皮素对淀粉消化酶的联合抑制实验
通过芦丁和槲皮素单独抑制时的抑制能力曲线计算出对α-淀粉酶和α-葡萄糖苷酶的半抑制浓度(IC50)值。在此基础上结合苦荞加工过程中芦丁和槲皮素的变化范围,将芦丁与槲皮素按照不同浓度比混合,参考1.3.1节中酶活性测定方法,进行联合抑制实验,计算芦丁与槲皮素联合对α-淀粉酶和α-葡萄糖苷酶活性的抑制率。为了评价芦丁和槲皮素联合使用的抑制作用,判断联合作用的效果,利用等效线图解法和Chou-Talalay药物联合指数(combination index,CI)进行评价。CI计算公式如下:
式中:D1、D2分别为组合系统中产生一定抑制水平芦丁和槲皮素的剂量;Dx1、Dx2分别为单独添加的导致相同抑制水平芦丁和槲皮素的剂量。
1.4 数据处理
所有实验采用3 个平行样品,数据用 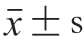 表示。使用SPSS Statistics 21.0的Duncan检验进行单因素方差分析(P<0.05),使用Origin 2018作图。
表示。使用SPSS Statistics 21.0的Duncan检验进行单因素方差分析(P<0.05),使用Origin 2018作图。
2 结果与分析
2.1 芦丁和槲皮素对淀粉消化酶的单独抑制能力
如图1所示,芦丁和槲皮素对淀粉消化酶都表现出剂量依赖性的抑制作用。其中,阿卡波糖作为阳性对照的酶抑制效果最强,对α-淀粉酶和α-葡萄糖苷酶的IC50值分别为0.047 mg/mL和0.03 mg/mL。但阿卡波糖对淀粉消化酶的过度抑制可能会导致结肠内未被消化的淀粉发生异常发酵,从而产生胃肠道功能紊乱[11];而芦丁和槲皮素相对温和的抑制活性,能有效缓解胃肠道不适。由图1A可知,芦丁和槲皮素对α-淀粉酶的IC50值分别为0.36 mg/mL和0.22 mg/mL;由图1B可知,芦丁和槲皮素对α-葡萄糖苷酶的IC50值分别为1.3 mg/mL和0.362 mg/mL。槲皮素比芦丁具有更强的抑制能力,是由于槲皮素C环上的羟基被一个糖基取代变为芦丁,羟自由基转变为糖基可能会发生空间位阻,削弱芦丁与酶的结合作用,从而降低芦丁的抑制能力[27]。
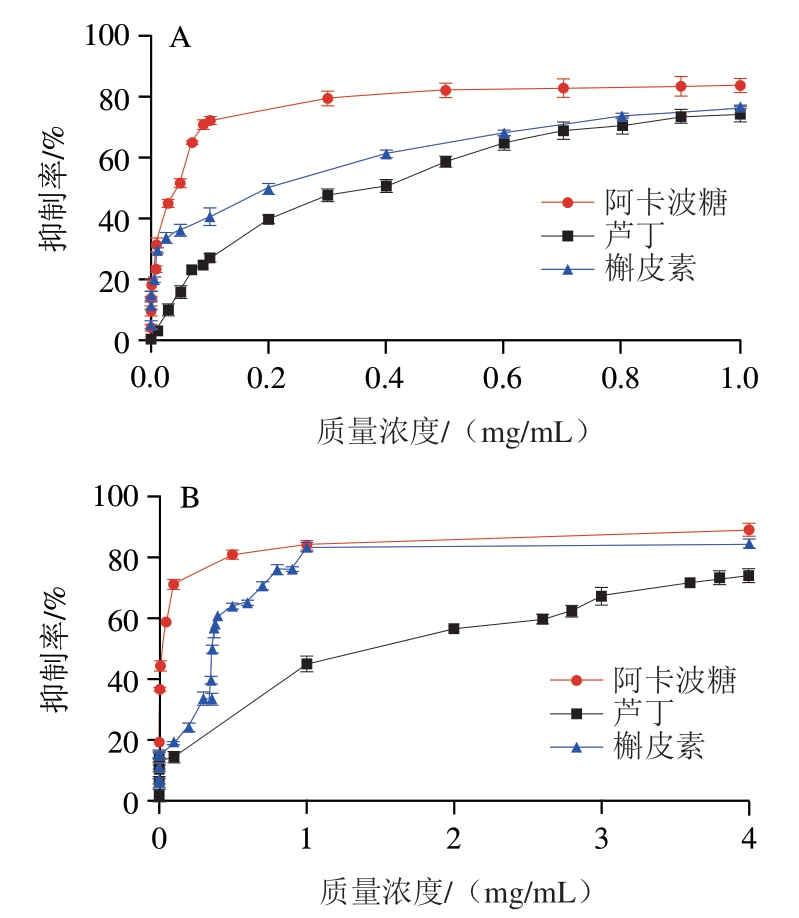
图1 芦丁和槲皮素对α-淀粉酶(A)和α-葡萄糖苷酶(B)的抑制曲线
Fig. 1 Inhibitory effects of rutin and quercetin on α-amylase (A) and α-glucosidase (B)
此外,由图1可知,芦丁和槲皮素对α-淀粉酶的抑制效果更强,分别是对α-葡萄糖苷酶抑制能力的3.6 倍和1.6 倍,这可能是由于芦丁和槲皮素B环上的羟基有利于与α-淀粉酶的活性位点结合。
2.2 芦丁和槲皮素对淀粉消化酶的抑制动力学分析
由图2可知,不同质量浓度的芦丁和槲皮素都能得到一条通过原点的直线,且斜率随着质量浓度的增加而减小。由此可知,芦丁和槲皮素对α-淀粉酶和α-葡萄糖苷酶都属于可逆性抑制作用。
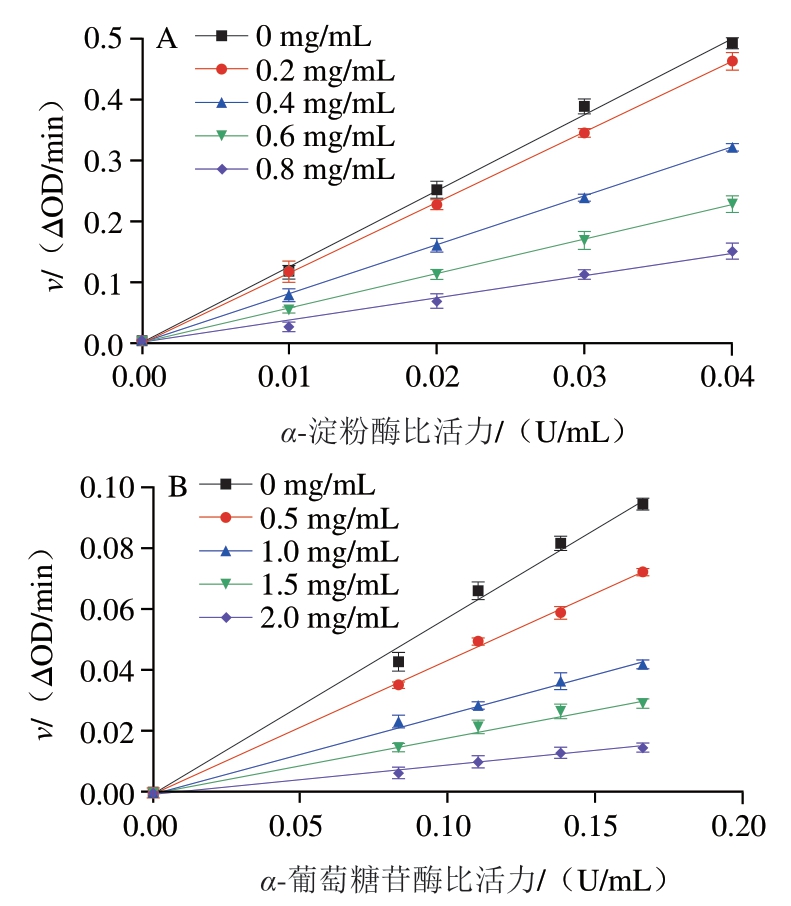
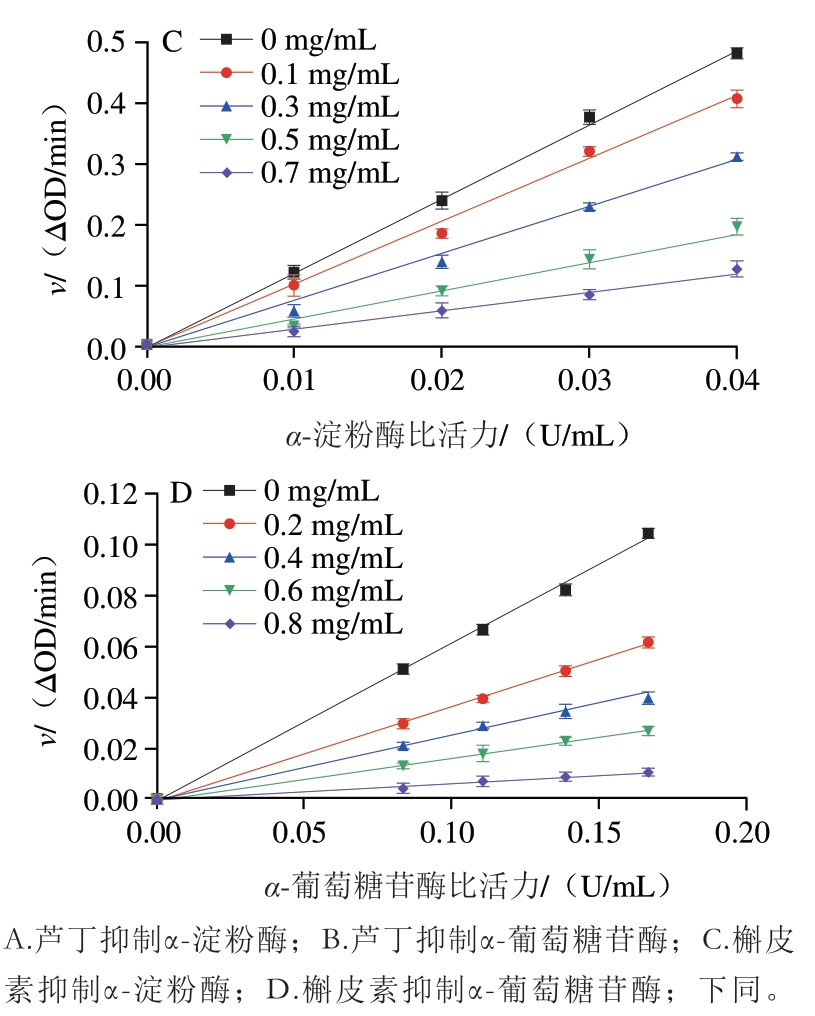
图2 芦丁和槲皮素对淀粉消化酶的抑制可逆性
Fig. 2 Reversible inhibitory effects of rutin and quercetin against starch-digesting enzymes
如图3A和C所示,芦丁和槲皮素对α-淀粉酶抑制的双倒数曲线,所有直线与纵轴相交,随着芦丁和槲皮素质量浓度的增加,Km值不断增加而v最大值保持不变。因此芦丁和槲皮素对α-淀粉酶属于竞争性抑制,通过与α-淀粉酶的活性中心结合,占据底物的结合位点,从而抑制底物的水解。根据竞争性抑制公式可以计算出芦丁和槲皮素对α-淀粉酶的Ki值分别为806.29、793.92 μg/mL,说明槲皮素与α-淀粉酶的结合更牢固,具有更强的抑制效果,与2.1节中槲皮素对α-淀粉酶的抑制能力强于芦丁的实验结果一致。
如图3B所示,所有直线都相交于第3象限,Km值和v最大同时减小,表明芦丁对α-葡萄糖苷酶属于非竞争性和反竞争性的混合型抑制,其中,Ki值为9.61 μmol/L,Kis值为3.38 μmol/L,说明芦丁更倾向于与酶-底物复合物结合。如图3D所示,所有直线都相交于第2象限,Km值逐渐升高,同时v最大逐渐降低,表明槲皮素对α-葡萄糖苷酶为竞争性和非竞争性的混合型抑制,Ki值为3.72 μmol/L,Kis值为9.74 μmol/L,说明槲皮素更倾向于与游离的α-葡萄糖苷酶结合。
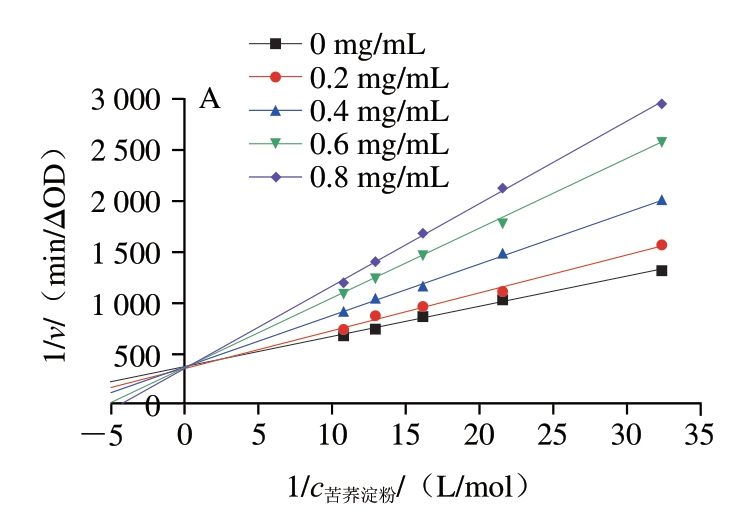
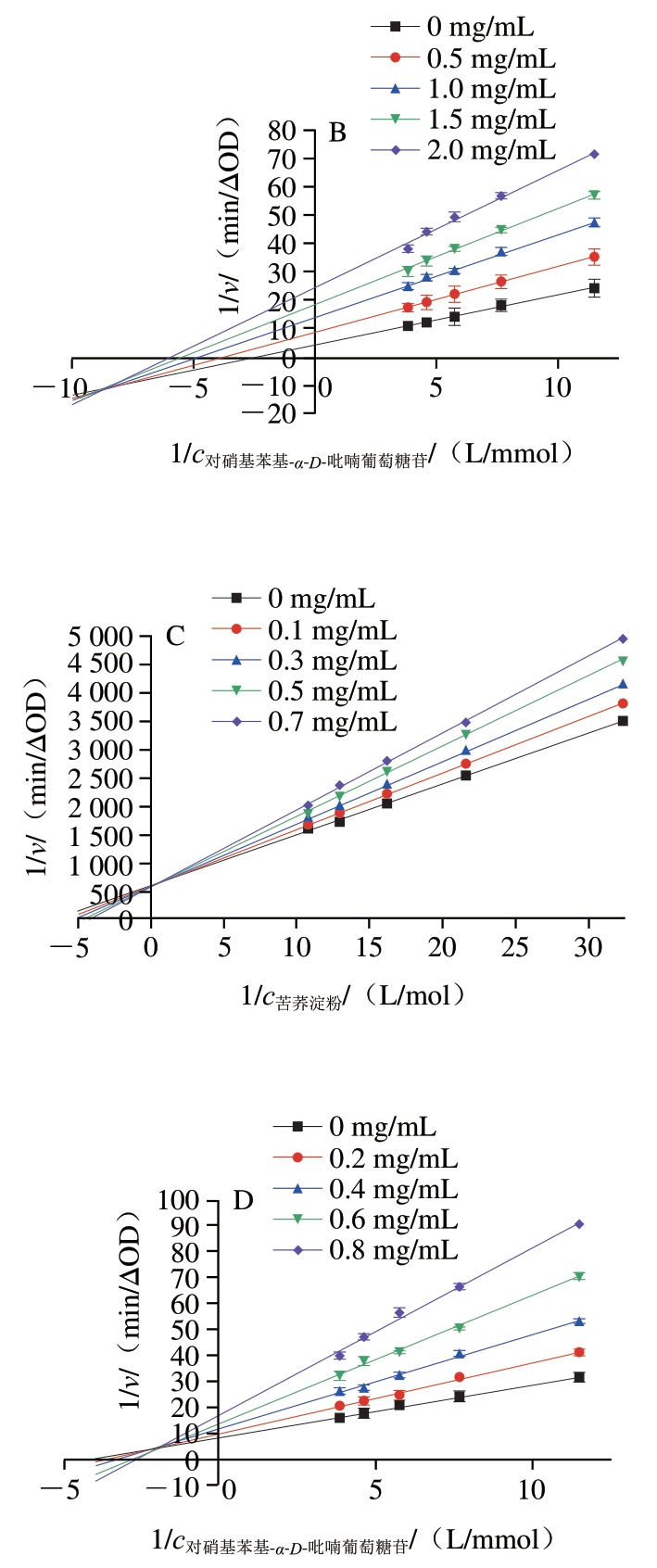
图3 芦丁和槲皮素对淀粉消化酶的双倒数图
Fig. 3 Double-reciprocal plots of rutin and quercetin against starch-digesting enzymes
2.3 芦丁和槲皮素对淀粉消化酶的荧光光谱分析
由图4可知,当测试温度298 K、激发波长280 nm时,α-淀粉酶和α-葡萄糖苷酶均在340 nm波长附近有最大发射峰(λmax)。当反应体系中加入不同浓度的芦丁和槲皮素,两种酶的荧光强度都展现出剂量依赖性的猝灭,且λmax发生不同程度的移动。如图4A和B所示,随着芦丁浓度的增加,α-淀粉酶和α-葡萄糖苷酶的λmax分别从340 nm移动到335 nm和332 nm;如图4C和D所示,随着槲皮素浓度的增加,α-淀粉酶和α-葡萄糖苷酶的λmax分别从342 nm和340 nm移动至338 nm。这种现象表明芦丁和槲皮素与α-淀粉酶和α-葡萄糖苷酶之间存在相互作用,导致氨基酸残基逐渐暴露在水溶液中,所处环境极性降低[28]。
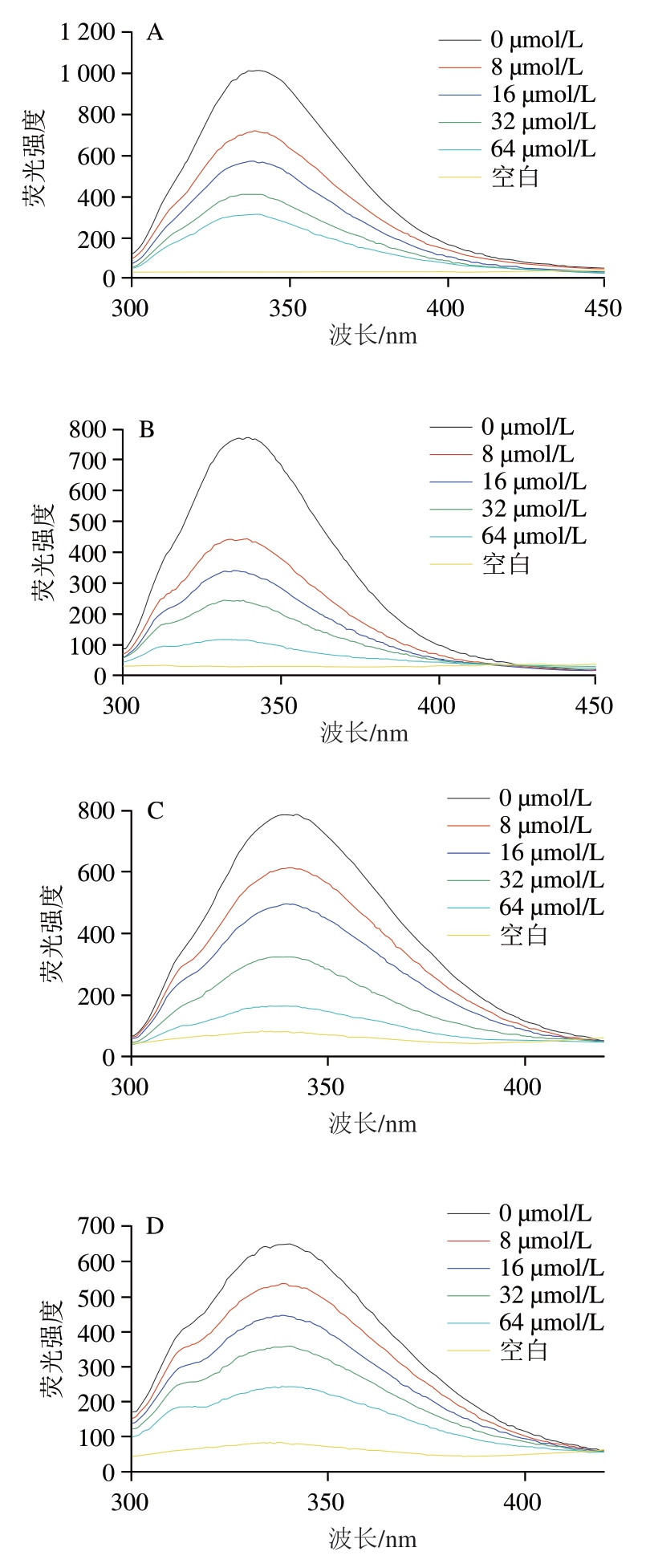
图4 芦丁和槲皮素与淀粉消化酶荧光光谱图
Fig. 4 Fluorescence spectra of rutin and quercetin against starch-digesting enzymes
2.4 芦丁和槲皮素对淀粉消化酶的结合性质分析
由图5可知,芦丁和槲皮素对α-淀粉酶和α-葡萄糖苷酶的Stern-Volmer曲线均具有良好的线性关系。由表1可知,随着温度的升高,芦丁对α-淀粉酶和α-葡萄糖苷酶的Ksv值分别降低了2.58×104 L/mol和1.97×104 L/mol,槲皮素对α-淀粉酶和α-葡萄糖苷酶的Ksv值分别降低了1.60×104 L/mol和2.12×104 L/mol;Ksv值均随着温度的升高而降低,且Kq值为1013和1012数量级,远大于生物大分子的最大散射碰撞猝灭常数2.0×1010 L/(mol·s),说明芦丁和槲皮素与α-淀粉酶和α-葡萄糖苷酶均通过形成复合物的方式发生静态猝灭。
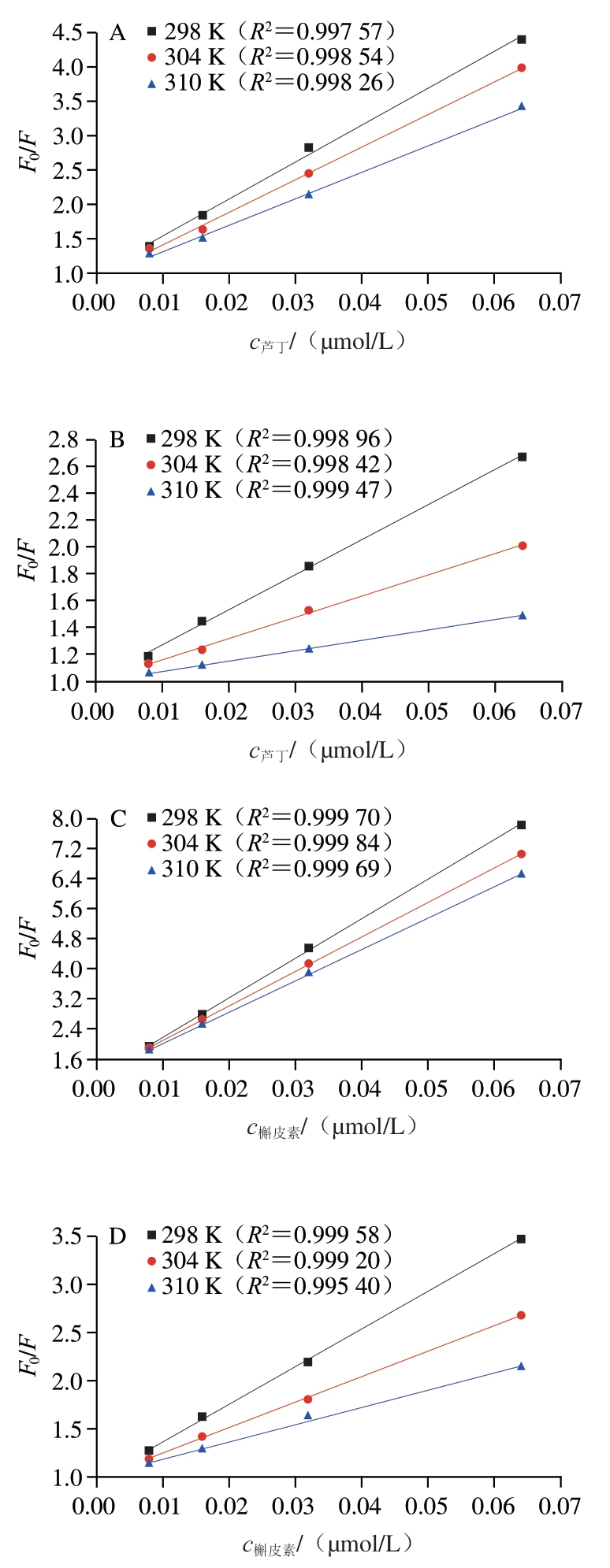
图5 芦丁和槲皮素对淀粉消化酶的Stern-Volmer曲线
Fig. 5 Stern-Volmer curves of rutin and quercetin against starch-digesting enzymes
由图6可知,芦丁和槲皮素对α-淀粉酶和α-葡萄糖苷酶相互作用的双对数曲线图均具有良好的线性关系,利用拟合直线的斜率和截距,并结合静态猝灭公式,由此可以计算得到Ka值和n。如表1所示,槲皮素对α-淀粉酶和α-葡萄糖苷酶的Ka值均高于芦丁,说明槲皮素与α-淀粉酶和α-葡萄糖苷酶的结合力更强;芦丁和槲皮素对α-淀粉酶的Ka值高于α-葡萄糖苷酶,说明芦丁和槲皮素对α-淀粉酶具有更强的结合力。此外,n值近似于1,表明芦丁和槲皮素在α-淀粉酶和α-葡萄糖苷酶上只存在一个(或一类)结合位点。
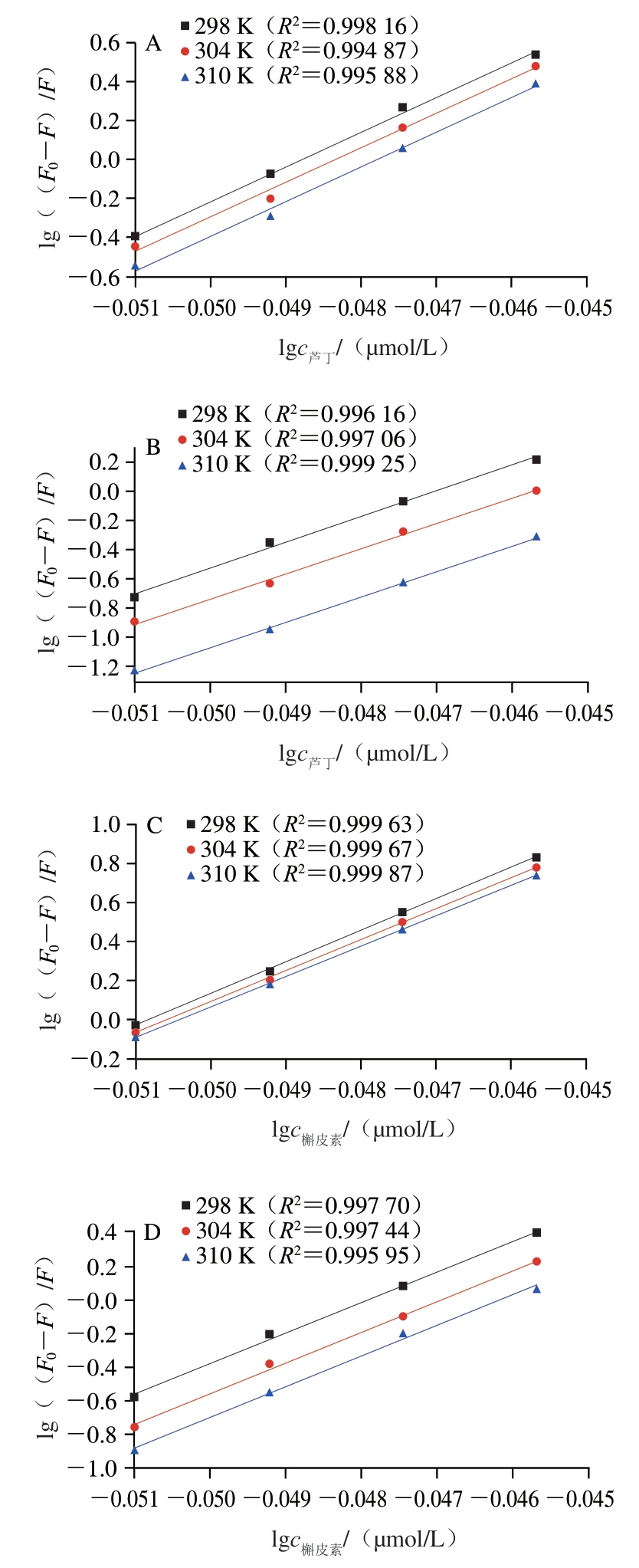
图6 芦丁和槲皮素与淀粉消化酶相互作用的双对数曲线图
Fig. 6 Double logarithm plots of rutin and quercetin with starch-digesting enzymes
通过Van’t-Hoff方程计算出ΔH、ΔS及ΔG的变化,可以判断芦丁和槲皮素与淀粉消化酶之间的相互作用力。如表1所示,ΔG均为负值,表明芦丁和槲皮素与α-淀粉酶和α-葡萄糖苷酶的结合是一种自发的过程。芦丁和槲皮素与α-淀粉酶反应时,ΔH均为负值,ΔS均为正值,表明这种结合是熵驱动的放热过程,疏水相互作用力和氢键是芦丁和槲皮素与α-淀粉酶复合物稳定的主要驱动力。芦丁和槲皮素与α-葡萄糖苷酶反应时,ΔH和ΔS均为负值,表明主要驱动力是氢键。
表1 芦丁或槲皮素与α-淀粉酶或α-葡萄糖苷酶相互作用及热力学参数
Table 1 Thermodynamic parameters for interaction between rutin or quercetin and α-amylase or α-glucosidase
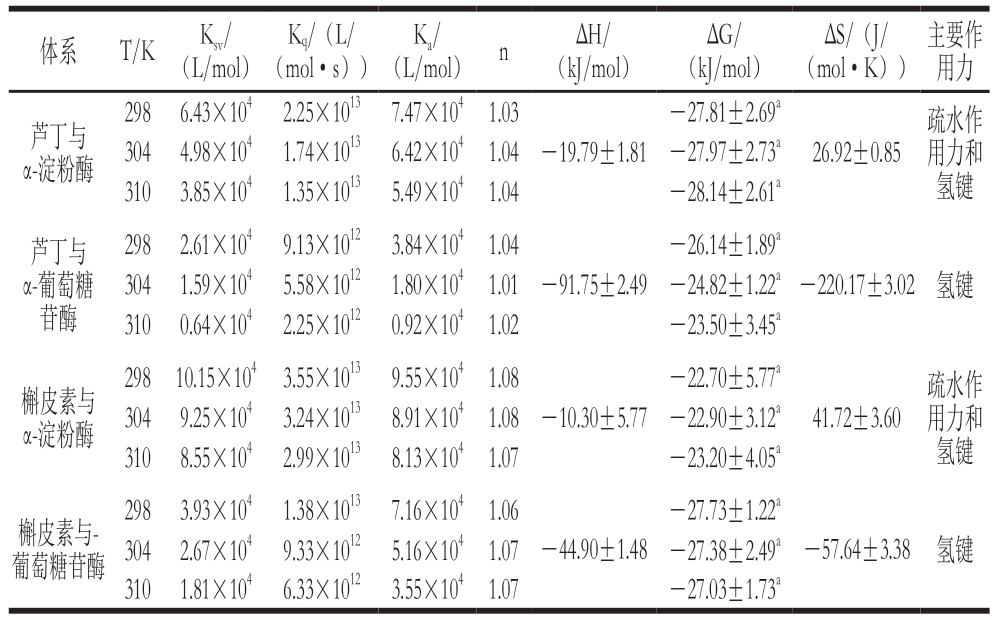
注:同列不同字母表示差异显著(P<0.05)。
体系 T/K Ksv/(L/mol)Kq/(L/(mol·s)) (L/mol) n ΔH/(kJ/mol)Ka/ΔG/(kJ/mol)ΔS/(J/(mol·K))主要作用力298 6.43×104 2.25×1013 7.47×104 1.03-27.81±2.69a芦丁与α-淀粉酶304 4.98×104 1.74×1013 6.42×104 1.04 -27.97±2.73a 310 3.85×104 1.35×1013 5.49×104 1.04 -28.14±2.61a-19.79±1.8126.92±0.85疏水作用力和氢键芦丁与α-葡萄糖苷酶298 2.61×104 9.13×1012 3.84×104 1.04-26.14±1.89a 304 1.59×104 5.58×1012 1.80×104 1.01 -24.82±1.22a 310 0.64×104 2.25×1012 0.92×104 1.02 -23.50±3.45a-91.75±2.49-220.17±3.02 氢键槲皮素与α-淀粉酶298 10.15×104 3.55×1013 9.55×104 1.08-22.70±5.77a 304 9.25×104 3.24×1013 8.91×104 1.08 -22.90±3.12a 310 8.55×104 2.99×1013 8.13×104 1.07 -23.20±4.05a-10.30±5.7741.72±3.60疏水作用力和氢键-27.73±1.22a 298 3.93×104 1.38×1013 7.16×104 1.06 304 2.67×104 9.33×1012 5.16×104 1.07 -27.38±2.49a 310 1.81×104 6.33×1012 3.55×104 1.07 -27.03±1.73a槲皮素与-葡萄糖苷酶-44.90±1.48-57.64±3.38 氢键
2.5 芦丁和槲皮素对淀粉消化酶的联合抑制作用
由2.1节的结果(图1)可知,芦丁和槲皮素对于α-淀粉酶的IC50比为1.64∶1,芦丁和槲皮素对α-葡萄糖苷酶的IC50比为3.6∶1。已有研究发现苦荞中芦丁含量是槲皮素的7 倍[29],但在加工存储过程中约80%的芦丁会水解成槲皮素[30],所以槲皮素含量通常是芦丁的5 倍。因此,分别以7∶1、1.64∶1和1.64∶8.2,作为芦丁和槲皮素联合使用抑制α-淀粉酶的浓度比,以7∶1、3.6∶1和3.6∶18作为芦丁和槲皮素联合使用抑制α-葡萄糖苷酶的浓度比。
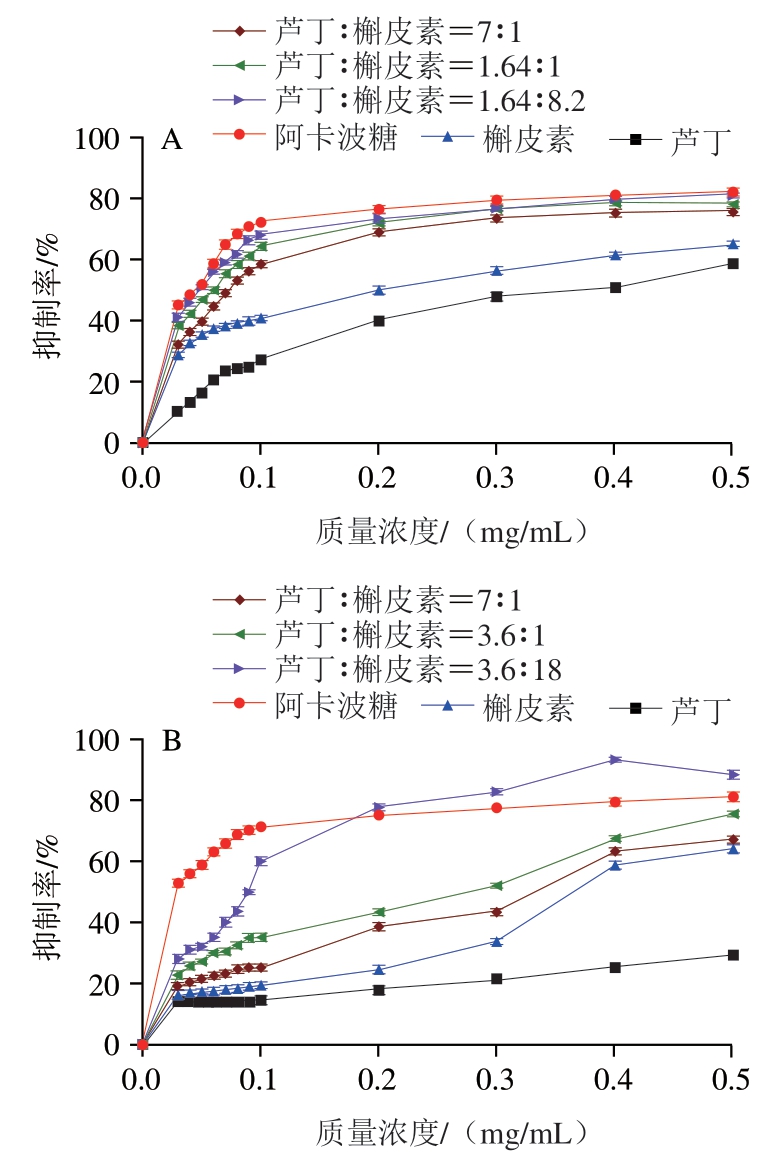
图7 芦丁和槲皮素联合使用对α-淀粉酶(A)和α-葡萄糖苷酶(B)的抑制能力
Fig. 7 Combined inhibition of rutin and quercetin on α-amylase (A)and α-glucosidase (B)
如图7所示,芦丁和槲皮素联合使用对α-淀粉酶和α-葡萄糖苷酶均具有抑制效果。在相同质量浓度下,芦丁和槲皮素联合作用优于单独抑制的效果,且抑制率随着二者联合质量浓度的增加而逐渐升高。二者浓度比为1.64∶8.2时对α-淀粉酶抑制能力最强,IC50值为0.055 mg/mL;二者浓度比为3.6∶18时对α-葡萄糖苷酶抑制能力最强,IC50值为0.091 mg/mL。结果表明,芦丁和槲皮素联合使用时均能够提高对α-淀粉酶和α-葡萄糖苷酶的抑制效果,且槲皮素较多时,抑制作用更强。
2.6 芦丁和槲皮素对淀粉消化酶联合抑制作用的评价
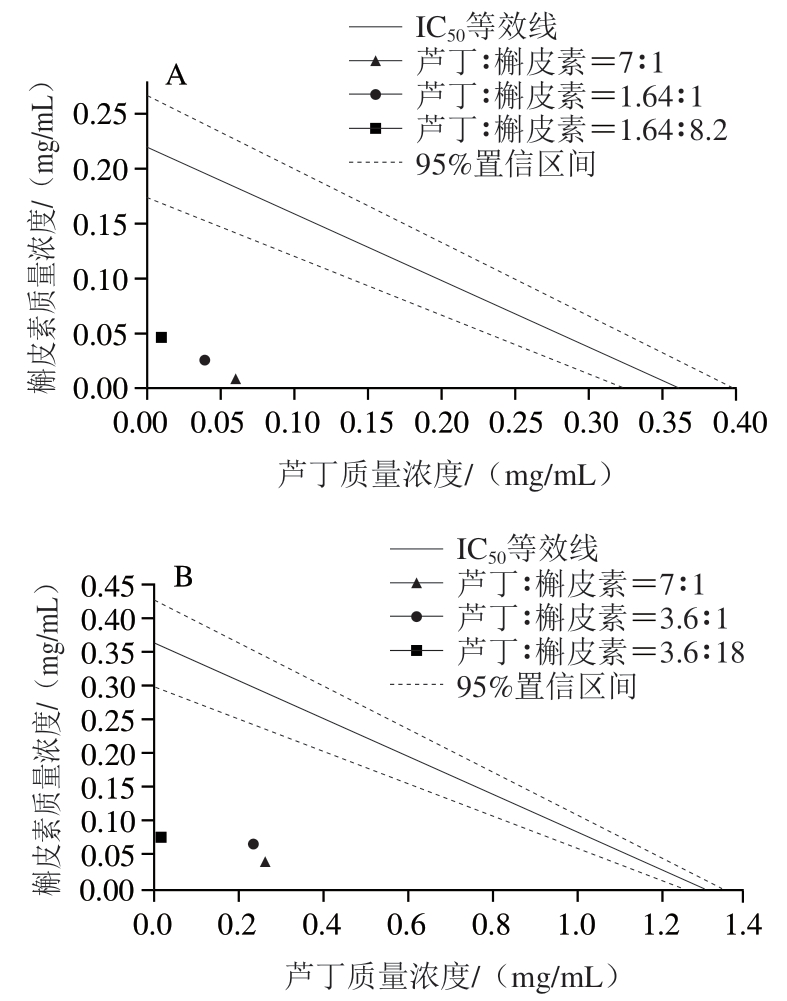
图8 芦丁和槲皮素联合抑制α-淀粉酶(A)和α-葡萄糖苷酶(B)的IC50等效线图
Fig. 8 IC50 isobolograms for inhibition of α-amylase (A) and α-glucosidase (B) by combined use of rutin and quercetin
由图8A可知,3 种浓度比下的剂量对均位于等效线的下方,CI值分别为0.20、0.22和0.24,均小于1,表明芦丁和槲皮素联合使用对α-淀粉酶表现出协同抑制的作用。其中,芦丁和槲皮素浓度比为7∶1时CI值最小,具有更好地协同抑制效果,这可能是由于α-淀粉酶上有多个活性位点,芦丁和槲皮素能够与α-淀粉酶的不同氨基酸残基发生特异性结合,联合使用时优势互补,增加了黄酮-酶复合物的稳定性。
由图8B可知,3 种浓度比下的剂量对均位于等效线的下方,CI值分别为0.41、0.36和0.22,均小于1。表明芦丁和槲皮素联合使用时对α-葡萄糖苷酶表现出协同抑制的作用。其中,芦丁和槲皮素浓度比为3.6∶18时CI值最小,具有更好的协同抑制效果,这可能是由于芦丁和槲皮素都能够非竞争性抑制α-葡萄糖苷酶活性,与α-葡萄糖苷酶的非竞争性位点结合,增强了协同抑制作用[31]。此外,由2.4节的结果可知,槲皮素与α-葡萄糖苷酶的结合力更强,因此槲皮素占比较多时协同抑制效果更好。
3 结 论
通过探究苦荞中黄酮的主要成分芦丁和槲皮素单独使用和联合使用的抑制效果,结合抑制动力学、荧光光谱法,更加精准和全面地分析苦荞中芦丁和槲皮素对淀粉消化酶的影响。主要研究结果表明,芦丁和槲皮素对α-淀粉酶和α-葡萄糖苷酶都具有剂量依赖性的抑制,且对两种淀粉消化酶的抑制效果皆为槲皮素优于芦丁。芦丁和槲皮素对α-淀粉酶的IC50值分别为0.36 mg/mL和0.22 mg/mL,对α-葡萄糖苷酶的IC50值分别为1.30 mg/mL和0.362 mg/mL。二者对α-淀粉酶的抑制效果强于α-葡萄糖苷酶。进一步判断抑制机理可知,芦丁和槲皮素与α-淀粉酶以疏水相互作用力和氢键结合,竞争性抑制酶的活性,且槲皮素与α-淀粉酶的结合能力更强,能起到更好的抑制效果;对α-葡萄糖苷酶均为通过氢键结合的混合型抑制。同时,二者与α-淀粉酶和α-葡萄糖苷酶的结合只存在一个(或一类)作用位点。将芦丁和槲皮素按照不同比例联合使用可以增强两者单用时的抑制能力,并且对α-淀粉酶和α-葡萄糖苷酶都具有协同抑制的作用,当二者浓度比为7∶1和3.6∶18时,对α-淀粉酶和α-葡萄糖苷酶的CI值分别达到0.20和0.22,具有最佳的协同抑制效果。
[1]VU N K, KIM C S, HA M T, et al. Antioxidant and antidiabetic activities of flavonoid derivatives from the outer skins of Allium cepa L.[J].Journal of Agricultural and Food Chemistry, 2020, 68(33): 8797-8811.DOI:10.1021/acs.jafc.0c02122.
[2]谭哲谞, 许利嘉, 陈四保. 植物来源α-葡萄糖苷酶抑制剂的研究新进展[J]. 中南药学, 2018, 16(7): 982-987. DOI:10.7539/j.issn.1672-2981.2018.07.020.
[3]BOULTON A. Strengthening the International Diabetes Federation(IDF)[J]. Diabetes Research and Clinical Practice, 2020, 160: 108029.DOI:10.1016/j.diabres.2020.108029.
[4]ZHU F. Glycemic control in Chinese steamed bread: strategies and opportunities[J]. Trends in Food Science & Technology, 2019, 86: 252-259. DOI:10.1016/j.tifs.2019.02.038.
[5]ZHAO C C, CHEN J, SHAO J H, et al. Lignan constituents from the fruits of Viburnum macrocephalum f. keteleeri and their α-amylase,α-glucosidase, and protein tyrosine phosphatase 1B inhibitory activities[J]. Journal of Agricultural and Food Chemistry, 2020, 68(40):11151-11160. DOI:10.1021/acs.jafc.0c03353.
[6]SUN L J, MIAO M. Dietary polyphenols modulate starch digestion and glycaemic level: a review[J]. Critical Reviews in Food Science and Nutrition, 2019, 60(4): 541-555. DOI:10.1080/10408398.2018.15448 83.
[7]ZHU J Z, CHEN C, ZHANG B, et al. The inhibitory effects of flavonoids on α-amylase and α-glucosidase[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(4): 695-708. DOI:10.1080/1040 8398.2018.1548428.
[8]乔锦莉, 张妍, 刘佩, 等. 野生蓝果忍冬多酚鉴定及其抗氧化、降血糖活性[J]. 食品科学, 2021, 42(11): 47-55. DOI:10.7506/spkx1002-6630-20200709-123.
[9]DI STEFANO E, OLIVIERO T, UDENIGWE C C. Functional significance and structure-activity relationship of food-derived α-glucosidase inhibitors[J]. Current Opinion in Food Science, 2018,20: 7-12. DOI:10.1016/j.cofs.2018.02.008.
[10]刘卫, 喻红兵. 沙格列汀联合阿卡波糖治疗新发2型糖尿病的效果研究[J]. 中外医学研究, 2021, 19(14): 39-41. DOI:10.14033/j.cnki.cfmr.2021.14.013.
[11]SUN L J, WARREN F J, GIDLEY M L, et al. Mechanism of binding interactions between young apple polyphenols and porcine pancreatic α-amylase[J]. Food Chemistry, 2019, 283: 468-474. DOI:10.1016/j.foodchem.2019.01.087.
[12]AGADA R, USMAN W A, SHEHU S, et al. In vitro and in vivo inhibitory effects of Carica papaya seed on α-amylase and α-glucosidase enzymes[J]. Heliyon, 2020, 6(3): e03618. DOI:10.1016/j.heliyon.2020.e03618.
[13]WANG J, WU T, FANG L, et al. Anti-diabetic effect by walnut (Juglans mandshurica Maxim.)-derived peptide LPLLR through inhibiting α-glucosidase and α-amylase, and alleviating insulin resistance of hepatic HepG2 cells[J]. Journal of Functional Foods, 2020, 69: 103944.DOI:10.1016/j.jff.2020.103944.
[14]WU X Q, HU M M, HU X, et al. Inhibitory mechanism of epicatechin gallate on α-amylase and α-glucosidase and its combinational effect with acarbose or epigallocatechin gallate[J]. Journal of Molecular Liquids, 2019,290: 111202. DOI:10.1016/j.molliq.2019.111202.
[15]刘娜. 苦荞淀粉-槲皮素复合物制备与特性研究[D]. 杨凌: 西北农林科技大学, 2019: 9-10.
[16]任顺成, 孙晓莎. 芦丁和槲皮素对小麦淀粉理化特性的影响[J]. 食品科学, 2018, 39(2): 25-30. DOI:10.7506/spkx1002-6630-201802005.
[17]肖杰, 王曦, 侯粲, 等. 苦荞调控糖脂代谢作用及其生物学机制研究进展[J]. 食品科学, 2019, 40(21): 343-349. DOI:10.7506/spkx1002-6630-20181024-274.
[18]吴韬, 肖丽, 李伟丽, 等. 苦荞的营养与功能成分研究进展[J]. 西华大学学报(自然科学版), 2021, 40(2): 91-96; 109. DOI:10.12198/j.issn.1673-159X.3521.
[19]刘钰, 曹亚楠, 彭镰心, 等. 加工方式对苦荞中黄酮类化合物的影响研究进展[J]. 食品工业科技, 2021, 42(15): 351-357. DOI:10.13386/j.issn1002-0306.2020070008.
[20]周晓婷, 张根义. 苦荞提取物成分分析及不同极性提取物对α-淀粉酶的抑制作用[J]. 食品科学, 2017, 38(18): 42-47. DOI:10.7506/spkx1002-6630-201718007.
[21]闫文杰, 段昊, 吕燕妮, 等. 苦荞在我国保健食品中的应用进展[J]. 食品科技, 2021, 46(6): 55-61. DOI:10.13684/j.cnki.spkj.2021.06.010.
[22]王斯慧, 白银花, 黄琬凌, 等. 苦荞黄酮对α-葡萄糖苷酶的抑制作用研究[J]. 食品科技, 2012, 37(2): 24-26; 31. DOI:10.13684/j.cnki.spkj.2012.02.011.
[23]王静, 刘丁丽, 罗丹, 等. 体外模拟消化对藜麦抗氧化活性、α-葡萄糖苷酶和α-淀粉酶抑制活性影响研究[J]. 中国粮油学报, 2021, 36(4): 51-58.DOI:10.3969/j.issn.1003-0174.2021.04.010.
[24]ZHAO C C, CHEN J, SHAO J H, et al. Lignan glycosides from the stems of Viburnum melonocarpum and their α-glucosidase inhibitory activity[J].Holzforschung, 2020, 74(1): 88-93. DOI:10.1515/hf-2019-0159.
[25]陈雨涔, 王莹莹, 杜若童, 等. 槲皮素、芦丁、没食子酸抑制黄嘌呤氧化酶的活性及动力学特性[J]. 现代食品科技, 2020, 36(12): 118-124.DOI:10.13982/j.mfst.1673-9078.2020.12.0608.
[26]梁宗瑶, 魏园园, 任维维, 等. 橡子仁萃取物成分分析及对α-淀粉酶、α-葡萄糖苷酶的抑制作用[J]. 食品工业科技, 2021, 42(17): 47-55.DOI:10.13386/j.issn1002-0306.2020120118.
[27]MARTINEZ-GONZALEZ A I, DÍAZ-SÁNCHEZ Á G, DE LA ROSA L A,et al. Inhibition of α-amylase by flavonoids: structure activity relationship(SAR)[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2019, 206: 437-447. DOI:10.1016/j.saa.2018.08.057.
[28]郭时印, 李林, 周虹, 等. 1-脱氧野尻霉素对α-葡萄糖苷酶的抑制作用机制[J]. 食品科学, 2019, 40(5): 53-58. DOI:10.7506/spkx1002-6630-20180808-081.
[29]王世霞, 李笑蕊, 贠婷婷, 等. 不同品种苦荞麦营养及功能成分对比分析[J]. 食品与机械, 2016, 32(7): 5-9; 35. DOI:10.13652/j.issn.1003-5788.2016.07.002.
[30]GERM M, ÁRVAY J, VOLLMANNOVÁ A, et al. The temperature threshold for the transformation of rutin to quercetin in Tartary buckwheat dough[J]. Food Chemistry, 2019, 283: 28-31. DOI:10.1016/j.foodchem.2019.01.038.
[31]ZHANG B W, LI X, SUN W L, et al. Dietary flavonoids and acarbose synergistically inhibit α-glucosidase and lower postprandial blood glucose[J]. Journal of Agricultural and Food Chemistry, 2017, 65(38):8319-8330. DOI:10.1021/acs.jafc.7b02531.