在谷物类食品中,燕麦蛋白质含量居首位(11.19%~19.85%)。其蛋白组成中氨基酸均衡且配比合理[1],其中球蛋白占总蛋白质含量的70%~80%,主要由12S、7S和3S蛋白组成[2],因燕麦蛋白溶解性等功能性质较差,限制了其在食品加工领域中的应用。对蛋白进行糖基化、胶凝化等改性处理,将改性蛋白作为添加剂应用于食品配方中是一种极具潜力的方法。通过糖基化改性,产物的溶解性、乳化性、凝胶性以及抗氧化活性等功能性质均有不同程度的提高[3-5]。凝胶性质是蛋白质作为食品添加剂十分重要的功能特性,蛋白质凝胶具有黏弹性,可包裹水、脂质、风味物质等食品成分,为新型食品的研发提供了很好的物质基础[5]。国内外对植物蛋白凝胶机理的研究主要集中在大豆蛋白上,其他植物蛋白的研究相对较少。刘建垒[6]研究发现燕麦蛋白在温度低于90 ℃时不能形成凝胶,随着温度升高,其破裂力、硬度减小,而黏附性增大。李琳琳[7]以燕麦球蛋白为原料,制备燕麦球蛋白酸性、碱性和中性凝胶,由凝胶的水分弛豫和流变学特性可知,加热温度和球蛋白浓度越高,pH值越小,加热时间越长越有利于燕麦球蛋白凝胶的形成,其凝胶弹性及凝胶网络稳定性越好。转谷氨酰胺酶(transglutaminase,TG)在参与催化蛋白交联反应时,将酶肽链上谷氨酰残基的γ-酰基,与赖氨酸上的ε-氨基、伯氨基和水发生交联,从而提高蛋白制品破断力、硬度、持水力等[8-9]。尚未有采用糖基化分别结合加热与TG两种处理方法进行复合改性燕麦蛋白的凝胶性质的报道。为了将改性蛋白作为添加剂更好地应用于食品工业中,本研究对燕麦蛋白及其糖基化产物分别进行热处理和TG改性,测定改性蛋白凝胶的结构和凝胶性质,探究糖基化改性结合热处理或TG改性对燕麦蛋白凝胶性质的影响。以期为燕麦蛋白的开发及应用提供一定理论依据。
1 材料与方法
1.1 材料与试剂
燕麦 黑龙江省农业科学院畜牧兽医分院实验基地;透析膜(再生纤维素膜,截留分子质量1 kDa)生工生物工程(上海)股份有限公司;乳糖 天津市凯通化学试剂有限公司;TG(酶比活力100 U/g) 江苏一鸣有限公司;邻苯二甲醛 上海阿拉丁生化科技股份有限公司;8-苯胺-1-萘磺酸(8-amino-1-naphthalene sulfonoc acid,ANS) 上海麦克林生化有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)标准蛋白、辣根过氧化物酶 生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BSA124S型电子天平 赛多利斯科学仪器(北京)有限公司;WK-600A型粉碎机 上海新诺仪器设备有限公司;SHA-C型恒温水浴振荡器 金坛市天竟实验仪器厂;PC/PLCLD-53型真空冷冻干燥机 美国Millrock公司;TDL-5A型台式离心机 上海安亭科学仪器厂;DF-11型集热式磁力加热搅拌器 山东东易日盛仪器有限公司;PB-10型pH计 北京赛多利斯仪器有限公司;TMS-PRO质构仪 北京盈盛恒泰科技有限责任公司;Spectrum One型傅里叶变换红外(Fourier transform infrared,FTIR)光谱仪 美国Perkin Elmer公司;TU-1901型紫外-可见分光光度计 北京普析通用仪器有限责任公司;EnSpire多功能酶标仪 珀金埃尔默企业管理(上海)有限公司;DYCZ-24DN迷你双垂直电泳仪北京市六一仪器厂;S-3400N扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司。
1.3 方法
1.3.1 燕麦蛋白及乳糖糖基化产物的制备
1.3.1.1 燕麦蛋白的制备
参考张蓓[10]的方法略作修改。燕麦籽粒磨粉过筛,正己烷脱脂。将脱脂后的燕麦粉以料水比1∶8(g/mL)配制溶液,用1 mol/L NaOH溶液调pH值为10,在50 ℃水浴振荡2 h,10 000 r/min离心10 min。将上清液用1 mol/L HCl溶液调pH值至4.2,静置30 min,10 000 r/min离心10 min得沉淀。水洗沉淀2 次,调pH值至7.0,冷冻干燥,得到燕麦蛋白,其蛋白质质量分数为78.81%。
1.3.1.2 乳糖糖基化燕麦蛋白(lactose glycosylated oat protein,LGOP)的制备
参考Zhu Dan等[11]的方法略作修改,根据本课题组前期实验得到LGOP制备的最优工艺为:准确称取燕麦蛋白20 g,将其分散于1 000 mL 0.2 mol/L磷酸盐缓冲溶液(pH 9)中,于35 ℃磁力搅拌1 h使蛋白完全分散。按照乳糖∶蛋白=2∶1(m/m)加入乳糖,于35 ℃磁力搅拌3 h。置于95 ℃的水浴中加热反应80 min,冰浴冷却至室温。4 ℃透析24 h除去未反应的乳糖,冷冻干燥后得到LGOP。
1.3.2 燕麦蛋白及LGOP热诱导凝胶的制备
取25 mL一定质量分数的燕麦蛋白及LGOP溶液置于50 mL小烧杯内,调节至一定pH值。磁力搅拌1 h,在某一温度下水浴加热一定时间后,冰浴急速冷却至室温。取出置于4 ℃冰箱中下静置过夜(12 h),分别得到燕麦蛋白热诱导凝胶(heat induced gel of oat protein,HIGOP)和LGOP热诱导凝胶(heat induced gel of LGOP,HIGLGOP),测定其凝胶强度。
1.3.3 HIGOP制备的最优工艺
根据本课题组前期实验,得到HIGOP制备的最优工艺:蛋白质量分数8%;pH 10;反应温度100 ℃;反应时间2.5 h。
1.3.4 HIGLGOP制备的正交试验优化
在单因素试验的基础上,选取蛋白质量分数、pH值、反应时间、反应温度为考察因素,以凝胶强度为评价指标,采用4因素3水平的正交试验优化HIGLGOP制备工艺条件。
1.3.5 燕麦蛋白及LGOP TG诱导凝胶的制备
取25 mL一定质量分数的燕麦蛋白及LGOP溶液置于50 mL小烧杯内,磁力搅拌1 h使蛋白质充分溶解,调节至一定pH值。加入一定量TG,在某一温度水浴振荡一定时间后,90 ℃下使酶灭活10 min,冰浴急速冷却至室温。取出置于4 ℃冰箱中静置过夜(12 h),分别得到燕麦蛋白酶诱导凝胶(oat protease induced gel,OPIG)和LGOP酶诱导凝胶(lactose glycosylated oat protease induced gel,LGOPIG),测定其凝胶强度。
1.3.6 OPIG制备的最优工艺
根据本课题组前期实验,得到OPIG制备的最优工艺:蛋白质量分数10%;酶添加量50 U/g;pH 7;反应温度55 ℃;反应时间3 h。
1.3.7 LGOPIG制备的正交试验优化
在单因素试验的基础上,选取蛋白质量分数、酶添加量、pH值、反应时间、反应温度为考察因素,以凝胶强度为评价指标,采用5因素4水平的正交试验优化LGOPIG制备的工艺条件。
1.3.8 质构性质测定
参考Zhang Qi等[12]方法并进行改动。将4 种燕麦蛋白凝胶样品分别切割成圆柱形(35 mm×30 mm)放置于25 ℃平衡30 min。采用质构仪对样品进行质地剖面分析,测定其弹性、硬度和胶黏性。蛋白凝胶强度定义为穿透凝胶所需的最大破断力(g)。参数设置:测前速率5.0 mm/s;测试速率5.0 mm/s;测试后速率5.0 mm/s;触发力0.2 N;穿透距离10 mm;压缩比50%。
1.3.9 持水性测定
采用离心法[13],分别取2.0 g 4 种燕麦蛋白凝胶样品置于离心管中,于4 ℃、10 000×g离心15 min。记录离心前离心管总质量(m1)、离心后离心管总质量(m2)及空离心管质量(m0),计算凝胶持水性:
1.3.10 表面疏水性(H0)测定
采用ANS荧光探针法[14]并进行改动。用磷酸盐缓冲液(0.01 mol/L、pH 7)分别将4 种燕麦蛋白凝胶样品配制质量浓度为0.012 5、0.025、0.05、0.1、0.2、0.4 mg/mL的燕麦蛋白凝胶,加入20 μL 8 mmol/L ANS荧光探针,漩涡混合。室温下避光反应15 min,在激发波长390 nm,发射波长470 nm,狭缝5 nm的条件下测定蛋白与ANS结合物的相对荧光强度,以燕麦蛋白凝胶浓度为横坐标,相对荧光强度为纵坐标作图,线性回归曲线的初始斜率即为H0。
1.3.11 SDS-PAGE测定
根据冯芳等[15]的方法,略有改动。采用15%分离胶、5%浓缩胶进行垂直夹板电泳。用碳酸盐缓冲溶液(0.02 mol/L、pH 7)配制燕麦蛋白凝胶的质量浓度为2 mg/mL,上样量10 μL。样品在分离胶时恒压80 V,样品在浓缩胶时恒压120 V,当指示剂前沿距电泳槽胶底0.5 cm时,关闭电源停止电泳。取下凝胶后分别用考马斯亮蓝R-250和Schiff试剂进行蛋白质和糖蛋白染色。
1.3.12 荧光光谱测定
用0.01 mol/L pH 7.6磷酸盐缓冲溶液配制质量浓度为0.4 mg/mL的燕麦蛋白凝胶样品,采用多功能酶标仪进行内源荧光光谱分析。为降低酪氨酸残基干扰,激发波长290 nm,扫描发射光谱范围为300~400 nm,激发和发射狭缝宽度均为5 nm[16]。
1.3.13 FTIR测定
分别称取2 mg的燕麦蛋白凝胶样品,加入0.2 g溴化钾,研磨均匀,压成均一透明的薄片。用FTIR仪测定波数为4 000~400 cm-1的红外光谱,分辨率4 cm-1,波数精度0.01 cm-1,扫描次数32 次,环境温度25 ℃。
1.3.14 微观结构的测定
分别将4 种燕麦蛋白凝胶切成方形并冷冻干燥。参考贾子璇等[17]的方法,样品经喷金处理后,用SEM测定其微观结构,电压10 kV,4 种燕麦蛋白凝胶的放大倍数分别为HIGOP 10 000 倍、HIGLGOP 10 000 倍、OPIG 200 倍、LGOPIG 10 000 倍。
1.4 数据处理
每组实验重复3 次,各组数据结果以 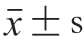 表示,用SPSS 19.0软件进行数据处理,采用方差分析及Duncan新复极差法进行差异显著性检验,P<0.05。
表示,用SPSS 19.0软件进行数据处理,采用方差分析及Duncan新复极差法进行差异显著性检验,P<0.05。
2 结果与分析
2.1 HIGLGOP的工艺优化分析
由表1可知,各因素对HIGLGOP凝胶强度的影响大小为:蛋白质量分数>pH值>反应时间>反应温度。由表2可知,蛋白质量分数和pH值对HIGLGOP凝胶强度的影响显著(P<0.05),而反应时间和反应温度对凝胶强度无显著影响。结合表1和表3得到最优组合为A2B2C2D2,即蛋白质量分数8%、pH 10、反应时间2 h、反应温度95 ℃,通过最优组合进行实验,得到HIGLGOP凝胶强度为(186.13±1.97)g,高于表1中9 个正交试验的结果。后续实验在此最优条件组合下进行。
表1 HIGLGOP制备条件的正交试验设计及结果
Table 1 Orthogonal array design and results for optimization of preparation conditions of HIGLGOP
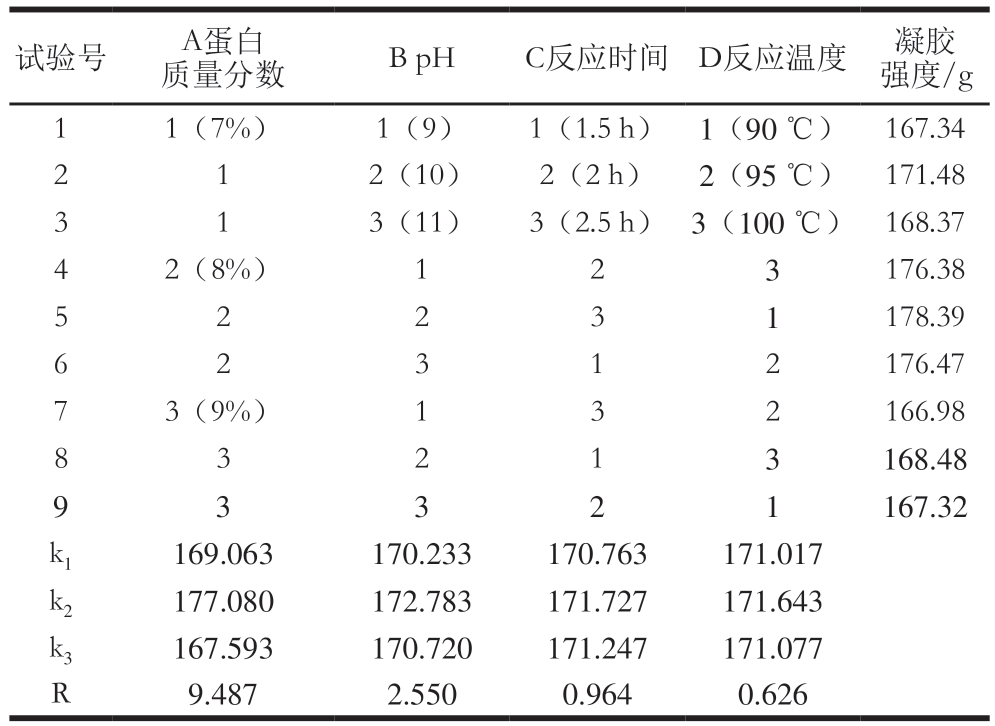
试验号 A蛋白质量分数B pHC反应时间D反应温度凝胶强度/g 1 1(7%) 1(9) 1(1.5 h) 1(90 ℃) 167.34 2 1 2(10) 2(2 h) 2(95 ℃) 171.48 3 1 3(11) 3(2.5 h) 3(100 ℃) 168.37 4 2(8%) 1 2 3 176.38 5 2 2 3 1 178.39 6 2 176.47 7 3(9%) 1 3 2 166.98 8 3 2 1 3 168.48 2 3 1 1 167.32 k1 169.063 170.233 170.763 171.017 k2 177.080 172.783 171.727 171.643 k3 167.593 170.720 171.247 171.077 R 9.487 2.550 0.964 0.626 9 3 3 2
表2 HIGLGOP制备条件的方差分析结果
Table 2 Analysis of variance for the effect of four variables on gel strength of HIGLGOP
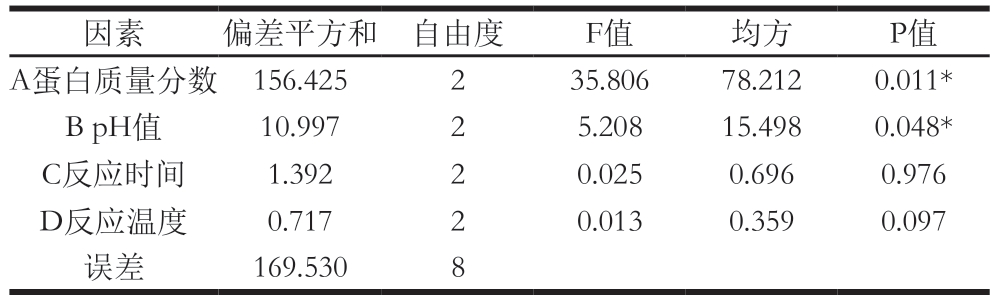
注:*.差异显著,P<0.05,表5同。
因素 偏差平方和 自由度 F值 均方 P值A蛋白质量分数 156.425 2 35.806 78.212 0.011*B pH值 10.997 2 5.208 15.498 0.048*C反应时间 1.392 2 0.025 0.696 0.976 D反应温度 0.717 2 0.013 0.359 0.097误差 169.530 8
表3 HIGLGOP制备条件的4因素多重比较结果
Table 3 Multiple comparison of four variables
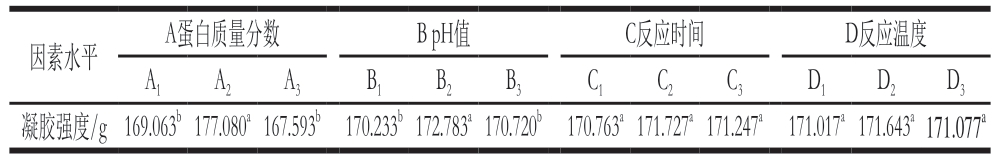
注:不同字母表示差异显著(P<0.05),表6同。
A蛋白质量分数 B pH值 C反应时间 D反应温度A1 A2 A3 B1 B2 B3 C1 C2 C3 D1 D2 D3凝胶强度/g169.063b177.080a167.593b 170.233b172.783a170.720b 170.763a171.727a171.247a 171.017a171.643a171.077a因素水平
2.2 LGOPIG的工艺优化分析
由表4可知,各因素对凝胶强度的影响大小为:酶添加量>蛋白质量分数>pH值>反应时间>反应温度。由表5可知,酶添加量对凝胶强度的影响显著(P<0.05),而蛋白质量分数、pH值、反应时间和反应温度对其无显著影响;结合表4和表6得到最优组合为A4B3C1D2E2,即蛋白质量分数8%、酶添加量40 U/g、pH 6.5、反应时间2.0 h、反应温度55 ℃,通过最优组合进行实验,得到凝胶强度为(159.64±1.83) g,高于表4中16 个正交试验的结果。后续实验在最优组合下进行。
表4 LGOPIG制备条件的正交试验设计及结果
Table 4 Orthogonal design and results for the optimization of preparation conditions of LGOPIG
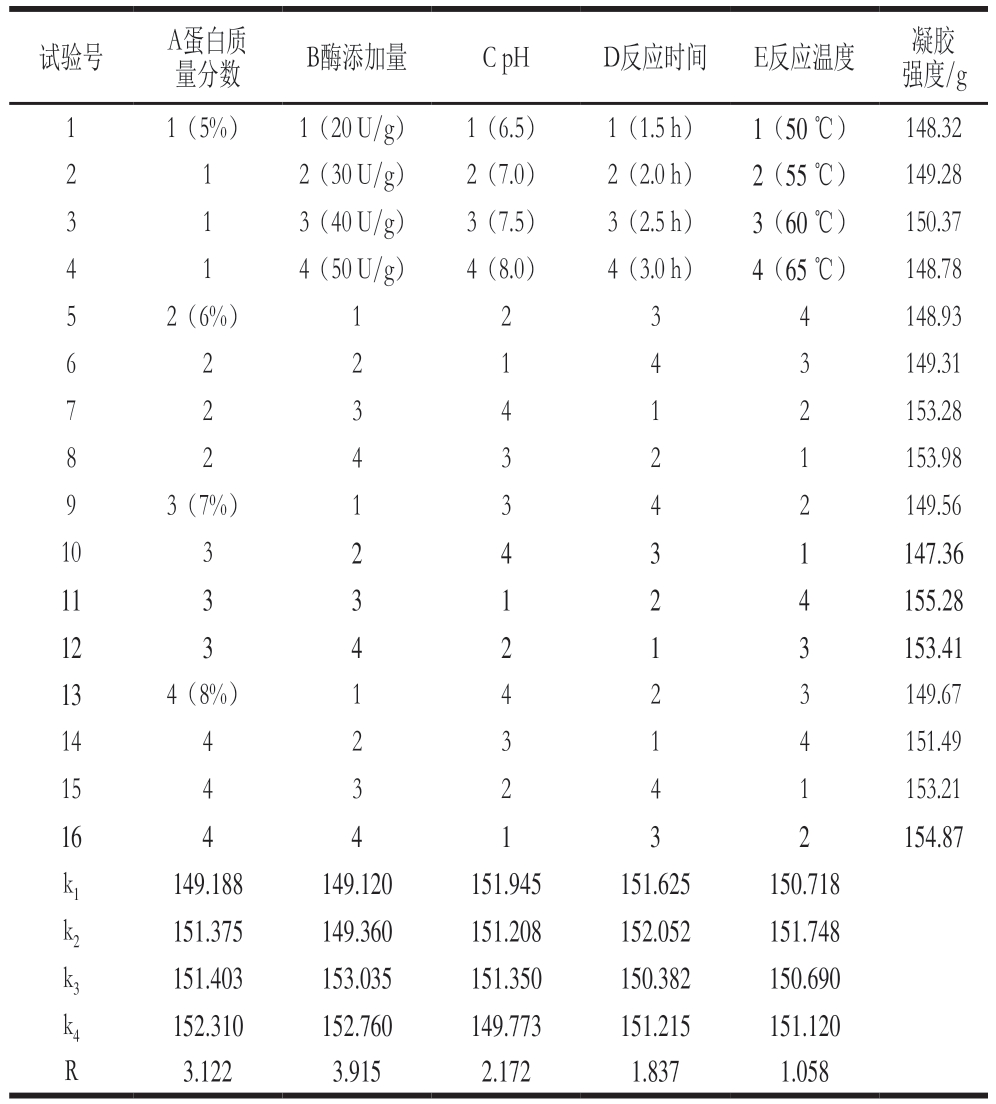
试验号 A蛋白质量分数 B酶添加量 C pH D反应时间 E反应温度 凝胶强度/g 1 1(5%) 1(20 U/g) 1(6.5) 1(1.5 h) 1(50 ℃) 148.32 2 1 2(30 U/g) 2(7.0) 2(2.0 h) 2(55 ℃) 149.28 3 1 3(40 U/g) 3(7.5) 3(2.5 h) 3(60 ℃) 150.37 4 1 4(50 U/g) 4(8.0) 4(3.0 h) 4(65 ℃) 148.78 5 2(6%) 1 2 3 4 148.93 6 2 2 1 4 3 149.31 7 2 153.28 8 2 4 3 2 1 153.98 2 3 4 1 9 3(7%) 1 3 4 2 149.56 10 3 2 4 3 1 147.36 11 3 3 1 2 4 155.28 12 3 4 2 1 3 153.41 13 4(8%) 1 4 2 3 149.67 14 4 2 3 1 4 151.49 15 4 3 2 4 1 153.21 16 4 4 1 3 2 154.87 k1 149.188 149.120 151.945 151.625 150.718 k2 151.375 149.360 151.208 152.052 151.748 k3 151.403 153.035 151.350 150.382 150.690 k4 152.310 152.760 149.773 151.215 151.120 R 3.122 3.915 2.172 1.837 1.058
表5 LGOPIG制备条件的方差分析结果
Table 5 Analysis of variance results for the effect of five variables on gel strength of LGOPIG
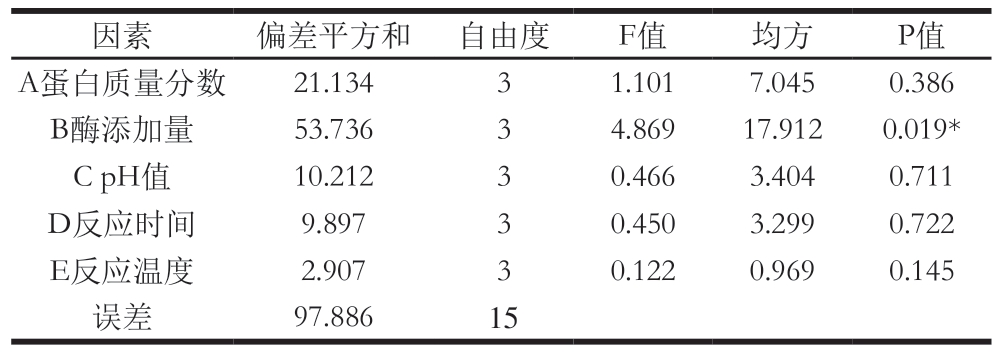
因素 偏差平方和 自由度 F值 均方 P值A蛋白质量分数 21.134 3 1.101 7.045 0.386 B酶添加量 53.736 3 4.869 17.912 0.019*C pH值 10.212 3 0.466 3.404 0.711 D反应时间 9.897 3 0.450 3.299 0.722 E反应温度 2.907 3 0.122 0.969 0.145误差 97.886 15
2.3 燕麦蛋白凝胶质构性质分析
由图1可以看出,与HIGOP相比,其他3 种燕麦蛋白凝胶的弹性和硬度均显著提高(P<0.05);4 种燕麦蛋白凝胶中,LGOPIG的质构性质最好。与HIGOP相比,LGOPIG的弹性、硬度和胶黏性分别提高了7.27%、9.49%和13.01%。LGOPIG的弹性和胶黏性显著高于HIGLGOP(P<0.05);LGOPIG的质构特性显著高于OPIG(P<0.05)。这与杜洪振等[18]的研究结果一致。添加TG可以提高蛋白凝胶的弹性、硬度和胶黏性,这可能是由于蛋白带净电荷,加入TG后与蛋白发生交联,降低了蛋白质分子之间的静电斥力。此外,在加热过程中蛋白质内部的非极性多肽会暴露出来,从而增强了临近多肽非极性片段的疏水相互作用,进而形成结构更加致密的凝胶网络。糖基化蛋白由于引入许多亲水羟基,易形成分子间氢键,因此更易形成稳定的三维网络凝胶,其凝胶的质构性质提高。
表6 LGOPIG制备条件的5因素多重比较结果
Table 6 Multiple comparison of five variables for the preparation of LGOPIG

因素水平A蛋白质量分数 B酶添加量 C pH值 D反应时间 E反应温度A1 A2 A3 A4 B1 B2 B3 B4 C1 C2 C3 C4 D1 D2 D3 D4 E1 E2 E3 E4凝胶强度/g149.188a 151.375a 151.403a 152.310a 149.120b 149.360b 153.035a 152.760ab 151.945a 151.208a 151.350a 149.773a 151.625a 152.052a 150.382a 151.215a 150.718a 151.748a 150.690a 151.120a
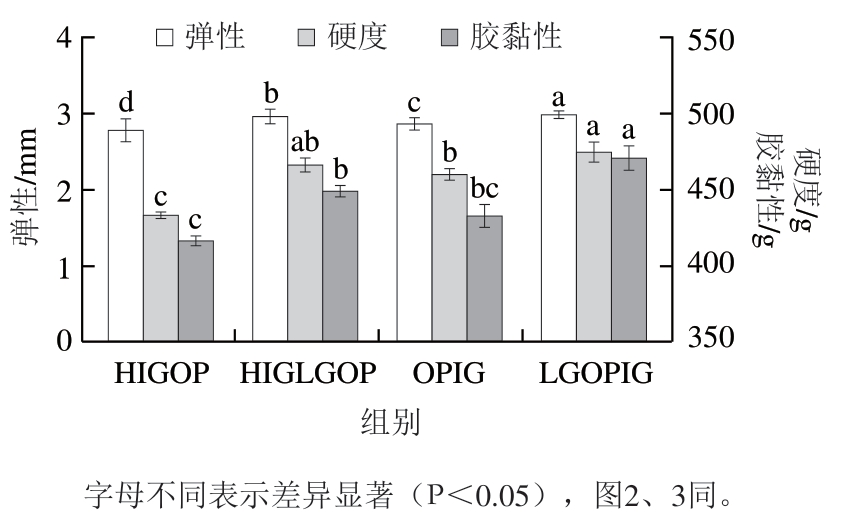
图1 4 种燕麦蛋白凝胶的质构性质
Fig. 1 Texture properties of four oat protein gels
2.4 燕麦蛋白凝胶持水性分析
由图2可以看出,4 种燕麦蛋白凝胶中,LGOPIG的持水性最好。与HIGOP相比,其他3 种燕麦蛋白凝胶的持水性都显著提高(P<0.05),HIGLGOP、OPIG、LGOPIG的持水性分别提高了14.21%、4.86%、22.22%。两种酶诱导蛋白凝胶(OPIG、LGOPIG)的持水性分别高于两种热诱导蛋白凝胶(HIGOP、HIGLGOP);两种糖基化改性蛋白凝胶(HIGLGOP、LGOPIG)的持水性分别高于两种未糖基化改性蛋白凝胶(HIGOP、OPIG)。这可能是由于肽链中谷氨酰胺残基的γ-羧酰胺基和赖氨酸残基的ε-氨基分别作为酰基的供体和受体,使燕麦蛋白形成分子内及分子间的ε-(γ-谷氨酰)赖氨酸异肽键,使蛋白质分子交联,形成更多水的结合位点,留住更多的水分,从而使得TG改性后燕麦蛋白的持水性显著提高,这与于殿宇等[19]的研究结果一致。葛侠[20]研究发现大豆分离蛋白糖基化后形成的凝胶强度和持水性明显高于没有糖基化处理的样品,这与本研究结果一致,这是由于亲水性糖基的导入能够提高蛋白质的持水能力。
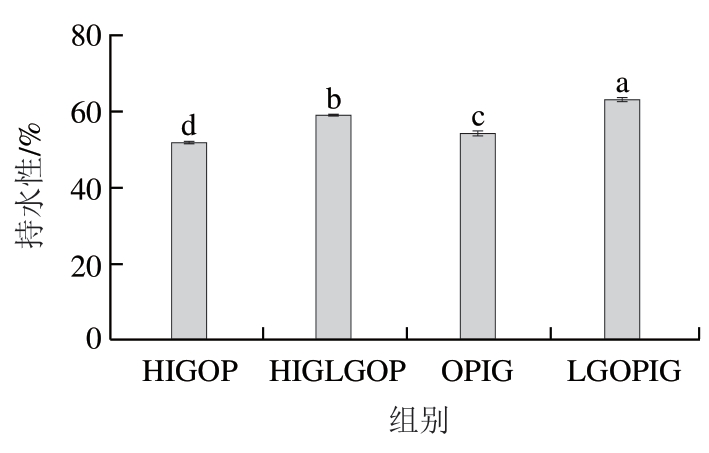
图2 4 种燕麦蛋白凝胶的持水性
Fig. 2 Water-holding capacity of four oat protein gels
2.5 燕麦蛋白凝胶表面疏水性分析
由图3可以看出,两种酶诱导蛋白凝胶(OPIG、LGOPIG)的H0分别高于两种热诱导蛋白凝胶(HIGOP、HIGLGOP);两种糖基化改性蛋白凝胶(HIGLGOP、LGOPIG)的H0分别低于两种未糖基化改性蛋白凝胶(HIGOP、OPIG)。有可能是H0由蛋白质的表面残基暴露的程度所决定。暴露于分子表面的疏水性残基越多,H0越强。燕麦蛋白经TG催化后,蛋白结构发生了改变,多肽链展开,疏水区域从分子内部基团暴露出来,使H0升高,这与臧学丽等[21]的结论一致。糖基化改性蛋白凝胶的H0低于未糖基化改性蛋白凝胶,表明糖基化会阻碍热处理过程中蛋白质的变性,从而减少疏水残基的暴露,这与赵城彬等[22]的研究结果一致。
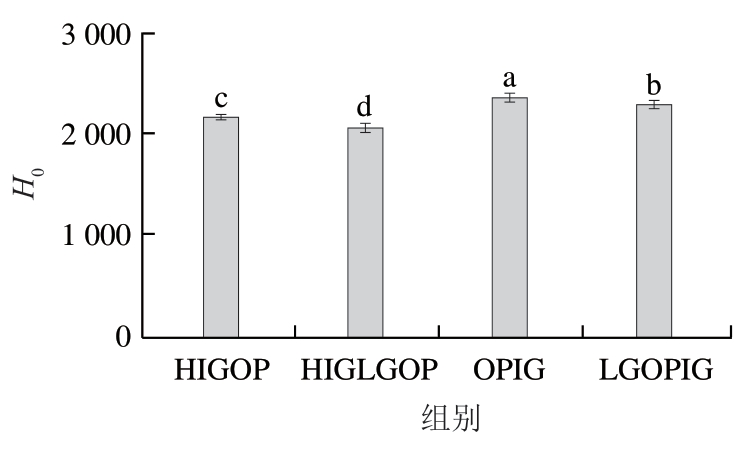
图3 4 种燕麦蛋白凝胶的表面疏水性
Fig. 3 Surface hydrophobicity of four oat protein gels
2.6 燕麦蛋白凝胶的SDS-PAGE分析
由图4可以看出,与热诱导蛋白凝胶(HIGOP、HIGLGOP)相比,TG交联后的蛋白凝胶(OPIG、LGOPIG)在分离胶顶端有大量大分子质量的蛋白交联产物,且其31.0、21.0 kDa处的颜色相对热诱导蛋白凝胶明显变浅,同时还有大分子质量的蛋白堆积在槽内无法向下迁移,不能进入凝胶(箭头处)。结果表明,TG引起燕麦蛋白发生分子间或分子内交联而形成大分子质量的交联产物,这和Zhao Qiang等[23]的研究结果一致。因此,TG可促进燕麦蛋白发生分子内或者分子间的交联,形成大分子质量的聚合物。全越[24]研究了TG对燕麦麸皮球蛋白的结构修饰,得出酶促糖基化球蛋白的亚基带比糖交联球蛋白明显,这直接证实TG催化氨基糖连接到球蛋白分子中。
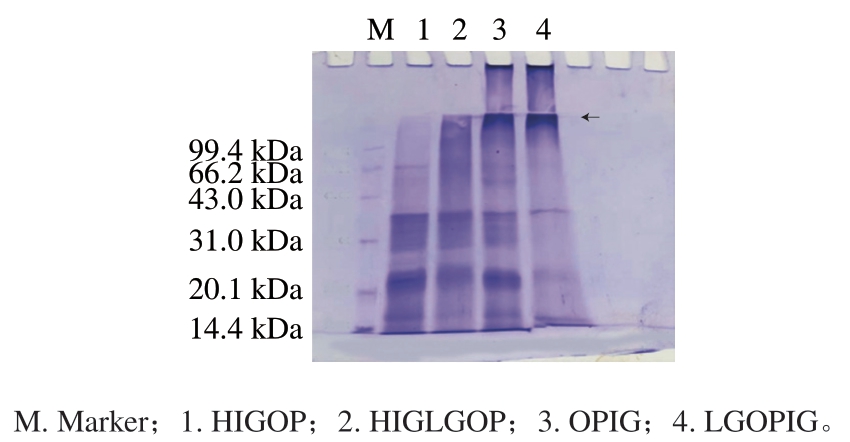
图4 4 种燕麦蛋白凝胶的SDS-PAGE图
Fig. 4 SDS-PAGE patterns of four oat protein gels
2.7 燕麦蛋白凝胶荧光光谱分析
由图5可知,两种酶诱导蛋白凝胶(OPIG、LGOPIG)的荧光强度分别高于两种热诱导蛋白凝胶(HIGOP、HIGLGOP);两种糖基化改性蛋白凝胶(HIGLGOP、LGOPIG)的荧光强度分别高于两种未糖基化改性蛋白凝胶(HIGOP、OPIG)。HIGOP、HIGLGOP、OPIG、LGOPIG的最大荧光发射波长分别为358、355、349、353 nm,说明TG交联后的蛋白最大荧光发射波长减小,发生了蓝移。酶诱导蛋白凝胶的荧光强度高于热诱导凝胶,原因为TG使得燕麦蛋白交联,引起蛋白结构发生变化,色氨酸、酪氨酸等发色氨基酸暴露,引起荧光强度增大。这与丁欣悦[25]的研究结果一致。糖基化改性蛋白凝胶的荧光强度高于未糖基化改性蛋白凝胶是因为含有羟基结构的糖与蛋白进行共价交联反应,使整个体系的亲水性增强,改性后的样品在水相中更容易分散,进而提高蛋白的荧光强度。朱小燕[26]采用TG分别对米渣蛋白和糖基化后的米渣蛋白进行交联,发现交联后的蛋白荧光强度有明显上升,且最大荧光发射波长同样发生了蓝移的现象。
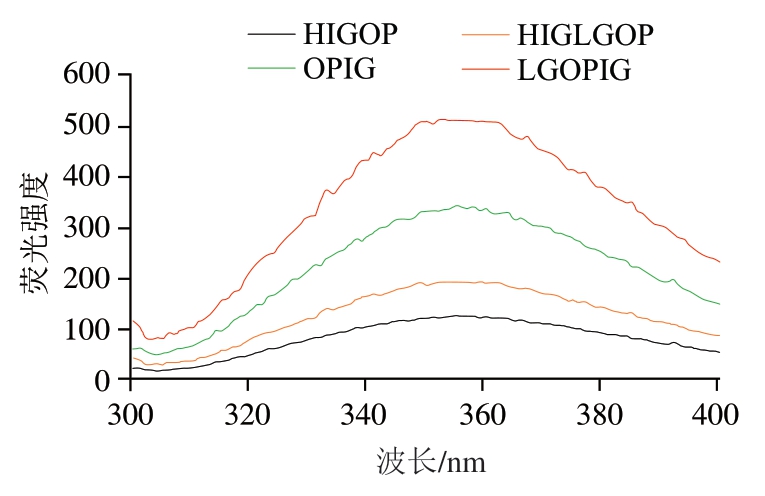
图5 4 种燕麦蛋白凝胶的荧光光谱图
Fig. 5 Fluorescence spectra of four oat protein gels
2.8 燕麦蛋白凝胶的FTIR分析
如图6所示,与未糖基化改性燕麦蛋白凝胶(HIGOP、OPIG)相比,糖基化蛋白凝胶(HIGLGOP、LGOPIG)在3 200~3 700 cm-1范围内吸收峰变宽,证明燕麦蛋白与乳糖共价结合之后,复合物的羟基数量增加,引起C—OH的伸缩振动[27]。在酰胺I带区域(1 600~1 700 cm-1)中,吸收导致C=O键的拉伸振动,因此被认为是用于研究蛋白质结构变化最敏感的区域。由图6可知,经TG改性处理后的蛋白,其波形均向高波数偏移约1~2 cm-1。这说明在TG影响下,蛋白结构不稳定,氢键作用变弱,使得C=O化学键的键长减小,而化学键的伸缩振动与键长的平方根呈反比,由于键长减小使伸缩振动频率增加,因此导致波数增加。Wang Pei等[28]通过FTIR测定分析得出,酶的添加改变了蛋白质之间的相互作用,形成更稳固的结构。
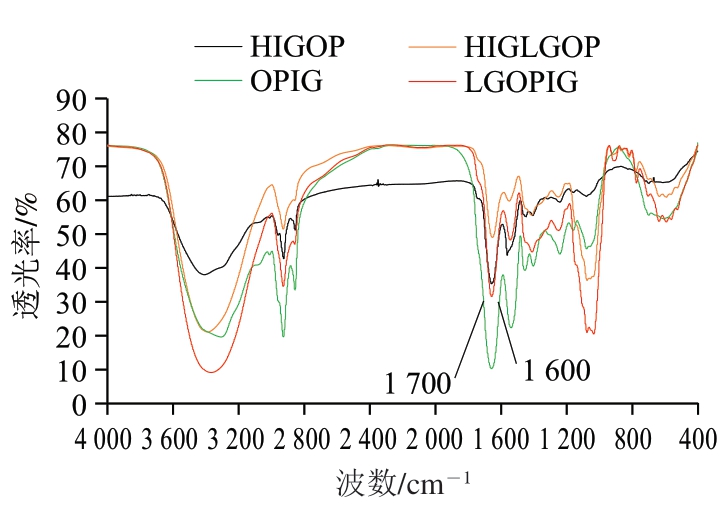
图6 4 种燕麦蛋白凝胶的FTIR光谱图
Fig. 6 FTIR spectra of four oat protein gels
2.9 燕麦蛋白凝胶微观结构分析

图7 4 种燕麦蛋白凝胶的SEM图
Fig. 7 SEM images of four oat protein gels
从图7可以看出,与未糖基化的燕麦蛋白凝胶(图7A和C)相比,LGOP凝胶(图7B和D)的表面结构变得更加疏松和多孔。这可能是糖基化反应形成了不均匀结构,使蛋白结构改变,导致燕麦蛋白凝胶的功能性质发生变化。与未经TG交联的燕麦蛋白(图7A和B)相比,经TG交联的燕麦蛋白凝胶(图7C和D)中的蛋白大小发生了很大的变化且凝胶空间中孔径减少。这说明TG能够降低蛋白质分子间的无序聚集形成更加有序的结构[29]。Han Minyi等[30]研究表明,TG诱导使得猪肉肌原蛋白凝胶中的小块状结构减少,大块状结构逐渐增多,这与本实验结果基本一致。王逢秋节等[31]研究表明,由于TG的加入,MgCl2-TG豆腐的凝胶网状结构较盐卤冷榨豆粉豆腐得到了明显的改善,包裹更多的冷榨豆粉纤维颗粒,将随机聚集的凝胶网络转变为具有连续性的蛋白网状结构,使其更为致密。
3 结 论
采用热处理及TG处理对燕麦蛋白及其糖基化产物进行胶凝化改性,TG处理的蛋白凝胶的质构性质、持水性、H0均高于热处理蛋白凝胶,糖基化改性燕麦蛋白凝胶的质构性质、持水性均高于未糖基化改性的燕麦蛋白凝胶,而糖基化改性燕麦蛋白凝胶的H0低于未糖基化改性的燕麦蛋白凝胶。结果说明TG与蛋白发生交联降低了蛋白质分子之间的静电斥力,易形成结构致密的凝胶网络,提高了蛋白凝胶的质构性、持水性及H0;连接了许多亲水羟基的糖基化蛋白易形成分子间氢键,提高了蛋白凝胶的质构性、持水性,降低了蛋白凝胶的H0。
通过SDS-PAGE、荧光光谱、FTIR光谱和SEM分析,证明TG能够改变蛋白质之间的相互作用,形成更稳固的三维网络凝胶结构,且凝胶微观结构更加均匀致密。因此,可以认为TG预处理比热处理能够有效地改善燕麦蛋白凝胶的性质和微观结构,可以为改善燕麦蛋白凝胶的性质及其在食品工业的应用提供新思路。
[1]乔瑶瑶, 赵武奇, 胡新中, 等. 近红外光谱技术检测燕麦中蛋白质含量[J]. 中国粮油学报, 2016, 31(8): 138-142. DOI:10.3969/j.issn.1003-0174.2016.08.025.
[2]ZHONG L, MA N, WU Y L, et al. Gastrointestinal fate and antioxidation of β-carotene emulsion prepared by oat protein isolate-Pleurotus ostreatus β-glucan conjugate[J]. Carbohydrate Polymers,2019, 221: 10-20. DOI:10.1016/j.carbpol.2019.05.085.
[3]MENGÍBAR M, MIRALLES B, HERAS Á. Use of soluble chitosans in Maillard reaction products with β-lactoglobulin. Emulsifying and antioxidant properties[J]. LWT-Food Science and Technology, 2017,75: 440-446. DOI:10.1016/j.lwt.2016.09.016.
[4]杜沁岭, 周思懿, 吴岱泽, 等. 湿法糖基化处理大豆11S蛋白后的表面活性变化[J]. 中国粮油学报, 2021, 36(1): 80-88. DOI:10.3969/j.issn.1003-0174.2021.01.014.
[5]赵成斌. β-葡聚糖对大豆分离蛋白混合凝胶性质的影响及在酸豆乳中应用的研究[D]. 哈尔滨: 东北农业大学, 2013: 2.
[6]刘建垒. 燕麦蛋白的提取及其亚基与功能特性研究[D]. 晋中: 山西农业大学, 2013: 51.
[7]李琳琳. 燕麦球蛋白的凝胶特性研究[D]. 福州: 福州大学, 2016: 40.
[8]范丽丽, 窦博鑫, 张晓琳, 等. 大豆7S球蛋白的MTGase条件对其表面疏水性与功能特性、溶液性质的影响及相关性分析[J].食品工业科技, 2020, 41(5): 52-57; 62. DOI:10.13386/j.issn1002-0306.2020.05.009.
[9]GASPAR A L C, DE GÓES-FAVONI S P. Action of microbial transglutaminase (MTGase) in the modification of food proteins:a review[J]. Food Chemistry, 2014, 171: 315-322. DOI:10.1016/j.foodchem.2014.09.019.
[10]张蓓. 燕麦蛋白质糖基化改性及乳化性研究[D]. 无锡: 江南大学,2015: 9.
[11]ZHU D, DAMODARAN S, LUCEY J A. Physicochemical and emulsifying properties of whey protein isolate (WPI)-dextran conjugates produced in aqueous solution[J]. Journal of Agricultural and Food Chemistry, 2010, 58(5): 2988-2994. DOI:10.1021/jf903643p.
[12]ZHANG Q, FENG M Q, DONG M S, et al. Effects of different coagulants on coagulation behavior of acid-induced soymilk[J].Food Hydrocolloids, 2013, 33(1): 106-110. DOI:10.1016/j.foodhyd.2013.02.020.
[13]姜国川, 王丽岩, 刘亚春, 等. 改性处理对猪肌原纤维蛋白结构及凝胶特性的影响[J]. 食品科学, 2019, 40(19): 89-95. DOI:10.7506/spkx1002-6630-20181011-088.
[14]赵城彬, 尹欢欢, 刘景圣, 等. 超声-转谷氨酰胺酶改善红豆蛋白功能性质及结构[J]. 食品科学, 2019, 40(19): 120-127. DOI:10.7506/spkx1002-6630-20181008-052.
[15]冯芳, 刘文豪, 陈志刚. 大豆7S、11S蛋白的结构与热致凝胶特性的分析[J]. 食品科学, 2020, 41(2): 58-64. DOI:10.7506/spkx1002-6630-20190121-243.
[16]李丹, 魏冬旭, 贾烨, 等. 大豆7S球蛋白结构特性与表面疏水性相关性研究[J]. 中国油脂, 2017, 42(4): 93-98. DOI:10.3969/j.issn.1003-7969.2017.04.021.
[17]贾子璇, 冉安琪, 刘季善, 等. 工业改性对大豆蛋白结构及大豆蛋白-肌原纤维蛋白复合凝胶的影响[J]. 食品科学, 2020, 41(4): 67-73.DOI:10.7506/spkx1002-6630-20190306-076.
[18]杜洪振, 孙钦秀, 杨振, 等. 转谷氨酰胺酶对鲤鱼肌原纤维蛋白乳化活性和凝胶特性的影响[J]. 食品工业科技, 2019, 40(6): 126-130; 178.DOI:10.13386/j.issn1002-0306.2019.06.021.
[19]于殿宇, 张欣, 邹丹阳, 等. 酶法改性对米糠蛋白凝胶硬度及功能性质的影响[J]. 中国食品学报, 2020, 20(9): 139-146. DOI:10.16429/j.1009-7848.2020.09.017.
[20]葛侠. 大豆分离蛋白的糖基化改性及其凝胶性质的研究[D]. 合肥:合肥工业大学, 2019: 33.
[21]臧学丽, 陈光. 转谷氨酰胺酶交联大豆分离蛋白结构表征[J]. 食品科学, 2019, 40(24): 73-78. DOI:10.7506/spkx1002-6630-20190722-282.
[22]赵城彬, 许秀颖, 刘景圣, 等. 超声预处理对大豆分离蛋白糖基化复合物酸诱导凝胶性质的影响[J]. 食品科学, 2019, 40(1): 123-129.DOI:10.7506/spkx1002-6630-20171210-119.
[23]ZHAO Q, XIONG H, SELOMULYA C, et al. Effects of spray drying and freeze drying on the properties of protein isolate from rice dreg protein[J]. Food and Bioprocess Technology, 2012, 6(7): 1759-1769.DOI:10.1007/s11947-012-0844-3.
[24]全越. 转谷氨酰胺酶对燕麦麸皮中球蛋白的结构修饰及其功能特性硏究[D]. 大庆: 黑龙江八一农垦大学, 2016: 43.
[25]丁欣悦. 超声辅助转谷氨酰胺酶及美拉德反应对大豆分离蛋白结构和功能性质的影响[D]. 南昌: 南昌大学, 2018: 28.
[26]朱小燕. TG酶与糖基化交联作用对米渣蛋白的结构、功能及流变学特性的影响研究[D]. 南昌: 南昌大学, 2016: 16.
[27]许彩虹. 大豆球蛋白糖基化接枝改性及其热聚集行为研究[D].广州: 华南理工大学, 2010: 71.
[28]WANG P, XU L, NIKOO M, et al. Effect of frozen storage on the conformational, thermal and microscopic properties of gluten: comparative studies on gluten-, glutenin- and gliadin-rich fractions[J]. Food Hydrocolloids, 2014, 35: 238-246. DOI:10.1016/j.foodhyd.2013.05.015.
[29]封小龙. 花生蛋白组分制备、改性及应用研究[D]. 北京: 中国农业科学院, 2014: 61.
[30]HAN M Y, ZHANG Y J, FEI Y, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[31]王逢秋节, 杨鑫鑫, 谷雪莲, 等. TG酶-MgCl2协同诱导对冷榨豆粉凝胶的影响[J]. 食品科学, 2022, 43(16): 169-176. DOI:10.7506/spkx1002-6630-20210806-081.